Artigo de Pesquisa
Plantago major L. (Plantaginaceae) pode ser utilizado como agente antimicrobiano para emprego em produtos para uso oral?
May Plantago major L. (Plantaginaceae) be used as an antimicrobial agent for use in oral application products?
Resumo
Plantago major L. (Plantaginaceae) é uma planta utilizada no tratamento de feridas e tosse devido ao seu potencial anti-inflamatório, cicatrizante e antimicrobiano. Visando o emprego da planta na formulação de produtos para uso oral, o objetivo deste estudo foi avaliar a atividade antimicrobiana desta espécie in vitro. Extratos etanólico e hidroalcoólico, preparados com partes aéreas de P. major, foram submetidos à triagem fitoquímica e análise de cromatografia em camada delgada (CCD). A atividade antimicrobiana dos extratos e de tintura comercial foi testada frente a Enterococcus faecalis e Pseudomonas aeruginosa por difusão em ágar. As análises fitoquímicas demonstraram a presença de substâncias fenólicas, cumarinas e triterpenos, além de baixo teor de fenóis e flavonoides nos extratos. Os sinais observados na CCD demonstraram ausência do marcador químico, ácido 5-O-cafeoilquínico, porém o número de classes de substâncias encontradas e a presença de um provável derivado de ácido 5-O-cafeoilquínico condizem com exemplares de P. major. Na avaliação da atividade antimicrobiana, os extratos alcoólicos e tintura não foram capazes de inibir o crescimento bacteriano, entretanto não deve ser descartada a sua ação anti-inflamatória devido as substâncias encontradas e o seu uso em sinergismo como outros agentes antimicrobianos para o desenvolvimento de produtos de uso oral.
- Palavras-chave:
- Plantas medicinais.
- Fitoterapia.
- Agentes antimicrobianos.
- Cromatografia em camada delgada.
Abstract
Plantago major L. (Plantaginaceae) has been widely used in the treatment of wounds and coughs due to its anti-inflammatory, healing and antimicrobial potential, according to popular indications. Aim at the use of this plant in the formulation of oral products, the objective of this work was to evaluate the antimicrobial activity of P. major extracts, in vitro. Ethanolic and hydroalcoholic extracts were prepared with dry aerial parts of the plant, which were submitted to phytochemical screening and analyzed by thin layer chromatography (TLC). The antimicrobial activity of the extracts and of a commercial tincture was performed by agar diffusion. Phytochemical screening showed presence of phenolic substances, cumarines and triterpenes, in addition to a low concentration of phenols and flavonoids in the extracts. The bands observed in TLC did not demonstrate 5-O-caffeoylquinic acid, a chemical marker, however the number of substances classes found and the presence of a probable 5-O-caffoylquinic acid derivative are consistent with P. major specimens. In agar diffusion test, the extracts and tincture were not able to inhibit the bacterial growth, however its anti-inflammatory activity should not be discarded due to the substances found and its synergic application with others antimicrobial agents to developing of oral use products.
- Keywords:
- Medicinal plants.
- Phytotherapy.
- Antimicrobial agents.
- Chromatography, thin layer.
Introdução
A utilização de plantas para a cura de enfermidade humana é uma prática consagrada ao longo da história, estando presente no dia a dia da população, promovendo uma melhor qualidade de vida do homem. Assim, a busca por substâncias que sejam biologicamente ativas na diversidade de metabólitos da flora, se transformou em tema para pesquisa e desenvolvimento de novos produtos[1,2].
A terapia fitoterápica apresenta extensa lista de ações farmacológicas relatadas que podem ser empregadas na cura, prevenção e controle de doenças [1]. Apesar de ser habitualmente empregada em práticas médicas, a fitoterapia apresenta uma baixa adesão por parte dos profissionais da área odontológica, apontando um novo campo de investimento. No entanto, alguns fatores necessitam ser ajustados para aumentar a adesão a estes produtos, dentre eles: (I) a definição da posologia de acordo com as indicações de uso; (II) informações mais simplificadas sobre os padrões de qualidade dos produtos; e (III) uma fonte segura e acessível com maiores informações sobre os fitoterápicos para os prescritores. Cabe ressaltar que os produtos de origem natural não são isentos de efeitos adversos como alergia e/ou toxidez[1,3].
Produtos contendo bioativos responsáveis pelo controle da microbiota bucal, reduzindo os índices de lesões cariogênicas, já estão presentes no mercado, além de outros fitoterápicos utilizados no tratamento de gengivites, estomatites aftosa, herpes simples e candidíase[1]. Trabalhos anteriores de nossa equipe mostraram a efetividade do uso de enxaguatórios bucais a base de óleos vegetais como adjuvantes da higiene bucal mecânica para o controle da população microbiana, sendo eficaz, em ensaios in vitro, na redução da quantidade de colônias de Candida albicans, Staphylococcus aureus e Enterococcus faecalis[4].
Dentre as plantas com potencial uso terapêutico está Plantago major L. (Plantaginaceae), herbácea conhecida popularmente como tanchagem, tansagem, transagem, tanchagem maior, llantén, plantagem ou língua de vaca e de origem do continente europeu. Esta planta tem aproximadamente 15 cm de altura, com folhas ovaladas e/ou elípticas, com margens glabras ou pilosas, dispostas em rosetas. Apresenta raiz central, de onde partem raízes secundárias, inflorescência quando madura ereta, e frutos com sementes com textura rugosa, irregulares e pequenas, o que facilita sua dispersão pelo vento. A tanchagem ocorre principalmente em regiões temperadas e subtropicais, sendo de fácil cultivo no Brasil, encontrada em todo o território nacional[5,6]. De acordo com as informações etnofarmacológicas, o infuso das folhas é usado para suprimir tosse brônquica associada à inflamação das vias respiratórias, podendo também apresentar atividade cicatrizante e no combate a inflamações da boca, garganta, gengivas e parotidites[5,6,7]. A literatura relata o uso de P. major L. para aplicações antiviral, antiparasitária, diurética, hematopoiética e hematoprotetora. Esses efeitos estão relacionados às atividades biológicas já descritas para os metabólitos secundários presentes, como taninos, saponinas, alcaloides, flavonoides, terpenos e glicosídeos[6]. O presente estudo teve como objetivo avaliar o potencial antimicrobiano in vitro de extratos hidroalcoólico, etanólico e tintura de P. major L. frente a microrganismos componentes da microbiota oral.
Material e Métodos
Material botânico e obtenção da matéria prima
Foram utilizadas partes aéreas secas de Plantago major L. comercializadas pela empresa Natural Florien CNPJ: 00.602.210/0001-50, localizada na cidade de Piracicaba/São Paulo. A tintura de P. majorL.comercial foi adquirida no comércio local da cidade de Juiz de Fora, Empresa Ely Martins, CNPJ: 96.435.995/0001-92.
Produção do extrato etanólico e hidroalcoólico de Plantago major L.
As partes aéreas de P. major L. foram selecionadas a fim de eliminar algum contaminante. Posteriormente, foi triturada em moinho de facas para aumentar a superfície de contato com o solvente a ser adicionado, fornecendo 64,64 g de material botânico moído. A quantidade de material foi dividida em duas partes iguais, sendo que em uma foi feita maceração dinâmica com etanol P.A. e a outra com mistura hidroalcoólica etanol:água (1:1 v/v). Os solventes eram trocados diariamente durante 7 dias. Depois, todo solvente filtrado de ambas as amostras foi levado separadamente para um evaporador rotatório com a temperatura do banho a 50°C e pressão a 50 mbar, sendo o resíduo seco transferido para um recipiente limpo destinado ao extrato e deixado secar à temperatura ambiente para ambas amostras. Ao final do processo obteve-se 1,67 g do extrato etanólico e 6,27 g do extrato hidroalcoólico.
Análise fitoquímica dos extratos
Os extratos brutos foram submetidos a análises fitoquímicas preliminares para determinação das principais classes químicas de metabólitos especiais, de acordo com o protocolo descrito por Matos[8], com algumas modificações. Soluções dos extratos foram preparadas, na concentração de 10 mg/mL, para a identificação de alcaloides pelo método de precipitação com os reagentes Dragendorff, Hager e Mayer. Os triterpenos e esteroides foram analisados através do método de Liebermann-Burchard, as saponinas analisadas pelo método de formação de espuma, as cumarinas através de solução de KOH 10%, os compostos fenólicos através de solução de FeCl3 3%, os taninos pelo método de precipitação com solução de gelatina 2,5%, os flavonoides foram avaliados com solução de AlCl3 5% e as antraquinonas através de solução de NaOH 0,5 M.
Determinação do conteúdo de compostos fenólicos
A determinação do teor de fenóis foi feita por meio de espectroscopia na região do visível utilizando o método de Folin-Ciocalteau com pequenas modificações[9,10]. O ácido tânico foi utilizado como padrão. A curva de calibração foi preparada, com concentrações variando de 7,5 a 350 µg/mL de uma solução metanólica de ácido tânico (500 µg/mL). Em microplacas de 96 poços foram adicionados 120 µL do reagente Folin-Ciocalteau 20%, 30 µL da amostra e 100 µL de carbonato de sódio 4%. Decorridos 30 min de incubação ao abrigo da luz, a absorbância foi medida em espectrofotômetro a 770 nm.
Para o doseamento dos extratos foi preparada uma solução estoque a 500 µg/mL em metanol. Poços somente com amostra e metanol foram utilizados como branco do teste. Em microplacas de 96 poços foram adicionados 120 µL do reagente Folin-Ciocalteau 20%, 30 µL da amostra e 100 µL de carbonato de sódio 4%. Decorridos 30 min de incubação ao abrigo da luz, a absorbância foi medida em espectrofotômetro a 770 nm. Todas as determinações foram realizadas em triplicata e a média ± desvio padrão foi utilizada para o cálculo do teor de fenóis. O conteúdo total de fenóis foi expresso em mg/g de extrato vegetal, em equivalentes de ácido tânico (EAT).
Determinação do conteúdo de flavonoides
O conteúdo de flavonoides foi determinado pelo método descrito por Miliauskas e colaboradores[11], com pequenas modificações. A rutina foi utilizada como padrão. A curva de calibração foi preparada, utilizando-se alíquotas de 0,02; 0,05; 0,1; 0,2; 0,4; 0,8 e 1,2 mL de uma solução etanólica de rutina (0,5 mg/mL). Adicionou-se quantidade de etanol necessária para obter 4,8 mL em cada tubo, e uma gota de ácido acético glacial. Posteriormente, adicionou-se 0,2 mL de uma solução etanólica de cloreto de alumínio 2%, totalizando 5 mL em cada tubo. O branco foi preparado da mesma forma que a amostra, porém substituindo a solução etanólica de cloreto de alumínio a 2% por etanol. Após 40 min de incubação, a 20ºC e ao abrigo da luz, as absorbâncias foram medidas a 415 nm em espectrofotômetro.
Para o doseamento dos extratos foi preparada uma solução estoque a 500 µg/mL em etanol. Dessa solução pipetou-se 0,2 mL para uma série de tubos de ensaio devidamente identificados e foi adicionado 4,6 mL de etanol, 1 gota de ácido acético glacial e 0,2 mL da solução etanólica de cloreto de alumínio a 2%, obtendo-se uma solução de 5 mL em cada tubo. O branco foi preparado com 0,2 mL da amostra, 1 gota de ácido acético e diluído para 5 mL com etanol. Após 40 min de incubação, a 20ºC e ao abrigo da luz, as absorbâncias das soluções foram registradas em espectrofotômetro a 415 nm. Todas as determinações foram realizadas em triplicata e a média ± desvio padrão foi utilizada para o cálculo do teor de flavonoides. O conteúdo total de flavonoides foi expresso em mg/g de extrato vegetal, em equivalentes de rutina (ER).
Avaliação de marcadores fitoquímicos do extrato por cromatografia em camada delgada (CCD)
Para identificar a presença de algum marcador conhecido de Plantago major e corroborar com os ensaios anteriores, foi realizada cromatografia em camada delgada (CCD) e estimado o fator de retenção (RF) para as substâncias separadas. Foi utilizado como padrão o ácido 5-O-cafeoilquínico, seguindo metodologia proposta por Braz et al.[12]. Foi selecionado o extrato hidroalcoólico para a avaliação do perfil químico devido ao seu maior rendimento. A concentração do extrato foi ajustada para 1 mg/mL e foi adicionado 10 μL em cromatoplaca de sílica-gel por meio de capilar de vidro. A concentração da substância padrão também foi a mesma utilizada para o extrato. A separação foi realizada em uma cuba cromatográfica saturada, utilizando-se como fase móvel uma mistura de tolueno, acetato de etila, metanol e ácido fórmico, na proporção 75:25:10:6 (v/v) – as proporções dos eluentes foram padronizadas e adaptadas para melhor separação dos compostos de acordo com a Monografia do Ministério da Saúde[6]. As cromatoplacas obtidas foram secas e observadas após aplicação do reagente revelador NP-PEG (Natural Product Reagent) e exposição das placas à luz UV em 365 nm.
Linhagens de microrganismos
As linhagens padronizadas de Pseudomonas aeruginosa (ATCC® 15442) e Enterococcus faecalis (ATCC® 19433) utilizadas neste estudo foram doadas pelo Instituto Nacional de Controle de Qualidade em Saúde (INCQS), unidade técnico-científica da Fundação Oswaldo Cruz (FIOCRUZ).
Teste de susceptibilidade antimicrobiana
Os microrganismos isolados foram repicados em caldo BHI (brain heart infusion) e incubados em estufa a 35 ± 2°C, por aproximadamente 14 horas, para recuperação. Para o teste de susceptibilidade pelo método de difusão em ágar por poços (hole plate)[13], foram feitas suspensões com densidade microbiana ajustada a escala 0,5 de McFarland em soro fisiológico estéril (bactérias: 108 UFC/mL), semeando-se 100 µL do inóculo em placas de Petri contendo ágar BHI por espalhamento. Em seguida, foram feitos poços com diâmetro aproximado de 4 mm em cada placa para a adição de alíquotas de 100 µL de cada amostra a ser testada (tintura e extratos). Os extratos foram empregados nas concentrações de 20, 50 e 100 mg/mL. As placas foram incubadas em estufa à 37°C por 24 horas para observação do halo de inibição. Como controle positivo e para fins de comparação, utilizou-se gluconato de clorexidina 0,12% empregando-se a mesma metodologia. Os ensaios foram realizados em duplicata e os dados representam a média da mensuração de 4 halos de inibição.
Resultados e Discussão
Nas últimas décadas, o interesse pelas terapias naturais tem aumentado significativamente, expandindo o uso de plantas medicinais e de fitoterápicos. O perfil fitoquímico da espécie P. major L. revela a presença de diversos constituintes químicos com aplicabilidade e comprovação de variados benefícios médicos, destacando-se flavonoides, associados a atividades anti-inflamatórias, antioxidantes e anticâncer[6,14], e triterpenos, relacionados a atividade anti-inflamatória por inibição seletiva da enzima cicloxigenase do tipo 2[15]. Em relação à atividade antimicrobiana, esta pode ser associada a polissacarídeos extraídos das folhas da planta, como um tipo de pectina polissacarídica, a PMII[16], com efeito comprovado em teste in vivo para tratamento de pneumonia estreptocócica em camundongos[17]. No entanto, estudos de atividade antimicrobiana de P. major L. são controversos, pois diferentes concentrações já foram estudadas, com diferentes cepas utilizadas, tendo-se, portanto, uma heterogeneidade dos resultados (TABELA 1).
| Referência | Tipo de extrato | Concentração | Metodologia | Resultados |
| Holetz et al. [18] | Etanol:água (9:1) | Variada | Microdiluição em caldo | S. aureus e C. tropicalis: MIC = 1 mg/mL C. parapsilosis, C. albicans, Bacillus subtilis, P. aeruginosa e Escherichia coli: MIC > 1 mg/mL C. krusei: MIC = 0,125 mg/mL |
| Freitas et al. [19] | Etanol:água (7:3) | 193 mg/mL | Disco difusão | S. aureus: halos entre 10 e 16 mm |
| Çitoğlu et al. [20] | Etanólico | 133 mg/mL | Disco difusão | E. coli: halo = 11 mm P. aeruginosa: halo = 10 mm S. aureus: 13 mm C. glabrata e C. krusei: halo = 12 mm C. albicans: halo = 7 mm |
| Vargas Neto et al.[21] | Alcoólico | Fitoterápico com 60% de extrato | Disco difusão e difusão em poço | C. albicans, C. parapsilosis, C. guiliermondii, C. krusei, C. kerfyr: inativo C. tropicalis: atividade em uma amostra (halo > 10 mm) de 13 amostras |
| Macrodiluição em tubo | Inibição do crescimento de todas espécies de levedura | |||
| Cogo et al.[22] | Etanólico | 100 mg/mL | Disco difusão | Helicobacter pylori: sem inibição |
| Ünsal et al. [23] | Etanólico | Variada | Microdiluição em caldo | S. aureus: MIC = 0,195 mg/mL S. epidermidis e C. albicans: MIC = 0,625 mg/mL Inativo contra E. coli, Klebsiella pneumoniae, Proteus mirabilis e P. aeruginosa |
| Karakaş et al. [24] | Etanólico | 100 mg/mL | Disco difusão | P. vulgaris: halo = 7 mm Inativo contra as demais bactérias testadas |
| Metiner et al. [25] | Etanólico | Variada | Macrodiluição em tubo | B. cereus e E. coli: 42,5 mg/mL Inativo contra as demais espécies testadas |
| Acetona | Variada | Macrodiluição em tubo | Ativo contra espécies testadas, com MIC variando entre 3,56 e 28,50 mg/mL | |
| Legenda: MIC - concentração inibitória mínima. | ||||
A análise fitoquímica revelou que o extrato etanólico e hidroalcoólico apresentam a mesma classe de constituintes químicos. Ambos extratos apresentaram positividade para substâncias fenólicas (taninos e flavonoides), cumarinas e triterpenos, e negatividade para alcaloides, esteroides e antraquinonas (TABELA 2).
| Amostras | Parte utilizada | Fitoconstituintes | ||||||||
| Al | Tr | Est | Sa | Cm | Fe | Ta | Fl | Ant | ||
| Extrato etanólico | Partes aéreas | - | + | - | - | + | + | + | + | - |
| Extrato hidroalcoólico | Partes aéreas | - | + | - | - | + | + | + | + | - |
| Legenda: + Positivo, - Negativo, Al - Alcaloides, Tr - Triterpenos, Est - Esteroides, Sa - Saponinas, Cm - Cumarinas, Fe - fenóis, Ta - Taninos, Fl - Flavonoides, Ant - Antraquinonas. | ||||||||||
A análise de teor de fenóis equivalentes em ácido tânico nos extratos etanólico e hidroalcoólico de P. major L. revelou a presença destas substâncias na composição destes extratos. O extrato etanólico demostrou uma concentração de 65,53 ± 2,77 mg/g de fenois e o extrato hidroalcoólico demostrou 32,12 ± 2,75 mg/g. A análise fitoquímica do teor de flavonoides revelou, por sua vez, uma correlação positiva com o teor de fenois, sendo que o extrato etanólico demostrou 28,76 ± 1,05 mg/g e o extrato hidroalcoólico demostrou 19,93 ± 0,51 mg/g.
Não foram encontradas todas as substâncias químicas descritas pela literatura para ambos os extratos, entretanto isso pode ser devido a variações climática e devido ao tipo de extração realizada, uma vez que tais condições podem alterar significativamente a presença dos metabolitos secundários[6]. Apesar disso, o grande número de classes de substâncias químicas encontradas neste trabalho confirma a identidade de um exemplar de P. major L.. As dosagens de substâncias fenólicas e flavonoides, substâncias com atividade antimicrobiana reconhecida[6,26], demonstraram a presença de um baixo teor dessas classes químicas para ambos extratos. Desta forma, a ausência destas classes e os baixos teores de substâncias encontradas nos extratos, podem ter sido fatores determinantes para a perda da atividade antimicrobiana.
Os ácidos clorogênicos têm como característica serem formados por uma esterificação entre o ácido quínico e um ácido hidroxicinâmico. Entre os constituintes dessa classe está o ácido 5-O-cafeoilquínico que é formado pela esterificação do ácido quínico e o ácido cafeico, este composto já foi identificado para a espécie Plantago major[5,27]. O ácido 5-O-cafeoilquínico, cuja a denominação na literatura também é dada como ácido clorogênico, é amplamente reconhecido pelo seu potencial antimicrobiano[28,29].
De forma a identificar algum marcador químico da espécie em estudo, foi realizada a técnica a CCD. A separação por CCD do extrato hidroalcoólico e do padrão de ácido 5-O-cafeoilquínico estão apresentados na FIGURA 1. O padrão apresentou um RF de 0,48, revelando uma zona de fluorescência azul, antes da revelação com NP-PEG e coloração azul esverdeada após a mesma quando observado em lâmpada UV de 365 nm. O extrato hidroalcoólico de P. major L.apresentou separação em cinco sinais distintos. Dois sinais puderam ser visualizados em lâmpada UV antes da revelação, uma zona de fluorescência mais elevada e de tonalidade vermelha (RF 0,85) e outra zona de tonalidade azul (RF 0,64) antes da revelação com NP-PEG. Após revelação o extrato apresentou sinais em 0,77 (coloração amarelada, sugestiva de flavonoides), 0,39 (coloração amarelada, sugestiva de flavonoides) e 0,28 (coloração azul-esverdeada, sugestiva de substância fenólica). Além disso, foi observada uma mudança de cor da substância com RF em 0,64 para a coloração azul-esverdeada, aspecto semelhante ao do ácido 5-O-cafeoilquínico, entretanto não foi observada por meio da técnica de CCD a presença do ácido 5-O-cafeoilquínico devido a falta de sinais em RF = 0,48, tanto antes quanto após revelação com NP-PEG e visualização em lâmpada UV de 365 nm.
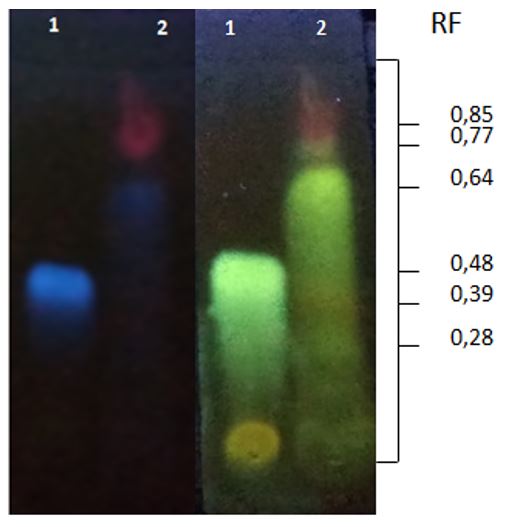
Uma substância com grande similaridade de fluorescência ao ácido clorogênico foi observada por meio da CCD, entretanto com RF diferente (ácido clorogênico com RF=0,48 e substância similar com RF=0,64), podendo, essa substância similar, ser um derivado da substância usada como padrão, dentre elas pode-se sugerir o ácido cafeico. A literatura descreve algumas características específicas para a CCD de ácido cafeico. Apresenta sob luz UV, fluorescência de coloração azul uma pouco mais intensa ao ser comparado com o ácido 5-O-cafeoilquínico, e apresentar um RF maior em relação ao mesmo, uma vez que o ácido cafeico está na forma de aglicona e possui menor polaridade. Na CCD apresentada neste trabalho, o padrão ácido 5-O-cafeoilquínico e o extrato hidroalcoólico apresentaram zonas de fluorescência, entretanto não foi possível detectar a presença do ácido clorogênico nos extratos de Plantago major L. Os resultados da CCD sugerem que a espécie empregada para a realização dos extratos seja de fato um exemplar de P. major L., mas sugere a ausência do ácido clorogênico e presença do ácido cafeico, um de seus derivados, este outro fator pode ter contribuído para a falta de bioatividade encontrada neste estudo.
Para avaliar a capacidade antimicrobiana das preparações alcoólicas e da tintura comercial de tanchagem foi empregado o método de difusão em ágar. As amostras dos extratos foram empregadas nas concentrações de 20, 50 e 100 mg/mL e a tintura foi aplicada sem nenhum preparo prévio. Após 24 horas de incubação, as placas foram observadas. A maior parte das amostras não apresentou halos de inibição. Os pequenos halos de inibição observados apresentaram colônias dentro das áreas dos halos, impedindo a mensuração do mesmo. Os dados dos ensaios estão apresentados na TABELA 3.
| Amostras | Concentração (mg/mL) | Diâmetro do halo (mm) | |
| Enterococcus Faecalis | Pseudomonas aeruginosa | ||
| Extrato etanólico | 100 | - | - |
| 50 | - | - | |
| 20 | - | - | |
| Extrato hidroalcoólico | 100 | - | - |
| 50 | - | - | |
| 20 | - | - | |
| Tintura | --- | - | - |
| Controle | 0,12% | 23,50 | 22,25 |
| Legenda: - ausência de halo. Controle: Gluconato de clorexidina 0,12% | |||
Em ensaios anteriores, os extratos hidroalcoólico de folhas de P. major L. não foram capazes de inibir o crescimento de microrganismos, tanto bactérias gram-negativas (BGN) e gram-positivas (BGP) quanto leveduras, testados nas concentrações 0,25, 0,50 e 1,0 mg/mL pelo método de difusão em ágar por poços e nem pelo método de microdiluição em caldo, para determinação da concentração inibitória mínima (MIC) (dados não mostrados). Desta forma, decidimos aumentar expressivamente as concentrações de extratos nos ensaios[20,24,25].
Os extratos hidroalcoólico, etanólico e a tintura comercial de P. major L. não apresentaram atividade antimicrobiana frente a E. faecalis e P. aeruginosa, nas concentrações testadas e pela metodologia empregada neste trabalho. Em um estudo etnobotânico realizado por Holetz e colaboradores[18], foi avaliada a atividade antimicrobiana de 13 extratos de plantas usadas popularmente em tratamento de doenças infecciosas, dentre eles, o extrato hidroalcoólico (90% v/v etanol) de folhas de P. major L. Corroborando com os resultados obtidos no presente estudo, foi observada atividade antibacteriana fraca contra S. aureus, sendo que a MIC obtida foi 1 mg/mL, e os extratos com MIC maiores que 1 mg/mL foram considerados inativos, entretanto, em um segundo ensaio de bioautografia de CCD, não foi observada zona de inibição para nenhum dos compostos separados; e o extrato demonstrou-se inativo frente às cepas de Escherichia coli, P. aeruginosa e Bacillus subtilis. Em relação às leveduras, o extrato não apresentou atividade antifúngica, exceto contra C. krusei, apresentando ação moderada (MIC: 0,125 mg/mL).
Em outro estudo, publicado posteriormente, o extrato etanólico de P. major L. mostrou-se inativo em concentrações de até 42,5 mg/mL, considerada uma concentração alta para MIC, não sendo efetivo para P. aeruginosa, S. aureus e outras bactérias[25]. Resultados similares foram observados por Spézia e colaboradores[30] quanto à ineficácia do extrato hidroalcoólico (70% v/v etanol) e outras frações de P. major L. contra diferentes microrganismos, dentre eles E. coli e S. aureus, por apresentar MIC maior ou igual a 1 mg/mL, sendo, portanto, considerado inativo. Metodologias similares a que foi empregada nesse trabalho, utilizaram o extrato etanólico na concentração de 100 mg/ml não sendo capaz de observar halos de inibição de crescimento para cepas de P. aeruginosa, Streptococcus pyogenes, S. aureus, S. epidermides,entre outras[23].
Não existe uma conformidade entre os extratos empregados em diferentes estudos. Condições climáticas, como sazonalidade, ritmo circadiano, temperatura, disponibilidade hídrica, poluição atmosférica, entre outros são capazes de mudar a constituição e a quantidade de metabólitos produzidos pelos exemplares[6,30]. Desta forma, nossos resultados reforçam a necessidade de técnicas espectrofotométricas e cromatográficas para avaliar o teor e identificação de substâncias ativas e garantir assim, resultados confiáveis em relação a bioatividade de P. major L.
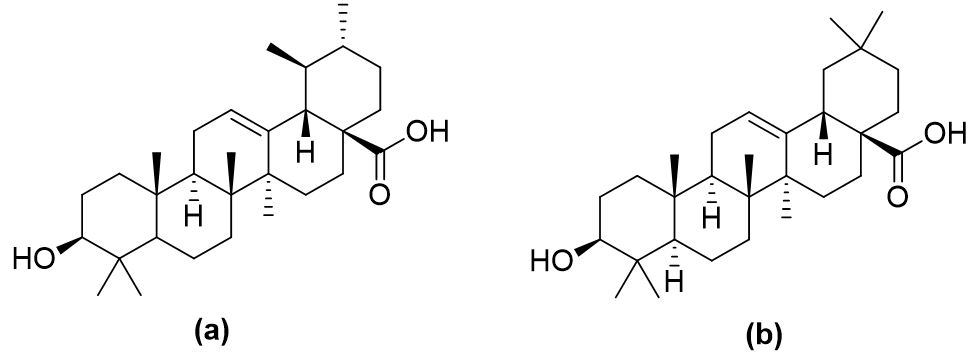
Para aplicação odontológica de produtos derivados de P. major L., tanto extratos alcoólicos quanto tinturas, deve-se observar que a literatura descreve a ausência de efeito antimicrobiano sobre os microrganismos da placa bacteriana da cavidade oral e de doença periodontal. A literatura relata a presença de flavonoides, alcaloides, saponinas, antraquinonas e taninos. No entanto, um forte indício da atividade anti-inflamatória do extrato de P. major L. trata de metabólitos presentes em amostras de extrato diclorometânico[15]. Nestes extratos de baixa polaridade, foram identificados dois triterpenos que atuam como inibidores para as duas isoformas da COX (cicloxigenase), ácido ursólico e o ácido oleanólico, cujas estruturas estão demonstradas na FIGURA 2, sendo este último mais seletivo para a isoformas COX2 e por isso capaz de evitar as reações adversas gastrointestinais.
Os extratos hidroalcoólico e etanólico de folhas de P. major L. desenvolvidos neste trabalho apresentaram marcadores químicos compatível com a espécie. Porém nenhuma atividade antimicrobiana foi observada, desestimulando-se o uso do extrato bruto ou da tintura para esta finalidade. As preparações de P. major L. associadas a outras espécies são capazes de inibir o crescimento microbiano, fortalecendo a indicação dos extratos como fontes eficientes de substâncias com potencial anti-inflamatório, capazes de apoiar as ações reparativas dos antimicrobianos.
Conclusão
Segundo os resultados apresentados, as preparações alcoólicas de Plantago major L. isoladas, nas condições testadas, não são capazes de inibir o crescimento microbiano, contradizendo algumas indicações populares, entretanto isto pode estar relacionado ao perfil e teor de substâncias químicas encontradas. No entanto, sua atividade anti-inflamatória não deve ser descartada sendo eficiente para amenizar os sintomas dos distúrbios causados por diversos microrganismos, uma vez que foram encontradas diversas classes de fitoconstituintes químicos neste estudo, que possuem esta atividade farmacológica.
Agradecimentos
Os autores agradecem às agências de fomento: Universidade Federal de Juiz de Fora, Coordenação de Aperfeiçoamento de Pessoal no Nível Superior, Fundação de Amparo à Pesquisa do Estado de Minas Gerais e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico pelas bolsas concedidas aos estudantes envolvidos neste trabalho.
Referências
1. Aleluia CM, Procópio VC, Oliveira MTG, Furtado PGS, Giovannini JFG, Mendonça SMS. Fitoterápicos na odontologia. Rev Odontol Univ. São Paulo. 2015; 27(2): 126-34. ISSN 1983-5183. [CrossRef].
2. Nóbrega JS, Silva FA, Barroso RF, Crispim DL, Oliveira CJA. Avaliação do conhecimento etnobotânico e popular sobre o uso de plantas medicinais junto a alunos de graduação. Rev Bras Gestão Amb. 2017; 11(1): 7-13. ISSN 2317-3122. [Link].
3. Machado AC, Oliveira RC. Medicamentos fitoterápicos na odontologia: evidências e perspectivas sobre o uso da aroeira-do-sertão (Myracrodruon urundeuva Allemão). Rev Bras Pl Med. 2014; 16(2): 283-9. ISSN 1516-0572. [CrossRef].
4. Pinto PF, Gonçalves EA. Avaliação da eficácia antimicrobiana dos enxaguatórios bucais contendo como princípios ativos o triclosan, cloreto de cetilpiridínio e óleos essenciais. HU Rev. 2013; 39(3-4): 45-50. ISSN 0103-3123. [CrossRef].
5. Samuelsen AB. The traditional uses, chemical constituents and biological activities of Plantago major L. A review. J Ethnopharmacol. 2000; 71(1-2): 1-21. ISSN 0378-8741. [PubMed].
6. Brasil. Ministério da Saúde, ANVISA. Monografia da espécie Plantago major L. (tanchagem). 2014. 86 p. Disponível em: [Link].
7. Teles DG, Costa MM. Estudo da ação antimicrobiana conjunta de extratos aquosos de tansagem (Plantago major L., Plantaginaceae) e Romã (Punica granatum L., Punicaceae) e interferência dos mesmos na ação da amoxicilina in vitro. Rev Bras Pl Med. 2014; 16(2): 323-8. ISSN 1516-0572. [CrossRef].
8. Matos FJA. Introdução à Fitoquímica Experimental. 2ª ed. Fortaleza: UFC; 1997. ISBN 8572820264 / 9788572820264.
9. Folin O, Ciocalteau V. On tyrosine and tryptophane determinations in proteins. J Biol Chem. 1927; 73(2): 627-50. ISSN 0021-9258. [Link].
10. Dowd LE. Spectrophotometric determination of quercetin. Anal Chem. 1959; 31(7): 1184-87. ISSN 0003-2700. [CrossRef].
11. Miliauskas G, Venskutonis PR, Van-Beer TA. Screening of radical scavenging activity of some medicinal and plant extracts. Food Chem. 2004; 85(2): 231-7. ISSN 0308-8146. [CrossRef].
12. Braz R, Wolf LG, Lopes GC, Mello JCP. Quality control and TLC profile dats on selected plant species commonly found in the Brazilian market. Rev Bras Farmacogn. 2012; 22(5): 1111-8. ISSN 0102-695X. [Link].
13. Maia-Araújo YLF, Mendonça LS, Orellana SC, Araújo ED. Comparação entre duas técnicas utilizadas no teste de sensibilidade antibacteriana do extrato hidroalcoólico de própolis vermelha. Sci Plena. 2011; 7(4): 1-4. ISSN 1808-2793. [Link].
14. Adom MB, Taher M, Mutalabisin MF, Amri MS, Kudos MBA, Sulaiman MWAW et al. Chemical constituents and medical benefits of Plantago major. J Bio Pha. 2017; 96(1): 348-60. ISSN 0753-3322. [CrossRef].
15. Stenholm A, Göransson U, Bohlin L. Bioassay-guided supercritical fluid extraction of cyclooxygenase-2 inhibiting substances in Plantago major L. Phytochem Anal. 2013; 24(2): 176-83. ISSN 0958-0344. [CrossRef] [PubMed].
16. Samuelsen AB, Paulsen BS, Wold JK, Otsuka H, Kiyohara H, Yamada H et al. Characterization of a biologically active pectin from Plantago major L. Carbohydr Polym. 1996; 30(1): 37-44. ISSN 0144-8617. [CrossRef].
17. Hetland G, Samuelsen AB, Løvik M, Paulsen BS, Aaberge IS, Groeng EC et al. Protective effect of Plantago major L. pectin polysaccharide against systemic Streptococcus pneumoniae infection in mice. Scand J Immunol. 2000; 52(4): 348-55. ISSN 0300-9475. [CrossRef] [PubMed].
18. Holetz FB, Pessini GL, Sanches NR, Cortez DAG, Nakamura CV, Dias Filho BP. Screening of some plants used in the Brazilian folk medicine for the treatment of infectious diseases. Mem Inst Oswaldo Cruz. 2002; 97(7): 1027-31. ISSN 0074-0276. [CrossRef] [PubMed].
19. Freitas AG, Costa V, Farias ET, Lima MCA, Sousa IA, Ximenes EA. Atividade antiestafilocócica do Plantago major L. Rev Bras Farmacogn. 2002; 12(1): 64-5. ISSN 0102-695X. [CrossRef].
20. Çitoğlu GS, Altanlar N. Antimicrobial activity of some plants used in folk medicine. J Fac Pharm Ankara. 2003; 32(3): 159-63. ISSN 2564-6524. [Link].
21. Vargas Neto P. Ação antifúngica de plantas medicinais e da própolis frente a leveduras do gênero Candida isoladas da cavidade bucal. 103 p. Ponta Grossa; 2004. Mestrado [Programa de Pós-graduação em Odontologia] – Universidade Federal de Ponta Grossa, UFPG. Ponta Grossa; 2004. [Link].
22. Cogo LL, Monteiro CLB, Miguel MD, Miguel OG, Cunico MM, Ribeiro ML et al. Anti-Helicobacter pylori activity of plant extracts traditionally used for the treatment of gastrointestinal disorders. Braz J Microbiol. 2010; 41(2): 304-9. ISSN 1517-8382. [CrossRef].
23. Üsal Ç, Vural H, Sariyar G, Çelik BÖ, Ötük G. Traditional medicine in Bi̇leci̇k province (Turkey) and antimicrobial activities of selected species. Turk J Pharm Sci. 2010; 7(2): 139-50. ISSN 1304-530X. [CrossRef]
24. Karakaş FP, Yildirim A, Türker A. Biological screening of various medicinal plant extracts for antibacterial and antitumor activities. Turk J Biol. 2012; 36(1): 641-52. ISSN 1300-0152. [Link].
25. Metiner K, Özkan O, AK S. Antibacterial effects of ethanol and acetone extract of Plantago major L. on gram positive and gram-negative bacteria. Kafkas Univ Vet Fak Derg. 2012; 18(3): 503-5. ISSN: 1300-6045. [Link].
26. Abdel-Shafi S, Al-Mohammadi AR, Sitohy M, Mosa B, Ismaiel A, Enan G et al. Antimicrobial activity and chemical constitution of the crude, phenolic-rich extracts of Hibiscus sabdariffa, Brassica oleracea and Beta vulgaris. Molecules. 2019; 24(23): 1-17. ISSN 1420-3049. [CrossRef] [PubMed].
27. Adolpho LO. Derivados dos ácidos clorogênico, cafeico e cinâmico: obtenção, avaliação da atividade antimicrobiana e de inibição enzimática. 145 p. Santa Maria. 2012. Mestrado [Programa de Pós-graduação em Farmacologia] – Universidade Federal de Santa Maria, UFSM. Santa Maria. 2012. [Link].
28. Almeida AA, Farah A, Silva DA, Nunan EA, Glória MB. Antibacterial activity of coffee extracts and selected coffee chemical compounds against enterobacteria. J Agric Food Chem. 2006; 54(23): 8738-43. ISSN 0021-8561. [PubMed].
29. Fiamegos YC, Kastritis PL, Exarchou V, Han H, Bonvin AM, Vervoort J et al. Antimicrobial and efflux pump inhibitory activity of caffeoylquinic acids from Artemisia absinthium against gram-positive pathogenic bacteria. PLoS One. 2011; 6(4): 1-12. ISSN 1932-6203. [CrossRef] [PubMed].
30. Spézia FP, Siebert D, Tenfen A, Cordova CMM, Alberton MD, Guedes A. Avaliação da atividade antibacteriana de plantas medicinais de uso popular: Alternanthera brasiliana (penicilina), Plantago major (tansagem), Arctostaphylos uva-ursi (uva-ursi) e Phyllanthus niruri (quebra-pedra). Rev Pan-Amaz Saúde. 2020; 11(1): 1-11. ISSN 2176-6223. [CrossRef].