Estado da Arte
Vigilância Científica da Jatropha curcas L. - “Planta Biodiesel”
Scientific Observations of Jatropha curcas L. - “The Biodiesel Source-Plant”
Resumo
O presente estudo promove um levantamento sobre a espécie Jatropha curcas L. (Euphorbiaceae), abordando seus aspectos etnobotânicos e fitoquímicos, assim como as atividades biológicas, incluindo a toxicidade de seus diferentes extratos de diversas partes da planta; assim como os aspectos relacionados à biotecnologia vegetal. O levantamento científico é completado com questões que se referem ao valor econômico desta espécie, quanto ao seu potencial para gerar energia (biocombustível) e as patentes relacionadas ao tema.
- Unitermos:
- Jatropha curcas.
- Euphorbiaceae.
- Biodiesel.
Abstract
This study provides a comprehensive review on the species Jatropha curcas L. (Euphorbiaceae), covering its ethnobotanic and phytochemical aspects as well as the biological activities, including the toxicity of the different extracts originated from diverse parts of the plant. The survey is complemented by issues concerning the economical value of the species and its potential for generating energy (biofuel) and the related patents on the theme.
- Key Words:
- Jatropha curcas.
- Euphorbiaceae.
- Biodiesel.
Introdução
A Jatropha curcas (L.) (Euphorbiaceae), conhecida popularmente como pinhão-manso, pinhão-branco, pinhão paraguaio ou pinha de purga é uma espécie vegetal nativa do México e cultivada em países tropicais, na América Central e do Sul, Sudeste da Ásia, Índia e África (GOONASEKERA et al., 1995). Foi autenticada pelo Dr. S. Balasubramaniam do Departamento de Botânica da Universidade de Peradeniya, Sri Lanka, sendo caracterizada como uma pequena árvore resistente a condições ambientais adversas, que atinge 3 - 4 m de altura (DUKE, 1988). O fruto da espécie é seco, tricoca, possui endocarpo lenhoso e de deiscência explosiva. A semente é ovalada, endospérmica, de envoltório liso com suaves estrias, com carúncula presa na parte ventral; a rafe é marcada longitudinalmente e pouco evidente, e presença de embrião munido com um par de cotilédones foliáceos e eixo hipocótilo radícula, cilíndrico e reto. A germinação é epígea e fanerocotiledonar (NUNES, 2007).
A espécie é propagada principalmente através de sementes heterozigotas. A viabilidade das sementes e taxa de germinação são baixas (JHA et al., 2007). A J. curcas L. é monóica, apresentando protandria. A proporção de machos para flores femininas é de 29:1. As flores de ambos os sexos abrem sincronicamente. O sistema sexual facilita a geitonogamia e xenogamia. Os visitantes florais incluem abelhas, formigas, moscas. A capacidade de autopolinização através da geitonogamia é considerada adaptativa para J. curcas de colonização (RAJU; EZRADANAM, 2002).
O pinhão-manso apresenta importância medicinal pelos seus efeitos farmacológicos. As sementes são utilizadas para o tratamento da gota, paralisia e reumatismo (SASTRI, 1959), com o seu óleo sendo utilizado como purgativo e para tratar afecções da pele (DUKE, 1988). Este mesmo óleo aporta uma grande importância econômica para esta espécie, devido ao grande potencial de produção de bicombustível (GOONASEKERA et al., 1995; NUNES, 2007). Segundo Openshaw (2000), a J. curcas é considerada uma planta multiuso, devido as seu potencial diverso, conforme está retratado na Figura 1.
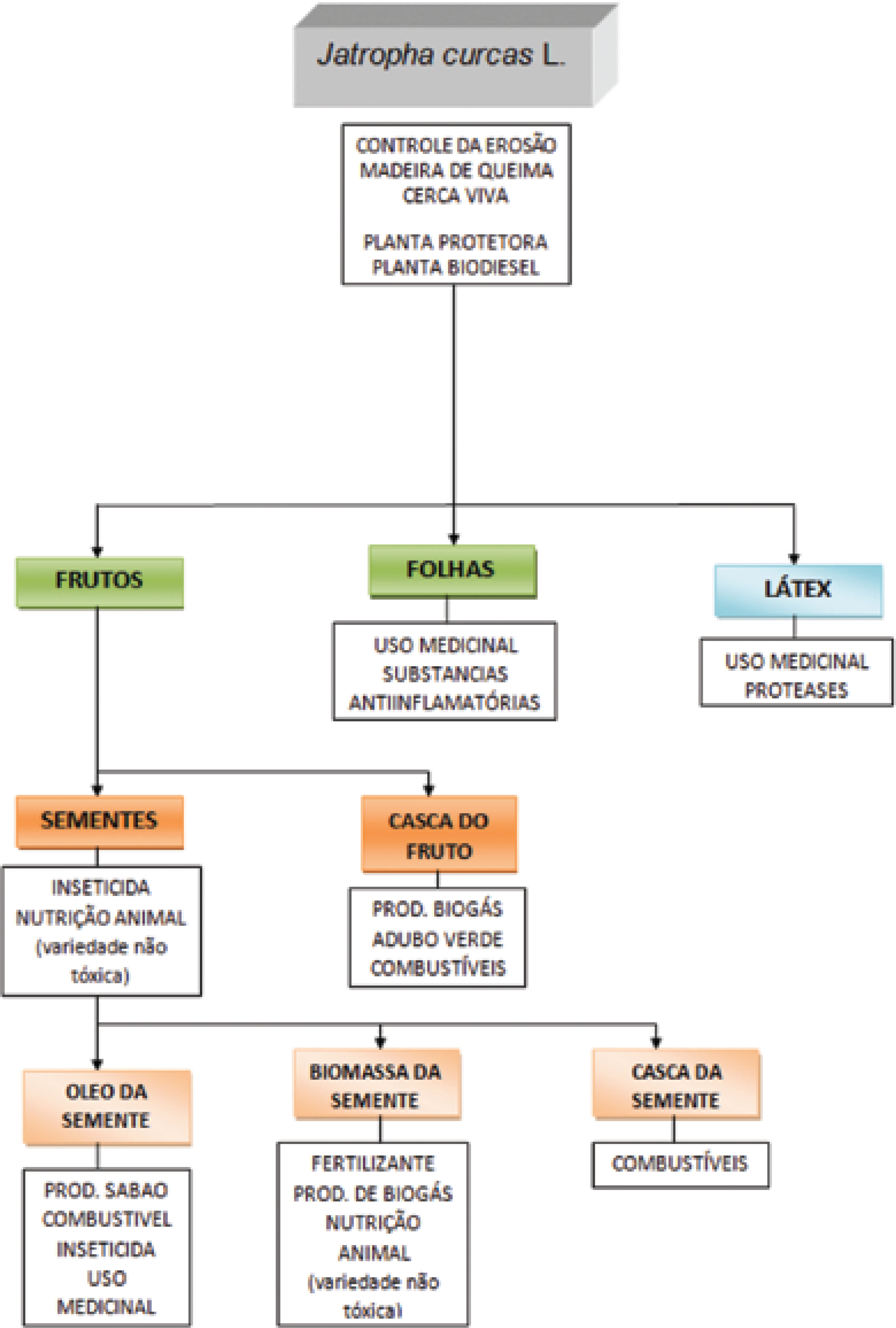
Etnobotânica
A J. curcas L. foi uma das plantas mais citadas num levantamento etnobotânico realizado no Assentamento Tarumã-Mirim, próximo a Manaus. A espécie é chamada de pinhão-branco pela comunidade e possui uso na odontalgia (LIMA, 2005). Na África, as sementes são usadas como anti-helmíntico e suas as folhas são usadas como homeostáticos (GUBITZ et al., 1999). O decocto da raiz é usado para tratar a pneumonia e sífilis (CHHABRA et al., 1990). Em Mali, as folhas são utilizadas no tratamento da malária (HENNING, 1997). No sul do Sudão, as sementes, bem como a fruta, são utilizadas como contraceptivo ou como abortivo (CHHABRA et al., 1990; LIST; HORHAMMER, 1979). Além disso, diferentes medicamentos fabricados a partir das sementes são utilizados para tratar ascite, gota e doenças de pele (JOUBERT et al., 1984). No Zaire, a J. curcas L. é utilizada tradicionalmente como abortivo (GUPTA et al., 1996). No México, o látex é usado para tratar infecções fúngicas na boca, picadas de abelhas e vespas, e para tratar problemas do aparelho digestivo em crianças (SCHMOOK; SERRALTAPERAZA, 1997). Na Índia, as folhas e caules da J. curcas são utilizadas pela tribo Tharu para extrair corante para tingir o algodão (SRIVASTAVA et al., 2008). Na Nigéria, é utilizada popularmente para manter a homeostasia sanguínea (OSONIYI; ONAJOBI, 2003). Em Camarões, as folhas são utilizadas para tratar febre reumática (SANDBERG et al., 2005). Na Amazônia peruana, o seu látex é usado como cicatrizante de feridas externas (VILLEGAS et al., 1997). É também utilizada também na medicina tradicional do Panamá (GUPTA et al., 1996), da Somália (SAMUELSSON et al., 1992) e da Tanzânia (KISANGAU et al., 2007). O óleo das sementes e os extratos aquosos das folhas e cascas são usados como laxante (CHHABRA et al., 1990; GUBITZ et al., 1999; MAMPANE et al., 1987), para tratar doenças da pele e aliviar a dores causadas pelo reumatismo e outras inflamações (CHHABRA et al., 1990). Decocções das folhas são utilizadas como antisépticos e contra tosses (HELLER, 1996). Algumas das propriedades medicinais tradicionais da J. curcas apresentadas foram comprovadas em laboratório, mas muitas dessas ainda precisam ser investigadas em profundidade para gerar produtos farmacêuticos confiáveis e comercializáveis.
Fitoquímica
Em geral, na composição da J. curcas observa-se a presença nas sementes de lectina, que são inibidores da tripsina (MAKKAR et al., 1997), e de ésteres do tipo forbol, responsáveis pela toxicidade. A sazonalidade e regiões de origem influenciam na composição química da espécie (MAKKAR et al. 1998), e nas variedades não tóxicas, a quantidade destes ésteres tóxicos é menor. A casca da semente é rica em fibras e pobre em proteínas. O primeiro estudo fitoquímico da J. curcas foi realizado em 1977 (KHAFAGY et al., 1977). Em 1978 foram isolados constituintes apolares da espécie (HUFFORD et al., 1978). Em 1987, relata-se pela primeira vez a presença de diterpenos nessa planta (ROJANAPO et al., 1987). Várias flavonas (Subramanian et al., 1971), derivados do forbol (Adolf et al.,1984), diterpenos (Naengchomnong et al., 1986; Chen et al., 1988) e uma cumarinolignana (Chen et al., 1988) foram encontradas na J. curcas.
A investigação química da J. curcas resultou no isolamento de vinte constituintes, dentre eles quatro diterpenos podocarpanos e seis outras substâncias: tetradecil-(E)-ferulato, 3-O-(Z)-cumaroil ácido oleanólico, heudelotinona, epi-isojatrogrossidiona, 2-α-hidroxiepi-isojatrogrossidiona, 2-methyanthraquinona e latirano (RAVINDRANATH et al., 2008). A partir da fração polar do extrato bruto das raízes foram isoladas, as seguintes substâncias: jatrophol, marmesina, propacina e jatrophina (NAENGCHOMNONG et al., 1994). Além dos dois sesquiterpenoides nomeados jatrophaols A e B (WANG et al., 2008). Do caule foram isolados: escopoletina (éster metílico), friedelina, epi-friedelinol e um triterpeno teracíclico - jatrocurina (4β-desmetil-24-metilenecicloartanil, 3β-p-hidroxi-m-methoxy-transcinamato) (TALAPATRA et al., 1993). A mistura de 5-hidroxipirrolidin-2-ona e pirimidin-2,4-diona foi isolada das folhas (STAUBMANN et al., 1999), cujo extrato metanólico também forneceu um di-norditerpeno (RAVINDRANATH et al., 2003). Do látex foi extraída e purificada uma protease (enzima proteolítica) denominada curcaína (NATH & DUTTA, 1991). Das sementes, foi purificada e parcialmente caracterizada uma hemaglutinina (glicoproteína) (ASSELEIH et al., 1989). Do óleo das mesmas, foi encontrado um promotor de tumor 12-desoxi-16hidroxiforbol - um diéster intramolecular (HIROTA et al., 1988).
A composição química do óleo das sementes da J. curcas é bem definida, consistindo de 35% proteínas e 60% óleo (ADEBOWALE; ADEDIRE, 2006). Estão presentes também trigliceróis e os ácidos graxos insaturados: oléico e linoléico (ADEBOWALE & ADEDIRE, 2006; AKINTAYO, 2004; AUGUSTUS et al., 2004; KPOVIESSI et al., 2004; MARTINEZ-HERRERA et al., 2006; SALIMON; ABDULLAH, 2008), ácidos graxos saturados: palmítico e esteárico (AUGUSTUS et al., 2004), e seis ésteres diterpênicos, todos eles contendo o grupamento 12-desoxi-16-hidroxiforbol (HAAS et al., 2002); além de saponinas, ésteres forbóis, lectinas, inibidores da tripsina, filatos, esterases e lípases, e o β-sitosterol como o metabólito secundário mais abundante (AKINTAYO, 2004).
Atividade Biológica
A J. curcas possui muitas atividades biológicas: antibacteriana, antifúngica, antitumoral, cicatrizante, etc. Algumas substâncias com atividade farmacológica foram isoladas do látex da J. curcas como: a Curcaciclina-A, um octapeptídeo capaz de inibir moderamente o complemento do sistema imunológico humano, além de inibir as células-T (VANDENBERG et al., 1995), e o nonapeptídeo cíclico curcaciclina B (AUVIN et al., 1997). O látex inibe a liberação de colagenases pelos fibroblastos (SIREGAR; AKBAR, 2001) e também é capaz de diminuir o tempo de coagulação sanguínea. Quando diluído, o mesmo aumenta o tempo de coagulação, apresentando atividades procoagulantes e anticoagulantes (OSONIYI; ONAJOBI, 2003). O látex também possui alcalóides incluindo Jatrophine, Jatropham e curcaína com propriedades anticancerígenas. Ele também é usado topicamente contra doenças de pele, hemorróidas e úlceras entre os animais domésticos (THOMAS et al., 2008). A proteína curcina, extraída das sementes, possui atividade antitumoral (LIN et al., 2003; LUO et al., 2006). Foi comprovado que essa proteína inibe o crescimento de células cancerígenas (LUO et al., 2006). Esse efeito está relacionado à atividade da N-glycosidase (LIN et al., 2003). Já o diterpeno curcusona B apresentou atividade antimetastática contra quatro linhagens de células cancerígenas humanas. Esse diterpeno é capaz de suprimir o processo metastático em doses não tóxicas para as células, constituindo uma molécula promissora na terapêutica dos cânceres metastáticos (MUANGMAN et al., 2005). O óleo, em associação com o ácido ascórbico é eficaz to tratamento de sarnas em ovinos (DIMRI & SHARMA, 2004).
Algumas substâncias encontradas na espécie indicam ação benéfica em relação ao tratamento da AIDS. O extrato metanólico da J. curcas coletada no Zaire, produziu efeito citoprotetor moderado contra o vírus HIV em culturas de linfoblastóides humanos (MUANZA et al., 1995). O extrato aquoso dos ramos inibe fortemente os efeitos citopáticos induzidos pelo HIV, com baixa citotoxicidade (MATSUSE et al., 1999). A substância β-1,3-glucanase, isolada das sementes, possui atividade antifúngica in vitro contra Rhizoctonia solani Kuha. e Gibberelle zeae (Schw.). A atividade antifúngica da β-1,3-glucanase é explicada pela sua capacidade de causar a hidrólise das paredes celulares dos fungos. Essa proteína pode ser útil como fungicida biológico, contudo é ligeiramente tóxica em ratos (WEI et al., 2005). Os crescimentos de Basidiobolus haptosporus e B. ranarum (NWOSU et al., 1995) e dos microorganismos Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa e Candida albicans (KISANGAU et al., 2007) também foram inibidos por J. curcas. Há indicativos da substância 4-butil-2-cloro-5-formil-1H-imidazol como aquela ativa como antibacteriana, sugerindo um sucedâneo para o imidazol (DAS et al., 2005). A seiva da planta possui atividade contra o crescimento das bactérias Staphylococcus, Bacillus e Micrococcus, sendo também capaz de impedir o embrionamento dos óvulos de Ascaris lumbricoides e Necator americanus (FAGBENRO-BEYIOKU et al., 1998)
A J. curcas oriunda da floresta amazônica peruana apresenta significante atividade cicatrizante de feridas externas e da úlcera gástrica (VILLEGAS et al., 1997). Esta atividade é confirmada pela ação do extrato bruto da casca, que é capaz de acelerar o processo de cicatrização da pele em ratos albinos, com aumento significativo de colágeno (SHETLY et al., 2006). O extrato metanólico das raízes da J. curcas apresenta significante atividade antiinflamatória em ratos e camundongos, sendo eficaz no modelo do edema de patas. O mecanismo envolve a inibição de mediadores do ciclo do ácido araquidônico pela via das ciclo-oxigenases (MUJUMDAR; MISAR, 2004). As folhas contêm apigenina, isovitexin e vitexin que, juntamente com outros fatores podem ser usadas contra a malária, doenças reumáticas e dores musculares (THOMAS et al., 2008). Estudo em laboratório realizado com ratos de infectados pelo Plasmodium falciparum (malária) demonstrou que decocção contendo extratos vegetais, incluindo a J. curcas, é eficaz no tratamento da malária (ANKRAH et al., 2003). Segundo PLETSCH & CHARLWOOD (1997) o princípio ativo responsável pelas atividades farmacológicas da Jatropha curcas L. é o diterpenóide macrocíclico jatrophona.
Toxidez
O óleo da J. curcas L. é utilizado como laxante e outras aplicações. Entretanto, possui também diversas aplicações industriais. Isso justifica a importância do seu estudo toxicológico. Trata-se de uma planta tóxica ao consumo humano, podendo causar carcinogênese, devido a presença dos ésteres diterpênicos (GMINSKI; HECKER, 1998; MAKKAR et al., 2009). Em 1984, na África, a J.curcas foi responsável pela intoxicação aguda de 30 crianças (JOUBERT et al., 1984). No ano de 1995, no Centro de Controle de Intoxicações (CCI) de Maringá-PR, foi a espécie responsável por 40% das intoxicações agudas causadas por espécies vegetais (AMADOR, 1997). A ingestão de 3 a 5 sementes causa náuseas, irritação gastrointestinal, dores abdominais, vômito e diarréia. Em casos mais graves, causa desidratação (JOUBERT et al., 1984; ABDU-AGUYE, 1986; MAMPANE et al., 1987).
O núcleo da semente constitui 62% e contém 52% de óleo. A LD 50 em ratos é de 6 mL/kg. O óleo da semente causa diarréia grave e infecção gastrointestinal em animais. A fração tóxica (2,4%) contém ésteres de forbol, e quando aplicada na pele de coelhos e ratos, produz uma severa irritação, seguida de necrose. Em camundongos, essa fração tem efeito tóxico letal Dessa forma, é essencial a remoção completa dos componentes tóxicos presente no óleo das sementes antes de sua utilização na medicina humana e em suas aplicações industriais (GANDHI et al., 1995).
A presença de ésteres de forbol altamente tóxicos, e de antinutrientes nas sementes, tais como inibidores da tripsina, lectinas e fitatos, impede o seu uso na alimentação animal (MAKKAR et al., 2008). Dessa forma, existem vários estudos que abordam processos de destoxificação de sementes e frutos de J. curcas, para que possam ser usados na nutrição animais. Essa destoxificação implica na inativação dos ésteres phorbóis e das lectinas, o que exige tratamentos químicos prévios e resulta na remoção de até 89% das substâncias tóxicas. No entanto, a quantidade remanescente de substâncias tóxicas ainda pode intoxicar significativamente os animais, principalmente no aparelho digestivo (HASS & MITTELBACH, 2000; RAKSHIT et al., 2008).
A produção de proteínas para alimentação humana e animal, a partir de sementes da J. curcas conseguiu avançar a partir da introdução de novas técnicas de destoxificação, que interferem na atividade do inibidor de tripsina em 90-97% e reduzem o conteúdo de fitato, tanino e saponina de 90, 85 e 98%, respectivamente; enquanto promovem também uma diminuição dos ésteres phorbóis e glicosídeos cianogênicos até níveis indetectáveis (DEVAPPA; SWAMYLINGAPPA, 2008; KUMAR et al., 2008). Esta diminuição da toxicidade da espécie pode ser o primeiro passo para sua utilização futura como alimento.
O efeito da fruta da J. curcas na regulação da fertilidade foi investigado pela administração oral de diferentes extratos em ratas grávidas durante um período de tempo variável. Os resultados apontam para as propriedades abortivas da fruta, pois ela é capaz de interromper a gravidez na fase inicial, após implantação embrionária. Durante a pesquisa, os animais apresentaram intoxicação aguda e perda de peso (GOONASEKERA et al., 1995). Essa constatação corrobora o uso popular da espécie como abortiva.
O extrato metanólico de J. curcas apresenta atividade moluscicida contra o caramujo Biomphalaria glabrata, que é o hospedeiro de Schistosoma mansoni e S. haematobium, sendo também tóxico contra as larvas do próprio Schistosoma - o que sugere o potencial da espécie no controle da esquistossomose (RUG; RUPPEL, 2000). O mesmo extrato também é capaz de causar anemia microcíticas e hipocrômica em ratos albinos, diminuindo o volume celular e as concentrações de hemoglobina e glóbulos vermelhos (OLUWOLE; BOLARINWA, 1997). O extrato metanólico das folhas da J. curcas foi tóxico aos camarões em salmoura, indicando sua capacidade de inibição tumoral, ao apresentar citotoxicidade e alta capacidade de intercalar com o DNA (GUPTA et al., 1996). O extrato aquoso das sementes também apresenta atividade moluscicida (CHIMBARI; SHIFF, 2008; LIU et al., 1997; VASSILIADES, 1984). O fato interessante é que sua potência depende tanto da fase de desenvolvimento do fruto e da espécie-alvo de caracol. A Biomphalaria glabrata, por exemplo, foi mais suscetível ao extrato das sementes provenientes do fruto imaturo, enquanto que a Bulinus globosus foi mais suscetível ao extrato das sementes oriundas de frutos sobremaduros (CHIMBARI; SHIFF, 2008). O óleo das sementes possui atividade ovicida contra a espécie de besouro Callosobruchus maculatus, podendo ser utilizado como inseticida (ADEBOWALE; ADEDIRE, 2006). Já o pó das sementes apresenta atividade inseticida contra o carruncho-do-feijão Callosobruchus maculatus (F.) (Coleoptera: Bruchidae). O pó é capaz de reduzir a oviposição e emergência de insetos adultos (EMEASOR et al., 2005). O jatropherol-I (diterpeno forbol), encontrado nas sementes da J. curcas é altamente tóxico para larvas do bicho-da-seda; fato associado a várias mudanças enzimáticas da larva e alterações patológicas das células epiteliais do intestino médio (JING et al., 2005).
Em estudos comparativos entre a toxicidade das sementes da J. curcas e Ricinus communis em pintos, observouse que esta última espécie é mais tóxica, pois a taxa de mortalidade, assim como os efeitos tóxicos foram maiores nos pintos que se alimentaram com a mamona (ELBADWI et al., 1995) do que com a mistura de mamona e pinhão-manso. Dentre os sintomas de toxidez comparada estão o fraco crescimento, perturbações motoras e distúrbios químicos e hematológicos (ELBADWI et al., 1992). Doses orais das sementes da J. curcas também são letais para cabritos (BECKER; MAKKAR, 1998; GADIR et al., 2003), causando diarréia sanguinolenta, dispnéia, desidratação, paralisia dos membros posteriores e decúbito antes da morte. As lesões nos animais afetados incluíam congestão e hemorragias generalizadas, enterohepatonefrotoxicicidade, hemorragia pulmonar, enfisema e cianose, ascite e hidropericárdio (GADIR et al., 2003). A semente da Jatropha curcas L. como componente da dieta de frangos diminui a retenção de proteínas, fibras e gorduras e causa perda de peso das aves, além de causar mortalidade em algumas delas. Dessa forma, há necessidade de um maior processamento das sementes antes que ela possa ser efetivamente utilizada como ingrediente de rações para aves (ADEYEMI et al., 2001). Após a dieta à base de sementes de J. curcas em pintos, os exames para avaliar a função hepática e renal dos animais indicaram a intoxicação nos animais, caracterizada por diminuição do crescimento, hepatonefropatias, hemorragias generalizadas e congestão (ELBADWI et al., 1991.
Aspectos biotecnológicos
Existem muitas publicações que abordam o uso do óleo das sementes da J. curcas como fonte de matéria-prima para a produção de combustível de motores de ignição, substituindo o óleo diesel, além da produção de biocombustível (MARTIN et al., 1984; TAKEDA, 1982). Técnicas para a regeneração de J. curcas provenientes de diversos explantes foram desenvolvidas. Avaliaram-se as regenerações de hipocótilo, pecíolo e explantes foliares em uma gama de concentrações de zeatina, cinetina e N-6 benziladenina (BA), quer individualmente ou em combinação com ácido indol-3-butírico? (AIB). A maior regeneração de hipocótilo e pecíolo foi obtida nos meios BA com IBA. Discos foliares a partir da terceira expansão exibiram maior potencial de regeneração do que aqueles a partir da quarta folha. Independente do tipo de explante, a indução de gemas e brotações diretas foi maior no meio MS com 2,22 M um BA e 4,9 M um AIB. Após simples procedimentos de endurecimento, as plantas crescidas in vitro puderam ser transferidas para o solo e cultivadas para a maturidade em campo (SUJATHA et al., 1996). Para o cultivo de embriões, o meio MS suplementado com 60 g.L-1 de sacarose proporciona bom desenvolvimento de embriões. Embriões oriundos de frutos secos apresentam maior crescimento in vitro e embriões provenientes de frutos imaturos necessitam da suplementação de sacarose no meio de cultura, para sustentar sua germinação. A associação de carvão ativado e água de coco não influenciam na germinação dos embriões. No entanto, a presença de carvão ativado ao meio favorece o enraizamento dos embriões (NUNES, 2007). Os melhores substratos para a germinação das sementes de J. curcas foram areia e papel toalha. A temperatura ideal para a germinação variou entre 20 e 30 graus Celsius (MARTINS et al., 2008). A propagação clonal in vitro foi alcançada utilizando-se explantes nodais em meio MS. Após esse processo as plântulas foram aclimatadas com sucesso, obtendo-se uma taxa de sobrevivência de 87% (DATTA et al., 2007).
Um protocolo de indução de brotações e regeneração de J. curcas a partir dos discos das folhas está em desenvolvimento, e pode ser útil na produção em massa dessa planta e na produção de plantas transgênicas (DEORE & JOHNSON, 2008). As plantas regeneradas após 2 meses de aclimatação foram transferidas com êxito para o campo visível, sem variação morfológica. Já existe um protocolo de propagação in vitro de variedades não tóxicas da J. curcas pela proliferação de gema axilar e regeneração de segmentos foliares (SUJATHA et al., 2005). O estágio de amadurecimento da cápsula do fruto da Jatropha curcas L. influencia na germinação e vigor das plântulas dessa espécie vegetal A taxa de germinação das sementes do fruto maduro foi maior do que a do fruto verde (KAUSHIK, 2003). A embriogênese somática é uma poderosa ferramenta da biotecnologia para aumentar a qualidade produção vegetal e torná-la mais rápida. Essa técnica tem sido aplicada com sucesso para regenerar o pinhão-manso. Calos embriogênicos foram obtidos a partir de explantes foliares em meio MS basal suplementada apenas com 9,3 μM Kn. A combinação do meio MS com 2,3 μM Kn e 1,0 μM IBA é a mais eficaz para indução de embriões somáticos de J. curcas (JHA et al., 2007).
O desenvolvimento de embriões oriundos de frutos da J. curcas em seus diversos estágios de maturação é mais expressivo em meio MS com sacarose. Além disso, a associação de carvão ativado com água de coco promoveu um melhor crescimento das mudas provenientes de embriões extraídos das sementes de frutos secos (NUNES et al., 2008). Um eficiente método de regeneração in vitro via explantes de brotos foi desenvolvido para a J. curcas (RAJORE; BATRA, 2005; THEPSAMRAN et al., 2008). Brotos foram proliferados nos meios MS com BAP (2,0 mg.L-1) e AIA (0,5 mg.L-1), juntamente com sulfato de adenina, glutamina e carvão ativado. A maior freqüência de indução raiz foi observado no meio com 3,0 mg.L-1 IBA. As plântulas regeneradas foram transferidas para campo com sucesso, após a aclimatação inicial (RAJORE; BATRA, 2005).
O tratamento ultrassônico das sementes da J. curcas antes da realização do processo de extração do óleo reduziu o tempo do processo de 18 para 6 horas (SHAH et al., 2005). Além disso, a combinação de sonicação e tratamento enzimático com uma preparação comercial de proteases fúngicas levaram a um rendimento de 97% para a extração de óleo das sementes (SHAH et al., 2004). Outros métodos diversos de extração de óleo das sementes são utilizados, dentre eles a utilização de solventes orgânicos e água. Os rendimentos das extrações com n-hexano e com água produziram 98% e 38% de extratos, respectivamente. Constatou-se também que a utilização de proteases que quebram a parede celular pode melhorar o rendimento da extração com água; com o uso de proteases alcalinas, o rendimento das extrações aquosas aumentou de 38% para 86%, num processo cuja vantagem é ser menos tóxico que os demais (WINKLER et al., 1997). O processo de extração do óleo das sementes também gera grande quantidade de biomassa, que pode ser usada na produção de adubo orgânico ou de enzimas, assim como fermentada para produção de etanol (SHARMA et al., 2009).
O teor de óleo, o perfil lipídico e a concentração de esteróis foram correlacionados com a fenologia da espécie J. curcas, durante seu desenvolvimento. As sementes foram coletadas em diferentes estágios de desenvolvimento a partir de uma semana após a fertilização, num intervalo de cinco dias após essa data até a maturidade. Estas foram classificadas como estágio I até VII. O teor de umidade das sementes variou de 8,8 a 90,3%; o menor teor foi na fase VII (sementes maduras) e o teor mais elevado foi na fase I. A monitoria deste processo por espectroscopia de RMN 1H dos extratos hexânicos revelou a presença de ácidos graxos livres (AGL), seus ésteres metílicos (FAME) e derivados triglicerídeos (TAG), juntamente com pequena quantidade de esteróis. As sementes jovens sintetizaram predominantemente lipídeos polares. A síntese de lipídeos foi notada quase três semanas após a fertilização. A partir da quarta semana, as sementes sintetizaram TAG. A fase III foi considerada o ponto de viragem do desenvolvimento das sementes já que, nesta fase, a concentração de esteróis baixou ao nível negligenciável, houve baixíssima formação de FAME, a acumulação de TAG aumentou substancialmente, e houve uma súbita queda na concentração FFA. Os resultados podem ser úteis para se compreender e melhorar a biossíntese de TAG, no sentido de reduzir o teor de AGL nas sementes maduras (ANNARAO et al., 2008).
Um estudo do efeito do NaCl no crescimento da J. curcas, monitorando-se a atividade enzimática e outros parâmetros, apontaram para um aumento da atividade das enzimas antioxidantes; fato que poderia ser explicado como uma resposta ao dano celular induzido pelo NaCl. Contudo, o aumento da atividade dessas enzimas não é suficiente para interromper os efeitos deletérios do NaCl e sim para reduzir a gravidade do estresse salínico e permitir o crescimento celular. Além disso, observouse que, quanto maior a concentração de NaCl, menor o crescimento dos calos do pinhão-manso (KUMAR et al., 2008). Já na influência do níquel na germinação das sementes da espécie, observou-se que a massa seca das plântulas diminuiu, enquanto o peso seco aumentou após exposição ao metal Além disso, o níquel causou alteração na atividade enzimática (YAN et al., 2008).
Ômicas
Foi definido o tamanho do genoma, a composição da base e do cariótipo da J. curcas. O cariótipo é composto de 22, relativamente pequenos, cromossomos metacêntricos e submetacêntricos, cujas dimensões variam de 1,71 a 1,24 mμ A possibilidade de um evento poliploidização na história evolutiva de J. curcas está em discussão (CARVALHO et al., 2008). No Sul da China, uma coleção de germoplasma da J. curcas L. está sendo montada com base na localização geográfica da espécie. Todavia, esta coleção não foi caracterizada utilizando técnicas moleculares associadas à gestão e utilização do germoplasma. Neste estudo, as relações genéticas de 58 acessos da espécie foram avaliadas com base na SSR e AFLP. Dezessete marcadores microssatélites foram desenvolvidos utilizando o FIASCO (Fast Isolation by AFLP of Sequences Containing Repeats) e apenas um foi através da SSR primers polimórficos com dois alelos. O agrupamento dos genótipos com base em marcadores AFLP, mostrou que a diversidade genética do pinhão-manso em Guizhou foi notavelmente diferente que de outras amostras (SUN et al., 2008). Estudos realizados na Índia com espécimes de J. curcas coletados em dez fontes diferentes, revelaram diferenças em relação ao peso e teor das sementes, altura, diâmetro, área foliar, dentre outros parâmetros, para as espécies coletadas. Essa constatação é explicada pelas diferenças fenotípicas e genotípicas das espécies. Análises como esta podem otimizar a escolha do fenótipo e genótipo mais adequado para se obter um maior teor de óleo das sementes. Essa seleção é muito importante visto a importância econômica e medicinal da espécie (GINWAL et al., 2004). Foi identificado um gene da J. curcas que codifica uma enzima envolvida no processo de adaptação dessa espécie ao estresse ambiental Esse gene é denominado JcBD1 e tem maior expressão em folhas e caules das plantas submetidas a tensões ambientais, tais como: seca, calor, e estresse salínico (ZHANG et al., 2008).
Produção Agronômica
A temperatura mínima letal para plantas jovens de pinhão-manso foi determinada, além disso, foram definidas e mapeadas as regiões que apresentam condições térmicas aptas ao seu cultivo, visando subsidiar a expansão desta cultura no sul do Brasil, como alternativa para produção de biodiesel (ANDRADE, 2007). A temperatura mínima de -3 ºC provocou a morte das folhas em 60% das plantas. A exposição a -4ºC foi letal para 60% das plantas, enquanto que a -5 ºC todas as plantas morreram. A fotossíntese foi prejudicada pelas baixas temperaturas e nos tratamentos a -4ºC e -5ºC os valores foram negativos, demonstrando que o processo foi completamente paralisado e as plantas estavam somente respirando. A atividade da peroxidase se elevou nos tratamentos +1 ºC, 0 ºC, -1 ºC e -2 ºC, decrescendo sob temperaturas iguais ou inferiores a -3ºC. Os teores de proteínas totais solúveis foram maiores quanto menores as temperaturas a que as plantas foram submetidas. Dessa forma, as baixas temperaturas aumentam a atividade da enzima peroxidase do pinhão-manso até o ponto em que se iniciam os danos, quando a atividade passa a decrescer e assim pode ser utilizada como indicativo de sensibilidade a baixas temperaturas. Com base nos danos verificados, estabeleceu-se a temperatura mínima crítica de 0 ºC no abrigo meteorológico como limitante ao cultivo (ANDRADE, 2007). A espécie tolera temperaturas elevadas e baixa umidade (AUGUSTUS et al., 2004).
A água salina pode ser utilizada com sucesso no cultivo da Jatropha curcas L. A salinidade não afetou o crescimento da espécie, o amadurecimento dos frutos e a absorção de sódio e potássio (DAGAR et al., 2006). A espécie é prudente na utilização de água. Ela possui mecanismos que controlam sua transpiração durante o verão (GUSH, 2008). Demonstrou-se que a proteína aquaporin JcPIP2 está envolvido na resposta da J. curcas às secas, provavelmente auxiliando no processo de condutividade da água através de membrana (ZHANG et al., 2007). O tipo de solo possui influencia no desenvolvimento das plântulas da J. curcas. Entre os tipos de solo, a sobrevivência das mudas e o tamanho das plântulas são maiores em argila dos solos aluviais (KATHIRAVAN et al., 2008). A espécie é capaz de crescer em solos contaminados com metais pesados desde que este seja tratado previamente com biofertilizante e biosludge (resíduos orgânicos). Em solo contaminado sem tratamento, quanto maior a concentração de metais pesados no solo, maior é a concentração na planta. Com a adição de resíduos orgânicos no solo, essa situação muda, pois a matéria orgânica ali presente age como quelante, reduzindo a toxidez dos metais para a planta (JUWARKAR et al., 2008; KUMAR et al., 2008). A J. curcas também é utilizada para recuperação e aumentar a qualidade de solos degradados, uma vez que mantém o estoque de carbono orgânico e de nitrogênio, além de aumentar a taxa de seqüestro de carbono e garantir uma maior infiltração da água. O uso dessa planta é uma alternativa sustentável de recuperação de solos (OGUNWOLE et al., 2008).
A espécie, após passar por tratamento utilizando fitoproteínas, melhora de forma acentuada seu crescimento vegetativo, enraizamento, floração, frutificação e formação de sementes. Isso contribui de forma positiva para o uso da espécie na recuperação de terrenos baldios com o solo degradado (DEBNATH; VERMA, 2008). A concentração de nutrientes das folhas da J. curcas foi classificada na seguinte ordem: N> Ca> K> Mg> P> S> Mn> Fe> B> Zn> Cu; e nos frutos foi: N> K> Ca> P 2 Mg> S> Mn> F e> B> Zn> Cu. A N. A concentração de K nas folhas foi de 2,3 e 1,4 nos frutos, o que indica que a exigência de potássio aumenta quando a unidade começa produção de frutas. Este estudo sugere que altas quantias de nutrientes são extraídas da planta durante a colheita, assim, a cultura exige adubação adequada para evitar a exaustão do solo após longos anos de cultivo (LAVIOLA; DIAS, 2008). Em testes in vitro, o extrato das folhas de J. curcas foi capaz de controlar a mancha marrom, uma doença que atinge o feijão-caupi (Vigna unguiculata) e é causada pelo Colletotrichum capsici. Esse fato aponta para a utilização da espécie no manejo de doenças de plantas (ONUH et al., 2008).
Valor Econômico
No México, a J. curcas demonstrou possuir um alto potencial agro-industrial por causa dos vários derivados que são possíveis de preparar. O óleo extraído das sementes pode ser utilizado como um substituto do diesel depois de sofrer transesterificação e outros processos. Atualmente, o biodiesel tem elevada procura nos Estados Unidos e Europa e vem sendo desenvolvido em países emergentes, como a Índia e o Brasil. Por ser tratar de uma matéria-prima promissora para produzir energia a partir de recursos renováveis. Assim, possui grande valor econômico. Os motores a combustão interna por compressão utilizam tradicionalmente como combustível o óleo diesel de origem mineral A recente adição, em pequenas proporções, de óleo de origem vegetal - biodiesel - ao óleo mineral, justificada pelos especialistas na área como contraponto à escassez do petróleo, e por outros como uma redução das emissões de gases contribuintes para o efeito estufa, abre uma perspectiva de utilização de óleos de fontes renováveis, em larga escala. As possibilidades de produção de óleo combustível de origem vegetal, no Brasil, são amplas, visto que são várias as oleaginosas disponíveis, incluindo plantas adaptadas à região nordeste do país, como o dendezeiro - Elaeis guineensis - e a mamoneira - Ricinus communis - ou nativas como o pinhão de purga - Jatropha curcas - também conhecido como pinhão manso (VALENTE, 2007). A biomassa gerada a partir da extração do óleo das sementes é rica em proteínas e carboidratos; entretanto, não pode ser utilizada como alimento de animais sem passar por tratamento prévio que elimine suas toxinas. Dessa forma, outro destino que pode ser dado a esse material é a produção de biogás. É possível produzir biogás a partir das sementes da planta, quando o uso de filtro anaeróbico conduz a 70% de rendimento em metano, (STAUBMANN et al., 1997). Para os países em desenvolvimento, como a Nicarágua, a J. curcas se afigura como uma planta muito promissora em termos de produção de energia, já que pode ser cultivada em solos muito pobres e fornece alto rendimento médio de sementes. A produção de ésteres metílicos do óleo através de transesterificação foi demonstrada, e o éster combustível pode ser usado diretamente em motores existentes, sem modificações. Hoje, a produção de ésteres metílicos é muito mais promissora, porém, sobretudo para países produtores de etanol, a produção de ácidos graxos - ésteres etílicos pode ser uma alternativa no futuro (FOIDL et al., 1996). Existem diversas publicações recentes que abordam o uso da J. curcas como biocombustível - processo de produção, processo de extração do óleo das sementes, tratamento químico do óleo que otimiza a produção, inovações tecnológicas, dentre outros (ACHTEN et al., 2007; AGARWAL, 2007; AZAM et al., 2005; BANAPURMATH et al., 2008; BERCHMANS; HIRATA, 2008; BORA et al., 2008; CATHARINO et al., 2007; ; CHHETRI et al., 2008; DEMAFELIS, 2008; DEMIRBAS, 2009; DERNIRBAS, 2008; ESCOBAR et al., 2008; FRANCIS et al., 2005; GRESSEL, 2008; KAUL et al., 2007; KAUSHIK et al., 2007; KUMAR et al., 2003; KUMAR; SHARMA, 2008; MENDONZA et al., 2007; MIN & YAO, 2007; MODI et al., 2007; MODI et al., 2006; PRAMANIK, 2003; PRASAD et al., 2000; RAJAGOPAL, 2008; RAO et al., 2007; RATHORE; MADRAS, 2007; RAZON, 2008; SARIN et al., 2007; SHAH et al., 2004; SHAH et al., 2003; SRICHAROENCHAIKUL et al., 2008; SU; WEI, 2008; SUBRAMANIAN et al., 2005; TAMALAMPUDI et al., 2008; TANG et al., 2007; TAPANES et al., 2008; TIWARI et al., 2007; TIWARI et al., 2006; VAN EIJCK & ROMIJN, 2008; VASUDEVAN et al., 2005; ZHANG et al., 2009; ZHOU et al., 2006; ZHU et al., 2006; WAHLEN et al., 2008; WINAYANUWATTIKUN et al., 2008).
Patentes
Não foi encontrada nenhuma patente referente à J. curcas no banco de dados do INPI e EPO. Todas as patentes encontradas para a espécie estão publicadas na base de dados Web of Science. A primeira patente sobre a espécie refere-se ao uso do óleo das sementes de Jatropha curcas L. como combustível em motores a diesel e gasolina. Em testes realizados em motores de caminhão, o óleo da semente apresentou desempenho semelhante ao óleo diesel, com a vantagem de baixa de emissão de gás carbônico e outros gases, além de ser um combustível originado de uma matéria-prima renovável (YUKO, 1984). Existe também uma patente sobre a produção de resinas alquídicas (material de revestimento) resistentes ao calor, a partir do óleo das sementes (DAINIPPON et al., 1992). Outras patentes diversas referem o uso do óleo da J. curcas como combustível. Estas patentes descrevem métodos de fabricação, novas técnicas de produção, formulações, etc. (AGARWAL, 2008; GHOSH et al., 2006; ZHANG et al., 2008; ZHANG et al., 2008; WANG, 2008; YUKO, 1985). Foi patenteado um método de extração do óleo das sementes da J. curcas com solventes orgânicos (TAMA et al., 1994), assim como um processo a partir de fermentação com microorganismos. Segundo os depositantes, esse método possui a vantagem de reduzir o custo de produção e melhorar o rendimento da extração (QIU et al., 2008).
Seguindo a tendência apresentada em algumas publicações sobre a espécie referente ao seu uso na nutrição animal, já existe patente de uma ração para peixe contendo J. curcas (YUAN et al., 2008). Outro depósito referese à produção de proteína vegetal a partir das sementes do pinhão-manso, como aditivo em alimentos (WHANG; ZHU, 2005). Comprovando várias publicações que apontam a atividade moluscicida do pinhão-manso, há uma patente de um produto em pó com esta propriedade, produzido a partir das sementes da planta, além de seu processo de extração e aplicação. Esse moluscicida não é tóxico para peixes, não causa poluição ambiental e é muito eficaz no combate de caracóis (LIU et al., 2000).
Existem vários depósitos de patentes referentes a produção agronômica e biotecnologia vegetal, como citadas a seguir: método de micropropagação (JOHNSON; DEORE, 2008); método para o armazenamento de sementes, envolvendo tratamento prévio para garantir mais de 90% de pureza, além da realização de ensaios de teor de água (deve estar entre 7 e 9%) das mesmas antes de serem embaladas, num processo que mantém a qualidade das sementes de forma efetiva, reduz a perda por oxidação e mantém a sobrevida das sementes acima de 90% (YUAN et al., 2008). Outra invenção refere-se ao método para prolongar o tempo de armazenamento do óleo da J. curcas usando-se antioxidante rosmarínico, contribuindo para o aumento da vida útil do óleo da planta (LI et al., 2006). Foi patenteado também um método referente ao plantio intercalado de Euphorbia lathyris e J. curcas, que traz benefícios econômicos pelo aumento da produtividade de matéria-prima a partir das duas espécies; um ponto importante quando se almeja torná-las fontes de produção de bioenergia (YUAN et al., 2008). Um método para melhorar o início de um enxerto do ramo da J. curcas envolve a seleção da época adequada de realização da enxertia dentre outros parâmetros, resultando numa melhora em cerca de 98% da taxa de sobrevivência da espécie (DUAN et al., 2008). Outro método melhorado envolveu a garantia da maturação do fruto a partir da análise de sua coloração. Estes são colhidos com um facão ou poda anexada a um pau de bambu, e após a secagem, são embalados separadamente. O método considera características reprodutivas da espécie, reduz custos e recursos humanos (YUAN et al., 2008). A J. curcas pode ser utilizada como fertilizante em combinação com os fungos micorrízicos. Esse adubo pode aumentar a taxa de absorção do solo, a nutrição da raiz da J. curcas, satisfazer a nutrição necessária para o crescimento da espécie, favorecer o desenvolvimento de frutos e aumentar o rendimento das sementes sem causar danos ecológicos (ZHAO et al., 2008). Existem duas patentes referentes à produção de um tipo de clone de matrizes de J. curcas em meio contendo fito-hormônios a partir de explantes meristemáticos. Segundo os depositantes, esse processo deve movimentar a economia, já que permitirá o cultivo padronizado de espécies com qualidade em grande escala para uso comercial Essa planta é útil para, por exemplo, tratamento do cancro, a limpeza dos dentes, e como um antídoto para mordidas de serpentes. Além disso, o óleo das sementes pode ser usado em motores a diesel e para fazer sabão. É importante ressaltar, que uma grande vantagem ambiental do uso do óleo da espécie é a não emissão de fumaça durante a queima (MURALI et al., 2008)
Existem patentes relacionadas ao uso farmacêutico da espécie. O extrato de J. curcas L. e de outras plantas da família Euphorbiaceae estão presentes na formulação de um estimulante de crescimento capilar para prevenção da alopecia (SHISEIDO, 1996) e em cosméticos (TAMA et al., 1994). Além disso, o extrato do ramo e das folhas está presente num agente antiviral ativo contra herpes, poliomielite, sarampo, varicela zoster, citomegalovírus e os vírus do DNA ou RNA (HOZUMI et al., 1993). Foi patenteado um medicamento de uso tópico contendo J. curcas em sua formulação, utilizado para tratar queimaduras, cortes e ferimentos da pele. Além de auxiliar no processo de cicatrização, possui ação antimicrobiana e evita a formação de cicatriz (PUSHPANGADAN et al., 2004). O isolamento do complexo (5-hydroxi-pirrolidin-2-ona e pirimidin-2,4-diona) das folhas da J. curcas, usado como agente antiinflamatório também foi patenteado (SUCHER & HOLZER, 1994). Em relação às ômicas, foi patenteado um fator de transcrição da J. curcas utilizado para cultivar plantas mais resistentes (SHEN et al., 2006).
Foi patenteada a produção de matérias-primas úteis para grandes indústrias a partir do óleo das sementes da Jatropha curcas L, são elas: a parodução de bio-polyol (RUI et al., 2008) e a preparação de espuma plástica de poliuretano, última patente depositada na base de dados do Web of Science em 2009. Essa espuma é utilizada em geladeiras, materiais construção e tem a vantagem de possuir excelente biodegradabilidade (RUI et al., 2009)
Referências
ABDU-AGUYE, I.; SANNUSI, A.; ALAFIYA-TAYO, R.A.; BHUSNURMATH, S.R. Acute toxicity studies with Jatropha curcas L. Human Toxicology, v.5, p.269-274, 1986.
ACHTEN, W.M.J.; MATHIJS, E.; VERCHOT, L. Jatropha biodiesel fueling sustainability? Biofuels Bioproducts & Biorefining (Biofpr), v.1, p.283-291, 2007.
ACHTEN, W.M.J.; VERCHOT, L.; FRANKEN, Y.J. Jatropha bio-diesel production and use. Biomass & Bioenergy, v.32, p.1063-1084, 2008.
ADEBOWALE, K. O.; ADEDIRE, C.O. Chemical composition and insecticidal properties of the underutilized Jatropha curcas seed oil. African Journal of Biotechnology, v.5, p.901-906, 2006.
ADEYEMI, O.A.; BALOGUN, M.O.; FASINA, O.E. Response of finishing broilers to graded levels of boiled Jatropha seeds. Indian Journal of Animal Sciences, v.71, p.800-803, 2001.
ADOLF, W.; OPFERKUCH, H.J.; HECKER, E. Irritant forbol derivatives from four Jatropha species. Phytochemistry, v23, p.129-132, 1984.
AGARWAL, D.; AGARWAL, A.K. Performance and emissions characteristics of Jatropha oil (preheated and blends) in a direct injection compression ignition engine. Applied Thermal Engineering, v.27, p.2314-2323, 2007.
AGARWAL, R. Process of extracting Jatropha Curcas Oil for use in diesel engines. Patent Number (s): IN200100744-I1, 2008.
AMADOR, J.C. Perfil das intoxicações agudas exógenas infantis na cidade de Maringá e região. Dissertação de Mestrado. Universidade Estadual de Londrina - Saúde Coletiva, 108 pp., 1997.
ANDRADE, G.A. Temperatura mínima letal e delimitação das áreas de baixo risco de geadas para o cultivo do pinhão-manso (Jatropha curcas L.) no Estado do Paraná. Dissertação de Mestrado. Universidade Estadual De Londrina - Agronomia, 69 pp., 2007.
ANNARAO, S.; SIDHU, O.P.; ROY, R. Lipid profiling of developing Jatropha curcas L. seeds using H-1 NMR spectroscopy. Bioresource Technology, v.99, p.9032-9035, 2008.
ASSELEIH, L.M.C.; PLUMBLEY, R.A.; HYLANDS, P.J. Purification and partial characterization of a hemagglutinin from seeds of Jatroph curcas. Journal of Food Biochemistry, v.13, p.1-20, 1989.
AUGUSTUS, G.D.P.R.; MEHALINGAM, P.; KANNAN, D. Evaluation and bioinduction of energy components in Jatropha curcas L. Asian Journal of Chemistry, v.16, p.1415-1420, 2004.
AUVIN, C.; BARAGUEY, C.; BLOND, A. Curcacycline B, a cyclic nonapeptide from Jatropha curcas enhancing rotamase activity of cyclophilin. Tetrahedron Letters, v.38, p.2845-2848, 1997.
AZAM, M.M; WARIS, A.; NAHAR, N.M. Prospects and potential of fatty acid methyl esters of some non-traditional seed oils for use as biodiesel in India. Biomass & Bioenergy, v.29, p.293-302, 2005.
BANAPURMATH, N.R.; TEWARI, P.G.; HOSMATH, R.S. Performance and emission characteristics of a DI compression ignition engine operated on Honge, Jatropha and sesame oil methyl esters. Renewable Energy, v.33, p.1982-1988, 2008.
BECKER, K.; MAKKAR, H.P.S. Effects of forbol esters in carp (Cyprinus carpio L). Veterinary and Human Toxicology, v.40, p.82-86, 1998.
BERCHMANS, H.J.; HIRATA, S. Biodiesel production from crude Jatropha curcas L. seed oil with a high content of free fatty acids. Bioresource Technology, v.99, p.1716-1721, 2008.
BORA, D.K.; DAS, L.M.; BABU, M.K. G. Performance of a mixed biodiesel fueled diesel engine. Journal of Scientific & Industrial Research, v.67, p.73-76, 2008.
CARVALHO, C.R.; CLARINDO, W.R.; PRACA, M.M. Genome size, base composition and karyotype of Jatropha curcas L., an important biofuel plant. Plant Science, v.174, p.613-617, 2008.
CATHARINO, R.R.; MILAGRE, H.M.S.; SARAIVA, S.A. Biodiesel typification and quality control by direct infusion electrospray ionization mass spectrometry fingerprinting. Energy & Fuels, v.21, p.3698-3701, 2007.
CHEN, M.; HOU, L.; ZHANG, G. The diterpenoids from Jatropha curcas. Zhiwu Xuebao, v.30, p.308-311, 1988. Chemical Abstracts, v.110, 21068h, 1989.
CHHABRA, S.C.; MAHUNNAH, L.A.; MSHIU, E.N. Plants used in traditional medicine in eastern Tanzania. IlL Angiosperms (Euphorbiaceae to Menispermaceae). Journal of Ethnopharmacology, v.28, p.255-283, 1990.
CHHETRI, A.B.; TANGO, M.S.; BUDGE, S.M. Non-edible plant oils as new sources for biodiesel production. International Journal of Molecular Sciences, v.9, p.169-180, 2008.
DAGAR, J.C.; TOMAR, O.S.; KUMAR, Y. Performance of some under-explored crops under saline irrigation in a semiarid climate in northwest India. Land Degradation & Development, p.17, v.285-299, 2006.
DAINIPPON INK & CHEMICALS INC.; YUKO, K.K. Heat resistant alkyd resin coating material obtained using type of tung oil obtained from seeds of Jatropha curcas. Patent Number(s): JP4028780-A, 1992.
DAS, B.; REDDY, M.R.; RAVINDRANATH, N. A substituted imidazole derivative from Jatropha curcas. Indian Journal of Chemistry Section B - Organic Chemistry Including Medicinal Chemistry, v.44, p.1119-1120, 2005.
DATTA, M.M.; MUKHERJEE, P.; GHOSH, B. In vitro clonal propagation of biodiesel plant (Jatropha curcas L.). Current Science, v.93, 1438-1442, 2007.
DEBNATH, M.; VERMA, H.N. Effect of phytoprotein treatment on Jatropha curcas for wasteland reclamation. African Journal of Biotechnology, v.7, p.613-616, 2008.
DEMAFELIS, R.B. Towards a village-scale biodiesel processing of Jatropha curcas in the Philippines. Philippine Journal of Crop Science, v.33, p.59-68, 2008.
DEMIRBAS, A. New liquid biofuels from vegetable oils via catalytic pyrolysis. Energy Education Science and Technology, v.21, p.1-59, 2008.
DEORE, A.C.; JOHNSON, T.S. High-frequency plant regeneration from leaf-disc cultures of Jatropha curcas L.: an important biodiesel plant. Plant Biotechnology Reports, v.2, p.7-11, 2008.
DEVAPPA, R.K.; SWAMYLINGAPPA, B. Biochemical and nutritional evaluation of Jatropha protein isolate prepared by steam injection heating for reduction of toxic and antinutritional factors. Journal of the Science of Food and Agriculture, v.88, p.911-919, 2008.
DIMRI, U.; SHARMA, M.C. Effects of sarcoptic mange and its control with oil of Cedrus deodara, Pongamia glabra, Jatropha curcas and benzyl benzoate, both with and without ascor bic acid on growing sheep: Assessment of weight gain, liver function, nutrient digestibility, wool production and meat quality. Journal of Veterinary Medicine Series A - Physiology Pathology Clinical Medicine, v.51, p.79-84, 2004.
DIMRI, U.; SHARMA, M.C. Effects of sarcoptic mange and its control with oil of Cedrus deodara, Pongamia glabra, Jatropha curcas and benzyl benzoate, both with and without ascorbic acid on growing sheep: Epidemiology; assessment of clinical, haematological, cell-mediated humoral immune responses and pathology. Journal of Veterinary Medicine Series A - Physiology Pathology Clinical Medicine, v.51, p.71-78, 2004.
DUAN, Y.; HE, L.; YUAN, L. Jatropha curcas branch top graft improving method, involves selecting proper season for grafting jatropha curcas branch, scion and stock, grafting operation, forming proper season from middle ten days of February to last ten days of March. Yunan Academy of Agricultural Sciences. Patent Number(s): CN101283660-A, 2008.
DUKE, J.A.; RATON, F.L. CRC Handbook of Medicinal Herbs. CRC Press, Boca Raton, p.253-54, 1988.
ELBADWI, S.M.; ADAM, S.E.I.; HAPKE, H.J. Toxic effects of lowlevels of dietary Jatropha curcas seed on brown hisex chicks. Veterinary and Human Toxicology, v.34, p.112-115, 1992.
ELBADWI, S.M.A.; MOUSA, H.M.; ADAM, S.E.I. Response of brown hisex chicks to low-levels of Jatropha curcas, Ricinus communis or their mixture. Veterinary and Human Toxicology, v.34, n.304-306, 1992.
ELBADWI, S.M.A.; ADAM, S.E.I.; HAPKE, H.J. Comparative toxicity of Ricinus communis and Jatropha curcas in brown hisex chicks. Deutsche Tierarztliche Wochenschrift, v.102, p.75-77, 1995.
EMEASOR, K.C.; OGBUJI, R.O.; EMOSAIRUE, S.O. Insecticidal activity of some seed powders against Callosobruchus maculatus (F.) (Coleoptera: Bruchidae) on stored cowpea. Zeitschrift Fur Pflanzenkrankheiten Und Pflanzenschutz - Journal of Plant Diseases and Protection, v.112, p.80-87, 2005.
ESCOBAR, E.C.; DERNAFELIS, R.B.; PHAM, L.J. Biodiesel Production from Jatropha curcas L. Oil by Transesterification with Hexane as Cosolvent. Philippine Journal of Crop Science, v.33, p.1-13, 2008.
FAGBENRO-BEYIOKU, A.F.; OYIBO, W.A. ; ANUFOROM, B.C. Disinfectant/antiparasitic activities of Jatropha curcas. East African Medical Journal, v.75, p.508-51, 1998.
FOIDL, N.; FOIDL, G.; SANCHEZ, M. Jatropha curcas L as a source for the production of biofuel in Nicaragua. Bioresource Technology, v.58, p.77-82, 1996.
FRANCIS, G.; EDINGER, R.; BECKER, K. A concept for simultaneous wasteland reclamation, fuel production, and socio-economic development in degraded areas in India: Need, potential and perspectives of Jatropha plantations. Natural Resources Forum, v.29, p.12-24, 2005.
GADIR, W.S.A.; ONSA, T.O.; ALI, W.E.M. Comparative toxicity of Croton macrostachys, Jatropha curcas and Piper abyssinica seeds in Nubian goats. Small Ruminant Research, v.48, p.61-67, 2003.
GANDHI, V.M.; CHERIAN, K.M.; MULKY, M.J. Toxicological studies on ratanjyot oil. Food and Chemical Toxicology, v.33, p.39-42, 1995.
GHOSH, P.K.; ADIMURTHY, S.; GANDHI, M.R. Preparation of fatty acid methyl ester useful as biodiesel involves transesterification of mechanically oil expelled obtained from plant materials by treatment with alkali followed by antioxidant and methanolic-potassium hydroxide solution. Council of Scientific & Industrial Research of India. Patent Number(s): US2006080891-A1; IN200402056-I1; WO2006043281-A1, 2006.
GHOSH, P.K.; SHETHIA, B.D.; PARMAR, D.R. Preparing fatty acid methyl ester from triglyceride oil comprises neutralizing free fatty acid in oil; adding antioxidant; treating with methanolic-potassium hydroxide, fatty acid methyl ester layer and flue gas; and collecting glycerol. Council of Scientific & Industrial Research of India. Patent Number(s): WO2006043281-A1, 2006.
GINWAL, H.S.; RAWAT, P.S.; SRIVASTAVA, R.L. Seed source variation in growth performance and oil yield of Jatropha curcas Linn. in central India. Silvae Genetica, v.53, p.186-192, 2004.
GMINSKI, R.; HECKER, E. Predictive and preventive toxicology of innovative industrial crops of the spurge (Euphorbiaceae) family. Interdisciplinary Science Reviews, v.23, p.99-112, 1998.
GOONASEKERA, M. M.; GUNAWARDANA, V. K.; JAYASENA, K. Pregnancy terminating effect of Jatropha curcas in rats. Journal of Ethnopharmacology, v.47, p.117-123, 1995.
GRESSEL, J. Transgenics are imperative for biofuel crops. Plant Science, v.74, p.246-263, 2008.
GUBITZ, G.M.; MITTELBACH, M.; TRABI, M. Exploitation of the tropical oil seed plant Jatropha curcas L. Bioresource Technology, v.67, p.73-82, 1999.
GUPTA, M.P.; MONGE, A.; KARIKAS, G.A. Screening of Panamanian medicinal plants for brine shrimp toxicity, crown gall tumor inhibition, cytotoxicity and DNA intercalation. International Journal of Pharmacognosy, v.34, p.19-27, 1996.
GUPTA, P.K.; KUMAR, R.; PANESAR, B.S. Studies on characterization of selected plant oils and their bio-diesels. Ama-Agricultural Mechanization in Asia, Africa and Latin America, v.39, p.14-18, 2008.
GUSH, M.B. Measurement of water-use by Jatropha curcas L. using the heat-pulse velocity technique. Water SA, v.34, p.579-583, 2008.
HAAS, W.; MITTELBACH, M. Detoxification experiments with the seed oil from Jatropha curcas L. Industrial Crops and Products, v.12, p.111-118, 2000.
HAAS, W.; STERK, H.; MITTELBACH, M. Novel 12-deoxy16-hydroxyforbol diesters isolated from the seed oil of Jatropha curcas. Journal of the Natural Products, v.65, p.1434-1440, 2002.
HELLER, J. Physic Nut. Jatropha curcas L. Promoting the Conservation and use of Underutilized and Neglected Crops. I. Institute of Plant Genetics and Crop Plant Research, Gatersleben/International Plant Genetic Resources Institute, Rome, 1.
HENNING, K. Fuel production improves food production: the jatropha project in Mali. In: Biofuels and Industrial Products from Jatropha Curcas. Giibitz, G.M., Mittelbach, M., Trabi, M. (Eds.), p.92-97. DBV Graz., 1997.
HIROTA, M.; SUTTAJIT, M.; SUGURI, H.A new tumor promoter from the seed oil of Jatropha curcas L., an intramolecular diester of 12-deoxy-16-hydroxyforbol. Cancer Research, v.48, p.5800-5804, 1988.
HOZUMI, T.; MATSUMOTO, T.; OOYAMA, H. Terpene(s) steam-distilled from aromatic plants especially active against herpes, polio, measles, varicella zoster, cytomegalovirus and DNA or RNA viruses. Patent Number(s): EP568001-A; EP568001-A2; JP6025003-A, 1995.
HUFFORD, C.D.; OGUNTIMEIN, B.O. Nonpolar constituents of Jatropha curcas. Lloydia - The Journal of Natural Products, v.41, p.161-165, 1978.
JHA, T.B.; MUKHERJEE, P.; DATTA, M.M. Somatic embryogenesis in Jatropha curcas Linn., an important biofuel plant. Plant Biotechnology Reports, v.1, p.135-140, 2007.
JING, L.; FANG, Y.; YING, X. Toxic impact of ingested Jatropherol-I on selected enzymatic activities and the ultrastructure of midgut cells in silkworm, Bombyx mori L. Journal of Applied Entomology, v.129, p.98-104, 2005.
JOHNSON, T.S.; DEORE, A.C. Producing micropropagated true-to-type Jatropha curcas plant useful for pharmaceutical or dermatological products, by isolating a leaf disc from the leaf of J. curcas, and micropropagating the leaf disc. Reliance Life Sciences Pvt Ltd. Patent Number(s): WO2008012832-A2; WO2008012832-A8; IN200600490-I3, 2008.
JOUBERT, P.H.; BROWN, J.M.M.; HAY, I.T. Acute-poisoning with Jatropha curcas (purging nut tree) in children. South African Medical Journal, p.65, p.729-730, 1984.
JUWARKAR, A.A.; YADAV, S.K.; KUMAR, P. Effect of biosludge and biofertilizer amendment on growth of Jatropha curcas in heavy metal contaminated soils. Environmental Monitoring and Assessment, v.145, p.7-15, 2008.
KATHIRAVAN, M.; PONNUSWAMY, A.S.; VANITHA, C. Influence of soil types on elite seedling production in Jatropha (Jatropha curcas L.). Plant Archives, v.8, p.111-113, 2008.
KAUL, S.; SAXENA, R.C.; KUMAR, A. Corrosion behavior of biodiesel from seed oils of Indian origin on diesel engine parts. Fuel Processing Technology, v.88, p.303-307, 2007.
KAUSHIK, N.; KUMAR, K.; KUMAR, S. Potential of Jatropha curcas for biofuels. Journal of Biobased Materials and Bioenergy, v.1, p.301-314, 2007.
KAUSHIK, N. Effect of capsule maturity on germination and seedling vigour in Jatropha curcas. Seed Science and Technology, v.31, p.449-454, 2003.
KHAFAGY, S.M.; MOHAMED, Y.A.; ABDELSALAM, N.A. Phytochemical study of Jatropha curcas. Planta Medica, v.31, p.274-277, 1977.
KISANGAU, D.P.; HOSEA, K.M.; JOSEPH, C.C. In vitro antimicrobial assay of plants used in traditional medicine in Bukoba Rural district, Tanzania African Journal of Traditional Complementary and Alternative Medicines, v.4, p.510-523, 2007.
KPOVIESSI, D.S.S.; ACCROMBESSI, G.C.; KOSSOUOH, C. Physicochemical properties and composition of pignut (Jatropha curcas) non-conventional oil from different regions of Benin. Comptes Rendus Chimie, v.7, p.1007-1012, 2004.
KUMAR, M.S.; RAMESH, A.; NAGALINGAM, B. An experimental comparison of methods to use methanol and Jatropha oil in a compression ignition engine. Biomass & Bioenergy, v.25, p.309-318, 2003.
KUMAR, A.; SHARMA, S. An evaluation of multipurpose oil seed crop for industrial uses (Jatropha curcas L.): A review. Industrial Crops and Products, v.28, p.1-10, 2008.
KUMAR, G.P.; YADAV, S.K.; THAWALE, P.R. Growth of Jatropha curcas on heavy metal contaminated soil amended with industrial wastes and Azotobacter - A greenhouse study. Bioresource Technology, v.99, p.2078-2082, 2008.
KUMAR, N.; PAMIDIMARRI, S.D.V.N.; KAUR, M. Effects of NaCl on growth, ion accumulation, protein, proline contents and antioxidant enzymes activity in callus cultures of Jatropha curcas. Biologia, v.63, v.378-382, 2008.
KUMAR, V.; MAKKAR, H.P.S.; BECKER, K. Detoxification of Jatrophacurcas seed meal and its utilization as a protein source in fish diet. Comparative Biochemistry and Physiology A - Molecular & Integrative Physiology, v.151, S13-S14, 2008.
LAVIOLA, B.G.; DIAS, L.A.D. Nutrient concentration in Jatropha curcas L. Leaves and fruits and estimated extraction at harvest. Revista Brasileira de Ciência do Solo, v.32, p.1969-1975, 2008.
LIMA, J.M.S. Etnofarmacologia de plantas Odontalgicas no Assentamento Tarumã-Mirim. Dissertação de Mestrado. Universidade do Estado do Amazonas - Biotecnologia e Recursos Naturais da Amazônia, 110 pp., 2005.
LIN, J.; YAN, F.; TANG, L. Antitumor effects of curcin from seeds of Jatropha curcas. Acta Pharmacologica Sinica, v.24, p.241-246, 2003.
LIST, P.H.; HORHAMMERL L. Hager’s Handbuch der Pharmazeutischen Praxis, Springer, Berlin. 1979.
LI, C.; GAO, Y.; OU, L. Method for prolong storage time of Jatropha curcas oil using rosemarinic antioxidant. Yunnan University. Patent Number(s): CN1814720-A; CN100410356-C, 2006.
LIU, S.; DAI, Y.; ZHOU, Z. Molluscicide powder comprising Jatropha curcas seed and its extraction process and application. Hubei Hubei Keqi Biological Engineering Co., Ltd. Patent Number(s): CN1256082-A; CN1086272-C, 2000.
LIU, S.Y.; SPORER, F.; WINK, M. Anthraquinones in Rheum palmatum and Rumex dentatus (Polygonaceae), and forbol esters in Jatropha curcas (Euphorbiaceae) with molluscicidal activity against the schistosome vector snails Oncomelania, Biomphalaria and Bulinus. Tropical Medicine & International Health, v.2, p.179-188, 1997.
LUO, M.J.; YANG, X.Y.; LIU, W.X. Expression, purification and anti-tumor activity of curcin. Acta Biochimica Et Biophysica Sinica, v.38, p.663-668, 2006.
MAKKAR, H.P.S.; ADERIBIGBE, A.O.; BECKER, K. Comparative evaluation of non-toxic and toxic varieties of Jatropha curcas for chemical composition, digestibility, protein degradability and toxic factors. Food Chemistry, v.62, p.207-215, 1998.
MAKKAR, H.P.S.; BECKER, K.; SPORER, F. Studies on nutritive potential and toxic constituents of different provenances of Jatropha curcas. Journal of Agricultural and Food Chemistry, v.45, p.3152-3157, 1997.
MAKKAR, H.P.S.; FRANCIS, G.; BECKER, K. Protein concentrate from Jatropha curcas screw-pressed seed cake and toxic and antinutritional factors in protein concentrate. Journal of the Science of Food and Agriculture, v.88, p.42-1548, 2008.
MAMPANE, K.J.; JOUBERT, P.H.; HAY, I.T. Jatropha curcas: use as a traditional Tswana medicine and its role as a cause of acute poisoning. Phytotherapy Research, v.1, p.50-51, 1987.
MARTIN, G.; MAYEUX, A. Reflections on oil crops as sources of energy .2. curcas oil (Jatropha curcas L.) - a possible fuel. Oleagineux, v.39, p.283-287, 1984.
MARTINEZ-HERRERA, J.; SIDDHURAJU, P.; FRANCIS, G. Chemical composition, toxic/antimetabolic constituents, and effects of different treatments on their levels, in four provenances of Jatropha curcas L. from Mexico. Food Chemistry, v.96, p.80-89, 2006.
MARTINS, C.C.; MACHADO, C.G.; CAVASINI, R. Temperature and substrate for the germination test of physic nut seeds. Ciencia e Agrotecnologia, v.32, p.863-868, 2008.
MATSUSE, I.T.; LIM, Y.A.; HATTORI, M. A search for antiviral properties in Panamanian medicinal plants. The effects on HIV and its essential enzymes. Journal Of Ethnopharmacology, v.64, p.15-22, 1999.
MENDOZA, T.C.; CASTILLO, E.T.; AQUINO, A.L. Towards making Jatropha curcas (tubang bakod) a viable source of biodiesel oil in the Philippines. Philippine Journal of Crop Science, v.32, p.29-43, 2007.
MIN, E.; YAO, Z.L. The development of biodiesel industry in recent years - Peculiarity, predicament and countermeasures. Progress in Chemistry, v.19, p.1050-1059, 2007.
MODI, M.K.; REDDY, J.R.C.; RAO, B.V.S.K. Lipase-mediated conversion of vegetable oils into biodiesel using ethyl acetate as acyl acceptor. Bioresource Technology, v.98, p.1260-1264, 2007.
MODI, M.K.; REDDY, J.R.C.; RAO, B.V.S.K. Lipase-mediated transformation of vegetable oils into biodiesel using propan-2-ol as acyl acceptor. Biotechnology Letters, v.28, p.637-640, 2006.
MUANGMAN, S.; THIPPORNWONG, M.; TOHTONG, R. Anti-metastatic effects of curcusone B, a diterpene from Jatropha curcas. In Vivo: International Journal of Experimental and Clinical Pathophysiology, v.19, p.265-268, 2005.
MUANZA, D.N.; EULER, K.L.; WILLIAMS, L. Screening for antitumor and anti-hiv activities of 9 medicinal-plants from Zaire. International Journal of Pharmacognosy, v.33, p.98-106, 1995.
MUJUMDAR, A.M.; MISAR, A. Anti-inflammatory activity of Jatropha curcas roots in mice and rats, Journal of Ethnopharmacology, v.90, p.11-15, 2004.
MURALI, K. S.; PATIL, M.; MAURYA, G. Producing a trueto-type clone of Jatropha curcas mother plant useful for e.g. treating cancer, cleaning teeth, as an antidote for snake-bites involving culturing meristematic explant of Jatropha curcas in media with phytohormones. Patent Number(s): US2008194026-A1, 2008.
NAENGCHOMNONG, W.; TARNCHOMPOO, B.; THEBTARANONTH, Y. (+)-jatrophol, (+)-marmesin, propacin and jatrophin from the roots of Jatropha curcas (Euphorbiaceae). Journal of the Science Society of Thailand, v.20, p.73-83, 1994.
NAENGCHOMNONG, W.; THEBTARANONTH, Y.; WIRIYACHITRA, P.; OKAMOTO, K.T.; CLARDY, J. Tetrahedron Letters, v.27, p.2439, 5675, 1986.
NATH, L.K.; DUTTA, S.K. Extraction and purification of curcain, a protease from the latex of Jatropha curcas Linn. Journal of Pharmacy and Pharmacology, v.43, p.111-114, 1991.
NUNES, C.F. Caracterização de frutos, sementes e plântulas e cultivo de embriões de pinhão-manso (Jatropha curcas L.). Dissertação de Mestrado. Universidade Federal De Lavras - Agronomia (Fitotecnia), 78 pp., 2007.
NUNES, C.F.; PASQUAL, M.; DOS SANTOS, D.N. Different supplements for in vitro embryo culture of physic nut. Pesquisa Agropecuaria Brasileira, v.43, p.9-14, 2008.
NWOSU, M.O.; OKAFOR, J.I. Preliminary studies of the antifungal activities of some medicinal-plants against basidiobolus and some other pathogenic fungi. Mycoses, v.38, p.191-195, 1995.
OGUNWOLE, J.O.; CHAUDHARY, D.R.; GHOSH, A. Contribution of Jatropha curcas to soil quality improvement in a degraded Indian entisol. Acta Agriculturae Scandinavica Section B - Soil and Plant Science, v.58, p.295-251, 2008.
OLUWOLE, F.S.; BOLARINWA, A.F. Jatropha curcas extract causes anaemia in rat. PHYTOTHERAPY RESEARCH, v.11, p.538-539, 1997.
ONUH, M.O.; OHAZURIKE, N.C.; EMERIBE, E.O. Efficacy of Jatropha curcas leaf extract in the control of brown blotch disease of cowpea (Vigna unguiculata). Biological Agriculture & Horticulture, v.25, p.201-207, 2008.
OPENSHAW, K. A review of Jatropha curcas: an oil plant of unfulfilled promise. Biomass & Bioenergy, v.9, 1-15, 2000.
OSONIYI, O.; ONAJOBI, F. Coagulant and anticoagulant activities in Jatropha curcas latex. Journal of Ethnopharmacology, v.89, p.101-105, 2003.
PLETSCH, M.; CHARLWOOD, B.V. Accumulation of diterpenoids in cell and root-organ cultures of Jatropha species. Journal of Plant Physiology, v.150, p.37-45, 1997.
PRAMANIK, K. Properties and use of Jatropha curcas oil and diesel fuel blends in compression ignition engine. Renewable Energy, v.28, p.239-248, 2003.
PRASAD, C.M.V.; KRISHNA, M.V.S.M.; REDDY, C.P. Performance evaluation of non-edible vegetable oils as substitutefuelsinlowheatrejectiondieselengines.Proceedings of the Institution of Mechanical Engineers Part D - Journal of Automobile Engineering, v.214, p.181-187, 2000.
PRUEKSAKORN, K.; GHEEWALA, S.H. Full chain energy analysis of biodiesel from Jatropha curcas L. in Thailand. Environmental Science & Technology, v.42, p.3388-3393, 2008.
PUSHPANGADAN, P.; MEHROTRA, S.; RAWAT, A.K.S. Herbal composition useful for the treatment of e.g. cuts, burns and wounds comprises extracts of plants selected from Jatropha curcas, clerodendrum infortunatum, centella asiatica or utlaria solicifolia optionally with an additive. Council of Scientific & Industrial Research of India. Patent Number(s): US2004121027-A1; WO2004056383-A1; AU2002353388-A1, 2004.
QIU, S.; HUANG, Y.; WANG, G. Preparation of Jatropha curcas seed oil comprises shelling Jatropha curcas seed, crushing, sterilizing, activating and adding microorganism strain, adding dissolving agent, clarifying and separating solution. Guizhou University. Patent Number(s): CN101225416-A, 2008.
RAJAGOPAL, D. Implications of India’s biofuel policies for food, water and the poor. Water Policy, v.10, p.95-106, 2008.
RAKSHIT, K.D.; DARUKESHWARA, J.; RAJ, K.R. Toxicity studies of detoxified Jatropha meal (Jatropha curcas) in rats. Food and Chemical Toxicology, v.46, p.3621-3625, 2008.
RAJORE, S.; BATRA, A. Efficient plant regeneration via shoot tip explant in Jatropha curcas L. Journal of Plant Biochemistry and Biotechnology, v.14, p.73-75, 2005.
RAJU, A.J.S.; EZRADANAM, V. Pollination ecology and fruiting behaviour in a monoecious species, Jatropha curcas L. (Euphorbiaceae). Current Science, v.83, p.1395-1398, 2002.
RAO, G.L.N.; PRASAD, B.D.; SAMPATH, S. Combustion analysis of diesel engine fueled with Jatropha oil methyl ester - Diesel blends. International Journal of Green Energy, v.4, p.645-658, 2007.
RATHORE, V.; MADRAS, G. Synthesis of biodiesel from edible and non-edible oils in supercritical alcohols and enzymatic synthesis in supercritical carbon dioxide. Fuel, v.86, p.2650-2659, 2007.
RAVINDRANATH, N.; RAMESH, C.; DAS, B. A rare dinorditerpene from Jatropha curcas. Biochemical Systematics and Ecology, v.31, p.431-432, 2003.
RAVINDRANATH, N.; REDDY, M.R.; MAHENDER, G. Deoxypreussomerins from Jatropha curcas: are they also plant metabolites? Phytochemistry, v.65, p.2387-2390, 2004.
RAVINDRANATH, N.; REDDY, M.R.; RAMESH, C. New lathyrane and podocarpane diterpenoids from Jatropha curcas. Chemical & Pharmaceutical Bulletin, v.52, p.608-611, 2004.
RAZON, L.F. Selection of Philippine Plant Oils as Possible Feedstocks for Biodiesel. Philippine Agricultural Scientist, v.91, p.278-286, 2008.
ROJANAPO, W.; PIMBUA, J.; GLINSUKON, T. Failure of diterpenes from Jatropha curcas to induce mutation in Salmonella typhimurium ta98 and ta100. Research Communications in Chemical Pathology and Pharmacology, v.58, p.397-400, 1987.
RUG, M.; RUPPEL, A. Toxic activities of the plant Jatropha curcas against intermediate snail hosts and larvae of schistosomes. Tropical Medicine & International Health, v.5, p.423-430, 2000.
RUI, Y.; XING, Y.; CAI, D. Manufacture of bio-polyol involves adding epoxidizing agent to Jatropha curcas oil, mixing epoxy Jatropha curcas oil and open-loop agent of active hydrogen, and reacting hydroxyl fatty acid glyceride and alcohol or alcohol amine. Nanjing Hongbaoli Co., Ltd. Patent Number(s): CN101108803-A, 2008.
RUI, J.; WEI, H.; YE, D. Preparation of polyurethane plastic foam used in refrigerator and ice box, involves forming mixed hydroxide fatty glyceride by reacting Jatropha curcas oil epoxide with loop opening agent having reactive hydrogen atom. Nanjing Hongbaoli Co., Ltd. Patent Number(s): CN101125912-A, 2009.
SALIMON, J.; ABDULLAH, R. Physicochemical Properties of Malaysian Jatropha curcas Seed Oil. Sains Malaysiana, v.37, p.379-382, 2008.
SAMUELSSON, G.; FARAH, M.H.; CLAESON, P. Inventory of plant used in traditional medicine in somalia .2. plants of the families Combretaceae to Labiatae. Journal of Ethnopharmacology, v.37, p.47-70, 1992.
SANDBERG, F.; PERERA-IVARSSON, P.; EL-SEEDI, H.R. A Swedish collection of medicinal plants from Cameroon. Journal of Ethnopharmacology, v.102, p.336-343, 2005.
SARIN, R.; SHARMA, M.; SINHARAY, S. Jatropha Palm biodiesel blends: An optimum mix for Asia. Fuel, v.86, p.1365-1371, 2007.
SASTRI, B.N. The Wealth of India, Ran’ Materials. Council of Scientific and Industrial Research, New Delhi, p.293-295, 1959.
SCHMOOK, B.; SERRALTA-PERAZA, L. J. curcas: distribution and uses in the Yucatan Peninsula of Mexico. In: Biofuels and Industrial Products from Jatropha Curcas. Giibitz, G.M., Mittelbach, M., Trabi, M. (Eds.), DBV Graz., p.53-57, 1997.
SHAH, S.; SHARMA, S.; GUPTA, M.N. Biodiesel preparation by lipase-catalyzed transesterification of Jatropha oil. ENERGY & FUELS, v.18, p.154-159, 2004.
SHAH, S.; SHARMA, S.; GUPTA, M.N. Enzymatic transesterification for biodiesel production. Indian Journal of Biochemistry & Biophysics, v.40, p.392-399, 2003.
SHAH, S.; SHARMA, A.; GUPTA, M.N. Extraction of oil from Jatropha curcas L. seed kernels by combination of ultrasonication and aqueous enzymatic oil extraction. Bioresource Technology, v.96, p.121-123, 2005.
SHAH, S.; SHARMA, A.; GUPTA, M.N. Extraction of oil from Jatropha curcas L. seed kernels by enzyme assisted three phase partitioning. INDUSTRIAL CROPS AND PRODUCTS, v.20, p.275-279, 2004.
SHETTY, S.; UDUPA, S.L.; UDUPA, A L. Wound healing activities of Bark Extract of Jatropha curcas Linn in albino rats. Saudi Medical Journal, v.27, p.1473-1476, 2006.
SHEN, S.; TANG, M.; LIU, J. Barbados nut cold-induced transcription factor, its encoding gene and uses in cultivating plants with increased resistance. Institute of Botany, the Chinese Academy of Science. Patent Number(s): CN1800212-A; CN100357319-C, 2006.
SHISEIDO CO., Ltd. Hair growth stimulants for prevention of alopecia comprises e.g. hot water extract of Jatropha curcas L. and Euphorbiaceae plants. Patent Number(s): JP8231350-A, 1996.
SIREGAR, F.; AKBAR, S. Jatropha curcas latex inhibit collagenase release by fibroblast. Journal of Dental Research, v.80, p.1377-1377, 2001.
SRICHAROENCHAIKUL, V.; PECHYEN, C.; AHT-ONG, D. Preparation and characterization of activated carbon from the pyrolysis of physic nut (Jatropha curcas L.) waste. Energy & Fuels, v.22, p.31-37, 2008.
SRIVASTAVA, S.K.; TEWARI, J.P.; SHUKLA, D.S. A folk dye from leaves and stem of Jatropha curcas L. used by Tharu tribes of Devipatan division. Indian Journal of Traditional Knowledge, v.7, p.77-78, 2008.
STAUBMANN, R.; FOIDL, G.; FOIDL, N. Biogas production from Jatropha curcas press-cake. Applied Biochemistry and Biotechnology, v.63/65, p.457-467, 1997.
STAUBMANN, R.; SCHUBERT-ZSILAVECZ, M.; HIERMANN, A. A complex of 5-hydroxypyrrolidin-2-one and pyrimidine-2,4-dione isolated from Jatropha curcas. Phytochemistry, v.50, p.337-338, 1999.
SU, E.; WEI, D.Z. Improvement in lipase-catalyzed methanolysis of triacylglycerols for biodiesel production using a solvent engineering method. Journal of Molecular Catalysis B-Enzymatic, v.55, p.3-4, 2008.
SUBRAMANIAN, S.S.; NAGARAJAN, S.; SULOCHANA, N. Flavonoids of some Euphorbiaceous plants. Phytochemistry, v.10, p.2548-2549, 1971.
SUBRAMANIAN, K.A.; SINGAL, S.K.; SAXENA, M. Utilization of liquid biofuels in automotive diesel engines: An Indian perspective. Biomass & Bioenergy, v.29, p.65-72, 2005.
SUCHER & HOLZER BAUPLANUNGSUND HANDELSGESELLSCHAFT. New complex of 5-hydroxy-pyrrolidin-2-one and pyrimidine-2,4-dione, isolated from Jatropha curcas leaves, used as antiinflammatory agent. Patent Number(s): AT9702133-A; AT406674-B, 1999.
SUJATHA, M.; MAKKAR, H. P. S.; BECKER, K. Shoot bud proliferation from axillary nodes and leaf sections of non-toxic Jatropha curcas L. Plant Growth Regulation, v.47, p.83-90, 2005.
SUJATHA, M.; MUKTA, N. Morphogenesis and plant regeneration from tissues culture of Jatropha curcas. Plant Cell Tissue and Organ Culture, v.44, p.135-141, 1996.
SUN, Q. B.; LI, L.F.; LI, Y. SSR and AFLP markers reveal low genetic diversity in the biofuel plant Jatropha curcas in China. Crop Science, v.48, p.1865-1871, 2008.
TAKEDA, Y. Development study on Jatropha curcas (sabu dum) oil as a substitute for dieselengine oil in Thailand. Journal of the Agricultural Association of China, v.120, p.1-8, 1982.
TALAPATRA, S.K.; MANDAL, K.; TALAPATRA, B. Terpenoids and related-compounds. 31. jatrocurin, a new tetracyclic triterpene from Jatropha curcas. Journal of the Indian Chemical Society, v.70, p.543-548, 1993.
TAMA SEIKAGAKU, K.K. ; REAL KAGAKU, K.K. Seed oil extracted from seed of Jatropha curcas L., Euphorbiaceae having high moisture retaining effects, used in cosmetic material. Patent Number(s): JP6239719-A, 1994.
TAMALAMPUDI, S.; TALUKDER, M.R.; HAMA, S. Enzymatic production of biodiesel from Jatropha oil: A comparative study of immobilized-whole cell and commercial lipases as a biocatalyst. Biochemical Engineering Journal, v.39, p.185-189, 2008.
TANG, Z.Y.; WANG, L.Y.; YANG, J.C. Transesterification of the crude Jatropha curcas L. oil catalyzed by micro-Na-OH in supercritical and subcritical methanol. European Journal of Lipid Science and Technology, v.109, p.585-590, 2007.
TAPANES, N.C.O.; ARANDA, D.A.G.; CARNEIRO, J.W.D. Transesterification of Jatropha curcas oil glycerides: Theoretical and experimental studies of biodiesel reaction. Fuel, v.87, p.2286-2295, 2008.
THEPSAMRAN, N.; THEPSITHAR, C.; THONGPUKDEE, A. In vitro induction of shoots and roots from Jatropha curcas L. explants. Journal of Horticultural Science & Biotechnology, v.83, p.106-112, 2008.
THOMAS, R.; SAH, N.K.; SHARMA, .P.B. Therapeutic biology of Jatropha curcas: A mini review. Current Pharmaceutical Biotechnology, v.9, p.315-324, 2008.
TIWARI, A.K.; KUMAR, A.; RAHEMAN, H. Biodiesel production from Jatropha (Jatropha curcas) with high free fatty acids: An optimized process. BIOMASS & BIOENERGY, v.31, p.569-575, 2007.
TIWARI, S.K.; SHUKLA, P.K.; PANDEY, A. Callus establishment in shoot proliferation in Jatropha curcas: A biodiesel plant through nodal explant culture. In Vitro Cellular & Developmental Biology-Animal, v.42, p.37A, 2006.
VALENTE, O.S. Desempenho e emissões de um motorgerador de energia elétrica operando com biodiesel. Dissertação de Mestrado. Pontifícia Universidade Católica de Minas Gerais - Engenharia Mecânica, 145 pp., 2007.
VAN EIJCK, J.; ROMIJN, H. Prospects for Jatropha biofuels in Tanzania: An analysis with Strategic Niche Management. Energy Policy, v.36, p.311-325, 2008.
VANDENBERG, A.J.J.; HORSTEN, S.F.A.J.; KETTENESVANDENBOSCH, J.J. Curcacycline-A - a novel cyclic octapeptide isolated from the latex of Jatropha curcas L. FEBS Letters, v.358, p.215-218, 1995.
VASSILIADES, G. Note on the molluscicidal properties of 2 euphorbiaceous plants - Euphorbia tirucalli and Jatropha curcas. REVUE D ELEVAGE ET DE MEDECINE VETERINAIRE DES PAYS TROPICAUX, v.37, p.32-34, 1984.
VILLEGAS, L.F.; FERNANDEZ, I.D.; MALDONADO, H. Evaluation of the wound-healing activity of selected traditional medicinal plants from Peru. Journal of Ethnopharmacology, v.55, p.193-200, 1997.
ZHANG, F.L.; NIU, B.; WANG, Y.C. A novel betaine aldehyde dehydrogenase gene from Jatropha curcas, encoding an enzyme implicated in adaptation to environmental stress. Plant Science, v.174, p.510-518, 2008.
ZHANG, Y.; WANG, Y.X.; JIANG, L.D. Aquaporin JcPIP2 is involved in drought responses in Jatropha curcas. Acta Biochimica et Biophysica Sinica, v.39, p.787-794, 2007.
ZHANG, D.; TAN, X.; PENG, W. Jatropha curcas nutshell liquid biological energy preparing method, involves separating and vaporizing thermal cracked oil at preset centigrade in vacuum with preset pressure, and cooling evaporated matters to obtain biological energy. Central South Forestry University. Patent Number(s): CN101235307-A, 2008.
ZHANG, D.; TAN, X.; PENG W. Jatropha curcas oil cake liquid biological energy preparing method, involves separating and vaporizing thermal cracked oil at preset centigrade in vacuum with preset pressure, and cooling evaporated matters to obtain biological energy. Central South Forestry University. Patent Number(s): CN101235306-A, 2008.
ZHAO, Q.; YUAN, L.; GOU, P. Jatropha curcas mycorrhizal fungi compound fertilizer contains one or more arbuscular mycorrhizal fungi containing glomus and gigaspora. Yunnan Shenyu New Energy Co Ltd. Patent Number(s): CN101186542-A, 2008.
ZHOU, H.; LU, H.F.; LIANG, B. Solubility of multicomponent systems in the biodiesel production by transesterification of Jatropha curcas L. oil with methanol. Journal of Chemical and Engineering Data, v.51, p.1130-1135, 2006.
ZHU, H.P.; WU, Z.B.; CHEN, Y.X. Preparation of biodiesel catalyzed by solid super base of calcium oxide and its refining process. Chinese Journal of Catalysis, v.27, p.391-396, 2006.
WAHLEN, B.D.; BARNEY, B.A.; SEEFELDT, L.C. Synthesis of Biodiesel from Mixed Feedstocks and Longer Chain Alcohols Using an Acid-Catalyzed Method. Energy & Fuels, v.22, p.4223-4228, 2008.
WANG, X.C.; MA, S.P.; LIU, J.H. Guaiane Sesquiterpenoids from Jatropha curcas. Natural Product Communications, v.3, p.1649-1652, 2008.
WANG, L.; ZHU, J. Production of vegetable protein. Patent Number(s): CN1711883-A, 2005.
WANG, C. Environmentally friendly bio-diesel oil comprises vegetable oil, methanol, ethanol, coal oil, zero diesel, and additive. Patent Number(s): CN101082003-A, 2008.
WEI, Q.; LIAO, Y.; CHEN, Y. Isolation, characterisation and antifungal activity of beta-1,3-glucanase from seeds of Jatropha curcas. South African Journal of Botany, v.71, p.95-99, 2005.
WINAYANUWATTIKUN, P.; KAEWPIBOON, C.; PIRIYAKANANON, K. Potential plant oil feedstock for lipasecatalyzed biodiesel production in Thailand. Biomass & Bioenergy, v.32, p.1279-1286, 2008.
WINKLER, E.; FOIDL, N.; GUBITZ, G.M. Enzyme-supported oil extraction from Jatropha curcas seeds. Applied Biochemistry and Biotechnology, v.63/65, p.449-456, 1997.
YAN, R.; GAO, S.; YANG, W. Nickel toxicity induced antioxidant enzyme and phenylalanine ammonia-lyase activities in Jatropha curcas L. cotyledons. Plant Soil And Environment, v.54, p.294-300, 2008.
YIN, H.; YANG, S.; SONG, B. Preparation of curcas biological diesel oil by solid phase catalytic method. Guizhou University. Patent Number(s): CN1824735-A; CN100390251-C, 2007.
YUAN, L.; YANG, S.; QU, W. Jatropha curcas seed storage method, involves processing pretreatment for seeds before storing to ensure more than ninety percent purity, and testing water content of seeds before packaging. Yunan Academy of Agricultural Sciences. Patent Number(s): CN101292596-A, 2008.
YUAN, L.; YANG, S.; QU, W. Jatropha curcas fruit collecting method, involves separately packing ripe and dried fruits while collecting Jatropha curcas fruit, where fruit in high place is cut by high pruning knife or fetched down by long bamboo stick. Yunan Academy of Agricultural Sciences. Patent Number(s): CN101292595-A, 2008.
YUAN, L.; YANG, S.; ZHANG, D. Inter-planting Euphorbia lathyris and Jatropha curcas involves opening interplanting land to strip-like flatland, digging Jatropha curcas planting pond and two Euphorbia lathyris, removing grass, and adding fertilizer after fix planting. Yunan Academy of Agricultural Sciences. Patent Number(s): CN101283657-A, 2008.
YUAN, X.; YUAN, P. Fish feed preparation, comprises fish powder, Jatropha curcas, wheat flour, vegetable oil, inorganic salt, vitamin group, choline, gelatin and water. Chinese Academy of Science - Wuhan Botanical Garden. Patent Number(s): CN101133780-A, 2008.
YUKO CHEMICAL CO., LTD. Oil from Jatropha curcas seeds useful as fuel in diesel and gasoline engines. Patent Number(s): AU8315448-A, 1984.
YUKO KAGAKU KOGYO K. Internal combustion engine fuel comprising pressed oil obtained from Jatropha curcas seeds. Patent Number(s): JP60081291-A; JP86060119-B, 1985.