Artigo de Pesquisa
Nanoemulsões formuladas para uso tópico: estudo de síntese e toxicidade
Nanoemulsions formulated for topical use: a study of synthesis and toxicity
Resumo
A Nanotecnologia tem se destacado significativamente em diversas áreas da ciência, em especial, na área farmacêutica. Os nanocarreadores de fármacos apresentam uma alternativa segura e eficaz, apresentando propriedades importantes do ponto de vista farmacoterápico. Sob esse aspecto, destacam-se as nanoemulsões como veículo de fármacos já consagrados. Trata-se de sistemas constituídos por glóbulos bastante reduzidos, em escala manométrica, que podem veicular princípio ativo sendo ainda adequados à distribuição de substâncias ativas na pele, permitindo maior absorção. Dentro deste contexto, o presente estudo de revisão descreve metodologias de síntese de nanoemulsões utilizando para composição da fórmula, extratos e óleos vegetais, medicamentos alopáticos convencionais e nanopartículas metálicas.
- Palavras-chave:
- Alopático.
- Nanobiotecnologia.
- Nanopartícula.
- Óleo vegetal.
Abstract
Nanotechnology has stood out significantly in several areas of science, especially in the pharmaceutical field. Drug nanocarriers are considered a safe and effective alternative because they possess essential properties from the pharmacotherapeutic perspective. In this regard, nanoemulsions stand out as a vehicle for already established drugs. These are systems made up of tiny globules on a nanometric scale, which can transport the active ingredient and are still suitable for the distribution on the skin, allowing more excellent absorption. In this sense, the present review describes methodologies for the synthesis of nanoemulsions using vegetable extracts and oils, conventional allopathic medicines, and metallic nanoparticles for the composition of the formula.
- Keywords:
- Allopathic.
- Nanobiotechnology.
- Nanoparticle.
- Vegetable oil.
Introdução
A nanotecnologia é uma área multidisciplinar que utiliza valores de nanoestruturas com dimensão entre 1 a 100 nanômetros (nm), focalizando em materiais de tamanho atômico, molecular e supramolecular, apontando o controle e manipulação desses novos materiais em escala celular ou menor, que não seria possível através da tecnologia convencional[1,2]. Os nanoprodutos ou nanomateriais desenvolvidos apresentam vantagens quanto à possibilidade de obtenção da estabilidade cinética, características organolépticas favoráveis, maior poder de penetração e/ou absorção, maior biodisponibilidade, incremento da solubilidade em água para substâncias pouco solúveis e a liberação controlada de fármacos[3,4].
Com a busca de sistemas terapêuticos mais eficazes, que garantam a baixa toxicidade, reduzam os efeitos adversos e diminuam as doses, a nanotecnologia é uma alternativa para a inovação dos medicamentos, principalmente, quando se refere a liberação controlada do fármaco. Entre as vantagens que os nanossistemas podem oferecer destaca-se a proteção do fármaco no sistema terapêutico contra possíveis instabilidades no organismo, mantendo seus níveis plasmáticos em concentrações constantes[5].
A síntese de nanofármacos envolve técnicas de fabricação e aplicação das nanoestruturas que possuem formas e tamanhos controlados[6]. As nanoemulsões (NEs), por exemplo, são muito utilizadas como veículos nas indústrias cosmética, farmacêutica e de alimentos. Estas apresentam vantagens como a veiculação de ativos tanto hidrofílicos como lipofílicos na mesma formulação, além de possibilitarem o controle de aspectos sensoriais adaptados às necessidades da via de administração para as quais se destinam[7].
As NEs são sistemas dispersos entre dois líquidos imiscíveis, cujas gotículas encontram-se com tamanho médio inferior a 200 nm[8,4], sendo necessário para a estabilização da fase aquosa (água) e fase oleosa (óleo essencial), o uso de tensoativo (ou surfactantes), para a obtenção de amostras homogêneas e estáveis. Esses sistemas em escala nanométrica podem ser considerados uma derivação das Emulsões, Microemulsões ou Macroemulsões, tradicionalmente desenvolvidas pela área farmacêutica (FIGURA 1). Quando se trata de NEs, os tamanhos das gotículas incorporadas ao sistema possuem dimensão em torno de 20 a 50 nm[9,10]. As NEs são obtidas, aplicando-se altas intensidades de agitação para dispersar uma fase líquida ou aquosa, fundida em um dispersante quente a uma fase oleosa constituída, geralmente, por óleo essencial, adicionando tensoativo, e com resfriamento subsequente para obter o núcleo sólido[11].

Os sistemas de NEs podem ter como componentes incorporados às formulações, além de tensoativos e a fase aquosa (geralmente água destilada, pura ou Milli-Q), os óleos essenciais (OEs), extratos alcoólicos de vegetais, óleos vegetais (copaíba, andiroba, por exemplo), nanopartículas metálicas, fármacos convencionais, entre outros. Os OEs são definidos pela Agência Nacional de Vigilância Sanitária (ANVISA) por meio da Resolução da Diretoria Colegiada (RDC) n° 2 de 2007[13], como produtos voláteis de origem vegetal obtido por processo físico (destilação por arraste com vapor de água, destilação à pressão reduzida ou outro método adequado), sendo flores, folhas, cascas, rizomas e frutos são matérias-primas para a produção de óleos essenciais[7].
Sendo assim, o objetivo desta revisão é abordar os métodos de obtenção de nanoemulsões, evidenciando os reagentes utilizados nas formulações, além de abordar os aspectos toxicológicos dos materiais nanoestruturados para fins terapêuticos.
Material e Métodos
Existem na literatura, diversos estudos sobre a síntese de NEs e as mais variadas técnicas utilizadas para sua obtenção, principalmente associadas a óleos vegetais com atividades terapêuticas. O presente estudo é caracterizado como uma revisão de literatura descritiva e comparativa, analisando produções científicas indexadas nas seguintes bases eletrônicas de dados: LILACS, MEDLINE e SCIELO, que enfocam a síntese e caracterização de NEs associadas ou não a medicamentos alopáticos convencionais.
A revisão ressalta a preferência de metodologia utilizada pelos pesquisadores para desenvolverem a referida forma nanofarmacêutica e quais as principais técnicas de caracterização do nanoproduto. O recorte temporal abrangeu um período compreendido entre os anos de 2000 a 2019. Outras fontes que abordam o tema, como artigos e resumos, serviram de suporte para a compreensão de conceitos na área nanofarmacêutica.
Após o levantamento dos estudos disponíveis em meio eletrônico, foram analisados outros critérios importantes à serem destacados como: os principais tipos de tensoativos utilizados, qual a técnica de síntese mais adequada para diferentes vias de administração do nanofármaco (oral, endovenosa ou tópica) e tipo de fármaco empregado na fórmula (óleo vegetal, extrato de plantas ou fármaco convencional).
Resultados e Discussões
As emulsões podem ser classificadas em óleo em água (O/A), água em óleo (A/O) e sistemas múltiplos (A/O/A ou O/A/O) (FIGURA 2). Quando as gotículas da fase aquosa estão dispersas em fase contínua oleosa, denomina-se A/O, porém, quando as gotículas da fase oleosa estão dispersas na fase aquosa, denomina-se O/A[14]. As emulsões múltiplas são sistemas onde os dois tipos de emulsões existem simultaneamente, podendo assim ser do tipo A/O/A ou O/A/O, no qual a fase dispersa contém pequenas gotas de outra fase dispersa em seu interior, e esta segunda fase dispersa está fisicamente separada por uma fase dispersa de composição distinta[15].
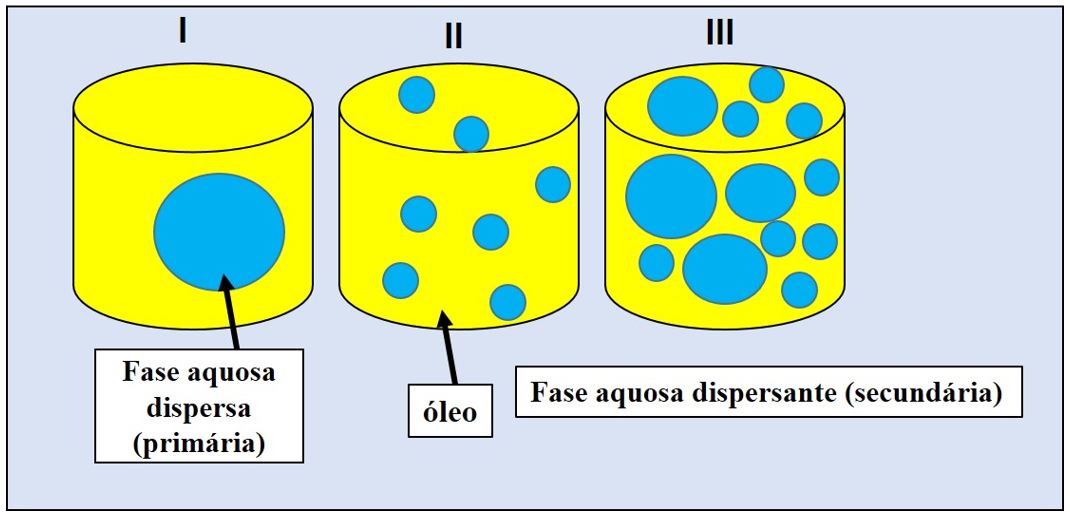
As emulsões, em especial as NEs, por serem constituídas de fase aquosa e fase oleosa, não se misturam espontaneamente, necessitando de um agente emulsionante, o tensoativo ou surfactante. Estão disponíveis diversos tipos de tensoativos como: Tween 20, Tween 60, Tween 80, Span 20, Span 60, Span 80, Triton-X, Éter laurílico etoxilado, Policaprolactona, Propilenoglicol, entre outros. Para a obtenção das NEs, são normalmente utilizadas o fármaco de interesse associado a formulação na forma de extrato vegetal, óleo essencial como: Melaleuca alternifólia, Cymbopogon martinii[17]; óleo de semente de algodão[18], Syagrus romanzoffiana[19], Prunus amygdalus, Bertholletia excelsa[20], óleo de girasol[21], óleo essencial de laranja[22], Lippia sidoides[23], Euterpe oleracea e Cetoconazol[10], óleo de Copaifera sp.[11], óleo de azeite refinado[24], Philodendron fragrantissimum[25], Gingko biloba e própolis verde[26], Lippia gracilis[27], Aleurites moluccanus L.[28], Rosmarinus officinalis [7], Pinus taeda L.[29], óleo de laranja [30].
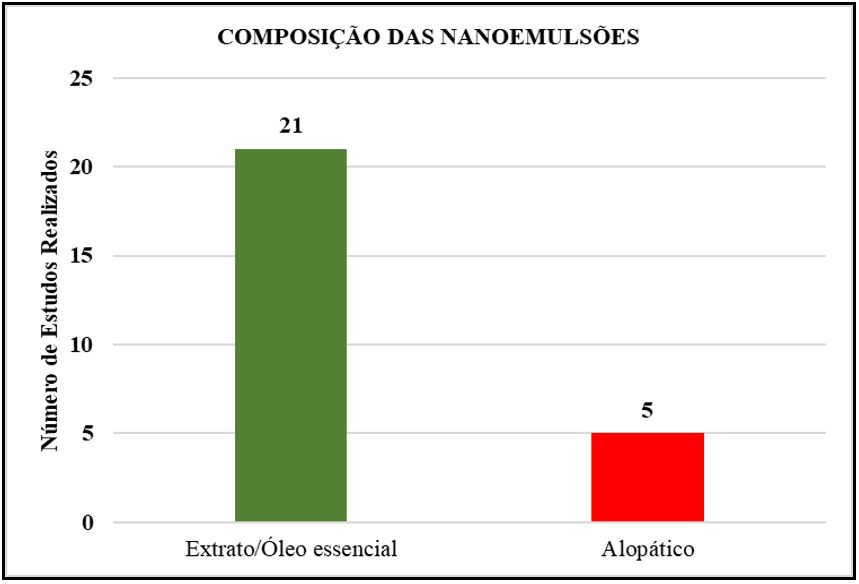
Outros estudos associam a Fase Aquosa e Fase Oleosa a fármacos alopáticos convencionais como nucleosídeos, antifúngicos e até mesmo, analgésicos e anti-inflamatórios. As NEs obtidas através da associação de óleo de gérmen e aciclovir apresentaram características físicas aceitáveis[31]. A combinação dos fármacos miltefosina e fluconazol foi alcançada, pois através da adição do manitol, houve diminuição da afinidade do fluconazol impedindo sua migração para fase aquosa, obtendo formulações estáveis quando avaliadas as características organolépticas e físico-químicas[2]. O desenvolvimento de NEs associando Anfotericina B e Itraconazol à base de óleo de oliva e de peixe, demonstraram atividade antifúngica contra os agentes da cromoblastomicose in vivo, sendo menos nefrotóxica que a formulação convencional[31], enquanto NEs associadas apenas a Anfotericina B foram eficazes em ensaios para avaliar a eficácia sobre formas amastigotas Leishmanicidas[32]. Para Marques et al.[33], foi possível o desenvolvimento de formulações de um sistema viável de NEs associada a Ibuprofeno preparadas pelo método da inversão de fases.
As emulsões múltiplas podem ser obtidas pelo método da etapa única baseando-se no conceito de que essas emulsões consistem em mesofase (sistema intermediário) entre simples sistemas A/O e O/A e podem ser formadas durante o processo de inversão de fases, sobretudo quando o tensoativo não-iônico é empregado na formulação[34,15].
Com relação aos métodos de obtenção de NEs, que consistem basicamente na emulsificação das duas fases (aquosa e oleosa) estabilizada por um tensoativo com a aplicação de alta ou baixa de energia para realizar o processo. Dos mecanismos mais utilizados, destacam-se os de baixa pressão (FIGURA 3).
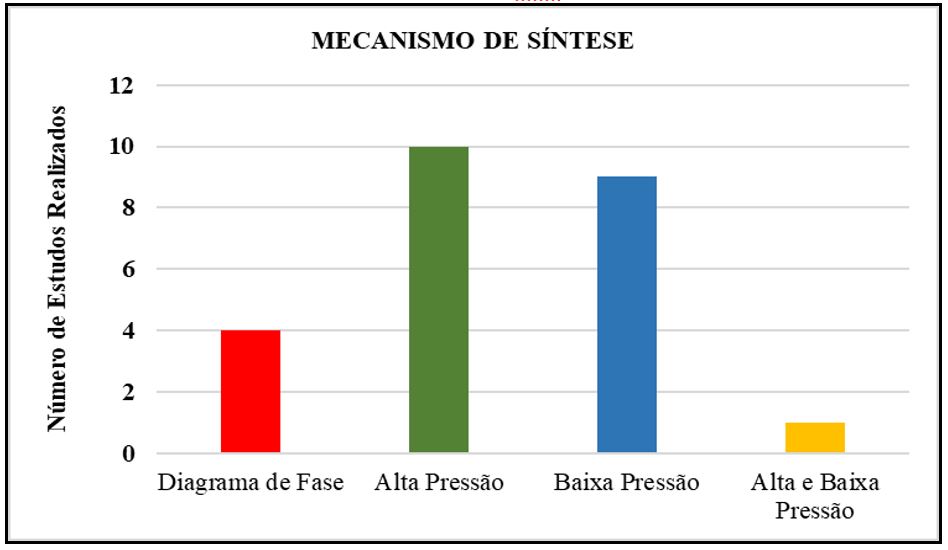
Os métodos de emulsificação por baixa energia fazem uso de propriedades físico-químicas do sistema e utilizam a inversão espontânea na curvatura do tensoativo para a obtenção de gotículas de tamanho reduzido, são eles: Inversão de Fases pela temperatura e Inversão de Fases pela alteração da fração volumétrica[28].
Uma grande vantagem do método de alta energia é, portanto, o fato de que muito menos surfactantes (ou tensoativos) é necessário para formar uma NE. Sendo assim, esse método possibilita benefícios econômicos e práticos, entre eles, menor custo com ingredientes; sabores desagradáveis reduzidos (associados a surfactantes); e menos problemas com a formação de espumas[35].
Muitos têm sido os estudos de liberação controlada de fármacos em escala nanométrica, sendo destacada a síntese de microemulsões e nanoemulsões, com grande número de estudos evidenciando uma nova alternativa farmacêutica. Como os sistemas de emulsões são divididos em duas fases, aquosa e oleosa, estas últimas são escolhidas, normalmente, extratos de plantas ou óleos essenciais para testes do fármaco de interesse e associações com fármacos alopáticos convencionais (FIGURA 4), a exemplos de estudos realizados utilizando Fluconazol, Aciclovir realizados[2,31], que obtiveram NEs combinadas a estes fármacos com características físicas aceitáveis.
As fases oleosa e aquosa também são denominadas fases lipofílica e hidrofílica, respectivamente. A fase oleosa influencia as microemulsões em dois aspectos: forma e tamanho das partículas e permeabilidade através da pele[24]. Em se tratando das nanoemulsões, normalmente é selecionada com base na solubilidade do fármaco a ser veiculado, na sua estabilidade, bem como na estabilidade da formulação desenvolvida[36].
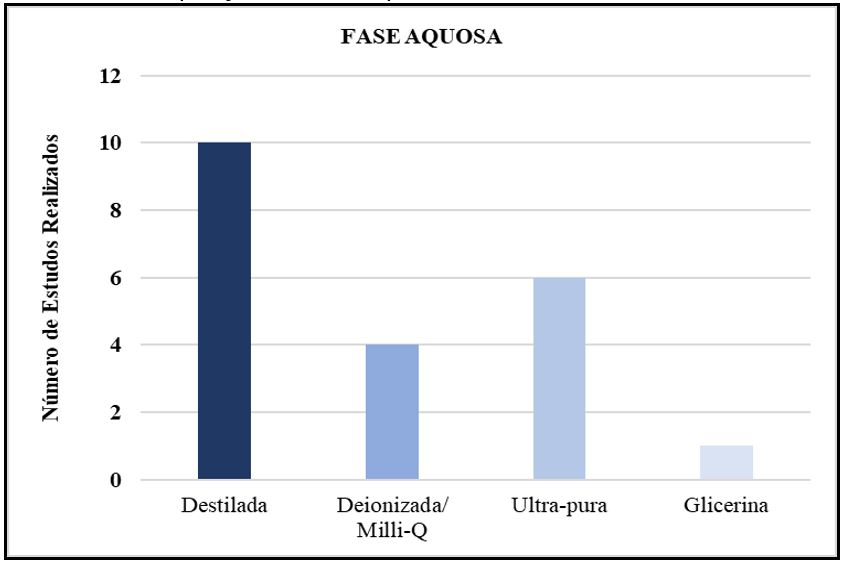
Na fase aquosa, rotineiramente são utilizadas águas Milli-Q, destilada, pura / ultra-pura e glicerina (FIGURA 5). A quantidade de água a utilizar é muito importante, pois influencia a estrutura interna das MEs[37].
Composição e Técnicas de obtenção de NES
As NEs são citadas na literatura com diferentes nomenclaturas, sendo também conhecidas como miniemulsões, microemulsões instáveis, submicroemulsões, entre outros[38]. Trata-se de uma derivação das emulsões, que consistem em misturas heterogêneas com pelo menos um líquido imiscível disperso em outro, na forma de gotículas com diâmetros geralmente maiores que 100 nm[39]. No entanto, para NEs, essa definição está relacionada em função do tamanho e com o aspecto transparente ou translúcido quando apresentam tamanhos inferiores a 200 nm e um aspecto leitoso quando têm tamanhos variando entre 200 e 500 nm[38]. Para Bedin[40], as NEs podem ser classicamente definidas como uma dispersão nanométrica de gotículas oleosas em uma fase aquosa externa, estabilizada por um sistema tensoativo adequado, cujo tamanho das partículas (gotículas) pode variar de 100 a 500 nm.
Para que ocorra a formação de um sistema nanoemulsionado, é necessário que duas condições sejam mantidas: a agitação constante, para que ocorra a dispersão de um líquido no outro; e a presença de pelo menos um agente emulsificante, para estabilizar o sistema[41,42,11]. Dessa forma, é possível assegurar uma interação entre o óleo e a água, reduzindo a tensão interfacial do sistema, impedindo assim que a coalescência das gotas ocorra[43,44]. Para que ocorra a obtenção de NEs é necessário fornecer energia, visto que elas não se formam espontaneamente, e esta energia pode ser fornecida por um dispositivo mecânico como homogeneizadores de alta-pressão ou ultrassom, que são capazes de realizar uma taxa de cisalhamento e, consequentemente, a formação de gotículas[38]. Os homogeneizadores de alta-pressão consistem basicamente de uma bomba de deslocamento positivo a qual injeta o líquido a ser homogeneizado sob pressão elevada em uma válvula homogeneizadora[14,45]. Já no ultrassom, o fluído é conduzido através de um orifício de diâmetro reduzido com pressão moderada e orientado em direção a uma lâmina vibratória onde sofre impacto, ocorrendo a formação das gotículas de tamanho reduzido devido a vibração da lâmina que produz ondas ultrassônicas capazes de exercer o efeito de corte[14].
A adição de agentes tensoativos tem a capacidade de diminuir a tensão interfacial do sistema e de formar um filme interfacial com propriedades esféricas e eletrostáticas em torno dos glóbulos da fase interna[15]. Os tensoativos são substâncias que, quando presentes em um sistema, têm a capacidade de adsorver na superfície (interface em que uma fase é gasosa) ou na interface (fronteira entre duas fases imiscíveis) e alterar sua energia livre[46,27]. A estabilidade coloidal inerente das NEs deve-se ao processo de obtenção das mesmas, que lhe atribui estabilização estérica quando se faz uso de tensoativos não iônicos e/ou polímeros[10]. Em alguns casos, a utilização de um co-tensoativo é necessária para aumentar a estabilidade do sistema. Com essa adição de co-tensoativo, pode ocorrer um aumento na estabilidade e na região de ocorrência de microemulsão[47,27].
Os tensoativos possuem uma natureza anfifílica, ou seja, possuem uma região hidrofóbica, que possui afinidade por solventes apolares e uma região hidrofílica, que tem afinidade por solventes polares, sendo que a região hidrofóbica pode ser formada por cadeias hidrocarbônicas saturadas ou insaturadas, ou, em poucos casos, anéis aromáticos. A outra região, que é a hidrofílica, pode ser aniônica, catiônica, anfótera e não-iônica[48,27]. Portanto, os tensoativos são classificados em iônicos, não-iônicos e anfóteros. Nesse sentido, os sistemas nanoemulsionados são compostos de fase aquosa, fase oleosa, tensoativo (ou surfactante) e, quando necessário, o co-tensoativo[24]. O co-tensoativo tem a finalidade de reduzir as tensões interfaciais em níveis mais baixos, interagir de várias formas na camada interfacial e melhorar a fluidez do filme, muito utilizado para tensoativos não-iônicos[49,50]. Esta molécula geralmente é um álcool, apresentando um grupamento polar a apolar[50]. Além disso, associações com nanopartículas metálicas também são comuns[11].
É necessária a escolha do tensoativo adequado ao tipo de forma farmacêutica que se pretende utilizar. Estes componentes estão disponíveis em grande número, mas o seu uso na formação de Microemulsões para aplicação tópica é limitado devido à sua toxicidade, irritação potencial e mecanismo de ação[24]. A utilização de tensoativos não-iônicos é mais frequente para a síntese de NEs. Entretanto, nanoemulsões catiônicas O/A têm sido propostas como potenciais sistemas de liberação para macromoléculas como Oligonucleotídeos antisenso (ON) ou Ácido desoxirribonucleico DNA[51].
Para a uniformização do sistema nanoemulsionado, são utilizadas metodologias de alta e baixa energia[14]. Os métodos de alta energia de emulsificação (homogeneizadores de alta pressão ou ultrassom), e métodos de baixa energia, no qual está incluído a Inversão de Fases e o método da temperatura de Inversão de Fases[42]. Esse processo depende de vários tipos de equipamentos que permitem produzir emulsões em escala laboratorial ou industrial, sendo eles, os agitadores mecânicos, homogeneizadores, ultra-sonicadores e moinhos coloidais[39].
A intensidade de sonicação é um parâmetro com grande influência no processo, uma vez que o seu aumento diminui o tamanho das partículas. Com o aumento do tempo de sonicação, a temperatura também aumenta, o que pode ser prejudicial no caso de materiais termolábeis ou no caso de reagentes que possam evaporar, como é o caso do etanol[24]. Durante o período de agitação inicial usada para emulsificação formam-se gotículas, e à medida que a agitação continua, a probabilidade de colisão das gotículas aumenta, também ocorre coalescência, o que pode diminuir a viscosidade de uma emulsão[39].
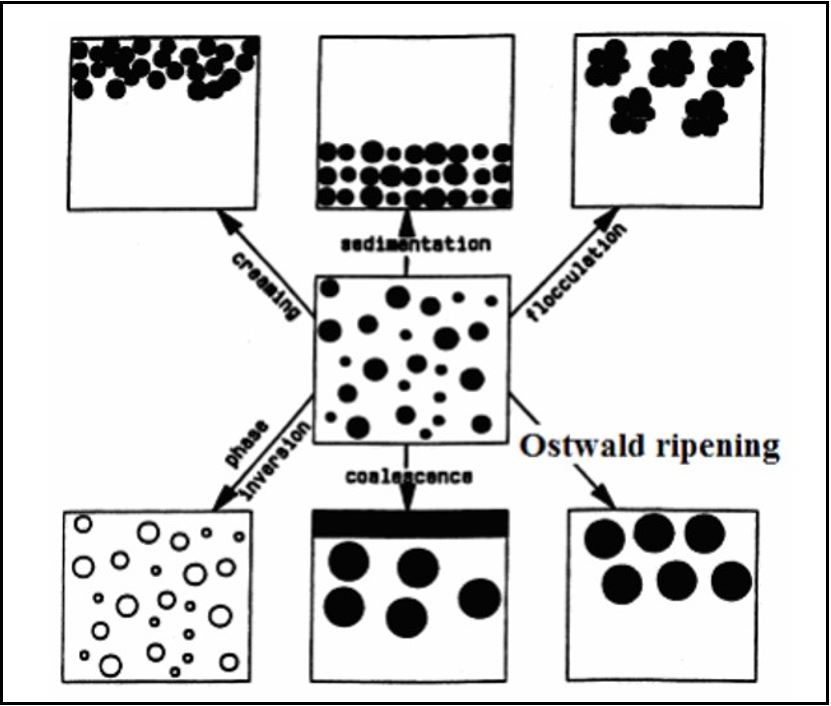
De acordo com Morais[15], as principais etapas e/ou mecanismos de processos de instabilidade observadas em emulsões podem ser: floculação, cremeação, coalescência, maturação de Ostwald (Ostwald ripening) e inversão de fases (FIGURA 6). Para que se evitem processos de instabilidade, é necessária a utilização correta de tensoativos que são obtidos através de cálculos matemáticos determinando o Equilíbrio-hidrófilo-lipófilo (EHL). Esse sistema irá representar o balanço do tamanho e força desses dois grupos e irá traduzir as propriedades hidrofílicas e lipofílicas de um composto anfifílico em termos de escala numérica, os valores de EHL vão aumentando à medida que a substância se torna mais hidrofílica[39].
Aspectos Toxicológicos das NES
Os estudos de toxicidade são imprescindíveis para comprovação da eficácia terapêutica dos nanofármacos, pois a combinação dos constituintes da formulação, bem como os métodos de síntese, interfere nas propriedades do produto final como estabilidade e interações do nanomedicamento. Como as NEs possuem a dimensão na escala nanométrica, são necessários cuidados quanto a interação das nano-formulações com organismos vivos. Estudos demonstram que os tamanhos das partículas podem alterar as propriedades biológicas de nanomateriais, como solubilidade, e que partículas menores possuem uma área de superfície maior, o que interfere diretamente na sua bioatividade[53,54]. Além disso, as altas concentrações de surfactantes e co-surfactantes (ou tensoativos), em algumas formulações de NEs, podem ser tóxicas para os tecidos onde se acumulam ou são aplicadas, resultando em hemólise, dano celular e inflamação tecidual[35].
Os óleos essenciais, bastante utilizados em nano-formulações, além de serem utilizados para estudos de atividade terapêutica, tem demonstrado atividade no controle in vitro de fitopatógenos[35], sendo uma alternativa na prática Biotecnológica. Em estudos utilizando óleo essencial de patchouli (Pogostemon cablin) com propriedade antifúngica, anti-helmíntica, entre outras e sua nanoemulsão[55], comprovou seu uso para atividades inseticidas e manejo de populações resistentes. Apesar do uso de plantas para fins terapêuticos ser muito difundido, as pessoas desconhecem o fato de que elas podem apresentar toxicidade, tanto para o homem, quanto para os amimais: assim, é importante avaliar seu grau toxicológico, pois mesmo possuindo atividades medicinais, sendo tóxico, seu uso se tornará inviável[56,57]. Vários desses produtos, que ocorrem naturalmente em plantas, têm mostrado propriedades quimiopreventivas contra carcinogênese utilizando modelo in vitro e animais[58]. Portanto, metodologias que expõe as NEs em testes para avaliar parâmetros obtendo características de toxicidade utilizando microorganismos ou organismos vivos, oferecem resultados seguros.
Os testes que envolvem atividade antimicrobiana são bastante empregados em ensaios de toxicidade. Alguns dados na literatura reportam que as ocorrências de bactérias resistentes a antibióticos têm despertado o interesse de pesquisas para o desenvolvimento de novas substâncias antimicrobianas, pois o fenômeno da resistência bacteriana a diversos antibióticos e agentes quimioterápicos impõe sérias limitações às opções para o tratamento de infecções bacterianas, representando uma ameaça para a saúde pública[57]. Diante disso, os produtos derivados de plantas vêm ganhando destaque como fonte alternativa de compostos antimicrobianos, como exemplo, extratos de plantas ricos em compostos fenólicos[59, 60], taninos, esteroides e alcaloides[61,62,57].
Ensaios para comprovação de atividade antimicrobiana foi melhorada, de uma forma geral, quando os compostos isolados óleo essencial de palmarosa (Cymbopogon martinii) e geraniol passaram a integrar uma nanoemulsão, mas principalmente quando as nanopartículas de prata foram acrescentadas[63]. Além da atividade antimicrobiana, testes de genotoxicidade também são realizados como indicador secundário de toxicidade. As nanoemulsões formuladas com óleo essencial de Eucalyptus globulus não ocasionou redução na viabilidade celular; não desencadeou a formação de espécies reativas de nenhuma natureza; onde, também, não se constatou perfil genotóxico nessa formulação em nenhuma das concentrações[64].
Conclusão
Com base nos resultados obtidos através da metodologia aplicada, podemos concluir que existe um grande interesse da comunidade científica em obter novas formas farmacêuticas em escala nanométrica utilizando extratos de plantas. Ainda é possível detectar a possibilidade relativamente diversa, do planejamento experimental, quanto aos métodos de síntese e caracterização das nanoemulsões a serem obtidas, bem como a sua viabilidade, pois, as amostras obtidas nos estudos apresentam características físico-químicas compatíveis com um sistema estável, característica desse tipo de nanofármaco. Faz-se importante a continuidade de estudos que apontem as propriedades toxicológicas e mutagênicas dos produtos sintetizados, já que boa parte é elaborada com o propósito de uso in vivo. As análises desse tipo de comportamento, utilizando os protocolos experimentais biotecnológicos, contribuirão para a validação dos nanofármacos e seu uso com segurança.
Agradecimentos
Os autores agradecem à Universidade Estadual de Maringá pelo apoio e incentivo à pesquisa.
Referências
1. Contreras CAM. Efeito da nanoemulsão lipídica associada a paclitaxel na prevenção da doença vascular do coração transplantado. Estudo experimental em coelhos. São Paulo. 2010. Tese de Doutorado [Programa de Pós-Graduação em Ciências / Programa de Cirurgia Torácica e Cardiovascular] - Faculdade de Medicina da Universidade de São Paulo, USP. São Paulo. 2010. [CrossRef] [Link].
2. Cappelaro AMS. Desenvolvimento de nanoemulsão combinando os fármacos Leishmanicidas miltefosina e fluconazol para uso oral. São Paulo; 2012. Dissertação de Mestrado [Programa de Pós-Graduação em Farmácia] - Universidade Bandeirante de São Paulo. [ Link ].
3. Irache JM, Esparza I, Gamazo C, Agueeros M, Espuelas S. Nanomedicine: Novel approaches in human and veterinary therapeutics. Vet Parasitol. 2011; 180(1-2): 47-71. [CrossRef ] [PubMed ]. Acesso em: 15 de nov. 2019.
4. Sidônio IAP. Avaliação do efeito letal da nanoemulsão de Rosmarinus officinalis L. sobre Bactrocera carambolae Drew e Hancock (DIPTERA: TEPHRITIDAE). Macapá; 2017. 51 f. Dissertação de Mestrado [Programa de Pós-Graduação em Biodiversidade Tropical] - Universidade Federal do Amapá, UNIFAP. Macapá. 2017. [Link ].
5. Sanches AR, Stulzer HK, Desenvolvimento e avaliação de nanoemulsões contendo o antiviral Acyclovir. Anais do XIX EAIC – UNICENTRO. 2010. Acesso em: 15 de nov. 2019. Disponível em: [Link].
6. Assunção LS. Desenvolvimento e caracterização de nanopartículas poliméricas ricas em β-caroteno obtidas pela técnica de deslocamento de solvente. Salvador. 2016. 108 f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciência de Alimentos] - Faculdade de Farmácia. Universidade Federal da Bahia, UFBA. 2016. [Link].
7. Zibetti FM. Desenvolvimento de formulação nanoestruturada contendo óleo essencial de Rosmarinus officinalis l. para o tratamento tópico do herpes. Niterói. 2016. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Aplicadas a Produtos da Saúde] - Universidade Federal Fluminense, UFF. Niterói. 2016. [Link].
8. Ostertag F, Weiss J, Mcclements DJ. Low-energy formation of edible nanoemulsions: Factors influencing droplet size produced by emulsion phase inversion. J Colloid Interf Sci. 2012; 388(1): 95-102. [CrossRef] Disponívem em: [Link]. Acesso em: 14 de nov. 2019.
9. Pey CM, Maestro A, Solé I, González C, Solans C, Gutiérrez JM. Optimization of nano-emulsions prepared by low-energy emulsification methods at constant temperature using a factorial desing study. Coll Surf A: Physucochem. 2006; 288(1-3): 144-150. Disponível em: [Link]. Acesso em 14 de nov. 2019.
10. Contente DML. Obtenção e caracterização de nanoemulsão óleo em água a partir de óleo de açaí (Euterpe oleracea M.). Belém. 2016. 92 f. Dissertação de Mestrado [Programa de Pós Graduação em Ciências Farmacêuticas] - Universidade Federal do Pará, UFPA. Belém. 2016. [Link].
11. Porto AS. Desenvolvimento de nanoemulsões O/A a base de óleo de copaíba, incorporadas com nanopartículas magnéticas de zinco. Brasília; 2015. xiii, 100 f., il. Dissertação de Mestrado [Programa de Pós-Graduação em Nanociência e Nanobiotecnologia] - Universidade de Brasília, UNB. Brasília. 2015. [CrossRef] [Link].
12. Sólans C, Izquierdo P, Nolla J, Azemar N, Celma MJG. Nanoemulsions. Curr Opin Coll Interf Sci. 2005; 10(3-4): 102-110. [CrossRef]. Disponível em: [Link]. Acesso em: 19 de nov. 2019.
13. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. ANVISA. Resolução nº 2, de 15 de janeiro de 2007. Aprova o Regulamento Técnico sobre Aditivos Aromatizantes/Aromas e revoga a Resolução nº. 104 de 14 de maio de 1999; Brasília.
14. Pereira GG. Obtenção de nanoemulsões O/A à base de óleo de semente de uva e oliva aditivadas de metoxicinamato de octila e estudo do potencial antioxidante e fotoprotetor das emulsões. Ribeirão Preto; 2008. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] - Universidade de São Paulo, USP. Ribeirão Preto. 2008. [CrossRef] [Link].
15. Morais JM, Santos ODH, Nunes JRL, Zanatta CF, Rocha-Filho PA. W/O/W multiple emulsion obtained by one-step emulsification method and evaluation of the involved variables. J Disper Sci Technol. 2008; 29(1): 63-69. [CrossRef]. Disponível em: [Link]. Acesso em: 15 de nov. 2019.
16. Florence AT, Whittehill D. The formulation and stability of multiple emulsions. Inter J Pharm. 1982; 11(4): 277-308. ISSN 0378-5173. [CrossRef]. Acesso em: 11 de nov. 2019.
17. Luiz C. Nanoemulsões de aloe vera e óleos essenciais de Melaleuca alternifolia e Cymbopogon martinii como indutores de resistência contra a mancha angular do morangueiro (xanthomonas fragarie). Florianópolis. 2017. Tese de Doutorado [Programa de Pós-Graduação em Recursos Genéticos Vegetais] - Centro de Ciências Agrárias. Universidade Federal de Santa Catarina, UFSC. Florianópolis. 2017. [Link].
18. Romeiro JG. Avaliação da ação epigenética e da citotoxicidade de um derivado de um análogo da curcumina veiculado em nanoemulsão lipídica em linhagens tumorais. São Paulo; 2013. 65f. Dissertação de Mestrado [Programa de Pós-Graduação em Farmácia] - Universidade Bandeirante de São Paulo, UNIBAN. São Paulo. 2013. [Link].
19. Mezadri H. Desenvolvimento de nanoemulsão contendo extratos dos frutos de Syagrus romanzoffiana (Cham.) Glassman e estudo fitoquimico desses extratos. Ouro Preto; 2010. 94 f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] - Universidade Federal de Ouro Preto, UFOP. Ouro Preto. 2010. [Link].
20. Rosani L. Desenvolvimento e estudo da estabilidade de nanoemulsões do tipo óleo em água com óleos vegetais. São Carlos; 2011. 85 f. Dissertação de Mestrado [Programa de Pós-Graduação em Química] - Universidade Federal de São Carlos, UFSCAR. São Carlos; 2011. [Link].
21. Rodrigues LM. Desenvolvimento e estudo de estabilidade preliminar de emulsões óleo/água (O/A) a base de óleos vegetais para prevenção e/ou adjuvante no tratamento de úlceras por pressão. Brasília. 2013. 45 f. Monografia de Conclusão de Curso. [curso de Farmácia], Universidade de Brasília, Faculdade de Ceilândia. Disponível: [Link]. Acesso em: 23 de set. 2020.
22. Oliveira PF, Costa JA, Spinelli L, Mansur CRE. Determinação da temperatura de inversão de fases de sistemas óleo/água/tensoativo por reometria. Anais do 10º Congresso Brasileiro de Polímeros, Foz do Iguaçu. 2009. Disponível em: [Link]. Acesso em: 18 de nov. 2019.
23. Frederico Pinto NO. Desenvolvimento de nanoformulações do óleo essencial de Lippia sidoides Cham. Fortaleza. 2014. Dissertação de Mestrado [Programa de Pós-Graduação em Engenharia Química] - Departamento de Engenharia Química. Universidade Federal do Ceará, UFC. Fortaleza. 2014. [Link].
24. Preto VLSM. Desenvolvimento de microemulsões para aplicação tópica. Bragança; 2016. 94 f. Dissertação de Mestrado [Programa de Pós-Graduação em Engenharia Química] - Instituto Politécnico de Bragança, IBP. Bragança, Portugal. 2016.
25. Saavedra, M.G. Avaliação da atividade larvicida da nanoemulsão do óleo essencial das raízes de Philodendron fragrantissimum (hook.) g.don (araceae) contra Aedes aegypti (linnaeus 1762) (Diptera: Culicidae). Macapá; 2018. 80 f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências da Saúde] - Universidade Federal do Amapá, UNIFAP. Macapá. 2018. [Link].
26. Souza PA. Determinação do fator de proteção solar in vitro e avaliação da estabilidade preliminar de emulsão de água em silicone contendo extratos de Ginkgo biloba l. (Ginkgoaceae) e própolis verde. Juiz de Fora. 2016. Monografia de Conclusão de curso. [Graduação em Farmácia] - Universidade Federal de Juiz de Fora, UFJF. Juiz de Fora. 2016.
27. Nascimento VSA. Sistemas microemulsionados contendo óleo essencial de lippia gracilis: obtenção, caracterização e potencial ação amebicida. São Cristovão; 2016. 91 f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] - Universidade Federal de Sergipe, UFS. São Cristóvão. SE. 2016.
28. Rocha ACF. Desenvolvimento de nanoemulsão contendo extratos de folhas de Aleurites moluccanus L. Willd (Euphorbiaceae) com atividade anti-inflamatória tópica. Itajaí; 2017. 163 f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] - Universidade do Vale do Itajaí, UNIVALI. Itajaí. 2017. [Link].
29. Bertoldi FC, Marchiori NC, Furtado W, Almeida AR, Maciel MVOB, Barreto PLM. Nanoemulsão de óleo essencial de Acícula de Pinus taeda l. III Congresso óleos e gorduras. Campinas, São Paulo. 2018; p.36. Disponível em: [Link].
30. Kourniatis LR, Spinelli LS, Mansur CR. Nanoemulsões óleo de laranja/água preparadas em homogeneizador de alta pressão. Rev Quím Nova. 2010; 33(2): 295-300. ISSN 0100-4042. [CrossRef]. Acesso em: 15 de nov. 2019.
31. Daboit TC. Nanoemulsões de anfotericina b e itraconazol: avaliação da atividade antifúngica in vitro e in vivo em agentes da Cromoblastomicose. Porto Alegre; 2013. 225 f. Tese de Doutorado [Programa de Pós-Graduação em Medicina: Ciências Médicas]. Universidade Federal do Rio Grande do Sul, UFRS. Porto Alegre. 2013. [Link].
32. Araújo GMF. Nanoemulsões de Anfotericina-B: desenvolvimento, caracterização e atividade leishmanicida. Campina Grande. 2013. 93 f. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farnacêuticas] - Universidade Estadual da Paraíba, Campina Grande, 2013. [Link].
33. Marques MV, Medeirosa BP, Alves SL, Barreto LV, Lima EM, Zampieria ALTC. Desenvolvimento e avaliação de nanoemulsões contendo ibuprofeno para aplicação tópica. Rev Biotecnol Ciên. 2015; 4(1Supl.Esp.). II Congresso de Ciências Farmacêuticas do Brasil Central. ISSN 2238-6629. [Link]. Acesso em: 14 de nov. 2019.
34. Sajjadi S, Jahanzad F, Brooks BW. Phase inversion in abnormal O/W/O emulsions: effect of surfactant concentration. Ind Eng Chem Res. 2002; 41(24):6033-6041. [CrossRef]. Disponível em: [Link]. Acesso em: 15 de nov. 2019.
35. Botelho BO, Melo DCA, Fontes CS, Queiroz, VT, Costa AV, Martins IVF. Aplicação de nanoemulsões na agricultura e medicina veterinária. Cap. 10. Tópicos especiais em ciência animal VII. 2018. p.143-156. ISBN: 978-85-54343-12-5. Disponível em: [Link].
36. Bruxel F, Laux M, Bartmann W, Fraga M, Koester LS, Teixeira HF. Nanoemulsões como sistemas de liberação parenteral de fármacos. Rev Quím Nova. 2012; 35(9): ISSN 0100-4042. [CrossRef]. Acesso em: 14 nov. 2019.
37. Santos PSS. Desenvolvimento e caracterização de microemulsões e microemulgeles contendo ibuprofeno. Portugal; 2015. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Médicas e da Saúde] - FF-UP. 2015.
38. Ferreira MS. Caracterização estrutural de sistemas formados por compostos siliconados: mesofases, microemulsões e nanoemulsões. Campinas. 2011. 125 f. Tese de Doutorado [Programa de Pós-Graduação em Ciências] – Instituto de Química. Universidade Estadual de Campinas, UNICAMP. Campinas. 2011. [Link].
39. Castro RML. Emulsão: uma revisão bibliográfica. João Pessoa. 2015. Trabalho de Conclusão de Curso [Graduação em Farmácia] - Universidade Federal da Paraíba, UFPB. João Pessoa. 2015. [Link].
40. Bedin AC. Nanoemulsões contendo Benzoilmetronidazol: desenvolvimento, caracterização e estudo de liberação in vitro. Toledo. 2011. 110 f. Dissertação de Mestrado [Programa de Pós-Graduação em Farmacologia] - Universidade Federal de Santa Catarina, UFSC, Toledo, 2011. [Link].
41. Lui W, Sun D, Li C, Liu Q, Xu J. Formation and stability of parafin oil-inwater nanoemulsions prepared by the emulsion inversion point method. J Colloid Inter Sci. 2005; 303(2): 557-563. ISSN 0021-9797. [CrossRef]. Acesso em: 15 de nov. 2019.
42. Bernardi DS. Desenvolvimento de nanoemulsão de óleo de arroz como adjuvante no tratamento de dermatite atópica e psoríase. Ribeirão Preto. 2011. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências] - Universidade de São Paulo, USP, Ribeirão Preto. 2011. [CrossRef] [Link].
43. Morales D, Guierrrez JM, Gracia-Celma MJ, Solans YC. A study of the relation between biocontinuous microemulsions and oil/water nanoemulsion formation. Langmuir. 2003; 19(18): 7196–7200. [CrossRef]. Acesso em: 15 de nov. 2019.
44. Becher P. Emulsions: theory and practice. 3rd ed. New York: Oxford University Press. J Am Chem Soc. 2002; 124(26): 7876–7877. 514p. ISBN: 0-8412-3496-5. [CrossRef].
45. Lachman L, Lieberman HA, Kanig JL. Teoria e Prática na Indústria Farmacêutica. trad.: Pinto JF, Ana IF. Editora Fundação Calouste Gulbenkian. 2001; vol. II, p. 509-1517.
46. Rosen MJ, Kunjappu JT. Surfactants and Interfacial Phenomena [on-line]. Wiley. 4º ed; 2012. Disponível em: [Link]. Acesso em: 13 nov. 2019.
47. Gomes FES. Obtenção de sistemas microemulsionados e estudo de simulação por dinâmica molecular de sistemas micelares objetivando a veiculação de produtos bioativos. Natal. 2010. 174 f. Tese de Doutorado [Programa de Pós-Graduação em Química /Fitoquímica] – Universidade Federal do Rio Grande do Norte, UFRN. Natal. 2010. [Link].
48. Rossi CGFT, Dantas TNDeC, Dantas Neto AA, Maciel MAM. Microemulsões: uma abordagem básica e perspectivas para aplicabilidade industrial. Rev Ciên Ex Terra Serop. 2007; 26(1-2): 45-67. Disponível em: [Link]. Acesso em: 18 de nov. 2019.
49. Vale T Y F. Desenvolvimento de tensoativos e sistemas microemulsionados para a recuperação de petróleo. Natal; 2009. 276 f. Tese de Doutorado [Programa de Pós-Graduação em Química] - Universidade Federal do Rio Grande do Norte, UFRN. Natal. 2009.
50. Oliveira AC. Avaliação da aplicação de microemulsão, nanoemulsão e solução de tensoativo na recuperação avançada de petróleo. Natal; 2015. Trabalho de Conclusão de Curso [Graduação em Química] - Universidade Federal do Rio Grande do Norte. Disponível em: [Link]. Acesso em: 23 de set. 2020.
51. Silva C, Martini E, Tavares G, Silveira T, Oliveira MC, Teixeira E. Caracterização físico-química de nanoemulsões catiônicas como sistemas de liberação de oligonucleotídeos. Acta Farm Bonae. 2006. 25 (1): 17-21. ISSN 0326-2383. Disponível em: [Link]. Acesso em: 17 de nov. 2019.
52. Tadros T, Izquierdo P, Esquena J, Solans, C. Formation and stability os nanoemulsions. Adv Colloid Interf Sci. 2004; 108-109: 303-318. [CrossRef]. Disponível em: [Link]. Acesso em: 19 de nov. 2019.
53. Setyawati MI, Tay CY, Docter D, Stauber RH, Leong DT. Understanding and exploiting nanoparticles intimacy with the blood vessel and blood.Chem Society Rev. 2015; 44(22). [CrossRef]. Disponível em: [Link]. Acesso em: 17 de nov. 2019.
54. Freitas SCMP. Veiculação do quimioterápico paclitaxel em nanoemulsões lipídicas no tratamento da aterosclerose experimental: importância do tamanho das partículas da nanoemulsão. São Paulo. 2016. Tese de Doutorado [Programa de Pós-Graduação em Ciências] - Universidade de São Paulo, USP. São Paulo. 2016. [CrossRef].
55. Santos AMO. Análise química e efeitos letais e sub-letais do óleo essencial de patchouli e sua nanoemulsão em populações de Sithopilus zeamais (Coleoptera: Curculionidae). São Cristovão; 2013. Dissertação de Mestrado [Programa de Pós-Graduação em Biotecnologia e Recursos Naturais] - Universidade Federal de Sergipe, UFS. São Cristóvão. 2013.
56. Pereira VS, Saraiva CRN, Rocha JE, Costa Lopes J, Nascimento Silva MK, Bandeira SMF. (2014). Estudo químico, toxicidade e atividade antibacteriana do óleo essencial de Ocimum gratissimum. Rev Interf Saú Human Tecnol.
57. Braquehais ID, Vasconcelos FR, Ribeiro ARC, Da Silva ARA, Franca MGA, De Lima DR et al. Estudo preliminar toxicológico, antibacteriano e fitoquímico do extrato etanólico das folhas de Jatropha mollissima (Pohl) Baill. (pinhão-bravo, Euphorbiaceae), coletada no Município de Tauá, Ceará, Nordeste Brasileiro. Rev Bras Pl Med. 2016; 18(2 Supl 1): 582-587. ISSN 1983-084X. [CrossRef]. Acesso em: 14 nov. 2019.
58. Silva RC. Fototoxicidade de nanoemulsão de extrato de crajiru (Arrabidaea chica) em linhagem de células de adenocarcinoma mamário murino (4t1). Brasília; 2013. 125 f. Tese de Doutorado [Programa de Pós-Graduação em Biologia Animal] - Universidade de Brasília, UNB. Brasília. 2013. [Link].
59. Oliveira ACM, Fontana A, Negrini TC, Nogueira MNM, Bedran TBL, Andrade CR et al. Emprego do óleo de Melaleuca alternifolia Cheel (Myrtaceae) na odontologia: perspectivas quanto à utilização como antimicrobiano alternativo às doenças infecciosas de origem bucal. Rev Bras Pl Med. 2011; 13(4): 492-499.
60. De Pinho L et al. Atividade antimicrobiana de extratos hidroalcoolicos das folhas de alecrim-pimenta, aroeira, barbatimão, erva baleeira e do farelo da casca de pequi. Ciên Rural. 2012; 42(2). ISSN 0103-8478. [CrossRef]. Acesso em: 15 de nov. 2019.
61. Mendes LPM, Maciel K, Vieira ABR, Mendonça LCV, Silva R, Rolim-Neto PJ et al. Atividade antimicrobiana de extratos etanólicos de Peperomia pelúcida e Portulaca pilosa. Rev Ciên Farm Bás Aplic. 2011; 32(1): 121-125. ISSN 1808-4532. [Link]. Acesso em: 12 de nov. 2019.
62. De Bessa NGF, Borges JCM, Beserra FP, Carvalho RHA, Pereira MAB, Fagundes R et al. Prospecção fitoquímica preliminar de plantas nativas do cerrado de uso popular medicinal pela comunidade rural do assentamento vale verde – Tocantins. Rev Bras Pl Med. 2013; 15(4 Supl1): 692-707. ISSN 1516-0572. Disponível em: [CrossRef]. Acesso em: 14 nov. 2019.
63. Lyra LPS. Desenvolvimento de nanoemulsão de geranial e óleo essencial da palmarosa (Cymbopogon martinii) e sua ação inibitória sobre linhagens de Cutibacterium acnes. Botucatu. 2019. 129 f. Dissertação de Mestrado [Programa de Pós-Graduação em Biologia Geral e Aplicada] – Instituto de Biociências. Universidade Estadual Paulista "Júlio de Mesquita Filho", UNESP. Botucatu. 2019. [Link].
64. Godoi SN. Avaliação da cito-genotoxicidade e da atividade frente a haemonchus contortus de nanoemulsões contendo óleo de eucalipto. Santa Maria. 2018. 92 f. Dissertação de Mestrado [Programa de Pós-Graduação em Nanociências] - Universidade Franciscana de Santa Maria. Santa Maria. 2018. [Link] .