Artigo de pesquisa
Dispersões sólidas de extratos de folhas de Eugenia florida DC. (Myrtaceae) para otimização da solubilidade do marcador ácido betulínico
Solid dispersions of leaves Eugenia florida DC. (Myrtaceae) extracts to optimize the solubility of the betulinic acid marker
Resumo
Eugenia florida DC. pertence à família Myrtaceae. Estudos fitoquímicos anteriores com extratos de folhas de E. florida revelaram a ocorrência de triterpenos e, entre seus constituintes, o ácido betulínico (AB), que apresenta uma vasta literatura com diferentes atividades biológicas, como anti-inflamatório, antimalárico, antimicrobiano, antiviral e anticâncer, porém, sua baixa solubilidade aquosa limita a sua biodisponibilidade. Para o aumento da biodisponibilidade tem destaque o uso de disperões sólidas, onde fármacos lipofílicos são dispersos em carreadores hidrofílicos, acarretando um aumento da solubilidade e perfil de dissolução. Neste trabalho, dispersões sólidas contendo extratos de E. florida foram preparados utilizando o carreador Gelucire®50/13 como agente polímerérico e a lactose monohidratada como suporte hidrofílico empregando a técnica de fusão. O sistema que apresentou melhor solubilidade de AB foi caracterizado através das técnicas de espectroscopia do Infravermelho com Transformada de Fourier (FTIR), Análise de Termogravimetria (TGA), Calorimetria Exploratória Diferencial (DSC) e Difratometria de Raios-X (DRX). A técnica de dispersão sólida aumentou onze vezes a solubilidade do ácido betulínico presente no extrato de folhas de Eugenia florida, sugerindo o aumento da biodisponibilidade do marcador.
- Palavras-chave:
- Dispersões Sólidas.
- Solubilidade.
- Ácido Betulínico.
- Eugenia florida.
Abstract
Eugenia florida DC. belongs to the family Myrtaceae. Previous phytochemical studies with extracts of E. florida leaves showed the occurrence of triterpenes and, among its constituents, the betulinic acid (BA), which presents a vast literature with different biological activities, such as anti-inflammatory, antimalarial, antimicrobial, antiviral and anticancer, however, its low aqueous solubility limits its bioavailability. In order to increase bioavailability, the use of solid dispersions is highlighted, where lipophilic drugs are dispersed in hydrophilic carriers, causing increase in solubility and dissolution profile. In this work, solid dispersions containing extracts of E. florida were prepared using the carrier Gelucire®50/13 as a polymeric agent and lactose monohydrate as a hydrophilic support using the fusion technique. The system that showed better BA solubility was characterized by Fourier Transform Infrared Spectroscopy (FTIR), Thermogravimetric Analysis (TGA), Differential Scanning Calorimetry (DSC) and X-Ray Diffractometry (DRX). The solid dispersion technique elevated the solubility of betulinic acid in Eugenia florida leaf extract eleven times, suggesting an increase in the bioavailability of the marker.
- Keywords:
- Solid Dispersions.
- Solubility.
- Betulinic Acid.
- Eugenia florida.
Introdução
Eugenia florida DC. pertence à família Myrtaceae[1,2]. Estudos fitoquímicos prévios com extratos de folhas de E. florida revelaram a ocorrência de triterpenos, sendo considerada uma importante fonte de ácido betulínico (FIGURA 1). O ácido betulínico é um triterpeno penta cíclico pertencente ao grupo lupânico e apresenta muitas atividades biológicas já descritas na literatura, como anti-inflamatório[3,4], antimalárico[4], antiviral[4-7], anti-HIV[8,9] e antitumoral[4,10-13].

Os triterpenos ácidos podem atuar em vários estágios no desenvolvimento de tumores, como na inibição de tumorigênese, inibição na progressão de tumor e indução da diferenciação tumoral[14]. Desde 1995 que Pisha e colaboradores[11] reportaram o ácido betulínico como altamente promissor agente antineoplásico, após a indução da apoptose em linhagens celulares de melanoma quer in vitro quer in vivo. Posteriormente, esta atividade foi confirmada como efetiva em outras linhagens celulares com diferentes origens tais como mama, cólon, pulmão, pâncreas, ovário, neuroblastoma, osteossarcoma, entre outras[15]. O mecanismo de ação antitumoral deste fitofármaco prende-se com a capacidade do mesmo induzir a morte celular apoptótica pela via mitocondrial[13]. Adquire, contudo, ainda mais relevância o interesse terapêutico deste composto quando se percebe que existe uma dada seletividade das células cancerígenas à sua ação, mas não sobre células humanas sadias[16-18].
Todavia, esta substância apresenta algumas limitações, no que diz respeito à fraca solubilidade da mesma e dos seus derivados, limitando a sua biodisponibilidade[19]. Existem várias técnicas disponíveis para melhorar a solubilidade de fármacos pouco solúveis e conseqüentemente a sua biodisponibilidade. As dispersões sólidas são técnicas bastante utilizadas para aumentar a solubilidade de fármacos pouco solúveis[20-22].
Dispersão sólida é definida como uma forma farmacêutica em que as substâncias ativas são dispersas em uma matriz/carreador, biologicamente inerte e geralmente hidrofílico[23,24]. A escolha do carreador utilizado deve ser compatível com a finalidade do estudo, uma vez que são as propriedades dos polímeros as responsáveis pelo perfil de liberação do fármaco[25].
Na busca do aumento da solubilidade do marcador AB presente nos extratos de folhas de E. florida, utilizou-se a técnica de dispersão sólida por fusão, propondo assim uma melhoria no insumo farmacêutico vegetal para ser utilizado em desenvolvimentos futuros de medicamentos antitumorais.
Materiais e Métodos
Obtenção do Extrato Seco de folhas de Eugenia florida DC. (Myrtaceae)
Foram coletadas folhas frescas e sadias de Eugenia florida do indivíduo localizado no Campus da Fundação Oswaldo Cruz – Manguinhos / RJ. – 22o 52' 38.13'' S / 43o 14' 47.45''. O indivíduo foi devidamente identificado e um voucher encontra-se depositado, no Herbário do Jardim Botânico, Rio de Janeiro, sob o número de registro RB 328.061 (Autorização CGEN n° 254/2015). O material foi seco a 40°C em estufa com circulação de ar por 72 h e moído em um moinho de facas. As folhas secas e trituradas foram submetidas à extração com etanol na proporção 1:10 (planta:solvente), por maceração com agitação ocasional duas vezes ao dia, com renovação de solvente 2 vezes a cada 48 horas. O solvente foi evaporado através de rota evaporador e em seguida liofilizado até obter um extrato seco[26].
Delineamento experimental
Foi utilizado o Gelucire®50/13 como polímero carreador e a lactose monohidratada spray dried como suporte hidrofílico para o desenvolvimento de dispersão sólida do extrato de folhas de Eugenia florida DC. (Myrtaceae), buscando um aumento da solubilidade do marcador ácido betulínico, sendo realizado um planejamento do tipo Delineamento de Faces Centradas (DFC) para otimizar o processo.
Na TABELA 1, podem-se observar os experimentos propostos pelo DFC, o planejamento foi realizado aleatoriamente e consiste em combinações, incluindo três repetições genuínas e três repetições no ponto central, totalizando os 45 experimentos realizados. A metodologia de superfície de resposta foi utilizada para investigar a influência das três variáveis independentes estudadas: quantidade de extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae)(X1), quantidade de Gelucire®50/13 (X2) e quantidade de lactose monohidratada spray dried (X3), no processo de solubilidade do marcador ácido betulínico presente no extrato de folhas de Eugenia florida DC. (Myrtaceae) em solução tampão pH 7, sendo realizada uma análise de regressão múltipla dos dados, para verificar os coeficientes do modelo de regressão pelo método dos mínimos quadrados, estes valores encontrados foram avaliados utilizando o software Protimiza Experimental Design.
O modelo de regressão polinomial foi utilizado para expressar a relação da função das variáveis independentes (Eq. (1)).

Onde y é a variável resposta, β0 é uma constante e βi, βii e βij são os coeficientes linear, quadrático e interativo do modelo, e xi e xj são variáveis independentes.
Foi realizada a análise de variância (ANOVA) para as variáveis independentes estudadas.
| Símbolos | Variáveis |
Níveis |
||
|---|---|---|---|---|
| (-1) | 0 | (+1) | ||
| X1 | Extrato (mg) | 50 | 275 | 500 |
| X2 | Gelucire (mg) | 500 | 725 | 950 |
| X3 | Lactose (mg) | 100 | 200 | 300 |
Preparação das dispersões sólidas
As dispersões sólidas propostas no DFC foram preparadas pelo método da fusão onde o extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae) foi misturado a lactose monohidratada spray dried e a mistura adicionada ao carreador Gelucire®50/13 fundido nas proporções extrato/polímero conforme descrito na TABELA 1 a 60ºC, aproximadamente, com homogeneização contínua até a formação de uma dispersão homogênea, que, em seguida, foi solidificada por resfriamento em banho de gelo e pulverizada com o auxílio de gral e pistilo. As amostras foram guardadas em frascos de vidro âmbar no dessecador até as análises.
Quantificação por Cromatografia Líquida de Alta Eficiência (CLAE)
O sistema CLAE consiste em um sistema LC LaChrom (Merck-Hitachi) com bomba quaternária (L-7100), forno de coluna (L-7300), amostrador automático (L-7200) e detector de UV (L-7400). A separação cromatográfica foi realizada usando uma coluna µBondapak Waters C18 3,9 mm × 300 mm e a pré-coluna Phenomenex Luna C18 150 mm x 4,6 mm (ambas com tamanho de partícula de 5 μm). Foi aplicada uma eluição isocrática usando 10% de água em pH 3 ajustado com ácido fosfórico (Fase móvel A) e 90% de acetonitrila (Fase móvel B). O tempo total de execução foi de 15 min, com uma vazão de 1,0 mL / min e a temperatura da coluna foi de 25°C. A aquisição de dados em 210 nm foi realizada após injeção de amostra de 10μL com fluxo de 1mL/min, empregando o EZChrom Elite Software 3.3.2 SP2 (Merck-Hitachi). A quantificação do marcador químico foi realizada a partir da interpolação da área de AB em curva de calibração em faixa de concentração determinada na validação da metodologia.
Validação da metodologia CLAE
O método de determinação do ácido betulínico no extrato das folhas de Eugenia florida DC. (Myrtaceae) foi baseado em Kumar[27]. Os parâmetros de validação e os critérios de aceitação atenderam às diretrizes do Instituto Brasileiro de Metrologia (INMETRO)[28]. Para validar a determinação de ácido betulínico no extrato de folhas de Eugenia florida DC. (Myrtaceae), foram avaliados os seguintes parâmetros de desempenho: seletividade, linearidade, precisão (repetibilidade e precisão intermediária), tendência (recuperação), limite de detecção (LoD), limite de quantificação (LoQ) e robustez. A seletividade foi avaliada comparando-se o tempo de retenção do padrão de ácido betulínico adicionado ao solvente (metanol) e na presença da matriz (extrato de folhas de Eugenia florida DC. (Myrtaceae)) e pela avaliação da pureza do ácido betulínico no extrato da planta. Para avaliar a linearidade, as matrizes foram fortificadas com a solução padrão de ácido betulínico nas concentrações de 0,01, 0,02, 0,05, 0,1, 0,2, 0,5 e 1,0 mg/mL, em sete repetições. Após as análises, foi criado um gráfico relacionando a área do pico à concentração, e as equações da curva e os coeficientes de determinação (R2) e correlação (r) foram determinados por regressão linear. Para avaliar a repetibilidade avaliou-se o desvio padrão relativo (RSD), com análises sucessivas das mesmas amostras em curtos intervalos de tempo e realizadas nas mesmas condições (mesmo equipamento e mesmo analista). A medição intermediária de precisão foi obtida por comparação estatística das amostras realizadas sob o mesmo procedimento de medição, no mesmo local e nas medidas replicadas nas mesmas amostras durante um período prolongado. As amostras foram fortificadas com a solução padrão em três níveis de concentração - baixa (10 mg/L), média (500 mg/L) e alta (1000 mg/L), considerando o intervalo linear do método, com três repetições cada. A tendência foi avaliada através da realização de testes de recuperação nas mesmas concentrações empregadas na precisão (alta, média e baixa) em triplicata. A recuperação obtida em cada concentração foi calculada usando a equação R = [(C1-C2) / C3] x 100, que considera a concentração de analito na amostra fortificada (C1), a concentração de analito na amostra não fortificada (C2) e a concentração de analito adicionada à amostra fortificada (C3). Os valores de LoD e LoQ foram calculados a partir de equações que consideram os parâmetros da curva analítica LoD = [(3 s) / S] e LoQ = [(10 s) / S], utilizando o (s) desvio (s) padrão da resposta e (o) inclinação da curva analítica (S). Na robustez do método foi avaliado o desvio padrão relativo das áreas AB após a modificação do valor da vazão em uma condição que promoveu uma diferença no tempo de retenção (Tr) cerca de 0,1 min do Tr original (5,7 min), ou seja, fluxo de 0,98 mL/min e 1,02 mL/min de vazão.
Ensaio de solubilidade
O coeficiente de solubilidade do marcador AB no extrato de folhas de Eugenia florida DC. (Myrtaceae) e dispersões sólidas foram determinados utilizando diferentes meios, simulando as condições de pH do trato gastrointestinal. Triplicatas de amostras em condições saturantes foram dispersas, nos diferentes meios de dissolução, com diferentes pH (1,2; 4,5; 7,0 e 12)[29], deixadas sob agitação por 2 horas a 25ºC ± 2. Após este período, foram centrifugadas, filtradas e quantificadas por CLAE.
Teste de dissolução in vitro
Os ensaios foram feitos em dissolutor Hanson SR8 PLUS, a 37 + 0,5ºC, utilizando o aparato II (pá) e velocidade de agitação de 100 rpm. O meio de dissolução foi 900 mL de tampão Na3PO4-HCl 0,2 M (pH 6,8 + 0,05) em cada cuba. Os ensaios foram realizados em triplicata e o perfil de dissolução foi acompanhado por um período total de 75 minutos. Alíquotas de 1,0 mL foram coletadas e filtradas em filtro de seringa com membrana de celulose regenerada de 0,45 µm. Alíquotas de 250,0 µL foram transferidas para vials. As amostragens foram realizadas nos tempos de 0, 15, 30, 45, 60 e 75 minutos. O perfil de dissolução foi realizado para o extrato liofilizado e para a dispersão sólida que apresentou melhor resultado no delineamento experimental (DS3). As amostras foram analisadas por CLAE.
Estudo do comportamento térmico
O comportamento térmico do extrato, do marcador ácido betulínico, da dispersão sólida DS3 e seus carreadores foram avaliadas utilizando o equipamento TGA/DSC 3 Mettler Toledo. As análises de termogravimetria (TGA) foram realizadas no intervalo de 30 a 997ºC, razão de aquecimento de 10ºC min-1, atmosfera inerte (N2 seco) com vazão de 50 mL min-1, cadinhos de óxido de alumínio de 150 µL e massa da amostra da ordem de 10 mg. As análises de DSC foram realizadas no intervalo de 30 a 997ºC, razão de aquecimento de 10ºC min-1, atmosfera inerte (N2 seco) com vazão de 80 mL min-1, cadinhos de óxido de alumínio de 40 µL e massa da amostra da ordem de 10 mg.
Difratometria de raios X
A cristalinidade do marcador ácido betulínico puro, do extrato de folhas de Eugenia florida DC. (Myrtaceae) e da dispersão DS3 foram avaliadas empregando-se o D8 Advance Bruker utilizando-se tubo de cobre, submetido a 40 kV, corrente de 25 mA, Cu Kα, λ = 1.54060 Å e λ = 1.54438. A amostra foi colocada em suporte de vidro, próprio do equipamento e exposta à radiação 3º ≤ 2θ ≤ 60º, com passo de varredura de 0,02º por 0,2 segundos. Detector Lynxeye.
Espectroscopia de absorção na região do infravermelho
Os espectros na região do infravermelho foram obtidos em Espectrofotômetro com Transformada de Fourier, modelo Nicolet 6700 Thermo Scientific, com resolução de 4 cm-1, na região compreendida entre 4000-400 cm-1.
Resultados e Discussão
Solubilidade do marcador AB no extrato de folhas de Eugenia florida DC. (Myrtaceae)
Pode-se observar a solubilidade de AB no extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae) em diferentes pHs (FIGURA 2), onde apresentou uma melhor solubilidade em pH 12, sendo este um pH impróprio para um medicamento.

Como o marcador possui atividade antitumoral e a intenção seria utilizar o extrato de folhas de Eugenia florida DC. (Myrtaceae) como insumo farmacêutico ativo vegetal (IFAV) para desenvolver um medicamento, tem-se a necessidade de utilizar técnicas de dispersão sólida para aumentar a solubilidade de AB em pH 7.
Delineamento experimental
Os resultados do delineamento experimental apresentaram boa adequabilidade ao modelo, por apresentar o valor de (p-valor) falta de ajuste menor que (<0,05), valores de F significativos apresentando um p-valor (<0,05). O modelo quadrático obteve R2 e R2aj de 0.94 e 0.91 respectivamente, sendo assim explicando uma alta variabilidade dos dados.
Na TABELA 2 estão representados os experimentos propostos pelo DFC, totalizando os 45 experimentos realizados. Neste planejamento as variáveis independentes estudadas foram: Extrato (X1), Gelucire (X2) e Lactose (X3).
| Amostra | X1 |
X2 |
X3 |
Área (AU) |
Solubilidade AB (%) |
|---|---|---|---|---|---|
| DS1A (50:500:100) | -1 | -1 | -1 | 7772075 | 47,0 |
| DS1B (50:500:100) | -1 | -1 | -1 | 7669891 | 46,6 |
| DS1C (50:500:100) | -1 | -1 | -1 | 7633293 | 45,8 |
| DS2A (500:500:100) | 1 | -1 | -1 | 4353634 | 29,0 |
| DS2B (500:500:100) | 1 | -1 | -1 | 5312385 | 35,5 |
| DS2C (500:500:100) | 1 | -1 | -1 | 3897466 | 25,8 |
| DS3A (50:950:100) | -1 | 1 | -1 | 11706492 | 80,6 |
| DS3B (50:950:100) | -1 | 1 | -1 | 10463834 | 72,0 |
| DS3C (50:950:100) | -1 | 1 | -1 | 11562935 | 80,5 |
| DS4A (500:950:100) | 1 | 1 | -1 | 6630821 | 48,9 |
| DS4B (500:950:100) | 1 | 1 | -1 | 6564158 | 47,4 |
| DS4C (500:950:100) | 1 | 1 | -1 | 6075709 | 44,3 |
| DS5A (50:500:300) | -1 | -1 | 1 | 4388792 | 44,8 |
| DS5B (50:500:300) | -1 | -1 | 1 | 4284484 | 43,6 |
| DS5C (50:500:300) | -1 | -1 | 1 | 3630565 | 36,5 |
| DS6A (500:500:300) | 1 | -1 | 1 | 1661303 | 10,9 |
| DS6B (500:500:300) | 1 | -1 | 1 | 1407230 | 9,1 |
| DS6C (500:500:300) | 1 | -1 | 1 | 1276814 | 8,2 |
| DS7A (50:950:300) | -1 | 1 | 1 | 5552694 | 46,2 |
| DS7B (50:950:300) | -1 | 1 | 1 | 5553887 | 46,0 |
| DS7C (50:950:300) | -1 | 1 | 1 | 5109400 | 42,3 |
| DS8A (500:950:300) | 1 | 1 | 1 | 3807163 | 31,4 |
| DS8B (500:950:300) | 1 | 1 | 1 | 3991960 | 32,9 |
| DS8C (500:950:300) | 1 | 1 | 1 | 2364261 | 19,5 |
| DS9A (50:725:200) | -1 | 0 | 0 | 6051681 | 40,9 |
| DS9B (50:725:200) | -1 | 0 | 0 | 6908175 | 47,4 |
| DS9C (50:725:200) | -1 | 0 | 0 | 5443009 | 37,3 |
| DS10A (500:725:200) | 1 | 0 | 0 | 1702360 | 11,1 |
| DS10A (500:725:200) | 1 | 0 | 0 | 1660592 | 10,7 |
| DS10C (500:725:200) | 1 | 0 | 0 | 1704739 | 11,1 |
| DS11A (275:500:200) | 0 | -1 | 0 | 4904240 | 40,0 |
| DS11B (275:500:200) | 0 | -1 | 0 | 5417894 | 44,0 |
| DS11C (275:500:200) | 0 | -1 | 0 | 5427066 | 44,3 |
| DS12A (275:950:200) | 0 | 1 | 0 | 3399174 | 22,8 |
| DS12B (275:950:200) | 0 | 1 | 0 | 3372141 | 21,9 |
| DS12C (275:950:200) | 0 | 1 | 0 | 3263470 | 21,3 |
| DS13A (275:725:100) | 0 | 0 | -1 | 1508238 | 19,4 |
| DS13B (275:725:100) | 0 | 0 | -1 | 1635134 | 17,5 |
| DS13C (275:725:100) | 0 | 0 | -1 | 1601306 | 17,0 |
| DS14A (275:725:300) | 0 | 0 | 1 | 4440657 | 28,0 |
| DS14B (275:725:300) | 0 | 0 | 1 | 4506526 | 28,2 |
| DS14C (275:725:300) | 0 | 0 | 1 | 5523346 | 34,7 |
| DS15A (275:725:200) | 0 | 0 | 0 | 4502198 | 40,3 |
| DS15B (275:725:200) | 0 | 0 | 0 | 4332800 | 38,6 |
| DS15C (275:725:200) | 0 | 0 | 0 | 4402002 | 39,1 |
| X1= Extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae); X2= Gelucire®50/13; X3= Lactose monohidratada spray dried. | |||||
A TABELA 3 apresenta às interações de primeira e de segunda ordem (p<0,05) as interações com efeito quadrático primário foram: Extrato (X1) Gelucire (X2) e Lactose (X3) e para a segunda ordem as interações quadráticas que foram significativas (p<0,05) foi extrato (X1) / Lactose (X3) e Gelucire (X2) / Lactose (X3).
| Fator | Soma dos quadrados |
Graus de liberdade |
Média dos quadrados |
Valor-F |
P |
|---|---|---|---|---|---|
| X1 | 38,0772 | 2 | 4,07.1013 | 89,86599 | 0,000000 |
| X2 | 118,6338 | 2 | 7,69.1012 | 16,94479 | 0,000015 |
| X3 | 348,9200 | 2 | 1,16.1013 | 25,55636 | 0,000000 |
| X1X3 | 19,4220 | 4 | 1,35.1013 | 29,91133 | 0,000000 |
| X2X3 | 116,1160 | 2 | 1,79.1012 | 3,96554 | 0,030453 |
| Falta de ajuste | 61,6855 | 1 | 1,95.1012 | 4,31574 | 0,047049 |
| Erro padrão | 1,2555 | 28 | 4,53.1011 | ||
| Soma dos quadrados - total | 704,1099 | 43 | |||
| X1= Extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae); X2= Gelucire50/13; X3 = Lactose monohidratada spray dried. *p<0,005. | |||||
A FIGURA 3 apresenta uma similaridade entre os valores obtidos experimentais versus os valores preditos, mostram os 45 experimentos realizados e que apresentam boa correlação entre eles corroborando com os resultados apresentados na TABELA 2.

A equação Eq. 02 representa o modelo estatístico matemático para explicar as variáveis independentes que foram estudadas para melhorar a solubilidade do marcador ácido betulínico em pH 7,0.
y=3366640,83 – 1710686,73X1 + 679365,90X2 -1229609,97X3 + 415136,08X1X3 – 276459,08X2X3 -126871,33X1X2 (Eq.02).
A superfície de resposta gerada pelo modelo relaciona a influência entre o extrato de folhas de Eugenia florida DC. (Myrtaceae) e os carreadores Gelucire®50/13 e lactose monohidratada representado pelas (FIGURAS 4A, 4B E 4C) na qual a FIGURA 4B representa uma correlação entre Gelucire®50/13 e lactose monohidratada demonstrando a adequabilidade do modelo, porém para que ocorra uma otimização com o ponto ideal serão necessários novos desenhos experimentais.

Para uma melhor visualização das dispersões sólidas obtidas a partir do delineamento experimental, e definição da melhor proporção de extratos e carreadores, foi elaborado um gráfico de barras (FIGURA 5) utilizando-se as médias das três repetições do delineamento experimental, obtendo-se assim 15 resultados de solubilidade do marcador ácido betulínico. A dispersão que melhor solubilizou o ácido betulínico foi DS3 com 50 mg de Extrato + 950 mg Gelucire®50/13 + 100 mg lactose monohidrtada, apresentando uma solubilidade de 80% de ácido betulínico no pH 7.

A dispersão sólida foi preparada pelo processo de fusão do Gelucire®50/13 e incorporação do extrato e lactose, na qual o polímero demonstrou sua capacidade de aumentar a solubilidade do AB quando utilizado em grandes quantidades juntamente com um suporte hidrofílico. Foi avaliado cada parâmetro que envolveu o preparo da dispersão sólida até otimizar todo o processo. O estudo de Maquiafável et al.[30] demonstrou no planejamento de secagem de própolis que quase todos os parâmetros influenciaram no processo de secagem do produto.
Outras técnicas de preparo de dispersões sólidas também devem ser testadas com os mesmos carreadores para avaliar se o processo pode melhorar e aumentar a solubilidade já observada do AB nas dispersões sólidas. Pereira et al.[31] utilizaram a metodologia de fusão e sonicação para o preparo das dispersões sólidas, e observou uma relação proporcional entre o tempo de sonicação com a solubilidade do fármaco.
Validação da metodologia CLAE
Uma série de experimentos com relação à linearidade, limites de detecção (LODs), limites de quantificação (LOQs) e reprodutibilidade do método foi realizada para validar o método proposto nas condições de trabalho otimizadas.
Esses resultados (TABELA 4) demonstram que o método proposto possui boa reprodutibilidade e alta sensibilidade para determinar o ácido betulínico em extratos de folhas de Eugenia florida DC. (Myrtaceae).
| Parâmetros de Mérito | Resultados | |
|---|---|---|
| Linearidade | ||
| Faixa de Trabalho | 10-1000 mg / L | |
| R2 (solvente) | 0,9989 | |
| R2 (matriz) | 0,9993 | |
| Limite de detecção | 2,4 mg / L | |
| Limite de quantificação | 7,2 mg / L | |
| Precisão | ||
| Repetibilidade | <3,5% | |
| Intermediária | tcalculado < ttabelado | |
| Tendência | ||
| Recuperação (nos 3 níveis de concentração) | 95%-108% | |
| Robustez | ||
| Variação da vazão (0,98 – 1,02 mL/min) | < 5% |


Perfil de dissolução
De acordo com os gráficos demonstrados nas Figuras 8 e 9, o perfil de dissolução da dispersão sólida DS3 (50 mg de Extrato + 950 mg Gelucire®50/13 +100 mg lactose monohidrtada) apresentou um valor de área sobre a curva com cerca de 11 vezes maior do que aquele observado na dissolução do extrato liofilizado. Desta forma, é possível inferir que a presença dos carreadores lactose e gelucire proporciona uma solubilização do ácido betulínico mais eficiente, nestas condições.


Caracterização das dispersões sólidas
Análise Térmica
A curva de TGA da dispersão sólida DS3 pode ser observado na FIGURA 10. A dispersão DS3 apresentou um comportamento semelhante ao do carreador Gelucire®50/13 que é o maior constituinte da dispersão. Além disso, a dispersão foi termicamente estável até aproximadamente 170°C. Isso mostra que o processo utilizado para obter as dispersões sólidas utilizadas neste estudo foi adequado para esses materiais, pois as amostras foram fundidas a aproximadamente 50°C.

A curva de DSC da dispersão sólida DS3 - 50:950:100 (Extrato: Gelucire®50/13: lactose monohidratada) apresentou um evento endotérmico de maior intensidade na faixa entre 30 e 50ºC e um Segundo evento, de baixa intensidade por volta de 140ºC. A degradação da amostra ocorre em torno de 230ºC. Comparando os resultados de DSC (FIGURA 11) da amostra com os carreadores, é possível relacionar o primeiro evento com a fusão do Gelucire®50/13, e o Segundo evento, com o sinal de hidratação da lactose.

Espectroscopia no infravermelho por transformada de Fourier (FT-IR)
Análises FT-IR foram realizadas para verificar se a dispersão sólida promoveu alguma interação entre o extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae) e os carreadores utilizados neste estudo.
Analisando separadamente cada componente da dispersão sólida foi possível observar que no extrato liofilizado de folhas de Eugenia florida DC. (Myrtaceae) as bandas principais do marcador AB em aproximadamente 1685 (C=O) e 1448 (C-O-H) cm-3. No carreador Gelucire®50/13 foi possível observar as bandas referentes a hidroxila e carbonila em aproximadamente 1729 e 3400 cm-1. Segundo Eloy et al.[32], estes grupos são característicos da estrutura química deste carreador, com bandas em aproximadamente 1650 cm-1 e 3400 cm-1 . Segundo Raut et al.[33], a forma monohidratada da lactose exibe picos de estiramento O-H nítidos e distintos em 3521,5 cm-1 . Na amostra analisada foi possível observar um pico em 3521,90 cm-1. Além disso, também foi possível observar bandas principais nas regiões de 3300 a 3200 cm-1 e de 1201 a 967 cm-1.
Na análise da dispersão sólida DS3, não foi possível observar as bandas características do marcador AB na região 1685 e 1448 cm-1, provavelmente, isso ocorreu devido a pouca quantidade de extrato em relação ao carreador Gelucire®50/13 que apresentou uma banda característica em 1729 cm-1. Ao avaliar a dispersão sólida DS4 que contém uma maior quantidade de extrato observou-se o surgimento de uma banda em 1612 cm-1, sugerindo um deslocamento da banda característica do marcador AB que nessa dispersão DS4 está em maior quantidade do que em DS3.
Difratometria de Raios X
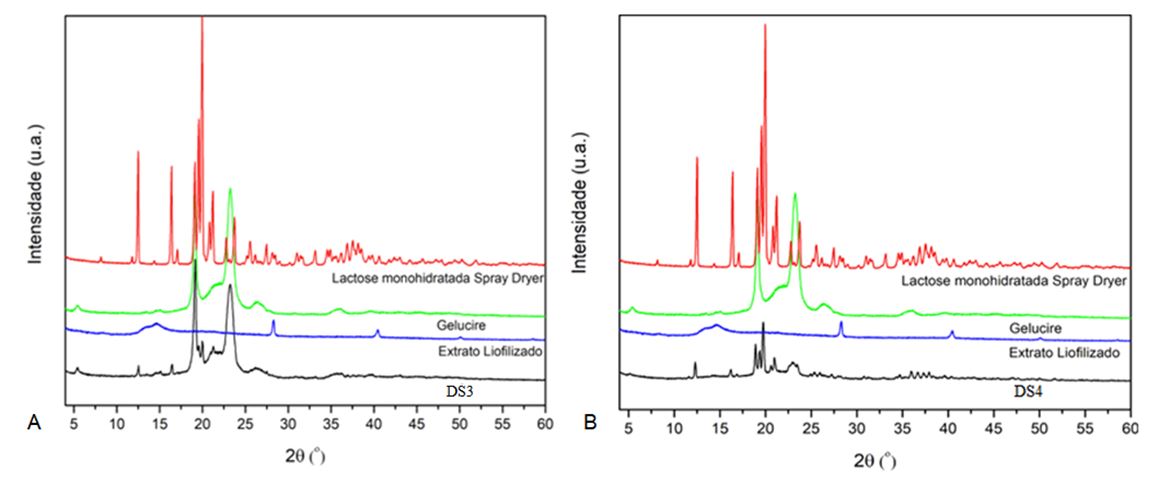
Na FIGURA 12, pode-se observar a medida de DRX da dispersão sólida DS3, sendo a dispersão sólida que tem menor quantidade de extrato e que apresentou melhor solubilidade do AB, e DS4 uma dispersão com 10 vezes mais quantidade de extrato liofilizado, sendo a solubilidade de AB menor.
Na FIGURA 12A, pode-se comparar a difração da dispersão sólida com a difração dos seus componentes, podendo observar a posição dos picos da lactose e do Gelucire®50/13 presentes no difratograma da dispersão. Entretanto, não se pode afirmar que os picos referentes ao extrato (28,3º e 40,46º) estão presentes no difratograma da dispersão. A baixa concentração do extrato na dispersão e/ou sua baixa cristalinidade, pode ser a razão para não identificar a sua presença, pode-se sugerir que o extrato manteve a sua forma cristalina durante o processo de preparo da dispersão sólida. Já na FIGURA 12B pode-se observar o aumento da intensidade dos picos e observa-se novos picos, provavelmente, devido ao aumento 10 vezes da concentração do extrato na dispersão sólida.
Conclusão
Este estudo foi o primeiro relato de desenvolvimento de dispersões sólidas a partir de extratos liofilizados de folhas de Eugenia florida DC. (Myrtaceae), que contém o marcador ativo ácido betulínico (lipofílico e antitumoral), utilizando os carreadores o Gelucire®50/13 como polímero e a lactose monohidratada como suporte hidrofílico. A dispersão sólida desenvolvida neste estudo apresentou um aumento da solubilidade do marcador ácido betulínico em onze vezes em relação do que foi observado na solubilidade do extrato liofilizado. A dispersão sólida foi caracterizada por técnicas de FTIR, DSC, TGA e DRX e os resultados corroboraram para avaliar que o extrato não foi degradado durante o preparo das dispersões sólidas. Portanto, a dispersão sólida, apresentou um acentuado aprimoramento da solubilidade do marcador AB e sua capacidade de ser dissolvido de maneira completa e rápida, ao contrário do extrato liofilizado.
Agradecimentos
Ao Laboratório de Química da Biodiversidade, Plataforma Agroecológica de Fitomedicamentos (PAF) de Farmanguinhos, ao Laboratório de Estudos do Estado Sólido de Farmanguinhos e ao Laboratório de Pesquisa, Desenvolvimento e Inovação de Bioprodutos, Faculdade de Farmácia, Universidade Federal de Goiás.
Referências
1. Lorenzi H. Árvores Brasileiras: Manual de Identificação e Cultivo de Plantas Arbóreas do Brasil. 2ª ed., Nova Odessa, São Paulo, 382p, 2000. ISBN-10: 858671450X.
2. Stevens PF. (2001 onwards). Angiosperm Phylogeny Website. Version 12, July 2012. [and more or less continuously updated since]. [Link].
3. Junges MJ. Triterpenos de Eugenia florida DC de potencial Anti-HIV. Cad Farm. Fundação Universidade de Rio Grande. 1997; 13(2): 103-104.
4. Simões CMO, Schenkel EP, Gosmann G, Mello JCP, Mentz LA, Petrovick PR. Farmacognosia: da Planta ao Medicamento, 6ª ed., Ed. Universidade/UFRSC/ED. UFSC, Porto Alegre, 475p, 2007. ISBN: 9788570259271.
5. Mukherjee PK, Saha K, Das J, Pal M, Saha BP. Studies on the Anti-inflamatory activity of rhizomes of Nelumbo nucifera. Pl Med. 1997; 63: 367-369. [CrossRef].
6. Sami A, Taru M, Salme K, Jari YK. Pharmacological properties of the ubiquitous natural product betulin. Eur J of Pharmac Sci. 2006; 29(1): 1-13. ISSN 0928-0987. [CrossRef].
7. Baltina LA, Flakhter OB, Nigmatullina LR, Boreko EI, Pavlova NI, Nikoleave SN et al. Lupane triterpenes and derivatives with antiviral activity. Bioorg Med Chem Lett. 2003; 13(20): 3549-3552. ISSN 0960-894X. [CrossRef].
8. Hess SC, Brum RL, Honda NK, Cruz AB, Moretto E, Cruz RB et al. Antibacterial activity and phytochemical analisis of Vochysia divergens (Vochysiaceae). J Ethnophar. 1995; 47(2): 97-100. ISSN 0378-8741. [CrossRef].
9. Pavlova NI, Savoniva OV, Nikolaeva SN, Boreko EI, Flekhter OB. Antiviral activity of betulin, betulinic acid and betulonic acid against some enveloped and non-enveloped viruses. Fitoterapia. 2003; 74(5): 489-492. ISSN 0367-326X. [CrossRef].
10. Cichewicz RH, Kouzi SA. Chemistry, biological activity, and chemotherapeutic potential of betulinic acid for the prevention and treatment of cancer and HIV infection. Med Res Rev. 2004; 24(1): 90-114. [CrossRef][PubMed].
11. Pisha E, Chai H, Lee I, Chagwedera TE, Faensworth NR, Cordell GA et al. Discovery of betulinic acid as a selective inhibitor of human melanoma that functions by induction of apoptosis. Nat Med. 1995; 1: 1046-1051. [CrossRef].
12. Schmidt M, Kunesch N, Poisson J, Gantier JC, Gayral P, Dedet JP. Isolation of Leishmanicidal triterpenes and lignans from Amazonian Liana Doliocarpus dentatus (Dilleneaceae). Phytother Res. 1997; 10: 1-4. [CrossRef].
13. Fulda S, Jeremias I, Siener HH, Pietsch T, Debatin KM. Belulinic acid: A new cytotoxic agent against malignant brain-tumor cells. Int J Cancer. 1999; 82: 435-441. [CrossRef].
14. Ovesna Z, Vachálková A, Horváthová K, Tóthová D. Pentacyclic triterpenoic acids: new chemoprotective compounds. Minireview. Neoplasma. 2004; 51(5): 327-333. [PubMed].
15. Sami A, Taru M, Salme K, Jari YK. Pharmacological properties of the ubiquitous natural product betulin. Eur J Pharm Sci. 2006; 29(1): 1-13. [CrossRef] [PubMed].
16. Fulda S. Betulinic acid for cancer treatment and prevention. Inter J Molec Sci. 2008; 9(6): 1096-1107. [CrossRef].
17. Fulda S, Debatin K. Sensitization for anticancer drug-induced apoptosis by betulinic acid. Neoplasis. 2005; 7(2): 162-170. ISSN 1476-5586. [CrossRef].
18. Zuco V, Supino R, Righetti SC, Cleris L, Marchesi E, Gambacorti-Passerini C et al. Selective cytotoxicity of betulinic acid on tumor cell lines, but not normal cells. Cancer Lett. 2002; 175(1): 17-25. [CrossRef] [PubMed].
19. Csuk R. Betulinic acid and its derivatives: a patent review (2008-2013). Expert Op Therap Paten. 2014; 24(8): 913-23. [CrossRef].
20. Almeida H. Métodos para o incremento da solubilidade de substâncias ativas pouco solúveis (BCS – Classe II). 126 f. Lisboa. 2009. Dissertação de Mestrado [em Farmacotecnia Avançada]. Universidade de Lisboa. Lisboa. 2009. [Link].
21. Leuner C, Dressman J. Improving drug solubility for oral delivery using solid dispersions. Euro J Pharm Bio. 2000; 50(1): 47-60. [CrossRef] [PubMed].
22. Babu VR, Areefulla SH, Mallikarjun V. Solubility and dissolution enhancement: An overview. J Pharm Res. 2010; 3(1): 141-145. ISSN 0974-6943. [Link].
23. Daman F, Blaton N, Naesens L, Balzarini J, Kinget R, Augustuns P et al. Physicochemical characterization of solid dispersions of the antiviral agent UC-781 with polyethylene glycol 6000 an Gelucire 44/14. Euro J Pharm Sci. 2000; 10(4): 311-322. [CrossRef].
24. Sethia S, Squillante E. Solid dispersions: revival with greater possibilities and applications in oral drug delivery. Crit Rev Therap drug Carrier Syst. 2003; 20(2-3): 215-247. [CrossRef].
25. Vasconcelos T, Sarmento B, Costa P. Solid dispersions as strategy to improve oral bioavailability of poor water-soluble drugs. Drug Discov Today. 2007; 12(23-24): 1068-1075. [CrossRef].
26. Nóbrega AB. Obtenção de um insumo farmacêutico ativo vegetal a partir de folhas de Eugenia florida DC para o desenvolvimento de um antitumoral. Niterói, 2017. 300 f. Tese de Doutorado [em Ciências Aplicadas a Produtos para Saúde] – Faculdade de Farmácia – Universidade Federal Fluminense, UFF, Niterói 2017. [Link].
27. Kumar D, Mallick S, Vedasiromon JR. Anti-leukemic activity of Dillenia indica L. fruit extract and quantification of betulinic acid by HPLC. Phytomedicine. 2010; 17(6): 431-435. [CrossRef] [PubMed].
28. INMETRO DOQ-CGCRE-008 Revisão 5: Instituto Nacional de Metrologia, Normalização e Qualidade Industrial. Orientações sobre Validação de Métodos de Ensaios Químicos, 2016.
29. USP33/NF27. General Chapter. Chemical tests / Dissolution. In: (Ed.) U.S. Pharmacopeia & National Formulary. United States Pharmacopea, 2010. [Link].
30. Marquiafável FS, Nascimento AP, Barud HS, Oliveira FM, Freitas LAP, Bastos JK et al. Development and characterization of a novel standardized propolis dry extract obtained by factorial design with high artepillin C content. J Pharm Tech Drug Res. 2015; 4(1): 1-13. [CrossRef].
31. Pereira SV, Colombo FB, de Freitas LAP. Ultrasound influence on the solubility of solid dispersions prepared for a poorly soluble drug. Ultrason Sonochem. 2015; 29: 461-469. [CrossRef].
32. Eloy JO, Saraiva J, de Albuquerque S, Marchetti JM. Solid Dispersion of Ursolic Acid in Gelucire 50/13: a Strategy to Enhance Drug Release and Trypanocidal Activity. AAPS Pharm Sci Tech. 2012; 13(4): 1436-1445. [CrossRef].
33. Raut DM et al. Dehydration of lactose monohydrate: analytical and physical characterization. Scholars Res Lib. 2011; 3(5): 202-212. ISSN 0975-5071. [Link].