Artigo Original
Estudo Químico e da Atividade Leishmanicida de Frações de Piper cabralanum C.DC. (Piperaceae)
Chemical Composition and Antileishmanial Activity from Fractions of Piper cabralanum C.DC. (Piperaceae)
Resumo
Folhas de Piper cabralanum C.DC. foram coletadas no Município de Teresópolis/RJ, em área particular próxima ao Parque Nacional da Serra dos Órgãos. O material vegetal foi seco em estufa a 40oC e, em seguida, submetido a extração com metanol por maceração estática. O extrato metanólico foi concentrado e particionado em solventes de diferentes polaridades, rendendo frações solúveis em n-hexano, diclorometano, acetato de etila e n-butanol. O extrato metanólico bruto e suas partições foram testadas em promastigotas de Leishmania amazonensis. Somente o extrato metanólico bruto e sua partição em n-hexano (PCA-Hex) mostraram boa atividade contra L. amazonensis (CE50 de 30 μg/ml e 25 μg/ml, respectivamente. Essa partição foi submetida à purificação por cromatografia em coluna com gel de sílica e posterior análise por cromatografia com fase gasosa acoplada à espectrometria de massas, o que possibilitou a caracterização de hidrocarbonetos, sesquiterpenos, esqualeno e uma mistura de esteróides (campesterol, estigmasterol e β-sitosterol).
- Unitermos:
- Piper cabralanum.
- Piperaceae.
- Atividade Leishmanicida.
- Hidrocarbonetos.
- Sesquiterpenos.
- Esteróides..
Abstract
Leaves from Piper cabralanum C.DC. were collected in the city of Teresópolis / RJ, in particular site near the National Park of Serra dos Órgãos. The plant material was dried and then subjected to extraction with methanol by static maceration. The obtained methanol extract was concentrated and subjected to liquid-liquid partition with solvents of different polarities, yielding fractions soluble in n-hexane, dichloromethane, ethyl acetate and n-butanol. The crude methanol extract and its partitions were tested in promastigotes of Leishmania amazonensis. Only the crude methanol extract and its partition obtained with n-hexane (PCA-Hex) showed high activity against promastigotes (IC50 value = 30 µg/ml and 25 µg/ml, respectively). This partition was subjected to purification by column chromatography with silica gel, and the resulting non-polar fractions were analyzed by gas chromatography coupled to mass spectrometry, which allowed the characterization of hydrocarbons, sesquiterpenes, squalene and a mixture of steroids (campesterol, stigmasterol and β-sitosterol).
- Key Words:
- Piper cabralanum.
- Piperaceae.
- Antileishmanial Activity.
- Hydrocarbons.
- Sesquiterpenes.
- Steroids..
Introdução
A família Piperaceae pertence à superordem Nymphaeiflorae, ordem Piperales (sensu Dahlgren, 1980), sendo formada por 5 gêneros (Piper, Peperomia, Pothomorphe, Ottonia e Sarcorhachis) e 1400 espécies que possuem distribuição cosmopolita, com boa representatividade na América Central e na América do Sul, ocorrendo principalmente no México, Panamá, Peru, Costa Rica e de Norte a Sul do Brasil até o Sudeste da Argentina (YUNKER, 1972; JOLY, 1985; DE CANDOLLE, 1886). A química de Piperaceae baseia-se, principalmente, nas substâncias isoladas de espécies dos gêneros Piper (amidas, lignanas, neolignanas, arilpropanóides, flavonóides, cromenos), entretanto, é descrita na literatura a ocorrência de metabólitos especiais interessantes em espécies dos gêneros Peperomia (derivados do ácido benzóico e seconeolignanas), Ottonia (amidas) e Pothomorphe (derivados catecólicos) (PARMAR et al., 1997; MOREIRA, 1999; VELOZO, 2004).
Investigações químicas de espécies dessa família realizadas pelo grupo possibilitaram o isolamento de diversas substâncias conhecidas e algumas inéditas, por exemplo, kaplanina, lhotzcromeno e blandacromenos I e II (MOREIRA et al., 1998; MOREIRA et al., 2000; VELOZO et al., 2006; VELOZO et al., 2009). A atividade biológica determinada para extratos, frações semi-purificadas e substâncias puras isoladas de Piperaceae do Estado do Rio de Janeiro mostra uma riqueza fantástica, principalmente em relação aos efeitos antiinflamatório e analgésico, depressor e estimulante do SNC, antimicrobiano, bactericida e citotóxico (MOREIRA et al., 2001; GUADALUPE-ROJAS, 1999; VELOZO, 2004). Cabe destacar, também, os resultados promissores já obtidos pelo grupo com a espécie Piper aduncum L., que levou ao isolamento de uma chalcona com importante atividade leishmanicida (TORRES-SANTOS et al., 1999a; TORRES-SANTOS et al., 1999b). A diversidade química de Piperaceae tem resultado na descoberta de relevantes atividades biológicas para extratos, frações e substâncias puras, o que justifica uma busca biomonitorada por novas substâncias. A realização de ensaios biológicos em espécies de Piperaceae, especificamente em testes leishmanicidas, constitui oportunidade ímpar para se purificar frações e isolar substâncias com grande potencial terapêutico para o tratamento dessa doença. As leishmanioses, cutânea e visceral, são doenças importantes sob o ponto de vista clínico e de saúde pública, especialmente no Brasil, para as quais não há vacina licenciada e o tratamento atual é insatisfatório, com altas taxas de toxidez e ineficácia (REMME et al., 2002; WHO, 2004).
Dando continuidade aos estudos fitoquímicos com espécies de Piperaceae do Estado do Rio de Janeiro, folhas de Piper cabralanum C.DC., uma espécie endêmica da Mata Atlântica, foram coletadas para um estudo químico e da atividade biológica. O extrato bruto metanólico das folhas e suas frações foram avaliados frente a formas promastigotas de Leishmania amazonensis. A fração mais ativa foi purificada por cromatografia em coluna, de acordo com técnicas tradicionais de isolamento e purificação.
Material e Métodos
Coleta e Identificação Botânica
Folhas da espécie Piper cabralanum C.DC. foram coletadas em Agosto de 2009, em área particular próxima ao Parque Nacional da Serra dos Órgãos, no município de Teresópolis, RJ. Uma exsicata foi preparada e enviada para identificação no Herbário do Jardim Botânico do Rio de Janeiro. A identificação foi feita pela especialista em Piperaceae, Dra. Elsie Franklin Guimarães, por comparação com material depositado no Herbário.
Preparação e Extração do Material Vegetal
O material vegetal foi seco em estufa a 40 oC, rendendo cerca de 400 g de folhas secas de P. cabralanum. Em seguida, o material seco foi submetido à extração com metanol por maceração estática. O extrato metanólico das folhas foi concentrado em evaporador rotatório sob pressão reduzida rendendo o extrato bruto metanólico (PCA-MeOH = 72,00 g) que foi, posteriormente, ressuspendido em solução de metanol:água 1:1, do qual se obtiveram quatro frações por partição líquido-líquido: (1) n-hexano (PCA-Hex = 16,00 g), (2) diclorometano (PCA-DCM = 13,58 g), (3) acetato de etila (PCA-AcOEt = 14,25 g) e (4) butanol (PCA-BuOH = 4,48 g). O resíduo aquoso final foi desprezado.
Purificação da Fração PCA-Hex
A fração em n-hexano (PCA-Hex, 16,00 g) foi purificada por cromatografia em coluna com gel de sílica, usando n-hexano, acetato de etila e metanol, como fases móveis, em gradientes de polaridade crescente. As frações provenientes da coluna foram agrupadas segundo perfil obtido por CCD.
Análise por Cromatografia com Fase Gasosa Acoplada à Espectrometria de Massas (CG-EM)
As frações iniciais da coluna (1 a 7 e 18) foram analisadas por CG-EM em aparelho Agilent 5890N, equipado com uma coluna DB-5 (25 m x 0,25μm x 0,30 mm), nas seguintes condições de análise: gradiente de temperatura de 60 oC a 240 °C, 3°C/min; hélio como gás de arraste a 1,0mL x min-1; temperatura do injetor a 270 oC; temperatura da fonte a 280 °C. As substâncias foram identificadas de acordo com seu perfil de fragmentação e por comparação a banco de dados.
Teste da Atividade Leishmanicida
Promastigotas de Leishmania amazonensis foram incubadas por 72 h na presença de concentrações variadas dos extratos a serem testadas (1 a 100 µM) a 26 ºC. A atividade leishmanicida foi avaliada colorimetricamente por ensaio com MTT ou Alamar Blue (TORRES-SANTOS et al. 1999a; GANGULY et al., 2005). Este teste foi feito em triplicata e o resultado representa o percentual médio de viabilidade celular ± desvio padrão.
Resultados e Discussão
Atividade Leishmanicida
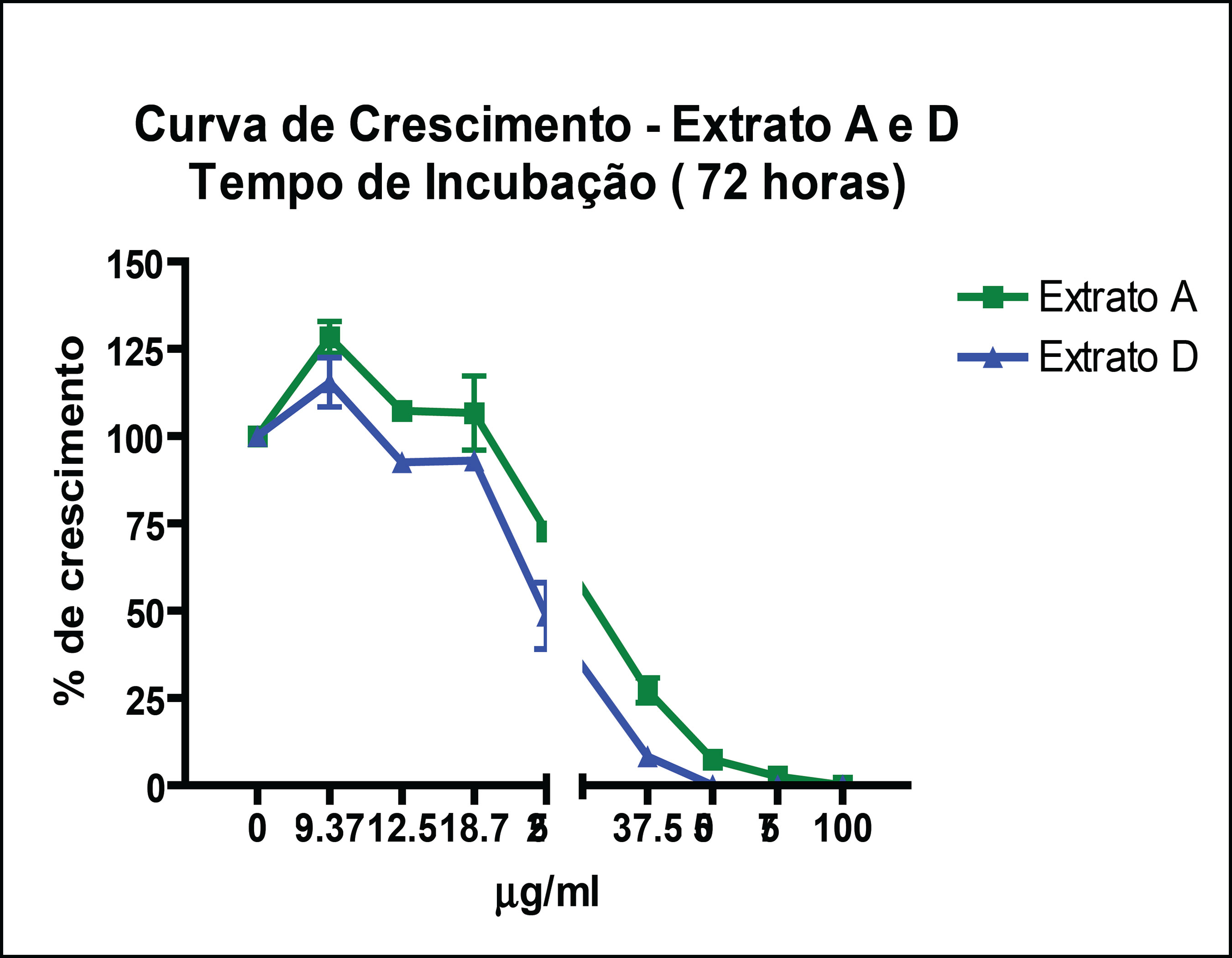
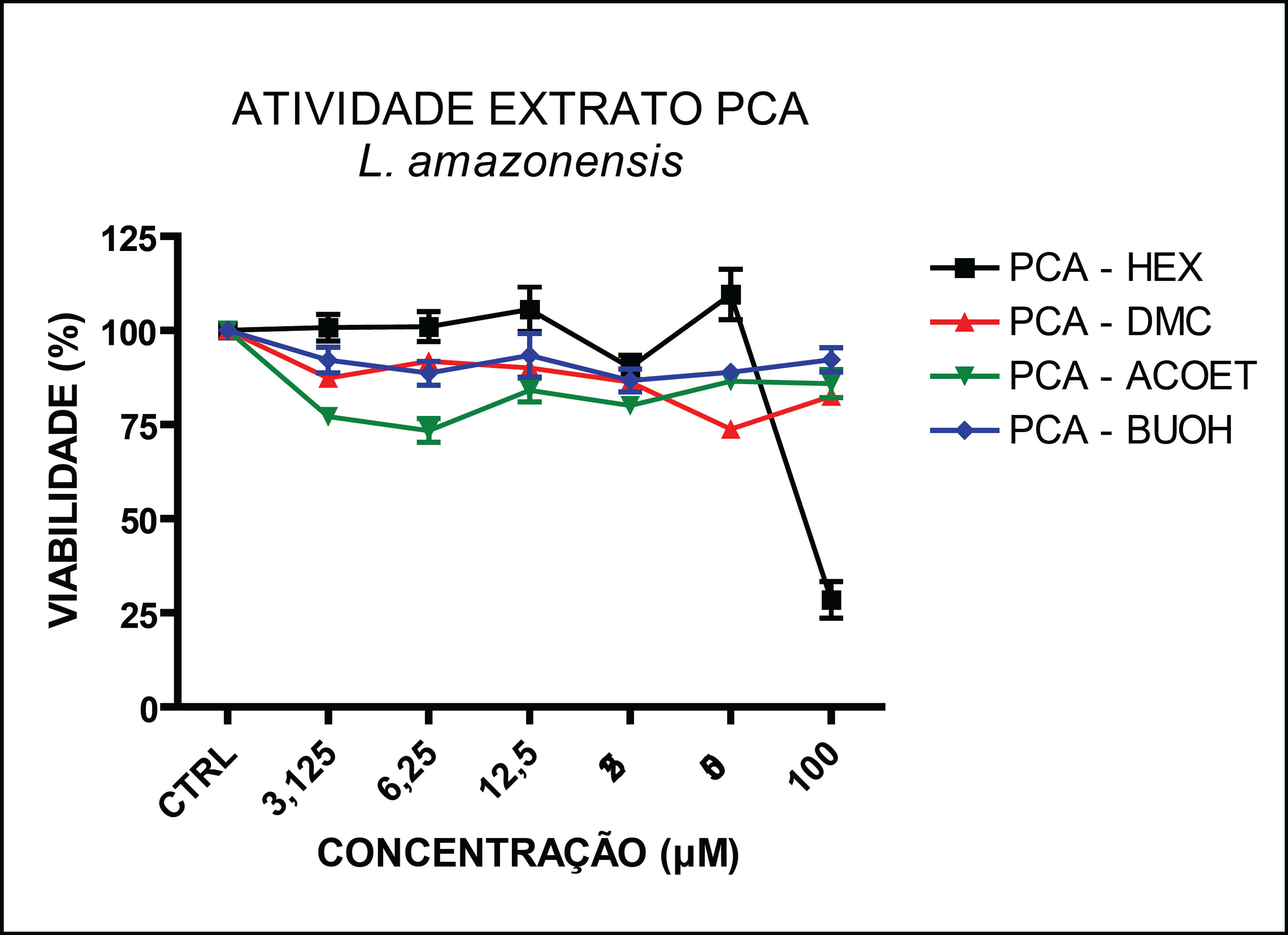
Os resultados obtidos permitiram verificar que somente o extrato bruto metanólico das folhas de Piper cabralanum (PCA-MeOH) e a partição em n-hexano deste extrato (PCA-Hex) mostraram atividade sobre Leishmania amazonensis, com CE50 de 30 μg/mL e 25 μg/mL, respectivamente (FIGURAS 1 e 2). As demais partições não apresentaram atividade leishmanicida significativa até a maior concentração avaliada (100 μg/mL). Uma vez que o extrato bruto metanólico (PCA-MeOH) representa uma fração com os principais constituintes da planta e que a atividade leishmanicida foi verificada apenas neste extrato e na partição hexânica (PCA-Hex), estando ausente nas demais, pode-se afirmar que substâncias apolares de P. cabralanum sejam as responsáveis pela atividade antiparasitária. As frações de baixa polaridade (PCA-Hex + PCA-DCM) renderam maior percentual extrativo (~ 7,5%). Em se tratando de substâncias com potencial leishmanicida, estas frações são promessas fitoquímicas, devido aos resultados leishmanicidas iniciais e ao relativo rendimento das frações apolares. Em estudos anteriores, Torres-Santos e cols. (1999a) descreveram a atividade leishmanicida da 2’,6’-diidroxi-4’-metoxichalcona, isolada de Piper aduncum L. (Piperaceae), com CE50 de 0,5 μg/mL e 24 μg/mL sobre promastigotas e amastigotas de L. amazonensis, respectivamente. Outros grupos também têm estudado a atividade leishmanicida de espécies de Piper. Hermoso e cols. (2003) correlacionaram a atividade leishmanicida de diidrochalconas isoladas de P. elongatum com derivados sintéticos. Mais recentemente, Sarkar e cols. (2008) demonstraram que a atividade leishmanicida do extrato etanólico de P. betle é devido à indução de apoptose no parasito. Os dados aqui apresentados, em conjunto com os encontrados na literatura, corroboram a relevância do estudo fitoquímico do gênero Piper para o desenvolvimento de novos fármacos para a leishmaniose.
Purificação da Fração PCA-Hex
Uma vez que PCA-Hex mostrou ser ativa contra Leishmania amazonensis, essa fração foi submetida à purificação em coluna de gel de sílica, usando n-hexano, acetato de etila e metanol como fases móveis, em gradientes de polaridade crescente. A cromatografia em coluna rendeu 77 frações que foram agrupadas segundo perfil obtido por CCD. As frações iniciais eluídas com n-hexano puro ou misturas de n-hexano e acetato de etila evidenciaram por CCD a presença de substâncias de baixa polaridade. As frações codificadas como 1 a 7 e 18 foram analisadas por CG-EM, o que permitiu a identificação de hidrocarbonetos na fração 1, 5 e 6; hidrocarbonetos e sesquiterpenos na fração 2 e 4; sesquiterpenos na fração 3; esqualeno na fração 7 e uma mistura de esteróides na fração 18 (TABELA 1). As frações codificadas como 1, 5 e 6 não se mostraram interessantes do ponto de vista fitoquímico, uma vez que mostraram somente hidrocarbonetos como componentes majoritários. A fração 2 mostrou-se rica em sesquiterpenos (48,55%), sendo o β-cariofileno identificado em maior percentual (25,35%), seguido de α-selineno (11,47%). A substância β-cariofileno possui inúmeras atividades biológicas, incluindo antiinflamatória, anestésica local, antimicrobiana e antioxidante (SHIMIZU et al., 1990; GHELARDINI et al., 2001; SAHIN et al., 2004). Recentemente, Santos e cols. (2008) demostraram a atividade do óleo de uma espécie de copaiba (Copaifera reticulata) contra Leishmania amazonensis. Os pesquisadores verificaram que a atividade da planta se deve, em parte, ao alto conteúdo do sesquiterpeno β-cariofileno (40,9%) presente no óleo. As frações 3 e 4 também mostraram a presença de sesquiterpenos com alto percentual relativo, sendo o guaiazuleno identificado como majoritário das duas frações (19,64% e 25,03%, respectivamente). Sesquiterpenos são substâncias amplamente distribuídas no Reino Vegetal, sendo abundantes em óleos essenciais de Piperaceae (SANTOS et al., 2001). Os sesquiterpenos com maior percentual relativo identificado nas frações analisadas (β-cariofileno, guaiazuleno e α-selineno) possuem como precursor imediato o pirofosfato de E,E-farnesila. Este mesmo precursor é o responsável pela biossíntese dos sesquiterpenos mais abundantes encontrados em óleos essenciais de espécies de Piperaceae da Mata Atlântica do Estado do Rio de Janeiro (SANTOS et al., 2001). A fração 7, após análise por CG-EM, mostrou a presença de esqualeno praticamente puro (91,73%). O esqualeno é uma substância natural precursora de triterpenos e esteróides, incluindo colesterol que está presente em tecidos animais. Esta substância possui inúmeras ações biológicas, com destaque para atividade antioxidante e inibidora do desenvolvimento de tumores (REDDY et al., 2009). Em Piperaceae, esteróides são mais comumente encontrados, enquanto triterpenos são raros (PARMAR, 1997; MOREIRA, 1999). Análise da fração 18 por CG-EM permitiu a identificação de uma mistura contendo campesterol (8.03%), estigmasterol (23.15%) e β-sitosterol (18.54%), além de hidrocarbonetos. A presença desses esteróides em extratos de Piperaceae tem sido descrita na literatura (PARMAR, 1997; MOREIRA, 1999; VELOZO, 2004). Avaliações anteriores da atividade leishmanicida de mistura contendo estigmasterol e β-sitosterol mostrou a baixa atividade desses esteróides em formas promastigotas e amastigotas de L. amazonensis (TORRES-SANTOS et al., 2004).
| Substância | TR (min) | % Relativo |
| Fração 1 | ||
| Undecano | 8,954 | 11,46 |
| Dodecano | 12,834 | 5,36 |
| Pentadecano | 25,296 | 5,19 |
| Hexadecano | 29,214 | 5,75 |
| Heptadecano | 32,955 | 5,92 |
| Octadecano | 36,521 | 3,95 |
| Nonacosano | 67,141 | 4,44 |
| Hexatriacontano | 72,934 | 4,94 |
| Fração 2 | ||
| Undecano | 8,954 | 5,64 |
| Dodecano | 12,834 | 3,58 |
| α -copaeno | 19,951 | 3,32 |
| E- β -cariofileno | 21,709 | 25,35 |
| α -selineno | 24,828 | 11,47 |
| α -Muroleno | 25,011 | 3,72 |
| δ -Cardieno | 25,787 | 4,69 |
| Fração 3 | ||
| α -Humuleno | 23,166 | 13,20 |
| Calameneno | 25,912 | 3,41 |
| Guaiazuleno | 31,667 | 19,64 |
| Fração 4 | ||
| α -selineno | 24,835 | 4,83 |
| Pentadecano | 25,296 | 3,20 |
| Hexadecano | 29,221 | 4,80 |
| Guaiazuleno | 31,666 | 25,03 |
| Heptadecano | 32,962 | 4,50 |
| Fração 5 | ||
| Nonadecano | 39,926 | 2,10 |
| Tetracosano | 54,861 | 2,38 |
| Hexacosano | 60,040 | 2,14 |
| Octacosano | 64,846 | 2,22 |
| Fração 6 | ||
| Eicosano | 43,177 | 1,83 |
| Tricosano | 52,117 | 1,79 |
| Tetracosano | 54,855 | 1,89 |
| Pentacosano | 57,498 | 2,25 |
| Hexacosano | 60,029 | 2,16 |
| Fração 7 | ||
| Esqualeno | 65,040 | 91,73 |
| Fracao 18 | ||
| Campesterol | 26.697 | 8.03 |
| Estigmasterol | 26.871 | 23.15 |
| β -Sitosterol | 27.332 | 18.54 |
| TR = Tempo de retenção obtido a partir das análises por CG-EM. Substâncias mais abundantes em negrito. | ||
O estudo da atividade biológica de frações de Piper cabralanum evidenciou que a fração em n-hexano é a responsável pelo efeito leishmanicida observado para o extrato bruto metanólico das folhas. Esta fração mostrou CE50 de 25μg/ mL sobre promastigotas de L. amazonensis. A purificação da fração ativa levou ao isolamento e caracterização de hidrocarbonetos, sesquiterpenos, esqueleno e de esteróides. Estes são os primeiros registros de atividade biológica e da composição química de Piper cabralanum C.DC.
Referências
DAHLGREN, A.M.T. A revised system of classification of the angiosperms. Botanical Linnean Society, v.80, p.91-124, 1985.
DE CANDOLLE, C. Piperaceae: In. Produmus Sistematis Naturalis Regni Vegetali (De Candolle, A.P., ed.), v.16, n.1, p.235-290, 1886.
GANGULY, S.; BANDYOPADHYAY, S.; SARKAR, A.; CHATTERJEE, M. Development of a semiautomated colorimetric assay for screening anti-leishmanial agents. Journal of Microbiological Methods, v.66, p.78-86, 2005.
GUADALUPE-ROJAS, M.; MOREIRA, D.L.; PEREIRA, N.A.; KAPLAN, M.A.C. Atividade antiinflamatória de extratos de Piper aduncum L. (Piperaceae). Revista Brasileira de Farmácia, v.80, p.5-6, 1999.
GHELARDINI, C.; GALEOTTI, N.; MANNELLI, L.C.; MAZZANTI, G.; BARTOLINI, A. Local anesthetic activity of β-caryophyllene. II Fármaco, v.56, p.387-389, 2001.
HERMOSO, A.; JIMENEZ, I.A.; MAMANI, Z.A.; BAZZOCCHI, I.L.; PINERO, J.E.; RAVELO, A.G.; VALLADARES, B. Antileishmanial activities of dihydrochalcones from Piper elongatum and synthetic related compounds. Structural requirements for activity, Bioorganic & Medicinal Chemistry, v.11, p.3975-3980, 2003.
JOLY, A.B. Introdução à Taxonomia Vegetal. Ed. Nacional, São Paulo, 1985.
MOREIRA, D. L.; GUIMARÃES, E. F.; KAPLAN, M. A. C. Non-Polar Constituents from Piper lhotzkyanum. Phytochemistry, v.49, n.5, p. 1054-1057, 1998.
MOREIRA, D.L. Aspectos químicos e farmacológicos de Piperaceae. Tese de doutorado, Núcleo de Pesquisas de Produtos Naturais, Universidade Federal do Rio de Janeiro, Rio de Janeiro, 1999, 147 pp.
MOREIRA, D.L.; GUIMARÃES, E.F.; KAPLAN, M.A.C. A C-glucosylflavone from Leaves of Piper lhotzkyanum. Phytochemistry, v.55, n.7, p.783-786, 2000.
MOREIRA, D.L.; CARDOSO, G.L.; SOUZA, P.O.; GUIMARÃES, E.F.; PEREIRA, N.A.; KAPLAN, M.A.C. Effect of Leaf Essential Oil from P. solmsianum C.DC. in Mice Behaviour, Anais da Academia Brasileira de Ciências. v.73, n.1, p.33-37, 2001.
PARMAR, V.S.; JAIN, S.C.; BISHT, K.S.; JAIN, R.; TANEJA, P.; JHA, A.; TYAGI, O.D.; PRASAD, A.K.; WENGEL, J.; OLSEN, C.E.; BOLL, P.M. Phytochemistry of the genus Piper. Phytochemistry, v.46, p.597-673, 1997.
REDDY, L.H.; COUVREUR, P. Squalene: A natural triterpene for use in disease management and therapy. Advanced Drug Delivery Reviews, v.61, p.1412-1426, 2009.
REMME, J.H.F.; BLAS, E.; CHITSULO, L.; DESJEUX, P.M.P.; ENGERS, H.D.; KANYOK, T.R.; KAYONDO, J.F.K.; KIOY, D.W.; KUMARASWAMI, V.; LAZDINS, J.K.; NUNN, P.P.; ODUOLA, A.; RIDLEY, R.G.; TOURE, Y.T.; ZICKER, F.; MOREL, C.M. Strategic emphases for tropical diseases research: a TDR perspective. Trends in Microbiology, v.10, n.10, p.435-440, 2002.
SANTOS, A.O.; UEDA-NAKAMURAB, T.; FILHO, B.P.D.; VEIGA JUNIOR, V.F.; PINTO, A.C.; NAKAMURA, C.V. Effect of Brazilian copaiba oils on Leishmania amazonensis. Journal of Ethnopharmacology, v.120, p.204-208, 2008.
SANTOS, P.R.D.; MOREIRA,D.L.; GUIMARÃES,E.F.; KAPLAN, M.A.C. Essential Oil Analysis of 10 Piperaceae species from the Brazilian Atlantic Forest. Phytochemistry, v.58, n.4, p. 547-551, 2001.
SARKAR, A.; SEN, R.; SAHA, P.; GANGULY, S.; MANDAL, G.; CHATTERJEE1, M. An ethanolic extract of leaves of Piper betle (Paan) Linn mediates its antileishmanial activity via apoptosis. Parasitology Research, v.102, n.6, p.1249-1255, 2008.
SAHIN, F.; GULLUCE, M.; DAFERERA, D.; SOKMEN, A.; SOKMEN, M.; POLISSIOU, M.; AGAR, G.; OZER, H. Biological activities of the essential oils and methanol extract of Origanum vulgare spp. in the Eastern Anatolia region of Turkey. Food Control, v.15, p.549-554, 2004.
SHIMIZU, M.; SHOGAWA, H.; MATSUZAWA, T.; YONEZAWAS, S.; HAYASHI, T.; ARISAWA, M.; SUZUKI, S.; YOSHIZAKI, M.; MORITA, N. Anti-inflamatory constituents of topically applied crude drugs. IV. Constituents and inflammatory effect of Paraguayan crude drug “Alhucema” (Lavandula latifolia Vill.). Chemical and Pharmaceutical Bulletin, v.38, p.2283-2284, 1990.
TORRES-SANTOS, E.C.; MOREIRA, D.L.; KAPLAN, M.A.C.; MEIRELLES, M.N.L.; Rossi-Bergmann, B. Selective effect of 2’,6’-dihydroxy-4’-methoxychalcone isolated from Piper aduncum on Leishmania amazonensis. Antimicrobial Agents and Chemotherapy, v.43, n.5, p.1234-1241, 1999a.
TORRES-SANTOS, E.C.; RODRIGUES-JR J.M.; MOREIRA, D.L.; KAPLAN, M.A.C.; ROSSI-BERGMANN, B. Improvement of in vitro and in vivo antileishmanial activities of 2’,6’-dihydroxy-4’-methoxychalcone by entrapment in poly(d,l-lactide) nanoparticles. Antimicrobial Agents and Chemotherapy, v.43, n.7, p. 1776-1778, 1999b.
TORRES-SANTOS, E.C.; LOPES, D.; OLIVEIRA, R.R.; CARAUTA, J.P.P.; FALCAO, C.A.B.; KAPLAN, M.A.C.; ROSSI-BERGMANN, B. Antileishmanial activity of isolated triterpenoids from Pourouma guianensis. Phytomedicine, v.11, p.114-120, 2004.
VELOZO, L.S.M. Química e Atividade Biológica de Piperacea Brasileiras, Tese de Doutorado, Núcleo de Pesquisas de Produtos Naturais, Universidade Federal do Rio de Janeiro, Rio de Janeiro, 2004, 200pp.
VELOZO, L.S.M.; FERREIRA, M.J.P.; SANTOS, M.I.S.; MOREIRA, D.L.; EMERECIANO, V.P.; KAPLAN, M.A.C. Unusual chromenes from Peperomia blanda. Phytochemistry, v.67, p.492-496, 2006.
VELOZO, L.S.M.; FERREIRA, M.J.P.; SANTOS, M.I.S.; MOREIRA, D.L.; GUIMARÃES, E.F.; EMERENCIANO, V.P.; KAPLAN, M.A.C. C-glycosyl flavones from Peperomia blanda. Fitoterapia. v.80, p.119-122, 2009.
YUNKER, T.G. The Piperaceae of Brazil, Hoehnea, v. 2, p. 19-366, 1972.
WHO: WORLD HEALTH ORGANISATION, 2004. Leishmaniasis. Disponível em: http://www.who.int/tdr/diseases/default.htm. Acesso em 10/03/2010.