Artigo de Pesquisa
Ontogenia das cavidades secretoras de onze espécies de Myrtaceae
Ontogeny of the secretory cavities of eleven Myrtaceae species
Resumo
Cavidades secretoras são constantemente citadas entre espécies da família Myrtaceae. As cavidades secretoras possuem origens diversas, podendo ser oriundas do afastamento de células (esquizógena), de morte celular programada (lisígena) ou da combinação destes dois processos (esquizolisígena). Este trabalho descreve a ontogenia das cavidades presentes nas folhas de onze espécies da família Myrtaceae. Foram utilizados ápices vegetativos de espécimes ocorrentes na região dos municípios de Itutinga e Sete Lagoas, Minas Gerais. As amostras foram fixadas em FAA70, estocadas em etanol 70%, desidratadas em série etílica e incluídas em metacrilato. Cortes transversais e longitudinais de 6 a 8 µm de espessura foram obtidos em micrótomo rotativo de avanço automático. Os cortes foram corados com Azul de Toluidina para caracterização estrutural. Lâminas permanentes foram montadas com resina sintética. As cavidades apontam para uma origem no meristema fundamental, apresentando paredes finas e citoplasma denso, e com intensa atividade de divisão celular, originando de forma precoce o epitélio secretor com células caracteristicamente achatadas. O afastamento das células no interior da cavidade ocorre conseguinte à formação do epitélio secretor. Ao final do processo de formação, as cavidades passam por um evento de apoptose, em que células do seu interior são degradadas, caracterizando a esquizolisigenia.
- Palavras-chave:
- Anatomia.
- Araçá.
- Epitélio secretor.
- Esquizolisigena.
Abstract
Secretory cavities are mentioned among species of the Myrtaceae family. The secretory cavities have different origins, which may be due to the separation of cells (schizogeny), programmed cell death (lysigeny) or the combination of these two processes (schizolysigeny). This work describes ontogeny of the leaves cavities of eleven species of the Myrtaceae family. Vegetative apexes of specimens occurring in the region of the municipalities of Itutinga and Sete Lagoas, Minas Gerais, were used. The samples were fixed in FAA70, dehydrated in an ethanol series and included in methacrylate. Transverse and longitudinal sections were obtained in a rotary microtome and stained with Toluidine Blue. Permanent slides were mounted with synthetic resin. The cavities point to an origin in the fundamental meristem, with thin walls and dense cytoplasm, and with intense cell division activity, originating the secretory epithelium with characteristically flat cells at an early stage. The separation of cells within the cavity occurs simultaneously to the formation of the secretory epithelium. At the end of the formation process, the cavities undergo an apoptosis event, in which cells inside are degraded, characterizing schizogenous process.
- Keywords:
- Anatomy.
- Arrack.
- Secretory epithelium.
- Schizolisigena.
Introdução
Estruturas secretoras são encontradas em diversas famílias vegetais (Angiospermas e Gimnospermas)[1]. São utilizadas como caráter taxonômico devido a posição que ocupam nas espécies e variedades em que ocorrem, além disso apresentam variação conforme a sua morfologia, anatomia e natureza da secreção[2-12].
São observados diversos tipos de estruturas secretoras, as quais podem estar localizadas em diferentes regiões na planta[13]. Sobre a superfície dos órgãos vegetais, estão situados os tricomas[13], nas axilas dos primórdios foliares e interpeciolar são observados os coléteres[14], já internamente temos as cavidades, ductos, idioblastos e laticíferos[13].
A presença de estruturas secretoras em plantas pode estar relacionada a fatores de adaptação e sobrevivência de espécies em seu ambiente[3]. Além disso é utilizada na taxonomia de espécies, em decorrência da composição química do exsudato e da posição que ocupam dentro do corpo do vegetal[2].
Dentre os tipos de estruturas secretoras às cavidades secretoras são as que apresentam lume esférico ou ovóide[3], delimitados por células secretoras especializadas, que podem ter origem esquizógena (por afastamento das células)[4], lisígena (morte celular programada)[15] ou esquizolisígena, ou seja, resultado da combinação dos dois processos anteriores descritos[4,16,17].
A família Myrtaceae é composta por aproximadamente 142 gêneros e 6.009 espécies, colocando-a como a maior família da ordem Myrtales[18]. No Brasil, a família Myrtaceae é formada por 23 gêneros e 1.026 espécies[19].
A presença de cavidades secretoras é considerada como uma característica marcante para espécies pertencentes à família Myrtaceae[2,20,21]. Estas sintetizam e/ou acumulam substâncias químicas de composição variada, sendo os óleos essenciais apresentando interesse econômico principalmente na indústria (cosméticos, aromatizantes, medicamentos, perfumes, antimicrobiana dentre outros) e ecológico como para de atração de polinizadores e proteção contra predadores[22,23].
Em trabalhos presentes na literatura, relatam que as cavidades secretoras encontradas em espécies da família Myrtaceae, apresentam desenvolvimento de origem esquizógena[2,3,5, 24-26]. Porém, outros estudos realizados com diferentes gêneros e espécies da família Myrtaceae, identificaram o desenvolvimento esquizolisígeno para estas estruturas[5,27-29].
Esta variação de registros referentes a origem de formação das cavidades secretoras é decorrente ao pouco estudo sobre o desenvolvimento destas estruturas, ambos padrões podem ocorrer[21]. Desta forma, existe a necessidade de estudos que envolvem a anatomia detalhada destas estruturas secretoras, principalmente por estas se localizarem internamente nas plantas[7].
Neste contexto, o presente trabalho visa contribuir para o conhecimento do padrão de desenvolvimento das cavidades secretoras presentes nos ápices vegetativos de espécimes da família Myrtaceae pertencentes aos gêneros Campomanesia, Eugenia, Myrcia, Myrciaria e Psidium.
Material e Métodos
Para realização das análises ontogênicas, foram coletados ápices vegetativos de onze espécies pertencentes a cinco gêneros da família Myrtaceae, ocorrentes nos municípios de Itutinga e de Sete Lagoas, Minas Gerais, Brasil, conforme apresentados na TABELA 1.
As amostras foram encaminhadas ao Laboratório de Anatomia Vegetal da Universidade Federal de São João Del-Rei, campus Sete Lagoas, para a confecção de lâminas dos primórdios foliares e preparação de seus respectivos vouchers, incorporados ao acervo do Herbário da Universidade Federal de Viçosa (Herbário VIC).
| Espécies | Georreferenciamento | Local de Coleta | N° registro (VIC) |
| Campomanesia sp. | 21°15'15"S e 44°41'21"W | Itutinga, MG2 | 48.721 |
| Eugenia dysenterica (Mart.) DC. | 19°28'30"S e 44°11'50"W | Sete Lagoas, MG1 | 48.717 |
| E. uniflora L. | 21°15'56"S e 44°41'40"W | Itutinga, MG2 | 48.712 |
| Myrciaria glazioviana (Kiaersk.) G.M.Barroso ex Sobral | 21°16'25"S e 44°40'49"W | Itutinga, MG2 | 48.719 |
| Myrcia multiflora (Lam.) DC. | 21°15'11"S e 44°41'15"W | Itutinga, MG2 | 48.715 |
| M. tomentosa (Aubl.) DC. | 21°15'50"S e 44°41'10"W | Itutinga, MG2 | 48.718 |
| Psidium cattleianum Afzel. ex Sabine | 21°16'26"S e 44°40'48"W | Itutinga, MG2 | 48.714 |
| P. guajava L. | 19°28'30"S e 44°11'40"W | Sete Lagoas, MG1 | 48.720 |
| P. gradifolium Mart. ex DC. | 21°15'16"S e 44°41'22"W | Itutinga, MG2 | 48.722 |
| P. guineense Sw. | 21°15'28"S e 44°41'14"W | Itutinga, MG2 | 48.713 |
| P. laruotteanum Cambess. | 19°28'32"S e 44°11'56"W | Sete Lagoas, MG1 | 48.716 |
| Legenda: 1campus de Sete Lagoas da UFSJ; 2Propriedade rural localizada na cidade de Itutinga, MG. | |||
Os ápices vegetativos das diferentes espécies foram fixados em FAA 70 (formalin, glacial acetic acid, ethanol 70%, 1:1:18 por volume) e estocadas em etanol 70%[30]. Desidratadas em álcool etílico e incluídas em metacrilato (Historesin, Leica Instruments, Heidelberg, Alemanha). Obteve-se cortes transversais e longitudinais com espessura de 6-8 µm, por meio micrótomo rotativo de avanço automático (Carl Zeiss RM55), sendo corados com Azul de Toluidina, pH 4,0. Para montagem das lâminas permanentes, utilizou-se resina sintética (Permount®, Fisher)[30].
A captura de imagens foi realizada com o auxílio de câmera (modelo AxioCam ERc5s, Zeiss) acoplada ao microscópio óptico trinocular (Carl Zeiss, Alemanha), com projeções de escalas micrométricas.
Resultados e Discussão
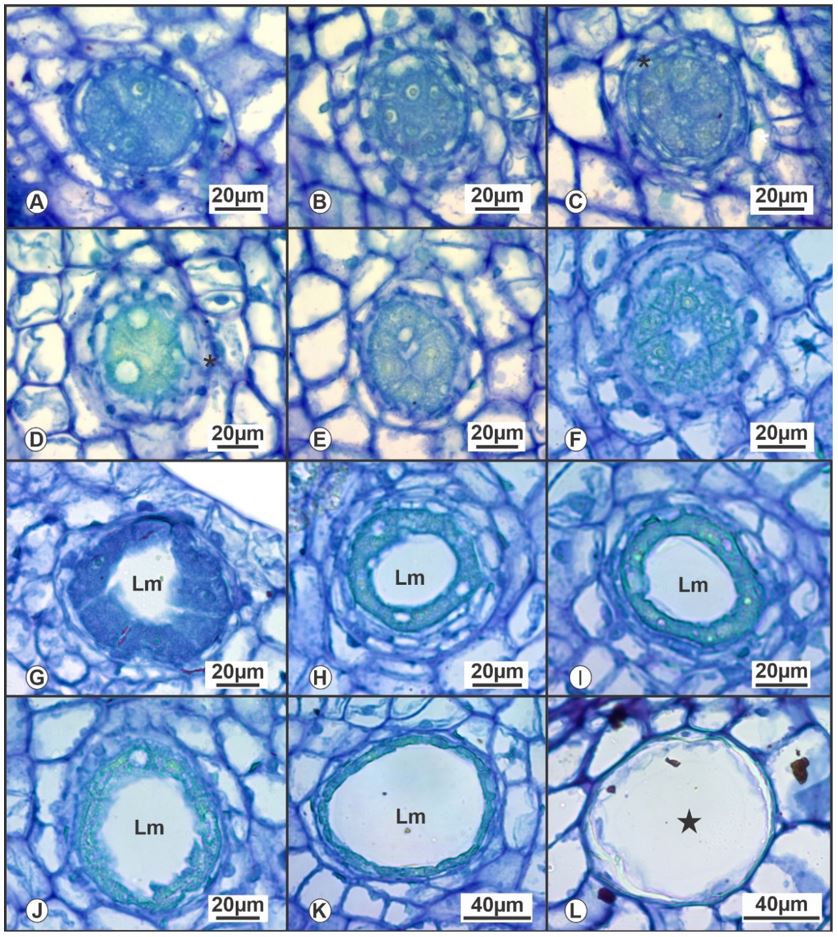
As cavidades secretoras das onze espécies dos cinco gêneros estudados apresentam padrão de desenvolvimento esquizolisígeno com desenvolvimento semelhante em todas as espécies como representado no desenvolvimento da cavidade secretora em Myrcia tomentosa (FIGURA 1 A-L). Quando totalmente formadas, as cavidades secretoras, são compostas por um epitélio secretor unisseriado e pelo lúmen, o qual apresenta formato esférico e que será acumulado a secreção produzida (FIGURA 1 L).
Perante o desenvolvimento das cavidades, estas aparentam se originar de células do meristema fundamental (FIGURA 1 A-B). Seu citoplasma se apresenta de forma densa, a qual inicialmente realizam divisões periclinais e anticlinais até resultar em um aglomerado de células esférico ou oval, as quais se diferenciam de outras células meristemáticas circundantes (FIGURA 1 A-B).
Durante o processo de intensa divisões celulares, observa-se a originação precoce do epitélio secretor com células distintamente achatadas (FIGURA 1 C-D). Ao passo que estas tangenciam o desenvolvimento das células do interior da cavidade.
Após a formação do epitélio secretor, ocorre o processo esquizógeno, por meio do afastamento das células do interior da cavidade (FIGURA 1 E-I). Neste processo inicia-se a formação do lume, o qual aumenta gradativamente a abertura do lume (FIGURA 1 E-J). À medida que se observa a maturação da cavidade decorrente do aumento do lume proveniente do processo esquizógeno, ao final, células remanescentes se degradam, por meio do processo de "lise", propiciando que no interior das cavidades seja acumulados o material secretado em seu interior (FIGURA 1 J-L). Ao final do processo de formação das cavidades, existe então a combinação dos dois processos, sendo inicialmente observado o afastamento celular (esquizógeno) e ao final o de morte celular (lisígeno), culminando assim no padrão esquizolisígeno de desenvolvimento das cavidades secretoras das espécies estudadas.
O epitélio secretor apresenta-se de forma unisseriada com células achatadas, que se alongam concentricamente e delimitam o lúmen. Ao final do desenvolvimento, observa-se o acúmulo de material de natureza não investigada neste estudo.
Observou-se para alguns espécimes em estudo, a ocorrência de células epidérmicas associadas as cavidades secretoras. Estas são denominadas células de cobertura ou de teto, observando-se uma ou duas células unisseriadas. A ocorrência destas, é observada nas cavidades que principalmente para as subdérmicas (FIGURA 1 L).
Poucos são os estudos de ontogenia de cavidades secretoras em Myrtaceae dado o grande número de representantes desta família. O presente estudo mostra que o desenvolvimento das cavidades secretoras das onze espécies, pertencentes à família Myrtaceae estudadas, apresentam origem esquizolisígena. O que corrobora com o observado na literatura, para outras espécies da família, como Melaleuca alternifolia[27]; Eugenia pyriformis[28] e Myrtus communis[5] e Campomanesia xanthocarpa[29].
Desenvolvimento esquizolisígeno das cavidades secretoras é relatado não somente para Myrtaceae como também para outras famílias botânicas, como, Anacardiaceae[16], Hypericaceae[4], Rutaceae[17] e Primulaceae[12].
Além disso, as características citológicas das células epiteliais, observadas são comuns para cavidades presentes em outras famílias, como Asteraceae[15], Anacardiaceae[16] e Salicaceae[7].
A presença de epitélio secretor, delimitando o lúmem, em que posteriormente após a maturidade serão acumulados e armazenados a secreção, são características de cavidades secretoras[3,13]. A observação de lúmem de formato esférico em corte longitudinal, diferencia as cavidades de ductos, pois, as cavidades o lúmen pode ser mais ou menos esférico, já nos ductos este se apresenta com o lúmen alongado[3].
Existe na literatura, controvérsias perante o tipo de formação das cavidades secretoras de Myrtaceae. As glândulas secretoras presentes nos tecidos vegetais podem ser resultado da desintegração celular (lisígenas) ou de sua separação celular (esquizógena)[21]. Este mesmo autor, relata que alguns autores classificam as cavidades secretoras das Myrtaceae como tendo origem lisígena, já outros, classificam-nas como esquizógenas. Porém com o presente estudo e de outros autores como já citado neste trabalho, descreve como a formação destas estruturas perante a combinação dos dois processos[21].
Em todas as espécies analisadas, tais estruturas são formadas muito cedo, durante o desenvolvimento do ápice vegetativo, podendo estar contidas tanto nos pecíolos como também nas folhas. Como observado ao final da fase de desenvolvimento das cavidades, estas já apresentam material acumulado, propiciando uma proteção biológica para as plantas. Em estudos com as estruturas secretoras em Primulaceae[12] observaram que as cavidades secretoras para diferentes espécimes de diferentes gêneros, estas são formadas durante o desenvolvimento foliar, sendo iniciado seu processo secretório antes que se tenha o desenvolvimento completo das folhas, fato este que segundo os autores pode estar relacionado o papel proteção da planta contra patógenos e herbívoros[12].
A natureza deste não foi investigada, porém, são citados na literatura que este material é composto principalmente de óleos essenciais[23].
Conclusão
Embora haja relatos de desenvolvimento esquizógeno e lisígeno das cavidades em Myrtaceae, o presente estudo demostra que o desenvolvimento das cavidades secretoras em onze espécies pertencentes a cinco gêneros desta família, ocorre por esquizolisigenia. Dado o grande número de representantes da família, estudos focados em ontogenia são necessários para se estabelecer padrões de desenvolvimento desta, importante, estrutura secretora em Myrtaceae.
Agradecimentos
À Universidade Federal de São João Del-Rei, campus Sete Lagoas pelo apoio. O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001.
Referências
1. Metcalfe CR, Chalk L. Anatomy of the Dicotyledons. vol. 2, Oxford: Clarendon Press, Oxford, 1957. 557p. ISBN: 9780198543831.
2. Solereder H. Systematic anatomy of the Dicotyledons. Oxford: Clarendon Press, v.1, 1908. p.350-355.
3. Fahn A. Secretory tissues in plants. London: Academic Press, 1979. 302p. ISBN: 0122476506.
4. Ciccarelli D, Andreucci AC, Pagni AM. Translucent glands and secretory canals in Hypericum perforatum L. (Hypericaceae): morphological, anatomical and histochemical studies during the course of ontogenesis. Ann Bot. 2001; 88(4): 637-644. ISSN 0305-7364 [CrossRef].
5. Kalachanis D, Psaras GK. Struture and development of the secretory cavities of Myrtus communis leaves. Biol Plant. 2005; 49(1): 105-110. ISSN 1435-8603. [CrossRef].
6. Cury G, Appezzato-da-Glória B. Internal secretory spaces in thickened underground systems of Asteraceae species. Aust J Bot. 2009; 57(3): 229-239. ISSN 0067-1924. [CrossRef].
7. Thadeo M, Meira RMSA, Azevedo AA, Araújo JMD. Anatomia e histoquímica das estruturas secretoras da folha de Casearia decandra Jacq. (Salicaceae). Rev Bras Bot. 2009; 32(2): 329-338. ISSN 0100-8404. [CrossRef].
8. Gomes SMA, Lombardi JA. Leaf anatomy as a contribution to the taxonomy of Salacioideae N.Halle´ ex Thorne & Reveal (Celastraceae). Plant Syst Evol. 2010; 289 (2): 13-33. ISSN 21996881. [CrossRef].
9. Tullii CF, Miguel EC, Lima NB, Fernandes KVS, Gomes VM, Cunha M. Characterization of stipular colleters of Alseis pickelii. Botany. 2013; 91(6): 403-413. ISSN 1480-3305. [CrossRef].
10. Machado SR, Teixeira SP, Rodrigues TM. Bacterial leaf glands in Styrax camporum (Styracaceae): first report for the family. Botany. 2014; 92(5): 403-411. ISSN 1480-3305. [CrossRef].
11. Fernandes VF, Thadeo M, Dalvi VC, Marquete R, Silva JXB, Pereira LJ et al. How to distinguish cavities from ducts in Casearia Jacq. (Salicaceae): Anatomical characterization and distribution. Flora. 2018; 240: 89-97. ISSN 0367-2530. [CrossRef].
12. Luna BN, Freitas MDF, Barros CF. Diversidade de estruturas secretoras de folhas em cinco gêneros neotropicais de Primulaceae: aspectos ecológicos e significado evolutivo. Botany. 2018; 97(1): 35-51. ISSN 1480-3305. [CrossRef].
13. Evert RF. Esau's Plant anatomy. Meristems, cells, and tissues of the plant body – their structure, function, and development. 3ª ed. New Jersey: Wiley, 2006. 624p. ISBN: 978-0-471-73843-5.
14. Paiva PSK, Teófilo FBS, Lima AKM, Cordoba BV, Miguel TBAR, Castro ME. Ontogenesis and secretion mechanism of Morinda citrifolia L. (Rubiaceae) colleters. S Afr. 2019; 121: 26-33. ISSN 1816-496X. [CrossRef].
15. Monteiro WR, de Moraes Castro M, Fahn A, Caldeira W. Observations on the development of the foliar secretory cavities of Porophyllum lanceolatum (Asteraceae). Nord J Bot. 1995; 15(1): 69-76. ISSN 1756-1051. [CrossRef].
16. Machado SR, Carmello-Guerreiro SM. Estrutura e desenvolvimento de canais secretores em frutos de Schinus terebentifolius Raddi (Anacardiaceae). Acta bot bras. 2001; 15(2): 189-195. ISSN 1677-941X. [CrossRef].
17. Bennici A, Tani C. Anatomical and ultrastructural study of the secretory cavity development of Citrus sinensis and Citrus limon: evaluation of schizolysigenous ontogeny. Flora. 2004; 199(6): 464-475. ISSN 0367-2530. [CrossRef].
18. WCSP - World Checklist of Selected Plant Families. Royal Botanic Gardens, Kew. [Link].
19. BFG - The Brazil Flora Group. Brazilian Flora 2020: innovation and collaboration to meet Target 1 of the Global Strategy for Plant Conservation (GSPC). Rodriguésia. 2018; 69(4): 1513-1527. ISSN 2175-7860. [CrossRef].
20. Fontenelle JB, Costa CG, Machado RD. Foliar anatomy and micromorphology of eleven species of Eugenia L. (Myrtaceae). Bot J Linn Soc. 1994; 115(2): 111-133. ISSN 0024-4074. [CrossRef]
21. Coneglian IRM. Morfoanatomia de ovário, pericarpo e semente de sete espécies de Myrteae DC. (Myrtaceae). 166 fs. 2011. Botucatu. Tese de Doutorado [Programa de Pós-Graduação em Ciências Biológicas (Botânica)] Instituto de Biociências de Botucatu - Universidade Estadual Paulista "Júlio de Mesquita Filho", UNESP, Botucatu, SP. 2011. [Link].
22. Pires CH, Paula JAMD, Tresvenzol LMF, Ferri PH, Fiuza TDS, Bara MTF. Composição química e atividade antimicrobiana dos óleos essenciais das folhas e flores de Callistemon viminalis (sol. ex Gaertn.) G. Don ex. Loudon (Myrtaceae). Rev Ciên Farm Bas Apl. 2013; 34(4): 597-601. ISSN 1808-4532. [Link].
23. Victório CP, Azevedo AC, Silveira EGP, Souza MC, Sato A, Gama PE et al. Leaf essential oils and volatiles, histochemistry and micromorphology of Neomitranthes obscura (DC.) N. Silveira (Myrtaceae) growing in sandy coastal plains of Rio de Janeiro. Biochem Syst Ecol. 2018; 78: 66-76. ISSN 0305-1978. [CrossRef].
24. Paula JA, Paula JR, Bara MT, Rezende MH, Ferreira HD. Pharmacognostic study about Pimenta pseudocaryophyllus (Gomes) L.R. Landrum leaves-Myrtaceae. Rev Bras Farmacogn. 2008; 18(2): 265-278. ISSN 0102-695X. [CrossRef].
25. Retamales HA, Scherson R, Scharaschkin T. Foliar micromorphology and anatomy of Ugni molinae Turcz. (Myrtaceae), with particular reference to schizogenous secretory cavities. Rev Chil Hist Nat. 2014; 87(1): 27. ISSN 0716-078X. [CrossRef].
26. Retamales HA, Cabello A, Serra MT, Scharaschkin T. Leaf micromorphology and anatomy of Myrceugenia rufa (Myrtaceae): An endemic coastal shrub of north-central Chile. Gayana Bot. 2015; 72(1): 76-83. ISSN 0016-5301. [CrossRef].
27. List S, Brown PH, Walsh KB. Functional anatomy of the oil glands of Melaleuca alternifolia (Myrtaceae). Aust J Bot. 1995; 43(6): 629-641. ISSN 0067-1924. [CrossRef].
28. Lorca GG, Amat AG, Gonzalez C. Análisis comparativo de caracteres diagnósticos para la identificación de tres especies argentinas de Myrtaceae empleadas en la medicina popular. Acta Farm Bon. 1995; 14(2): 81-86. ISSN 0326-2383. [Link].
29. Gogosz AMG, Cosmo NL, Bona C, Souza LA. Morfoanatomia da plântula de Campomanesia xanthocarpa O. Berg. (Myrtaceae). Acta Bot Bras. 2010; 24(3): 613-623. ISSN 1677-941X. [CrossRef]
30. Johansen DA. Plant microtechnique. London: McGraw Hill, 1940. 523p. ISBN: 9780011854670.