Artigo Original
Estudo Anatômico em Folhas de Lepechinia speciosa (A. St.- Hil. ex. Benth) Epling
Anatomical study of the leaf of Lepechinia speciosa (A. St.- Hil. ex. Benth) Epling
Resumo
A fitoterapia no Brasil foi retomada durante as décadas 70 e 80 e tem fornecido um incremento nas pesquisas de novas drogas de origem vegetal. Neste contexto, a família Lamiaceae, com 500 espécies distribuídas em 28 gêneros nativos do Brasil, despertou interesse em pesquisadores, impulsionados pelas evidências médicas do potencial de suas espécies. Lepechinia speciosa é uma espécie endêmica dessa família, com atividade antimicrobiana comprovada do seu óleo essencial. Entretanto, até o momento, não há descrição das suas características anatômicas, essencial para identificação das fontes das substâncias secretadas, permitindo aplicação terapêutica em fitoterapia. Com o objetivo de fornecer subsídios para os estudos farmacognósticos de L. speciosa, a caracterização anatômica foliar foi realizada com folhas plenamente expandidas, coletadas de um único indivíduo. Procederam-se em seguida a dissociação da epiderme e os cortes transversais seriados de 5 μm do ápice, nervura principal, bordo e pecíolo, que foram impregnados e emblocados em parafina histológica. Foram usados corantes específicos. Em vista frontal, a epiderme adaxial é formada por células poliédricas, com paredes anticlinais retas e espessadas; estômatos anisocíticos e tricomas tectores ramificados, pluricelulares e tricomas capitados simples ou pluricelulares. A epiderme abaxial é composta de células com paredes anticlinais sinuosas, abundância de tricomas ramificados ou simples pluricelulares; estômatos anomocíticos, anisociticos e paracíticos. Mesofilo dorsiventral. Pecíolo cilíndrico, com sulco central na região proximal, com 4 feixes vasculares colaterais e um feixe central amplo em forma de arco. Nervura principal proeminente na face abaxial, com cutícula fina; feixe vascular colateral em forma de arco, com terminações anficrivais. Bordo revoluto, com grandes rugosidades, onde é possível visualizar os feixes vasculares.
- Unitermos:
- Lepechinia speciosa. Lamiaceae.
- Anatomia Foliar.
- Plantas Medicinais ..
Abstract
Phytotherapy has been retaken in Brazil during the 70’s and 80’s, and has provided an increment in the search for new drugs of plant origin. In that context, the family Lamiaceae with 500 species distributed in 28 genera native to Brazil, aroused interest of researchers, led by medical evidence of the potential of some of its species. Lepechinia speciosa is an endemic species of this family, with antimicrobial proven effectiveness of its essential oil. Nevertheless, until now there is no work providing the description of its anatomical characteristics, which is essential to identify the sources of substances secreted to allow the therapeutic application in phytotherapy. With the aim of providing subsidies for this species pharmacognostic study, the anatomical characterization of L. speciosa leaves was carried out from extended leaves collected from a single individual. Epidermal dissociation and serial transverse sections of 5 μm from apex, main vein, board and petiole prepared in histological paraffin blocks were obtained. Specific staining reactive was used. In the frontal view of the epidermis, the upper surface consists of polyhedral cells, anticlinal walls straight and thick, anysocytic stomata, branched, pluricellular tector trichomes, or simple, pluricellular and capitate. Down surface epidermis composed of cells with sinuous anticlinal walls, abundance of branched or simple pluricellular trichomes; stomata of anomocytic, anysocytic and paracytic types. Mesophyll dorsiventral. Petiole cylindrical, with central sulcus in the upper region, with 4 collateral vascular bundles and one large arc-shaped central bundle. Main prominent vein on the abaxial surface with little thicker cuticle; vascular colateral bundle arch-shaped, with anficrival ends. Rondure board, with large elevations (roughness), where it is possible to visualize the vascular bundles.
- Key Words:
- Lepechinia speciosa; Lamiaceae.
- Leaf Anatomy.
- Medicinal Plants ..
Introdução
Lepechinia speciosa é descrita como um arbusto aromático. É caracterizada por apresentar folhas pilosas na face dorsal, dando-lhe um aroma intenso e fortíssimo odor (NOGUEIRA et al., 2006). Sua ocorrência é registrada exclusivamente sobre a Serra da Mantiqueira (BRADE, 1956), nos estados do Rio de Janeiro, São Paulo e Minas gerais (PEREIRA, 1957). Segundo Nogueira et al. (2006), poucos são os trabalhos que citam a composição do óleo essencial ou ainda dos efeitos farmacológicos da Lepechinia speciosa em específico. No entanto, segundo os mesmos autores, estudos recentes têm demonstrado os efeitos positivos da espécie contra microorganismos patogênicos, principalmente graças à sua atividade antimicrobiana de amplo espectro contra a ação de bactérias Gram positivas e Gram negativas em testes feitos a partir do óleo extraído de suas folhas frescas. Foram identificados quarenta e quatro compostos, representando 93% do total do óleo extraído. Os principais compostos na fração volátil identificados foram os acetatos de bornila (39,18%), limoneno, (12,92%), camphene (11,85%) e viridiflorol (6,07%); ressaltando ainda que a lepechinia speciosa é caracterizada por apresentar uma grande quantidade de monoterpenos hidrocarbonetos (33,27%). Estes dados podem ser comparados aos dados obtidos por Morais (1972) na análise das partes aéreas de L. speciosa, que após secagem foram submetidas ao arraste com vapor, gerando 0,8% de óleo essencial. Análise por cromatografia em fase gasosa preparativa demonstrou na composição do óleo essencial as seguintes substâncias majoritárias: acetato de bornila (6,1%); limoneno (18,2%); camphene (6,5%); e sesquiterpenos (45,5%).
Nogueira et al. (2005) analisaram os constituintes químicos presentes no óleo essencial de L. speciosa em relação às suas propriedades antimicrobianas no combate aos agentes Candida albicans sorotipo b, Cryptococcus neoformans T444 e Staphylococcus aureus MRSA. Todos os microorganismos estudados mostraram-se vulneráveis a ação do óleo essencial utilizado. Segundo os autores do estudo, esses resultados são semelhantes aos encontrados para outras espécies do gênero e mencionam que tal atividade antimicrobiana pode ser atribuída à ação de algumas substâncias presentes no óleo, como acetato de bornila, isocariofileno e cânfora.
Embora seja uma espécie endêmica no Brasil (BRADE, 1956) e já se conheçam algumas de suas atividades biológicas e características químicas (NOGUEIRA et al., 2006), não há, até o momento, qualquer trabalho que faça a descrição de suas características anatômicas. A análise da organização morfológica do vegetal, determinando-se as estruturas que o formam, tanto no aspecto macro, como microscópico, contribui para fundamentar os estudos de identificação das substâncias por ele secretadas e para viabilizar a aplicação terapêutica desta espécie em um fitoterápico (BRASIL, 2010a; 2010b). Este trabalho tem por objetivo descrever a estrutura anatômica das folhas de L. speciosa em microscopia óptica, oferecendo subsídios que proporcionem o estudo farmacognóstico desta espécie.
Material e Métodos
As folhas totalmente expandidas de Lepechinia speciosa utilizadas para o estudo anatômico, foram coletadas do 4º ao 6º nó de um só indivíduo, na Serra da Mantiqueira, localizado nas coordenadas 22º 35’ 510S e 44º 40’ 291O, a 2.364 metros de altitude. As folhas foram fixadas em álcool a 70%. Um exemplar testemunho, devidamente identificado pela profissional botânica R. B. Moura, está depositado no Herbário do Instituto de Biologia da UFRJ (RFA) sob o nº de registro 28365.
Para preparação e inclusão do material em parafina, utilizou-se uma metodologia adaptada a partir do método histológico para tecidos animais descrito por Brancroft e Gamble (2002), onde o tempo do material em estufa para desidratação e diafanização foi reduzido para 20 minutos. Para inclusão em parafina, foram utilizados fragmentos das folhas. No limbo, na região da nervura principal, foram selecionadas partes do ápice, terço médio e base, além do bordo. Também se utilizou fragmento da região proximal, mediana e distal do pecíolo, em relação ao limbo. Os fragmentos obtidos foram acondicionados em unicassetes, modelo cralplast utilizados para biópsia de tecido animal. Após este, passaram pelo processo de desidratação, através de 05 (cinco) banhos consecutivos de álcool etílico absoluto à temperatura de 60 ºC, em estufa (estufa de Cultura modelo 002CBFanem LTDA) por 20 minutos cada banho. Em seguida, os fragmentos passaram pelo processo de diafanização ou clarificação, onde foram imersos em Xilol PA por 03 (três) vezes, por 20 minutos cada à temperatura de 60ºC em estufa. Foram feitos 2 banhos consecutivos de parafina histológica (Marca Vetec-PF-56-58ºC) fundida numa temperatura de 60 ºC, em estufa por 1 hora cada banho. Em seguida, os fragmentos já inclusos em parafina foram colocados em moldes de metal para histologia da marca Shandon a uma temperatura de 56º - 58 ºC utilizando-se como massa de inclusão a parafina histológica.
Incluído o material, procedeu-se ao resfriamento imediato, em uma placa fria à temperatura de -7 ºC, impedindo a cristalização da parafina. Nesse processo foi utilizado um autoinclusor da marca Shandon, modelo Histocentre 2. Foram realizados cortes histológicos transversais em micrótomo da marca Shandon modelo AS325, obtendo-se secções seriadas de 5 µm. As séries contendo 3 cortes histológicos foram distendidas em banho-maria à temperatura média de 40 ºC ( ± 2 ºC) e em seguida, foram deitadas em lâminas de vidro. As lâminas confeccionadas contendo as secções foram colocadas em estufa em temperatura de 60 ºC por 30 a 40 minutos para derretimento da parafina existente nessas secções. Após esse período, foi realizada a desparafinização: as lâminas passaram por 3 banhos consecutivos de aproximadamente 3 segundos cada em Xilol PA a temperatura ambiente e 5 banhos consecutivos de aproximadamente 3 segundos cada em álcool etílico absoluto e lavagem em água corrente por cinco minutos.
Posteriormente, as secções foram clarificadas em solução de hipoclorito de sódio 50%, neutralizadas em água acética 1:500 e lavadas em água corrente por 2 minutos. Em seguida, as secções foram coradas pelo corante duplo safrabau, preparado na proporção 9:1 (v:v) de 90 mL de azul de Astra 1% e 10 mL de safranina 1%, conforme proposto por Kraus e Arduin (1997) e montadas sob lamínula em Bálsamo do Canadá.
Para a análise das epidermes adaxial e abaxial, foi efetuada a dissociação das epidermes, seguindo metodologia descrita por Kraus e Arduin (1997). A coloração para a visualização foi feita com Safranina 1%, por 1 minuto. As lâminas foram observadas e fotografadas sob microscópico óptico (NiKon), com câmera (Leica IM50) acoplada. As descrições e classificação dos estômatos e dos tricomas foram feitas de acordo com as recomendações de Metcalf e Chalk (1959; 1979). As estruturas anatômicas seguiram as descrições de Esaú (1990) e as estruturas macroscópicas feitas segundo Judd e colaboradores (2002). Os nomes científicos e as abreviaturas dos autores dos táxons seguem as especificações do International Plant Name Index (IPNI).
Resultados e Discussão
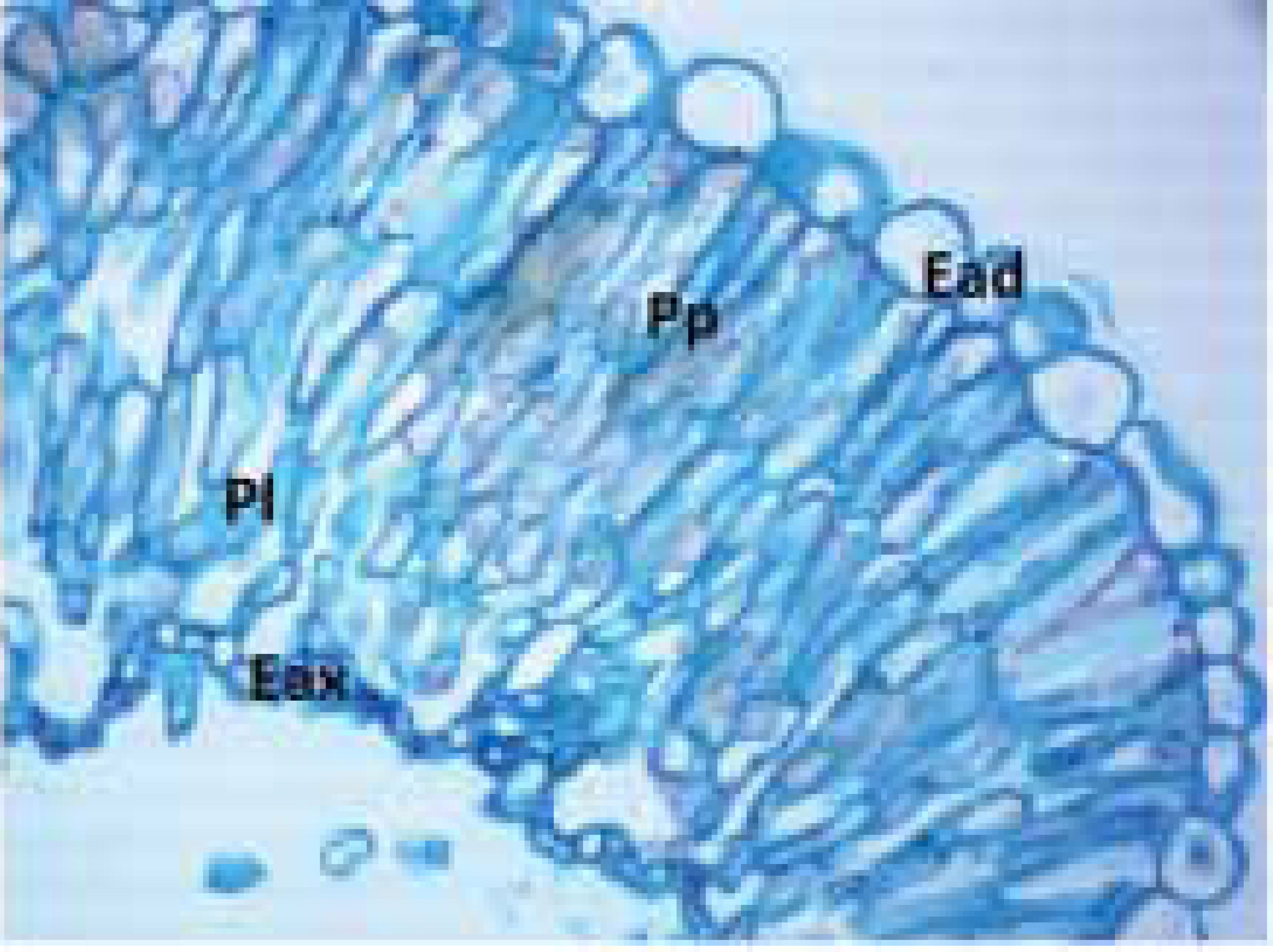
As epidermes dissociadas, observadas em vista frontal, mostram a face adaxial constituída de células poliédricas, de paredes anticlinais retas e espessas; estômatos do tipo anisocítico estão presentes (FIGURA 1). São observados tricomas ramificados pluricelulares tectores, ou simples (FIGURA 2). Foi observada também a ocorrência de tricomas pluricelulares capitados. São freqüentes os cristais em forma de ráfides nas células da epiderme adaxial. Na face abaxial, a epiderme é formada por células com paredes anticlinais fortemente sinuosas na região entre nervuras. Sobre as nervuras, as células epidérmicas são alongadas e estreitas, de paredes anticlinais retas (FIGURA 3). Em toda a superfície abaxial são observados 4 tipos de tricomas: ocorre abundância de tricomas pluricelulares ramificados, formando uma trama suspensa sobre a epiderme; alguns destes tricomas têm a terminação de uma das ramificações capitada.



Também ocorrem na face abaxial tricomas unicelulares, com o ápice expandido em uma forma globosa. A epiderme da face abaxial é provida de tricomas simples, com 3 a 4 células, sendo a apical capitada. São encontrados nesta face muitos estômatos dos tipos: anomocítico, anisocítico e paracítico. Em relação à face adaxial, estima-se que na face abaxial haja 4 vezes mais tricomas. Não ocorrem estômatos na epiderme que cobre as regiões de nervura (FIGURA 3).
A partir da observação das epidermes dissociadas em vista frontal, pode-se caracterizar a folha de L. speciosa como velutínea e anfiestomática. Sobre as paredes anticlinais da epiderme de espécies de Lamiaceae, Metcalfe; Chalke (1959) afirmam que os tipos mais comuns são paredes sinuosas, conforme foi observado na face abaxial de Lepechinia speciosa. Os autores mencionam também que o tipo de folha anfiestomática está representado entre as Lamiaceae e que a forma predominante de cristais observados na família é a de octaedro e que as ráfides não são muito freqüentes. Esau (1990) e Cutter (2002) afirmam que a abundância de tricomas está diretamente relacionada com a xeromorfia, isto é adaptação morfológica da folha a ambientes secos. Presença de paredes espessas e cutícula também são características de plantas xerófitas (ESAU, 1990). Os campos de altitude, onde Lepechinia speciosa ocorre são caracterizados por períodos prolongados de estiagem durante o inverno, havendo nesta fase queda na temperatura, podendo chegar a valores negativos (SEGADAS-VIANNA; DAU, 1968), podendo ocorrer geadas (MOURA, 2005). Através do corte transversal próximo ao bordo, na região mediana da folha, é possível perceber a rugosidade da lâmina foliar. As rugosidades são formadas como “pregas”, onde se pode observar desenvolvimento de colênquima angular formando as elevações da lâmina (FIGURA 4).

Na região entre nervuras, ambas as faces apresentam epiderme uniestratificada e a face abaxial é coberta por cuticula e extratos cuticulares (FIGURA 5). As células da epiderme inferior são menores, quando comparadas às células da epiderme superior (Fig. 6). O mesofilo é composto de parênquima clorofiliano paliçádico, representado por 2 a 4 camadas de células constituindo quase totalmente o mesofilo, e lacunoso em distribuição heterogênea, do tipo dorsiventral (FIGURAS 5 e 6); são observadas drusas entre as células do mesofilo (FIGURA 4), alem da presença de ráfides. Mesofilo dorsivental com parênquima paliçádico mais desenvolvido do que o lacunoso é característico de folhas de plantas xerófitas (ESAU, 1990; CUTTER, 2002), como é o caso de L. speciosa. Metcalfe e Chalk (1959) mencionam a ocorrência de diferentes tipos de mesofilo entre as Lamiaceae, incluindo o dorsiventral.

Uma vez que não existem trabalhos anatômicos realizados dentro do gênero Lepechinia, as comparações quanto à estrutura anatômica de L. speciosa foram feitas em relação a outras espécies da família Lamiaceae. Assim, em estudo de Plectranthus neochilus (boldo), um representante da família Lamiaceae, Duarte e Lopes (2007) observaram também a presença de epiderme unisseriada, porém o mesofilo é homogêneo. Os autores mencionam a presença de diferentes tricomas secretores. Já Toledo, Alquini e Nakashima (2004) observaram nas folhas de outra espécie de Lamiaceae, a Cunila microcephala, epiderme uniestratificada coberta por cutícula em ambas as faces, fato não observado em L. speciosa; mesofilo heterogêneo dorsiventral e 3 tipos de tricomas, entre tectores e glandulares. Martins (2002) descreve a anatomia das folhas de Mentha spicata com epiderme unisseriada nas duas faces, destacando a presença de cristais tanto na epiderme quanto no mesofilo. Apresenta o mesofilo heterogêneo dorsiventral, com uma só camada de parênquima paliçádico, diferindo de L. speciosa. A autora também cita a presença de tricomas em ambas as faces e as células da face adaxial sendo maiores do que as da face abaxial, fato também registrado para L. speciosa. O pecíolo caracteriza-se pela forma cilíndrica, com um sulco central na região adaxial. É revestido por uma epiderme uniestratificada, rica em tricomas. A morfologia interna do pecíolo apresenta-se uniforme, em cortes transversais. A mesma distribuição de tecidos é observada, desde a região proximal, até a distal (FIGURA 7). Abaixo da epiderme pode-se observar a presença de 2 a 4 camadas de colênquima angular. O parênquima fundamental apresenta poucos espaços intercelulares. Apresenta cinco feixes vasculares do tipo colateral, sendo um deles, central em forma de arco aberto, bem desenvolvido e dois de cada lado do sulco (Fig. 7). No feixe central, o floema apresenta os elementos de tubo crivados e suas células companheiras formando pequenos grupos intercalados por células parenquimaticas de maiores dimensões, alem de tecido colenquimatoso e fibras (FIGURA 8). Os feixes das regiões laterais são colaterais, envolvidos por bainha de tecido colenquimatoso e algumas fibras (FIGURA 9). A descrição anatômica do pecíolo está em consonância com a descrita para a família Lamiaceae segundo Metcalf e Chalk (1959). Duarte e Lopes (2007), ao estudar Plectranthus neochilus, descreveram o pecíolo da espécie apresentando um contorno plano-convexo, contendo feixes vasculares colaterais, sendo um arco central aberto e dois feixes menores nas extremidades. Os autores também mencionam a presença de colênquima angular sob a epiderme.



Na região do limbo, a nervura principal apresenta-se levemente côncava junto à superfície adaxial e proeminente na face abaxial (FIGURA 10). Adjacente à epiderme encontram-se duas a três camadas de colênquima angular. Nesta região não é observada continuidade do parênquima paliçádico, nota-se parênquima fundamental com poucos espaços intercelulares. Observa-se a presença de feixe vascular central colateral em forma de arco aberto com duas regiões anficrivais nas extremidades, e a presença de fibras envolvendo o feixe (FIGURA 11).


Em Cunila microcephala, Toledo, Alquini e Nakashima (2004) descrevem a presença de parênquima paliçádico na região da nervura mediana e colênquima do tipo lamelar, diferente do descrito para L. speciosa. Os autores observaram, ainda, um feixe vascular central colateral, assim como observado em L. speciosa, porém sem apresentar regiões anficrivais.
Através do corte transversal do bordo observa-se um contorno arredondado e acentuadas ondulações e elevações bem pronunciadas (rugosidades) onde é possível a visualização de feixes vasculares (FIGURA 12). As células epidérmicas apresentam cutícula espessa que recobre toda a extensão da face abaxial do bordo. Mesófilo de distribuição dorsiventral e uniforme em toda extensão, formado por camadas de células parenquemáticas lacunosas e paliçádicas, sendo esta, a maior camada. Este fato reforça suas características de planta xerófita (ESAU, 1990; CUTTER, 2002). Nesta região pode-se observar menor quantidade de espaços intercelulares no parênquima paliçádico, em comparação com a região entre nervuras do terço médio da lâmina foliar. Nota-se, embora que distante da porção terminal do bordo, a presença de ráfides e drusas na camada do parênquima. Segundo Metcalfe e Chalk (1959), a presença de cristais não é muito comum na família Lamiaceae, porém, em algumas espécies, podem aparecer sob a forma de ráfides, bastões ou na forma octaédrica, a qual é considerada a forma predominante. Na folha de L. speciosa, observa-se uma prevalência na forma de drusa e ráfide.

Conclusões
Neste trabalho é apresentada uma descrição inédita da anatomia foliar da espécie Lepechinia speciosa, através de uma metodologia não convencional para tecidos vegetais. Como característica relevante na descrição anatômica da folha de L. speciosa, destaca-se a abundância e diversidade de tricomas encontrados em sua epiderme alem da presença de grande quantidade de cristais, principalmente do tipo drusa. Essas características são de fundamental importância para a análise farmacognóstica da espécie, assinalando um maior controle de qualidade na matéria-prima vegetal.
Referências
BRADE, A.C. Flora do Parque Nacional do Itatiaia. Boletim do Parque Nacional do Itatiaia, n.5, p.5-85, 1956.
BRANCROFT, J.D.; GAMBLE, M. (eds). Theory and Practice of Histological Techniques. 5th ed., Ed. Churchill, Livingstone, 2002, 311 pp.
BRASIL. Resolução RDC 10 de 9 de março de 2010. Dispõe sobre a notificação de drogas vegetais junto à Agência Nacional de Vigilância Sanitária (ANVISA) e dá outras providências, 2010a. D.O.U., n.46, seção 1, p.52-96. Brasília, DF, 10/03/2010.
BRASIL. Resolução RDC 17 de 16 de abril de 2010. Dispõe sobre as boas práticas de fabricação de medicamentos junto à Agência Nacional de Vigilância Sanitária (ANVISA), 2010b. Disponível em: http://www.farmacotecnica.ufc.br/arquivos/RDC17_2010b.pdf
CUTTER, E.G. Anatomia Vegetal: Parte II. Órgãos, Experimentos e Interpretações. 1ª ed., Ed. Roca, São Paulo, 2002, 304 pp.
ESAU, K. Anatomia das plantas com sementes (trad. Berta L. de Morretes). Ed. Edgard Blücher, São Paulo, 1990, 293 pp.
DUARTE, M.R.; LOPES, J.F., Stem and leaf anatomy of Plectranthus neochilus Schltr., Lamiaceae. Revista Brasileira de Farmacognosia, v.17, n.4, p.549-556, 2007
JUDD, W.S.; CAMPBELL, C.S.; KELLOG, E.A.; STEVENS, P.F.; DONOGHUE, M.J. Plant Systematics: A phylogenetic approach. 2nd ed., Sinauer Associates Inc., Massachusetts, 2002, 300 pp.
KRAUS, J.E.; ARDUIM, M. Manual básico de métodos em morfologia vegetal. EDUR-Editora Universidade Rural, Seropédica, RJ, 1997, 198 pp.
MARTINS, M.B.G., Estudo em microscopia óptica e de microscopia eletrônica de varredura em folhas de Mentha spicata X Suaveolens (Lamiaceae). Bragantia, v.61, n.3, p.205-218, 2002.
METCALFE, C.R.; CHALK, L. Anatomy of the Dicotyledons: leaves, stem, and wood in relation to taxonomy with notes of economic uses. v. 2, Clarendon Press, Oxford, 1959, 1500 pp.
METCALFE, C.R.; CHALK, L. Anatomy of Dicotyledons. 2 ed., v. 1, Claredon Press, Oxford, 1979, 294 pp.
MORAIS, A.A.; MOURÃO, J.C.; GOTTLIEB, O.R.; KOKETSU, M.; MOURA, L.L.; SILVA, M.L.; MARX, M.C.; MENDES, P.H.; MAGALHÃES, M.T. Óleos terpênicos do Estado do Rio de Janeiro. Anais da Academia Brasileira de Ciências (Supl.), v.44, p.320-322, 1972.
MOURA, R.B. Desenvolvimento in situ e in vitro das espécies de Esterhazya J. C. Mikan (Scrophulariaceae) do Estado do Rio de Janeiro. Tese de Doutorado. Programa de Pós-graduação em Biotecnologia Vegetal, Universidade Federal do Rio de Janeiro, 2005, 127 pp.
NOGUEIRA, F.L.P.; MOURA, R.B.; KAPLAN, M.A.C. Análise do óleo essencial de Lepechinia speciosa em fase vegetativa e reprodutiva e avaliação da atividade antimicrobiana. In: V Simpósio Brasileiro de Farmacognosia, Recife. Livro de Resumos, 2005.
NOGUEIRA, F.L.P.; MOURA, R.B.; MOREIRA, D.L. Determination of leaf essential oil composition of Lepechinia speciosa by GC/EM. In: 37th International symposium on Essential Oils, Nice, CD ROM, 2006.
PEREIRA, E. Labiateae. Rodriguésia, v.2, n.20, p.89-104, 1957.
SEGADAS-VIANNA, F. DAU, L. Ecology of the Itatiaia range, southeastern Brazil (II Climates and altitudinal climatic zonation). Arquivos do Museu Nacional, Rio de Janeiro, v.53, p.31-53, 1968.
TOLEDO, M.G.T., ALQUINI, Y., NAKASHIMA, T. Caracterização anatômica das folhas de Cunila microcephala Benth. (Lamiaceae). Revista Brasileira de Ciências Farmacêuticas, v.40, n.4, p.487-493, 2004.