Artigo Original
Estudo Químico de Musa acuminata Colla (Musaceae)
Chemical Composition of Musa acuminata Colla (Musaceae)
Resumo
As inflorescências e frutos de Musa acuminata Colla (banana ouro) foram coletados no município de Magé, RJ. As inflorescências ainda frescas foram fragmentadas e submetidas à extração com metanol. O extrato metanólico foi analisado por CLAE-UV e submetido à partição líquido-líquido com solventes de diferentes polaridades. Análise da fase hexânica por CG-EM permitiu a caracterização da mistura dos seguintes constituintes: palmitato de metila, linoleato de metila e linolenato de metila. As inflorescências secas foram submetidas à hidrodestilação em aparelho tipo Clevenger resultando na extração de 34 substâncias. As análises do perfil cromatográfico e dos constituintes voláteis e semivoláteis das inflorescências evidenciaram majoritariamente três grupos de componentes: sinalizadores químicos de pequena massa molecular (benzaldeído, heptanal), sesquiterpenos (β-bisaboleno, nerolidol) e hidrocarbonetos de cadeia longa saturados e não saturados (C17 - C29). As substâncias voláteis dos frutos foram extraídas pela técnica de SPME e analisadas por CG-EM, mostrando a presença de três grupos principais: ésteres, cetonas e um derivado arilpropanoídico, caracterizando o aroma da banana.
- Unitermos:
- Musa acuminata.
- Musaceae.
- Banana.
- Hidrodestilação.
- SPME..
Abstract
Inflorescences and fruits of Musa acuminata Colla (banana ouro) were collected at city of Mage, RJ. Fresh inflorescences were fragmented and subjected to extraction with methanol. The methanol extract was analyzed by HPLC using UV detector and subjected to liquid-liquid partition with solvents of different polarities. The hexane phase analysis showed a mixture of the following major constituents: ethyl palmitate, methyl linoleate and methyl linolenate. Dried inflorescences were submitted to hydrodistillation in a Clevenger type apparatus resulting in extraction of the volatile compounds which can be considered in three groups: components of small molecular mass (benzaldehyde, heptanal), sesquiterpenes (β-bisabolene, nerolidol) and long chain saturated and unsaturated hydrocarbons (C17-C29). Volatile compounds of the fruits were extracted by SPME technique and analysed by GC-MS showing the presence of three major groups: esters, ketones and an arylpropanoid derivative, characterizing the aroma of banana.
- Key Words:
- Musa acuminata.
- Musaceae.
- Banana.
- Hydrodistillation.
- SPME...
Introdução
A família Musaceae pertence à Superordem Zingiberiflorae e ordem Zingiberales (PUGIALLI et al., 1993). Essa família é formada pelos gêneros Ensete, Musa e Musella. Várias espécies de Musa e de Ensete são também usadas como plantas ornamentais sendo amplamente comercializadas no mercado internacional (HÄKKINEN, 2009; DE LANGE et al., 2009). Musa é o maior gênero de Musaceae compreendendo cerca de 70 espécies e mais de 500 cultivares (HÄKKINEN; HONG, 2007). O gênero é amplamente cultivado em todas as regiões tropicais do mundo (KENNEDY, 2009). A importância econômica dessas plantas é ressaltada não só pela produção do fruto, difundida pelo mundo todo, mas também pelo valor das atividades farmacológicas registradas para os extratos dos vários órgãos da planta, tais como: atividade antifúngica (KAMO et al., 2001), inseticida (PASCUAL; RODRIGUEZ, 2007), antiúlcera (COSTA; BRITO, 1997), dentre outras. As inflorescências de M. acuminata Colla possuem excelente atividade antiviral contra herpesvírus simples humano tipo 1 e herpesvírus simples humano tipo 2, ambos resistentes ao aciclovir (MARTINS et al., 2009).
Embora a maioria das bananas seja consumida fresca, o número de produtos processados tem aumentado. O grande potencial desses novos derivados comerciais de banana merece investigação adicional (WANG et al., 2007). Recentemente uma farinha foi elaborada a partir de inflorescências desidratadas da bananeira (FINGOLO et al., 2009). Dando continuidade aos estudos fitoquímicos com espécies de Musaceae, foram coletadas no município de Magé, RJ, inflorescências e frutos de Musa acuminata Colla, conhecida popularmente como banana ouro. Vale a pena ressaltar que apesar de existirem vários estudos sobre a química dos diferentes órgãos da bananeira, há pouquíssimo registro sobre as inflorescências, o que justifica este estudo como contribuição para o conhecimento da família Musaceae.
Material e Métodos
Coleta e Identificação Botânica
Inflorescências de Musa acuminata Colla foram coletadas no Parque Santo Eugênio, rodovia Rio-Teresópolis, Km 107, Parada Modelo, município de Magé, RJ. O material botânico foi identificado pelo botânico Dr. João Marcelo Alvarenga Braga, JBRJ e detém exsicata depositada no Herbário do Jardim Botânico do Rio de Janeiro, sob o registro RB 402574A.
Preparação e Extração do Material Vegetal
O material ainda fresco foi reduzido a pequenos fragmentos e submetido à extração com metanol, com troca sucessiva de solvente. Os filtrados resultantes dessa maceração foram reunidos e concentrados sob pressão reduzida em rotaevaporador, mantendo a temperatura do banho em torno de 40 °C. O extrato metanólico suspenso em MeOH:H2O (2:8) foi submetido à partição líquido-líquido, com diferentes solventes, resultando as frações: hexânica, diclorometânica, em acetato de etila e butanólica, além do resíduo aquoso.
Análise das frações voláteis das inflorescências e dos frutos
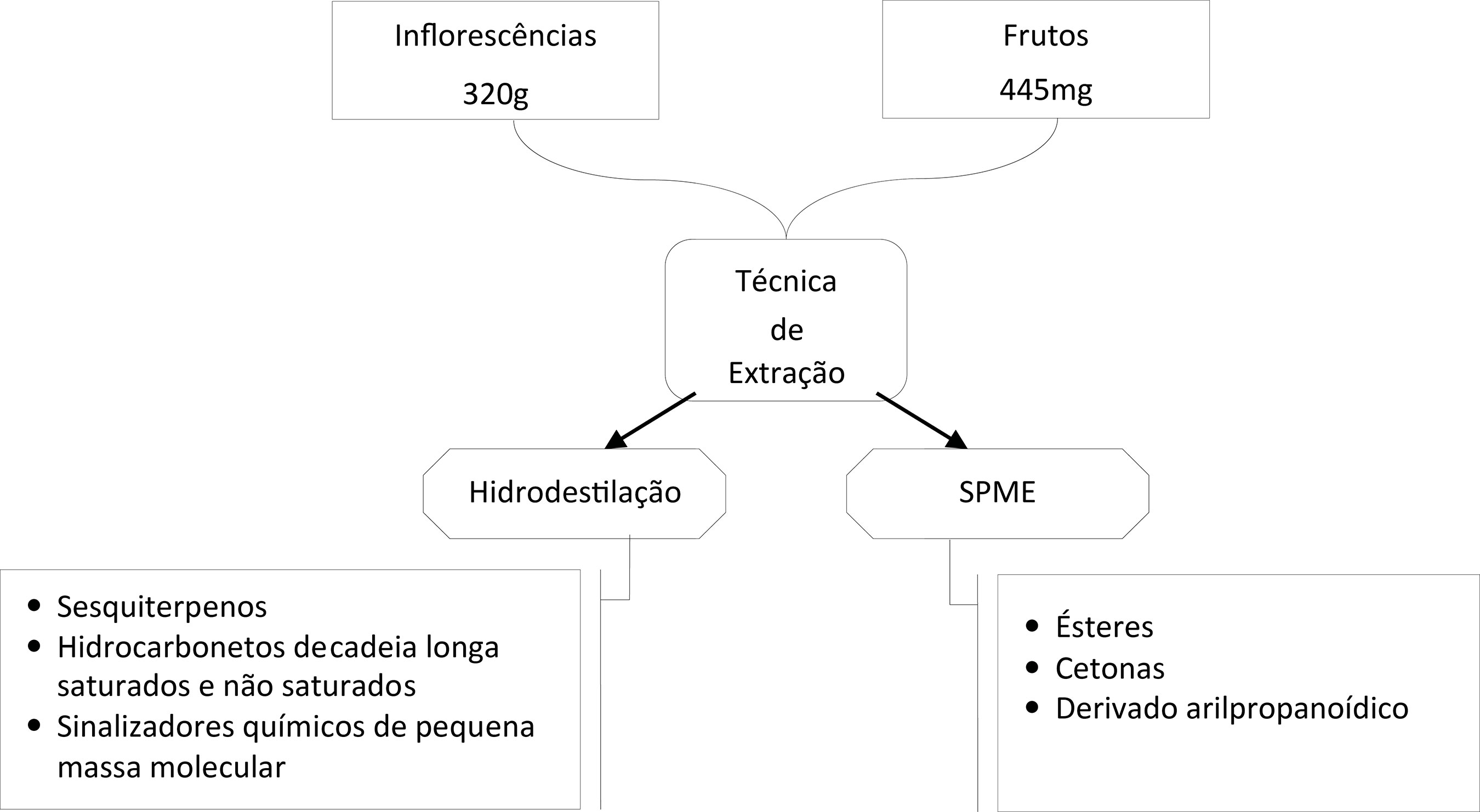
Os constituintes voláteis dos frutos frescos foram determinados através da técnica de microextração em fase sólida (SPME) e as substâncias voláteis das inflorescências secas foram obtidas por hidrodestilação, em aparelho do tipo Clevenger.
Hidrodestilação
A extração da fração volátil do material botânico (320 g de inflorescências secas) foi efetuada através da hidrodestilação por 2 horas em aparelho do tipo Clevenger. A fração volátil resultante foi extraída da água de coobação com diclorometano e analisada por cromatografia com fase gasosa acoplada à espectrometria de massas (CG-EM).
Microextração em Fase Sólida (do inglês, Solid Phase Microextraction - SPME)
Após a coleta, os frutos sem cascas foram cortados em pedaços (445mg) e acondicionados dentro de um frasco de 4 mL. A seguir o frasco foi fechado com septo e tampa metálica sob pressão e acondicionados por aproximadamente 20 min a 80ºC. A extração das substâncias voláteis presentes no espaço aéreo sobre os frutos foi feita, sendo utilizada uma seringa especial com a fibra de DVB-CAR 70μm durante 15 min.
Cromatografia com Fase Gasosa Acoplada à Espectrometria de Massas (CG-EM)
As substâncias voláteis das inflorescências e dos frutos de M. acuminata foram analisadas por CG-EM em aparelho GCMS-QP50000 Shimadzu, nas seguintes condições: 70 eV, coluna capilar ZB-5MS (30 m x 0,25 mm x 0,25 μm), injetor a 260 ºC, interface a 200 °C, programação de temperatura de 60 a 240 °C (3 °C/min) sendo hélio o gás de arraste (1 mL/min). As substâncias foram identificadas de acordo com seu perfil de fragmentação no espectro de massas e por comparação a banco de dados do aparelho e com a literatura especializada (ADAMS, 2001). Os constituintes apolares da fase hexânica obtida por partição líquido-líquido do extrato metanólico também foram analisados por CG-EM, no mesmo aparelho, porém, com programação de temperatura de 60 a 290 °C (10 °C/min).
Cromatografia líquida de alta eficiência (CLAE)
Para a caracterização dos componentes químicos do extrato metanólico utilizou-se cromatografia líquida de alta eficiência (CLAE) em aparelho Shimadzu SPDM10A/LC-10AD/CBM-10A, usando coluna REXCHROMC18 (5μ, 250 x 4,6mm) para CLAE analítico. O fluxo foi de 1 mL/min e a fase móvel consistiu de água (pH 3,0 com H3PO4) como solvente A e acetonitrila como solvente B.
Resultados e Discussão
O extrato metanólico das inflorescências frescas de M. acuminata foi analisado por CLAE-UV, que permitiu sugerir a presença de substâncias fenólicas e flavonoídicas (Figura 1).

A fase hexânica obtida a partir do extrato metanólico das inflorescências de M. acuminata foi submetida à CG-EM e revelou como constituintes majoritários: palmitato de metila, linoleato de metila e linolenato de metila. O emprego da hidrodestilação em aparelho tipo Clevenger possibilitou a extração da fração volátil das inflorescências de M. acuminata, cujo percentual dos constituintes químicos identificados correspondeu a 82,24% do material obtido (Tabela 1).
| TR | % Relativa | Substâncias |
| 4,22 | 0,24 | heptanal |
| 5,69 | 0,92 | benzaldeído |
| 6,07 | 0,07 | 3-hidroxi-1-octeno |
| 6,19 | 0,08 | 6-metil-5-hepten-2-ona |
| 6,33 | 0,11 | 2-octanona |
| 8,14 | 0,20 | fenilacetaldeído |
| 10,27 | 0,08 | nonanal |
| 10,46 | 0,24 | 3,4-dimetilciclohexanol |
| 23,49 | 0,14 | biciclo[7,2,0]undec-4-eno,4,11,11-trimetil-8-metileno |
| 25,02 | 0,15 | α-humuleno |
| 26,56 | 0,22 | (+)-ledeno |
| 26,74 | 0,22 | γ-elemeno |
| 27,33 | 0,80 | β-bisaboleno |
| 27,70 | 0,19 | amorfeno |
| 29,60 | 2,60 | (+)-nerolidol |
| 34,97 | 0,46 | heptadecano |
| 35,58 | 0,26 | hexadecanal |
| 38,65 | 0,60 | nonadecano |
| 43,09 | 2,40 | palmitato de metila |
| 44,68 | 3,42 | ácido palmítico |
| 45,35 | 0,53 | palmitato de etila |
| 47,13 | 0,47 | 10-heneicoseno |
| 47,81 | 0,45 | heneicoseno |
| 48,51 | 2,71 | estearato de metila |
| 48,80 | 8,30 | linoleato de etila |
| 51,79 | 1,26 | docosano |
| 53,74 | 0,50 | 5-nonadecen-1-ol |
| 54,00 | 9,36 | 9(Z)-tricoseno |
| 54,86 | 13,29 | tricosano |
| 59,62 | 7,34 | tetracosano |
| 60,45 | 17,60 | pentacosano |
| 63,32 | 0,44 | hexacosano |
| 66,42 | 1,23 | octacosano |
| 67,27 | 5,36 | nonacosano |
| Total identificado identificado | 82,24 | |
| TR = Tempo de retenção em minutos. | ||
A análise do perfil cromatográfico permitiu caracterizar três grupos de componentes: sinalizadores químicos de pequena massa molecular (benzaldeído, heptanal), sesquiterpenos (β-bisaboleno, nerolidol), e hidrocarbonetos e não saturados saturados de cadeia longa (C17-C29).A utilização da técnica de SPME na análise da fração volátil dos frutos segmentados de M. acuminata levou à identificação de três grupos de constituintes químicos majoritários (TABELA 2): ésteres, cetonas e um derivado arilpropanoídico, caracterizando o aroma da banana ouro.
| TR | % Relativa | Substâncias |
| 4,28 | 4,27 | acetato de 2-pentila |
| 4,84 | 3,73 | acetato de amila |
| 8,25 | 2,79 | butanoato de butila |
| 8,86 | 4,40 | acetato de hexila |
| 9,30 | 8,48 | butanoato de 2-pentila |
| 10,49 | 21,82 | isobutanoato de isoamila |
| 16,34 | 16,75 | butanoato de hexila |
| 17,39 | 3,42 | butanoato de 2-metilciclohexila |
| 17,53 | 1,27 | 5-metil-5-hexen-2-ona |
| 20,50 | 12,82 | 1,1-diacetilpropano |
| 21,25 | 1,55 | 2,2-diacetilpropano |
| 22,02 | 3,49 | butanoato de vinila |
| 25,20 | 1,90 | acetato de undec-2-enila |
| 27,73 | 9,72 | butanoato de 2-pentenila |
| 28,58 | 2,11 | 1,2-dibutanoato de etano |
| 32,22 | 1,49 | elemicina |
| Total identificado | 100 | |
| TR = Tempo de retenção em minutos. | ||
Através das duas diferentes técnicas utilizadas para avaliação dos constituintes voláteis, elaborou-se a Figura 2.
Referências
ADAMS, R. P. Identification of essential oil components by gas chromatography/quadrupole mass spectroscopy, 2001, 456 pp.
COSTA, M.A.A.M.; BRITO, A.R.M.S. Phytotherapy Research, v.11, p.28-31, 1997.
DE LANGE, E.; VRYDAGHS, L.; MARET, P.; PERRIER, X.; DENHAM, T. Why bananas matter: an introduction to the history of banana domestication. Ethnobotany Research & Applications, v.7, p.165-177, 2009.
FINGOLO, C.E.; MOURA, M.R.L.; KAPLAN, M.A.C. (2009). Farinha Nutritiva, Processo de Produção da Farinha Nutritiva e Seus Usos. Protocolo de Patente no 020090112935.
HÄKKINEN, M. Musa chunii Häkkinen, a new species (Musaceae) from Yunnan, China and taxonomic identity of Musa rubra. Journal of Systematic Evolution, v.47, p.87-91, 2009.
HÄKKINEN, M.; HONG, W. New species and variety of Musa (Musaceae) from Yunnan, China, Novon, v.17, p.440-446, 2007.
KAMO, T.; HIRAI, N.; IWAMI, K.; FUJIOKA, D.; OHIGASHI, H. Tetrahedron, v.36, n.57, p. 7649-7656, 2001.
KENNEDY, J. Bananas and people in the homeland of genus Musa: not just pretty fruit. Ethnobotany Research & Applications, v.7, p.179-198, 2009.
MARTINS, F.O.; FINGOLO, C.E.; KUSTER, R.M.; KAPLAN, M.A.C.; ROMANOS, M.T.V. Atividade antiviral de Musa acuminata Colla, Musaceae. Revista Brasileira de Farmacognosia, v. 19, n.3, p.781-784, 2009.
PASCUAL-VILLALOBOS, M.J.; RODRIGUEZ, B. Biochemical Systematics and Ecology, v.1, n.35, p.11-16, 2007.
PUGIALLI, H.R.L.; KAPLAN, M.A.C.; GOTTLIEB, O.R. Quimiotaxonomia da Superordem Zingiberiflorae (Sensu Dahlgren). I. Flavonóides como Marcadores Quimiossistemáticos, Acta Botânica Brasilica, v.7, n.2, p.135-148, 1993.
WANG, J.; LI, Y.Z.; CHEN, R. R.; BAO, J.Y.; YANG, G.M. Comparison of volatiles of banana powder dehydrated by vacuum belt drying, freeze-drying and air-drying. Food Chemistry, v.104, p.1516-1521, 2007.