Estado da Arte
Quassia amara L. (Simaroubaceae)
Quassia amara L. (Simaroubaceae)
Resumo
Este estudo se baseia na literatura convencional e científica, com o objetivo de compilar as informações relevantes à espécie Quassia amara L. (Simaroubaceae), relacionadas ao seu potencial medicinal, e como matéria-prima para produtos farmacêuticos e inseticidas.
Abstract
This study, based on both conventional and scientific literature, aims to compile the data that are relevant to the medicinal use of Quassia amara L. (Simaroubaceae) and as raw material for the manufacture of phytopharmaceutical and insecticidal products.
Parte utilizada
As folhas são a parte mais utilizada contra a malária e várias outras doenças, contudo o uso popular e comercial das cascas, raízes e madeira também é muito extenso. A escolha varia com o tratamento visado (BERTANI et al., 2005; GIRÓN et al., 1991; OCAMPO; AFFIOLI, 1987; MORTON, 1981).
Sinonímia
Quassia alatifolia Stokes, Quassia officinalis Rich., segundo Grandtner ( 2005).
Nomes comuns
Amargo, pau-amarelo, pau-quássia, quássia, quássia-amarga, quássia-decaiena, quina, quina-quina, quinarana, batakka dî basta, contra cruceto, creceto morado, cruceta, crucete, cuasamara, cuasia, cuasia amarga, hombre grande, hombrón, guabito amargo, guabo amargo, guavita amarga, guavito amargo, juavita amarga, kini, limoncillo, palo amarillo, palo de hombre, palo quinina, puesilde, quasia, quasia amarga, quini, quininagru, tigrilla, tigrillo, udut pulu, wanabaka e wéwe gífi na América Central; na Guiana Francesa e Suriname bitter ash, bitter bush, bitterhout, bitterholz, bitterwood, bois amer, couachi, kvassia, kwasi bita, kwassi, quinquina de Cayenne, quashie-bitters, quassia-bitters, quassia wood, Surinam wood, ya-ko-yik y ya-ku-yik (LOPEZ SAEZ; PEREZ SOTO, 2008; COE; ANDERSON, 2005; MORTON, 1981; PITTIER, 1978; WOODSON et al., 1973).
Variedades e espécies botânicas correlatas
Duas variedades da espécie: Q. amara var. paniculata e Q, amara var. grandiflora (Panama, Trinidad) são citadas (Tropicos.org. Missouri Botanical Garden. 2010).
As espécies Quassia africana, Quassia indica e Quassia multiflora também contêm quassinóides semelhantes à Q. amara (SIMÃO et al. 1991).
Compilação: Quassia amara L. (Simaroubaceae)
História do uso medicinal
Fermin e Haller registraram o uso medicinal de quássia no Suriname em 1714 e 1742, respectivamente; com base nesta informação, o sueco Rolander procurou o nativo do Suriname chamado Quassi que tratava a febre com ela. Em 1756, a planta foi levada para Estocolmo, onde o botânico Lineu em 1762 criou para ela o gênero Quassia. O termo amara se refere ao seu sabor amargo (BROWN, 1995; OCAMPO; AFFIOLI, 1987; PEREIRA, 1837). As propriedades desta planta foram estudadas em Estocolmo desde 1764. O consumo medicinal de Quassia na Europa vem desde o século XVIII, primeiramente na Suécia em 1756, e difundindo-se depois como planta medicinal por todo o continente (BUSBEY, 1939, GRENAND et al. 2004). Tanto DA MATTA (1912) como CHERNOVIZ (1920) citam o uso medicinal no Brasil na virada dos séculos XIX/XX. A substância isolada quassina é citada por ambos estes autores. Ela foi obtida sob forma cristalina por Winckler em 1835 e foi caracterizada estruturalmente por Clark e cols. (1937).
Distribuição geográfica
A família Simaroubaceae tem distribuição pantropical, com a Quassia amara distribuindo-se pela América Tropical, desde os 18° de latitude N do México até o norte da América do Sul, incluindo a Amazônia (BROWN, 1995; GENTRY, 1993; PÉREZ, 1990; HOLDRIDGE; POVEDA, 1975), sendo que sua origem biogeográfica não está muito clara, devido a seu cultivo como planta medicinal desde a antiguidade (THOMAS, 1990).
Cultivo e Propagação
A tecnologia de propagação e cultivo de Q. amara em Costa Rica foi descrita por Díaz e cols. (2006). A tecnologia de propagação e cultivo foi estudada no Brasil e há relato de cultivo em outros países da América Central e do Sul (MACEDO et al., 2005; MORTON, 1981; HOLDRIDGE; POVEDA, 1975; WOODSON et al., 1973). Habita em zonas de precipitação elevada (1500-4500 mm anuais) (BROWN, 1995); podendo aparecer em terrenos secos ou em terrenos de ribeira onde a umidade é permanente (VILLALOBOS, 1996), sendo favorecida por habitats de meia sombra. Encontra-se naturalmente entre o nível do mar e 500 m, chegando, excepcionalmente, na Nicarágua, à altitude de 800 m (STEVENS et al., 2001).
Material vegetal utilizado
Tanto a madeira como as folhas de Quassia amara são utilizadas na medicina. A escolha da parte dependeria teoricamente do uso pretendido. Assim, a simalikalactona D e a quassimarina encontradas na folha foram relacionadas com a atividade contra a malária e neoplasias. A atividade inseticida foi relacionada às quassina e neoquassina, encontradas principalmente no caule, porém achadas também nas folhas, especialmente nas folhas jovens (MACEDO et al., 2005).
Características macroscópicas: Arbusto grande ou arvoreta de 4-7 m de altura, dotada de copa estreita e mais ou menos rala; apresentando folhas compostas, com cinco folíolos, imparipinadas, ráquis e pecíolos alados, folíolos oblanceolados, ápice abruptamente acuminado e base atenuada. As inflorescências terminais racemosas espiciformes, flores com cálice 5-lobado, com lobos ablongo-triangulares; corola vistosa vermelho-vivo, glabra com 3,5 a 4,5 cm de comprimento, androceu com 10 estames inserido no disco pupuliforme, gineceu apocárpico com ovário glabro, estilete alongado, estigma diminuto, pentasulcado. Fruto drupáceo ovóide, com 1,5 cm de comprimento e 2,3 cm de diâmetro, semente ovada (BERG, 1993).
Características microscópicas: As características anatômicas de Quassia amara são comuns à família Simaroubaceae, tais como: folha hipoestomática, mesófilo dorsiventral, presença de tricomas unicelulares simples, tricomas 2-braços, glândulas multicelulares e cristais de oxalato. As características peculiares à espécie são a presença de esclereídeos filiformes distribuídos em todas as direções no mesofilo, fornecendo-lhe consistência e proteção; tricomas glandulares ovalados divididos em três partes: cabeça, pescoço e pé; tricomas filiformes com células basais secretoras e tricomas simples onde todo o corpo libera óleo (MACEDO et al., 2005). A madeira é reconhecida ao microscópio por seus falsos anéis de crescimento anual (bandas de parênquima); apresentando raios medulares formados por uma ou duas filas de células de extensão de 20 a 25 células de largura (DÍAZ et al., 2009). Análise dos grãos de pólen de Quassia amara ao microscópio ótico apontam uma área polar grande, aberturas tricolporadas, exina semitectada e microreticulada (JUAREZ-JAIMES, 1992).
Propriedades organolépticas: Quassia amara é conhecida como a planta mais amarga conhecida, embora esta propriedade possa levar a uma confusão no mercado com a Picramnia excelsa (Sw.) Planch., a qual é conhecida como quássia da Jamaica (DÍAZ et al., 2009; WAGNER et al. 1984). Os princípios amargos são encontrados em todas as principais partes da planta.
Processos de extração
Tradicional: Diversas partes da Quassia amara possuem amplo emprego terapêutico, e seus processos de extração tradicionais podem ser aquosos, como decocção ou infusão, ou ainda hidroalcoólicos, com o intuito de conduzir ao extrato seco, extrato fluido, pó, tintura, elixir, vinho, xarope e licor (MORAES, 2009; PEREIRA,1854; BALFOUR, 1851).
Produtos da indústria e do comércio: Quassina, o principal produto cristalino isolado da madeira, tem importância comercial devido às suas propriedades terapêuticas e inseticidas e possivelmente organolépticas. O produto comercial varia conforme a origem. Exemplos citados continham desde 66% quassina e 26% neoquassina até 29% quassina e 37% neoquassina (DOU et al., 1996). Existe no mercado a tintura da planta Quassia vinager, utilizado no tratamento de pediculose, com base na sua propriedade repelente aos insetos. A tintura também atua como um potente inibidor da formação da quitina (ALCALDE; DEL POZO, 2007). Uma empresa de Costa Rica (quassia@racsa.co.cr) oferece madeira de quassia e extratos secos destinados aparentemente ao uso como inseticida e repelente. A operação é baseada em uma plantação em Curidabat, San José. Em colaboração com ela uma subsidiária farmacêutica produz o fitoterápico digestivo (dispepsia) Q’assia, para o comércio interno na Costa Rica; onde também outra empresa (mondaisa@ racsa.co.cr) oferece saches da madeira em pó. Existem à venda fórmulas contendo Quassia amara associada com outras plantas. Um exemplo é o “Lipotrom”, uma formulação fitoterápica contendo Aloe ferox (Aloe), Quassia amara (quina), Cynara scolymus (alcachofra), Gentiana lutea (genciana), Peumus boldus (boldo), Rhamnus purshiana (cáscara sagrada), Solanum paniculatum (jurubeba) e Valeriana officinalis (valeriana); que utilizada no tratamento de insuficiência hepática, como colagoga, laxante e nas perturbações digestivas decorrentes de doenças do fígado (MELLO et al., 2009).
Ensaios gerais de identidade
Os quassinóides são considerados marcadores taxonômicos da família Simaroubaceae (POLONSKY, 1973). São empregados diversos métodos analíticos para a quantificação dos quassinóides, especialmente para quassina e neoquassina. Dentre eles se destacam: cromatografia de camada fina (CCD), cromatografia líquida de alta resolução (CLAE) e cromatografia gasosa acoplada à espectrometria de massa (CG-EM), descritas em seguida.
Métodos Analíticos
Cromatografia em Camada Delgada: Fernand (2003) em sua tese desenvolveu um método analítico, empregando CCD para identificação dos constituintes químicos da Quassia amara. A fase móvel utilizada foi clorofórmio:metanol 95:5 (WAGNER et al. 1984); com detecção pelo reagente ácido fosfomolíbdico com visualização UV em 254 nm, revelando alcalóides (ß-carbolinas, cantina-6-onas) e quassinóides.
Cromatografia Líquida de Alta Eficiência e Espectrome- tria de Massa: Para tratamento da malária, leucemia e doenças viróticas os quassinóides simalikalactona-D e quassimarina devem estar presentes em teores adequados. Para uso como inseticida ou repelente de insetos, a quassina e a neoquassina são os componentes de interesse. Estes quassinóides somente podem ser quantificados na mistura complexa presente na planta por CLAE em fase reversa, seguida por comparação dos tempos de retenção e dos sinais de RMN com amostras padrões ou com dados na literatura (HOUËL et al 2009; BERTANI et al 2007; DOU et al. 1996). Os resultados do método cromatográfico desenvolvido evidenciaram uma boa resposta para a quantificação dos principais quassinóides e boa linearidade dos mesmos na faixa de concentração de 25-1000 ng/mL. Entretanto, não foi encontrada metodologia analítica de rotina para quantificar quassimarina, cujas características foram descritos por Kupchan e Streelman (1976). SARAIS e cols. (2010), desenvolveram um método rápido de cromatografia líquida e espectrometria de massas, para quantificar os quassinóides inseticidas presentes em Quassia amara (quassina, neoquasina e picrasinosídeo B). Apresentam um método rápido e acurado para a identificação dos quassinóides inseticidas presentes em frutas e vegetais. A extração dos quassinóides é feita com acetonitrila, e estes são separados utilizando coluna Zorbax Eclipse XDB C8, com eluição isocrática e fase móvel consistindo de água e metanol com 0,1% de ácido fórmico.
Distinção de plantas semelhantes
Quassiae lignum do comércio pode consistir de Quassia amara (quássia do Suriname) ou Picrasmnia excelsa (quássia da Jamaica), ambos contendo quassina e neoquassina como componentes principais. Uma comparação cromatográfica entre as duas espécies foi realizada com CLAE-UV por Nestler e cols. (1980).
Especificações ou limites de pureza
Na ausência de dados na literatura técnica referente especificamente a Quassia amara, os limites não podem ser estabelecidos neste momento. Entretanto, como guia geral, os limites estabelecidos para outras plantas medicinais pelas Farmacopéias Brasileiras III e IV (partes 2 em diante), os procedimentos analíticos da Farmacopéia Brasileira IV parte 1, e os Guidelines da OMS (WHO, 2007), podem sugerir uma base de análise. Os valores médios de limites nas Farmacopéias citadas variam nos seguintes intervalos: para Material Estranho, até 1-3% (procedimento Farmacopéia Brasileira, 4ª edição, vol. I, V.4.2.2.); água em folhas secas (umidade), 9-15% (procedimento V.4.2.3.); Cinzas totais, 4-6% (cascas) e 8-15% (folhas) (procedimento V.4.2.4.), cinzas insolúveis em ácido 1-3% (procedimento V.4.2.5.). Os limites de contaminação por metais, poluentes orgânicos, inclusive praguicidas, materiais radioativos, micotoxinas e toxinas bacterianas, organismos microbiológicos, inclusive de fungos e protozoários, insetos e outros artrópodos e invertebrados, solventes, etc. e os procedimentos de análise são descritos no Guidelines for Assessing Quality of Herbal Medicines da OMS (WHO, 2007).
Componentes químicos principais
Quassinóides: quassina e neoquassina, quassimarina e simalikalactona D, hidroxiquassina, dehidroquassina, isoquassina, isoparaína, nigacillactona, quassialactol, nor-quassina, e 12α-hidroxi-13,18-dehidroparaína, paraína, iso-paraína, paraína 11-acetilparaína, quassinol e quassol A, 18-hidroxiquassina e 14-15-dehidroquassina, 16α-O-metilneoquassina, 1-α-O-metilquassina (HOUËL et al 2009; BERTANI et al 2007; GUO et al., 2005; 2009; DOU et al. 1996; BARBETTI et al., 1993).
Alcalóides indólicos: derivados da cantina: 3-metilcantina-2,6-diona; 5-hidroxi-3-metil-4-metoxicantina-2,6-diona; 3-metilcantina-5,6-diona; 2-metoxicantina-6-ona; 5-hidroxi-4-metoxicantina-6-ona e 3-N-óxido de 5-hidroxi-4-metoxicantina-6-ona. Derivados de ß-carbolina: 1-vinil-4,8-dimetoxi-ß-carbolina; 1-metoxicarbonil-ßcarbolina, (DÍAZ et al. 2006; BARBETTI et al., 1987; 1990; 1993).
Esteróides: ß-sitosterona, ß-sitosterol, campesterol
Ácidos alifáticos: ácido málico
Ácidos aromáticos: ácido gálico, ácido gentísico
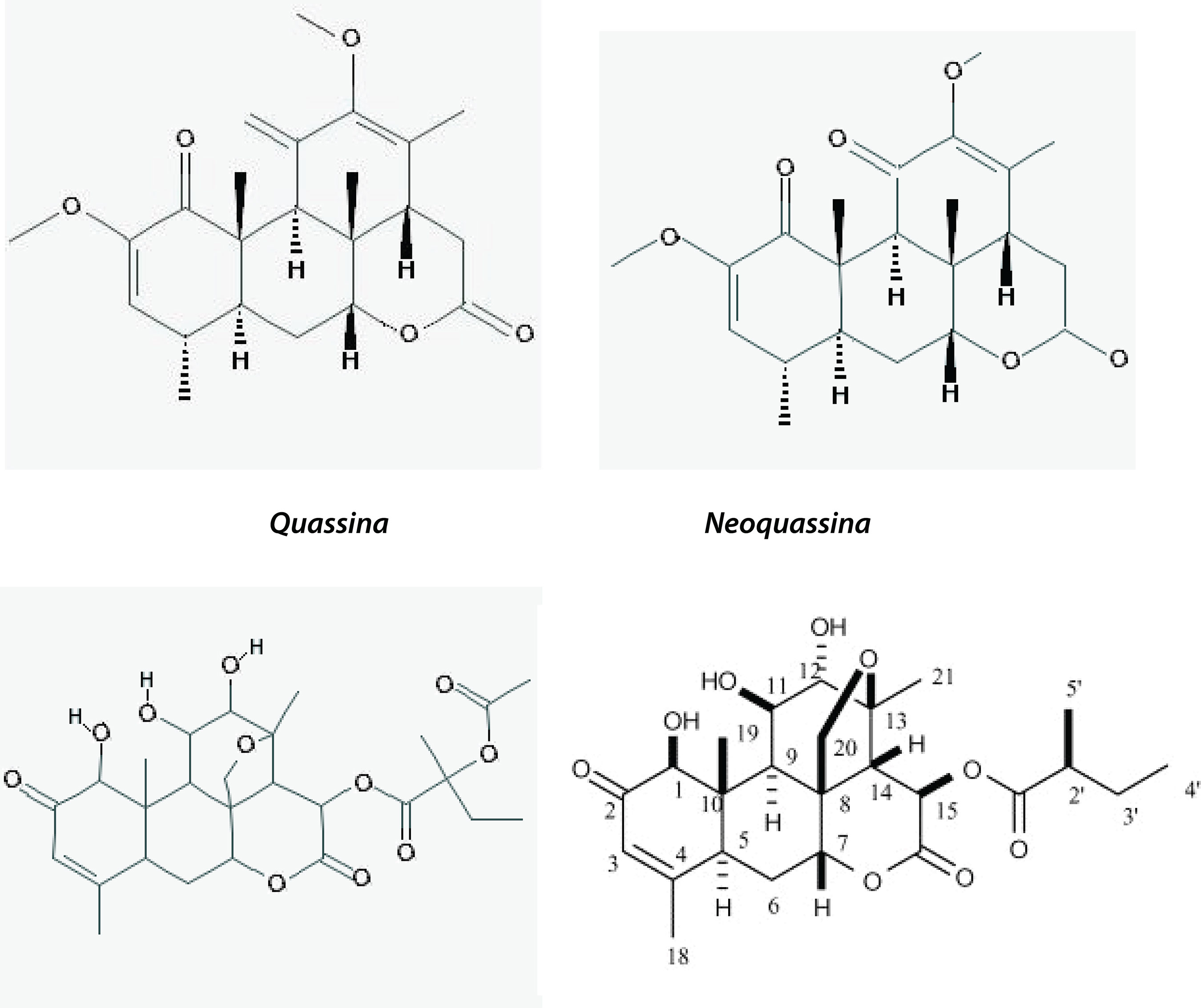
Distribuição na planta
O quassinóide majoritário, quassina, tem um teor médio de 0,10% na madeira de Quassia amara, chegando a 0,16% em troncos de maior diâmetro nos exemplares de terrenos úmidos e com apropriada exposição ao sol. Também ocorre em boa concentração no córtex A quassina também é encontrada em menor teor nos frutos, flores e folhas de Quassia amara (DÍAZ et al., 2004; BARBETTI et al., 1993; SIMÃO et al. 1991; ROBINS et al., 1984; VALENTA, 1971; HOLMAN, 1940). A neoquassina, o segundo quassinóide majoritário encontrado nas partes lenhosas de Quassia amara (acompanha a quassina), atingindo o teor mais elevado em exemplares expostos ao sol e de maior idade. Há semelhança entre material de ocorrência natural com o cultivado (VILLALOBOS et al., 1996, 1999; DÍAZ et al., 2004). A simalikalactona D e a quassimarina, os componentes principais responsáveis por atividade antimalárica e antineoplásica, estão presentes principalmente nas folhas juvenis, na seiva (BERTANI et al., 2006; KUPCHAN; STEELMAN, 1976). A observação sobre a infusão de folhas jovens secas ser mais ativa contra a malaria in vivo do que in vitro poderia indicar a sinergia de outras substâncias, talvez metabólitos do hospedeiro, ativas em si ou que facilitam a ação de simalikalactona D (BERTANI et al., 2007). A quantidade de quassina é também maior nas folhas jovens do que nas de maior idade; e maior também no nervo central e nos pecíolos maduros do que nas lamelas (ROBINS et al., 1984).
Usos medicinais
Usos apoiados em dados clínicos
O controle clínico da pediculose humana por um decocto da madeira e córtex de Quassia amara foi comprovado em ensaio clínico duplo cego contra placebo (NINCI, 1991).
Usos descritos em medicina tradicional
Tem sido empregada na medicina tradicional para combater a malária, problemas gastrointestinais, inclusive úlcera gástrica, flatulência, diarréia, parasitas intestinais (Entamoeba histolytica e Oxyurus), desordens do fígado e males da vesícula, inclusive náuseas e manchas da pele causadas por problemas hepáticos, bem como um estimulante de apetite, em cefaléia, tontura, arritmia cardíaca, diabetes, leucemia, como inseticida contra piolhos, em infecções por bactérias, contra anemia e picadas de cobras (ALCALDE; DEL POZO, 2007; SEGLEAU, 2001; TOMA, 2001; DOU et al., 1996; DUKE, 1994; GIRON et al., 1991; WILKELMAN, 1986; GUPTA et al.,1979; CECCHINI, 1971). Algumas tribos amazônicas utilizam a planta em banhos contra o sarampo e em lavagem bucal após a extração de dentes (LORENZI; MATOS, 2002).
Emprego do córtex e da madeira: A madeira e o córtex de Quassia amara vêm sendo empregadas principalmente na região do Baixo Amazonas, desde longa data, em substituição à casca de Cinchona para a malária (LORENZI; MATOS, 2002). Toma e cols. (2001; 2002) registram o uso do decocto das cascas e da madeira como antimicrobiano, analgésico, e como digestivo. Embora ele também cite o uso destas partes contra malária, outros autores apontam a infusão das folhas jovens para este uso (BERTANI et al., 2005). Receitas para os usos em afecções gastrointestinais, náuseas, e como tônico, foram publicadas por DA MATTA (1912); CHERNOVIZ (1920) e GRIEVE (1931). Le Cointe (1934) também registra estes usos medicinais. A infusão das cascas e da madeira é empregada em forma de clister como amebicida e anti-helmíntico (Entamoeba histolytica e Oxyurus, por exemplo) (NUNEZ-MELÉNDEZ, 1975; DIAZ et al., 2006). As tribos indígenas do Caribe nicaragüense utilizam o decocto dos talos como antídoto contra as picadas de serpentes (COE e ANDERSON, 1996a, 1996b, 1997, 1999, 2005). Na Europa se preparam vinhos amargos por maceração de uma pequena quantidade de madeira, para combater náuseas (DIAZ et al., 2006; CECCHINI, 1971). A madeira e o córtex da Quassia, macerados em água fria, como infusão ou licor tem propriedades tônicas e digestivas. O uso da decocção e da infusão de madeira e cascas para diabetes é descrito por Holdridge e Poveda (1975) (LOPEZ SAEZ et al., 2008). Segundo A infusão é utilizada em manchas da pele do rosto causadas por problemas hepáticos (DIAZ et al. 2006; SEGLEAU, 2001). Na Argentina e na Costa Rica emprega-se a decocção da madeira e córtex também para eliminar piolhos do couro cabeludo (NINCI, 1991; DIAZ et al., 2006).
Emprego das folhas: Na Guiana Francesa, o decocto das folhas frescas vem sendo utilizado como chá digestivo e para o tratamento da malária (BERTANI et al., 2005; MORS et al., 2000).
Emprego das flores: Em 1714 Fermin descreveu o uso no Suriname das flores para disfunções estomáquicas (PEREIRA, 1837).
Emprego das raízes: O cozimento da raiz de Quassia amara é tônico energético, antitérmico e empregado contra a dispepsia e vômitos espasmódicos (MORAES, 2009).
Outras utilizações
Inseticida natural: A atividade inseticida do caule e das cascas de Quassia amara é registrada desde 1884, na Inglaterra, no controle de afídeos e lepidópteros (PRAKASH; RAO, 1997; também tem sido ensaiados com eficácia em ácaros, coleópteros, hemípteros, himenópteros, lepidópteros e tissanópteros (ALCALDE e DEL POZO, 2007; INCLAN et al., 2007; MANCEBO et al., 2000; LESKINEN et al., 1984).
Subseqüentes trabalhos confirmaram essa propriedade (MANCEBO et al. 2000; CUBILLO et al., 1995; GRAINGE; AHMED, 1988; LE COINTE, 1934), que parece se dever a um processo de autodefesa, pois a madeira não é atacada pelos insetos.
Atividade antiofídica: Tradicionalmente tem sido utilizada na Nicarágua a decocção do córtex da Quassia amara como um potente antiofídico e também para controlar os vômitos provocados pelas mordidas das cobras (PÉREZ SOTO, 2008).
Alimentício: A madeira de Quassiaamara já foi utilizada como sucedâneo do lúpulo, na fabricação de cerveja e como princípio amargo em outras bebidas e alimentos (ALLEN, 1887).
Farmacologia
Atividade antimalárica
Ajaiyeoba e cols.(1999) mostraram que o extrato metanólico das folhas de Q. amara a 100-200 mg/kg via oral, diariamente por 3 dias, suprimiu Plasmodium berghei berghei em camundongos até o quarto 4. No entanto, não houve cura radical dos camundongos tratados, e eles morreram até o dia 16 após infecção. A Cloroquina, usada como controle, era menos ativa até o 4º dia, mas não demonstrou a recidiva observada com o extrato.
Baseado em resultados prévios (BERTANI, 2005; 2006) na Guiana Francesa, Bertani e cols. (2007) administraram por via oral infusos de folhas jovens frescas de Quassia amara a 0,5 mL contendo 2,3 microg de simalikalactona, 2 vezes ao dia durante 4 dias, a camundongos infectados por Plasmodium yoelli yoelli. Ao mesmo tempo analisaram os extratos pelo teor de simalikalactona D (CABRAL, 1993) mostrando que as folhas jovens secas continham apenas 1% do conteúdo de simalikalactona das folhas jovens frescas, tornando muito mais alta a dose necessária para suprimir a parasitemia. Outros grupos foram tratados com infusos de folhas maduras, que também continham pouca simalikalactona e se mostraram menos ativos. O resultado permitiu concluir que a simalikalactona era o componente antimalárico mais importante, mas não excluiu a presença de outras substâncias no extrato que contribuíssem para essa atividade. Os trabalhos também demonstraram, em culturas de Plasmodium falciparum, uma alta atividade de infusos das folhas jovens frescas, aquelas que tinham o maior teor de simalikalactona-D.
Atividade anti-helmíntica
Uma decocção da madeira em forma de supositório ou clister foi usada clinicamente para controlar Oxyurus e outros helmintos intestinais (ICS-UNIDO, 2010) e, por via oral, na expulsão de Entamoeba histolytica, esta última atividade atribuída a quassina (HARRIS; PHILLIPSON, 1982).
Atividade antibacteriana
O extrato apolar (diclorometano) das cascas de Quassia amara apresentou um valor de Concentração Inibitória Mínima (CIM) de 62,5 µg/mL na técnica do Microplate Alamar Blue Assay (MABA) contra Mycobacterium fortuitum, sendo o mais ativo de 26 extratos de plantas oriundas principalmente do cerrado, examinadas por Arantes e cols. (2005).
Motilidade intestinal
Badilla e cols.(1998) avaliaram a atividade do extrato bruto do córtex (ou da madeira seca) de Quassia amara sobre o trato intestinal de ratos. Estudaram cinco grupos de animais, sendo um grupo tratado com neostigmina 1 mg/kg via subcutânea , um segundo grupo com atropina 1 mg/kg via intramuscular, e três grupos tratados com o extrato aquoso bruto de Q. amara via oral, em doses de 250, 500 e 1000 mg/kg respectivamente. Nos animais tratados com 500 e 1000 mg/kg, o extrato aquoso de Q. amara produziu um aumento do trânsito intestinal dependente da dose, provavelmente mediado, segundo os autores, por uma ação muscarínica direta ao nível dos receptores M1 e M2, ou por uma ação anticolinesterásica.
Atividade antiulcerogênica
Badilla e cols. (1998) também determinaram a atividade antiulcerogênica em ratos, pelo modelo de indução de úlceras por aplicação de indometacina (10 mg/kg, via subcutânea). Um grupo controle foi tratado por via oral com 0,5 ml de água, e um segundo grupo controle positivo com 50 mg/kg de ranitidina. Concomitantemente, três grupos foram tratados por via oral com o extrato aquoso bruto do córtex (ou da madeira seca) de Quassia amara a doses de 250, 500 e 1000 mg/kg. Os animais tratados com 1000 mg/kg mostraram uma redução da acidez do conteúdo estomacal e da atividade péptica e um aumento da camada muco protetora da mucosa gástrica contra agentes indutores de lesões. Entretanto, no modelo de úlcera induzida por indometacina betanecol, (TOMA et al., 2002), os extratos de diclorometano e hexano, nas doses de 100 mg/kg por via oral inibiram significativamente as lesões ulcerosas. Nas lesões em úlceras induzidas por HCl-etanol ou por contenção e frio (estresse) em camundongos, todos os extratos investigados inibiram o índice de lesões ulcerativas a uma dose de 100 mg/kg. Os autores atribuíram a ação aos quassinóides, principalmente quassina e neoquassina, e sugerem vários mecanismos para o excelente grau de proteção atingido, entre eles os estímulos da síntese de prostaglandinas e da mucosa.
Atividade antiinflamatória
O extrato metanólico da planta inteira inibiu por um fator de 4,5 vezes a produção de NO em macrófagos J774 de camundongos frente ao estímulo de LPS sem mostrar citotoxicidade. A secreção de IL-1β e IL-12 se reduziu em 50% como o foram também NO sintase (iNOS) e ciclooxigenase-2 (COX-2). Os sobrenadantes de células tratadas com o extrato assinalaram uma redução de TNF-α por um fator de 3 a 5 vezes. Todas estas observações sugerem uma atividade potencial antiinflamatória (VERMA et al., 2010).
Entretanto (extratos das cascas de Q. amara de quatro diferentes polaridades como: 70% EtOH, 100% EtOH, 100% diclorometano, e 100% hexano, não exibiram atividade analgésica ou antiinflamatória em camundongos nos modelos da placa quente, contorção induzido por ácido acético ou edema de pata induzido por carragenana quando administrados por via oral (100, 250 e 500 mg/kg) (TOMA et al., 2002).
Atividade antileucêmica
A seiva das folhas de Quassia amara mostrou atividade contra o tumor experimental P388 de leucemia linfática em camundongos. Os principais componentes responsáveis pela atividade foram identificados como quassimarina e simalikalactona com T/C 165-175 em PS a 4mg/kg e 1 mg/kg respectivamente, ainda mostrando T/C 125 a 50 μg/kg. Também foi ativa em cultura de células do carcinoma humana KB, com ED50entre 1 e 10 ng (KUPCHAN; STREELMAN, 1976). O efeito inibidor da síntese de DNA e proteínas em Rous sarcoma vírus, exibido por vários quassinóides, sem afetar células normais, é ilustrada também pelo estudo de PIERRÉ e cols. (1980).
Atividade antileishmania e estimuladora do sistema imune
Na dose de 25 µg/mL (64,36 µM), a quassina mostrou baixa citotoxicidade para macrófagos peritoneais de camundongos, mas controlou a Leishmania donovani neles instalada. L. donovani exerce conhecidamente o seu efeito patogênico através da inibição da produção de óxico nítrico nos macrófagos infectados. Quassina reverte este efeito, estimulando a produção de NO e também estimulando citoquinas pró-inflamatórias, tais como TNF-α e IL-12 nos macrófagos (BHATTACHARJEE et al., 2009).
Atividade no Sistema Nervosa Central e sobre o diafragma
Barros e cols. (2009) avaliaram a atividade geral dos extratos aquoso, butanólico e de frações semipurificadas das folhas secas de Quassia amara L. no SNC, na contração muscular esquelética e na atividade da Ca2+-ATPase de músculo esquelético. A administração do extrato aquoso (1 g/kg p.o.) não alterou o comportamento de camundongos, mas aumentou a duração do sono barbitúrico. Em relação a este parâmetro, a fração butanólica foi 10 vezes mais potente que o extrato aquoso. A duração do sono induzido por éter não foi afetada pelos extratos. In vitro, a incubação da fração butanólica (0,1; 0,3 e 1,0 mg/mL) potenciou a contração do músculo diafragma de rato de 5%, 17% e 50%, respectivamente. Efeito semelhante foi obtido com a incubação de 5 frações semipurificadas. A atividade da Ca2+-ATPase de músculo esquelético foi inibida na presença das 5 frações com IC50 de 9,7; 8,5; 2,1; 1,8 e 2,1 μg/mL respectivamente. Uma hipótese para explicar a potenciação do sono barbitúrico seria a interação dos extratos com enzimas hepáticas responsáveis pelo metabolismo dos barbitúricos, descartando-se uma ação direta no SNC.
Atividade hormonal e ação antifertilidade
O extrato metanólico do caule de Q. amara inibe a secreção de testosterona tanto basal como estimulada pelo hormônio luteinizante (LH) em células Leydig de ratos que receberam o extrato. Ensaios in vivo mostraram que o extrato administrado na água de beber, em doses entre 100 e 2000 mg/kg causou uma redução do peso dos testículos, epidídimo e vaso seminal. As contagens de esperma e níveis de LH e FSH foram reduzidas. Entre 2-metoxicantin-6-ona e quassina isoladas deste extrato a atividade foi relacionada com a quassina. Este efeito é relacionado com a atividade antifertilidade de Quassia. A fertilidade é recuperada em 8 semanas póstratamento (NJAR et al., 1995; RAJI; BOLARINWA, 1997).
Atividade antiviral
Apers e cols. (2002) mostraram que simalikalactona-D, isolada das raízes de Quassia africana Baill., é a responsável pela alta atividade contra os vírus Herpes simplex, Semliki forest, Coxsackie e Vesicular stomatitis. A quassina não demonstrou tal atividade.
Adbel-Malek e cols. (1996) mostraram que um extrato aquoso da casca de Quassia amara tem atividade inibitória in vitro de HIV em células linfoblastóides MT-2 com um índice terapêutico acima de 25.
Toxicologia
Ensaios experimentais em animais
Casca: Arantes (2009) avaliou a toxicidade oral aguda e em médio prazo (90 dias) segundo protocolos da OECD, do extrato diclorometânico das cascas de Q. amara. O extrato foi administrado por gavagem em forma de solução aquosa homogeizada com Tween 80, nas concentrações de 200, 400 e 800 µg/mL na água de beber. Efeitos sobre o aspecto (pelo, pele, lacrimação, piloerecção) e comportamento (tremores) foram observados a 30 min, 1, 2, 4, 8 e 24 h, não ocorrendo nenhum desvio nos animais controles que receberam somente água, exceto uma irritabilidade em 30% nos animais com maior dosagem. O perfil bioquímico do sangue (alanina aminotransferase, aspartarto aminotransferase, gama glutamiltransferase, fosfatase alcalina, bilirubina, uréia, creatinina, tempo de protrombina) registrou um aumento discreto de uréia e creatinina. Nas ratas fêmeas houve uma alteração nas doses mais altas de ALT e γ-GT. O perfil hematológico, dos ratos (machos e fêmeas) não mostrou nenhuma alteração. Observações macroscópicas dos órgãos como coração, pulmão, baço, rim e fígado não apresentaram qualquer alteração visível. No estudo de toxicidade oral aguda com dose de 5000 mg/ kg não houve nenhuma morte.
Madeira: Garcia-Gonzalez e cols. (1997) não observaram qualquer indicação de toxicidade aguda com um extrato aquoso da madeira de Q. amara em camundongos com doses orais de 500 e 1000 mg/kg/dia durante 9 dias. Em outro ensaio foi observado um aumento da mobilidade intestinal, discreto a 500 mg/kg e significante a 1000 mg/kg.
Folhas: Barros e cols. (2009) mostraram que a administração do extrato aquoso das folhas secas (1000 mg/kg p.o.) não alterou o comportamento de camundongos, mas aumentou a duração do sono barbitúrico. O consumo de decocções de folhas frescas de Q. amara não demonstrou resultado tóxico (BERTANI et al., 2005).
Droga associada: Mello e cols. (2009) desenvolveram um estudo pré-clínico da formulação “Lipotrom”, contendo Aloe ferox (aloé), Quassia amara (quina), Cynara scolymus (alcachofra), Gentiana lutea, (genciana), Paumus boldus (boldo), Rhamnus purshiana (cáscara sagrada), Solanum paniculatum (jurubeba) e Valeriana officinalis (valeriana), no qual foram investigados os efeitos toxicológicos quando administrados por via oral (44 dias) em ratas Wistar, durante a prenhez e lactação e em coelhos machos “Nova Zelândia” durante 30 dias. As dosagens administradas foram 10 vezes as preconizadas para fins terapêuticos em seres humanos. Foram avaliados os seguintes sinais: deambulação, comportamento, sonolência, alterações de ritmo e freqüência respiratória. A formulação fitoterápica não apresentou efeitos tóxicos na gestação e lactação e foi considerada relativamente inócua.
Ensaio Clínico
Um ensaio clínico simples foi conduzido com um fitoterápico (Q’assia da Lisan S.A., Costa Rica) derivado de Q. amara (provavelmente da casca, solvente não especificado) em 60 voluntários (15-60 anos) com dispepsia. Destes um grupo cuja dispepsia derivava de consumo de álcool, recebeu extrato padronizado em forma de um comprimido 3 vezes ao dia por 5 dias (dose não especificada). O outro grupo com dispepsia de diferente origem recebeu o mesmo tratamento, contudo durante 30 dias. Sintomas como dor epigástica, hiperacidez, diarréia e constipação desapareceram em aproximadamente metade dos pacientes e diminuíram nos demais (ICS-UNIDO, 2010).
Efeitos Adversos
Lanini e cols. (2009) descrevem riscos da utilização do chá de Quassia inadequadamente. Em doses altas, pode produzir diminuição de pressão arterial e não se deve ingerir acompanhada de bebidas alcoólicas. São registrados problemas gastrintestinais, cefaléia, tontura e arritmia cardíaca.
Precauções
Gerais: Em doses normais (1g/dia via oral em ratas) nenhum efeito adverso foi observado. Altas dosagens do extrato do caule e sementes produzem vômitos, irritação da mucosa gástrica, (ALONSO, 2004; CANIGUERAL et al. 1998; CÁCERES, 1996). Se for ingerida em excesso pode causar depressão (SEGLEAU, 2001). O uso tópico no couro cabeludo contra piolhos não demonstrou efeito adverso (NEWALL et al., 1996). A quássia é contraindicada para mulheres durante a menstruação, porque produz cólicas uterinas (NEWALL et al., 1996; OCAMPO; MAFIOLI, 1987; MANFRED, 1947).
Interações com drogas: Altas dosagens podem interferir quando associadas a drogas para tratamentos cardíacos e anticoagulantes (ALONSO, 2004; NEWALL et al., 1996).
Efeitos sobre a fertilidade: Conforme citado acima o extrato metanólico do caule administrado na água de beber reduziu a fertilidade de ratos machos. A quassina foi demonstrada ser o principal responsável por este efeito (RAJI; BOLARINWA, 1997).
Gravidez: Não é recomendado a gestantes (CÁCERES, 1996; NEWALL et al., 1996; ALONSO, 2004).
Efeitos sobre a lactação: Está contra indicado para mulheres em fase de aleitamento (CÁCERES, 1996; NEWALL et al., 1996).
Uso pediátrico: Não é recomendado para crianças (CÁCERES, 1996; NEWALL et al., 1996).
Formas de Dosagem
Da madeira e casca: Dados encontrados no portal ICS-UNIDO:
Infusão e maceração: 2-7 gramas por dia, distribuídas em 2-3 vezes ao dia.
Extrato fluído: A dose é de 1-2 g.
Tintura: Relação de 1:5 em 50-70% etanol. Dosagem: 1-2 ml.
Enema: 150 ml infusão 1:2 administrada pelo reto durante três manhãs consecutivas em conjunto com sulfato de magnésio 16g via oComprimidos: Não foram encontrados dados que definem a dose em comprimidos fabricados pela LISAN, Costa Rica, mas recomenda-se para hiperacidez e problemas de digestão resultantes de consumo excessivo de bebidas alcoólicas e de alimentos gordurosos, 1 a 2 comprimidos ao dia (ICS-UNIDO, 2010). USP recomenda 65 mg em forma seca e a Farmacopéia Britânica 0,2 a 0,3 g de pó do extrato aquoso. Em casos de deficiência da secreção de bílis: 1 tablete 3 vezes ao dia durante 20 dias (ICS-UNIDO, 2010).
Posologia em uso popular
Decocção: 2 colheres de sopa de cascas picadas em 1 litro de água por 15 minutos. Tomar 2 xícaras de chá ao dia.
Infusão: 6 colheres de sopa de folhas picadas em 1 litro de água fervente.
Uso externo: banhos nos casos de sarampo (PLANTMED, site).
Para tratamento da malária: No uso popular observado por BERTANI et al. (2005): folhas frescas (20g) são colocadas em um litro de água fria e fervidas por 10 minutos deixando esfriar. Para a preparação do decocto do caule Bertani e cols. (2005) observaram o uso de 100g de caule em 800 mL de água e ferver por 15 min. deixando esfriar. Informação sobre a o regime de administração da infusão e do decocto não foi encontrada. Nota-se que o teor de simalikalactona-D, o quassinoide mais ativo contra malária, é maior em folhas jovens frescas, com uma concentração de 4,63µg/ml na infusão, sendo da ordem de 2 ng/ml na infusão de folhas maduras, previamente dessecadas, (BERTANI et al., 2007).
Regulamentações
Na Europa, a quassina é permitida com um limite máximo de 5 mg/kg em produtos alimentícios sendo permitido até 10 mg/kg em confeitaria e 50 mg/kg em bebidas alcoólicas (European Commission); (NEWALL et al., 1996). Nos Estados Unidos, “Quassia” (de Picramnia excelsa ou Quassia amara) é considerada de uso seguro em alimentos, segundo a lista Generally Regarded as Safe Status (GRAS 172.510) do FDA - (ICS-UNIDO, 2010). Nas bebidas não alcoólicas o limite permitido é de 71,8 ppm (LEUNG; FOSTER, 1996). Na homeopatia, segundo a Consulta Pública no 85 de 2002 da ANVISA, não há restrição aplicável para esta droga, cim base na sua toxicidade relativa de substâncias utilizadas. Quassia amara é listada nas Farmacopéias do Egito, França, Japão, Europa, na British Herbal Pharmacopoeia (BHP, Reino Unido - 1983, 1990) e no Martindale (30a Ed.).
Referências
ABDEL-MALEK, S.; BASTIEN, J.W.; MAHLER, W.F., JIA, QI; REINECKE, M.G.; ROBINSON, W.E.; SHU, Y.-H. Drug leads from the Kallawaya herbalists of Bolivia. 1. Background, rationale, protocol and anti-HIV activity. Journal of Ethnopharmacology, 50, 157-166, 1996.
AJAIYEOBA, E.O.; ABALOGU, U.I.; KREBS, H.C.; ODUOLA, A.M.J. In vivo antimalarial activities of Quassia amara and Quassia undulata plant extracts in mice. Journal of Ethnopharmacology, v.67, p.321-325, 1999.
ALCALDE, M.T.; DEL POZO, A. Vinagre de quassia como tratamiento cosmético natural contra los piojos, Farmácia práctica. Formación Permanente en Dermofarmacia. OFFARM (Barcelona), v.26, n.3, p.132-133, 2007.
ALLEN, A.H. An improved method of detecting quassia and certain other hop-substitutes in beer. Analyst, v.12, p.107-112, 1887.
ALONSO, J. Tratado de Fitofármacos y Nutracéuticos. 1ª ed. Editora Corpus. Buenos Aires, p. 894-896, 2004.
APERS, S.; CIMANG, A.K.; VANDEN BERGHE, D.; VAN MEENEN, E.; LONGANGA, A.O.; FORIERS, A.; VLIETINCK, A.; PIETERS, L. Antiviral activity of simalikalactone D, a quassinoid from Quassia africana. Planta Medica, v.68, p.20-24, 2002.
ARANTES, V.P.; SATO, D.N.; VILEGAS, W.; SANTOS, L.C. e LEITE, C.Q.F. Plantas do Cerrado brasileiro com atividade contra Mycobacterium fortuitum. Revista de Ciências Farmmacêuticas Básica e Aplicada, v.26, p.195-198, 2005.
ARANTES, V.P. Avaliação Pré-Clínica de Extratos Vegetais de Plantas do Cerrado Brasileiro com Atividade Antimicobacteriana. Tese de Doutorado, Araraquara - SP, 2009.
BADILLA, B.; MIRANDA, T.; MORA, G.; e VARGAS, K. Actividad gastroinstestinal del extracto acuoso bruto de Quassia amara (Simarubaceae). Revista de Biologia Tropical, v.46, p.203-210, 1998.
BALFOUR, J.H. Manual of Botany, Introduction to the study of the Structure, Physiology and Classification of Plants, 2nd ed., John Joseph Griffin and Co. Glasgow, 1851, p.391.
BARBETTI, P.; GRANDOLINI, G.; FARDELLA G.; CHIAPPINI, I. Indole Alkaloids from Quassia amara. Planta Medica, v.53, p.289-290, 1987.
BARBETTI, P.; GRANDOLINI, G.; FARDELLA G.;CHIAPPINI, I.; MASTALIA, A. New Canthin-6-one Alkaloids from Quassia amara. Planta Medica, v.56, p. 216-217, 1990.
BARBETTI, P.; GRANDOLINI, G.; FARDELLA G.; CHIAPPINI, I. Quassinoids from Quassia amara. Phytochemistry, v.32, p.1007-1013, 1993.
BARROS, J.S.; LAPA, A.J.; TANAE, M.M. Avaliação da atividade farmacológica, in vitro, da Fração Butanólica de Quassia amara L (Simaroubaceae). Anais da 61ª Reunião Anual da SBPC, Manaus, 2009.
BERG, M.E.V.D. Plantas Medicinais na Amazônia: Contribuição ao seu Conhecimento Sistemático, 2ª. Edição. Museu Paraense Emílio Goeldi, Belém, p.58-61, 1993.
BERTANI, S.; BOURDY, G.; LANDAU, I.; ROBINSON, J.C.; ESTERRE, P.; DEHARO, E. Evaluation of French Guiana tradicional antimalarial remedies. Journal of Ethnopharmacology, v.98, p.45-54, 2005.
BERTANI, S.; HOUEL E.; STIEN, D.; CHEVOLOT, L.; JULLIAN, V.; GARAVITO, G.; BOURDY, G.; DEHARO, E. Simalikalactone D is responsible for the antimalarial properties of an Amazonian traditional remedy use made with Quassia amara L. (Simaroubaceae). Journal of Ethnopharmacology, v.108, p.155-157, 2006.
BERTANI, S., HOUEL, E., BOURDY, G.; STIEN, D.; JULLIAN, V.; LANDAU, I.; DEHARO, E. Quassia amara L. (Simaroubaceae) leaf tea: Effect of the growing stage and desiccation status on the antimalarial activity of a tradicional preparation. Journal of Ethnopharmacology, v.111, p.40-42, 2007.
BHATTACHARJEE, S.; Gupta, G.; BHATTACHARYA, P.; MUKHERJEE, A.; MUJUMDAR, S.B.; PAL, A.; MAJUMDAR, S. Quassin alters the immunological patters of murine macrophages through generation of nitric oxide to exert antileishmanial activity. Journal of Antimicrobial Chemotherapy, v. 63, p. 317-324, 2009.
BROWN, N.R. The autoecology and agroforestry potential of the biterwood tree Quassia amara L. ex Blom (Simaroubaceae). Thesis PhD, Cornell University, 250 pp., 1995.
BUSBEY, R.L. A bibliography of quassia. United States Department of Agriculture, Bureau of Entomology and Plant Quarantine, Philadelphia, 56 pp., 1939.
CABRAL, J.A., MCCHESNEY, J.D., MILHOUS, W.K., A new antimalarial quassinoid from Simaba guianensis. Journal of Natural Products, v.56, p.1954-1961, 1993.
CÁCERES, A. Plantas de uso medicinal en Guatemala. Ed. Universitaria, San Carlos de Guatemala, 1996.
CANIGUERAL, S.; VILÁ, R.; WICHTL, M. Plantas Medicinales y Drogas Vegetales para infusión y Tisana. OEMF SRL. Espanha, 1998.
CECCHINI, T. Enciclopedia de las hierbas y de las plantas medicinales. Ed. De Vecchi, Barcelona. p.153, 1971.
CHERNOVIZ, P.L.N. Diccionario de Medicina Popular, 18ª Ed., Paris, 1908; 19ª edição, 1920; reimpresso como a Grande Farmacopéia Brasileira, Editora Itatiaia, Belo Horizonte, 1996.
CLARK, E.P. Quassin. I. The Preparation and Purification of Quassin and Neoquassin, with Information Concerning their Molecular Formulas. Journal of the American Chemical Society, v.59, p.927-931, 1937.
COE, F.G.; ANDERSON, G.J Ethnobotany of the Garífuna of Eastern Nicaragua. Economical Botany, v.50, p.71-107, 1996a.
COE, F.G.; ANDERSON, G.J Screening of medicinal plants used by the Garífuna of Eastern Nicaragua for bioactive compounds. Journal of Ethnopharmacology, v.53, p.29-50, 1996b.
COE, F.G.; ANDERSON, G.J Ethnobotany of the Miskitu of Eastern Nicaragua. Journal of Ethnopharmacology, v.17, p.171-214, 1997.
COE, F.G.; ANDERSON, G.J. Ethnobotany of the Sumu (Ulwa) of Souteastern Nicaragua and comparisons with Miskitu plant lore. Economy Botany, v.53, p.363-386, 1999.
COE, F.G.; ANDERSON, G.J. Snakebite ethnopharmacopoeia of eastern Nicaragua. Journal of Ethnopharmacology, v.96, p.303-323, 2005.
CUBILLO, D.; SANABRIA, G.; HILJE, L. Efecto de un extracto de Quassia amara sobre la mosca blanca. In: Ocampo, R. (ed.), Potencial de Quassia amara como insecticida natural. Actas CATIE. Cartago, Costa Rica. p.105-109, 1995.
DA MATTA, A.A., Flora Médica Brasiliense, 1912, reimpressão, Ed. Valer, Manaus, 2003.
DÍAZ, R.; HERNÁNDEZ, L.; OCAMPO, R.; CICCIO, J.F. Domesticación y Fitoquímica de Quassia amara (Simaroubaceae) em el trópico húmedo de Costa Rica. Lankesteriana, v.6, p.49-64, 2006.
DÍAZ, R.; CICCIO, J.F.; OCAMPO, R. Domesticación de recursos naturales nativos em condiciones agroecológicas en el trópico húmedo em el Caribe de Costa Rica. In: CANUTO, J.C. & J.A. COSTABEBER (eds.). Agroecologia. Conquistando a Soberania Alimentar, Embrapa Clima Temperado, Pelotas, Brasil, 2004, p.193-212.
DOU, J.; KHAN, I.A.; MCCHESNEY, J.D.; BURANDT JR, C. Qualitative and Quantitative High Performance Liquid Chromatographic Analysis of Quassinoids in Simaroubaceae Plants. Phytochemical Analysis, v.7, p.192-200, 1996.
DUKE, J.A. Amazonian Ethnobotanical Dictionary. CRC Press, USA, pp. 181, 1994.
FARMACOPÉIA BRASILEIRA, quarta edição, partes I-V, Ateneu Editora, São Paulo, 1988-2004.
FERNAND, V.E. Initial Characterization of Crude Extracts from Phyllanthus amarus Schum. And Thonn. And Quassia amara L. using Normal Phase Thin Layer Chromatography. Master Thesis, Louisiana St. Univ. 70p., 2003.
GARCÍA-GONZÁLEZ, M., GONZÁLEZ-CAMACHO, S.M., PAZOS-SANOU, L. Pharmacologic activity of the aqueous wood extract from Quassia amara (Simarubaceae) on albino rats and mice. Revista de Biologia Tropica, v.44-45, p.47-50, 1997.
GENTRY, A.H. A field guide to the families and genera of woody plants of northwest South America (Colombia, Ecuador, Peru). Conservation International, Washington, p. 783-786, 1993.
GIRON, L.M.; FREIRE, V.; ALONZO, A.; CACERES, A. Ethnobotanical survey of the medicinal flora used by the Caribs of Guatemala. Journal of Ethnopharmacology, v.34, p.173-187, 1991.
GRAINGE M.; AHMED S. Handbook of Plants with Pest-Control Properties. John Wiley & Sons. New York, 1988.
GRANDTNER, M.M. Elsevier’s Dictionary of Trees, vol 1, pág. 736, Foreign Language Study, 2005.
GRENAND, P; MORETTI, C.; JAQUEMIN, H.; PRÉVOST, M-F. Pharmacopées traditionelles en Guayane, IRD Editions, Paris, pp. 624-625, 2004.
GRIEVE, M. A Modern Herbal, Harcourt, Brace, New York, p.662-663, 1931.
GUO, Z.; VANGAPANDU, S.; SINDELAR, R.W.; WALKER, L.A., SINDELAR, R.D. Biologically Active Quassinoids and Their Chemistry: Potential Leads for Drug Design. Current Medicinal Chemistry, 12, 173-190, 2005.
GUO, Z.; VANGAPANDU, S.; SINDELAR, R.W.; WALKER, L.A., SINDELAR, R.D. Biologically Active Quassinoids and Their Chemistry: Potential Leads for Drug Design. Frontiers in Medicinal Chemistry, 4, 285-308, 2009.
GUPTA, M.P.; ARIAS, T.D.; CORREA, M.; LAMBA, S.S. Ethnopharmacognostic observations on Panamanian medicinal plants. Part. I. Quarterly Journal of Crude Drug Research, v.17, p.115-130, 1979.
HARRIS, A.; PHILLIPSON, J., Cytotoxic and amoebicidal compounds from Picramnia excelsa. Journal of Pharmacy and Pharmacology, v.34, p.43, 1982.
HOLDRIDGE, L.R.; POVEDA, L.J. Árboles de Costa Rica. I. Palmas, otras monocotiledóneas arbóreas y árboles con hojas compuestas o lobuladas. Centro Científico Tropical, San José. p. 432-439, 1975.
HOLMAN, H.J. A survey of insecticide materials of vegetable origin. Imperial Institute, Londres, Gran Bretaña, p.133-153, 1940.
HOUËL, E.; BERTANI, S.; BOURDY, G.; DEHARO, E.; JULLIAN, V.; VALENTIN, A.; CHEVALLEY, S.; STIEN, D. Quassinoid constituents of Quassia amara L. leaf herbal tea. Impact on its antimalarial activity and cytotoxicity. Journal of Ethnopharmacology, v.126, p.114-118, 2009.
ICS-UNIDO (International Centre for Science and High Technology) Medicinal and Aromatic Plants, portal acessado em 10/09/2010. http://portal.ics.trieste.it/MAPs/MedicinalPlants_Plant.aspx?id=650
INCLAN, D.J.; ALVARADO, E.; WILLIAMS, R.N. Evaluación de cuatro insecticidas naturales para el control de tecla, Strymon megarus (Godart) (Lepidóptera: Lycaenidae), em el cutivo de pina. Tierra Tropical, v.3, p.199-210, 2007.
JUÁREZ-JAIMES, V. Flora palinológica de Guerrero: Simaroubaceae, Vol.2, UNAM - México, 1992.
KUPCHAN, S.M.; STREELMAN, D.R. Quassimarin, a new antileukemic quassinoid from Quassia amara. Journal of Organic Chemistry, v.41, p.3481-3482, 1976.
LANINI, J.; DUARTE-ALMEIDA, J.M.; NAPPO, S.; CARLINI, E.A. “O que vêm da terra não faz mal” - relatos de problemas relacionados ao uso de plantas medicinais por raizeiros de Diadema/SP. Brazilian Journal of Pharmacognosy, v.19, p.121-129, 2009.
LE COINTE, P.A Amazônia Brasileira. Vol. 3. Árvores e Plantas Úteis. Livraria Clássica, Belém, pp. 387-388, 1934.
LESKINEN, V.; POLONSKY, J.; BHATNAGAR, S. Antifeedant activity of quassinoids. Journal of Chemical Ecology, v.10, p.1497-1507, 1984.
LEUNG, A.Y.; FOSTER, S. Encyclopedia of Common Natural Ingredientsusedin Foods, Drugs and Cosmetics, 2a edição, Ed. Jonh Wiley & Sons, New York, 1996.
LORENZI, H.; ABREU MATOS, F.J. Plantas Medicinais no Brasil. Inst. Plantarum, Nova Odessa, SP, p.512, 2002.
MACEDO, E.G.; POTIGUARA, R.C.V.; ROCHA NETO, O. Anatomia Foliar de Quassia amara L. (Simaroubaceae), uma Espécie Medicinal e Inseticida. Boletim do Museu Paraense Emilio Goeldi. Ser. Ciências Naturais, v.1, p.9-18, 2005.
MANCEBO, F.; HILJE, L.; MORA, G.A.; SALAZAR, R. Antifeedant activity of Quassia amara (Simaroubaceae) extracts on Hypsipyla grandella (Lepidoptera: Pyralidae) larvae. Crop Protection, v.19, p.301-305, 2000.
MANFRED, L. 7.000 Recetas Botânicas a base de 1.300 plantas medicinales americanas. Kier, Buenos Aires, 778 pp., 1947.
MELLO, J.R.B.; MELLO, F.B.; LANGELOH, A. Toxicidade Pré-Clínica de Fitoterápico Contendo Aloe ferox, Quassia amara, Cynara scolymus, Gentiana lútea, Peumus boldus, Rhamnus purshiana, Solanum paniculatum e Valeriana officinalis. Latin American Journal of Pharmacy, v.28, p.183-91, 2009.
MORAES, M. Phytographia ou Botanica Brasileira Applicada Medicina, S Artes E., Biblio Bazaar, LLC, p.334, 2009.
MORS, W.B.; RIZZINI, C.T.; PEREIRA, N.A. Medicinal Plants of Brazil, Reference Publications, Algonac, Michigan, 2000.
MORTON, J.F. Atlas of medicinal plants of Middle America. Charles C.Thomas Publisher, Springfield, Illinois, p.389-390, 1981.
NESTLER, T.; TITTEL, G.; WAGNER, H. Quantitative Bestimmung der Bitter-Quassinoide von Quassia amara und Picrasma excelsa. Planta Medica, v.38, p.204-213, 1980.
NEWALL, C.A.; ANDERSON, L.A.; PHILLIPSON, J.D. Herbal Medicines. A guide for healthcare professionals. The Pharmaceutical Press, London, UK, 1996.
NJAR, V.C.; ALAO, T.O.; OKOGUN, J.I.; RAJI, Y.; BOLARINWA, A.F.; NDUKA, E.U. Antifertility activity of Quassia amara: quassin inhibits the stereidogenesis in rat Leydig cells in vitro. Planta Medica, v.61, p.180-182, 1995.
NINCI, M.E. Prophylaxis and treatment of pediculosis with Quassia amara. Revista de la Facultad de Ciencias Médicas (Córdoba), v.49, p.27-31, 1991.
NÚNEZ-MELÉNDEZ, E. 2-methoxycanthin-6-one: a new alkaloid from the Stern wood of Quassia amara. Planta Medica, v.59, p.259-261, 1975.
OCAMPO, R.; MAFFIOLI, A. El uso de algunas plantas medicinales en Costa Rica. Vol.1. Litografia e Imprenta Lil. SA, San José, Costa Rica, pp.49-50, 1987.
PEREIRA, J. The Elements of Material Medica and Therapeutics, vol.2, pp. 874-875, Joseph Carson, Philadelphia, 1854.
PEREIRA, London Medical Gazette: or, Journal of Practical Medicine, v.20, 532, p.1837.
PÉREZ, E. Plantas útiles de Colombia. Ed.Victor Hugo, Medellín, Colômbia, p.695-697, 1990.
PÉREZ SOTO, J. Conocimientos y usos etnobotánicos acerca de plantas con potencial medicinal de la comunidad de Tilgue (Isla de Ometepe, Departamento de Rivas, Nicarágua). Monografia de Licenciatura, UNAN-Managua, Nicarágua, 2008, 150 pp.
PIERRÉ, A.; ROBERT-GÉRO, M.; TEMPÊTE, C.; POLONSKY, J. Structural requirements of quassinoids for the inhibition of cell transformation. Biochemical and Biophysical Research Communications, v.93, n.3, p.675-686, 1980.
PITTIER, H. Plantas usuales de Costa Rica. Ed. Costa Rica, San José, Costa Rica, p.170, 1978.
PLANTA MED, http://www.plantamed.com.br/planta-servas/especies/Quassia_amara.htm Acessado em 22/09/2010.
POLONSKY, J.; Quassionoid bitter principles. Fortschritte der Chemie Organischer Naturforstoffe, v.30, 101-150, 1973.
PRAKASH, A.; RAO, J. Botanical pesticides in agriculture. CRC Press Inc., Boca Raton, Florida, USA, 1997.
RAJI, Y.; BOLARINWA, A.F. Antifertility activity of Quassia amara in male rats - in vivo study. Life Sci. v.61, p.1067-1074, 1997.
ROBINS, R.J.; RHODES, M.J.C. High-perfomance liquid chromatographic methods for the analysis and purification of quassinoids from Quassia amara L. Journal of Chromatography, v.283, p.436-440, 1984.
LOPEZ SAEZ, J.A.; PÉREZ SOTO, J. Etnofarmacología y actividad biológica de Quassia amara (Simaroubaceae): Estado de la cuestión. Boletin Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, v.7, p.234-246, 2008.
SARAIS, G.; COSSU, M.; VARGIU, S; CABRAS, P.; CABONI, P. Liquid chromatography electrospray ionization tandem mass spectrometric determination of quassin and neoquassin in fruits and vegetables. Journal of Agricultural and Food Chemistry, v.58, p.2807-2811, 2010.
SEGLEAU, J. Plantas medicinales en el trópico húmedo, San José, Ed. Guayacán. p. 102-103, 2001.
SIMÃO, S.M.; BARREIROS, E.L.; DAS, G.F.; DA SILVA, M.F.; GOTTLIEB, O.R. Chemogeographical evolution of quassinoids in Simaroubaceae. Phytochesmistry, v.30, p.853-865, 1991.
STEVENS, W.D.; ULLOA C.; POOL A.; MONTIEL, O.M. Flora de Nicarágua, v.85, tomos I, II y III. Missouri Botanical Garden Press, St. Louis Missouri, 2001.
THOMAS, W.W. The American genera of Simaroubaceae and their distribuition. Acta Botanica Brasilica, v.4, p.11-18, 1990.
TOMA, W. Atividade analgésica e antiulcerogênica de quatro extratos de diferentes polaridades obtidos a partir das cascas de Quassia amara L. Tese de Mestrado, Universidade Estadual de Campinas, UNICAMP, 2001, 122 pp.
TOMA, W; GRACIOSO, J.S.; ANDRADE, F.D.P.; HIRUMA-LIMA, C.A.; VILEGAS, W.; BRITO, A.R.M.S. Antiulcerogenic Activity of Four Extracts Obtained from the Bark Wood of Quassia amara L. (Simaroubaceae). Biological and Pharmaceutical Bullettin, v.25, p.1151-1155, 2002.
Tropicos.org. Missouri Botanical Garden, <http://www.tropicos.org/Name/29400117. Acesso em 12/08/2010.
VALENTA, Z. Ryanodine and quassin. In International TOPAC Congress of Pesticide Chemistry, Pesticide Chemistry Proceedings, Tel-Aliv, Israel, 1971.
VERMA N.; TRIPATHI, S.K.; SAHU, D.; DAS; H.R.; DAS, R.H. Evaluation of inhibitory activities of plant extracts on production of LPS-stimulated pro-inflammatory mediators in J774 murine macrophages. Molecular and Cellular Biochemistry, v.336, p.127-35, 2010.
VILLALOBOS, R. Caracterización de la distribución de una planta medicinal (Quassia amara) como base para su manejo técnico, pp. 17-22. In X Congresso Nacional Agronômico Vol. I., EUNED, San José, Costa Rica, 1996.
VILLALOBOS, R.; MARMILLOD, D.; OCAMPO, R.; MORA, G.; ROJAS, C. Variations in the quassin and neoquassin content in Quassia amara (Simaroubaceae) in Costa Rica. Ecological and Management implications. Acta culturae, v.502, p.369-375, 1999.
WAGNER, H, BLADT, S.; ZGAINSKI, E.M. Plant drug Analysis, Springer, Berlin, p.134, 1984.
WILKELMAN, M. Frequently used medicinal plants in Baja California Norte. Journal of Ethnopharmacology, v.18, p.109-131, 1986.
WOODSON, R.E.; SCHERY R.W.; PORTER, D.M. Flora of Panama. Part VI. Family 90. Simaroubaceae. Annals of the Missouri Botanical Garden, v.60, n.1, p.23-39, 1973.
WHO. WORLD HEALTH ORGANIZATION. WHO Guidelines for Assessing Quality of Herbal Medicines with Reference to Contaminants and Residues, Genebra, 2007.