REVISÃO
Hesperozygis ringens (Benth.) Epling (Lamiaceae): uma revisão
Hesperozygis ringens (Benth.) Epling (Lamiaceae): a review
Resumo
Hesperozygis ringens é uma espécie nativa e endêmica do Rio Grande do Sul pertencente à Lamiaceae. Essa planta arbustiva está distribuída em cinco municípios gaúchos e encontrada em regiões restritas próximo a locais arenosos e pedregosos. O forte odor característico da espécie é proporcionado pelo óleo essencial, mais especificamente a pulegona como o principal constituinte. Este trabalho propôs, por meio de uma revisão, apresentar o potencial de H. ringens em diversas linhas de ação das propriedades dos óleos essenciais, assim como a sua composição química. Estudos realizados mostraram a ação antiparasitária e alelopática em algumas espécies de pragas, parasitas e plantas daninhas, o que a favorece como alternativa na produção de antiparasitários e herbicidas naturais. Outras propriedades se destacam na atividade anestésica e bactericida para o controle de microrganismos parasitas de peixes, aspectos de grande interesse na piscicultura. Mais recentemente, foi detectada a presença do ácido rosmarínico, responsável pelas propriedades medicinais. Com todos os estudos que estão sendo desenvolvidos, H. ringens torna-se uma espécie promissora, porém atualmente essa espécie se encontra ameaçada de extinção. Como forma de propagação, a estaquia pode ser uma alternativa de reprodução.
- Palavras-chave:
- Espécie ameaçada.
- Antiparasitário.
- Alelopatia.
- Produtos naturais.
- Labiatae.
Abstract
Hesperozygis ringens is a native and endemic species from Rio Grande do Sul belonging to Lamiaceae. This shrub plant is distributed in five municipalities in the state of Rio Grande do Sul and is found in restricted regions close to sandy and stony locations. The strong odor characteristic of the species is provided by essential oil, more specifically pulegone as the main constituent. This work proposed, by means of a review, to present the potential of H. ringens in several lines of action due to the properties of essential oils as well as their chemical composition. Studies have shown the antiparasitic and allelopathic action in some species of pests, parasites, and weeds, which favors it as an alternative in the production of natural antiparasitic and herbicides. Other properties are highlighted in the anesthetic and bactericidal activity for the control of fish parasitic microorganisms, aspects of great interest in pisciculture. More recently, the presence of rosmarinic acid, responsible for its medicinal properties, has been detected. With all the studies that are being developed, H. ringens has become a promising species, but currently this species is threatened with extinction. As a means of propagation, cuttings can be an alternative for reproduction.
- Keywords:
- Threatened species.
- Antiparasitic.
- Allelopathy.
- Natural products.
- Labiatae.
Introdução
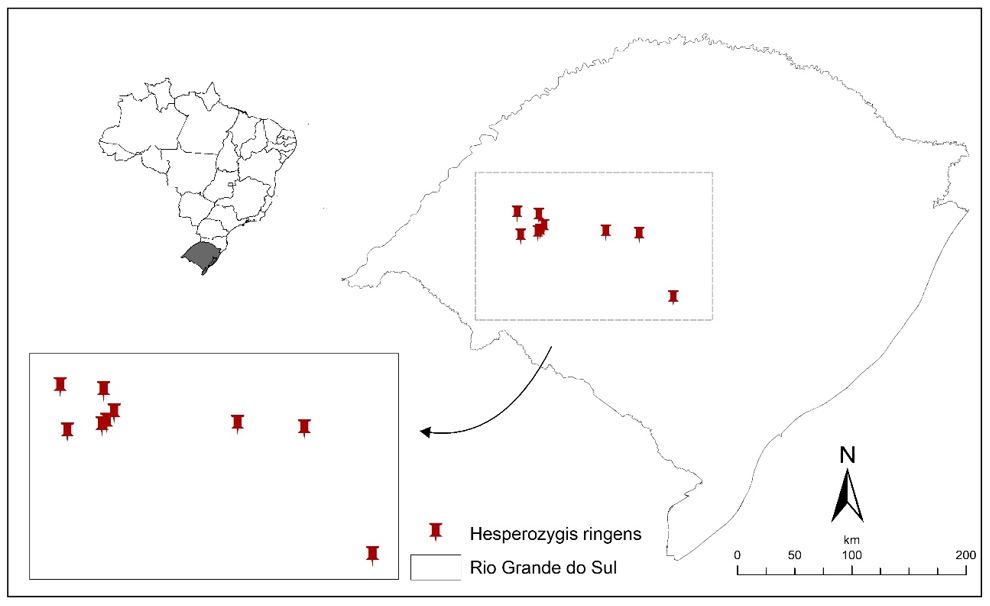
Lamiaceae (Labiatae) é uma família de eudicotiledôneas que apresenta aproximadamente 236 gêneros e 7300 espécies distribuídas pelo mundo[1.2]. No Brasil, ela é representada por 71 gêneros (7 endêmicos) e 596 espécies (361 endêmicas)[2]. Dentre os gêneros nativos, destaca-se Hesperozygis Epling, o qual está distribuído pelo sudeste e sul do país com sete espécies endêmicas descritas: H. dimidiata Epling & Math., H. kleinii Epling & Játiva, H. myrtoides (A. St.-Hil. ex Benth.) Epling, H. nitida (Benth.) Epling, H. rhododon Epling, H. ringens (Benth.) Epling e H. spathulata Epling[3]. A espécie Hesperozygis ringens, nativa do Rio Grande do Sul, é uma planta arbustiva, aromática, popularmente conhecida como "espanta-pulga", distribuída em locais restritos nos campos rochosos e arenosos da região central e oeste do estado. Foram encontradas populações nos municípios de Alegrete, São Francisco de Assis, Caçapava do Sul, Santa Maria e São Pedro do Sul[4-6] (FIGURA 1).
As regiões do sudoeste do Rio Grande do Sul, como São Francisco de Assis e Alegrete, vêm passando por transformações devido ao processo de arenização, que ocorre naturalmente principalmente em consequência dos ventos e da precipitação, causando a movimentação do solo, retirada da cobertura vegetal e soterramentos. A paisagem também é afetada pela fragilidade do ecossistema pelas atividades agropecuárias que ocorrem de modo indiscriminado[7]. Por conta desses fatores, plantas endêmicas das localidades entram em situação de risco, incluindo H. ringens que se encontra na Lista Nacional Oficial de Espécies da Flora Ameaçadas de Extinção[8].
Para a compreensão da situação da espécie em relação à variabilidade genética das suas populações, estudos com populações de Alegrete, São Francisco de Assis e Caçapava do Sul mostraram que as populações estão bem estruturadas, com pouca variabilidade intraespecífica, porém entre as populações são significativamente distintas, o que presumem os fenômenos de deriva genética e endogamia. Também não houve correlação entre distâncias genética e distância geográfica[5,9].
Além de conhecer a situação em que espécies ameaçadas se encontram, também é necessária a busca por metodologias que deem suporte na reprodução e propagação dos indivíduos. No processo de germinação, as sementes germinam tanto na presença quanto na ausência de luz e em temperaturas de 15ºC, 20ºC e 25ºC, considerando as temperaturas mais baixas com a obtenção do maior número de sementes germinadas[10]. A propagação por meio da estaquia foi verificada em H. ringens com: estacas apicais e não apicais; material oriundo de casas de vegetação e do campo; e de dois tipos de substratos com cascas de arroz. Os resultados mostraram ser um método viável com alta taxa de enraizamento, principalmente naquelas desenvolvidas em casas de vegetação, o que contribui para a produção e o estabelecimento das plantas em viveiros[11]. Além disso, estudos com geotecnologias, como a caracterização espectral das folhas de H. ringens, podem ser ferramentas úteis na detecção e no monitoramento de populações através do sensoriamento remoto[12].
Com relação às características estruturais, H. ringens apresenta flores com morfologia típica das lamiáceas: bilabiadas, zigomorfas, diclamídeas e pentâmeras. Apresenta folhas opostas, forma: ovada, consistência: membranácea, indumento: pilosa a tomentosa, bases e ápices: agudos, margem: inteira/crenulada, tamanho: variando 1,5 a 2,2 cm de comprimento e 0,7 a 2,2 cm de largura[3,13] (FIGURA 2).

Quanto a características anatômicas dos órgãos vegetativos, há a presença de tricomas glandulares e não glandulares nas folhas e caules. As folhas apresentam duas formas de estômatos dialelocíticos acima da epiderme e a presença de lipídios nas paredes celulares da endoderme. Espaços intercelulares são encontrados no caule e idioblastos fenólicos são encontrados nas raízes. Em todos os órgãos vegetativos estão espalhados uma grande quantidade de cristais[14].
O objetivo deste trabalho foi apresentar uma revisão sobre Hesperozygis ringens, incluindo as características externas e internas da planta, habitat, a composição química do óleo essencial e as suas propriedades.
Material e Métodos
Esta revisão foi realizada por meio de uma pesquisa nas seguintes bases de dados: Google Acadêmico, Scielo e PubMed. Como base deste artigo, iniciou-se a busca por "Hesperozygis ringens" em qualquer período e em qualquer idioma. Em um primeiro levantamento foram buscados 492 resultados no Google Acadêmico. Os artigos que apresentavam a espécie como citação ou referência foram desconsiderados. Na busca foram encontrados e selecionados 21 artigos sobre Hesperozygis ringens como a principal espécie do trabalho. No PubMed e no Scielo foram encontrados 11 e 5 resultados respectivamente, no qual todos estão inseridos neste artigo. O sítio da Flora e Funga do Brasil foi utilizado para obter dados mais atualizados sobre características e distribuição.
A partir dos conteúdos dos trabalhos selecionados, novas buscas por termos afins foram realizadas: "Hesperozygis", "Lamiaceae", "Óleos essenciais", "Pulegona" e "Produtos naturais". De acordo com as informações obtidas, a apresentação deste artigo ficou dividida em quatro seções, a primeira sobre a composição química do óleo essencial e as demais sobre as suas propriedades antiparasitárias, alelopáticas e anestésicas.
Resultados e Discussão
Composição do óleo essencial
Várias espécies de Lamiaceae são bastante conhecidas por serem plantas aromáticas, especialmente pelos compostos químicos nelas contidos que são de interesse comercial. Essas substâncias hidrofóbicas voláteis com características próprias constituem os óleos essenciais, metabólitos secundários sintetizados pela própria planta. Os óleos essenciais podem ser extraídos de várias partes do corpo do vegetal e as suas propriedades variam de acordo com o tipo, a quantidade e a interação entre os compostos que os formam[15,16].
Lamiaceae apresenta compostos secundários da classe dos terpenoides ou terpenos, conhecidos como óleos essenciais. Esses produtos secundários ou naturais sintetizados pelas plantas, estão relacionados com a interação com outros organismos: na atração de polinizadores, na defesa contra herbívoros e patógenos, na simbiose com microrganismos e na competição com outras plantas[17]. As propriedades desses compostos beneficiam as plantas e o próprio ser humano que os utiliza como matéria-prima para produtos da indústria alimentícia, farmacêutica, cosmética e perfumaria[15].
Nas lamiáceas, alguns óleos essenciais atuam como agentes antioxidantes no combate aos radicais livres, os quais são ingeridos pelo consumo de alimentos ou bebidas que os contenham. Outros possuem atividades bactericida, fungicida e inseticida[18], atuando como um agente natural com potencial para substituir o uso de agrotóxicos sintéticos, minimizando os efeitos danosos destes produtos ao ambiente e a saúde humana[19]. Inseridas na família Lamiaceae, encontram-se plantas usualmente utilizadas pela população humana como chás e temperos, sendo as espécies dos gêneros: Cunila D.Royen ex L., Hyssopus L., Lavandula L., Melissa L., Mentha L., Ocimum L., Origanum L., Plectranthus L'Hér., Rosmarinus L. e Salvia L.[20,21]. Além das espécies com suas propriedades já conhecidas e amplamente divulgadas, são necessários estudos sobre espécies ainda pouco conhecidas, mas com potencial para produção de produtos naturais como H. ringens.
Testes histoquímicos detectaram proteínas, lipídios, óleo essenciais, resinas oleosas, flavonoides, alcaloides e compostos fenólicos não somente nas folhas, mas também nas pétalas de H. ringens. Os lipídios totais, resinas oleosas e os óleos essenciais estão presentes principalmente nos tricomas glandulares e no mesofilo das folhas e nos tricomas glandulares e superfície das pétalas[22].
Para a extração, identificação, quantificação e isolamento dos componentes químicos presentes no óleo essencial das folhas de H. ringens, diversos trabalhos com diferentes abordagens contribuíram para uma melhor compreensão da sua constituição. Entre as metodologias utilizadas se encontram: a extração através de hidrodestilação em aparelho de Clevenger, extração assistida por ultrassom (UAE-EtOH), fluído supercrítico (SFE-CO2), cromatografia gasosa acoplada à espectrometria de massas (GC-MS), cromatografia gasosa – detector por ionização de chama (GC-FID) e cromatografia líquida de alta eficiência (HPLC)[23-26].
De acordo com um levantamento dos dados obtidos nos trabalhos citados acima foram identificados mais de 20 componentes químicos no óleo essencial de H. ringens. As principais substâncias em maior abundância são os terpenos, mais especificamente os monoterpenos pulegona (79% a 96%), limonemo (0,7 a 2,7%) e linalol (0,5% a 1,6%), as demais substâncias com valores geralmente abaixo de 1%[23-26].
A identificação dos compostos contidos no extrato de H. ringens com UAE-EtOH, foi realizada por UPLC-MS (Cromatografia Líquida de Ultra Performance com espectrômetro de massa). Os compostos fenólicos detectados no extrato são conhecidos devido as suas propriedades medicinais. O constituinte presente em maior quantidade é o ácido rosmarínico, um polifenol relacionado às atividades antioxidantes, anticarcinogênicas, anti-inflamatórias, anti-hipertensivas e hepatoprotetoras[27-29].
Fatores genéticos e ambientais, como luz, temperatura, água, solo e altitude podem causar mudanças e diferenças na composição e o rendimento dos óleos essenciais[30,31]. Em H ringens, a sazonalidade é um fator que influencia no rendimento, sendo os mais altos no outono, primavera e verão e menores no inverno[32].
Em outras espécies do mesmo gênero também se verifica algumas diferenças na composição dos óleos. Hesperozygis myrtoides (A. St.-Hil. ex Benth.) Epling também apresenta pulegona (21,4% a 44,4%), isomentona (32,7% a 47,7) e limoneno (3,5% a 7,7) enquanto Hesperozygis rhododon Epling apresenta a mentona (43,4%), a pulegona (29,6%) e o limoneno (4,2%)[23,33,34].
Propriedades antiparasitárias
A busca por acaricidas naturais tem sido relevante, pois podem substituir os sintéticos em virtude destes se tornarem ineficazes contra carrapatos que adquirem resistência rapidamente, além de serem prejudiciais ao meio ambiente. As vantagens para a produção de produtos à base de óleos essenciais incluem: menor contaminação do ambiente e dos alimentos, desenvolvimento da resistência dos parasitas mais lento e menor toxicidade aos animais e seres humanos[35].
A partir das propriedades do óleo essencial de H. ringens, experimentos laboratoriais foram realizados para detectar os possíveis efeitos antiparasitários no carrapato-de-boi (Rhipicephalus microplus). Testes de imersão em fêmeas ingurgitadas e larvas mostrou a ocorrência de diminuição na postura de ovos pelas fêmeas, e dos ovos que foram postos verificou-se inibição da eclosão em 95% (concentração de 50 µL / mL) e 30% (concentração de 25 µL / mL). O posterior isolamento da pulegona e a sua aplicação direta, mostraram efeitos semelhantes indicando o composto como responsável pela ação do óleo[24].
Apesar dos resultados de testes em laboratórios encontrados na literatura apresentarem o potencial antiparasitário para a espécie, ainda não há relatos de estudos na aplicação direta nos bovinos infestados no campo. Uma das dificuldades da obtenção dos mesmos resultados in vivo é a baixa persistência dos extratos no ambiente, necessitando de estratégias que protejam os compostos ativos e permitam a sua rápida penetração nos carrapatos[35]. Outro obstáculo a ser analisado é a necessidade de verificar a penetração e absorção cutânea dos componentes do óleo e seus efeitos nos bovinos, uma vez que podem comprometer a saúde do animal, além da pecuária destinar a carne e laticínios para o consumo humano[24].
Embora os estudos com H. ringens sejam recentes, os efeitos da pulegona são conhecidos desde a sua identificação em outras espécies que possuem o mesmo composto (Mentha pulegium L.). Para as plantas, a produção e a utilização destes compostos servem como linhas de defesa contra o ataque de insetos herbívoros. Uma primeira linha age no impedimento da alimentação como se fosse um repelente, e em segunda linha com a intoxicação e malefícios no desenvolvimento dos insetos[36-38]. Estudos também mostraram a eficácia do óleo essencial como agente inibitório em fungos decompositores de madeira, principalmente em algumas espécies de podridão branca (Ganoderma applanatum (Pers.) Pat. e Trametes versicolor (L.) Lloyd)[39].
Propriedades alelopáticas
A procura por herbicidas naturais e menos prejudiciais ao meio ambiente e a saúde pública, vem sendo uma alternativa por meio da fabricação de produtos provenientes de óleos essenciais de plantas com propriedades alelopáticas. Visto que os herbicidas sintéticos apresentam grande persistência no ambiente que além da poluição gerada, pode causar intoxicação e atividades carcinogênicas e mutagênicas nas células[40].
Um dos primeiros trabalhos a serem realizados com a espécie foi a verificação do potencial alelopático na germinação de sementes de alface (Lactuca sativa L.). De acordo com as diluições testadas no experimento, foram relatados os seguintes efeitos do óleo essencial: presença de necrose nas pontas das radículas (diluição / 1:64); radículas mais curtas com inibição do crescimento do hipocótilo seguidas da morte da planta (diluições / 1:32 e 1:16); e radículas não emergidas ou morte imediatamente após a emergência (diluições / 1:8, 1:4 e 1:2). Nesse mesmo estudo, também foi verificado a ação do óleo essencial de H. rhododon que diferentemente apresentou menor inibição da germinação das sementes em comparação com H. ringens[23].
De maneira semelhante, foi realizado um novo estudo com concentrações mais baixas do óleo essencial (0,25% a 5%) envolvendo a alface, além de outras culturas e plantas daninhas como: o picão-preto (Bidens pilosa L.), o azevém (Lolium multiflorum Lam.), a aveia-preta (Avena strigosa Schreb.), a soja (Glycine max (L.) Merr.) e o arroz (Oryza sativa L.). Nas eudicotiledôneas, a germinação do picão-preto foi inibida completamente na maior concentração (5%), sem afetar a germinação da alface e da soja. Em relação às monocotiledôneas, a maior concentração (5%) reduziu pela metade o número de sementes germinadas de arroz e de azevém, e inibiu completamente em aveia-preta. Com estes indicativos, o extrato de H. ringens apresenta maiores efeitos inibitórios em gramíneas e um potencial para controlar ervas daninhas que, neste caso, mostraram serem mais afetadas em relação às culturas[41]. Testes de germinação de soja e picão-preto também foram avaliados em maiores concentrações (0, 25, 50, 75 e 100%), o que resultou em efeitos prejudiciais na germinação e no crescimento de plântulas, corroborando para a ação alelopática da espécie[42].
Efeitos adversos também foram avaliados em Eragrostis plana Nees (capim-annoni), espécie exótica que causa grandes prejuízos na pecuária e sua proliferação diminui a qualidade e a quantidade de espécies nativas do bioma Pampa. Testes com óleo essencial de H. ringens promoveram a inibição da germinação e do desenvolvimento da raiz e da parte aérea, sendo maiores os resultados com o aumento de concentração do óleo essencial aplicado. Além disso, foram observadas a diminuição da concentração de clorofila, perda da integridade da membrana plasmática e danos teciduais[43].
Propriedades anestésicas
Existe uma crescente demanda por anestésicos baratos e seguros capazes de reduzir o estresse produzido em peixes durante procedimentos como captura e manuseio. Com esses estudos, o uso do óleo essencial é uma possível alternativa em procedimentos na aquicultura que requerem a utilização de anestésicos[44].
O óleo essencial de H. ringens foi testado para utilização na piscicultura em como um possível anestésico natural capaz de diminuir o estresse nos peixes durante os procedimentos de captura e manuseio[25,45,46]. Segundo estudos com Rhamdia quelen Quoy & Gaimard (jundiá), Colossoma macropomum (Cuvier, 1916) (tambaqui) e Oreochromis niloticus (Linnaeus, 1758) (tilápia-do-nilo), foram observados efeitos favoráveis para um bom anestésico: anestesia rápida; hiperatividade ou estresse mínimos e; rápida recuperação ao seu estado normal[47-50].
Os estágios de larvas, pós-larvas e alevinos de R. quelen podem ser atacados por larvas de insetos da ordem Odonata. Essas pragas são encontradas nos tanques de piscicultura e podem causar perdas na produção e no suprimento de juvenis. Um novo trabalho foi realizado envolvendo espécies de Coenagrionidae, a família mais diversificada de Odonata. Os gêneros identificados e que foram afetados com a exposição ao óleo foram: Acanthagrion, Homeoura, Ischnura e Oxyagrion[51].
Os compostos hidrofóbicos dos óleos essenciais também possuem a capacidade de penetrar nas células bacterianas e parasitárias e causar disfunções de organelas e deformidades celulares. Óleos essenciais de H. ringens apresentam toxicidade para o zooplâncton de água doce Daphnia pulex, no parasita Gyrodactylus sp e age como bactericida nos diferentes patógenos de jundiá, como: Aeromonas hydrophila e Aeromonas veronii, Citrobacter freundii e Raoltella ornithinolytica[52,53].
Conclusão
As diversas aplicações para qual H. ringens pode ser utilizada e as poucas informações sobre a espécie forneceram uma variedade de estudos nas áreas da botânica e química. Não foram encontrados na literatura trabalhos da morfologia e anatomia floral, assim como modos de reprodução e polinizadores. Da mesma forma, não há registo de trabalhos com a ação destes compostos em insetos da ordem Siphonaptera, grupo que representa as pulgas, embora o nome comum da espécie ("espanta-pulga") possa sugerir. Ainda que muitos dos trabalhos citados sejam pioneiros ou testes, os resultados apresentados contribuem para um melhor entendimento da espécie. Cabe ressaltar a importância da preservação das populações existentes desta espécie promissora.
Fontes de Financiamento
Bolsas de mestrado concedidas pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), infraestrutura e material de expediente concedido pelo Departamento de Biologia da Universidade Federal de Santa Maria.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelas bolsas de mestrado concedidas aos dois primeiros autores deste artigo.
Colaboradores
Concepção do estudo: LGL; ACM; LE
Curadoria dos dados: LGL
Coleta de dados: LGL
Análise dos dados: LGL; MMW
Redação do manuscrito original: LGL
Redação da revisão e edição: LGL; MMW; ACM; LE.
Referências
1. Zhao F et al. An updated tribal classification of Lamiaceae based on plastome phylogenomics. BMC Biol. 2021; 19: 1-27. [https://doi.org/10.1186/s12915-020-00931-z] [https://pubmed.ncbi.nlm.nih.gov/33419433/].
2. Antar GM et al. Lamiaceae in Flora e Funga do Brasil. Jardim Botânico do Rio de Janeiro. [acesso em: 03 dez. 2023]. Disponível em: [https://floradobrasil.jbrj.gov.br/FB142].
3. Antar GM, Oliveira AB. Hesperozygis in Flora e Funga do Brasil. Jardim Botânico do Rio de Janeiro. [acesso em: 03 dez. 2023]. Disponível em: [https://floradobrasil.jbrj.gov.br/FB8156].
4. De Freitas EM, Trevisan R, Schneider ÂA, Boldrini II. Floristic diversity in areas of sandy soil grasslands in Southwestern Rio Grande do Sul, Brazil. Rev Bras Biociênc. 2010; 8(1): ISSN 1980-4849. [https://seer.ufrgs.br//index.php/rbrasbioci/article/view/114913/62207].
5. Fracaro F, Echeverrigaray S. Genetic variability in Hesperozygis ringens Benth. (Lamiaceae), an endangered aromatic and medicinal plant of Southern Brazil. Biochem Genet. 2006; 44(11-12): 471-482. ISSN 1573-4927. [https://doi.org/10.1007/s10528-006–9044-z] [https://pubmed.ncbi.nlm.nih.gov/17109219/].
6. Schaefer J, Essi L. A checklist of Asteraceae from Pedra do Lagarto, Santa Maria, Rio Grande do Sul, Brazil. Check List. 2017; 13: 1075. ISSN 1809-127X. [https://doi.org/10.15560/13.6.1075].
7. Rovedder A, Eltz F, Girardi-Diero A, Deble L. Análise da composição florística do campo nativo afetado pelo fenômeno da arenização no sudoeste do Rio Grande do Sul. Rev Bras Agrociênc. 2005; 11(4): 501-503. ISSN: 2317-2436.
8. Brasil. Ministério do Meio Ambiente. Lista nacional oficial de espécies da flora ameaçadas de extinção. Portaria MMA 443, 17 de dezembro de 2014. 2014. [http://ckan.jbrj.gov.br/dataset/23f2e24c-5676-4acd-83f0-03621cba4364/resource/53e32c38-9d0e-486c-8b4e-666ddbb30429/download/especiesportaria443.pdf].
9. Leite LG, Leonardo JLSH, Mazzocato AC, Essi L. Genetic diversity of Hesperozygis ringens (Benth.) Epling (Lamiaceae): current situation on natural populations of Rio Grande do Sul, Brazil. Rev Bras Bot. 2023; 46(1): 61-68. [https://doi.org/10.1007/s40415-023-00869-w].
10. Leite LG, Stefanello R, Essi L. Seed germination of Hesperozygis ringens (Benth.) Epling, an endemic and threatened species. Acta Sci Biol Sci. 2022; 44: e58431-e58431. [https://doi.org/10.4025/actascibiolsci.v44i1.58431].
11. Siqueira J, Bruxel F, Orlandi CR, Avrella ED, Fior CS, De Freitas EM. Vegetative propagation of endemic species of the Pampa biome. Ci e Nat. 2020; 42: 68. ISSN: 2179-460X. [https://doi.org/10.5902/2179460X39235].
12. Pinheiro CG, Mallmann CL, Pereira Filho W, Heinzmann BM. Remote sensing in the leaf spectral characterization of the Hesperozygis ringens, an endangered species. Sci agrár parana. 2022; 212-215. [https://doi.org/10.18188/sap.v21i2.29314].
13. Viana A. Morfologia e anatomia foliar de espécies de angiospermas com ocorrência nos campos de areais do bioma pampa. Cascavel; 2018. Dissertação de Mestrado [Programa de Pós-Graduação em Conservação e Manejo de Recursos Naturais] – Universidade Estadual do Oeste do Paraná, Unioeste, Cascavel, PR. 2018. [http://tede.unioeste.br/handle/tede/3800].
14. Pinheiro CG, De Oliveira JMS, Heinzmann BM. Histological and histochemical characterization of leaves and petals of the endangered native Brazilian species Hesperozygis ringens (Benth.) Epling. Flora. 2018; 239: 1-10. ISSN 0367-2530. [https://doi.org/10.1016/j.flora.2017.11.001].
15. Craveiro AA, Queiroz DC. Óleos essenciais e química fina. Quím Nova. 1993; 16(3): 224-228. ISSN 1678-7064.
16. Lubbe A, Verpoorte R. Cultivation of medicinal and aromatic plants for specialty industrial materials. Ind Crops Prod. 2011; 34(1): 785-801. ISSN 0926-6690. [https://doi.org/10.1016/j.indcrop.2011.01.019].
17. Vizzotto M, Krolow ACR, Weber GEB. Metabólitos secundários encontrados em plantas e sua importância. Embrapa Clima Temperado-Documentos (INFOTECA-E). 2010. ISSN 1516-8840.
18. Lima RK, Cardoso, MG. Família Lamiaceae: importantes Óleos Essenciais com Ação Biológica e Antioxidante. Rev Fitos. 2007; 3(03): 14-24. [https://www.arca.fiocruz.br/handle/icict/19155].
19. Spadotto CA. Abordagem interdisciplinar na avaliação ambiental de agrotóxicos. In: Embrapa Meio Ambiente-Artigo em anais de congresso (ALICE). 2006; p. 1-9.
20. Battisti C, Garlet TMB, Essi L, Horbach RK, De Andrade A, Badke MR. Plantas medicinais utilizadas no município de Palmeira das Missões, RS, Brasil. Rev Bras Biocienc. 2013; 11(3): ISSN 1980-4849 [ http://www.ufrgs.br/seerbio/ojs/index.php/rbb/article/view/2457 ]
21. Mamadalieva NZ et al. Aromatic medicinal plants of the Lamiaceae family from Uzbekistan: ethnopharmacology, essential oils composition, and biological activities. Medicines. 2017; 4(1): 8. ISSN 2305-6320. [https://doi.org/10.3390/medicines4010008] [https://pubmed.ncbi.nlm.nih.gov/28930224/].
22. Pinheiro CG, Oliveira JMS, Heinzmann BM. Structural characterization of vegetative organs of the endangered Brazilian native species Hesperozygis ringens (Benth.) Epling. An Acad Bras Cienc. 2018; 90(3): 2887-2901. ISSN 1678-2690. [https://doi.org/10.1590/0001-3765201820170606].
23. Von Poser GL et al. Essential oil composition and allelopathic effect of the Brazilian Lamiaceae Hesperozygis ringens (Benth.) Epling and Hesperozygis rhododon Epling. J Agric Food Chem. 1996; 44(7): 1829-1832. ISSN: 1520-5118. [https://doi.org/10.1021/jf950653c].
24. Ribeiro VLS, Dos Santos JC, Bordignon SA, Apel MA, Henriques AT, Von Poser GL. Acaricidal properties of the essential oil from Hesperozygis ringens (Lamiaceae) on the cattle tick Riphicephalus (Boophilus) microplus. Bioresour Technol. 2010; 101(7): 2506-2509. ISSN 0960-8524. [https://doi.org/10.1016/j.biortech.2009.11.016].
25. Toni C et al. Fish anesthesia: effects of the essential oils of Hesperozygis ringens and Lippia alba on the biochemistry and physiology of silver catfish (Rhamdia quelen). Fish Physiol Biochem. 2014; 40(3): 701-714. ISSN 1573-5168. [https://doi.org/10.1007/s10695-013-9877-4] [https://pubmed.ncbi.nlm.nih.gov/24141557/].
26. Rosa IA et al. Extracts of Hesperozygis ringens (Benth.) Epling: in vitro and in vivo antibacterial activity against fish pathogenic bacteria. J Appl Microbiol. 2019; 126(5): 1353-1361. ISSN 1364-5072. [https://doi.org/10.1111/jam.14219] [https://pubmed.ncbi.nlm.nih.gov/30735293/].
27. Lou K et al. Rosmarinic acid stimulates liver regeneration through the mTOR pathway. Phytomedicine. 2016; 23(13): 1574-1582. ISSN: 0944-7113. [https://doi.org/10.1016/j.phymed.2016.09.010]. [https://pubmed.ncbi.nlm.nih.gov/27823621/].
28. Lin SY et al. Hepatoprotective activities of rosmarinic acid against extrahepatic cholestasis in rats. Food Chem Toxicol. 2017; 108: 214-223. ISSN: 0278-6915. [https://doi.org/10.1016/j.fct.2017.08.005] [https://pubmed.ncbi.nlm.nih.gov/28789951/].
29. Dolwitsch CB et al. Hesperozygis ringens (Benth.) Epling: a study involving extraction, chemical profiling, antioxidant and biological activity. Nat Prod Res. 2020; 35(22): 1-6. ISSN: 1478-6427. [https://doi.org/10.1080/14786419.2019.1710703] [https://pubmed.ncbi.nlm.nih.gov/31920093/].
30. Prins CL, Vieira IJC, Freitas SP. Growth regulators and essential oil production. Braz J Plant Physiol. 2010; 22(2): 91-102. ISSN 1677-9452. [https://doi.org/10.1590/S1677-04202010000200003].
31. Lima HRP, Kaplan MAC, Cruz AVM. Influência dos fatores abióticos na produção e variabilidade de terpenóides em plantas. Floresta Amb. 2012; 10(2): 71-77. ISSN 2179-8087.
32. Pinheiro CG et al. Seasonal variability of the essential oil of Hesperozygis ringens (Benth.) Epling. Braz J Biol. 2016; 76(1): 176-184. ISSN 1678-4375. [https://doi.org/10.1590/1519-6984.16314].
33. Castilho CVV et al. In vitro activity of the essential oil from Hesperozygis myrtoides on Rhipicephalus (Boophilus) microplus and Haemonchus contortus. Rev Bras Farmacogn. 2017; 27(1): 70-76. ISSN 0102-695X. [https://doi.org/10.1016/j.bjp.2016.08.005].
34. Martini MG et al. Chemical composition and antimicrobial activities of the essential oils from Ocimum selloi and Hesperozygis myrtoides. Nat Prod Commun. 2011; 6(7): 1027-30. ISSN: 1555-9475. [https://doi.org/10.1177/1934578X1100600726] [https://pubmed.ncbi.nlm.nih.gov/21834250/].
35. Borges LMF, Sousa LAD, Barbosa CS. Perspectives for the use of plant extracts to control the cattle tick Rhipicephalus (Boophilus) microplus. Ver Bras Parasitol Vet. 2011; 20(2): 89-96. ISSN: 1984-2961. [https://doi.org/10.1590/S1984-29612011000200001].
36. Hefendehl FW. Beiträge zur biogenese ätherischer Öle Zusammensetzung zweier ätherischer Öle von Mentha pulegium L. Phytochemistry. 1970; 9(9): 1985-1995. ISSN: 0031-9422. [https://doi.org/10.1016/S0031-9422(00)85350-9].
37. Freeman BC, Beattie GA. An overview of plant defenses against pathogens and herbivores. The Plant Health Instr. 2008. ISSN 2572-679X. [https://doi.org/10.1094/PHI-I-2008-0226-01].
38. Wink M. Plant breeding: importance of plant secondary metabolites for protection against pathogens and herbivores. Theor Appl Genet. 1988; 75(2): 225-233. ISSN 1432-2242.
39. Pinheiro CG et al. Hesperozygis ringens (Benth.) Epling essential oil: antifungal activity and effect on ergosterol content of wood-decay fungi. J Essent Oil Res. 2021; 33(3): 265-275. [https://doi.org/10.1080/10412905.2020.1840450].
40. Abouziena HF, Haggag WM. Weed control in clean agriculture: a review. Pl Daninha. 2016; 34(2): 377-392. ISSN 1806-9681. [https://doi.org/10.1590/S0100-83582016340200019].
41. Pinheiro CG, Amaral LDP, Rolim JM, Longhi SJ, Machado SLDO, Heinzmann BM. Essential oil of the Brazilian native species Hesperozygis ringens: a potential alternative to control weeds. J Essent Oil Bear Plants. 2017; 20(3): 701-711. ISSN: 0976-5026. [https://doi.org/10.1080/0972060X.2017.1319297].
42. Lima CS, Lima MFRC, Birck TP, Stefanello R. Allelopathic Potential of Hesperozygis ringens Extracts on Seed Germination of Soybeans and Beggarticks, J Agric Sci. 2020; 12(11):. ISSN 1916-9760, [https://doi.org/10.5539/jas.v12n11p1].
43. Bruxel F et al. Phytotoxicity of Hesperozygis ringens (Benth.) Epling essential oil on Eragrostis plana Nees. Flora. 2022; 297: 152167. [https://doi.org/10.1016/j.flora.2022.152167].
44. Purbosari N, Warsiki E, Syamsu K, Santoso J. Natural versus synthetic anesthetic for transport of live fish: A review. Aquacult Fish. 2019; 4(4): 129-133. ISSN: 2468-550X. [https://doi.org/10.1016/j.aaf.2019.03.002].
45. Silva LL et al. Anesthetic activity of Brazilian native plants in silver catfish (Rhamdia quelen). Neotrop Ichthyol. 2013; 11(2): 443-451. ISSN 1679-6225. [https://doi.org/10.1590/S1679-62252013000200014].
46. Toni C et al. Stress response in silver catfish (Rhamdia quelen) exposed to the essential oil of Hesperozygis ringens. Fish Physiol Biochem. 2015; 41(1): 129-138. ISSN 1573-5168. [https://doi.org/10.1007/s10695-014-0011-z] [https://pubmed.ncbi.nlm.nih.gov/25403153/].
47. Gilderhus PA, Marking LL. Comparative efficacy of 16 anesthetic chemicals on rainbow trout. North Am J Fish Manage. 1987; 7(2): 288-292. ISSN: 1548-8675. [https://doi.org/10.1577/1548-8659(1987)7%3c288:CEOACO%3e2.0.CO;2].
48. Ferreira AL et al. Efficacy of Hesperozygis ringens essential oil as an anesthetic and for sedation of juvenile tambaqui (Colossoma macropomum) during simulated transport. Aquacult Int. 2022; 30(3): 1549-1561. [https://doi.org/10.1007/s10499-022-00868-w].
49. Ferreira AL et al. Hesperozygis ringens essential oil as an anesthetic for Colossoma macropomum during biometric handling. Cienc Rural. 2023; 53. [https://doi.org/10.1590/0103-8478cr20220264].
50. Ferreira AL et al. Anesthetic and sedative efficacy of essential oil of Hesperozygis ringens and the physiological responses of Oreochromis niloticus after biometric handling and simulated transport. Fish Physiol Biochem. 2022; 48(5): 1155-1166. [https://doi.org/10.1007/s10695-022-01109-w] [https://pubmed.ncbi.nlm.nih.gov/35932409/].
51. Silva DT et al. Larvicidal activity of Brazilian plant essential oils against Coenagrionidae larvae. J Economic Entomol. 2014; 107(4): 1713-1720. ISSN: 1938-291X. [https://doi.org/10.1603/EC13361] [https://pubmed.ncbi.nlm.nih.gov/25195467/]
52. Dawood MA et al. Antiparasitic and antibacterial functionality of essential oils: an alternative approach for sustainable aquaculture. Pathogens. 2021; 10(2): 185. [https://doi.org/10.3390/pathogens10020185] [https://pubmed.ncbi.nlm.nih.gov/33572193/].
53. Bandeira Jr. G et al. Potential uses of Ocimum gratissimum and Hesperozygis ringens essential oils in aquaculture. Ind Crop Prod. 2017; 97: 484-491. ISSN: 0926-6690. [https://doi.org/10.1016/j.indcrop.2016.12.040].