Revisão
Bioprospecção de atividade anticâncer dos gêneros Garcinia e Clusia: uma breve revisão
Bioprospecting of anticancer activity of genera Garcinia and Clusia: a brief review
Resumo
A bioprospecção é uma das formas de extrair valor econômico da biodiversidade brasileira, abrangendo principalmente a indústria farmacêutica. O câncer é uma das principais causas de mortalidade no mundo e 64,9% das drogas anticâncer, aprovadas de 1946 a 2019, são de origem natural. A família Clusiaceae possui vários metabólitos secundários bioativos, destacando-se a ação antineoplásica de espécies dos gêneros Garcinia e Clusia. O objetivo deste trabalho foi realizar uma breve revisão da atividade anticâncer dos gêneros Clusia e Garcinia, pertencentes à família Clusiaceae. A pesquisa bibliográfica foi realizada no período de 2000 até 2021, nas bases de dados Scifinder, PubMed, Scopus e Web of Science. Foram selecionados os estudos in vitro e in vivo dos dois gêneros, sobre a atividade anticâncer de algumas das substâncias isoladas mais representativas, e os mecanismos de ação envolvidos. Foram excluídas as duplicatas ou os dados considerados questionáveis ou insuficientes. Essa revisão reforça a importância da bioprospecção de moléculas anticâncer da família Clusiaceae, que poderia contribuir para a descoberta de fármacos de origem natural, visando o desenvolvimento tecnológico sustentável brasileiro.
- Palavras-chave:
- Bioprospecção.
- Clusiaceae.
- Clusia studartiana.
- Câncer.
- Garcinia.
Abstract
Bioprospecting is a way to extract economic value from Brazilian biodiversity, comprising mainly the pharmaceutical industry. Cancer is one of the main causes of mortality in the world and 64.9% of anticancer drugs approved from 1946 to 2019 were extracted from natural sources. The Clusiaceae family has several bioactive secondary metabolites, highlighting the antineoplastic action of species from the genera Garcinia and Clusia. The objective of this work was to carry out a brief review on anticancer activity of the Clusia and Garcinia genera, belonging to the Clusiaceae family. The bibliographic search was carried out from 2000 to 2021, in the Scifinder, Pubmed, Scopus and Web of Science databases. In vitro and in vivo studies of both genera were selected, on anticancer activity of some of the most representative isolated substances, and the action mechanisms involved. Duplicates, questionable or insufficient data were excluded. This review reinforces the importance of bioprospecting anticancer molecules from the Clusiaceae family, which could contribute to drug discovery from natural sources and a sustainable technological development in Brazil.
- Keywords:
- Bioprospecting.
- Clusiaceae.
- Clusia studartiana.
- Cancer.
- Garcinia.
Introdução
Biodiversidade, bioprospecção e câncer
O Brasil abrange mais de 8,5 milhões de quilômetros quadrados, sendo efetivamente o quinto maior país do mundo em extensão, contendo a maior floresta tropical, extensas planícies e áreas montanhosas. Possui uma grande diversidade de flora e fauna, devido à existência de habitats muito diferentes e peculiares[1]. É o país com a maior diversidade genética vegetal do planeta, com 115.333 espécies de animais e 47.754 espécies de plantas e fungos, sendo 32.292 angiospermas[2]. A biodiversidade brasileira foi a responsável por descobertas de substâncias que conduziram a inovações no tratamento de doenças no Brasil e no mundo, mas apesar disso, seus recursos biológicos ainda não foram muito explorados[1].
A bioprospecção é a busca sistemática por organismos, genes, enzimas, substâncias, processos e partes provenientes de seres vivos em geral, sendo uma das formas de extrair um valor econômico da biodiversidade. Essa estratégia, eventualmente, pode levar ao desenvolvimento de um produto com importante significado para a humanidade. A bioprospecção abrange muitos setores como a agricultura, a biotecnologia, a indústria farmacêutica e de cosméticos e a saúde, entre outros[3]. A indústria farmacêutica, relacionada à saúde e ao bem-estar, se destaca movimentando U$1,3 trilhão em 2019, e devendo ultrapassar U$1,5 trilhão até 2023[4]. Neste setor, produtos naturais constituem 51,15% das moléculas aprovadas como fármacos, no período de 01/01/1981 a 30/09/2020, considerando-se sob essa classificação também os derivados de produtos naturais. Portanto, estes continuam a ser uma fonte de grande importância, apesar do número muito reduzido de programas da indústria farmacêutica para a descoberta de medicamentos[5].
Entre as várias doenças existentes, o câncer é considerado uma das principais causas de mortalidade. Em 2018, foram descritos 17 milhões de novos casos e 9,5 milhões de mortes causadas por câncer no mundo. Estima-se que a incidência de câncer crescerá até alcançar 27,5 milhões de novos casos e 16,3 milhões de mortes até 2040, devido ao crescimento e envelhecimento da população. Dessa forma, o câncer continua sendo um grave e crítico problema de saúde pública mundial[6].
As pesquisas realizadas, na área de agentes anticâncer, mostraram uma grande contribuição de substâncias de origem natural. De 1946 a 1980 foram aprovadas 74 substâncias com atividade anticâncer e de janeiro de 1981 até setembro de 2019 foram aprovadas 185. Do total de 259 substâncias, 168 (64,9%) são originárias ou derivadas de produtos naturais [5].
Perfil fitoquímico de Clusiaceae – gêneros Garcinia e Clusia
A família Clusiaceae é uma fonte importante de metabólitos secundários, tais como: antraquinonas, antronas, benzofenonas, cumarinas, flavonoides, xantomas e triterpenos de diversos tipos[7]. Várias espécies desta família possuem atividades: anti-inflamatória, antiinfecção e anticâncer, antinociceptivos, antioxidantes, antidiabética, antimicrobial, hepatoprotetora entre outras atividades farmacológicas[8-11].
Esta família possui aproximadamente 15 gêneros e 800 espécies, distribuídas nas regiões tropicais, de acordo com o mapa (FIGURA 1)[12], sendo representadas por arbustos, árvores e algumas espécies são hemiepífitas. No Brasil ocorrem 12 gêneros e 147 espécies de Clusiaceae[13].
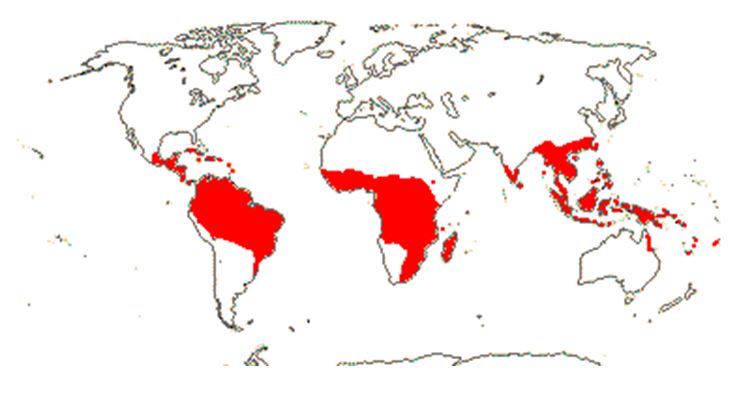
O gênero Garcinia possui aproximadamente 240 espécies[12,13], distribuídas no sudeste da Ásia (Ex: G. cambogia, G. dulcis e G. mangostana), na Índia (Ex: G. indica), na África (Ex: G. kola)e na América do Sul (Ex: G. humilis e G. brasiliensis)[14]. Em geral, os frutos das espécies deste gênero são comestíveis e usados na agricultura. As suas sementes são utilizadas na produção de corantes ou óleos, como antioxidantes ou no tratamento de várias doenças como hiperglicemia, diabetes e câncer[15-18].
Existem várias classes de substâncias nas espécies de Garcinia, tais como: xantonas[19], procianidinas[20], bisflavonóides[21] e floroglucinois[22]. As espécies desse gênero apresentam uma grande variedade de atividades farmacológicas, destacando-se a atividade anticâncer[9,11,18,22].
Na China, a resina gamboge, extraída de espécies de Garcinia é rica em xantonas, e usada em formulações orais e injetáveis para o tratamento de carcinoma de mama e linfoma maligno[23]. Estas xantonas têm despertado muito interesse por sua atividade citotóxica, em várias linhagens de células tumorais, mesmo em baixas concentrações. Além disso, frequentemente estas substâncias não possuem resistência a múltiplas drogas (MDR), uma propriedade importante para os quimioterápicos[24]. Por estes motivos, estas substâncias são consideradas promissores agentes anticâncer, sendo citados alguns exemplos abaixo.
Dez xantonas foram isoladas dos caules de Garcinia schomburgkiana. Três destas xantonas mostraram citotoxicidade contra quatro linhagens tumorais (KB, HeLa S3, MCF-7 e Hep G2), com valores de IC50 na faixa de 0,18-9,95 μM[25].
O garcinol, uma benzofenona poliisoprenilada, é isolado dos frutos de Garcinia indica e possui propriedades anticâncer, envolvendo diferentes alvos, demonstrada por muitos estudos in vitro e in vivo[26]. Estudos recentes indicam o garcinol é um inibidor de histona acetiltransferases (HAT) e desregulador de microRNA (miRNA), que atuam no desenvolvimento e progressão de vários tipos de câncer. Esta ação moduladora de HAT e miRNA indica um potencial epigenético[27].
Outro gênero da família Clusiaceae, que também é muito estudado, é o gênero Clusia, que compreende cerca de 300 a 400 espécies, com distribuição neotropical e altamente diversificada na América Central e do Sul[12]. A distribuição total deste gênero estende-se ao norte e ao sul dos trópicos e o Brasil possui aproximadamente cerca de 70 espécies[28].
O perfil químico das espécies de Clusia é representado pela presença de benzofenonas polipreniladas[29-31], xantonas[32], bifenilas[33], flavonoides[34,35] e triterpenoides[36]. Este gêneroé considerado uma das principais fontes de benzofenonas em Angiospermas[29], sendo considerado marcador químico do gênero Clusia[30]. A atividade anticâncer em Clusia rosa foi atribuída à presença destas benzofenonas polipreniladas, tendo como alvo a enzima topoisomerase[37]. Outros estudos sobre a atividade anticâncer das espécies de Clusia já foram descritos[38-42] e serão detalhados e mostrados nesta revisão.
Os estudos descritos na literatura sobre a ação anticâncer das espécies dos gêneros Clusia e Garcinia, realizados em modelos experimentais in vitro e in vivo, validam a importância da realização de pesquisas sobre metabólitos secundários bioativos nestas espécies, visando o desenvolvimento de medicamentoscom atividade anticâncer.
O objetivo deste trabalho foi realizar uma breve revisão da atividade anticâncer dos gêneros Clusia e Garcinia, pertencentes à família Clusiaceae.
Material e Método
A pesquisa bibliográfica foi realizada, no período de 2000 até 2021, nas bases de dados Scifinder, PubMed, Scopus e Web of Science. Foram selecionados os estudos sobre a atividade anticâncer in vitro e in vivo de algumas das substâncias mais representativas destes gêneros e os mecanismos envolvidos. Foram excluídas as duplicatas ou os dados que foram considerados questionáveis ou insuficientes.
Resultados e Discussão
Atividade anticâncer do gênero Garcinia
Os frutos de G. mangostana (mangostão), G. xanthochymus e G. cambogia são utilizados pelos povos do leste asiático como alimento ou controle da obesidade. Na Índia, os extratos de G. xanthochymus e G. cambogia são usados para intensificar o sabor do curry e o extrato de G. cambogia é também usado como antisséptico para preservar os alimentos[43-45].
O principal constituinte do mangostão é a α-mangostin, que possui ação anticâncer e quimiopreventiva, agindo nos três diferentes estágios da carcinogênese, que são denominados como iniciação, promoção e progressão[46].
A ação quimiopreventiva de substâncias está ligada à etapa de iniciação do câncer que envolve a inibição das enzimas da fase I (pertencentes ao citocromo P450/superfamília CYP), responsáveis pela ativação dos carcinógenos e posteriormente à indução das enzimas da fase II (Ex: glutationa-S-transferase), que conjugam os carcinógenos com ligantes endógenos, para promover a sua eliminação[47]. De fato, foi observado que α-mangostin inibiu o surgimento de lesões pré-neoplásicas, induzidas por 7,12 dimetilbenzantraceno (DMBA), em ensaio de cultura ex vivo de células de mama de camundongo. Uma vez que a ativação por DMBA requer a presença das enzimas da fase I (CYP1A1, CYP1A2 e CYP1B1), possivelmente este fato deve estar ligado à inibição destas enzimas na fase de iniciação do câncer[48].
Corroborando esta hipótese, o tratamento realizado com a α-mangostina em células de câncer de mama, do tipo SK-BR-3, provocou a inibição da aromatase (CYP-19) nestas células, de forma dose-dependente. A linhagem SK-BR-3 possui altos níveis de aromatase (CYP-19), que é uma enzima limitante da taxa na biossíntese de estrogênio. Como o estrogênio desempenha um papel vital no desenvolvimento e progressão do câncer de mama responsivo a hormônios, o efeito supressor de α-mangostina na aromatase indica seu potencial como agente quimiopreventivo na carcinogênese mamária[49].
A geração de espécies reativas de oxigênio (ERO) e de espécies reativas de nitrogênio (ERN) pode ocorrer por vias endógenas e exógenas tais como: os processos inflamatórios, a irradiação UV, a cadeia respiratória mitocondrial, a peroxidação lipídica, e os poluentes ambientais[50]. Em condições normais, as células mantêm o balanço de ERO/ERN em níveis adequados, pela ação de antioxidantes enzimáticos como SOD, CAT e GPx, assim como através de antioxidantes não enzimáticos, como GSH e ácido úrico[51]. Quando ocorrem perturbações neste equilíbrio, as defesas celulares ficam sobrecarregadas e a célula sofre modificações oxidativas de carboidratos e proteínas, cortes de fita de DNA e peroxidação lipídica, podendo gerar o câncer. Comprovou-se que α-mangostin apresentou um efeito de proteção em processos que envolviam estresse oxidativo[52-55], e que os mecanismos envolvidos incluíam a eliminação de radicais livres, a modulação de enzimas ligadas ao estresse oxidativo e a atenuação do processo inflamatório, bloqueando o câncer, ainda na sua etapa inicial[46].
Na fase de promoção do câncer, as células com disfunção no controle de proliferação celular e das proteínas reguladoras de apoptose podem originar um núcleo de células pré-neoplásicas. Estudos realizados com α-mangostin mostraram que esta substância foi capaz de atuar, em concentrações micromolares, nesta fase do câncer. O mecanismo de atuação desta substância ocorre através da modulação dos principais mediadores do ciclo celular, gerando apoptose, por bloqueio na transição G1/S, resultando na interrupção no ciclo celular na fase G1 em: câncer de próstata[56], melanoma[57], câncer de mama[58] e câncer pancreático[59]. No câncer de próstata, sua atividade antiproliferativa envolveu ainda a regulação negativa das ciclinas D1 e D3, Rb fosforilado e ciclina E[56]. Esta substância induz a apoptose de várias linhagens de células tumorais in vitro, assim como também em modelos de implante de tumor em animais, através de modulação das moléculas de sinalização pró e antiapoptóticos[60,61], de forma seletiva, com baixa toxicidade para as células normais[62-64].
Posteriormente, as células pré-neoplásicas transformam-se em neoplásicas quando passam a ter propriedades angiogênicas, promovendo a invasão de células e tecidos, gerando metástases e entrando no estágio de progressão do câncer. A supressão da angiogênese envolve principalmente a modulação da expressão do factor de crescimento endotelial vascular (VEGF), que estimula a proliferação das células endoteliais, a migração e a diferenciação para formar novos vasos sanguíneos. O VEGF liga-se aos seus receptores, gerando mudanças conformacionais nos receptores, dimerização e autofosforilação dos resíduos de tirosina, ativando assim a cascata de sinalização como MAPK e via PI3K/Akt[65]. A substância α-mangostin reduziu a expressão de VEGF, em células de câncer de mama T47D[66], inibindo assim a sua progressão. Além disso, esta xantona mostrou ser capaz de prevenir a progressão do câncer pancreático induzido por hipóxia, que também está associada à angiogênese[67].
Além da invasão de células tumorais que ocorre através do estroma associado ao tumor, as subsequentes metástases são os eventos centrais que ocorrem na progressão neoplásica. Uma das marcas da invasão tumoral e migração é a degradação excessiva da matriz extracelular mediada por enzimas proteolíticas, principalmente MMP-2 e MMP-9. A xantona α-mangostina é capaz de regular negativamente a expressão de MMP-2 e MMP-9, de maneira dose-dependente, bloqueando assim a invasão e a metástase de vários tipos de câncer como o carcinoma de pele[68], de células escamosas de cabeça e pescoço[69], o adenocarcinoma de pulmão[70], o carcinoma de próstata[71] e o câncer pancreático[72].
Além de ser capaz de bloquear, reverter ou retardar a carcinogênese, agindo em todas as suas etapas por diferentes mecanismos, a α-mangostina também inibe a atividade do transportador ABC, que é uma interessante característica para a quimioterapia, pois previne a resistência a múltiplas drogas (MDR)[73].
Além dos artigos descritos, há outro artigo de revisão sobre o α-mangostin, que mostra suas propriedades quimiopreventivas, antiproliferativas, pró-apoptóticas, antiangiogênicas e antimetastáticas contra uma ampla gama de tipos de células tumorais[74].
A substância garcinona E, outra xantona presente no mangostão, mostrou citotoxicidade em várias linhagens de células de carcinoma hepatocelular (HCC)[75], e inibiu a proliferação de células de feocromocitoma (PC12) e de glioma (U87), com dependência da dose, sendo esta atividade mais intensa nas células de glioma[76]. Sua atividade anticâncer também foi avaliada em células de câncer colorectal (HCT-116), hepatocelular (HepG2) e mama (MCF-7). Sua atividade antiproliferativa contra HCT-116 e HepG2 ocorre devido à interrupção do ciclo celular na fase G0/G1 e indução de apoptose e necrose[43]. O tratamento realizado com esta xantona em células de câncer oral (HSC-4) inibiu a sua proliferação destas células e o seu potencial de formação de colônias. Este estudo mostrou que o efeito antiproliferativo desta substância ocorre devido a apoptose, ocorrendo também a supressão da migração e invasão celular, por inibição da expressão de MMP-2 e MMP-9. Além destes resultados, foi observado ainda uma redução no nível de IL-6, que contribuiu para a inibição da metástase e um nível elevado de IL-2, sugerindo que a Garcinona E possui uma atividade anti-inflamatória e imunoestimulante, que contribui diretamente para o seu potencial antimetastático[77]. O crescimento de dois outros tipos de linhagens cancerígenas de ovário (HEY e A2780) também foi inibido pelo tratamento com garcinona E, através da modulação do estresse induzido pelo retículo endoplasmático (RE) que ativou a via de sinalização (IRE) -1α, induzindo assim a apoptose. O mecanismo apoptótico baseou-se na interrupção no ciclo celular na fase G2/M. O processo de invasão celular, baseado nas modificações nas MMPs e, diretamente relacionado à metástase foi bloqueado[78]. Um estudo mais recente apresentou resultados semelhantes, pois esta xantona também mostrou uma potente atividade citotóxica em células de câncer cervical (HeLa), com mecanismos de ação que envolvem também a apoptose por interrupção do ciclo celular na fase G2/M. Além disso, esta xantona também foi capaz de suprimir a migração, a invasão e a adesão celular[79].
Além da garcinona E, várias outras xantonas preniladas, também foram isoladas do mangostão (Ex: 8-desoxigartanina, gartanina, 9-hidroxicalabaxantona e tovofillina A). Todas mostraram atividade antiproliferativa sobre células de câncer gástrico (SGC 7901), cervical (HeLa) e hepatoma (HepG2), sendo que a garcinona-E possuí o efeito citotóxico mais intenso. A substituição por unidades isoprênicas nos anéis A e B em combinação com uma substituição 4-oxo são determinantes para a atividade antiproliferativa, enquanto que a ciclização da unidade isoprênica ocasiona um decréscimo desta atividade[80].
A garciniaxantona I e mais cinco substâncias conhecidas foram isoladas da casca de G. xanthochymus e testadas em quatro linhagens de células tumorais: hepatoma (HepG2), adenocarcinoma de pulmão (A549), câncer gástrico (SGC7901) e câncer de mama (MCF-7). Os resultados obtidos neste estudo permitiram concluir que a garciniaxantona I promove apoptose nas células de hepatoma (HepG2) pela via mitocondrial, mediada pelas caspases 3/7/9, através do aumento da expressão do gene Bax (pró-apoptótico), com redução da expressão dos genes supressores de apoptose (Bcl-2, Bcl-XL, Mcl-1). O tratamento com esta substância inibe também a expressão das metaloproteinases de matriz (MMP-7 e MMP-9), que são enzimas de degradação da matriz celular, ligadas à migração celular e à metástase[81].
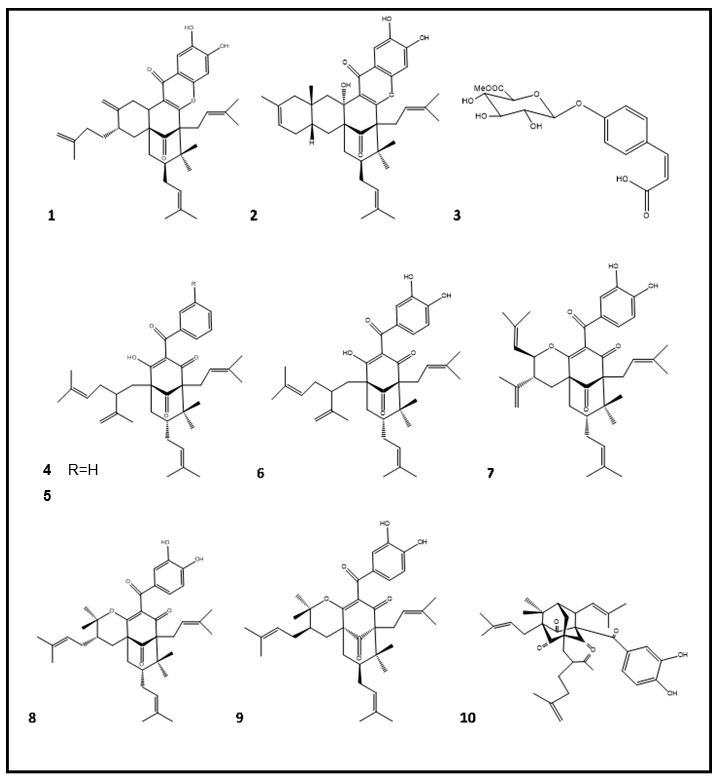
Pela primeira vez foram isoladas, dos frutos de G. xanthochymus, as garcinoxantocinas A e B e um fenilpropanoide glicosilado, além de sete substâncias já conhecidas, spiritona, 14-desoxigarcinol, xantochimol, garcicovina C, isogarcinol, cicloxantochimol e garcinialiptona (FIGURA 2). A atividade anticâncer destas substâncias foi avaliada contra células de glioblastoma (U251MG) e câncer de mama (MDA-MB-231). Entre as substâncias, a 14-desoxigarcinol mostrou a maior inibição na proliferação de células de U251MG, com IC50 de 1,3 µM. As substâncias garcinoxantocinas A e B, xantochimol, garcicovina, isogarcinol e cicloxantochimol também mostraram uma boa atividade antiproliferativa, mostrando valores de IC50 1,8–6,0 µM, enquanto que a garcinialiptona foi inativa. Nenhuma destas substâncias mostrou efeito na viabilidade celular de MDA-MB-231. Ainda neste estudo, o tratamento das células de glioma com xantochimol inibiu a fosfo-tirosina STAT3, sugerindo que a atividade antiproliferativa desta substância poderia estar ligada à inibição desta proteína, uma vez que STAT-3 é um importante alvo que controla a proliferação e sobrevivência celular. A garcicovina C inibiu a migração das células do glioma e a atividade de ligação do STAT-3 ao DNA. Dessa forma, xantochimol e garcicovina C possuem um efeito inibidor do tumor, relacionado à inibição de STAT-3 em células tumorais[82].
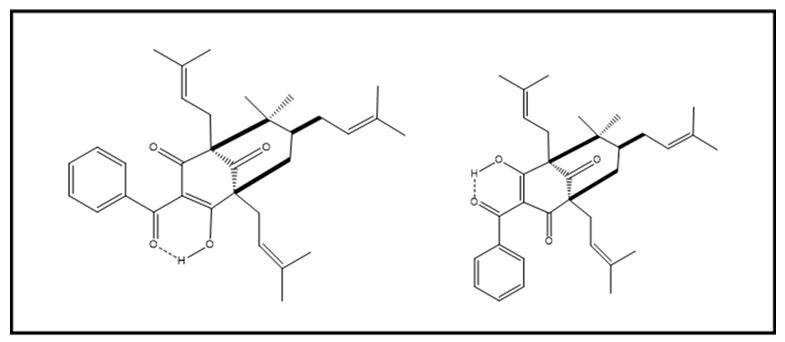
A substância 7-epiclusianona (FIGURA 3), isolada de G. brasiliensis, apresentou efeito citotóxico com concentração-dependente para células A-549, promovendo a interrupção do ciclo celular na transição G1/S[83]. Em outro estudo, as substâncias garciniafenona e 7-epiclusianona foram testadas em diferentes células: melanoma (UACC-62), câncer de mama (MCF-7) e mama resistente a medicamentos (NCI-ADR), câncer de pulmão de não pequenas células (NCIH460), câncer de ovário (OVCAR 03), câncer de próstata (PC03), câncer de rim (786-0) e câncer de língua (CRL-1624 e CRL-1623). As duas benzofenonas mostraram efeito citotóxico em todas as linhagens, mas apenas a 7-clusianona teve um efeito dose-dependente, possuindo ainda uma maior citotoxicidade na maioria das linhagens tumorais. O mecanismo antiproliferativo envolvido está relacionado à inibição das catepsinas B e G. Estas duas enzimas são secretadas pelas células cancerosas e promovem a hidrólise da matriz celular do tumor primário, rompendo assim o limite com os tecidos da vizinhança deste, provocando a invasão e metástase[84]. A viabilidade de duas linhagens celulares de glioblastoma (U251MG e U138MG) foi drasticamente inibida, quando ambas foram tratadas com 7-epiclusianona. A capacidade de formação de colônias, dos dois tipos de células, também foi significativamente reduzida, demonstrando efeitos em longo prazo, mesmo após a remoção do tratamento. Em baixas concentrações, o tratamento das células de glioblastoma com a 7-epiclusianona (10 µM) mostrou alterações na progressão do ciclo celular, causando diminuição na população da fase G2/M. Em culturas de U251S houve redução da população na fase S e na fase G2/M e em maiores concentrações de 7-epiclusianona (40 µM) houve um significante aumento na população Sub-G1 para as duas linhagens. Os resultados são compatíveis com a ocorrência de apoptose, mas os mecanismos envolvidos são diferentes e necessitam de um aprofundamento em estudos posteriores[85].
Em 2019, um estudo realizado por Taylor e colaboradores[86], mostrou que a 7-epiclusianona também inibiu o crescimento de 60 linhagens de células cancerosas e induziu morte celular significativa em apenas alguns tipos de câncer, particularmente para o câncer renal, melanoma, tumores do SNC, câncer de cólon e câncer de pulmão de não pequenas células (NSCLC). Entre as linhagens de NSCLC, a mais suscetível à 7-epiclusianona foi a linhagem NCIH460, que é originária do fluido pleural, sendo a escolhida para realização de estudos sobre os mecanismos envolvidos. A análise do ciclo celular revelou que a morte celular foi precedida por uma interrupção na fase G1/S, semelhante ao ocorrido em células de câncer de pulmão A549[83], sugerindo que o mesmo mecanismo de ação pode estar envolvido, envolvendo apoptose de maneira dose-dependente. Ainda neste estudo, em concentrações menores que 200 nM, foi observada uma significativa inibição da invasão celular. Além disso, a 7-epi-clusianona, a uma concentração de 20 µM, mostrou reduzir significativamente a formação dos tubos de células endoteliais da veia umbilical humana (HUVEC). Esta etapa é crítica para o processo de angiogênese, sendo utilizada tanto pelo processo de cicatrização de feridas, quanto na alimentação do tumor. Dessa forma, a 7-epi-clusianona possivelmente atua para inibir o crescimento contínuo do tumor e as metástases da linhagem NCIH460. Além disso, esta substância possui uma boa capacidade imunomoduladora, que torna possível a combinação dos dois tratamentos, a quimioterapia citotóxica e a terapia imunológica, resultando em uma maior eficácia.
Em um estudo mais recente, a 7-epiclusianona apresentou atividade antiproliferativa contra células de câncer de mama (MCF-7 e Hs 578T), sendo mais responsivo na primeira. Este efeito foi relacionado à parada no ciclo celular na fase G1/S, nas duas linhagens, por modulação de reguladores do ciclo celular e sua atividade pró-apoptótica foi associada à sua capacidade de aumentar a razão BAX (proteína apoptótica) / BCL-2(proteína anti-apoptótica)[87].
Atividade anticâncer do gênero Clusia
A clusianona (FIGURA 4) é uma benzofenona poliisoprenilada, isômera da nemorosona, que foi isolada pela primeira vez das raízes de Clusia congestiflora[88].
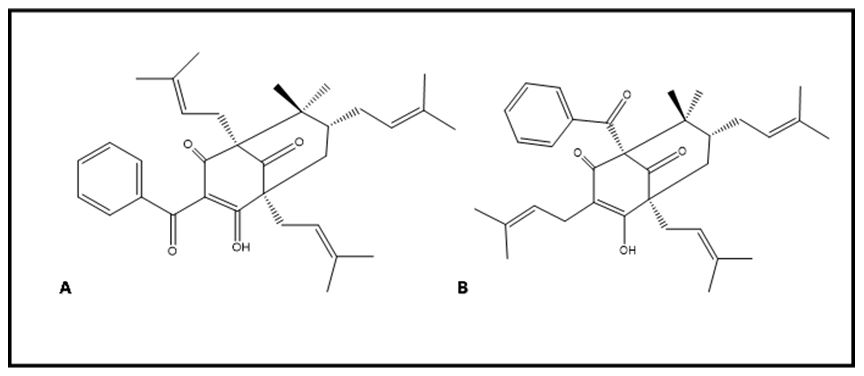
Os enantiômeros nemorosona e clusianona, assim como outros pares de enantiômeros de acilfloroglucinol policíclicos poliprenilado (PPAP), foram obtidos por via sintética, para a realização dos testes de citotoxicidade de cada enantiômero puro contra diferentes linhagens tumorais. Os resultados obtidos para os tratamentos com os enantiômeros da nemorosona, da clusianona, são similares para as linhagens de carcinoma cervical (HeLa), carcinoma pancreático (MIA-PaCa2) e câncer de mama (MCF7). Os enanciômeros da nemorosona possuem atividades muito semelhantes aos da clusianona[89]. Em estudos realizados anteriormente foi observado que a nemorosona atua por dissipação no potencial da membrana mitocondrial e liberação de Ca+2 e níveis elevados de estresse celular[90]. Desta forma, a similaridade entre os isômeros clusianona e nemorosona deve-se às ações físico-quimicas comparáveis membrana mitocondrial[89]. Esta ação nas mitocôndrias foi demostrada em um estudo posterior, realizado em células isoladas de fígado de rato (HepG2). Neste estudo, o tratamento com a clusianona e a nemorosona promovem o desacoplamento mitocondrial protonofórico, pela dissociação dos prótons fenólicos na matriz mitocondrial. Isso foi evidenciado pela dissipação do potencial de membrana mitocondrial e pela inibição de influxo de Ca+2, pela promoção do efluxo em mitocôndrias carregadas com Ca+2 e por uma diminuição nos níveis de ATP e NAD (P) H e geração de ROS. A ação citotóxica e o desacoplamento da clusianona foram, consideravelmente, menores do que as da nemorosona, provavelmente devido à presença de uma ligação de hidrogênio intramolecular, que diminui a interação com os receptores[91].
A substância nemorosona, isolada de resinas florais de Clusia rosea, mostrou atividade citotóxica em células de carcinoma epitelial (HeLa), epidermóide (Hep-2), prostáticos (PC-3) e do sistema nervoso central (U-251)[92]. Esta substância também mostrou citotoxicidade in vitro contra células de mama, colon, ovário, fígado e pulmão[93]. Em células leucêmicas do tipo Jurkat e K-562 esta substância mostrou atividade antiproliferativa e apoptótica, através da inibição da enzima Akt/PKB promovendo a interrupção do ciclo celular. Ainda neste trabalho, foram realizadas avaliações in vivo que sugerem que a nemorosona afeta significativamente a hematopoiese em camundongos[94].
A nemorosona mostrou atividade citotóxica em linhas de células de neuroblastoma do tipo NB69, Kelly, SK-N-AS e LAN-1, assim como nas células LAN-1 quimioresistentes à cisplatina, etoposideo, adriamicina e 5-fluoruracil. Nas células LAN-1, esta benzofenona, apresentou um aumento de células na fase G0/G1 e uma diminuição da percentagem de células na fase S, com aumento dos níveis de proteína p21Cip1, uma das principais reguladoras interrupção do ciclo celular na fase G1/S, evidenciando a presença de um mecanismo apoptótico. Os danos causados ao DNA, característicos de 'apoptose tardia', foram avaliados semiquantitativamente e considerados significativos. Houve também um aumento significativo de caspases-3, de maneira dose-dependente. A atividade enzimática do imunoprecipitado Akt/PKB foi fortemente inibida in vitro, sugerindo que, seu efeito antiproliferativo, pelo menos em parte, está relacionado ao alvo Akt/PKB, nas linhagens de células estudadas[95].
Sua ação nas células pancreáticas (Capan-1, AsPC-1 e MIA-PaCa-2) difere do mecanismo de ação em células leucêmicas já descrito anteriormente[94], envolvendo a liberação do citocromo C das mitocôndrias e subsequente apoptose dependente de caspase. Os resultados mostraram ainda que o potencial da membrana mitocondrial foi abolido e houve um aumento dos níveis de cálcio citosólico. O perfil de expressão gênica revelou 336 genes afetados pela nemorosona. Um total de 75 genes foi alterado, em todas as três linhagens celulares, e muitos destes estavam dentro da rede de resposta de proteína desdobrada (UPR). A UPR é desencadeada pelo acúmulo de proteínas desdobradas ou mal dobradas no retículo endotelial (RE) e tem como objetivo restabelecer a homeostase celular, desencadeando, porém, a apoptose caso esta não seja alcançada. Em resumo, o mecanismo anticâncer da nemorosona nas células pancreáticas mostrou uma rápida elevação do nível de cálcio citosólico, despolarização da membrana mitocondrial, seguido por ativação da apoptose, por meio de uma via de resposta ao estresse denominada UPR[96].
A nemorosona também mostrou atividade antiproliferativa em células de carcinoma de mama (MCF-7), com receptor de estrogênio positivo pela interrupção do ciclo celular na fase G0/G1. Este efeito antiproliferativo parece envolver a interação da nemorosona com os receptores de estrogênio, pois, foi significativamente reduzido por adição de 17β-estradiol e intensificado por adição de um antagonista de receptor de estrogênio. Não houve citotoxicidade em células tumorais de MDA-MD-231, uma linhagem de células de câncer de mama com receptor de estrogênio negativo e em uma linhagem celular de carcinoma de próstata (LNCaP), confirmando a interação da nemorosona com os receptores de estrogênio[97]. Em um estudo posterior, seguindo-se diferentes metodologias, a nemorosona inibiu a ação do 17-β-estradiol em células de câncer de mama dependente de estrogênio (MCF-7 BUS), confirmando sua ação antiestrogênica[98]. Maiores investigações sobre os mecanismos anticâncer envolvidos nestas células de adenocarcinoma de mama (MCF-7 BUS) mostraram que, além da parada discreta do ciclo celular na fase G0/G1, a nemorosona causa depleção significativa na fase G2/M. Além disso, ocorreu a alteração da expressão de 19 genes relacionados a diferentes vias, especialmente o ciclo celular, a apoptose e receptores hormonais[99].
Já foi mencionado neste trabalho que o efeito citotóxico da nemorosona contra células de carcinoma hepático (HepG2) atua por um mecanismo que promove a dissipação do potencial de membrana de mitocôndrias, através de desacoplamento protonofórico e ativação de deflexão de adenosina trifosfato (ATP)[90]. Em outro estudo realizado em células HepG2, o tratamento com nemorosona inibiu significativamente a proliferação celular, tanto na presença quanto na ausência dos fatores solúveis secretados pelos macrófagos associados ao tumor (TAMs), com redução do número de colônias e da migração celular[100].
Em outro trabalho, foi mostrado que o efeito citotóxico da nemorosona, em células de carcinoma de colo LoVo WT e LoVo Dox (resistentes à doxorrubicina), foi dose e tempo-dependente, inclusive restaurando a sensibilidade da linhagem resistente à doxorrubicina. Ocorreu apoptose por interrupção do ciclo celular na fase G0/G1, nas duas linhagens tumorais, tanto no tratamento realizado apenas com nemorosona como no tratamento conjunto realizado com doxorrubicina. A produção de ROS foi significativamente maior do que a obtida apenas com o tratamento com doxorrubicina, especialmente em células resistentes. Isso sugere que, na indução da morte celular, o efeito sinérgico de nemorosona e doxorrubicina envolveu o aumento da produção de ROS. O tratamento com nemorosona ou com doxorrubicina em células LoVo WT também diminuiu significativamente o potencial de membrana mitocondrial. Já os tratamentos combinados aumentaram o potencial de membrana. O efeito sinérgico das combinações destes tratamentos na apoptose é mediado pela produção de ROS, podendo estar em estreita associação com a concentração de nemorosona. Os co-tratamentos também induziram a parada do ciclo celular, resultando em apoptose por uma maior produção de ROS e alteração drástica do potencial de membrana[101]. O mesmo grupo de pesquisa estudou a ação anticâncer de nemorosona sobre células de câncer coloretal (CRC), sendo observado que a sua viabilidade celular e a sua capacidade clonogênica foram reduzidas significativamente por este tratamento, de maneira dose-dependente, induzindo apoptose com interrupção do ciclo celular na fase G0/G1. Além disso, a nemorosona reduziu a expressão do gene BCL2 (antiapoptótico) e intensificou a expressão dos genes TP53 e BAX (pró-apoptóticos), resultando na ativação das caspases 3/7. Esta benzofenona poliisoprenilada atenuou a migração celular e a invasão tumoral pela inibição da atividade de MMP9, pelo aumento da E-caderina (envolvida na adesão celular), assim como pela diminuição da expressão de β-catenina e vimentina, que são proteínas que estão envolvidas na transição epitelial-mesenquimal (EMT), diminuindo assim o potencial metástico das células CRC[102].
Em estudo recente, a citotoxicidade de vinte e cinco substâncias, isoladas de extratos de Clusia criuva, foram testadas em células de glioblastoma humano (GL-15). O ácido betulínico não esterificado, o ácido betulínico esterificado pelo feruloil em C-28, as propolonas B, C e D e a hiperisampsina E apresentaram um potencial citotóxico superior a temozolomida. Esta substância é o principal agente quimioterápico usado para combater a proliferação de células de glioma (grau IV), sendo utilizado como controle[103].
Foi avaliada a citotoxicidade dos extratos em hexano, acetato de etila e metanol de Clusia latipes em células de câncer de próstata humano (PC-3), células de câncer de cólon (RKO), células de astrocitoma (D-384) e células de câncer de mama (MCF-7). O extrato em acetato de etila apresentou citotoxicidade mais relevante e o hexânico mostrou atividade genotóxica in vitro, avaliada através de ensaio Cometa. Friedelina, friedolan-3-ol e hesperidina, isoladas do extrato hexânico são substâncias citotóxicas, assim como β-amirina, isolada do extrato em acetato de etila (FIGURA 5)[104].
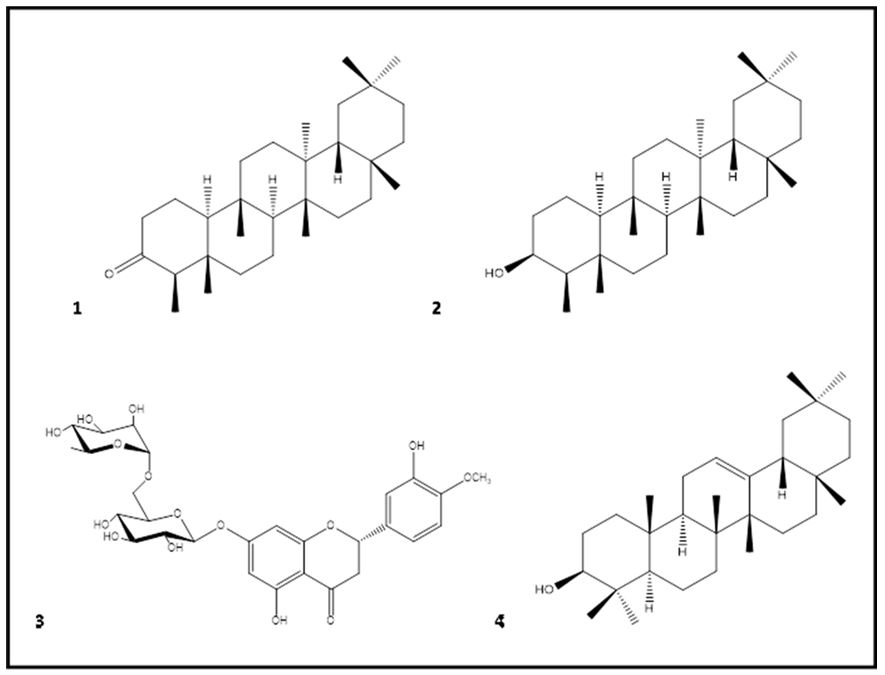
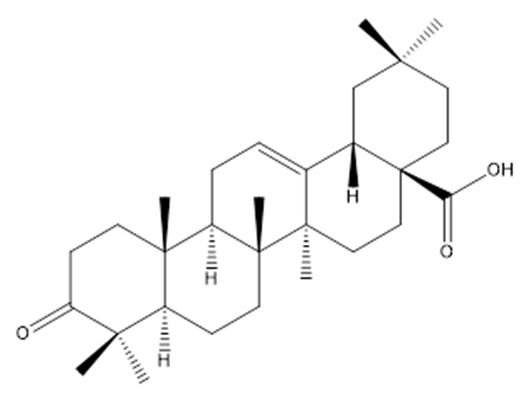
As aplicações medicinais de espécies de Clusiaceae já são conhecidas há muito tempo, destacando-se sua atividade antineoplásica. Por esse motivo, nosso grupo desenvolve pesquisas da família Clusiaceae que se iniciou com a espécie Clusia studartiana, inédita do ponto de vista químico e farmacológico, registrada no Patrimônio Genético (SISGEN), sob o número AB5D582. O projeto denomina-se "Bioprospecção e isolamento de produtos naturais com potencial atividade antitumoral de Clusiaceae" (FIOCRUZ/UERJ) e é realizado em colaboração com o Laboratório de Farmacologia Molecular/FIOCRUZ. Como resultado deste trabalho, dois triterpenos pentacíclicos friedolan-3β-ol (FIGURA 5) e o ácido 3-oxo-olean-12-en-28-oico (FIGURA 6) foram isolados do extrato hexânico das partes aéreas de Clusia studartiana e mostraram inibição na proliferação de células de leucemia mielóide (K562). Contudo, apenas o ácido 3-oxo-olean-12-en-28-oico foi capaz de aumentar a percentagem de Anexina (V)/Iodeto de propídeo (PI) nas células (p<0,05), com 40% de aumento de caspase 3/7, mostrando ainda inibição na atividade do P-gp. Dessa forma, o ácido 3-oxo-olean-12-en-28-oico mostrou-se como um promissor agente anticâncer, inclusive prevenindo a resistência a múltiplas drogas (MDR) [105].
A citotoxicidade dos triterpenos já é bem descrita na literatura. Estas substâncias inibem a proliferação celular e induzem a morte celular através de alvos específicos para câncer como proteassomas, Bcl-2, NF-κB, TNF, STAT-3, TLR, PI3K/Akt/mTOR e angiogênse[106]. Basicamente, seu mecanismo anticâncer consiste em inibição da inflamação e do estresse oxidativo, na regulação do ciclo celular e na indução de apoptose e na redução da proliferação celular. Os triterpenos destacam-se na pesquisa e no desenvolvimento de novas terapias anticâncer naturais/ semissintéticas, em particular para tratamento de cânceres dependentes de hormônio sexual (mama, ovário, endométrio, próstata e testículo), que estão relacionados à alta incidência de mortes em todo o mundo. Nestes tipos de câncer, os hormônios sexuais mantêm altas taxas mitóticas e aumentam a proliferação celular, aumentando a probabilidade de incidência de erros genéticos, divisão celular desordenada e fenótipos malignos[107].
Conclusão
No cenário brasileiro, onde a biodiversidade de seus biomas ainda permanece pouco explorada, a bioprospecção de substâncias anticâncer na família Clusiaceae pode contribuir para a descoberta de fitofármacos que poderiam ser associados a um desenvolvimento tecnológico moderno e sustentável. Nossa perspectiva é realizar um estudo mais profundo com Clusia studartiana, para a valorização da nossa biodiversidade através da sua possível utilização terapêutica e econômica.
Referências
1. Newman DJ. The influence of brazilian biodiversity on searching for human use pharmaceuticals. J Braz Chem Soc. 2017; 28(3): 402-414. ISSN 01035053 [CrossRef].
2. SiBBr. Sistema da Informação sobre a Biodiversidade Brasileira. Acesso em: 05 jan. 2021. Disponível em: [Link].
3. Saccaro Junior NL. Bioprospecção e desenvolvimento sustentável. Desafios do Desenvolvimento. Instituto de Pesquisa Econômica Aplicada (IPEA) [online] 2012; Acesso em: 22 fev. 2021. Disponível em: [Link].
4. Institute for Human Data Science (IQVIA). The global use of medicine in 2019 and outlook to 2023 – Forecasts and Areas to Watch. Institute Reports January 2019. Acesso em: 18 fev. 2021. Disponível em: [Link].
5. Newman DJ, Cragg GM. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 2020; 83(3): 770−803. ISSN 01633864, 15206025. [CrossRef].
6. American Cancer Society (ACS). Global cancer facts and figures. Atlanta 2018. Acesso em: 10 jan. 2021. Disponível em: [Link].
7. Vieira LLM, Kijoa A. 2009. Triterpenes from the plants of the family Clusiaceae (Guttiferae): chemistry and biological activities. In natural products chemistry biochemistry and pharmacology. Goutam Brahmachari (Editor), Narosa Publishing House Pvt. Ltd., New Delhi, India, 326-381. ISBN: 978-81-7319-886-1.
8. Pradeep Kumar SV, Puranik SB, Nandini BN. Evaluation of alpha-mangostin, isolated and purified from the crude extract of Garcinia mangostana, for the antidiabetic, anti-inflammatory and antioxidant activity. Int J Pharm Pharm Res.2017; 8(2): 75-95. ISSN 2349-7203. [Link].
9. Ibrahim SRM, Abdallah HM, El-Halawany AM, Radwan MF, Shehata IA, Al-Harshany EM et al. Garcixanthones B and C, new xanthones from the pericarps of Garcinia mangostana and their cytotoxic activity. Phytochem Lett. 2018. 12-16. ISSN 1874-3900 [CrossRef].
10. Jiang Y, Xiao L, Fu W, Tang Y, Lertnimitphun P, Kim N et al. Gaudichaudione H Inhibits inflammatory responses in macrophages and dextran sodium sulfate-induced colitis in mice. Front Pharmacol. 2020; 10: 1561. ISSN 1663-9812. [CrossRef].
11. Espírito Santo BLS, Santana LF, Junior WHK, Araújo FO, Bogo D, Freitas KC et al. Medicinal potential of Garcinia species and their compounds. Molecules 2020; 25: 4513. eISSN 1420-3049 [CrossRef].
12. Stevens PF. 2001 Angiosperm Phylogeny Website. Version 14. July 2017. [and more or less continuously updated since]. Acesso em: 20 mar. 2020. Disponível em [Link].
13. REFLORA - Flora do Brasil 2020 - Algas Fungos e Plantas. Jardim Botânico do Rio de Janeiro. Acesso em: 15 ago. 2020. Disponível em: [Link].
14. Ullah MF, Ahmad A.Nutraceuticals and natural product derivatives: disease Prevention & Drug Discovery. John Wiley & Sons, 2019. ISBN: 978-1-119-43667-6.
15. Chen TH, Tsai MJ, Fu YS, Weng CF. The exploration of natural compounds for anti-diabetes from distinctive species Garcinia linii with comprehensive review of the garcinia family. Biomolecules. 2019; 9(11): 641. ISSN 2218-273X. [CrossRef].
16. Karim N, Rahman A, Chanudom L, Thongsom M, Tangpong J. Mangosteen vinegar rind from Garcinia mangostana prevents high-fat diet and streptozotocin-induced type ii diabetes nephropathy and apoptosis. J Food Sci. 2019; 84(5): 1208-1215. ISSN 1750-3841. [CrossRef].
17. Ali MY, Paul S, Tanvir EM, Hossen MS, Rumpa NN, Saha M et al. Antihyperglycemic, antidiabetic, and antioxidant efects of Garcinia pedunculata in rats. Evid-Based Compl Alt. [online]. 2017. ID 2979760.Acesso em: 20 fev. 2021. ISSN 1741-4288. [CrossRef].
18. Brito LC, Berenger AL, Figueiredo MR. An overview of anticancer activity of Garcinia and Hypericum. Food ChemToxicol. 2017; 109: 847-862. ISSN 0278-6915 [CrossRef].
19. Mello RFA, Pinheiro WBS, Benjamim JK, Siqueira FC, Chisté RC, Santos AS. A fast and efficient preparative method for separation and purification of main bioactive xanthones from the waste of Garcinia mangostana L. by high-speed counter current chromatography. Arab J Chem. 2021; 103252. ISSN 1878-5352. [CrossRef].
20. John OD, Mouatt P, Panchal SK, Brown L. Rind from purple mangosteen (Garcinia mangostana) attenuates diet-induced physiological and metabolic changes in obese rats. Nutrients. 2021; 13: 319. ISSN 2072-6643 [CrossRef].
21. Al-Shagdari A, Alarcón AB, Cuesta-Rubio O, Piccinelli AL, Rastrelli L. Biflavonoids, main constituents from Garcinia bakeriana leaves. Nat Prod Comm. 2013; 8(9): 1237-1240. ISSN 15559475. [CrossRef].
22. Fuentes RG, Pearce KC, Du Y, Rakotondrafara A, Valenciano AL, Cassera MB et al. Phloroglucinols from the roots of Garcinia dauphinensis and their antiproliferative and antiplasmodial activities. J Nat Prod. 2019; 82(3): 431-439. ISSN 0163-3864. [CrossRef].
23. Nanjing University of Chinese Medicine. 2006. Dictionary of Chinese Traditional Medicines. Shanghai Scientific and Technical Publishers, Shanghai, China.
24. Wang X, Deng R, Lu Y, Xu Q, Yan M, Ye D et al.Gambogic acid as a non-competitive inhibitor of ATPbinding cassette transporter B1 reverses the multidrug resistance of human epithelial cancers by promoting ATP-binding CassetteTransporter B1 protein degradation. Basic Clin Pharmacol. 2013; 112: 25-33. ISSN 2279-0780. [CrossRef].
25.Kaennakam S, Sukandar ER, Juntagoot T, Siripong P, Tip-Pyang S. Four new xanthones and their cytotoxicity from the stems of Garcinia schomburgkiana. J Nat Med. 2021. 75(4): 871-876. ISSN 13403443.[CrossRef].
26. Aggarwal V, Tuli HS, Kaur J, Aggarwal D, Parashar G, Parashar NC et al. Garcinol exhibits anti-neoplastic effects by targeting diverse oncogenic factors in tumor cells. Biomedicines. 2020; 8(5): 103. ISSN 2227-9059. [CrossRef].
27. Kopytko P, Piotrowska K, Janisiak J, Tarnowski M. Garcinol-A natural histone acetyltransferase inhibitor and new anti-cancer epigenetic drug. Int J Mol Sci. 2021; 22: 2828. ISSN 1422-0067. [CrossRef].
28. Lüttge U. Clusia A woody neotropical genus of remarkable plasticity and diversity. Ecological Studies 194. Springer Berlin Heidelberg. 2007. ISBN 978-3-540-37243-1.
29. Kumar S. Yanshu, Sharma S, Chattopadhyay SK. The potential health benefit of polyisoprenylated benzophenones from Garcinia and related genera: ethnobotanical and therapeutic importance. Fitoterapia. 2013; 89(1): 86-125. ISSN 0367-326X. [CrossRef].
30. Anholeti MC, Paiva, SR, Figueiredo MR, Kaplan MAC. Chemosystematic aspects of polyisoprenylated benzophenones from the Genus clusia. An Acad Bras Cienc. 2015; 87(1): 289-301.ISSN 0001-3765. [CrossRef].
31. Ferraz CG, Silva MDCC, Pereira DASG. Caldas BVV, Mattos R, Oliveira VVG et al. Polyprenylated benzophenone derivatives from Clusia burle-marxii and their chemotaxonomic significance. Biochem Systemat Ecol. 2021; 94: 104218. ISSN 0305-1978. [CrossRef].
32. Silva EM, Araújo RM, Freire-Filha LG, Silveira ER, Lopes NP, Paula JE et al. Clusiaxanthone and tocotrienol series from Clusia pernambucensis and their antileishmanial activity. J Braz Chem Soc. 2013; 24(8): 1314-1321. ISSN 1678-4790. [CrossRef].
33. Ribeiro PR, Ferraz CG, Guedes MLS, Martins D, Cruz FG. A new biphenyl and antimicrobial activity of extracts and compounds from Clusia burlemarxii. Fitoterapia. 2011; 82(8): 1237-1240. ISSN 1873-6971. [CrossRef].
34. Silva MCA, Paiva SR. Antioxidant activity and flavonoid content of Clusia fluminensis Planch. & Triana. An Acad Bras Cienc. 2012; 84(3): 609-616. ISSN 0001-3765. [CrossRef].
35. Ferreira RO, de Carvalho Jr. AR, Riger CJ, Castro RN, da Silva TMS, de Carvalho MG. Chemical constituents and in vivo antioxidant activity of flavonoids isolated of Clusia lanceolata (Clusiaceae). Quim Nova. 2016; 39 (9): 1093-1097. [CrossRef].
36. Ferraz CG. Derivados poliprenilados de benzofenonas, triterpenos, esteróides, bifenila e xantona de Clusia burlemarxii e atividade citotóxica contra células GL-15, de glioblastoma humano. Salvador. 2011. Dissertação de Mestrado [Programa de Pós-graduação em Química] – Universidade Federal da Bahia, UFBA, Salvador. 2011. [Link].
37. Carballo DD, Seeber S, Strumberg D, Hilger RA. Novel antitumoral compound isolated from Clusia rosea. Int J Clin Pharmacol Ther. 2003; 41(12): 622-3. ISSN 0946-1965. [CrossRef].
38. Ferraz CG, Ribeiro PR, Marques EJ, Mendonça R, Guedes MLS, Silveira ER et al. Polyprenylated benzophenone derivatives with a novel tetracyclo [8.3.1.03,11.05,10] tetradecane core skeleton from Clusia burle-marxii exhibited cytotoxicity against GL-15 glioblastoma-derived human cell line. Fitoterapia. 2019; 138: 104346. ISSN 0367-326X. [CrossRef].
39. Cuesta-Rubio O, Frontana-Uribeb BA, Ramírez-Apanb T, Cárdenas J. Polyisoprenylated benzophenones in cuban propolis; biological activity of nemorosone. Z Naturforsch C J Biosci. 2002; 57(3-4): 372-8. ISSN 0341-0382. [CrossRef].
40. Díaz-Carballo D, Seeber S, Strumberg D, Hilger RA. Novel antitumoral compound isolated from Clusia rosea. Int J Clin Pharmacol Ther. 2003; 41(12): 622-623. [CrossRef].
41. Díaz-Carballo D, Malak S, Freistühler M, Elmaagacli A, Bardenheuer W, Reusch HP. Nemorosone blocks proliferation and induces apoptosis in leukemia cells. Int J Clin Pharmacol Ther. 2008; 46(8): 428-439. ISSN 0946-1965. [CrossRef].
42. Díaz-Carballo D, Malak S, Bardenheuer W, Freistuehler M, Reuscha HP. Cytotoxic activity of nemorosone in neuroblastoma cells. J Cell Mol Med. 2008; 12 (6B): 2598-2608. ISSN 1582-4934. [CrossRef].
43. Mohamed GA, Al-Abd AM, El-Halawany AM, Abdallah HM, Ibrahim SRM. New xanthones and cytotoxic constituents from Garcinia mangostana fruit hulls against human hepatocellular, breast and colorectal cancer cell lines. J Ethnopharmacol. 2017. 198: 302-312. ISSN 1872-7573. [CrossRef].
44. Semwal RB, Semwal DK, Vermaak I, Viljoen A. A comprehensive scientific overview of Garcinia cambogia. Fitoterapia. 2015; 102: 134-148. ISSN 0367-326X. [CrossRef].
45. Hassan, NKNC, Taher M, Susanti D. Phytochemical constituents and pharmacological properties of Garcinia xanthochymus: a review. Biomed Pharmacother. 2018; 106: 1378-1389. ISSN 7533322. [CrossRef].
46. Zhang K-J, Gu Q-L, Yang K, Ming X-J, Wang J-X. Anticarcinogenic effects of α-mangostin: a review. Planta Med. 2017; 83 (188-202). ISSN 0032-0943. [CrossRef].
47. Signorelli P, Ghidoni R. Resveratrol as an anticancer nutrient: molecular basis, open questions and promises J Nutr Biochem. 2005. 16(8): 449-66. ISSN 0955-2863 [CrossRef].
48. Jung H-A, Su B-N, Keller WJ, Mehta RG, Kinghorn AD. Antioxidant xanthones from the pericarp of Garcinia mangostana (Mangosteen). J Agric Food Chem. 2006; 54(6): 2077-2082. ISSN 0021-8561. [CrossRef].
49. Balunas MJ, Brueggemeier BSRW, Kinghorn AD. Xanthones from the botanical dietary supplement mangosteen (Garcinia mangostana) with aromatase inhibitory activity. J Nat Prod. 2008; 71(7): 1161-1166. ISSN 0163-3864. [CrossRef].
50. Yu BP. Cellular defenses against damage from reactive oxygen species. Physiol Rev. 1994; 74(1): 139-162. ISSN 1522-1210. [CrossRef].
51. Ma Q. Transcriptional responses to oxidative stress: pathological and toxicological implications. Pharmacol Ther. 2010. 125(3): 376-393. ISSN 1879-016X. [CrossRef].
52. Sampath PD, Vijayaraghavan K. Cardioprotective effect of α-mangostin, a xanthone derivative from mangosteen on tissue defense system against isoproterenol-induced myocardial infarction in rats. J Biochem Mol Toxicol. 2007; 21(6): 336-339. ISSN 1099-0461. [CrossRef].
53. Sampath PD, Kannan V. Mitigation of mitochondrial dysfunction and regulation of eNOS expression during experimental myocardial necrosis by alpha-mangostin, a xanthonic derivative from Garcinia mangostana. Drug Chem Toxicol. 2009; 32(4): 344-52. ISSN 1525-6014. [CrossRef].
54. Buelna-Chontal M, Correa F, Hernández-Reséndiz S, Zazueta C, Pedraza-Chaverri J. Protective effect of α-mangostin on cardiac reperfusion damage by attenuation of oxidative stress. J Med Food. 2011; 14(1): 1370-1374. ISSN 1557-7600. [CrossRef].
55. Márquez-Valadez B, Lugo-Huitrón R, Valdivia-Cerda V, Miranda-Ramírez LR, Pérez-De La Cruz V, González-Cuahutencos O et al. The natural xanthone alpha-mangostin reduces oxidative damage in rat brain tissue. Nutr Neurosci. 2009; 12(1): 35-42. ISSN 1476-8305. [CrossRef].
56. Johnson JJ, Petiwala SM, Syed DN, Rasmussen JT, Adhami VM, Siddiqui IA et al. α-Mangostin, a xanthone from mangosteen fruit, promotes cell cycle arrest in prostate cancer and decreases xenograft tumor growth. Carcinogenesis. 2012; 33(2): 413-419. ISSN 1460-2180. [CrossRef].
57. Wang JJ, Zhang W, Sanderson BJ. Altered mRNA expression related to the apoptotic effect of three xanthones on human melanoma SK‑MEL‑28 cell line. Biomed Res Int. 2013: 715603. ISSN 2314-6141. [CrossRef].
58. Kurose H, Shibata MA, Iinuma M, Otsuki Y. Alterations in cell cycle and induction of apoptotic cell death in breast cancer cells treated with α-mangostin extracted from mangosteen pericarp. J Biomed Biotechnol. 2012: 672428. [CrossRef].
59. Xu Q, Ma J, Lei J, Duan W, Sheng L, Chen X et al. α-Mangostin suppresses the viability and epithelial-mesenchymal transition of pancreatic cancer cells by downregulating the PI3 K/Akt pathway. Biomed Res Int. 2014: 546353. ISSN 2314-6141. [CrossRef].
60. Aisha AF, Abu-Salah KM, Ismail Z, Majid AM. In vitro and in vivo anti-colon cancer effects of Garcinia mangostana xanthones extract. BMC Complement Altern Med. 2012; 12: 104. ISSN 1472-6882. [CrossRef].
61. Watanapokasin R, Jarinthanan F, Jerusalmi A, Suksamrarn S, Nakamura Y, Sukseree S et al. Potential of xanthones from tropical fruit mangosteen as anticancer agents: caspase-dependent apoptosis induction in vitro and in mice. Appl Biochem Biotechnol. 2010; 162(4): 1080-1094. ISSN 1559-0291. [CrossRef].
62. Matsumoto K, Akao Y, Kobayashi E, Ohguchi K, Ito T, Tanaka T et al. Induction of apoptosis by xanthones from mangosteen in human leukemia cell lines. J Nat Prod. 2003; 66(8): 1124-1127. ISSN 0163-3864. [CrossRef].
63. Chen JJ, Long ZJ, Xu DF, Xiao RZ, Liu LL, Xu ZF et al. Inhibition of autophagy augments the anticancer activity of α-mangostin in chronic myeloid leukemia cells. Leuk Lymphoma. 2014; 55(3): 628-638. ISSN 1029-2403. [CrossRef].
64. Menasria F, Azebaze AGB, Billard C, Faussat AM, Nkengfack AE, Meyer M et al. Apoptotic effects on B-cell chronic lymphocytic leukemia (B-CLL) cells of heterocyclic compounds isolated from Guttiferaes. Leuk Res. 2008; 32(12): 1914-1926. ISSN 0145-2126. [CrossRef] [PubMed].
65. Olsson AK, Dimberg A, Kreuger J, Claesson-Welsh L. VEGF receptor signaling–in control of vascular function. Nat Rev Mol Cell Biol. 2006; 75(5): 359-371. ISSN 1471-0080. [CrossRef] [PubMed].
66. Arifianti L, Rofida S, Sukardiman, Zaini NC. Antiangiogenesis from pericarp of mangosteen on T47D breast cancer. Planta Husada. 2014: 2(1): 12-15. ISSN 2338-7130. [Link].
67. Lei J, Huo X, Duan W, Xu Q, Li R, Ma J et al. Alpha-Mangostin inhibits hypoxia-driven ROS-induced PSC activation and pancreatic cancer cell invasion. Cancer Lett. 2014; 347(1): 129-138. ISSN 1872-7980. [CrossRef] [PubMed].
68. Wang JJ, Sanderson BJ, Zhang W. Significant anti-invasive activities of α-mangostin from the mangosteen pericarp on two human skin cancer cell lines. Anticancer Res. 2012; 32(9): 3805-3816. [Link].
69. Kaomongkolgit R. Alpha-mangostin suppresses MMP-2 and MMP-9 expression in head and neck squamous carcinoma cells. Odontology. 2013; 101(2): 227-232. ISSN 1618-1255. [CrossRef] [PubMed].
70. Shih YW, Chien ST, Chen PS, Lee JH, Wu SH, Yin LT. α-Mangostin suppresses phorbol 12-myristate 13-acetate-induced MMP-2/MMP-9 expressions via αvβ3 integrin/FAK/ERK and NF-κB signaling pathway in human lung adenocarcinoma A549 cells. Cell Biochem Bioph. 2010; 58(1): 31-44. ISSN 1559-0283. [CrossRef] [PubMed].
71. Hung SH, Shen KH, Wu CH, Liu CL, Shih YW. α-Mangostin suppresses PC-3 human prostate carcinoma cell metastasis by inhibiting matrix metalloproteinase-2/9 and urokinase-plasminogen expression through the JNK signaling pathway. J Agric Food Chem. 2009; 57(4): 1291-1298. ISSN 1520-5118. [CrossRef].
72. Yuan J, Wu Y, Lu G. α-Mangostin suppresses lipopolysaccharide-induced invasion by inhibiting matrix metalloproteinase-2/9 and increasing E-cadherin expression through extracellular signalregulated kinase signaling in pancreatic cancer cells. Oncology Lett. 2013; 5(6): 1958-1964. ISSN 1792-1082. [CrossRef].
73. Wu C-P, Hsiao SH, Murakami M, Lu YJ, Li YQ, Huang YH et al. Alpha-Mangostin reverses multidrug resistance by attenuating the function of the multidrug resistance-linked ABCG2 transporter. Mol Pharm. 2017; 14(8): 2805-2814. ISSN 1543-8392. [CrossRef].
74. Muchtaridi M, Wijaya CA. Anticancer potential of α-mangostin. Asian J Pharm Clin Res. 2017; 10(12): 440-445. ISSN 2455-3891. [CrossRef].
75. Ho C-K, Huang Y-L, Chen C-C. Garcinone E, a xanthone derivative, has potent cytotoxic effect against hepatocellular carcinoma cell lines. Pl Med. 2002; 68(11): 975-979. ISSN 0032-0943. [CrossRef].
76. Yang R, Li P, Li N, Zhang Q, Bai X, Wang L et al. Xanthones from the Pericarp of Garcinia mangostana. Molecules. 2017; 22(5): 683. ISSN 1433-1373. [CrossRef].
77. Sheeja K, Lakshmi S. Antimetastatic potential of garcinone E in human oral cancer cells. Asian Pac J Cancer Prev. 2019; 20 (1): 65-72. ISSN 1513-7368. [CrossRef].
78. Xu X-H, Liu Q-Y, Li T, Liu J-L, Chen X, Huang L et al. Garcinone E induces apoptosis and inhibits migration and invasion in ovarian cancer cells. Sci Rep. 2017; 7(1):1-13. ISSN 2045-2322. [CrossRef].
79. Yang L, Xu Z, Wang W. Garcinone-E exhibits anticancer effects in HeLa human cervical carcinoma cells mediated via programmed cell death, cell cycle arrest and suppression of cell migration and invasion. AMB Express. 2020; 10(1): 126. ISSN 2191-0855. [CrossRef].
80. Ying Y-M, Yu K-M, Lin T-S, Ma L-F, Fang L, Yao J-B et al. Antiproliferative prenylated xanthones from the pericarps of Garcinia mangostana. Chem Nat Compd. 2017; 53(3): 555–556. ISSN 1573-8388. [CrossRef].
81. Jin S, Shi K, Liu L, Chen Y, Yang G. Xanthones from the bark of Garcinia xanthochymus and the mechanism of induced apoptosis in human hepatocellular carcinoma HepG2 cells via the mitochondrial pathway. Int J Mol Sci. 2019; 20(19): 4803. ISSN 1422-0067. [CrossRef].
82. Youn UJ, Sripisut T, Miklossy G, Turkson J, Laphookhieo S, Chang LC. Bioactive polyprenylated benzophenone derivatives from the fruits extracts of Garcinia xanthochymus. Bioorganic Med Chem Lett. 2017; 27(16): 3760-3765. ISSN 0960-894X. [CrossRef].
83. Ionta M, Ferreira-Silva GA, Niero EL, Costa EM, Martens AA, Rosa W et al. 7-epiclusianone, a benzophenone extracted from Garcinia brasiliensis (Clusiaceae), induces cell cycle arrest in G1/S transition in A549 cells. Molecules. 2015; 20(7): 12804-12816. ISSN 1433-1373. [CrossRef].
84. Murata RM, Yatsuda R, dos Santos MH, Kohn LK, Martins FT, Nagem TJ et al. Antiproliferative effect of benzophenones and their influence on cathepsin activity. Phytother Res. 2010; 24(3): 379-383. ISSN 0951-418X. [CrossRef].
85. Sales L, Pezuk JA, Borges KS, Brassesco MS, Scrideli CA, Tone LG et al. Anticancer activity of 7-epiclusianone, a benzophenone from Garcinia brasiliensis, in glioblastoma. BMC Complement Altern Med. 2015; 15: 393. ISSN 1472-6882. [CrossRef].
86. Taylor WF, Yanez M, Moghadam SE, Farimani MM, Soroury S, Ebrahimi SN et al. 7-epi-clusianone, a multi-targeting natural product with potential chemotherapeutic, immune-modulating, and anti-angiogenic properties. Molecules. 2019; 24(23): 4415. ISSN 1433-1373. [CrossRef].
87. Lamartine-Hanemann SS, Ferreira-Silva GA, Horvath RO, Soncini R, Caixeta ES, Rocha-Sales B et al. A tetraprenylated benzophenone 7-epiclusianone induces cell cycle arrest at G1/S transition by modulating critical regulators of cell cycle in breast cancer cell lines. Toxicol In Vitro. 2020; 68:104927. ISSN 0887-2333. [CrossRef].
88. McCandlish LE, Hanson JC, Stout GH. The structures of two derivatives of bicyclo [3,3,1]nonane-2,4,9-trione. A natural product: clusianone, C33H42O4, and trimethylated catechinic acid, C18H20O6. Acta Crystallogr. 1976; 32(6): 1793-1801. ISSN 1600-8642. [Link].
89. Simpkins NS, Holtrup F, Rodeschini V, Taylor JD, Wolf R. Comparison of the cytotoxic effects of enantiopure PPAPs, including nemorosone and clusianone. Bioorg Med Chem Lett. 2012; 22(19): 6144-6147. ISSN 0960-894X. [CrossRef].
90. Pardo-Andreu GL, Nuñez-Figueredo Y, Tudella VG, Cuesta-Rubio O, Rodrigues FP, Pestana CR et al. The anti-cancer agent nemorosone is a new potent protonophoric mitochondrial uncoupler. Mitochondrion. 2011; 11(2): 255-263. ISSN 1567-7249. [CrossRef].
91. Reis FHZ, Pardo-Andreu GL, Nunez-Figueredo Y, Cuesta-Rubio O, Marin-Prida J, Uyemura AS et al. Clusianone, a naturally occurring nemorosone regioisomer, uncouples rat liver mitochondria and induces HepG2 cell death. Chem-Biol Interact. 2014; 212: 20-29. ISSN 0009-2797. [CrossRef].
92. Cuesta-Rubio O, Frontana-Uribeb BA, Ramírez-Apanb T, Cárdenas J. Polyisoprenylated Benzophenones in Cuban Propolis; Biological Activity of Nemorosone. Z Naturforsch C J Biosci. 2002; 57(3-4): 372-378. ISSN 0939-5075. [CrossRef].
93. Díaz-Carballo D, Seeber S, Strumberg D, Hilger RA. Novel antitumoral compound isolated from Clusia rosea. Int J Clin Pharmacol Ther. 2003; 41(12): 622-623. ISSN 0946-1965. [CrossRef].
94. Díaz-Carballo D, Malak S, Freistühler M, Elmaagacli A, Bardenheuer W, Reusch HP. Nemorosone blocks proliferation and induces apoptosis in leukemia cells. Int J Clin Pharmacol Ther. 2008; 46(8): 428-439. ISSN 0946-1965. [CrossRef].
95. Díaz-Carballo D, Malak S, Bardenheuer W, Freistuehler M, Reuscha HP. Cytotoxic activity of nemorosone in neuroblastoma cells. J Cell Mol Med. 2008; 12(6B): 2598-608. ISSN 1582-4934. [CrossRef].
96. Holtrup F, Bauer A, Fellenberg K, Hilger RA, Wink M, Hoheisel JD. Microarray analysis of nemorosone-induced cytotoxic effects on pancreatic cancer cells reveals activation of the unfolded protein response (UPR). Br J Pharmacol. 2011; 162(5): 1045-1059. ISSN 1476-5381. [CrossRef].
97. Popolo A, Piccinelli AL, Morello S, Sorrentino R, Osmany CR, Rastrelli L et al. Cytotoxic activity of nemorosone in human MCF-7 breast cancer cells. Can J Physiol Pharmacol. 2011; 89(1): 50-57. ISSN 1205-7541. [CrossRef].
98. Camargo MS, Prieto AM, Resende FA, Boldrin PK, Cardoso CR, Fernández MF et al. Evaluation of estrogenic, antiestrogenic and genotoxic activity of nemorosone, the major compound found in brown Cuban propolis. BMC Complement Altern Med. 2013; 13: 201. ISSN 1472-6882. [CrossRef].
99. Camargo MS, Oliveira MT, Santoni MM, Resende FA, Oliveira-Höhne AP, Espanha LG et al. Effects of nemorosone, isolated from the plant Clusia rosea, on the cell cycle and gene expression in MCF-7 BUS breast cancer cell lines. Phytomedicine2015; 22(1): 153-157. ISSN 0944-7113. [CrossRef].
100. Frión-Herrera Y, Gabbia D, Cuesta-Rubio O, Martin S, Carrara M. Nemorosone inhibits the proliferation and migration of hepatocellular carcinoma cells. Life Sci. 2019; 235: 116817. ISSN 1879-0631. [CrossRef].
101. Frión-Herrera Y, Gabbia D, Díaz-García A, Cuesta-Rubio O, Carrara M. Chemosensitizing activity of Cuban propolis and nemorosone in doxorubicin resistant human colon carcinoma cells. Fitoterapia. 2019; 136: 104173. ISSN 0367-326X. [CrossRef].
102. Frión-Herrera Y, Gabbia D, Scaffidi M, Zagni L, Cuesta-Rubio O, Martin S et al. The Cuban Propolis component nemorosone inhibits proliferation and metastatic properties of human colorectal cancer cells. Int J Mol Sci. 2020; 21: 1827. ISSN 1422-0067. [CrossRef].
103. Marques EJ, Ferraz CG, dos Santos IBF, dos Santos IIP, El-Bacha RS, Ribeiro PR et al. Chemical constituents isolated from Clusia criuva subsp. Criuva and their chemophenetics significance. Biochem Syst Ecol. 2021; 97: 104293. ISSN 0305-1978. [CrossRef].
104.Bailon-Moscoso N, Romero-Benavides JC, Sordo M, Villacis J, Silva R, Celi L et al. Phytochemical study and evaluation of cytotoxic and genotoxic properties of extracts from Clusia latipes leaves. Rev Bras Farmacog. 2016: 26(1): 44-49. ISSN 1981-528X.[CrossRef].
105. Brito LC, Carvalho MV, Silva VP, Heringer AP, Silva PM, Fontão APGA et al. Evaluation of cytotoxic activity of triterpenes from Clusia studartiana. J Med Plants Res. 2019; 13(15): 335-342. ISSN 1996-0875. [CrossRef].
106. Gill BS, Kumar S, Navgeet. Triterpenes in cancer: significance and their influence. Mol Biol Reports. 2016; 43(9): 881-896. ISSN 1573-4978. [CrossRef].
107. Şoica C, Voicu M, Ghiulai R, Dehelean C, Racoviceanu R, Trandafirescu C et al. Natural Compounds in Sex Hormone-Dependent Cancers: The role of triterpenes as therapeutic agents. Front Endocrinol. 2021; 11: 612396. ISSN 1664-2392. [CrossRef].