Artigos Originais / Original Article
Utilização da Espectrometria de Massas e Análise Multivariada para a Confirmação da Autenticidade de Fitoterápicos Contendo Maytenus ilicifolia.
Use of mass Spectrometry and Multivariate Analysis to confirm the authenticity of Phytotherapic Products containing Maytenus ilicifolia.
Resumo
A espinheira-santa (Maytenus ilicifolia Mart. ex Reiss.) é uma das principais espécies da fitoterapia brasileira, usada no tratamento de gastrites e úlceras gástricas. Sua inclusão na norma do Ministério da Saúde Portaria GM no 3237 de 2007, inaugurou a entrada da fitoterapia no Sistema Único de Saúde através de financiamento público para aquisição de produtos à base dessa espécie. No presente trabalho, buscou-se avaliar, a partir do fingerprint em espectrometria de massas associada à análise multivariada, a autenticidade de produtos fitoterápicos contendo espinheira santa comercializados em São Paulo, em comparação com a droga vegetal autêntica. O teor de umidade nas amostras foi avaliado pela técnica de reflectância no infravermelho para se confirmar se estavam dentro dos limites estabelecidos, em caso contrário, a umidade excessiva poderia ser um fator importante na deterioração das amostras. Após a análise por espectrometria de massas, foram selecionados os principais íons presentes nos espectros e realizou-se uma análise estatística multivariada. Observou-se que algumas amostras são verdadeiras, em comparação com a droga vegetal. Entretanto, algumas outras não podem ser consideradas como sendo espinheira santa. A técnica de espectrometria de massas aliada à análise multivariada é uma ferramenta importante para a confirmação da autenticidade de drogas vegetais existentes em fitoterápicos.
- Palavras-chave:
- espectrometria de massas.
- análise das componentes principais.
- Maytenus ilicifolia.
- controle de qualidade.
Abstract
Espinheira-santa (Maytenus ilicifolia Mart. ex Reiss.) is one of the most important plant species used in Brazilian phytotherapy for the treatment of gastric ulcers and gastritis. Its inclusion in the GM no 3237 norm edited by the Ministry of Health in 2007 inaugurated the entry of phytotherapy in the Unique Health System by public funding for the acquisition of these types of products. In the present study, using mass spectrometry fingerprinting allied to multivariate analysis, the authenticity of phytotherapic products containing Espinheira santa, by comparison to an authentic plant sample was confirmed. The humidity in the samples was evaluated by infrared reflectance to confirm if it was within the established limits, as excessive humidity could be a decisive factor in sample degradation. After analysis by mass spectrometry, the main ions present in the spectra were selected and a multivariate analysis processed. It was clearly shown that some samples were authenticated by their similarity to the plant sample, while others could not be considered to be Espinheira-santa. The use of mass spectrometry allied to multivariate analysis is an important tool for the confirmation of plant drugs used in phytotherapic products.
- Keywords:
- mass spectrometry.
- principal component analysis.
- Maytenus ilicifolia.
- quality control.
Introdução
Maytenus ilicifolia (espinheira-santa) é indicada para vários males do aparelho digestivo e, no passado, era muito utilizada pelos índios brasileiros com outra finalidade: suas folhas eram empregadas no combate a tumores (esse uso pode ter gerado um dos seus nomes populares - erva-cancerosa). A planta, pertencente à família Celastraceae, é originária do Brasil e pode ser encontrada na região que vai de Minas Gerais ao Rio Grande do Sul, sendo mais abundante nas matas do sul do Paraná. Também é conhecida popularmente como espinho-de-deus, salva-vidas, sombra-de-touro, erva-cancerosa e espinheira-divina. A espinheira-santa é uma planta perene, de porte arbóreo-arbustivo, que atinge cerca de 2 a 3 metros de altura. Suas folhas são inteiriças e apresentam espinhos nos bordos, enquanto que as flores, axilares, apresentam coloração amareloesverdeada. A planta produz frutos pequenos e vermelhos, sua propagação se dá por meio de sementes e o cultivo dá bons resultados em regiões de clima ameno (Círio et al., 2003).
Quanto aos metabólitos secundários da M. ilicifolia, cerca de 30 substâncias já foram isoladas; entre os constituintes majoritários estão triterpenos, com esqueletos variados, ácido clorogênico, B-amirina, entre outros (Simões et al., 2003).
Espécies do gênero Maytenus apresentam como características os compostos macrocíclicos chamados maitansinóides, como a maitensina, maitenprina e maitenbutina, que foram isolados de diversas partes da plantas, como folhas, caule e raízes (Ahmed et al., 1991). Segundo Itokawa e colaboradores (1990), dos extratos metanólicos de M. ilicifolia foram isolados dois triterpenos, cangoronina e ilicifolina, juntamente com sete triterpenos: ácido maitenóico, D:Bfriedoolean- 5-en-3b,29-diol, D:A-friedoolean-29-ol-3-ona, pristimerina, ácido salasperímico, isopristimerina III e isotingenona III. Já da casca das raízes foram isolados poliésteres sesquiterpênicos, denominados cangorinas A - J. Foram isolados por Shirota e colaboradores em 1997, quatro triterpenos dímeros, cangorosina A, atropcangorosina A, diidroatropcangorosina A e cangorosina B.
Por meio da extração por CO2 supercrítico de marcadores de folhas de M. ilicifolia, Mossi e colaboradores (2004), analisaram e identificaram componentes como o esqualeno, vitamina E, estigmasterol, friedelan-3-ol, friedelina, entre outros. De extratos hexânicos foram isolados friedelina e friedelanol (Vilegas et al., 1994).
Em folhas de M. ilicifolia foram isolados três novos glicosídeos, ilicifolinosídeos A-C (Zhu, Sharapin e Zhang, 1998).
A partir de infusões aquosas de folhas M. ilicifolia foram isolados flavonóides di, tri e tetrassacarídeos derivados do canferol, junto com um trissacarídeo da quercetina (Leite et al., 2001). Quatro novos triterpenóides com vários esqueletos, maitefolinas A-C, e cafeato de 3-uvaol foram isolados de extratos metanólicos de folhas de Maytenus ilicifolia (Ohsaki et al., 2004).
Através de uma extração com solução aquosa de hidróxido de potássio 2% a quente e cromatografia de troca-iônica, foi isolada uma arabinogalactana das folhas de M. ilicifolia (Cipriani et al, 2007).
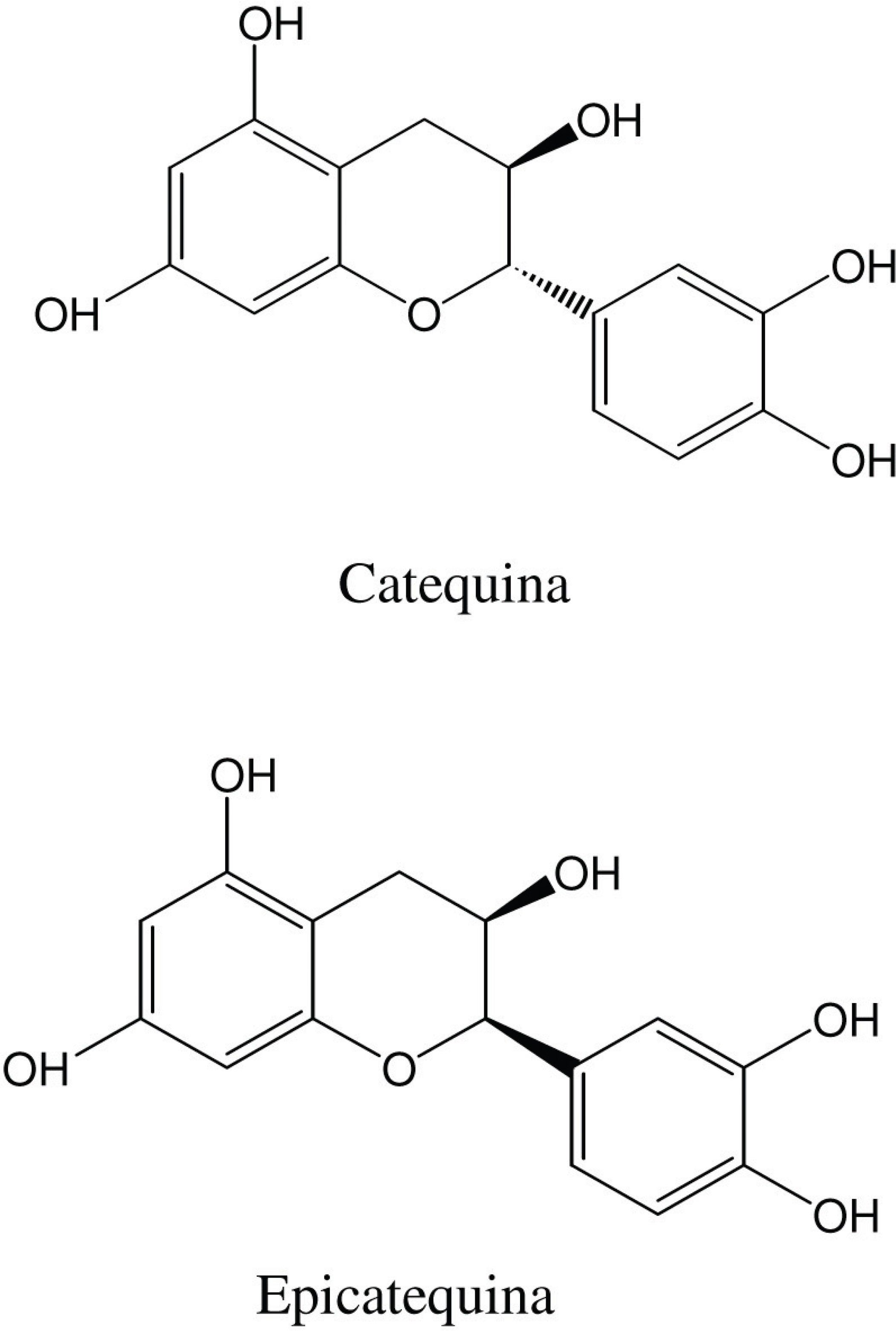
Utilizando-se a técnica da cromatografia em fase líquida de alta eficiência (HPLC) acoplada a um detector de massas (ESI-MS), Souza e colaboradores em 2008, identificaram componentes presentes nas folhas de M. ilicifolia, sendo caracterizados como afzelequina, epiafzelequina, catequina, epicatequina (FIGURA 1), galocatequina e epigalocatequina, sendo estes compostos da classe dos taninos condensados.
Soares e colaboradores (2004) desenvolveram e validaram um método cromatográfico utilizando fase reversa para a separação e quantificação de catequina e epicatequina que são marcadores da planta, em extratos aquosos de folhas de M. ilicifolia, sendo que o método apresentou boa repetibilidade (DP < 1,5%), reprodutibilidade (DP < Epicatequina 5%) e uma boa precisão. Lopes e colaboradores (2010) também desenvolveram e validaram um método analítico em HPLC para a quantificação de epicatequina em espinheira santa.
Em extratos aquosos de talos, ramos, folhas e raízes foram identificados aminoácidos, fenóis, taninos, fitoesteróides insolúveis, leucoantocianidinas e saponinas (Martins, 1998).
Mandich, Bittener e Barros (1984), dentre vários outros autores (Xavier e D’angelo, 1996; Nakamura et al., 1997; Zhu, Sharapin e Zhang, 1998; Leite et al., 2001; Tiberti et al., 2007 e Negri, 2007) isolaram flavonóides heterosídeos de M. ilicifolia. Entre eles, destacam-se os mostrados na FIGURA 2.
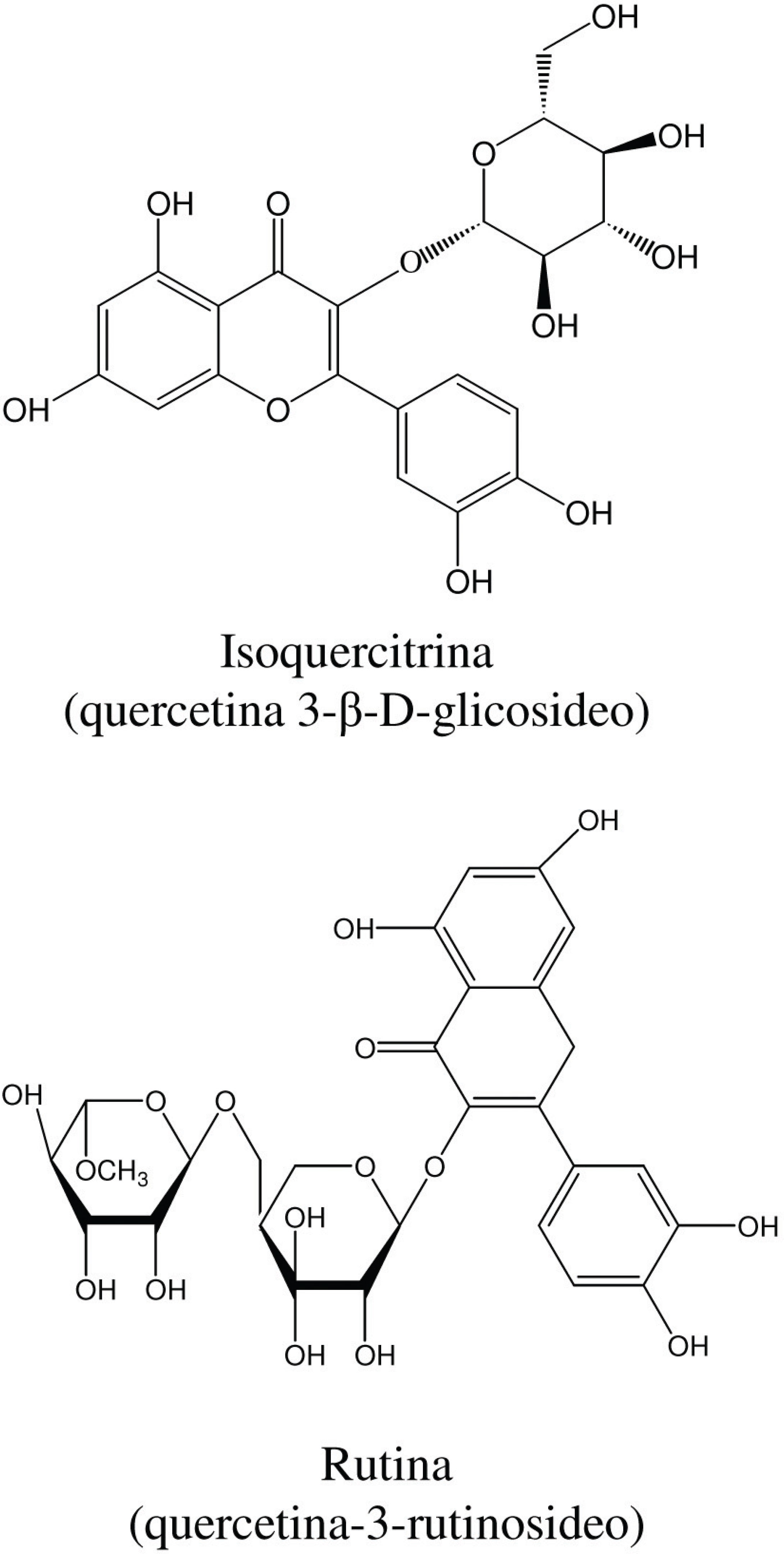
Os taninos condensados, que são formados por unidades de catequina unidas entre si por ligações entre o carbono 3 de uma unidade e o carbono 8 de outra unidade, são apontados como constituintes químicos majoritários em extratos aquosos de M. ilicifolia (FIGURA 3), sendo utilizados como marcadores no controle de qualidade de extratos e medicamentos Rutina (quercetina-3-rutinosideo) fitoterápicos através de diferentes técnicas de avaliação e desenvolvimento tecnológico (Pessuto et al., 2006). Apresentam estrutura complexa e são resistentes à hidrólise, mas podem ser solúveis em solventes orgânicos aquosos, dependendo de sua estrutura. Em razão de suas estruturas químicas, sem a presença de ligações éster e depsídica, as proantocianidinas não são susceptíveis a hidrólise pela tanase (Battestin, 2007).
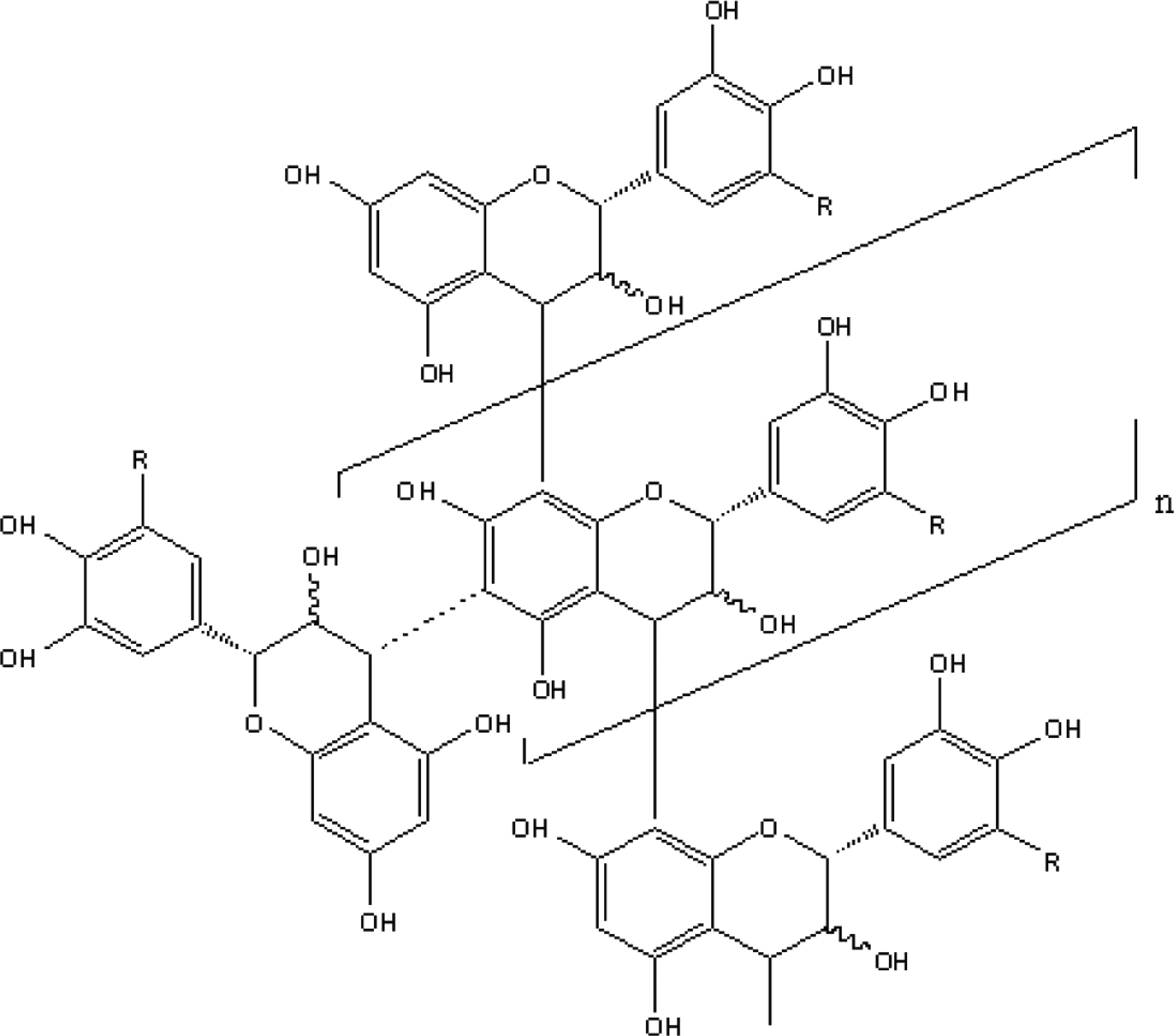
Foram identificados em espinheira santa, os seguintes taninos condensados: epicatequina-(4ß8)-catequina (Procianidina B1) e epicatequina-(4ß8)-epicatequina (Procianidina B2). Alguns taninos condensados (figura 4) (Mandich et al., 1984; Radomski, 2006) apresentaram as atividades antiúlcera gástrica (Carlini e Braz, 1988) e antimutagênica para o teste de AMES (Vargas, Guidobono e Henriques, 1991).
A Agência Nacional de Vigilância Sanitária estabeleceu, em resolução, o registro simplificado de fitoterápicos (ANVISA, 2004, 2010). No Anexo I da RE 89 de 2004, substituída pela Instrução Normativa 5 (ANVISA, 2008), é mencionada a presença da espinheira santa como planta medicinal para a elaboração de fitoterápico. Em complemento, o Ministério da Saúde está implantando a prática da fitoterapia no Sistema Único de Saúde (SUS) em todo o Brasil, padronizando inicialmente o uso do guaco (Mikania glomerata) e da espinheira santa (Maytenus ilicifolia) nas unidades básicas, o que reforça a necessidade de parâmetros adequados para o controle de qualidade de tais produtos (Ministério da Saúde, 2007).
Considerando a importância da prática da fitoterapia no SUS começando com a espinheira santa e relatos da ausência de controle de qualidade em muitas formulações existentes no mercado contendo esta planta (Vilegas, Lanças e Cervi, 1994), é que este trabalho foi proposto e desenvolvido. Nesse contexto, avaliou-se a qualidade de produtos à base de espinheira-santa existentes no mercado paulista, determinando-se alguns parâmetros físico-químicos, em comparação com a droga vegetal autêntica, cuja identidade botânica foi confirmada. As amostras foram avaliadas por espectrometria de massas e análise estatística multivariada com a finalidade de se comprovar sua veracidade através destas duas técnicas analíticas.
Materiais e métodos
Amostras comerciais de fitoterápicos
Foram obtidos produtos contendo Maytenus ilicifolia em diversas formas farmacêuticas, tendo sido adquiridos de farmácias comerciais e de manipulação da cidade de São Paulo e de Campinas. Tais amostras, após preparo, foram direcionadas à espectrometria de massas e análise estatística multivariada. As informações sobre as amostras estão na TABELA 1.
| Amostra | Forma Farmacêutica |
| DVES1 | Droga vegetal autêntica |
| ESC1 | Cápsulas de extrato seco 380mg ESC2 |
| ESC3 | Cápsulas de extrato seco 380mg |
| ESC4 | Cápsulas de extrato seco 40mg |
| ESC5 | Cápsulas de extrato seco 300mg |
| ESC6 | Extrato seco ESC7 |
| ESC8 | Droga vegetal pulverizada fina |
| ESC9 | Droga vegetal pulverizada fina |
| ESC10 | Extrato Fluído Extrato Fluído |
A amostra comercial na forma de droga vegetal inteira foi avaliada quando à sua identidade botânica (Farmacopéia Brasileira, IV, 1998) triturada em liquidificador e armazenada em embalagem de vidro, para a extração de ativos e análise por espectrometria de massas.
Determinação de água em drogas vegetais
No presente trabalho, a determinação de água foi avaliada método da reflectância de infravermelho (Farmacopéia Brasileira, V, 2010). Este método é baseado na espectrometria, onde uma amostra é irradiada com luz em dois comprimentos de ondas diferentes na região do infravermelho. Um comprimento de onda é absorvido pela água, enquanto o outro é usado como referência e é muito pouco absorvido. A porcentagem de umidade é dada no monitor da balança após o tempo de uma hora a 60°C.
O teor de umidade por infravermelho foi verificado em todas as amostras comerciais em triplicata, excetuando-se a ESC9 e ESC10 por se tratarem de extratos fluidos.
Preparo da amostra
Todas as amostras sólidas foram pulverizadas ou trituradas de forma a limitar a dimensão de seus componentes a, no máximo, 3 mm de espessura.
Preparo das soluções-mãe (SM)
Foram empregados 0,750 g do extrato seco, pó e extrato fluído. O material foi transferido para um erlenmeyer com 150 ml de água e deixado em agitação por 30 minutos a 70°C em mesa agitadora. Após este período, resfriou-se em água corrente sendo transferido seu conteúdo para um balão volumétrico de 250 ml, lavando-se e completando- se o volume com água. Tomou-se cerca de 80 ml do extrato e filtrou-se através de papel filtro, sendo desprezados os primeiros 50 ml. O filtrado obtido foi denominado de solução-mãe (SM) (Farmacopéia Brasileira.V, 2010). Foram obtidas soluções-mãe de droga vegetal autêntica (DVES1) e de dez amostras comerciais (ESC1 a ESC10).
Análise das soluções-mãe por espectrometria de massas
As soluções-mãe da droga vegetal, extratos fluidos, extratos secos e cápsulas foram diluídas em uma solução metanólica a 70% (v/v) (metanol grau cromatográfico da Tedia, Fairfield, OH, USA), água deionizada a 30% (v/v) com 0,1% de hidróxido de amônio (Ecibra). Foram analisadas em modo negativo por inserção direta, sob um fluxo de 10 μl/min, no espectrômetro de massas com ionização por eletrospray (ESI-MS), obtendo-se assim o perfil denominado de fingerprint. Os ESI-MS fingerprints em modo negativo foram obtidos em um equipamento de massa de alta resolução Micromass Q-TOF nas seguintes condições: os capilares e cones de voltagem foram selecionados a -3000 V e -40 V, respectivamente, com uma temperatura de de-solvatação de 100oC.
Análise estatística multivariada
Na análise quimiométrica, os dados processados são representados por uma matriz X. No presente estudo, as linhas representam as soluções mãe de todas as formulações comerciais de espinheira santa e da droga vegetal (TABELA 1) e cada coluna (p) representa as variáveis (por exemplo, os íons identificados no fingerprint em espectrometria de massas). As amostras são representadas como pontos no espaço dimensional. Portanto, um dos objetivos desta análise é justamente reduzir o espaço para duas ou três dimensões, que é a limitação humana para identificar, classificar e reconhecer objetos. A matriz T chamada de “scores” representa a posição de uma amostra nesse novo espaço. A matriz V chamada de “loadings” representa uma matriz que descreve o peso de cada variável nesse novo eixo de coordenadas (conhecido como coordenadas principais, PCs). Foi empregada nesta análise multivariada, o software Pirouette, versão 2.6, da Infometrix, Woodinville, WA, EUA.
Resultados e Discussão
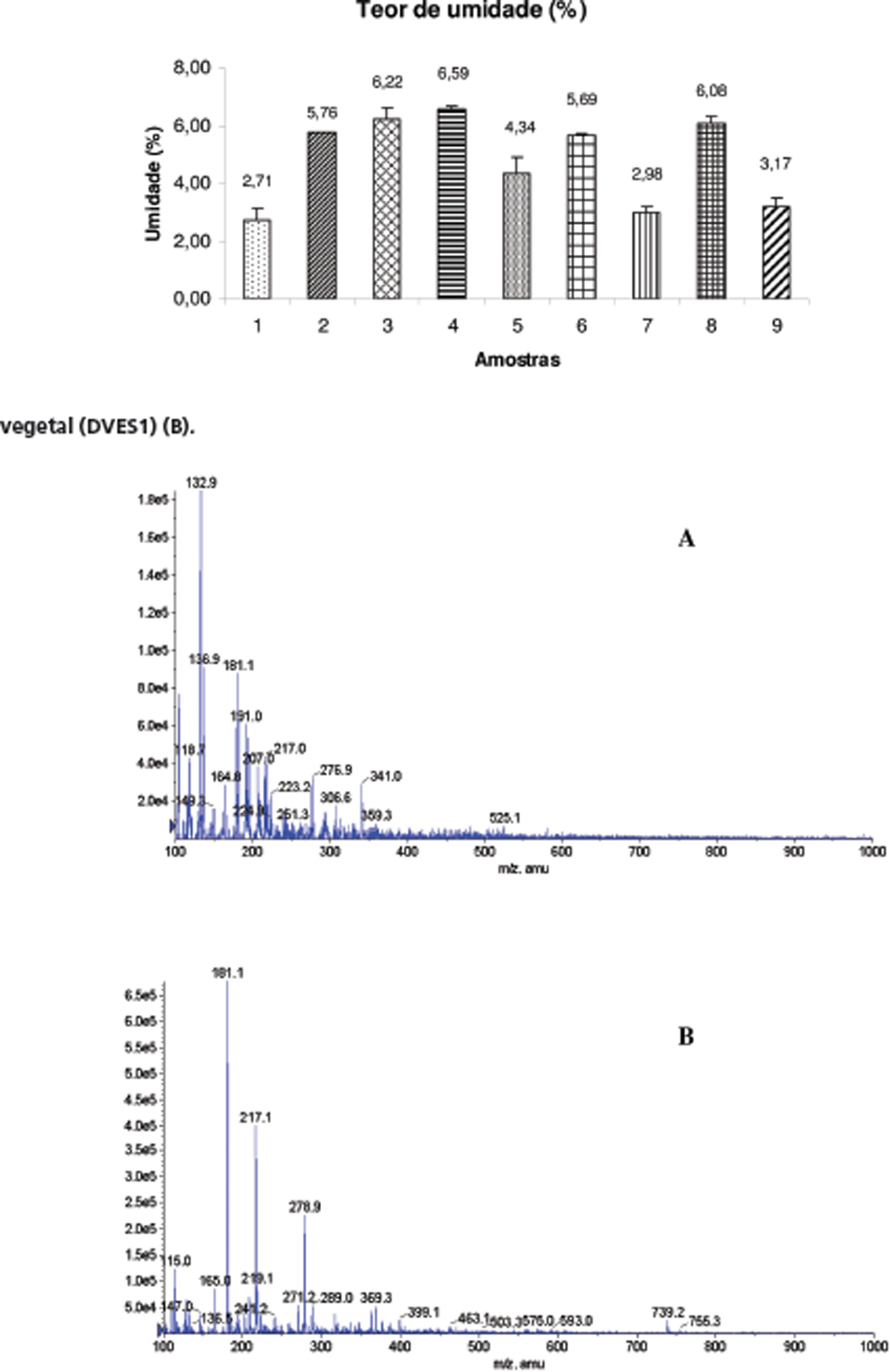
A presença de quantidade excessiva de água em drogas vegetais propicia o desenvolvimento de micro-organismos, insetos e hidrólise de princípios ativos, entre outros e consequente deterioração de constituintes da droga, havendo a necessidade de manutenção de seu conteúdo dentro de limites específicos, em geral, na faixa de 8 a 14% (Farmacopéia Brasileira IV, 1988). Este parâmetro foi avaliado no presente trabalho para se assegurar que todas as formas farmacêuticas sólidas e a droga vegetal estavam de acordo com o parâmetro oficial. A Figura 4 mostra os resultados obtidos do teor de umidade empregando-se a técnica de infravermelho. Observa-se que todas as amostras apresentam valores de umidade dentro dos limites preconizados pela Farmacopéia Brasileira que é de no máximo 12% (Farmacopéia Brasileira, 2010).
O coeficiente de variação dos resultados obtidos na análise de umidade empregando se a técnica de infravermelho variou entre 0,12 e 16,70%. A flutuação grande no coeficiente de variação da técnica de infravermelho pode ser atribuída ao fato das amostras serem de serem diferentes formas farmacêuticas, sendo importante salientar que o maior valor obtido por infravermelho ainda é bem menor do que o obtido na técnica de gravimetria (28,51% - dados não mostrados). No caso da utilização da técnica de infravermelho, uma flutuação grande no coeficiente de variação pode ser atribuída ao fato mencionado anteriormente, havendo a necessidade de se padronizar melhor a técnica. Mas é importante salientar que o maior coeficiente de variação dos valores de umidade obtidos por infravermelho ainda é bem menor do que o calculado para a obtenção do valor de umidade por gravimetria. Conclui-se, portanto que a utilização de balança de infravermelho apresenta menor variação nos dados obtidos, sendo uma técnica com menor probabilidade de erros experimentais.
As amostras comerciais de espinheira santa foram analisadas por fingerprinting em espectrometria de massas em comparação com a autêntica da droga vegetal. A FIGURA 5 mostra o fingerprinting de uma amostra comercial analisada, em comparação com a droga vegetal autêntica.
Figura 4 Teor de umidade (%) da droga vegetal (DVES1) e das amostras comerciais de espinheira
Para todas as amostras foram selecionados os íons com valores de intensidade de massa mensuráveis (103,0; 105,0; 111,3; 115,0; 117,0; 119,0; 130,8; 133,0; 136,9; 139,0; 147,0; 151,0; 157,1; 165,0; 170,9; 175,2; 181,0; 197,0; 191,1; 192,9; 194,8; 197,0; 202,8; 207,1; 208,9; 209,3; 215,2; 217,0; 218,7; 220,9; 233,1; 260,8; 271,0; 276,9; 278,9; 285,0; 289,0; 295,1; 315,0; 317,1; 321,1; 327,0; 341,0; 343,1 e 396,7 M-). Estes dados foram colocados na planilha de cálculos da análise quimiométrica. Os resultados desta análise são mostrados na FIGURA 6.
A FIGURA 6A mostra os scores (amostras de fitoterápicos contendo Maytenus ilicifolia). Os gráficos bidimensionais (FIGURA 6A e B) dividem as amostras em grupos de acordo com as semelhanças nas suas composições (íons marcadores). A FIGURA 6A (scores) apresenta as amostras de fitoterápicos (ESC1 a ESC10) em comparação com a droga vegetal autêntica (DVES 1). A FIGURA 6B mostra santa (ESC1 a ESC8), pelo método de reflectância no infravermelho (identificação das amostras, vide TABELA 1). Onde: 1 (DVES1), 2 (ESC1), 3 (ESC2), 4 (ESC3), 5 (ESC4), 6 (ESC5), 7 (ESC6), 8 (ESC7) e 9 (ESC8).
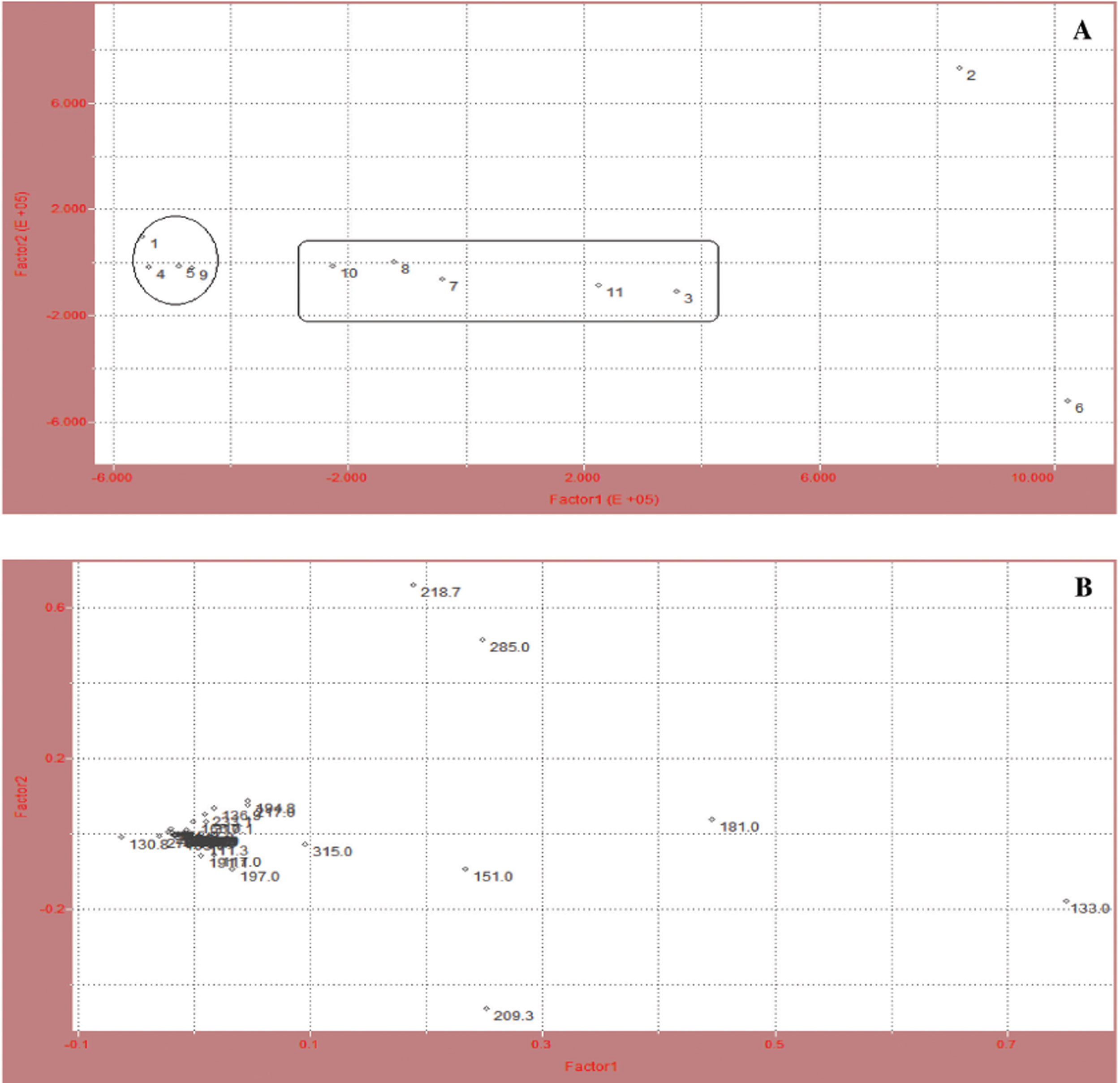
os íons obtidos na fragmentação por espectrometria de massas (loadings) (FIGURA 5). As amostras 4 (ESC3), 5 (ESC4) e 9 (ESC8) são as mais similares, contendo vários íons em comum, e mais próximas da amostra de referência, que é a droga vegetal autêntica, 1 (DVES1). As amostras 2 (ESC1) e 6 (ESC5) são as mais discrepantes, isto é não contém nenhum dos íons presentes na droga vegetal (DVES1). As amostras ESC2, ESC6, ESC7, ESC9 e ESC10 estão numa região intermediária no gráfico apresentando os íons 133,0; 151,0; 181,0; 209,3; 218,7; 285,0 e 315,0 em comum (FIGURA 6). Concluise que as amostras ESC1 e ESC5 podem não ser autênticas. Com certeza as amostras ESC3, ESC4 e ESC8 contêm espinheira-santa, em comparação com a droga vegetal autêntica de Maytenus ilicifolia. Ao se analisar os pesos moleculares dos compostos mostrados nas FIGURAS 1 e 2, observa-se que a catequina e a epicatequina possuem massa exata de 290,08 g/mol. Como os espectros de massa foram obtidos em modo negativo (menos um H+) o valor de massa aproximada a se encontrar para estes compostos seria o de 289. A droga vegetal autêntica (DVES1) e os fitoterápicos ESC2 e ESC10 possuem seguramente a catequina ou a epicatequina, pois no espectro (fingerprint) destas amostras foi observado este íon. Leite e colabiradores (2001) isolaram e caracterizaram o triglicosídeo canferol-3-O-a-L-ramnopiranosil(1ß6)-O-[a-L- ramnopiranosil(1ß2)] O-b-D-galactopiranosideo (mauritianina), outro tri-glicosideo, quercetina-3-O-a-L-ramnopiranosil(1ß6)-O-[a-L-ramnopiranosil(1ß2)]-O-b-D-galactopiranosideo e o di-glicosideocanferol- 3-O-a-L-ramnopiranosil(1ß2)-O-b-D- galactopiranosideo. Outros compostos que os mesmos autores identificaram em Maytenus ilicifolia, foram: o mono-glicosideo trifolina (canferol-3-O-b-D-galactopiranosideo), a hiperina (quercetina-3-O-b-D-galactopiranosideo), o triglicosídeo flavônico mauritianina, e a epi-catequina. O fracionamento de um extrato aquoso liofilizado de folhas de Maytenus ilicifolia levou a obtenção de cinco frações, fornecendo um derivado tetraglicosilado de canferol, além do galactitol (FIGURA 7) (Leite et al., 2010).
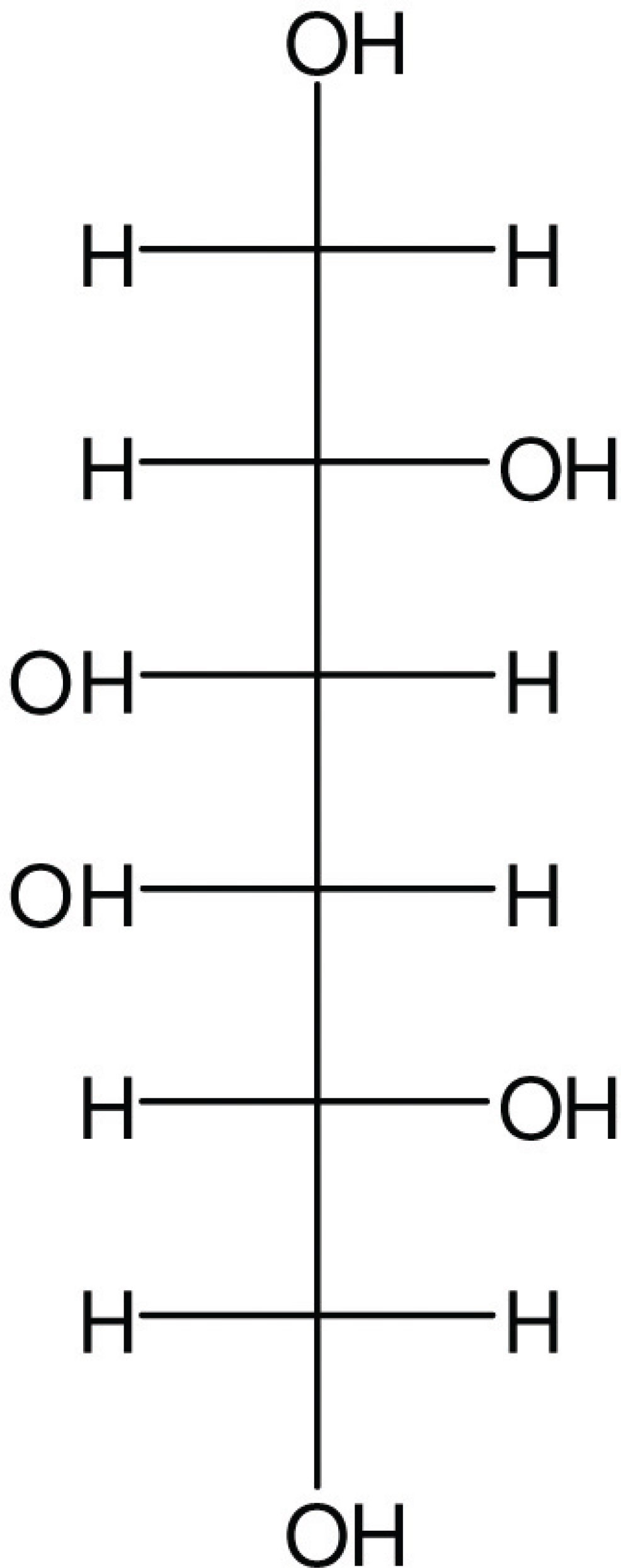
O galactitol é um composto de massa molecular exata de 182,08 g/mol. Como o espectro de massas das amostras foi obtido em modo negativo, era de esperar o aparecimento de um pico de massa ao redor de 181. As amostras da droga vegetal autêntica (DVES1), ESC1, ESC2, ESC4, ESC5, ESC6, ESC9 e ESC10 apresentam o galactitol, pois esta massa aparece no fingerprint destas amostras.
Conclui-se, portanto, que a técnica de espectrometria de massas aliada à análise multivariada, é uma ferramenta importante para a confirmação da autenticidade de drogas vegetais existentes em fitoterápicos.
Referências
Ahmed, M.S.; Fong, H.K.S.; Soejarto D.D.; Dobberstein, R.P.; Waller, R.M-A. 1991 - High-performance liquid chromatographic separation and quantitation of maytansinoids in Maytenus ilicifolia. Journal of Chomatography, v. 213, p. 340-344.
ANVISA, Agência Nacional de Vigilância Sanitária, Resolução RE no. 89 - Lista de Registros Simplificados de Fitoterápicos, de 16 de março de 2004. Disponível em <www.portal.saude.gov.br/portal/arquivos/pdf/RE_89_16_03_2004.pdf.> Acesso em: 27 ago 2010.
ANVISA, Agência Nacional de Vigilância Sanitária, Instrução Normativa no. 5, Lista de Medicamentos Fitoterápicos de Registro Simplificado, de 11 de dezembro de 2008. Disponível em: <http://e-legis.anvisa.gov.br/leisref/public/showAct.php?id=344778&word##.> Acesso em: 27 ago 2010.
ANVISA, Agência Nacional de Vigilância Sanitária, Resolução da Diretoria Colegiada RDC no 10, de 09 de março de 2010. Dispõe sobre a notificação de drogas vegetais junto à Agência Nacional de Vigilância Sanitária (ANVISA) e dá outras providências. Disponível em <www.brasilsus.com.br/legislacoes/rdc/103202-10. html> Acesso em: 27 ago 2010.
Battestin, V. 2007 - Produção, purificação, caracterização e aplicação da tanase de Paecilomyces Variotii. 100p. Tese (Doutorado). Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, Campinas.
Carlini, E.A. e Braz, S. 1998 - Efeito protetor do liofilizado obtido no abafado de Maytenus sp (Espinheira-santa) contra úlcera gástrica experimental em ratos. In: Carlini, E.A. (coord.). 1998 - Estudo de ação antiúlcera gástrica de plantas brasileiras (Maytenus ilicifolia “espinheira-santa” e outras), p. 21 -36. CEME/AFIP, Brasília.
Cipriani, T.R. 2007 - Polissacarídeos de Maytenus ilicifolia (Espinheira-santa) com atividade gastroprotetora. 95p. Tese (Doutorado). Pós-graduação em Bioquímica, Universidade Federal do Paraná, Curitiba.
Cirio, G.M.; Doni Filho, L.; Miguel, M.D.; Miguel, O.G.; Zanin, S.M.W. 2003 - Interrelação de parâmetros agronômicos e físicos de controle de qualidade de Maytenus ilicifolia, mart. ex. reiss (espinheira-santa) como insumo para a indústria farmacêutica. Visão Acadêmica, v.4, p.67-76.
Farmacopéia Brasileira 4a Edição, Parte I, v.2.20,1998. Atheneu Editora, São Paulo.
Farmacopéia Brasileira 5a. Edição, Parte I, v.2.20, 2010. Atheneu Editora, São Paulo.
Itokawa, H.; Shirota, O.; Morita, H.; Takeya, K.; Tomioka, N.; Itai, A. 1990 - New triterpene dimers from Maytenus ilicifolia. Tetrahedron Letters, v.31, p.6881 - 6882.
Leite, J.P.V.; Rastrelli, L.; Romussi, G.; Oliveira, A.B.; Vilegas, J.H.Y.; Vilegas, W.; Pizza, C. 2001 - Isolation and HPLC Quantitative Analysis of Flavonoid Glycosides from Brazilian Beverages (Maytenus ilicifolia and M. aquifolium). Journal of Agriculture and Food Chemistry, v.49, p. 3796- 3801.
Leite, J.P.V.; Braga, F.C.; Romussi, G.; Persoli, R.M.; Tabach, R.; Carlini, E.A.; Oliveira, A.B. 2010 - Constituents from Maytenus ilicifolia leaves and bioguided fractionation for gastroprotective activity. Journal of Brazilian Chemical Society, v.21, p.248-254.
Lopes, G.C.; Blainski, A.; Santos, V.P.; Diciaula, M.C.; Mello, J.C.P. 2010 - Development and validation of an HPLC method for the determination of epicatechin in Maytenus ilicifolia (Schrad.) Planch., Celastraceae. Revista Brasileira de Farmacognosia (Brazilian Journal of Pharmacognosy), v.20, p.789-795.
Mandich, L.; Bittener, M.; Silva, M.; Barros, C. 1984 - Phytochemical screening of medicinal plants studies of flavonoids. Revista Latinoamericana de Química, v.15, p.80 - 82.
Martins, E.R.; Castro, D.M.; Castellani, D.C.; Dias, J.E.E. 1998 - Plantas Medicinais. Editora UFV, Viçosa.
Ministério da Saúde. Portaria GM no 3.237 de 24 de dezembro de 2007. Aprova as normas de execução e de financiamento da assistência farmacêutica na atenção básica em saúde. Diário Oficial da União 27 de dezembro de 2007.
Mossi, A.J.; Cansian, R.L.; Carvalho, A.Z.; Dariva, C.; Oliveira, J.V.; Mazutti, M.; Filho, I.N.; Echeverrigaray, S. 2004 - Extraction and characterization of volatile compounds in Maytenus ilicifolia, using high-pressure CO2. Fitoterapia, v.75, p. 168-178.
Nakamura, M.; Nakasumi, T.; K. CA 127: 70825n. Yoshizawa, T.; Minagawa, Y.; Nakagawa. Pat. Appl. EP 776,667 (Cl. A61K35/78) 4 Jun 1997, JP Appl. 95/336,104, 30 de Novembro de 1996.
Negri, M.L.S. 2007 - Secagem das folhas de espinheira-santa - Maytenus ilicifolia Mart. ex. Reiss. sob diferentes temperaturas e influência nos teores de polifenóis, na atividade antioxidante e nos aspectos microbiológicos. 79p. Dissertação (Mestrado). Departamento de Farmácia, Universidade Federal do Paraná, Curitiba.
Ohsaki, A.; Imai, Y.; Naruse, M.; Ayabe, S.; Komiyama, K. e Takshima, J. 2004 - Four new triterpenoids from Maytenus ilicifolia. Journal of Natural Products, v.67, p.469-471.
Pessuto, M.B. 2006 - Análise fitoquímica de extratos de folhas de Maytenus ilicifolia Mart. ex Reissek e avaliação do potencial antioxidante. 104p. Dissertação (Mestrado). Faculdade de Ciências Farmacêuticas, Universidade Estadual de Maringá, Maringá.
Radomski, M.I. 2006 - Teores foliares de silício, taninos e lignina, em Maytenus ilicifolia Martius ex Reiss (espinheira-santa), em função de variáveis ambientais e genéticas. 116p. Tese (Doutorado). Faculdade de Ciências Agronômicas, UNESP, Botucatu.
Shirota, O.; Morita, H.; Takeya, K. e Itokawa, H. 1997 - Revised structures of cangorosins, triterpene dimers from Maytenus ilicifolia. Journal of Natural Products, v.60, p.111-115.
Simões, C.M.O. (org.). 2003 - Farmacognosia: da planta ao medicamento. 5a edição. p. 222, 296, 263-288. Editora da Universidade UFRGS / Editora da UFSC, Porto Alegre/Florianópolis.
Soares, L.A.L; Oliveira, A.L.; Ortega G.G.; Petrovick, P.R. 2004 - Development and validation of a LC-method for determination of catechin and epicatechin in aqueous extractives from leaves of Maytenus ilicifolia. Journal of Pharmaceutical and Biomedical Analysis, v.36, p.787-790.
Souza, L. M.; Cipriani ,T R.; Iacomini, M.; Gorin, P. A. J.; Sassaki, G. L. 2008 - HPLC/ESI-MS and NMR analysis of flavonoids and tannins in bioactive extract from leaves of Maytenus ilicifolia. Journal of Pharmaceutical and Biomedical Analysis, v.47, p.59-67.
Tiberti, L.A.; Yariwake, J.H.; Ndjoko, K.; Hostettmann, K. 2007 - Identification of flavonols in leaves of Maytenus ilicifolia and M. aquifolium (Celastraceae) by LC/ UV/MS analysis. Journal of Chromatography B, v.846, p.378-384.
Vargas, V.M.F.; Guidobono, R.R. e Henriques, J.A. 1991 - Genotoxicity of plant extracts. Memórias do Instituto Oswaldo Cruz, v.86, p.67 - 70.
Vilegas, J.H.Y.; Lanças, F.M.; Cervi, A.C. 1994 - High resolution gas chromatography analysis of ‘espinheira santa’ (Maytenus ilicifolia and M. aquifolium): analysis of crude drug adulterations. Phytotherapy Research, v.8, p.241 - 244.
Vital, B.V.; Carneiro, A.C.O.; Pimenta, A.S.; Della Lucia, R.M. 2004. Adesivos à base de taninos das cascas das duas espécies de eucalipto para a produção de chapas de flocos. Ver.Árvore, v.28, p.571-582.
Xavier, H.S. e D’angelo, L.C.A. 1996 - Perfil cromatográfico dos componentes polifenólicos de Maytenus ilicifolia Mart. (Celastraceae). Revista Brasileira de Farmacognosia, v.5, p.20-28.
Zhu, N.; Sharapin, N. e Zhang, J. 1998 - Three glucosides from Maytenus ilicifolia. Phytochemistry, v.47, p.265-268.