Artigo de Pesquisa
Bioprospecção de plantas medicinais com potencial anticancerígeno no Brasil: caracterização e métodos de extração
Bioprospecting of medicinal plants with anticancer potential in Brazil: characterization and extraction methods
Resumo
O câncer é um problema de saúde pública mundial e pesquisas têm apontado que o número de novos casos deve atingir 29,4 milhões até 2040. Além disso, o avanço desigual da doença causará maior impacto nos países de baixa e média renda. Nesse contexto, o avanço da doença associado aos efeitos adversos dos tratamentos empregados atualmente revela a urgência de avaliar métodos alternativos para combater o câncer. Com isso, o uso de plantas medicinais é desejável, por apresentarem menores contraindicações, graças ao baixo efeito antiproliferativo em tecidos saudáveis e elevada inibição para diversas linhagens tumorais. Sob a perspectiva brasileira, a bioprospecção de espécies vegetais é promissora, devido à elevada biodiversidade nacional. Com isso, o objetivo do presente trabalho foi de avaliar as vertentes da pesquisa na área de extração de compostos bioativos a partir de fontes vegetais, identificando as espécies, perfil fitoquímico e técnicas de extração mais utilizadas. Pode-se concluir que o uso de solventes orgânicos é massivo, o que prejudica o "scale-up" dos processos e pode inviabilizar o uso efetivo de fitoterápicos de plantas medicinais em escala industrial.
- Palavras-chave:
- Fitoterápicos.
- Atividade antiproliferativa.
- Plantas medicinais.
- Extração supercrítica.
- Bioprospecção.
Abstract
Cancer is a worldwide public health issue, and the research has indicated that the number of new cases will reach 29.4 million by 2040. In addition, the uneven spread of the disease will show greater impact in low- and middle-income countries. In this context, the disease growth associated with the adverse effects of the treatments currently used reveals the urgency of evaluating alternative methods to reach this challenge. Thus, the use of medicinal plants is desirable, since they display fewer contraindications, due to the low antiproliferative effect on healthy tissues and high inhibition for several tumor lines. Under the Brazilian perspective, the bioprospecting of plants is promising, because of the high national biodiversity. Therefore, the aim of the present work was to evaluate research's aspects of bioactive compounds extraction from plant sources, identifying the species, phytochemical profile, and most used extraction techniques. It can be concluded that the use of organic solvents is massive, which impairs the scale-up of the process, and may limit the effective use of phytotherapy's from medicinal plants on an industrial scale.
- Keywords:
- Herbal medicines.
- Antiproliferative activity.
- Medicinal plants.
- Supercritical extraction.
- Bioprospecting.
Introdução
O câncer é, atualmente, um problema de saúde pública mundial. Segundo a Organização Mundial da Saúde (OMS), em 2018 foram constatados 18,1 milhões de novos casos da doença e 9,6 milhões de mortes, em que 1 em cada 6 mortes foram devido à patologia. As projeções mostram que até 2040 serão contabilizados 29,4 milhões de casos por ano, representando um aumento de mais de 60%[1].
Pesquisas revelaram ainda que, em 2019, 90% dos países desenvolvidos possuíam tratamentos adequados para os pacientes oncológicos em seu sistema público de saúde. Em contrapartida, nos países de baixa renda, essa quantidade era de 15%, culminando em elevadas taxas de mortalidade; em comparação com os países ricos, o impacto do avanço do câncer nas próximas duas décadas pode ser até 81% maior nas regiões carentes. Isso se justifica por uma associação de fatores, em especial pelo diagnóstico tardio de carcinomas preveníveis, prognóstico ineficaz e baixa disponibilidade de tratamento e medicamentos[2].
Atualmente, é comum a utilização de terapias antineoplásicas para o tratamento do câncer, com destaque para a quimioterapia, radioterapia, hormonioterapia e cirurgia. Não obstante, nota-se que o emprego dessas técnicas possui uma série de efeitos colaterais decorrentes de sua toxicidade, que afetam não apenas as células doentes, mas também os tecidos saudáveis. Como consequência, tem-se, em alguns casos, complicações no quadro clínico dos pacientes que podem levar à descontinuação do tratamento, devido à elevada agressão sofrida pelo organismo[3,4].
Assim, os efeitos adversos dos tratamentos tradicionais podem ser mitigados pelo uso das plantas medicinais, que possuem menores contraindicações, devido aos efeitos citotóxicos serem mais amenos. Combinado com as vantagens de haver grande disponibilidade de plantas, como é o caso do Brasil, e baixo custo para sua aquisição, a atividade anticancerígena dos constituintes à base de plantas é uma abordagem desejável para o manejo da doença[3,5,6].
As plantas medicinais vêm sendo utilizadas pela humanidade desde a antiguidade, sabendo-se hoje que seus constituintes estão associados à resposta farmacológica e ao potencial medicamentoso de diversas espécies vegetais[7]. O uso de ervas com finalidade terapêutica tem se mostrado promissor, dada a grande variedade de compostos e estruturas químicas associadas à bioatividade das plantas[5,6]. Além disso, os produtos naturais têm tido papel fundamental no desenvolvimento de drogas, visto que no período de 1940 até 2014, 83% das 136 novas substâncias químicas registradas para ação anticancerígena foram obtidas a partir de fontes naturais, direta ou indiretamente. Estima-se ainda que 49% das moléculas aprovadas no mesmo período tenham sido originadas dos produtos naturais e seus derivados[8].
Sob a perspectiva brasileira, o país apresenta condições favoráveis para progredir no tema, tanto pela elevada biodiversidade nacional, quanto pelo conhecimento herdado dos povos indígenas sobre o manejo das plantas medicinais, sendo o uso sustentável dos recursos naturais fomentado pelo Programa Nacional de Plantas Medicinais e Fitoterápicos [9]. Apesar disso, pode-se dizer que a fração de espécies disponíveis nos biomas brasileiros que já foram estudadas do ponto de vista etnofarmacológico permanece insignificante [10].
Os extratos obtidos das matrizes vegetais têm ação anticancerígena em diversas linhagens tumorais. De acordo com a literatura, compostos como polifenóis, alcaloides e terpenos são amplamente utilizados por terem ação antiproliferativa e desempenharem efeitos quimiopreventivos[11].
Diversas técnicas podem ser utilizadas para a obtenção de metabólitos secundários dos extratos de plantas medicinais, sendo por diversas vezes separados em métodos convencionais e alternativos. No primeiro grupo estão inclusas as técnicas tradicionais, como maceração, decocção, Soxhlet, infusão e hidrodestilação. Já o segundo grupo abrange as técnicas mais sofisticadas e modernas, podendo-se citar como exemplos a extração supercrítica, extração em contracorrente, extração assistida por ultrassom, enzimas ou micro-ondas[12].
Apesar das técnicas convencionais continuarem sendo amplamente utilizadas, elas apresentam algumas desvantagens claras, como a dificuldade de recuperação do solvente, a necessidade de etapas de purificação e as elevadas temperaturas do processo, que podem levar à degradação térmica dos componentes de interesse [13]. Quanto ao emprego dos métodos não-convencionais, pode-se mencionar como principais vantagens o menor consumo de solventes orgânicos, maior seletividade, menor produção de resíduos, menor tempo de extração, abordagem menos poluente ao ambiente, menores temperaturas envolvidas no processo e maior pureza. Contudo, o maior desafio para a utilização dessas técnicas está relacionado à limitada aplicação desses processos em larga escala, pelos elevados custos com equipamentos, de forma que seu uso fica restrito à obtenção de produtos com alto valor agregado[12].
Dentre as técnicas alternativas, a extração supercrítica apresenta características muito vantajosas para a obtenção de extratos naturais. A técnica permite a obtenção de extratos livres de solventes e a variação das condições operacionais do processo (pressão e temperatura) modificam a densidade do fluido, conferindo alta seletividade ao método. Dentre os fluidos supercríticos utilizados, o principal é o dióxido de carbono (CO2), devido ao fato do mesmo ser inerte, atóxico, de baixo custo, apresentar alta disponibilidade e propriedades críticas relativamente baixas (304 K e 7,38 MPa)[13].
Diante do potencial das plantas medicinais e da crescente necessidade de viabilizar tratamentos confiáveis para o câncer, o principal objetivo deste trabalho foi avaliar quais são as vertentes inovadoras de pesquisa na área de extração dos compostos bioativos com ação anticancerígena a partir de matéria prima vegetal, identificando as espécies estudadas, a composição química, os métodos de extração utilizados e a resposta biológica, priorizando trabalhos nacionais.
Metodologia
A metodologia empregada neste trabalho consistiu em uma revisão bibliográfica realizada nas bases científicas Science Direct e PubMed. No Science Direct foram considerados apenas artigos que se enquadrassem nos tipos "Review articles" e "Research articles", enquanto no PubMed não foi utilizado nenhum filtro quanto ao tipo de trabalho. Em ambos os casos, considerou-se o período de 2015 a 2021. A TABELA 1 sumariza os indexadores utilizados na busca e o total de trabalhos encontrados aplicando os filtros mencionados.
| Indexadores | Science Direct | PubMed | Total |
| 'cancer' AND 'Brazil' AND 'plants' AND 'anticancer' AND 'antitumoral' AND 'bioactive' | 77 | 10 | 87 |
| 'bioactive compounds' AND 'extraction' AND 'Brazilian' AND 'cancer' AND 'antiproliferative' AND 'activity' | 299 | 7 | 306 |
| Total | 376 | 17 | 393 |
Assim, foram adotados critérios visando abordar os pontos mais relevantes sobre o potencial anticancerígeno das plantas medicinais, fornecendo dados acerca do perfil fitoquímico, metodologia empregada no processo de extração e realização de ensaios para verificar a atividade biológica dos extratos. Ademais, a escolha de trabalhos brasileiros tem por objetivo ratificar a importância de estudos etnofarmacológicos em âmbito nacional, dadas as condições favoráveis para o desenvolvimento de pesquisas no ramo e à necessidade de maior inserção da medicina alternativa para o combate de doenças como o câncer no Brasil.
Em seguida, o potencial anticancerígeno de diferentes espécies de plantas é discutido, conforme apresentado na TABELA 2. Os extratos dessas matrizes vegetais foram obtidos a partir de diferentes técnicas de extração e avaliados em diferentes linhagens tumorais, visando mostrar a versatilidade de aplicação de plantas medicinais no tratamento do câncer.
Conforme será visto adiante, os trabalhos selecionados empregaram as técnicas da maceração, Soxhlet, hidrodestilação, extração assistida por ultrassom e extração supercrítica. As FIGURAS 2 a 6 exibem representações esquemáticas simplificadas dos métodos utilizados pelos autores, a fim de facilitar a compreensão do procedimento experimental.
A técnica de maceração consiste em utilizar folhas, que podem ser frescas ou secas, cominuídas. O material vegetal é então macerado junto ao solvente e, em seguida, a amostra é filtrada e concentrada em rotaevaporador para obtenção do extrato.
A hidrodestilação com aparelho tipo Clevenger está representada na FIGURA 1. O método consiste em inserir uma mistura de material vegetal com água destilada em um balão localizado sobre uma manta de aquecimento. O aquecimento do conjunto provoca o arraste do vapor de água e do óleo essencial extraído da planta. O vapor é então condensado e, ao final do processo, uma camada de óleo (hidrolato), cuja densidade é inferior à da água, forma-se sobre a água, de modo que o óleo essencial pode então ser separado da água.
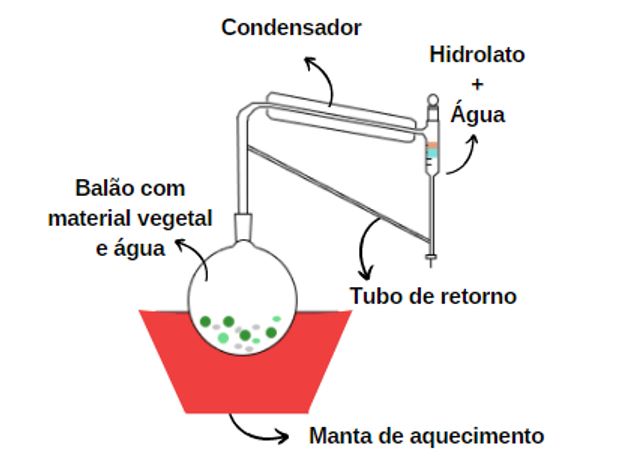
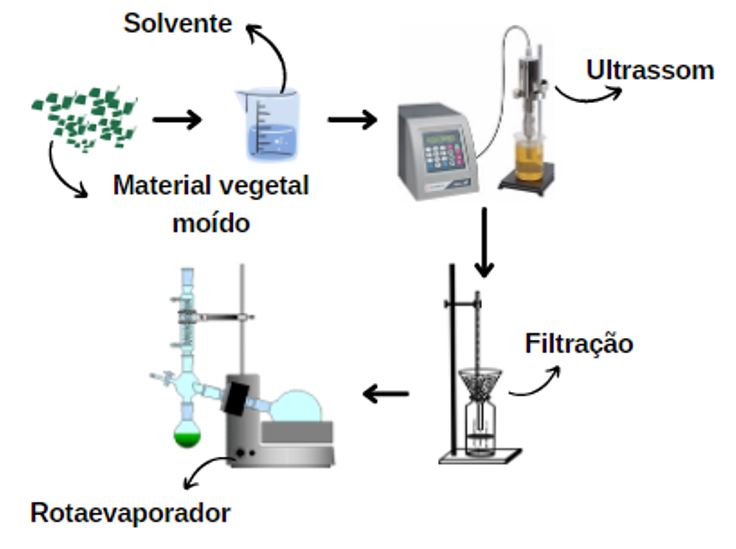
A técnica de extração assistida por ultrassom, FIGURA 2, consiste em empregar o material vegetal seco e moído em um processador ultrassônico (ultrassom) em que, a propagação de ondas ultrassônicas causa intenso colapso de bolhas nos vasos da planta (cavitação), ocasionando a ruptura de tecidos e promovendo a liberação dos metabólitos no solvente. O material é então filtrado e concentrado em rotaevaporador.
| Espécie | Família | Parte da planta | Método de Extração | Perfil fitoquímico | Linhagens celulares | Ref. |
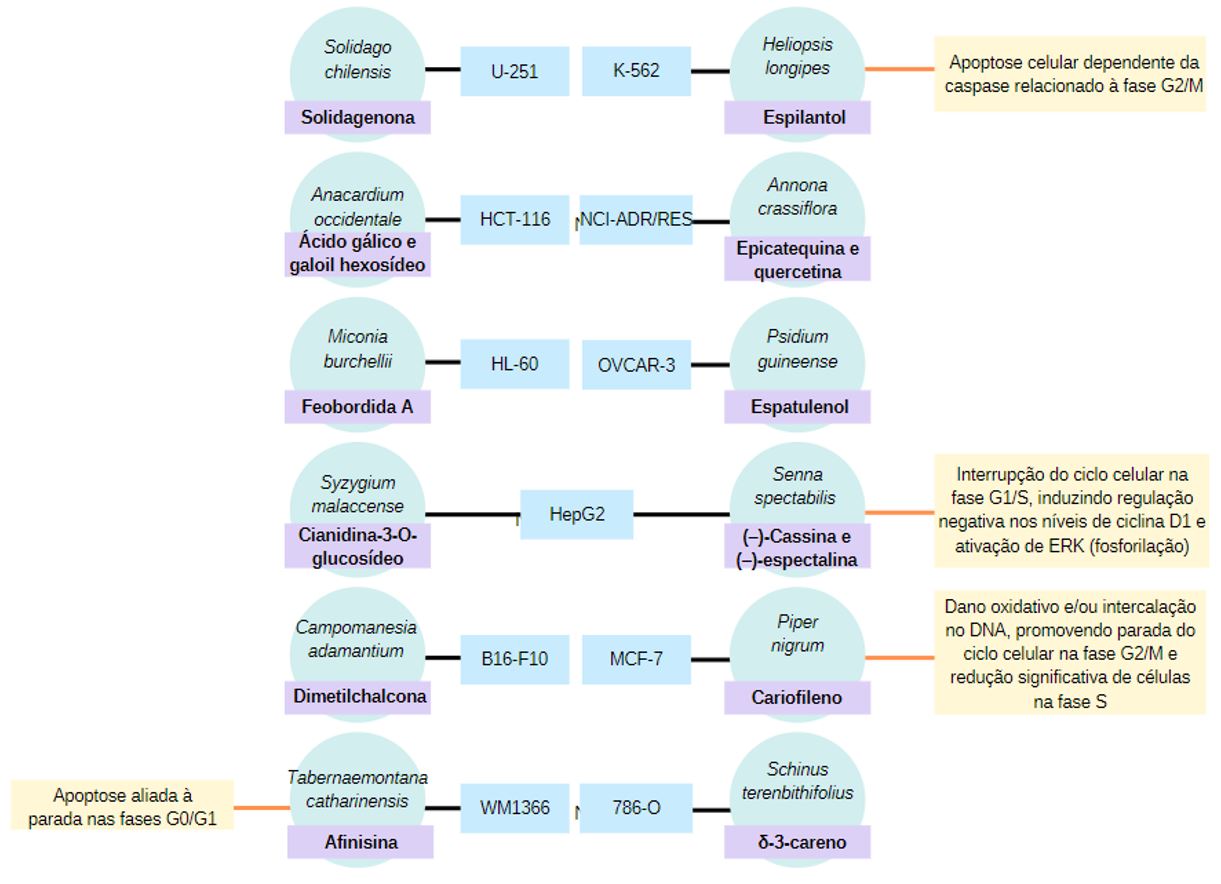
| Solidago chilensis Meyen | Asteraceae | Partes aéreas | Maceração | Solidagenona e quercitrina | U-251, MCF-7, 786-, NCI-H460 e PC-3 | [14] |
| Anacardium occidentale L. | Anacardiaceae | Folhas | Maceração | Ácido gálico, galoil hexosídeo | HL-60, NCI-H292, HCT-116, P815 e L929 | [15] |
| Casca | ||||||
| Miconia burchellii Triana | Melastomataceae | Folhas | Maceração | Feoforbida A, caempferol, caempferol-3-O-β-glucopiranosídeo, ácido oleanólico, ácido ursólico, lupeol e b-sitosterol | HCT-116 e L929 | [16] |
| Syzygium malaccense | Myrtaceae | Frutas | Maceração | Cianidina-3-O-glucosídeo, cianidina-3,5-O-diglucosídeo e peonidina-3-O-glucosídeo | HepG2 | [17] |
| Campomanesia adamantium (Cambess.) O. Berg | Myrtaceae | Frutas | Maceração | Demetoximateucinol, aurenciatina A, dimetilchalcona A, champanona A e champanona D | B16-F10, MCF-7, PC-3, 786-O, HepG2 e NIH/3T3 | [18] |
| Tabernaemontana catharinensis A. DC. | Apocynaceae | Caules | Extração assistida por ultrassom | Afinisina | WM1366, SK-MEL-28, A375 e CCD-1059Sk | [19] |
| Heliopsis longipes S.F. Blake | Asteraceae | Raízes | Soxhlet | Espilantol | HaCaT, HeLa e MCF-7 | [20] |
| Annona crassiflora Mart. | Annonaceae | Casca | Extração assistida por ultrassom | Epicatequina e catequina | U-251, MCF-7, NCI-ADR/RES, NCI-H460, PC-3, OVCAR-3, HT-29, K-562 e HaCaT | [21] |
| Sementes | Quercetina, epicatequina, ácido clorogênico e ácido cafeico | |||||
| Psidium guineense Sw. | Myrtaceae | Folhas | Hidrodestilação | Espatulenol | U-251, MCF-7, NCI-ADR/RES, 786-O, NCI-H460, PC-3, OVCAR-3, HT-29, K-562 e HaCaT | [22] |
| Senna spectabilis (sin. Cassia excelsa var. Acutifolia, Cassia carnaval, Cassia spectabilis) | Fabaceae | Flores | Maceração | (‒)-Cassina e (‒)-espectalina | A549, MCF-7, Hs578T, HepG2, U138MG, U-251MG e CCD-1059Sk | [23] |
| Piper nigrum L. | Piperaceae | Frutas | Maceração | Cariofileno e α-copaeno | MCF-7 | [24] |
| Extração supercrítica | Cariofileno e piperina | |||||
| Schinus terenbithifolius Raddi | Anacardiaceae | Frutas | Extração supercrítica | δ-3-careno, α-felandreno, limoneno, germacreno D e cariofileno | NCI-ADR/RES, HT-29, MCF-7, OVCAR-3, PC-3, 786-O, NCI-H460, U-251, K-562 e HaCaT | [25] |
| Linhagens celulares: Glioblastoma (U-251, U138MG, U-251MG), mama (MCF-7, Hs578T), rim (786-O), pulmão (NCI-H460, NCI-H292, A549), próstata (PC-3), leucemia (HL-60, K-562), cólon (HCT-116, HT-29), mastocitoma (P815), fibroblastos saudáveis (L929, NIH/3T3), fígado (HepG2), melanoma (B16-F10, WM1366, SK-MEL-28, A375), epitelial saudável (CCD-1059Sk), queratinócitos normais (HaCaT), cervical (HeLa), ovário (OVCAR-3) e ovário com resistência a drogas (NCI-ADR/RES). | ||||||
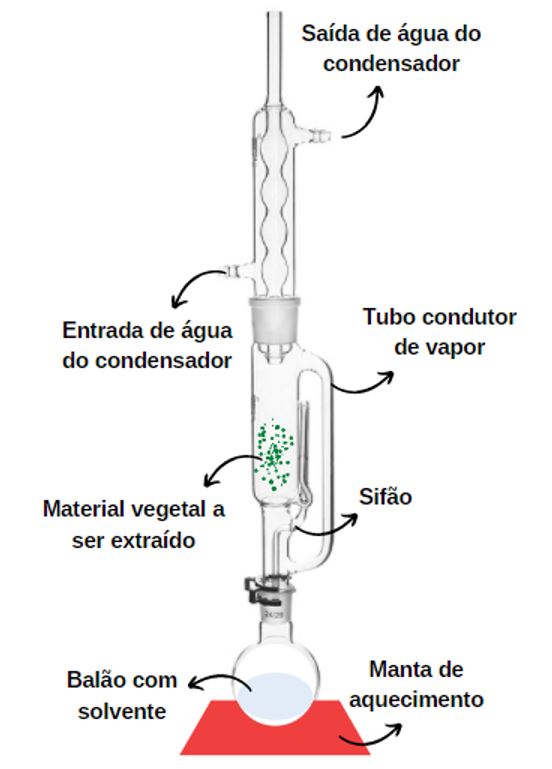
A extração por Soxhlet representada na FIGURA 3 é uma extração que ocorre sob refluxo. O material a ser extraído é inserido no cartucho e o solvente é inserido no balão. O conjunto é aquecido pela ação da manta de aquecimento e segue um fluxo ascendente no equipamento. Ao ser resfriado na região do condensador, o solvente goteja sobre o material promovendo sua extração. O processo ocorre em ciclos devido à ação do sifão e o material obtido é então concentrado em um rotaevaporador para remoção do solvente.
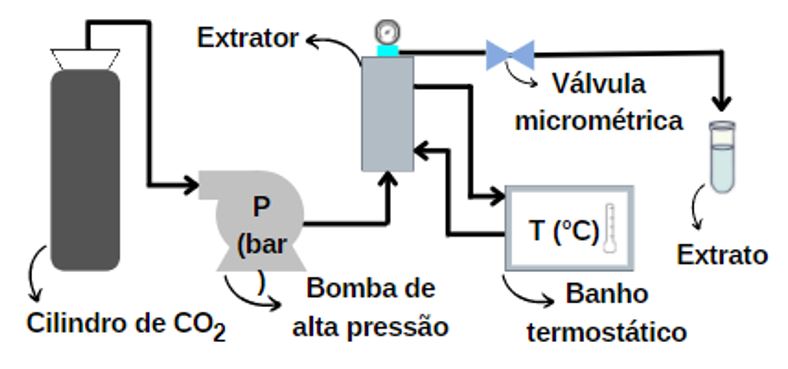
A extração supercrítica é representada de maneira simplificada na FIGURA 4. O dióxido de carbono (solvente) é pressurizado pela ação de uma bomba de alta pressão, equipamento que permite manter constante a pressão desejada para o experimento. O extrator, que é alimentado com a matriz vegetal a ser extraída, é conectado à linha pressurizada de CO2 e ao banho termostático, que mantém a temperatura desejada. O extrato é coletado pela abertura de uma válvula micrométrica para obtenção do produto puro.
Resultados e Discussão
O potencial antiproliferativo da quercitrina (flavonoide) e solidagenona (diterpeno) extraídos a partir de Solidago chilensins Meyen foi investigado por Gomes et al. No estudo, foram utilizadas as seguintes linhagens celulares: gliobastoma (U-251), mama (MCF-7), rim (786-O), pulmão (NCI-H460) e próstata (PC-3)[14].
As partes aéreas da planta foram secas a 25°C, moídas em moinho de facas e, em seguida, peneiradas para selecionar as partículas de 425 μm (Mesh/Tyler 35). Posteriormente, 10 g do material moído e desidratado foram extraídos por maceração utilizando diclorometano (DES) e etanol (HES) durante cinco dias. O material foi filtrado e os solventes foram eliminados à pressão reduzida utilizando rotaevaporador, produzindo dois extratos[14].
A técnica de cromatografia líquida de alta performance (HPLC) foi empregada para caracterizar os extratos. Observou-se que HES apresentou quercitrina como componente majoritário, enquanto a solidagenona foi o principal constituinte de DES. Os compostos foram então isolados de seus respectivos extratos e submetidos ao ensaio in vitro, a fim de avaliar sua performance contra diferentes linhagens tumorais. Doxorrubicina (DOX) foi usada como controle positivo nas concentrações de 0,0025, 0,25, 2,5 e 25 μg.mL-1[14].
Os autores observaram que, para concentrações na faixa de 0,25 a 250 μg.mL-1 durante um tempo de exposição de 48 h, entre os extratos de alta e baixa polaridade (HES e DES), DES apresentou os melhores resultados para as concentrações de 25 e 250 μg.mL-1, sendo que, devido à baixa diferença de inibição das células tumorais nas duas concentrações, pode-se afirmar que a 25 μg.mL-1 foi a melhor condição estudada. A solidagenona apresentou uma elevada ação antiproliferativa para todas as linhagens tumorais estudadas e o melhor resultado foi obtido para U-251 em DES (33,24 μg.mL-1). Já quanto ao flavonoide isolado, quercitrina, observou-se que não houve inibição significativa no crescimento de nenhuma das células tumorais analisadas. Os resultados encontrados, portanto, permitiram mostrar o elevado potencial da solidagenona extraída de S. chilensins, sendo um resultado promissor para a continuação de estudos in vivo, a fim de coletar maiores informações acerca do potencial anticancerígeno da espécie[14].
O potencial antitumoral da Anacardium occidentale L., espécie nativa da América do Sul e largamente utilizada devido às suas propriedades medicinais, foi estudada por Costa et al.[15]. Os pesquisadores produziram dois extratos, a partir das folhas (150 g) e das cascas da planta (120 g). O material foi lavado, seco, moído e macerado com 1500 mL de etanol 96% durante 72 h. Em seguida, as amostras foram filtradas e o solvente eliminado pela ação de um rotaevaporador em condição de pressão reduzida.
Por meio de espectrometria de massa de alta resolução, os autores caracterizaram as amostras LEAo (extrato das folhas) e BEAo (extrato obtido da casca) e, para o primeiro extrato, foram identificados 11 compostos e seis para o segundo, sendo que desses, dois não possuíam identificação na literatura. As amostras LEAo e BEAo apresentaram dois compostos em comum, o ácido gálico e o galoil hexosídeo, ambos tendo como precursor a quercetina. Isso mostra que, nos extratos obtidos a partir da A. occidentale, há predominância de flavonoides, compostos amplamente associados à atividade anticancerígena[15].
Para verificar o efeito anticancerígeno dos extratos, foram empregues cinco linhagens celulares, leucemia (HL-60), pulmão (NCI-H292), câncer de cólon (HCT-116), mastocitoma (P815) e fibroblastos (L929). A curcumina foi utilizada como padrão para as análises in vitro. O estudo foi feito com os extratos que apresentaram atividade para inibição do crescimento celular maior que 75%, determinando-se posteriormente o IC50, índice que mostra a concentração capaz de inibir 50% do crescimento celular[15].
Os autores observaram que os extratos de A. occidentale apresentaram ação anticancerígena promissora contra as quatro linhagens tumorais após 72 h de exposição. Sabendo-se que para IC50 < 30 μg.mL-1 o resultado é considerado promissor, pode-se dizer que, quanto menor for o IC50, melhor o resultado, dado que o extrato, mesmo em baixa concentração, é capaz de inibir o crescimento das células tumorais. Dessa forma, notou-se que o melhor efeito foi observado para o câncer de cólon (HCT-116) no extrato da casca, BEAo, cujo IC50 foi o menor observado (9,44 μg.mL-1). Já para as células normais (L929), o extrato apresentou uma baixa citotoxicidade em todos os casos analisados, uma vez que os IC50 foram superiores a 50 μg.mL-1[15].
Com os resultados encontrados por Costa et al.[15], pode-se afirmar que o extrato da planta foi capaz de inibir o crescimento de diferentes linhagens tumorais e, além disso, o efeito citotóxico foi seletivo às células cancerígenas, preservando as células saudáveis. Contudo, apesar dos resultados positivos obtidos pelos pesquisadores, torna-se necessário ainda avaliar os mecanismos de ação associados às propriedades farmacológicas dos extratos.
O perfil fitoquímico e a atividade dos extratos das folhas de Miconia burchellii Triana foram avaliados por Cunha et al.[16]. O ensaio in vitro por MTT avaliou cinco linhagens tumorais e uma célula saudável após 72 h de exposição aos extratos. Astrocitoma (SNB-19), cólon (HCT-116), próstata (PC3), leucemia (HL-60) e mama (MCF-7) foram as linhagens tumorais empregadas no ensaio, enquanto fibroblastos (L929) representaram as células normais.
As folhas de M. burchellii Triana foram secas durante 24 h em estufa a 45°C e moídas em moinho de facas. Em seguida, 2250 g do material foram extraídos por maceração, utilizando hexano (MBLE-H), acetato de etila (MBLE-A) e metanol (MBLE-M), para obtenção de três frações de extratos. Os autores obtiveram respectivamente, 7,1 g de MBLE-H, 22,8 g de MBLE-A e 99,6 g de MBLE-M[16].
A caracterização dos extratos foi feita por cromatografia, resultando na identificação de oito compostos: feoforbida A, caempferol, caempferol-3-O-β-glucopiranosídeo, ácido oleanólico, ácido ursólico, lupeol e b-sitosterol. Os compostos isolados foram caracterizados por meio de ressonância magnética nuclear 1D e 2D (NMR) e a feoforbida A, isolada por cromatografia a partir da fração MBLE-A, foi submetida ao ensaio in vitro a fim de avaliar o efeito citotóxico do extrato nas células do estudo[16].
No estudo do percentual de inibição do crescimento celular foi utilizada uma concentração única de 100 μg.mL-1 para o extrato cru (MBLE) e suas frações (MBLE-H, MBLE-A e MBLE-M), enquanto uma dose de 10 μg.mL-1 foi empregada para o composto puro (feoforbida A). Dos extratos avaliados, a fração MBLE-A resultou em inibição superior a 75% para todas as linhagens, exceto de câncer de próstata (PC3), com inibições variando de 79,38 a 93,11%; contudo, a fração também inibiu o crescimento de células saudáveis em 93,45%. A fração de hexano apresentou elevada toxicidade contra a linhagem HL-60 (leucemia) e baixa citotoxicidade contra as células saudáveis (L929) com inibições de, respectivamente, 90,33 e 42,34%. Tanto o extrato metanólico quanto o extrato cru apresentaram baixas citotoxicidades para cinco das seis linhagens celulares estudadas, sendo que o efeito moderado foi observado apenas contra a leucemia, com uma inibição de 68,93 e 69,87%. Por fim, o composto puro, feoforbida A, apresentou baixa citotoxicidade contra as linhagens SNB-19, HCT-116, PC3 e MCF-7, sendo a maior inibição para as células de câncer de mama com percentual de 42,01%. O composto teve efeito de citotoxicidade elevada para HL-60 (leucemia), entretanto, a feoforbida A também se mostrou citotóxica contra as células saudáveis (L929), com inibição de 75,06%[16].
Devido ao resultado promissor encontrado por Cunha et al.[16] para o extrato MBLE-A, obtido com acetato de etila, a amostra foi submetida a um ensaio para determinação do IC50, utilizando ainda doxorrubicina como controle positivo. Ademais, foi avaliado também o comportamento do componente puro (feoforbida A) no ensaio. Além do IC50, os autores avaliaram o SI, um índice de seletividade dado pela razão entre a célula saudável (nesse caso, L929) e a linhagem tumoral avaliada. Observou-se que a fração MBLE-A apresentou maior potencial de inibição contra a linhagem SNB-19, cujo IC50 foi de 37,72 μg.mL-1. A feoforbida A também mostrou potencial de inibição contra as linhagens estudadas, contudo, nenhuma das amostras mostrou seletividade entre as células normais de fibroblastos e as células tumorais, necessitando de mais estudos sobre a espécie para garantir a segurança do extrato em aplicações medicinais.
A espécie Syzygium malaccense foi investigada por Vuolo et al.,[17] utilizando as cascas da planta que, apesar de haver indícios indicando a riqueza de compostos bioativos nessa região, sua atividade ainda não foi investigada em linhagens tumorais, sendo o alvo deste estudo. As frutas de jambo vermelho foram manualmente descascadas, sendo posteriormente liofilizadas, trituradas, homogeneizadas e congeladas a -18°C para estocagem. A técnica de maceração com etanol foi utilizada pelos autores, em que 25 g de material foram extraídos com 100 mL de solvente (99,5%) em temperatura ambiente. O etanol foi evaporado e suspendido em água ultrapura. A amostra foi liofilizada até utilização nos ensaios colorimétricos e de cromatografia. O rendimento obtido no processo foi de 44,82%.
Dos compostos químicos identificados no extrato, cianidina-3-O-glucosídeo, cianidina-3,5-O-diglucosídeo e peonidina-3-O-glucosídeo foram os constituintes majoritários caracterizados. Com relação aos compostos fenólicos, observou-se a presença de ácido gálico, ácido clorogênico e (‒)-epigalocatequina, que foram encontrados pela primeira vez no extrato de casca de S. malaccense[17].
O extrato etanólico foi testado quanto à inibição da proliferação celular de hepatoma (HepG2). As células tumorais foram tratadas com extratos em diferentes concentrações, variando de 1 a 50 mg.mL-1 após 72 h de exposição. O melhor efeito proliferativo foi observado com resultado de EC50 igual a 40,92 mg.mL-1 na máxima concentração estudada. Os autores não conseguiram estabelecer uma correlação significativa entre o efeito anticancerígeno contra as células HepG2 e os compostos bioativos encontrados no extrato. Portanto, os efeitos anticancerígenos podem ocorrer devido à presença de um constituinte em especial ou por causa do efeito sinérgico entre os constituintes presentes no extrato vegetal. Por fim, os autores conseguiram mostrar pela primeira vez o efeito de inibição do extrato de casca de jambo vermelho contra HepG2, indicando seu potencial terapêutico[17].
Devido à falta de informações sobre os efeitos da gabiroba na proliferação de células cancerígenas, Silva et al.[18] estudaram a espécie nativa do Cerrado brasileiro, Campomanesia adamantium (Cambess.) O. Berg. Os frutos da planta foram separados em duas partes, casca (DEGPE) e polpa com sementes (DEGPU) e, as duas partes foram secas em estufa de convecção a 37°C até completa desidratação, durante cerca de 48 h. Em seguida, os materiais foram extraídos exaustivamente por maceração durante 15 dias em temperatura ambiente, empregando diclorometano como solvente, com renovação a cada cinco dias. Finalizado o processo, os extratos foram filtrados e concentrados em evaporador rotativo para eliminação do solvente, sendo estocados em freezer a -20°C.
Os extratos da casca e polpa, respectivamente, DEGPE e DEGPU, foram caracterizados por cromatografia líquida ultrarrápida e, ao todo, 30 compostos foram encontrados, mas apenas 13 foram identificados, apresentando os mesmos constituintes para os dois extratos. Desses, sete compostos foram isolados, a saber: 7-hidroxi-5-metoxi-6-C-metilflavanona, 5,7-dihidroxi-6-C-metilflavanona, 5,7-dihidroxi-6,8-C-metilflavanona (demetoximateucinol), 4',6'-dihidroxi-3'-metil-2'-metoxi chalcona (aurenciatina A), 4',6'-dihidroxi-3',5'-dimetil-2'-metoxi chalcona (dimetilchalcona), champanona C e champanona D[18].
Ensaios de viabilidade celular foram realizados contra diversas linhagens celulares B16-F10 (melanoma murino), MCF-7 (mama), PC-3 (próstata), 786-O (rim), HepG2 (fígado) e NIH/3T3 (fibroblastos). Os resultados mostraram que os efeitos antiproliferativos e a seletividade de DEGPU foram maiores que os de DEGPE, com destaque para a inibição no crescimento celular de B16-F10, PC-3 e HepG2. Dentre os compostos isolados utilizados no ensaio in vitro, os compostos demetoximateucinol, aurentiacina A, champanona C, dimetilchalcona e champanona D apresentaram atividade contra B16-F10, sendo que a dimetilchalcona (DMC) revelou o melhor resultado, com IG50 de 7,11 μg.mL-1 e seletividade maior que dois[18].
Foram investigados ainda os efeitos do extrato DEGPU e do composto DMC isolado na indução de apoptose baseados nas alterações de morfologia e ativação de caspase-3 nas células de melanoma. Os autores puderam observar que as células B16-F10 tratadas com diferentes concentrações de DEGPU, DMC e doxorrubicina (controle negativo) foram induzidas à apoptose. Isso se deu por modificações na membrana e formação de corpos apoptóticos. A maior indução foi verificada para o extrato da polpa (DEGPU) na concentração de 25 μg.mL-1 para os tempos de exposição de 24 e 48 h. O tratamento a 250 μg.mL-1 foi letal para as células estudadas em ambos os períodos. Já o DMC induziu apoptose de 54% das células com exposição de 24 h e 84% a 48 h na concentração de 20 μg.mL-1. As análises da caspase-3 mostraram que 25 μg.mL-1 de DEGPU foram capazes de ativar cerca de 30% das caspase-3, quando comparado ao controle negativo, enquanto DMC (20 μg.mL-1) não foi capaz de ativá-la[18].
Os resultados obtidos por Silva et al.[18] foram promitentes e indicaram, de forma preliminar, que o extrato DEGPU obtido de Campomanesia adamantium é uma possível fonte de compostos bioativos com ação anticancerígena. Em adição, a dimetilchalcona isolada pode ser considerada como um agente anticâncer para as células de melanoma (B16-F10).
O melanoma, tumor originado nos melanócitos, é um câncer agressivo que acomete a pele. Tradicionalmente compostos como temozolomida, cisplatina e dacarbazina são os agentes quimioterápicos empregados no tratamento da doença, contudo, devido aos efeitos adversos causados pelas medicações, os autores[19] optaram por avaliar os efeitos do biocomponente afinisina, isolado da Tabernaemontana catharinensis A. DC. na proliferação celular e na apoptose de diferentes linhagens de melanoma (WM1366, SK-MEL-28 e A375), sendo também avaliado em uma linhagem de pele não-tumoral (CCD-1059Sk).
Conforme procedimento experimental descrito por Rosales et al.[19], do mesmo grupo de pesquisa, as inflorescências foram removidas dos caules que, em seguida, foram secos em estufa com circulação de ar forçada a 30°C durante sete dias. O material seco foi moído em moinho de facas e, posteriormente foi extraído por ultrassom utilizando etanol (10 mL.g-1) como solvente, com o equipamento configurado a 40% de amplitude, a uma potência de 500 W, durante 30 minutos. A amostra foi então filtrada e o solvente removido em rotaevaporador à pressão reduzida. O sólido remanescente foi extraído pela técnica de extração ácido-base para a obtenção dos extratos fracionados, totalizando 29 frações. O composto afinisina foi isolado por cromatografia de camada fina (TLC), totalizando uma massa de 0,02697 g, que corresponde a um rendimento de 0,3%.
O ensaio para determinação do IC50 foi realizado nas quatro linhagens celulares para tempos de exposição de 24 e 48 h. Os resultados de viabilidade celular mostraram que o composto foi capaz de inibir 50% do crescimento celular das três células de melanoma estudadas. O melhor resultado para o ensaio de 24 h foi observado para a WM1366, cujo IC50 foi de 48,22 μg.mL-1, seguido da célula SK-MEL-28, com IC50 de 57,84 μg.mL-1. Para a condição de exposição de 48 h, o comportamento observado foi o mesmo, sendo que os IC50 foram de respectivamente, 32,86 e 41,51 μg.mL-1. Com isso, o melhor resultado foi após 48 h de exposição para a linhagem de SK-MEL-28. Nos ensaios, a afinisina se mostrou seletiva para A375 após 24 h, com IC50 igual a 75,04 μg.mL-1, e para CCD-1059Sk após 48 h, com índice de inibição de 77,81 μg.mL-1. Isso indica que a afinisina apresenta alguma seletividade às células saudáveis, dado que foi o maior IC50 observado no estudo[19].
Devido ao ensaio com 48 h de exposição ter fornecido os melhores resultados, os autores fixaram essa condição para os demais testes. O grupo de pesquisadores realizou um teste de anexina, para investigar se a inibição no crescimento celular observado foi causada por apoptose, que é um mecanismo envolvido na inibição de proliferação de células cancerígenas. Os autores concluíram que a afinisina induziu apoptose significativa em todas as células de melanoma avaliadas. Além disso, a indução de apoptose aliada à parada nas fases G0/G1 indicaram que o composto isolado tem potencial farmacológico para o desenvolvimento de agentes quimioterápicos contra o melanoma, sendo um resultado promissor para a pesquisa etnofarmacológica[19].
Heliopsis longipes S. F. Blake é uma planta pertencente à família Asteraceae, que possui como metabólitos característicos a presença de N-alquilamidas, compostos conhecidos por suas propriedades: anti-inflamatória, imunomoduladora, analgésica e anticancerígena. Os autores[20] investigaram os efeitos do extrato da planta em linhagens de HeLa (câncer cervical), HaCaT (queratinócitos), K-562 (leucemia) e MCF-7 (mama). Para a obtenção do extrato de H. longipes empregou-se a técnica de extração com Soxhlet, utilizando n-hexano como solvente por três dias. O extrato rico em alquilamidas obtido das raízes secas e moídas da planta foi submetido à pressão reduzida com temperatura de 40°C e foi posteriormente estocado no escuro sob refrigeração mantida a -20°C. A análise de cromatografia permitiu a identificação do espilantol como composto majoritário presente no extrato HLE.
O extrato HLE e o espilantol foram utilizados em testes para determinação da viabilidade celular, determinando-se também a seletividade dos extratos. Para HLE foram realizados ensaios com 24 e 48 h de exposição, enquanto para o espilantol apenas a condição de 48 h foi estudada. O HLE foi mais seletivo para as células de leucemia, com SI de 10,57. Quanto à inibição do crescimento celular, tanto para 24 quanto para 48 h, o IC50 observado para as células HaCaT, foi superior a 300 μg.mL-1, mostrando que o extrato não atinge as células saudáveis. A maior inibição do HLE para as condições estudadas ocorreu no ensaio de 48 h para a linhagem K-562, cujo índice IC50 foi de 87,14 μg.mL-1. Já os resultados para o componente isolado foram mais potentes que os obtidos para o extrato HLE para todas as células estudadas. O índice IC50 para HaCaT foi superior a 100 μg.mL-1, mostrando que o composto apresenta alguma seletividade entre as células cancerígenas e normais. A maior seletividade ocorreu para K-562, assim como foi observado para HLE (39,39 μg.mL-1) por Willig et al.[20].
Os autores verificaram que o efeito inibitório às células tumorais foi relacionado à fase G2/M, estando associado a apoptose celular dependente da caspase. Pode-se então concluir que os resultados obtidos por Willig et al.[20] indicaram que o extrato da planta apresentou atividade anticancerígena, sem produzir efeitos citotóxicos em células saudáveis. Além disso, apesar dos resultados com o componente puro indicarem maior inibição do crescimento celular, o tratamento com HLE parece fornecer maior segurança às células normais, já que a inibição do espilantol foi levemente significativa para HaCaT.
Os efeitos antioxidante, antiproliferativo e curativo dos extratos obtidos a partir das cascas e sementes de Annona crassiflora Mart. foram estudados por Prado et al.[21]. As frutas maduras foram lavadas com água destilada e manualmente separadas entre polpa, sementes e casca. As cascas e sementes foram liofilizadas e moídas em moinho de facas. Os materiais foram embalados a vácuo e estocadas a -20°C. Procedeu-se à extração assistida por ultrassom, onde 1 g de amostra foi homogeneizado com uma mistura 7:7:6 v/v/v (15 mL) de metanol, acetona e água aplicando vórtex por 30 segundos. Em seguida, as amostras foram levadas para o ultrassom em temperatura ambiente por 30 minutos e, posteriormente, foram levados para a centrífuga. Os sobrenadantes foram coletados e os resíduos foram extraídos mais duas vezes. Depois, os sobrenadantes coletados foram combinados e evaporados em pressão reduzida a 35°C. Esse processo foi repetido três vezes e a amostra foi guardada a vácuo sob -20°C.
O conteúdo dos extratos da casca e sementes foi caracterizado. No primeiro extrato se observou a presença de epicatequina e catequina como compostos majoritários, enquanto o segundo apresentou quercetina, epicatequina e ácidos clorogênio e cafeico[21].
Os extratos foram avaliados contra diversas células: glioma (U-251), mama (MCF-7), ovário (NCI-ADR/RES com fenótipo de resistência a drogas), pulmão (NCI-H460), próstata (PC-3), ovário (OVCAR-3), cólon (HT-29), leucemia (K- 562) e queratinócitos (HaCaT). Os valores de concentração necessários para inibir completamente a proliferação celular (TGI) foram investigados. Os resultados mostraram que o extrato da casca apresentou melhor inibição contra as células de glioma (37,64 μg.mL-1), enquanto o extrato da semente apresentou maior efeito antiproliferativo contra NCI-ADR/RES. De forma geral, o extrato da semente apresentou efeitos antiproliferativos superiores ao da casca para todas as linhagens estudadas. Cabe ressaltar que o controle positivo (doxorrubicina) exerceu elevado efeito contra as células saudáveis, com TGI igual a 0,092 μg.mL-1. Isso mostra que, apesar dos extratos apresentarem efeitos citotóxicos contra células normais, a ação é muito mais amena se comparada ao controle negativo[21].
Desse modo, a espécie A. crassiflora apresentou resultados in vitro promissores, apesar de o conteúdo fenólico ter se mostrado baixo. Com isso, a planta tem potencial para o desenvolvimento de drogas antiproliferativas, em especial para NCI-ADR/RES (TGI = 5,36 μg.mL-1)[21].
O potencial farmacológico de Psidium guineense (Sw.) foi investigado por Nascimento et al.[22]. O óleo essencial foi obtido das folhas frescas, extraídas pelo método de hidrodestilação em aparelho Clevenger durante 4 h. A identificação dos componentes obtidos no extrato foi realizada por GC-MS e o procedimento resultou na caracterização de 38 compostos, sendo que o espatulenol (sesquiterpeno) foi o componente majoritário obtido, representando 80,71% do óleo. Posteriormente, o espatulenol foi purificado em uma coluna de cromatografia.
As atividades do extrato (EOPG) e do composto isolado (PG-1) foram analisadas contra células tumorais de glioma (U-251), mama (MCF-7), ovário com resistência a drogas (NCI-ADR/RES), rim (786-O), pulmão (NCI-H460), próstata (PC-3), ovário (OVCAR-3), cólon (HT-29), leucemia (K-562) e queratinócitos (HaCaT), sendo a última uma linhagem saudável. O EOPG mostrou inibição celular para todas as linhagens avaliadas, sendo o melhor resultado para OVCAR-3, mostrando significativa inibição com GI50 de 0,89 μg.mL-1. Já o composto isolado exibiu um efeito antiproliferativo moderado, cujo valor foi de 49,30 μg.mL-1. Assim, é possível observar que o efeito sinergético do óleo essencial apresentou melhor resultado do que o espatulenol isolado, mostrando a importância da associação dos compostos presentes nos extratos obtidos por fontes vegetais para o desempenho de sua atividade biológica. Contudo, o EOPG também apresentou inibição da proliferação celular das células não-tumorais (HaCaT), com GI50 de 7,98 μg.mL-1, enquanto o espatulenol teve um efeito mais moderado (61,27 μg.mL-1)[22].
Com isso, os resultados obtidos indicaram ação anticancerígena do óleo essencial das folhas de P. guineese para diversas linhagens tumorais, com desempenho superior para o câncer de ovário, OVCAR-3. São necessários, ainda, estudos in vivo e sobre a seletividade da ação antiproliferativa do extrato, a fim de garantir a segurança para as células normais[22].
Extratos de Senna spectabilis (sin. Cassia excelsa var. Acutifolia, Cassia carnaval, Cassia spectabilis)foram produzidos a partir de suas flores para avaliação da composição química e ensaio de atividade biológica. As flores foram secas em estufa durante seis dias a 40°C e então moídas, sendo posteriormente extraídas por maceração em etanol durante seis dias. A amostra foi então filtrada e mais 3 L de solvente foram adicionados ao material residual por dois dias. Por fim, os extratos foram combinados produzindo 104 g de extrato etanólico, em que, após partição, obteve-se uma fração rica em alcaloides, resultando em 39 g de material. Essa fração bruta foi exaustivamente extraída até obter uma fração alcaloide crua (9 g). Em seguida, a amostra foi purificada por cromatografia em coluna, resultando em uma mistura complexa dos alcaloides majoritários, (‒)-cassina e (‒)-espectalina (4,82 g)[23].
O ensaio de viabilidade celular foi realizado com carcinomas de pulmão (A549), mama (MCF-7 e Hs578T), fígado (HepG2), glioblastoma (U138MG e U-251MG) e fibroblastos normais (CCD-1059Sk). As células foram tratadas por 24, 48 e 72 h. A inibição celular apresentou resultados promissores apenas para 48 h de tratamento com a mistura de alcaloides. Os resultados mostraram que o maior efeito antiproliferativo ocorreu para HepG2, com IC50 de 26,45 μg.mL-1; já as células saudáveis apresentaram um índice de 55,62 μg.mL-1. O índice de seletividade foi de 2,10, valor superior ao observado para DOX, que é um potente agente quimioterápico[23].
Os autores relacionaram a atividade antiproliferativa da fração alcaloide devido à interrupção do ciclo celular na fase G1/S. A progressão do ciclo nessas fases é regulada por um mecanismo de elevada complexidade, envolvendo fatores como a ativação de quinases, como as cinases dependentes de ciclina, denominadas CDKs. Assim, a fim de promover maior entendimento acerca do mecanismo de ação da mistura de alcaloides, foram estudadas as mudanças na expressão dos níveis de ciclina D1 e fosforilação de ERK. Os resultados comprovaram que os alcaloides induziram regulação negativa em D1 e inibiram a ativação de ERK, demonstrando pela primeira vez que (‒)-cassina e (‒)-espectalina exercem papel fundamental na modulação da expressão de ciclina D1 e na fosforilação de ERK. Com isso, a pesquisa dos autores permitiu, além de verificar indícios do potencial antitumoral dos compostos obtidos de S. spectabilis, avaliar seu mecanismo de ação[23].
A atividade antitumoral de extratos de Piper nigrum L. foi analisada por Grinevicius et al.[24] a partir de extração convencional e supercrítica. A maceração foi realizada com 144 g.L-1 de pimenta moída com etanol (93% v/v), durante 72 h com renovação diária do solvente, o qual foi separado posteriormente em um rotaevaporador sob pressão reduzida a 45°C, obtendo uma oleoresina concentrada (ET). Já para a extração supercrítica com dióxido de carbono foram utilizados 20 g de material seco, a temperatura foi mantida fixa em 40°C e, a pressão foi avaliada nas condições de 150, 200 e 300 bar, obtendo os extratos SFE150, SFE200 e SFE300. Além disso, na condição de 200 bar e 40°C, os autores empregaram etanol (7,5% v/v) como cossolvente (SFE200 + ETOH), para determinar a influência da presença de um solvente de maior polaridade no meio para os testes realizados. A solubilidade do etanol na extração supercrítica variou entre 0,781 e 0,911 g.cm-3, promovendo solubilidade adequada para a extração dos compostos da planta.
Os compostos extraídos das amostras ET, SFE200, SFE300 e SFE200 + ETOH foram identificados por análises de UV-vis, HPLC, ESI-IT-MS (espectrometria de massa com ionização por electrospray) e GC-MS. O perfil fitoquímico dos extratos foi caracterizado pela presença de mono e sesquiterpenos, sendo o maior conteúdo representado pelos sesquiterpenos. Para todos os extratos avaliados o componente majoritário foi o cariofileno, sendo que vale destacar também a presença de compostos como germacreno D e α-humuleno, que são compostos bioativos comumente associados à atividade antitumoral. Os extratos SFE apresentaram melhores resultados quanto à solubilidade e seletividade, além de reduzir a perda de produtos. Além disso, o conteúdo de piperina em SFE200 foi, aproximadamente, 1,9 vezes superior que o obtido para ET (convencional), onde os valores encontrados foram de, respectivamente, 60,35 e 32,12%[24].
Os efeitos dos extratos em células tumorais MCF-7 foram avaliados e o melhor resultado correspondeu ao extrato obtido por extração supercrítica a 40°C e 200 bar (SFC200). A ação citotóxica dessa amostra resultou em um valor EC50 (metade da concentração efetiva máxima) igual a 14,4 μg.mL-1. Grinevicius et al.[24] atribuíram o ocorrido à maior quantidade de monoterpenos e sesquiterpenos nessa amostra.
Grinevicius et al.[24] apontaram que a presença de cariofileno pode aumentar a atividade antitumoral do α-humuleno, conferindo ao produto melhores propriedades anticancerígenas. Posteriormente, os autores submeteram as amostras ET e SFE200, devido à melhor performance no ensaio in vitro, ao teste in vivo com modelo de tumor de Ehrlich em ratos. Os resultados mostraram que SFE200 causou significante redução na quantidade de células na fase S. Os autores correlacionaram essa observação à possibilidade de dano oxidativo e/ou intercalação no DNA, ocasionando a parada do ciclo celular na fase G2/M.
Desse modo, os estudos de Grinevicius et al.[24] comprovaram a melhor seletividade e o melhor desempenho dos extratos obtidos pela técnica alternativa do fluido supercrítico (FSC) se comparado ao método da maceração, tradicionalmente empregado para a obtenção de compostos de origem vegetal. Ademais, o extrato supercrítico obtido na condição de 200 bar e 40°C exibiu os melhores efeitos contra as células de câncer de mama MCF-7, induzindo a apoptose celular provavelmente devido ao efeito sinérgico entre a piperina e os sesquiterpenos presentes no óleo. Com isso, a Piper nigrum L. tem indícios de ser uma promissora espécie para abordagens alternativas empregadas para o manejo do câncer.
A planta medicinal Schinus terenbithifolius Raddi (Anacardiaceae), é nativa do Brasil e apresenta um elevado potencial para exploração do ponto de vista etnofarmacológico. A caracterização química do extrato obtido por extração supercrítica com CO2 e os efeitos das condições operacionais no rendimento e na atividade antiproliferativa dos extratos foram estudados por[25].
As frutas da espécie foram secas em estufa a 40°C por três dias, moídas em liquidificador industrial e classificadas por granulometria com peneiras Tyler de 10 a 42 Mesh por 20 min. O diâmetro médio de partículas foi calculado (0,828 mm), sendo adequado de acordo com a faixa elucidada na literatura (0,25 a 2 mm)[25].
Um planejamento de experimentos fatorial completo de ordem 2² com 3 réplicas no ponto central foi utilizado para avaliar as condições a serem utilizadas na extração supercrítica. A TABELA 3 resume as principais informações sobre o planejamento de experimentos e as variáveis de saída da extração, cuja pressão foi avaliada entre 100 e 300 bar e, a temperatura foi investigada entre 40 e 60°C.
| Planejamento fatorial completo | Variáveis de saída | ||||
| Ensaio | Pressão (bar) | Temperatura (°C) | ρ (g.cm-3) | Xo (%) | δ-3-careno (%) |
| 1 | 100 (-1) | 40 (-1) | 0,562 | 5,70 | 6,24 |
| 2 | 300 (+1) | 40 (-1) | 0,928 | 13,0 | 2,23 |
| 3 | 100 (-1) | 60 (+1) | 0,298 | 3,08 | 7,47 |
| 4 | 300 (+1) | 60 (+1) | 0,831 | 13,7 | 2,16 |
| 5 | 200 (0) | 50 (0) | 0,762 | 12,5 | 2,59 |
| 6 | 200 (0) | 50 (0) | 0,762 | 11,8 | 2,72 |
| 7 | 200 (0) | 50 (0) | 0,762 | 12,8 | 2,57 |
| EO | - | - | - | 4,20 | 7,29 |
| DE | - | - | - | 16,6 | 1,12 |
| EE | - | - | - | 42,6 | 0,00 |
| Fonte: Adaptado de Silva et al[25]. | |||||
Pode-se perceber que a TABELA 3 contém as sete condições operacionais utilizadas na extração supercrítica, em que os valores entre parêntesis representam os valores codificados do planejamento de experimentos (-1, 0, 1). Além disso, a densidade dos extratos supercríticos (scCO2) são ilustradas na quarta coluna. O rendimento global (Xo) calculado pela Eq. (1), assim como o conteúdo de δ-3-careno (kg do composto/kg de extrato x 100), foi aferido para os extratos scCO2, EO (hidrodestilação), DE (Soxhlet com diclorometano) e EE (Soxhlet com etanol).
| Xo = | mE | 100 |
| md |
A extração supercrítica, assim como a hidrodestilação e o Soxhlet seguiram os procedimentos experimentais descritos na seção de Material e Método. As técnicas convencionais foram empregadas para comparação dos resultados obtidos entre os diferentes métodos. Dos resultados apresentados para a densidade do scCO2, nota-se que o melhor resultado foi obtido a 300 bar e 40°C (0,928 g.cm- ³). A extração de Soxhlet com etanol apresentou melhor rendimento global 42,6%, enquanto scCO2 a 100 bar e 60°C exibiu o maior conteúdo de δ-3-careno (7,47%)[25].
A caracterização química dos extratos foi feita por GC-MS. Os componentes majoritários dos extratos scCO2, EO e DE foram δ-3-careno, limoneno, α-felandreno e germacreno D. Nos extratos scCO2 o aumento da temperatura resultou em maior extração de sesquiterpenos[25].
Os ensaios de viabilidade celular foram realizados em nove linhagens tumorais (NCI-ADR/RES, HT-29, MCF-7, OVCAR-3, PC-3, 786-O, NCI-H460, U-251, K-562) e uma saudável (HaCaT). Os resultados observados mostraram que os extratos supercríticos obtidos em 50 ou 60°C, independente da pressão, exibiram melhor performance contra o câncer de rim (786-O). Por outro lado, a 200 bar e 50°C se observou atividade contra células NCI-ADR/RES (ovário resistente a drogas), próstata (PC-3), ovário (OVCAR-3) e glioma (U-251). Os resultados comprovam que os sesquiterpenos dos extratos exibem atividade anticancerígena em diversas linhagens e, para trabalhos futuros, deve-se explorar o fracionamento dos extratos[25].
A FIGURA 5 resume as principais informações discutidas neste trabalho, elucidando os principais compostos obtidos a partir das espécies avaliadas, relacionando os metabólitos às linhagens tumorais de melhor desempenho.
Conclusão
Este trabalho confirmou o potencial de bioprospecção de espécies vegetais ricas em compostos bioativos no Brasil, cuja composição está associada aos efeitos anticancerígenos em diversas linhagens celulares.
Dos trabalhos selecionados, a grande maioria empregou técnicas convencionais, que são baseadas no uso de solventes orgânicos. Devido à necessidade de purificação dos extratos para remoção dos solventes, são necessárias inúmeras etapas de separação, o que é altamente dispendioso, podendo inviabilizar o uso efetivo das plantas medicinais em escala industrial.
Apenas três estudos abordaram técnicas alternativas, como extração assistida por ultrassom e supercrítica. Isso revela que trabalhos direcionados para o uso da química "verde" ainda são insuficientes, apesar de fornecerem produtos com alta pureza e livres de solventes.
A escolha do melhor método de extração exerce forte influência na solubilidade dos constituintes, de maneira a impactar na composição química do extrato, uma vez que fatores como o tipo de solvente utilizado (característica polar ou apolar), condições de operação (pressão, temperatura) e outros, podem priorizar a extração de determinados compostos químicos. Dessa forma, a obtenção dos compostos bioativos está associada ao potencial anticancerígeno do extrato.
Além disso, deve-se considerar ainda o efeito sinérgico da mistura, visto que as plantas medicinais estão sujeitas às variações climáticas, que influenciam na composição química e, consequentemente, nas atividades biológicas. Em adição, utilizar o composto puro tende a ser mais caro que o extrato, dada a necessidade de etapas adicionais para isolar o componente da mistura.
Agradecimentos
À FAPERJ – Fundação de Apoio à Pesquisa do Estado do Rio de Janeiro – e ao CNPq/PIBIC pelo apoio financeiro. Este trabalho foi realizado com o apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.
Referências
1. World Health Organization. WHO report on cancer: setting priorities, investing wisely and providing care for all. World Health Organization. 2020; 149. [Link].
2. Wild CP, Weiderpass E, Stewart BW. World cancer report: cancer research for cancer prevention. Inter Agen Res Cancer. 2020; 630. [Link].
3. Souza MVN, Pinheiro AC, Ferreira ML, Gonçalves RSB, Lima CHC. Produtos Naturais em Fase Avançada de Testes Clínicos no Tratamento contra o Câncer Natural Products in Advance Clinical Trials Applied to Cancer. Rev Fitos. 2007; 3:25-42. [Link].
4. Ferreira RG, Franco LFR. Efeitos colaterais decorrentes do tratamento quimioterápico no câncer de mama: Revisão bibliográfica. Rev Univ Val Rio Verde. 2017; 15(2):633-638. [CrossRef].
5. Ijaz S, Akhtar N, Khan MS, Hameed A, Irfan M, Arshad MA et al. Plant derived anticancer agents: A green approach towards skin cancers. Biomed Pharmacoth. Elsevier. 2018; 103: 1643-1651. [CrossRef].
6. Majolo F, Delwing LKOB, Marmitt DJ, Bustamante-Filho IC, Goettert MI. Medicinal plants and bioactive natural compounds for cancer treatment: Important advances for drug discovery. Phytochem Lett. 2019; 31: 196–207. [CrossRef].
7. Almeida MZ. Plantas medicinais: abordagem histórico-contemporânea. Plantas medicinais: abordagem histórico-contemporânea. 3ª Ed. EDUFBA. 2011; 34-66. [Link].
8. Newman DJ, Cragg GM. Natural Products as Sources of New Drugs from 1981 to 2014. J Nat Prod. 2016; 79(3): 629–661. [CrossRef].
9. Brasil. Ministério da Saúde. Política e Programa Nacional de Plantas Medicinais e Fitoterápicos. Secretaria de Ciência, Tecnologia e Insumos Estratégicos, Departamento de Assistência Farmacêutica - Brasília: Ministério da Saúde. 2016; 190. [Link].
10. Elisabetsky E, Shanley P. Ethnopharmacology in the Brazilian Amazon. Pharmacol Therap. 1994; 64(2): 201-214. [CrossRef].
11. Žitek T, Dariš B, Finšgar M, Knez Ž, Bjelić D, Hrnčič MK. The Effect of Polyphenolics in Extracts from Natural Materials on Metabolic Activity of Metastatic Melanoma WM-266-4 Cells Appl Sci. 2020; 10(10): 3499. [CrossRef].
12. Handa SS, Khanuja SPS, Longo G, Rakesh DD. Extraction Technologies for Medicinal and Aromatic Plants. Int Cent Sci High Technol. 2008. [Link].
13. Haloui I, Meniai AH. Supercritical CO2 extraction of essential oil from Algerian Argan (Argania spinosa L.) seeds and yield optimization. Int J Hydrogen Energy. 2017; 42(17): 12912-12919. [CrossRef].
14. Gomes DB, Zanchet B, Locateli G, Benvenutti RC, Vechia CAD, Schönell AP et al. Antiproliferative potential of solidagenone isolated of Solidago chilensis. Rev Bras Farmacogn. 2018; 28(6): 703–709. [CrossRef].
15. Costa AR, Silva JRL, Oliveira TJS, Silva TG, Pereira PS, Borba EFO et al. Phytochemical profile of Anacardium occidentale L. (cashew tree) and the cytotoxic and toxicological evaluation of its bark and leaf extracts. South African J Bot. 2020; 135: 355-364. [CrossRef].
16. Cunha GOS, Silva DM, Santos ML, Moraes Filho MO, Pessoa CO, Guimarães CJ et al. Chemical constituents and cytotoxic activity of Miconia burchellii Triana (Melastomataceae) leaves. South African J Bot. 2021; 137:345–350. [CrossRef].
17. Vuolo MM, Batista AG, Biasoto ACT, Correa LC, Maróstica Júnior MR, Liu RH. Red-jambo peel extract shows antiproliferative activity against HepG2 human hepatoma cells. Food Res Int. 2019; 124: 93-100. [CrossRef] [PubMed].
18. Silva MCBL, Bogo D, Alexandrino CAF, Perdomo RT, Figueiredo PO, Prado PR et al. Antiproliferative activity of extracts of Campomanesia adamantium (Cambess.) O. Berg and Isolated Compound Dimethylchalcone Against B16-F10 Murine Melanoma. J Med Food. 2018; 21(10): 1024-1034. [CrossRef] [PubMed].
19. Rosales PF, Gower A, Benitez MLR, Pacheco BS, Segatto NV, Roesch-Ely M et al. Extraction, isolation and in vitro evaluation of affinisine from Tabernaemontana catharinensis in human melanoma cells. Bioorg Chem. 2019; 90: 103079. [CrossRef] [PubMed].
20. Willig JB, Salomón JLDO, Vianna DRB, Moura S, Pilger DA, Buffon A et al. Heliopsis longipes S.F. Blake (Asteraceae) extract causes cell cycle arrest and induces caspase dependent apoptosis against cancer cell lines. South African J Bot. 2019; 125: 251–260. [CrossRef].
21. Prado LG, Arruda HS, Araujo NMP, Braga LEO, Banzato TP, Pereira GA et al. Antioxidant, antiproliferative and healing properties of araticum (Annona crassiflora Mart.) peel and seed. Food Res Int. 2020; 133: 109168. [CrossRef] [PubMed].
22. Nascimento KF, Moreira FMF, Santos JÁ, Kassuya CAL, Croda JHR, Cardoso CAL et al. Antioxidant, anti-inflammatory, antiproliferative and antimycobacterial activities of the essential oil of Psidium guineense Sw. and spathulenol. J Ethnopharmacol. 2018; 210:351–358. [CrossRef] [PubMed].
23. Pereira RM, Ferreira-Silva GA, Pivatto M, Santos LA, Bolzani VS, Paula DAC et al. Alkaloids derived from flowers of Senna spectabilis, (-)-cassine and (-)-spectaline, have antiproliferative activity on HepG2 cells for inducing cell cycle arrest in G1/S transition through ERK inactivation and downregulation of cyclin D1 expression. Toxicol Vitr. 2016; 31: 86-92. [CrossRef] [PubMed].
24. Grinevicius VMAS, Andrade KS, Ourique F, Micke GA, Ferreira SRS, Pedrosa RC. Antitumor activity of conventional and supercritical extracts from Piper nigrum L. cultivar Bragantina through cell cycle arrest and apoptosis induction. J Supercrit Fluids. 2017; 128: 94-101. [CrossRef].
25. Silva BG, Fileti AMF, Foglio MA, Ruiz ALTG, Rosa PTV. Supercritical carbon dioxide extraction of compounds from Schinus terebinthifolius Raddi fruits: Effects of operating conditions on global yield, volatile compounds, and antiproliferative activity against human tumor cell lines. J Supercrit Fluids. 2017; 130:10–16. [CrossRef].