Revisão
Potencial efeito terapêutico das folhas de Moringa oleifera Lamarck (Moringaceae): uma revisão do seu papel no controle da glicemia em estudos in vivo
Potential therapeutic effect of Moringa oleifera Lamarck (Moringaceae) leaves: a revision of its role in glycemic control in vivo studies
Resumo
A espécie Moringa oleifera Lamarck (Moringaceae) vem se destacando no Brasil, devido ao seu elevado teor nutricional, sendo amplamente utilizada na complementação alimentar. Muitos estudos têm sido publicados sobre sua ação no tratamento de diabetes mellitus, bem como sobre diversas outras propriedades, como antioxidante, protetor de tecidos, efeito anti-hipertensivo e imunomodulador. Porém, seu crescente uso irracional, por parte da população, desencadeou a proibição do uso e da comercialização de produtos à base de moringa no Brasil pela Agência Nacional de Vigilância Sanitária (ANVISA). Nesse cenário, este estudo teve como objetivo realizar uma revisão de literatura para avaliar a potencial ação antidiabética das folhas de M. oleifera. Para tanto,foram analisados 43 estudos não clínicos (12 - in vitro; 31 - in vivo). Os estudos analisados apontaram uma promissora atividade antidiabética para as folhas. Todavia, a ausência de padronização no processo de obtenção e na caracterização química nos produtos de moringa avaliados e alguns vieses metodológicos nos modelos, enfraquecem as evidências científicas e o entendimento do seu mecanismo de ação.
- Palavras-chave:
- Moringa.
- Toxicidade.
- Antioxidante.
- Anti-hiperglicêmica.
- Diabetes.
Abstract
Moringa oleifera Lamarck (Moringaceae) has been highlighted in Brazil due to its high nutritional content and is widely used in food supplementation. Lately, many studies have been published about its actions in the treatment of diabetes mellitus and in several other properties, such as antioxidant, tissue protector and antihypertensive and immunomodulator effect. However, its growing irrational use by the population has triggered the prohibition of its use and commercialization of products in Brazil by the National Health Surveillance Agency (ANVISA). In this context, this study aimed to conduct a literature review to assess the potential antidiabetic action of M. oleifera leaves. For this purpose, 43 non-clinical studies (12 - in vitro; 31 - in vivo) were analyzed. The studies analyzed pointed to a promising antidiabetic activity. However, the lack of methodological standardization of the process and chemical characterization of products added to some methodological biases in studies weakened the scientific evidence on their efficacy, and the understanding of their mechanism of action.
- Keywords:
- Moringa.
- Toxicity.
- Antioxidant.
- Antihyperglycemic.
- Diabetes.
Introdução
O uso de plantas para tratar, curar e prevenir doenças é uma prática medicinal remota das sociedades humanas[1,2]. Muitos medicamentos utilizados atualmente na terapêutica foram obtidos a partir da observação do uso de produtos naturais[3-5]. Pode-se afirmar que a ação terapêutica das plantas é decorrente de substâncias químicas biologicamente ativas que fazem parte principalmente do seu metabolismo secundário[6]. Moringa oleifera Lamarck(ordem Brassicales)(FIGURA 1), conhecida popularmente como moringa, acácia branca, árvore da vida, presente de Deus, "drumstick", "horseradish" e "malunggay", é originária da Índia e vem se destacando mundialmente em decorrência de suas promissoras propriedades nutricionais e medicinais[7].
Folhas, vagens, seiva, flores e sementes são amplamente utilizadas na alimentação de populações tradicionais, como suplementação nutricional e forragem para animais, suprindo, muitas vezes, a carência de vitaminas, proteínas, fibras e minerais em países menos desenvolvidos[7-9]. As folhas apresentam maior destaque, por serem ricas em fitonutrientes, vitaminas (A, B1,2,3,6,9, C, D e E), fibras, proteínas, minerais (cálcio, potássio, zinco, magnésio, fósforo, ferro, cobre e selênio), β-caroteno e compostos antioxidantes que são geralmente escassos nas dietas dos países em desenvolvimento[10-13]. Por serem ricas em ferro, as folhas auxiliam no tratamento de anemias, elevando a concentração de hemoglobina nas hemácias[14].
As folhas possuem elevado teor de metabólitos secundários, com destaque aos flavonoides, que são metabólitos promotores de saúde. Estes têm despertado grande interesse por seu potencial anti-inflamatório e antioxidante e por seu possível papel na prevenção de doenças crônicas relacionadas ao estresse oxidativo, como cardiopatia isquêmica, diabetes e câncer[15].

No Brasil, há relatos de introdução da M. oleifera na década de 1950 como planta ornamental de ruas e praças, dado que sua importância nutricional e medicinal não era ainda conhecida[16]. Atualmente, as folhas da M. oleifera vêm sendo amplamente utilizadas pela população para tratar diabetes, hipercolesterolemia, hipertensão arterial, inflamações articulares (artrite e artrose), câncer e imunodeficiências, através de produtos adquiridos nas feiras livres, lojas de produtos naturais e na internet (pó das folhas secas, cápsulas, comprimidos, extratos), em diversas regiões do país, em especial na região Nordeste[17]. Contudo, é importante destacar que para um produto de origem natural ser considerado um fitoterápico e obter seu registro no Ministério da Saúde deve-se comprovar sua segurança, eficácia e qualidade, conforme descrito na Resolução de Diretoria Colegiada (RDC) Nº 26 de 13 e maio de 2014, que dispõe sobre o registro de fitoterápicos, sendo necessários anos de pesquisa e investimento[18].
Apesar da grande biodiversidade brasileira, o número de fitoterápicos registrados no país ainda é muito baixo e vem decrescendo ao longo dos últimos anos em função de maiores exigências na legislação sanitária, elevados preços dos fitoterápicos e de sua maior utilização por prescrição médica[19]. Também vale salientar que produtos registrados na categoria de suplemento alimentar, cuja definição consta na RDC N° 243 de 26 de julho de 2018, não podem conter alegação terapêutica, nem qualquer forma de indução ao uso do produto[20].
Assim, produtos que contêm M. oleifera e estavam sendo comercializados na categoria de suplementos, apresentando alegações terapêuticas, estavam em desacordo com a legislação vigente. Frente a esse impasse, recentemente, a Agência Nacional de Vigilância Sanitária (ANVISA), prezando pelo uso racional de plantas medicinais, por meio da Resolução N° 1.478, de 3 de junho de 2019, proibiu a comercialização, distribuição, fabricação, importação e a propaganda de alimentos que contenham M. oleifera em sua composição sob qualquer forma de apresentação. A ação foi motivada em função da ausência de avaliação e comprovação da segurança do uso da espécie em alimentos no Brasil, assim como pela constatação de inúmeros produtos constituídos pela planta e comercializados irregularmente como suplementos alimentares, atribuindo-lhes finalidade terapêutica não cabível para alimentos[21].
Dentre os usos mais indicados para M. oleifera, destaca-se o tratamento da diabetes mellitus (DM), que é um importante e crescente problema de saúde no mundo inteiro, em especial nos países em desenvolvimento como o Brasil, sendo resultante principalmente dos maus hábitos alimentares, do sedentarismo e do processo de envelhecimento populacional[22]. A DM corresponde a um distúrbio metabólico crônico multifatorial, que afeta grande parte da população e, segundo a Organização Mundial da Saúde (OMS), caracterizado por hiperglicemia persistente, resultante da deficiência na produção de insulina ou de sua ação, ou de ambos os casos, gerando complicações a longo prazo[22].
A diabetes pode ser classificada em tipo 1 ou 2. A diabetes mellitus tipo 1 corresponde a uma doença crônica autoimune com destruição das células 𝛃-pancreáticas ocasionando uma deficiência absoluta de insulina. Por sua vez, a diabetes tipo 2 é caracterizada por uma redução progressiva da secreção de insulina das células 𝛃-pancreáticas em meio à resistência à insulina[22].
A diabetes mellitus tipo 2 (DM2) é responsável por acometer a maioria dos pacientes diabéticos (cerca de 90 a 95%) e, frequentemente, a terapia monoalvo adotada falha no gerenciamento dos níveis de glicose no sangue e na prevenção de outras comorbidades[23]. Nesse cenário, buscando reverter essa realidade, estudos que avaliam o uso de produtos naturais associados aos tratamentos protocolados existentes estão ganhando cada vez mais importância em razão de sua ação multialvo que se constitui como alternativa ao tratamento[23].
Dentro deste contexto, as folhas da M. oleifera vêm sendo extensivamente usadas para tratar a DM, de diferentes formas: frescas, consumidas de forma isolada na refeição ou adicionadas na salada com outros vegetais; secas, utilizadas para preparação de infusões (chás); na forma de pó, como suplemento; e, ainda, o uso de extratos em formas farmacêuticas (FIGURA 2).

Assim, por meio de uma revisão integrativa da literatura, o artigo teve como objetivo avaliar o potencial de Moringa oleifera Lamarck no controle da glicemia em modelos animais.
Aspectos botânicos
Moringa oleifera Lam. que tem como sinonímias M. moringa (L.) Millsp., M. pterygosperma Gaertn, Guilandina moringa L., Hyperanthera moringa (L.) Vahl. e M. zeylanica Burmanné uma angiosperma pertencente à família Moringaceae, cujo único gênero Moringa apresenta mais 12 espécies, a saber: M. arborea, M. borziana, M. concanensis, M. drouhardii, M. hildebrandtii, M. longituba, M. ovalifolia, M. peregrine, M. pygmaea, M. rivae, M. ruspoliana, e M. stenopetala. Dentre tais espécies, a mais conhecida e estudada é a M. oleifera[24-27]. A árvore é originária do noroeste da Índia, do Paquistão, de Bangladesh e do Afeganistão, encontrando-se mais especificamente nas áreas do sopé da Cordilheira do Himalaia[28,29].
Segundo Leone et al.[11], a espécie possui madeira de aspecto macio, crescimento rápido e pode alcançar 12 m de altura, sendo adaptada a áreas de clima tropical e subtropical (760 a 2500 mm; 18°C a 28°C). Por ser tolerante à seca, é considerada uma cultura de climas secos e áridos, sobrevivendo nas mais diversas categorias de solos, sendo os melhores para seu desenvolvimento os argilosos com pH levemente alcalino ou os areno-argilosos que tenham boa drenagem, visto que suas raízes tornam-se apodrecidas em ambientes encharcados[28,30]. A planta é caracterizada por apresentar folhas compostas verdes bi ou tripinadas, folíolos medindo de 12-18 mm de comprimento, pecíolos amarelos ou brancos com ausência de linhas vermelhas, características que a distingue da M. concanensis, que se diferencia pelo seu grande porte, folhas bipinadas, folíolos com 15-30 mm de comprimento, pétalas com estrias vermelhas ou avermelhadas na base. Possui vagens suspensas com 3 lados, contendo em seu interior sementes globulares aladas, flores de coloração creme, tronco cinza esbranquiçados e raiz tuberosa[28-34] (FIGURA 3).

Etnofarmacologia da Moringa oleifera
A utilização da M. oleifera como fonte nutricional e terapêutica não é uma atividade recente, haja vista que os povos egípcios, gregos, romanos e indianos já faziam seu uso desde a antiguidade[8,35,36]. Diversos estudos de caráter etnofarmacológicos desenvolvidos em diferentes países apontam a utilização da planta para tratar desde casos de desnutrição a problemas como úlcera, inflamação, inchaço, infecção bacteriana, asma, febre, artrite, artrose, tumores (câncer), síndrome da imunodeficiência adquirida (HIV/AIDS), infecções cutâneas, anemia, tuberculose, deficiência de sêmen (infertilidade), conjuntivite, cólera, tosse, garganta inflamada, diarreia, incluindo até mesmo, doenças de caráter crônico como hipertensão arterial, hipercolesterolemia e diabetes[24,35-39]. As folhas são a parte mais utilizada para propósitos terapêuticos (malária, dores estomacais, hiperglicemia, hipertensão, cicatrizante, acidente vascular encefálico, artrite, endoparasitoses, dentre outras) e nutricionais (TABELA 1).
| Parte da planta | Uso popular | Forma de uso | Referências |
| Folhas | Diabetes, pressão alta, malária, artrite, dor de estômago, vermes e etc. | Cruas, infusões, pós, trituradas, molhos, sopas e mingaus. | [24,39] |
| Raízes e tronco | Dor de dente, diabetes, pressão alta, impotência sexual, picada de cobras e escorpiões. | Decocção e maceração aquosa ou etanólica. | [40,41] |
| Flores | Impotência sexual e infertilidade em ambos os sexos. | Decocção com leite de vaca. | [42] |
.
Material e Método
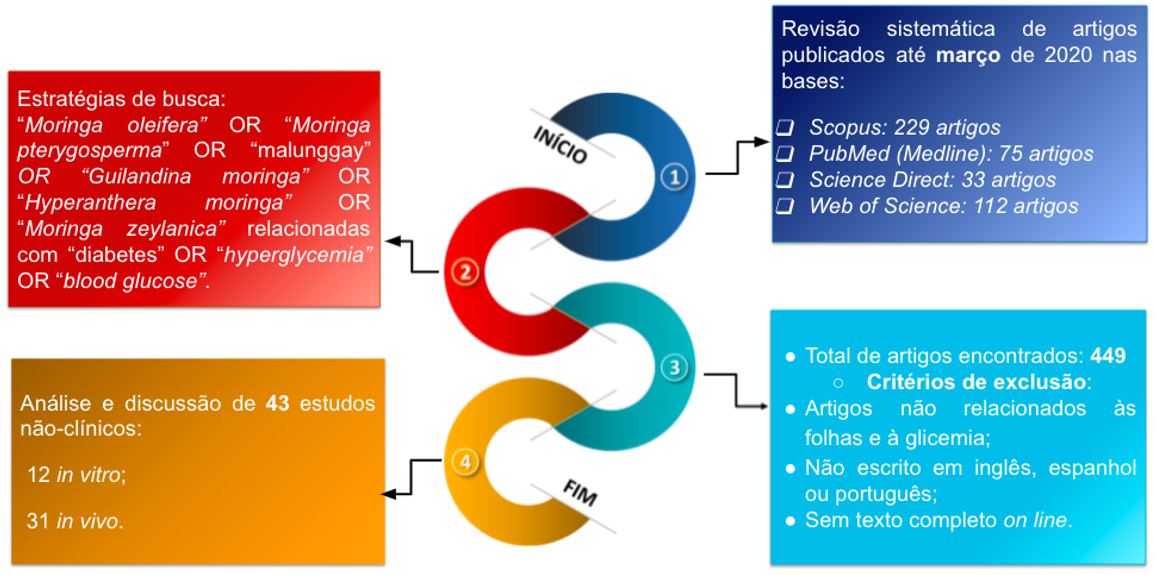
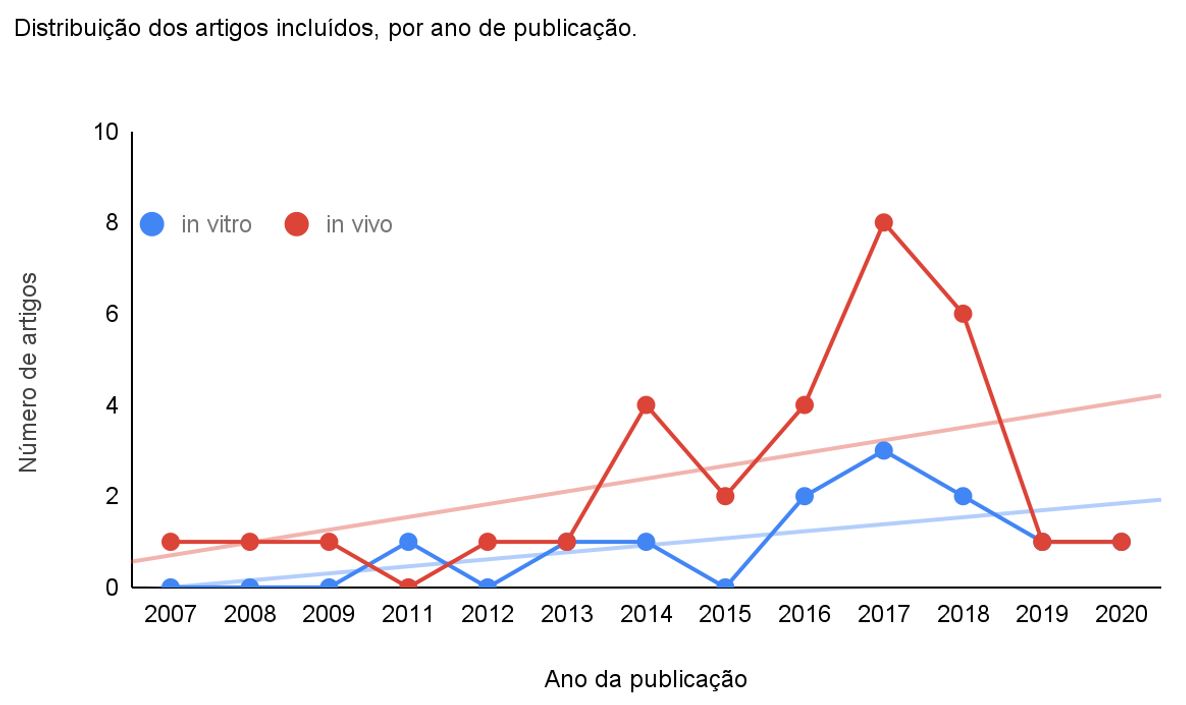
Em busca de responder à pergunta objeto deste estudo, foi realizada uma revisão de artigos publicados on-line, até março de 2020, encontrados nas bases de dados como Scopus, PubMed (Medline), Science Direct e Web of Science (artigos open acess de 1990 a março de 2020). A pesquisa foi conduzida utilizando como palavras-chave "Moringa oleifera" OR "Moringa pterygosperma" OR "malunggay" OR "Guilandina moringa" OR "Hyperanthera moringa" OR "Moringa zeylanica" relacionadas com "diabetes" OR "hyperglycemia" (hiperglicemia) OR "blood glucose" (glicose sanguínea) no título do artigo, no resumo (abstract) ou nas palavras-chave (keywords). Dentre as publicações encontradas, foram excluídas aquelas que não foram conduzidas com as folhas de M. oleifera e não apresentavam relação com a glicemia, que não estavam disponíveis em língua inglesa, espanhola ou portuguesa e as que não dispunham do texto completo on-line. Logo, após a aplicação dos critérios de exclusão, foram considerados 43 artigos nesta revisão. Tais artigos tratam dos aspectos etnofarmacológicos, fitoquímicos e farmacológicos das folhas da planta em estudo, e incluem 43 estudos não-clínicos [in vitro (12) e in vivo (31)] (FIGURA 4).
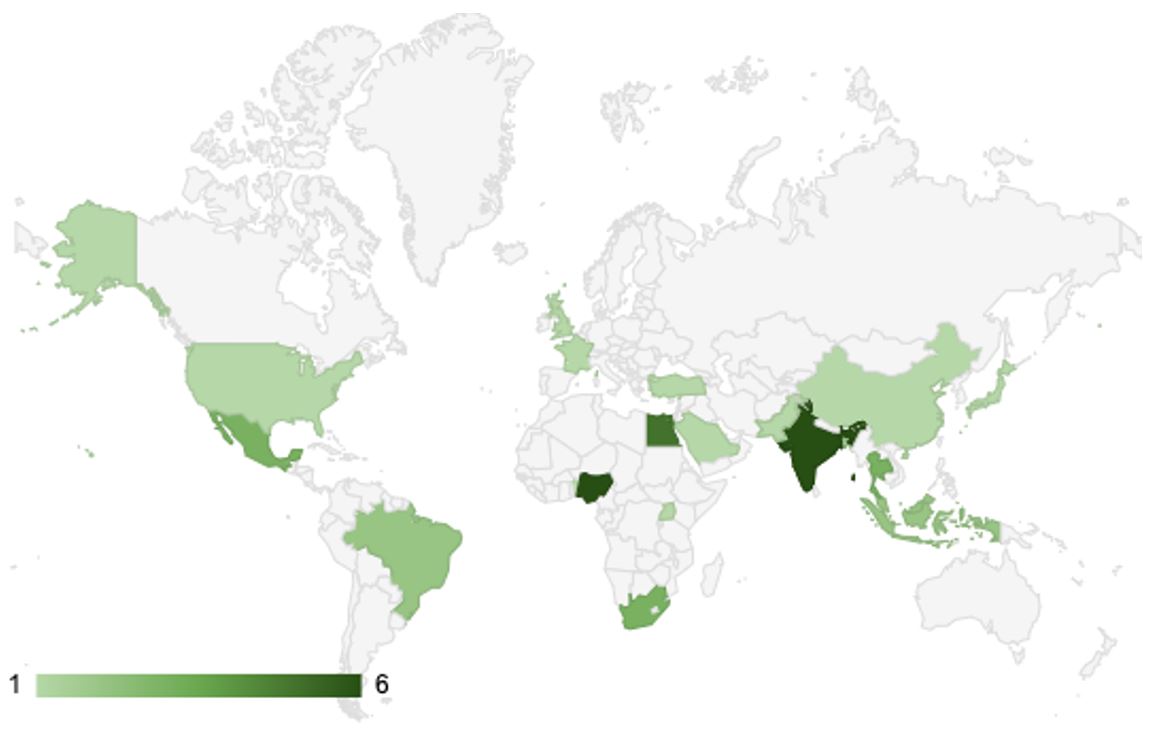
Os artigos analisados foram desenvolvidos em 18 países diferentes, tendo sido a Nigéria o país que mais publicou, com 7 artigos (FIGURA 5). Cabe enfatizar que as sinonímias da planta foram pesquisadas em bancos de dados botânicos como The Plant List, Tropicos e African Plant Database. Os artigos analisados compreenderam um período histórico de 13 anos de 2007 a 2020, sendo 2017 o mais profícuo em publicações (7) (FIGURA 6).
Resultados e Discussão
Recentes publicações de revisão de literatura abordam a relação entre M. oleifera e seus efeitos hipoglicemiantes. Porém, muitas não incluem nas discussões os resultados acerca dos estudos in vitro que podem fornecer informações sobre o possível mecanismo de ação de M. oleifera.
No escopo dessa pesquisa, percebeu-se que dos 43 estudos não clínicos (12 - in vitro e 31 - in vivo), o uso da M. oleifera apresentou duas vertentes principais[43-45]: uma com ênfase nas propriedades nutracêuticas, com uso das folhas in natura[14] ou na forma de droga vegetal[46-50]; e outra com foco nas propriedades farmacoterapêuticas, com o uso das folhas em apresentações como comprimidos[51], contendo o pó das folhas secas (TABELAS 1 - 2). Cabe ressaltar que para uso terapêutico o ideal seria utilizar extrato vegetal seco padronizado ou quantificado, cujo controle é relacionado ao teor de marcadores terapêuticos e ativos, respectivamente ou "outros extratos", cujo controle é por é por meio de um teor referência de marcadores analíticos, como forma de garantir a segurança, eficácia e qualidade[18]. Neste caso, estima-se o desenvolvimento de um fitoterápico, sendo considerado um produto tecnicamente elaborado, com registro de medicamento e indicação terapêutica. No entanto, observa-se no caso da moringa o grande número de produtos comercializados, como cápsulas, que contêm o pó das folhas secas. Os resultados obtidos com o uso dos extratos que contêm as substâncias que foram extraídas da matriz vegetal não podem ser extrapolados ao efeito farmacológico do consumo do pó de uma planta, fator que dificulta a análise comparativa entre os estudos.
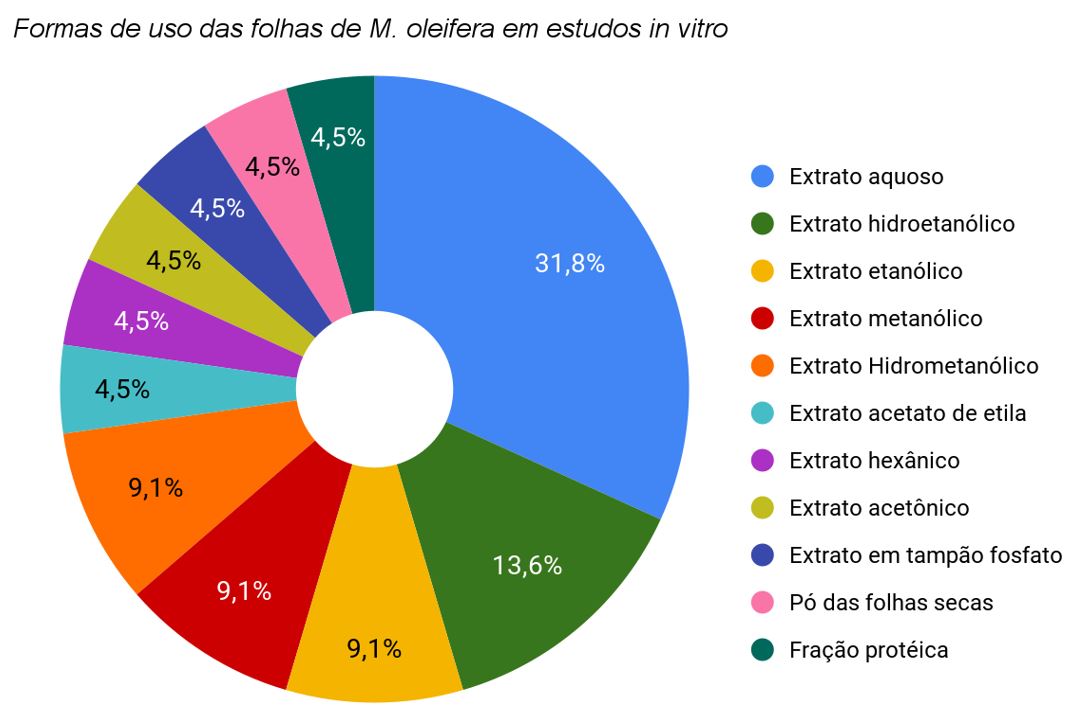
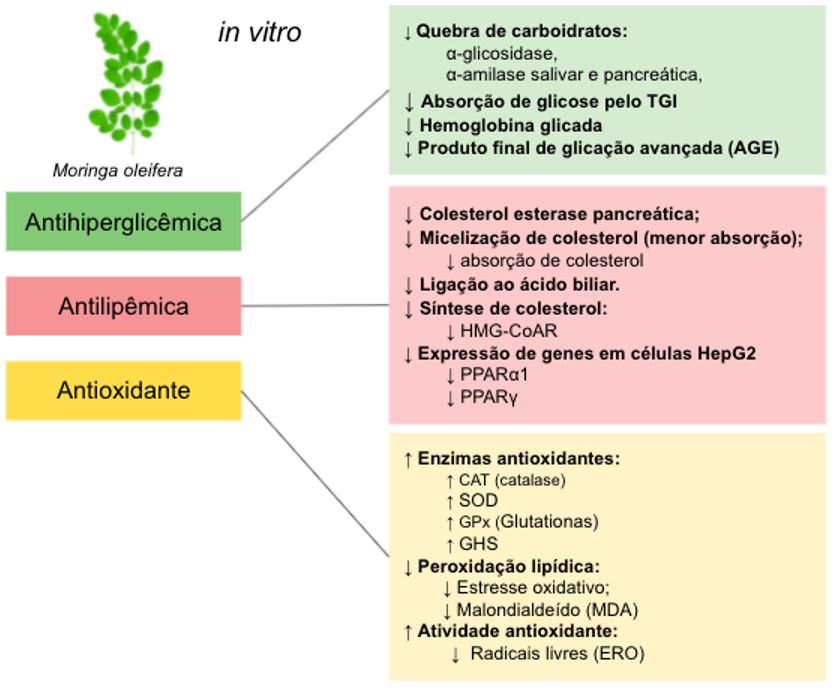
No que se refere aos estudos in vitro analisados neste estudo (TABELA 1, GRÁFICO 1 e 2), a maioria dos extratos avaliados foi de natureza aquosa (7 estudos) ou hidroetanólica (3 estudos). Quanto à atividade anti-hiperglicemiante, percebeu-se que os principais mecanismos de ação estudados foram a inibição das enzimas α-amilase e α-glicosidase que são responsáveis pela digestão de carboidratos, ocasionando a redução da glicemia pós-prandial e, por conseguinte, da hemoglobina glicada, contribuindo assim para a normalização da glicemia[52].
O extrato aquoso na concentração de 6,49 e 4,73 µg/mL promoveu inibição significativa IC50 da α-amilase pancreática e da α-glicosidase respectivamente[53]. Adisakwattana e Chanathong[52], também avaliaram o extrato aquoso e, observaram a inibição dessas enzimas que foi relacionada à presença de fenois, flavonoides e taninos. Em pesquisa mais recente, amostras concentradas de polissacarídeos obtidos de frações de extratos etanólicos das folhas de M. oleifera, preparado com auxílio de microondas, também demonstraram redução significativa na atividade dessas enzimas, sendo que a fração MLP-3 na concentração de 0,1 mg/mL apresentou maior capacidade com um percentual de inibição de 88,27% sobre α-amilase e 89,68% sobre a α-glicosidase[54].
Ocorreu discrepância em relação ao efeito sobre a lipase pancreática, uma vez que em um estudo utilizando extrato aquoso das folhas não foi verificada inibição da atividade da enzima [52]. No entanto, em outro trabalho, o uso do pó das folhas, secas em diferentes temperaturas, apresentou resultado efeito inibitório sobre a enzima[48].
A ação antioxidante foi relatada para o extrato hidrometanólico na concentração de 2,5 a 10 mg/mL ao inibir de 10-45% a formação de produtos finais de glicação avançada, o que poderia indicar uma ação preventiva de complicações diabéticas[55]. Também foi observada ação antioxidante para o extrato aquoso na concentração de 0,5 a 2,0 mg/mL, que apresentou um percentual de inibição de 14,52-40,65%[56]. Tal efeito pode ainda ser visto nos testes DPPH com extrato metanólico na concentração de 30 µg/mL que inibiu 33,19% dos radicais livres e com o extrato aquoso que apresentou IC50 na concentração de 14,18 µg/mL[53-57].
Alguns estudos demonstram que as folhas de M. oleifera impedem os danos oxidativos por serem capazes de aumentar os níveis de enzimas antioxidantes no fígado, como superóxido dismutase, catalase, glutationa peroxidase, glutationa transferase e glutationa redutase; aumentar os níveis de glutationa reduzida, diminuir significativamente a peroxidação lipídica e apresentar efeito hepatoprotetor[55,58-60].
A capacidade antihiperglicemiante e antioxidante dos extratos foi relacionada à presença de alguns compostos bioativos em sua composição, em especial à elevada concentração de compostos polifenólicos, ácidos fenólicos, flavonoides (canferol, rutina, quercetina-3-glicosídeo), taninos condensados, dentre outros, como glicomoriginina, β-caroteno, vitaminas C e E e polissacarídeos[50,53,54,61-64]. Porém, nenhum estudo avaliou o teor das substâncias bioativas, somente os teores totais de fenois, flavonoides e flavonois, ou indicou algum metabólito como sendo o marcador ativo da espécie. Em outros estudos com extratos etanólicos e metanólicos os principais flavonoides, obtidos das folhas de M. oleifera, foram o canferol e a quercetina[65,66].
Diversos relatos apontam que os efeitos deletérios da DM podem estar intimamente associados à ação de espécies reativas de oxigênio (ERO) geradas por peroxissomos, metabolismo mitocondrial, citocromo P450s e vários sistemas enzimáticos citosólicos, sendo por essa razão que o potencial antioxidante tem sido muito investigado[67]. Porém, Pojer e colaboradores[68] sugeriram que os efeitos promovidos pelos flavonoides na saúde dependem principalmente de mecanismos complexos, e não diretamente da atividade antioxidante, sendo necessários mais estudos que avaliem os mecanismos envolvidos. Embora se saiba que a espécie M. oleifera reduz a hiperglicemia, o mecanismo de ação ainda não é totalmente definido.
| Atividade farmacológica | País | Extrato/Fração/ Isolado | Método/Alvo | Fitoquímica | Resultados | Referências |
| Anti-hiperglicêmica | Tailândia | Extrato aquoso de folhas secas | Ensaio de inibição das enzimas α-glicosidase, α-amilase pancreática, lipase pancreática e colesterol esterase pancreática. Micelização de colesterol e ligação ao ácido biliar. | - | Constatou-se inibição da α-amilase pancreática, da α-glicosidase, da colesterol esterase, da micelização do colesterol e da ligação dos ácidos biliares. No entanto, o extrato não inibiu a lipase pancreática. | [52] |
| Antioxidante | Índia | Extrato aquoso de folhas frescas | Determinação de fenóis totais por Folin-Ciocalteu. Determinação de flavonoides e flavonois totais por espectrofotometria. Determinação do potencial antioxidante total pelo poder antioxidante de redução férrica. | Determinação de fenois e flavonoides totais. | Verificou-se que os fenois totais correspondem a 120 mg/g equivalente ácido gálico. O teor de flavonoides e flavonois totais corresponderam a 40,5 e 12,25 mg/g equivalente em quercetina, respectivamente. Quanto ao potencial antioxidante total do extrato foi de 85 µM/g. | [62] |
| Antioxidante | Tailândia | Extrato (20:80, v/v) de folhas secas | Ensaio de capacidade de absorção de radicais de oxigênio, determinação de fenóis e flavonoides totais. Ensaio de inibição da formação de AGE, da viabilidade celular e do estresse oxidativo e detecção de expressão gênica do metabolismo lipídico por células HepG2. | - | Observou-se que o teor total de antioxidantes foi de 9307 ± 364 equivalente trolox por mM/Kg, total de polifenois 218 ± 1 equivalente ácido gálico, flavonoides totais 286 ± 12 equivalentes quercetina. Na concentração de 2,5 a 10 mg/mL o extrato pode inibir 10-45% da formação de AGE. Concentração de 2000-3000 mg/L reduz significativamente a viablidade celular e > 100 mg/L o estresse oxidativo. A concentração de 600 mg/L reduziu significativamente a expressão de HMG-CoAR, e os genes PPARα1 e PPARγ em células HepG2. |
[55] |
| Antioxidante | Índia | Pó das folhas secas em diferentes temperaturas | Determinação do total de antioxidante pelo método do fosfomolibdênio e eliminação dos radicais livres por DPPH. Ensaio de inibição da α-glicosidase e da lipase | Determinação de fenóis e flavonoides totais. | Constatou-se com relação aos efeitos da temperatura do forno sobre o pó das folhas que a maior concentração de compostos fenólicos foi encontrada na temperatura de 100 °C por 15 min. com total de 33 mg/Kg equivalente ácido gálico. O máximo de 33,87 mg/Kg equivalente quercetina foi a 150 °C por 5 min. A maior atividade antioxidante foi observada na temperatura de 150 °C por 10 min. com 0,020 trolox equivalente, enquanto que a maior atividade DPPH foi a 150 °C por 30 min. As enzimas α-glicosidase e lipase pancreática tiveram sua atividade reduzida com aumento da temperatura e tempo de exposição. | [48] |
| Antioxidante | Tailândia | Extrato aquoso de folhas secas | Determinação da glicação da albumina sérica. Ensaio de inibição da formação de AGE e determinação de frutosamina e grupos tióis proteicos. | Determinação de fenólicos totais. | Observou-se que o teor de fenólicos totais correspondeu a 38,56 ± 1,50 mg equivalentes ácido gálico. A capacidade de inibir a formação de AGE numa concentração do extrato de (0,5-2,0 mg/mL) foi de 14,52 - 40,65% na glicação da glicose e 45,82 - 65,43 na glicação da frutose. Verificou-se também redução na concentração de frutosamina e de tióis proteicos. | [56] |
| Antioxidante | Nigéria | Extrato aquoso, hidrometanólico (50:50, v/v), Metanólico, hidroetanólico (50:50, v/v) e Etanólico, do pó de folhas secas |
Determinação da atividade antioxidante. | Determinação qualitativa de alcaloides, esteroides, terpenoides, saponinas, flavonoides, fenois, glicosídeos cardiotônicos, glicosídeos cumarínicos e antraquinonas. | Nenhuma variação fitoquímica foi encontrada nos extratos. O extrato 100% metanólico apresentou a maior capacidade inibitória de radicais livres no teste DPPH (33,19%) em 300 µg/mL. | [57] |
| Anti-hiperglicêmica | Bangladesh | Extrato hidroetanólico (80%) do pó de folhas secas. | Determinação da inibição da atividade da α-amilase. in situ: de seis segmentos diferentes do trato gastrointestinal (GI), para avaliar potencial em interferir na absorção da glicose a nível intestinal. |
- | Foi elucidado que M. oleifera é capaz de inibir a absorção de glicose pela inibição da α-amilase. Constatou-se redução significativa da atividade da α-amilase após 1-1,5 h. O pó das folhas apresentou elevada capacidade de adsorção de glicose em diferentes concentrações de glicose em solução. | [69] |
| Anti-hiperglicêmica | China | Frações ricas em polissacarídeos da solução etanólica a 40% (MLP-1), 60% (MLP-2) e 80% (MLP-3). | Determinação da inibição da atividade das enzimas α-amilase e α-glicosidase. | Polissacarídeos xilose, manose, glicose, galactose e arabinose) | Todas as frações conseguiram reduzir de forma significativa as atividades das enzimas α-amilase e α-glicosidase, porém a MLP-3 na concentração de 0,1 mg/mL reduziu em 88,27% a primeira e 89,68% a segunda. | [54] |
| Anti-hiperglicêmica e antioxidante |
Uganda | Extrato aquoso, de folhas secas ao sol trituradas | Determinação de atividade antioxidante e quelação de metais (Fe2+ e Cu2+). Ensaio de inibição da α-amilase pancreática e da α-glicosidase. Determinação da peroxidação lipídica induzida por Fe2+ em isolados homogeneizados do pâncreas de ratos. |
Determinação de fenois por CLAE-DAD: isoquercitrina 64,53 mg/g; ácido clorogênico 50,69 mg/g; quercetina 47,91 mg/g; ácido elágico 33,15 mg/g; ácido gálico 32,45 mg/g; quercitrina 29,42 mg/g; canferol 18,23 mg/g; rutina 15,27 mg/g; epicatequina 10,03 mg/g, e catequinas 9,98 mg/g. Determinação de fenólicos totais: 29,20 mg por equivalente grama de ácido gálico. Determinação de flavonoides totais: 17,48 mg por equivalente grama de quercetina. |
Observou-se inibição significativa da α-amilase pancreática e da α-glicosidase com IC50 correspondente a 6,49 e 4,73 µg/mL respectivamente. Verificou-se elevado potencial antioxidante com IC50 do DPPH de 14,18 µg/mL e a IC50 na quelação do cobre e do ferro foi de 3,14 µg/mL e 3,23 µg/mL respectivamente. Em relação ao pâncreas homogeneizado na presença de Fe2+, a IC50 na redução da formação de ácido malondialdeído (MDA) fruto da peroxidação lipídica foi de 27, 85 µl/mL. |
[53] |
| Anti-hiperglicêmica | Indonésia | Extrato em tampão fosfato de folhas frescas e de folhas secas nas concentrações de: 1%, 5%, 10% e 15%. | Inibição da atividade da enzima α-glicosidase. | - | Verificou-se maior capacidade inibitória da α-glicosidase nos extratos das folhas frescas que nos extratos de folhas secas, com maior inibição na concentração de 15%, cuja atividade inibitória foi de 83,94% e 81,39%, respectivamente, em pH 7. | [70] |
| Anti-hiperglicêmica, antioxidante, antimicrobiana e antifúngica | África do Sul | Extrato etanólico, hidrometanólico (50%) acetônico e aquoso, do pó das folhas secas, da raiz principal e das raízes laterais. | Determinação de atividade antioxidante, potencial redutor férrico (FRAP) e inibição da atividade da α-glicosidase. Determinação de fenólicos totais. Bioensaio de atividade antifúngica (Candida albicans) e de atividade antimicrobiana. | Fenois, taninos e flavonoides | As folhas apresentam maior teor de fenólicos. Todos os extratos apresentaram fraca atividade antifúngica. As folhas apresentaram melhor atividade antimicrobiana. O teste DPPH demonstrou que todas as partes da planta possuem elevado potencial antioxidante, com destaque de EC50 para as raízes: raiz principal (0,057 µg/mL), raízes laterais (1,23 µg/mL) e folhas (20,54 µg/mL). Percebeu-se que as folhas obtiveram maior potencial redutor férrico. Na atividade antidiabética as folhas apresentaram maior atividade, inclusive assemelhando-se ao padrão (acarbose). | [63] |
| Anti-hiperglicêmica | Nigéria | Extrato aquoso (decocção), metanólico, acetato de etila e hexânico (soxhlet) de folhas, raízes e sementes. | Inibição da atividade das enzimas α-amilase e α-glicosidase. Atividade de antiglicação. | - | Constatou-se que o extrato metanólico e o hexânico das folhas, na concentração de 10 mg/mL apresentaram maior inibição da α-amilase com IC50 de 8,217 ± 0,792 mg/mL e 9,397 ± 0,298 mg/mL respectivamente. Quanto à α-glicosidase, o extrato hexânico das raízes, seguido do extrato aquoso das folhas, ambos na concentração de 1 mg/mL, promoveram maior inibição com IC50 respectivo de 0,382 ± 0,006 mg/mL e 1,480 ± 0,017 mg/mL. O extrato hexânico das raízes e o aquoso das sementes obtiveram maior potencial antiglicação com IC50 de 0,772 ± 0,040 mg/mL e 0,882 ± 0,046 mg/mL. | [64] |
| AGE: do inglês, Produtos finais de glicação avançada; HMG-CoAR: 3-hidroxi-3-metil-glutaril-CoA redutase; PPAR (⍺1, ɣ): Receptores ativados por proliferadores de peroxissomos. | ||||||
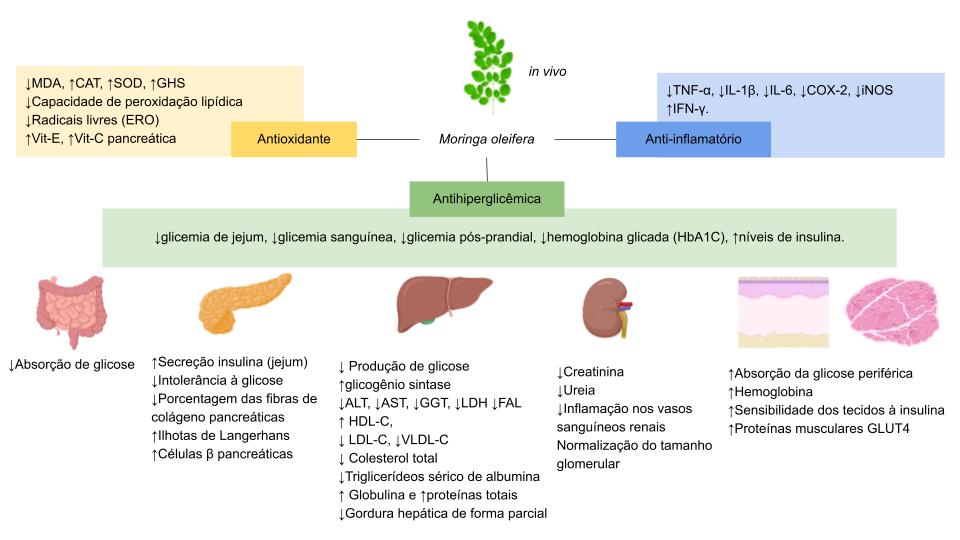
No que concerne aos estudos in vivo (TABELA 2), além da ação anti-hiperglicêmica, outras atividades como antidislipidêmica (redução do perfil lipídico), antioxidante (aumento das enzimas antioxidantes e redução da peroxidação lipídica), anti-inflamatória (aumento de IFN-γ e redução de TNF-α, IL-6, IL-1β, dentre outras), hepatoprotetora (redução de ALT, AST e GGT), renoprotetora (redução da creatinina e ureia), cardioprotetora, retinoprotetora, cicatrizantes e toxicológicas foram avaliadas. A maior parte dos estudos utilizou extratos aquosos, seguido dos etanólicos, metanólicos, hidroetanólico e fração butanólica do extrato hidroetanólicos, tendo como matéria-prima o pó das folhas secas ou as folhas frescas, sendo que apenas um estudo avaliou o uso de folhas secas inteiras[71], sem estar na forma de pó (GRÁFICO 2 e 3). Outro trabalho, todavia, analisou comprimidos do pó das folhas secas administrado em animais (os comprimidos eram reconstituídos em 0,5 mL de água de forma que cada animal do grupo controle recebia através de seringa de 1 mL dose de 10 mg/Kg do comprimido)[51]. As doses administradas apresentaram amplo intervalo variando de 50 a 1000 mg/Kg, promovendo, sem exceção, redução da glicemia, tendo maior potencialidade a dose de 600 mg/Kg do extrato metanólico, reduzindo-a em 84%, com aumento do número dos receptores GLUT 4 musculares responsáveis pelo transporte da glicose para dentro das células[72]. Em outro estudo, o extrato etanólico em doses de 200, 400 e 600 mg/Kg também elevou tais receptores ao ativar a via insulino-dependente de Akt, demonstrando a potencial capacidade desses derivados vegetais em reduzir a glicemia[73].
Doses a partir de 100 mg/Kg ocasionaram elevação da insulina plasmática e redução da resistência à insulina, ou seja, aumento da tolerância à glicose como consequência da maior sensibilização dos tecidos musculares, hepáticos e adiposos à insulina. Estes efeitos podem estar intrinsecamente relacionados tanto com o aumento das ilhotas de langerhans, quanto com a regeneração e aumento das células β-pancreáticas e dos hepatócitos, sendo constatados em extratos aquosos nas doses de 200 e 250 mg/Kg[74,75]. Ainda com relação à elevação da insulina plasmática, Attakpa e colaboradores[73] observaram que a dose de 400 mg/Kg do extrato etanólico promoveu níveis condizentes com a normalidade.
Cabe ainda ressaltar que, dentre os estudos, apenas dois avaliaram a concentração da hemoglobina glicada, constatando, por conseguinte, sua redução, nas doses de 200 e 300 mg/Kg[76, 77]. Sendo assim, torna-se clara a necessidade de mais estudos que preconizam esse parâmetro essencial ao estudo da DM, uma vez que é indicador dos níveis glicêmicos do indivíduo ao longo dos últimos 3 a 4 meses[22].
Ademais, o extrato hidroetanólico de M. oleifera a 95% (v/v) apresentou alta atividade anti-hiperglicêmica, reduziu significativamente a concentração de glicose no sangue em ratos diabéticos (P <0,01), que foi relacionada à presença de quercetina 3- β-D-glicosídeo e canferol-3-O-glicosídeo[78].
Waterman et al.[79] avaliaram um extrato aquoso das folhas M. oleifera concentrado de isotiocianatos, encontrando 4-[(⍺-L-ramnosiloxi)benzil] isotiocianato e 4-[(4-O-acetil-⍺-L-ramnosiloxi)benzil]isotiocianato, que promoveram em ratos C57BL/6L significativa redução no ganho de peso corporal, redução da adiposidade hepática, gliconeogênese, insulina, colesterol e biomarcadores do processo inflamatório; além disso, aumento também da sinalização e sensibilização à insulina.
Aju et al.[77] avaliaram o extrato metanólico das folhas na dose de 300 mg/Kg e identificaram os compostos: ácido heptadecanóico, ácido hexadecanóico, Dl-⍺-tocoferol, ácido 11, 14, 17-eicosatrienóico e 9, 12, 15-octadecatrienóico.
| Atividade farmacológica | País | Planta | Extrato/fração | Dose/Via/ Duração |
Método | Modelo animal | Resultados | Referências |
| Anti-hiperglicêmica | Japão | Pó das folhas secas | Inexistente | 200 mg/Kg, oral (gavagem, diluído em água), 1 dia | Ratos propensos à hiperglicemia (Goto-Kakizaki) | Ratos machos Goto-Kakizaki e Wistar | Foram observadas redução da glicose sanguínea e da intolerância à glicose em ambos tipos de ratos. | [46] |
| Anti-hiperglicêmica e antidislipidêmica | Bangladesh | Pó grosso das folhas secas | Etanólico | 200 mg/Kg, intraperitoneal, 7 dias | Ratos induzidos por 100 µL de adrenalina, via intraperitoneal por 5 dias consecutivos | Ratos albinos | Constatou-se redução significativa da concentração da glicose sérica, do colesterol e dos triglicerídeos. | [80] |
| Anti-hiperglicêmica | Índia | Folhas frescas | Aquoso | 100, 200 e 300 mg/Kg, oral, 21 dias | DM induzida por STZ | Ratos machos albinos Wistar | Observou-se que a dose de 200 mg/Kg foi a mais efetiva na redução da glicemia sanguínea (redução de 69,2%) e da glicemia pós-prandial (redução de 51,2%) principalmente nos ratos severamente diabéticos. Além disso, verificou-se também um aumento de 10,9% na hemoglobina. | [14] |
| Anti-hiperglicêmica e antidislipidêmica | Índia | Pó das folhas secas | Aquoso | 200 mg/Kg, oral, 60 dias | Ratos insulino-dependentes por dieta rica em frutose e ratos diabéticos induzidos por STZ. | Ratos machos Wistar | Verificou-se que a dose de 200 mg/Kg inibiu o ganho de massa corporal nos ratos insulino-resistentes (IR) e evitou a perda de massa excessiva nos ratos diabéticos (STZ). Além disso, preveniu a elevação da glicose sanguínea nos ratos IR, bem como elevou sua sensibilidade à insulina, reduzindo seus níveis plasmáticos. No grupo dos ratos STZ, elevou-se a concentração da insulina plasmática normalizando a glicose sanguínea. Quanto ao perfil lipídico, verificou-se redução da concentração sanguínea de triglicerídeos, colesterol total, LDL-C e VLDL-C em todos os grupos tratados com extrato e elevação do HDL-C nos ratos STZ. | [81] |
| Anti-hiperglicêmica e antioxidante | Egito | Pó das folhas secas | Aquoso | 200 mg/Kg, oral, 8 semanas | DM induzida por STZ | Ratos machos albinos Sprague-Dawley | Verificou-se redução significativa na concentração plasmática da glicose em jejum, bem como elevação sérica de GHS e redução de MDA demonstrando seu potencial anti-hiperglicêmico e antioxidante. Ademais, notou-se crescimento significativo nas áreas de coloração roxa de Gomori e redução na porcentagem das fibras de colágeno pancreáticas, além de aumento nas ilhotas de Langerhans e no número de células β pancreáticas | [75] |
| Anti-hiperglicêmica | Nigéria | Comprimido de pó das folhas secas | Inexistente | 100, 200, 300 mg/Kg, oral (dissolvido em 0,5mL de água), 1 dia, única dose | DM induzida por aloxano | Ratos Wistar albinos de ambos os sexos | Após 8 horas da administração da dose, observou-se redução máxima da glicose sanguínea em 54,4%, 72,5% e 79,2% para os grupos tratados com as doses de 100, 200 e 300 mg/Kg respectivamente, sendo mais efetivas que o fármaco padrão glibenclamida com apenas 40,5%. | [51] |
| Anti-hiperglicêmicaantidislipidêmica e hepatoprotetora |
Egito | Pó das folhas secas | Aquoso | 250 mg/Kg, oral, 18 dias | DM induzida por aloxano | Ratos fêmeas albinas Wistar | Observou-se a normalização dos níveis séricos de glicose, colesterol e MDA nos ratos diabéticos. Além disso, houve regeneração dos danos causados aos hepatócitos e às células β pancreáticas. | [74] |
| Anti-hiperglicêmica e toxicológica | Nigéria | Pó das folhas secas | Etanólico | 200 mg/Kg, oral, 2 x ao dia, 5 dias | DM induzida por aloxano | Ratos albinos adultos Wistar de ambos os sexos | Constatou-se intensa redução na concentração plasmática da glicose, bem como ausência de citotoxicidade. Porém, verificou-se redução na concentração de bicarbonato plasmático indicando a possibilidade de intoxicação por acidose. Vale salientar que tal redução foi menor quando comparada com os ratos tratados com metformina. | [82] |
| Anti-hiperglicêmica e antioxidante | Nigéria | Pó das folhas secas de M. oleifera; Pó das sementes de Myristica fragrans |
Aquoso | Doses não definidas, oral, 1 semana | DM induzida por aloxano | Ratos machos Wistar albinos | Ambos extratos promoveram redução significativa da concentração de glicose plasmática. Além disso, observou-se redução significativa na concentração plasmática de MDA e elevação da GHS, GPx, CAT e SOD. | [83] |
| Anti-hiperglicêmica e antidislipidêmica | Inglaterra | Pó das folhas | Metanólico | 300, 600 mg/Kg, oral, 6 semanas | DM induzida por aloxano | Ratos machos Wistar | Observou-se que ambas as doses do extrato promoveram a melhora da tolerância intraperitoneal da glicose nos ratos diabéticos, sem diferenças significativas entre si. A redução na concentração da glicose sanguínea foi de 76% e 84% nas dosagens de 300 e 600 mg/Kg respectivamente, além de elevar a concentração plasmática de insulina. Também houve redução nos níveis de triglicerídeos e colesterol plasmático, inibição do aumento do LDL-C e elevação do HDL-C em ambas as dosagens. A dose de 300 mg/Kg promoveu aumento significativo da enzima glicogênio sintase e a absorção de glicose nos tecidos tratados com extrato foi de 49% e 59% com as dosagens correspondentes a 300 mg e 600 mg/Kg. | [72] |
| Anti-hiperglicêmica | Estados Unidos | Folhas frescas | Aquoso concentrado em isotiocianatos | Dieta muito rica em gordura administrada juntamente com 5% do extrato concentrado ad libitum, oral, 3 meses | Obesidade induzida por dieta rica em gorduras. | Camundongos machos C57BL/6J | Verificou-se redução na concentração de glicose sanguínea no teste de intolerância à glicose, bem como nos níveis de insulina, leptina, resistina e colesterol. Vale salientar que a sensibilidade dos tecidos à insulina também foi elevada. | [79] |
| Anti-hiperglicêmica e toxicológica | Egito | Pó das folhas secas | Inexistente | 0, 150, 329, 485 mg/Kg, oral (incorporado na alimentação), 56 dias | Animais sadios | Coelhos machos Nova Zelândia brancos | Constatou-se redução significativa na concentração da glicose plasmática nas doses de 150 e 329 mg/Kg, bem como aumento na hemoglobina. Contudo, a dose de 485 mg/Kg causou deformação de eritrócitos, danos aos tecidos hepáticos e renais, além de elevar a glicose plasmática. | [47] |
| Anti-hiperglicêmica e antidislipidêmica | Paquistão | Pó das folhas secas | Etanólico | 0,125, 250, 500, 1000 mg/Kg, oral, 14 dias | DM induzida por STZ | Ratos machos Sprague-Dawley | Foi observado que a dose mais efetiva para a redução da concentração plasmática da glicemia foi a de 1000 mg/Kg, com redução de 16% no teste agudo e 53% no teste subcrônico. Com relação a perda de peso corporal, quanto maior a dose, maior a perda de peso corporal. Além disso, as doses de 250 e 500mg/Kg elevaram o HDL-C e reduziram o LDL-C e o colesterol total. | [84] |
| Anti-hiperglicêmica e retinoprotetora | Nigéria | Pó das folhas secas | Etanólico | 300 mg/Kg extrato; 300 mg/Kg extrato + sitagliptina 50 mg/Kg, oral, 42 dias | DM induzida por aloxano | Ratos Wistar de ambos os sexos | Foi constatado que quando administrados de forma isolada a sitagliptina e o extrato apresentam propriedades anti-hiperglicêmicas. Contudo, quando administrados de forma concomitante essa atividade é reduzida acarretando danos na retina como lesões e catarata. Vale salientar que a administração de 300 mg/Kg do extrato inibiu danos na retina. | [85] |
| Anti-hiperglicêmica e antioxidante | Egito | Pó das folhas secas | Aquoso | 100 mg/Kg, oral, 14 dias | DM induzida por aloxano | Ratos albinos | Foi verificado nos ratos diabéticos tratados com o extrato redução na glicemia de jejum, elevação nos níveis de insulina e redução da resistência à insulina, bem como redução nos níveis de creatinina e ureia plasmáticos. Além disso, a capacidade antioxidante total permaneceu inalterada quando comparada com o grupo controle e houve aumento significativo na produção de IFN-γ. | [86] |
| Anti-hiperglicêmica | Benin | Pó das folhas | Etanólico | 200, 400, 600 mg/Kg, oral, 8 semanas | Obesidade e estado pré-diabético induzido por dieta rica em gorduras | Camundongos machos C57BL/6 | Observou-se que todas as doses conseguiram reduzir a concentração glicêmica no teste de tolerância à glicose a nível não-diabético. O extrato de 400 mg/Kg obteve maior aumento na produção de insulina, sendo que todos os extratos reduziram a concentração plasmática de glicose a níveis não-diabéticos. É importante destacar que também ativam a via insulino-dependente de Akt (proteína-quinase) elevando a produção de proteínas musculares GLUT4. | [73] |
| Anti-hiperglicêmica, antidislipidêmica e cardioprotetora | Egito | Pó das folhas secas | Aquoso | 200, 400 mg/Kg, oral, 30 dias | DM induzida por aloxano | Ratos machos albinos adultos | Constatou-se que ambas as doses elevaram significativamente a concentração de insulina sérica, reduziram a glicose plasmática, bem como o colesterol, os triglicerídeos, a creatinina e a ureia sérica; sendo a dose de 400 mg/Kg mais efetiva. Pode-se também abordar que essa dose restaurou a aparência do músculo cardíaco com discos intercalares intactos e sarcoplasmas e núcleos normais. | [87] |
| Anti-hiperglicêmica | Malásia | Pó das folhas secas | Hidroetanólico (95%, 75%, 50%, 25% (v/v);
Aquoso Fração butanólica do extrato hidroetanólico a 95% |
Teste hipoglicêmico em ratos saudáveis, 1000 mg/Kg, oral, 1 dose. Teste de tolerância à glicose intraperitoneal em ratos saudáveis, 500 mg/Kg de glicose, intraperitoneal, 1 dose Teste anti-hiperglicêmico em ratos diabéticos dose múltipla, 1000 mg/Kg, oral, 14 dias Teste anti-hiperglicemico da fração butanólica, 500 mg, Oral, 1 dose |
DM induzida por STZ | Ratos machos Sprague-Dawley | Os extratos hidroetanólicos (95, 75, 50, 25%) e o aquoso não apresentaram efeitos hipoglicemiantes nem promoveram mudanças no teste intraperitoneal de tolerância à glicose em ratos saudáveis. Porém, nos ratos diabéticos, todos os extratos, em doses múltiplas promoveram reduções significativas na concentração de glicose plasmática após 7 e 14 dias de tratamento com destaque para o extrato hidroetanólico a 95% e o aquoso que reduziram 64,07% e 60, 06% respectivamente. No tratamento com dose única, os extratos 95% e 75% conseguiram reduzir a glicose em 30,28 e 18,05% respectivamente. A fração butanólica do extrato etanólico a 95% realizou atividade significativa anti-hiperglicêmica, e foram identificados os compostos ácidos criptoclorogênico, canferol 3-O-glicosídeo e quercetina 3-β-glicosídeo. | [78] |
| Anti-hiperglicêmica e antiesteatose hepática | Coreia do Sul | Pó das folhas secas | Aquoso fermentado por Lactobacillus sakei, L. plantarum, e L. brevis | 250 mg/Kg, oral, 10 semanas | Obesidade induzida por dieta rica em gorduras | Camundongos machos C57BL/6J | Os ratos tratados com o extrato fermentado apresentaram menor tolerância à glicose e significativa redução nos níveis de gordura hepática (redução da expressão dos múltiplos genes sintetizadores de lipídios e histologia hepática), assemelhando-se a dos ratos saudáveis. Enquanto isso, os ratos tratados com extrato não fermentado conseguiram reduzir a gordura hepática de forma parcial. | [88] |
| Anti-hiperglicêmica,anti-inflamatória, antioxidante e renoprotetora | África do Sul | Pó das folhas secas | Metanólico | 250 mg, oral, 6 semanas | DM induzida por STZ | Ratos machos adultos Wistar | Verificou-se redução significativa da concentração plasmática da glicose nos ratos tratados, bem como em seu peso total e relativo renal. Também, percebeu-se redução nos níveis de creatinina e MDA; elevação nas enzimas CAT, SOD e GHS, com redução da GPx. Além disso, Interleucina-6 e TNF-α foram reduzidas e os danos renais foram reduzidos quando comparados com o grupo diabético sem tratamento. | [89] |
| Anti-hiperglicêmica e antioxidante | Brasil | Pó das folhas frescas | Aquoso/ Fração rica de Proteína Isolada das Folhas de M. oleifera (MO-LPI) | 500 mg/Kg, intraperitoneal, 7 dias | DM induzida por aloxano | Camundongos machos | Observou-se redução significativa de 56,2% da concentração da glicose plasmática nos ratos tratados. Nenhuma alteração foi encontrada nos níveis de insulina plasmática. Também não se constatou alteração com relação aos níveis de SOD, porém a atividade da CAT aumentou 58,6% nos ratos tratados. Já os níveis de MDA nos ratos tratados foram semelhantes aos dos ratos não diabéticos. | [90] |
| Anti-hiperglicêmica, antidislipidêmica, anti-inflamatória e renoprotetora. | Coreia do Sul | Folhas secas | Etanólico | 150 mg/Kg, oral, 5 semanas | Camundongos C57BLKS/J Iar-m+/Leprdb |
Camundongos C57BLKS/J Iar-m+/Leprdb |
Verificou-se redução significativa na concentração da glicose sérica dos ratos tratados com o extrato, além de elevação nos níveis de insulina e redução do triglicerídeo e do LDL-C. Também se observou redução inflamatória nos vasos sanguíneos renais e normalização do tamanho glomerular com redução expressiva dos genes TNF-α, IL-1β, IL-6, COX-2, e iNOS. | [71] |
| Anti-hiperglicêmica | Índia | Pó das folhas secas | Aquoso | 100 mg/Kg, oral, 3 semanas (ratos induzidos por STZ) 200 mg/Kg, oral,
3 semanas (ratos induzidos por dieta rica em gorduras) |
DM induzida por STZ em ratos Wistar;
DM induzida por dieta rica em gorduras e ratos C57BL/6 |
Ratos Wistar fêmeas
Camundongos fêmeas C57BL/6 |
As doses de 100, 200 mg/Kg reduziram os níveis de glicose sanguínea nos ratos diabéticos. Além disso, reduziram a tolerância à glicose em ratos normais e também nos diabéticos. | [91] |
| Anti-hiperglicêmica e indutora de foliculogênese | Indonésia | Folhas frescas | Aquoso | 250, 500 mg/Kg, oral, 14 dias | Síndrome do Ovário Policístico (SOP) induzido por testosterona | Ratas fêmeas Wistar adultas | Os extratos causaram redução significativa nos níveis de insulina quando comparado com o grupo controle SOP. Os extratos promoveram foliculogênese significativamente aumentada em número e diâmetros dos folículos de Graaf com melhores resultados que os ratos saudáveis dos grupos e os do grupo com SOP tratados com metformina. | [92] |
| Anti-hiperglicêmica e cicatrizante | Brasil | Pó das folhas secas | Aquoso | 100 mg/Kg, oral, 10 dias. | DM induzida por STZ | Ratos Wistar adultos | Observou-se redução significativa da concentração da glicose sanguínea nos ratos saudáveis ou diabéticos tratados com o extrato. Também se notou maior contração da área da ferida nos ratos tratados com o extrato, bem como redução significativa da expressão sérica de TNF-α, IL-1β e IL-6. | [93] |
| Anti-hiperglicêmica,anti-inflamatória, antidislipidêmica, renoprotetora e hepatoprotetora. |
Arábia Saudita | Pó das folhas secas | Etanólico/fração de acetato de etila | 200 mg/Kg, oral, 30 dias | DM induzida por STZ | Ratos machos Sprague-Dawley | Verificou-se, nos ratos tratados com o extrato, redução significativa da concentração de hemoglobina glicada, glicose sanguínea e elevação dos níveis de insulina. Constatou-se também aumento sérico de albumina, globulina e proteínas totais, bem como redução de creatinina, ALT, LDH e FAL. Outras reduções foram observadas no colesterol total, triglicerídeo total, LDL-C, porém houve aumento do HDL-C. Percebeu-se, além disso, diminuição de MDA e elevação na concentração de GPx, GST, CAT, SOD, Vit-E, GSH, e Vit-C pancreática. Por fim, observou-se redução significativa da expressão de TNF-α, IL-6 e IL-1β. | [76] |
| Anti-hiperglicêmica e antidislipidêmica | México | Pó das folhas secas | Inexistente | 700 mg/Kg, oral, 3 semanas | Síndrome Metabólica induzida por dieta rica em gorduras | Ratos machos Wistar | Observou-se redução na glicemia de jejum, na tolerância à glicose, nos níveis de triglicerídeos e na circunferência abdominal dos ratos tratados. | [49] |
| Anti-hiperglicêmica, antidislipidêmica antioxidante |
Malásia | Pó das folhas secas | Metanólico/composto isolado ácido gálico-4-O-β-D-glicopiranósideo (GAGP) | 100, 200 e 400 mg/Kg, oral, 4 semanas | DM induzida por aloxano | Ratos machos Sprague Dawley | As doses apresentaram redução significativa na concentração de glicose sanguínea já no 8° dia de tratamento, bem como diminuíram os níveis séricos de colesterol total, triglicerídeos, LDL-C, HDL-C, FAL, ureia e creatinina. Notou-se também aumento na atividade da CAT, níveis próximos à normalidade da GSH e redução significativa da capacidade de peroxidação lipídica. | [94] |
| Anti-hiperglicêmica | México | Pó das folhas secas | Inexistente | 50 mg/Kg, oral, 8 semanas | DM induzida por aloxano | Ratos machos Sprague Dawley | Constatou-se que os ratos diabéticos em tratamento com M. oleifera apresentaram redução na glicemia sanguínea quando comparados com os diabéticos sem tratamento. | [50] |
| Anti-hiperglicêmica e hepatoprotetora | África do Sul | Pó das folhas secas | Metanólico | 250 e 500 mg/Kg, oral, 54 dias | DM induzida por STZ | Ratos machos Wistar | Verificou-se que a glicemia de jejum dos ratos tratados com 500 mg/Kg foi significativamente reduzida, enquanto os ratos tratados com a dose de 250 mg/Kg não apresentaram tal diferença frente aos diabéticos não tratados. Ambos extratos elevaram a concentração plasmática da insulina em jejum, bem como reduziram a intolerância à glicose. Com relação às enzimas hepáticas, houve redução significativa de ALT, AST e GGT, sendo que a dose de 500 mg/Kg mais efetiva para GGT. Além disso, os ratos tratados com os extratos não apresentaram alterações ou danos hepáticos com os ratos diabéticos não tratados. | [95] |
| Anti-hiperglicêmica, antioxidante e cardioprotetora |
Índia | Pó das folhas secas | Metanólico | 300 mg/Kg, oral, 60 dias | DM induzida por STZ | Ratos machos albinos Sprague Dawley | Observou-se redução significativa até concentrações normais de glicose sanguínea periférica, glicose sérica e hemoglobina glicada (HbA1C) nos ratos diabéticos tratados com o extrato. Houve também elevação da insulina plasmática e das enzimas antioxidantes SOD, CAT, GPx e GSH. Além disso, percebeu-se redução de substâncias originadas pela peroxidação lipídica como as reativas do ácido tiobarbitúrico, hidroperóxidos e dienos conjugados. Por fim, constatou-se melhorias na histopatologia cardíaca ao se comparar com ratos diabéticos sem tratamento. | [77] |
| STZ: Estreptozotocina; LDL-C: Lipoproteína de baixa densidade; VLDL-C: Lipoproteína de muito baixa densidade; HDL-C: Lipoproteína de alta densidade; MDA: Malondialdeído; GHS: Glutationa redutase; GPx: Glutationa peroxidase; CAT: Catalase; SOD: Superóxido dismutase; IFN-γ: Interferon-gama; TNF-α: Fator de necrose tumoral alfa; IL (1β, 6): Interleucina; COX-2: Ciclo-oxigenase-2; iNOS: Óxido nítrico sintase induzível; LDH: Lactato desidrogenase; FAL: Fosfatase alcalina; GST: Glutationa S-tranferase; GGT: Gamaglutamiltransferase. | ||||||||
Como visto diversos estudos in vitro e in vivo têm mostrado evidências farmacológicas do potencial da espécie M. oleífera na redução dos níveis de glicemia (efeito anti-hiperglicemiante), por diferentes mecanismos propostos, indicando ser um agente promissor na proteção contra as complicações decorrentes da DM. No entanto, é importante mencionar que quase a totalidade dos trabalhos não apresenta uma caracterização do perfil cromatográfico dos extratos, tampouco uma análise do teor dos marcadores dos extratos. Portanto, não é possível correlacionar por meio dos estudos não clínicos a resposta farmacológica com a composição fitoquímica, pois nenhum estudo relacionou as propriedades farmacológicas à presença de determinado metabólito especial.
Paralelo a isso, nota-se também a ausência de busca pela identificação de biomoléculas ativas que estariam relacionadas a ligantes de múltiplos alvos, fitocomplexos, explorando o efeito "espingarda de ervas" ("herbal shotgun"), dessa forma, não está claro até que ponto os vários constituintes presentes nas preparações de M. oleifera se inter-relacionam através de efeitos aditivos ou de forma sinérgica com diferentes alvos; ou que se refere ao efeito de uma única substância agindo em um único alvo, a "bala de prata"[23].
Conclusão
Diante do exposto, ao final da análise dos estudos sobre o uso das folhas de M. oleifera para o tratamento do diabetes, aqui elencados, não foi possível concluir sobre sua eficácia e segurança não-clínica. Embora o tratamento com o pó das folhas e com extratos tenha exibido atividade antidiabética significativa nos estudos in vitro e in vivo, a ausência de padronização metodológica no desenvolvimento dos estudos e nos produtos avaliados diminui a força das evidências constatadas. Em suma, ainda que os resultados dos estudos não-clínicos sejam muito promissores para a ação antidiabética e tenham apresentado efeitos adversos apenas em doses acima das avaliadas nos estudos farmacológicos, mais pesquisas a longo prazo e estudos em humanos usando extratos com controle fitoquímico (quali e quantitativo) devem ser conduzidos para a obtenção de evidências clínicas confiáveis de segurança e eficácia. Adicionalmente, faz-se necessário ainda estabelecer o teor do(s) marcador(es) químico(s) para as folhas de M. oleifera que possa ser correlacionado à resposta farmacológica e assegurar a qualidade da matéria-prima.
Referências
1. Veiga Júnior VF, Pinto AC, Maciel MAM. Plantas medicinais: cura segura? Quim Nova. 2005; 28(3): 519-528. ISSN 0100-4042. [https://doi.org/10.1590/S0100-40422005000300026].
2. Khan H. Medicinal plants in light of history: recognized therapeutic modality. Evid Based Compl Altern Med. 2014; 19(3): 216-219. ISSN 1741-427X. [https://doi.org/10.1177%2F2156587214533346].
3. Raskin I, Ripoll C. Can an apple a day keep the doctor away?. Curr Pharm Des. 2004; 10: 3419-3429. ISSN 1381-6128. [https://doi.org/10.2174/1381612043383070].
4. Le Couteur P, Burreson J. Os botões de Napoleão: as 17 moléculas que mudaram a história. Rio de Janeiro: Zahar, 2006. ISBN 9788571109247.
5. Newman DJ, Cragg GM. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 2020. 83(3): 770-803. ISSN 1520-6025. [https://doi.org/10.1021/acs.jnatprod.9b01285].
6. Ma ZF, Ahmad J, Zhang H, Khan I, Muhammad S. Evaluation of phytochemical and medicinal properties of Moringa (Moringa oleifera) as a potential functional food. S Afr J Bot. 2020; 129: 40-46. ISSN 0254-6299. [https://doi.org/10.1016/j.sajb.2018.12.002].
7. Anwar F, Latif S, Ashraf M, Gilani AH. Moringa oleifera: a food plant with multiple medicinal uses. Phytother Res. 2007; 21: 17-25. ISSN 1099-1573. [https://doi.org/10.1002/ptr.2023].
8. Zaku SG, Emmanuel S. Tukur AA, Kabir A. Moringa oleifera: an underutilized tree in Nigeria with amazing versatility: a review. Afr J Food Sci. 2015; 9(9): 456-461. ISSN 1996-0794. [https://doi.org/10.5897/AJFS2015.1346] [https://academicjournals.org/journal/AJFS/article-full-text-pdf/85D538355442].
9. Barichella M et al. Nutritional characterisation of Zambian Moringa oleifera: acceptability and safety of short-term daily supplementation in a group of malnourished girls. Int J Food Sci Nutr. 2018; 70(1): 107-115. ISSN 0963-7486. [https://doi.org/10.1080/09637486.2018.1475550].
10. Moyo B, Masika PJ, Mar LJ, Hugo A, Muchenje V. Nutritional characterization of Moringa (Moringa oleifera Lam.) leaves. Afr J Biotechnol. 2011; 10(60): 12925-12933. ISSN 1684-5315. [https://doi.org/10.5897/AJB10.1599].
11. Leone A, Spada A, Battezzati A, Schiraldi A, Aristil J, Bertoli S. Cultivation, genetic, ethnopharmacology, phytochemistry and pharmacology of Moringa oleifera leaves: an overview. Int J Mol Sci. 2015; 16: 12791-12835. ISSN 1422-0067. [https://doi.org/10.3390/ijms160612791].
12. Gopalakrishnan L, Doryia K, Kumar DS. Moringa oleifera: a review on nutritive importance and its medicinal application. Food Sci Human Wellness. 2016; 5(2): 49-56. ISSN 2213-4530. [https://doi.org/10.1016/j.fshw.2016.04.001].
13. Gandji K, Chadare FJ, Idohou R, Salako VK, Assogbadjo AE, Kakai RLG. Status and utilization of Moringa oleifera Lam: a review. Afr Crop Sci J. 2018; 26(1): 137-156. ISSN 1021-9730. [http://dx.doi.org/10.4314/acsj.v26i1.10]
14. Jaiswal D, Rai PK, Kumar A, Mehta S, Watal G. Effect of Moringa oleifera Lam. leaves aqueous extract therapy on hyperglycemic rats. J Ethnopharmacol. 2009; 123: 392-396. ISSN 0378-8741. [https://doi.org/10.1016/j.jep.2009.03.036]
15. Lin M, Zhang J, Chen X. Bioactive flavonoids in Moringa oleifera and their health-promoting properties. J. Funct. Foods. 2018;47: 469-479. ISSN 1756-4646. [https://doi.org/10.1016/j.jff.2018.06.011].
16. Rangel MS. Moringa oleifera: um purificador natural de água e complemento alimentar para o nordeste do Brasil. 2007. Disponível em: [http://www.jardimdeflores.com.br/floresefolhas/A10moringa.htm]. Acesso em: 25 fev. 2020.
17. Silva GV, Souto JS, Santos JB. Cultivo de moringa: importância nutricional, uso e aplicações. Meio Ambiente (Brasil). 2019; 1(3): 23-32. ISSN 2675-3065. Disponível em: [https://meioambientebrasil.com.br/index.php/MABRA/article/view/38/36]. Acesso em: 22 mai. 2020.
18. Brasil. Agência Nacional de Vigilância Sanitária, ANVISA. RDC n° 26, de 13 de maio de 2014. Dispõe sobre o registro de medicamentos fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos. Diário Oficial da União, Poder Executivo, Brasília, 14 mai. 2014. Disponível em: [http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2014/rdc0026_13_05_2014.pdf]. Acesso em: 30 jul. 2019.
19. Carvalho ACB, Lana TN, Perfeito JPS, Silveira D. The brazilian market of herbal medicinal products and the impact of the new legislation on traditional medicines. J Ethnopharmacol. 2018; 212: 29-35. ISSN 0378-8741. [https://doi.org/10.1016/j.jep.2017.09.040]
20. Brasil. Agência Nacional de Vigilância Sanitária, ANVISA. RDC n° 243, de 26 de julho de 2018. Dispõe sobre os requisitos sanitários dos suplementos alimentares. Diário Oficial da União, Poder Executivo, Brasília, 27 jul. 2018. Disponível em: [http://www.in.gov.br/materia/-/asset_publisher/Kujrw0TZC2Mb/content/id/34379969/]. Acesso em: 30 jul. 2019.
21. Brasil. Agência Nacional de Vigilância Sanitária, ANVISA. Resolução-RE n° 1.478 de 03 de junho de 2019. Diário Oficial da União, Poder Executivo, Brasília, 04 jun. 2019. Disponível em: [https://crn7.org/index.php/ultimas-noticias/336-resolucao-re-n-1-478-de-3-de-junho-de-2019]. Acesso em: 11 ago. 2019.
22. Sociedade Brasileira de Diabetes (SBD). Diretrizes Sociedade Brasileira de Diabetes 2019-2020. São Paulo: Editora Clannad, 2019. 491p. Disponível em: [https://www.diabetes.org.br/profissionais/images/DIRETRIZES-COMPLETA-2019-2020.pdf]. Acesso em: 15 ago. 2019.
23. Artasensi A, Pedretti A, Vistoli G, Fumagalli L. Type 2 Diabetes Mellitus: a Review of Multi-Target drugs. Molecules. 2020; 25(8): 1-20. ISSN 1420-3049. [https://doi.org/10.3390/molecules25081987].
24. Mbikay M. Therapeutic potential of Moringa oleifera leave in chronic hyperglycemia and dyslipidemia: a review. Front. Pharmacol. 2012; 3(1): 1-12. ISSN 1663-9812. [https://doi.org/10.3389/fphar.2012.00024].
25. Padayachee B, Baijnath H. An overview of the medicinal importance of Moringaceae. J Med Plants Res. 2012; 6(48): 5831-5839. ISSN 1996-0875. [https://academicjournals.org/journal/JMPR/article-full-text-pdf/BA35BA323431].
26. Shahzad U, Khan MA, Jaskani JM, Khan IA, Korban SS. Genetic diversity and population structure of Moringa oleifera. Conserv. Genet. 2013; 11: 1161-1172. ISSN 1566-0621. [https://doi.org/10.1007/s10592-013-0503-x].
27. The Plant List. (2020). Version 1.1. Disponível em: [http://www.theplantlist.org/tpl1.1/record/tro-21400003]. Acesso em: 26 mar. 2019.
28. Ramachandran C, Peter KV, Gapalakrishnan PK. Drumstick (Moringa oleifera): a multipurpose indian vegetable. Econ Bot. 1980; 34(3): 276-283. ISSN 0013-0001. [https://doi.org/10.1007/BF02858648].
29. Alegbeleye O.O. How Functional Is Moringa oleifera? A review of its nutritive, medicinal, and socioeconomic potential. Food Nutr Bull. 2017; 39(1): 149-170. ISSN 0379-5721. [https://doi.org/10.11772F0379572117749814].
30. Nouman W, Basra SMA, Siddiqui MT, Yasmeen A, Gull T, Alcayde MAC. Potential of Moringa oleifera L. as livestock fodder crop: a review. Turk J Agric For. 2014; 38: 1-14. ISSN 1300-011X. [http://dx.doi.org/10.3906/tar-1211-66].
31. Santos ARF. Desenvolvimento Inicial de Moringa oleifera Lam. sob condições de estresse. São Cristóvão; 2010. Dissertação de Mestrado [Programa de Pós-Graduação e Estudos em Recursos Naturais] - Universidade Federal de Sergipe, UFS. São Cristóvão; 2010. Disponível em: [http://livros01.livrosgratis.com.br/cp134670.pdf]. Acesso em: 06 mar. 2020.
32. Seshadri S, Nambiar VS. Kanjero (Digera arvensis) and Drumstick Leaves (Moringa oleifera): Nutrient Profile and Potential for Human Consumption. In: Simopoulos AP, Gopalan C. World Review of Nutrition and Dietetics. Karger Medical and Scientific Publishers: Basel; 2003, v. 91: 41-59. [https://doi.org/10.1159/000069927].
33. Gupta S, Jain R, Kachhwaha S, Kothari SL. Nutritional and medicinal applications of Moringa oleifera Lam.: review of current status and future possibilities. J Herb Med. 2018; 11: 1-11. ISSN 2210-8033. [https://doi.org/10.1016/j.hermed.2017.07.003].
34. Panda DS, Ansari SA. Preformulation study on the gum of Moringa oleifera. Malays. J. Pharm. Sci. 2013; 11(2): 41-47. ISSN 1675-7319. [http://web.usm.my/mjps/mjps11022013/mjps11022013_5.pdf].
35. Fahey JW. Moringa oleifera: A review of the medical evidence for its nutritional, therapeutic, and prophylactic properties. Part 1. Trees Life J. 2005; 1(5): 1-15. ISSN 1559-1891. [https://doi.org/10.1201/9781420039078.ch12].
36. Mahmood KT, Mugal T, Haq IU. Moringa oleifera: a natural gift- a review. J Pharm Sci Res. 2010; 2(11): 775-781. ISSN 0975-1459. [https://pdfs.semanticscholar.org/9438/104f5f3da8ba1ae394e8f07118adcd25af07.pdf].
37. Pandey A, Pandey RD, Tripathi P, Gupta PP, Haider J, Bhatt S et al. Moringa oleifera Lam. (Sahijan) - A plant with a plethora of diverse therapeutic benefits: an updated retrospection. Med Arom Pl. 2012; 1(1): 2-8. ISSN 2167-0412. [https://doi.org/10.4172/map.1000101].
38. Muhammad HI, Asmawi MZ, Khan NAK. A review on promising phytochemical, nutritional and glycemic control studies on Moringa oleifera Lam. in tropical and sub-tropical regions. Asian Pac J Trop Biomed. 2016; 6(10): 896-902. ISSN 2588-9222. [https://doi.org/10.1016/j.apjtb.2016.08.006].
39. Vergara-Jimenez M, Almatrafi MM, Fernandez ML. Bioactive components in Moringa oleifera Leaves Protect against Chronic Disease. Antioxidants. 2017; 6(91): 1-13. ISSN 2076-3921. [https://doi.org/10.3390/antiox6040091].
40. Prabu M, Kumuthakalavalli R. Folk remedies of medicinal plants for snake bites, scorpions stings and dog bites in eastern Ghats of Kolli Hills, Tamil Nadu, India. IJRAP. 2012. 3(5): 696-700. ISSN 2229-3566. [https://doi.org/10.7897/2277-4343.03523].
41. Papoola JC, Obembe OO. Local knowledge, use pattern and geographical distribution of Moringa oleifera Lam. (Moringaceae) in Nigeria. J Ethnopharmacol. 2013; 150: 682-691. ISSN 0378-8741. [https://doi.org/10.1016/j.jep.2013.09.043]
42. Patel S, Thakur AS, Chandy A, Manigauha A. Moringa oleifera: a review of the medicinal and economic importance to the health and nation. Drug Invent Today. 2010. 2(7): 339-342. ISSN 0975-7619. [https://www.researchgate.net/publication/285761492].
43. Ahmad J, Khan I, Blundell R. Moringa oleifera and glycemic control: A review of current evidence and possible mechanisms. Phytother Res. 2019; 33(11): 2841-2848. ISSN 1099-1573. [https://doi.org/10.1002/ptr.6473].
44. Vargas-Sánchez K, Jaramillo EG, Reyes REG. Effects of Moringa oleifera on glycaemia and insulin levels: a review of animal and human studies. Nutrients. 2019. 11: 1-19. ISSN 2072-6643. [https://doi.org/10.3390/nu11122907].
45. Owens IFS, Dada O, Cyrus JW, Adedoyin OO, Adunlin G. The effects of Moringa oleifera on blood glucose levels: A scoping review of the literature. Complement Ther Med. 2020. 50: 1-8. ISSN 0965-2299. [https://doi.org/10.1016/j.ctim.2020.102362].
46. Ndong M, Uehara M, Katsumata S, Suzuki K. Effects of oral administration of Moringa oleifera Lam on glucose tolerance in Goto-Kakizaki and Wistar rats. J Clin Biochem Nutr. 2007; 40(3): 229-233. ISSN 1880-5086. [https://doi.org/10.3164/jcbn.40.229].
47. El-Badawi AY, EL-Wardany I, Abedo AA, Omer HAA. Haematological, blood biochemical constituents and histopathological responses of growing rabbits fed different levels of moringa leaves. Int J Chemtech Res. 2016; 9(4): 1011-1021. ISSN 0974-4290. [https://www.researchgate.net/publication/331821866].
48. Parwani L, Bohra Y, Gupta S, Kumar R. Effect of temperature on α-glucosidase, lipase inhibition activity and other nutritional properties of Moringa oleifera leaves: intended to be used as daily antidiabetic therapeutic food. J. Food Nutr Res. 2016; 55(1): 69-77. ISSN 1336-8672. [https://www.researchgate.net/publication/296585083].
49. López M, Ríos-Silva M, Huerta M, Cárdenas Y, Bricio-Barrios JA, Díaz-Reval MI et al. Effects of Moringa oleifera leaf powder on metabolic syndrome induced in male Wistar rats: a preliminary study. J. Int. Med. Res. 2018; 46(8): 3327-3336. ISSN: 0300-0605. [https://doi.org/10.1177%2F0300060518781726].
50. Villarruel-López A, López-de la Mora DA, Vazquéz-Paulino OD, Puebla-Mora AG, Torres-Vitela MR, Guerrero-Quiroz LA et al. Effect of Moringa oleifera consumption on diabetics rats. BMC Compl Altern Med. 2018; 18(127): 01-10. ISSN 2662-7671-0605. [https://doi.org/10.1186/s12906-018-2180-2].
51. Momoh MA, Chime AS, Kenechukwu FC. Novel drug delivery system of plant extract for the management of diabetes: an antidiabetic study. J Diet Suppl. 2013; 10(3): 252-263. ISSN 1939-0211. [https://doi.org/10.3109/19390211.2013.822454].
52. Adisakwattana S, Chanathong B. Alpha-glucosidase inhibitory activity and lipid-lowering mechanisms of Moringa oleifera leaf extract. Eur Rev Med Pharmacol Sci. 2011; 15: 803-808. ISSN 2284-0729. [https://www.researchgate.net/publication/51512950].
53. Jimoh TO. Enzymes inhibitory and radical scavenging potentials of two selected tropical vegetable (Moringa oleifera and Telfairia occidentalis) leaves relevant to type 2 diabetes mellitus. Rev Bras Farmacogn. 2018; 28: 73-79. ISSN 0102-695x. [https://doi.org/10.1016/j.bjp.2017.04.003].
54. Chen C, Zhang B, Huang Q, Fu X, Liu RH. Microwave-assisted extraction of polysaccharides from Moringa oleifera Lam. leaves: characterization and hypoglycemic activity. Ind Crops Prod. 2017; 100: 1-11. ISSN 0926-6690. [https://doi.org/10.1016/j.indcrop.2017.01.042].
55. Sangkitikomol W, Rocejanasaroj A, Tencomnao T. Effect of Moringa oleifera on advanced glycation end-product formation and lipid metabolism gene expression in HepG2 cells. Genet Mol Res. 2014; 13(1): 723-735. ISSN 1676-5680. [http://dx.doi.org/10.4238/2014.January.29.3].
56. Nunthanawanich P, Sompong W, Sirikwanpong S, Mäkynen K, Adisakwattana S, Dahlan W et al. Moringa oleifera aqueous leaf extract inhibits reducing monosaccharide-induced protein glycation and oxidation of bovine serum albumin. Springerplus. 2016; 5: 01-07. ISSN 2193-1801. [https://doi.org/10.1186/s40064-016-2759-3].
57. Adepoju-Bello AA, Jolayemi OM, Ehianeta TS, Ayoola GA. Preliminary phytochemical screening, antioxidant and antihyperglycaemic activity of Moringa oleifera leaf extracts. Pak J Pharm Sci. 2017; 30(6): 2217-2222. ISSN 1011-601X. [https://www.researchgate.net/publication/320551944].
58. Verma AR, Vijayakumar M, Mathela CS, Rao CV. In vitro and in vivo antioxidant properties of different fractions of Moringa oleifera leaves. Food Chem Toxicol. 2009; 47: 2196-2201. ISSN 0278-6915. [https://doi.org/10.1016/j.fct.2009.06.005].
59. Uma N, Fakurazi S, Hairuszah I. Moringa oleifera enhances liver antioxidant status via elevation of antioxidant enzymes activity and counteracts paracetamol-induced hepatotoxicity. Malays J Nutr. 2010; 16(2): 293-307. ISSN 1394-035X. [https://www.researchgate.net/publication/225300446].
60. Moyo B, Oyedemi S, Masika PJ, Muchenje V. Polyphenolic content and antioxidant properties of Moringa oleifera leaf extracts and enzymatic activity of liver from goats supplemented with Moringa oleifera leaves/sunflower seed cake. Meat Sci. 2012; 91: 441-447. ISSN 0309-1740. [https://doi.org/10.1016/j.meatsci.2012.02.029].
61. Chumark P, Khunawat P, Sanvarinda Y, Phornchirasilp S, Morales NP, Phivthong-ngam L et al. The in vitro and ex vivo antioxidant properties, hypolipidemic and antiatherosclerotic activities of water extract of Moringa oleifera Lam. leaves. J Ethnopharmacol. 2008; 116: 439-446. ISSN 0378-8741. [https://doi.org/10.1016/j.jep.2007.12.010].
62. Jaiswal D, Rai PK, Mehta S, Chatterji S, Shukla S, Rai DK et al. Role of Moringa oleifera in regulation of diabetes-induced oxidative stress. Asian Pac J Trop Med. 2013; 6(6): 426-432. ISSN 1995-7645. [https://doi.org/10.1016/S1995-7645(13)60068-1].
63. Tshabalala T, Ndhlala AR, Ncube B, Abdelgadir HA, Van Staden J. Potential substitution of the root with the leaf in the use of Moringa oleifera for antimicrobial, antidiabetic and antioxidant properties. S Afr J Bot. 2019; 1-7. ISSN 0254-6299. [https://doi.org/10.1016/j.sajb.2019.01.029].
64. Magaji UF, Sacan O, Yanardag R. Alpha amylase, alpha glucosidase and glycation inhibitory activity of Moringa oleifera extracts. S Afr J Bot. 2020; 128: 225-230. ISSN 0254-6299. [https://doi.org/10.1016/j.sajb.2019.11.024].
65. Coppin JP, Xu YP, Chen H, Pan MH, Ho CT, Juliani Ret et al. Determination of flavonoids by LC/MS and anti-inflammatory activity in Moringa oleifera. J. Funct Foods. 2013; 5: 1892-1899. ISSN 1756-4646. [https://doi.org/10.1016/j.jff.2013.09.010].
66. Rodríguez‐Pérez C, Gilbert‐López B, Mendiola JA, Quirantes-Piné R, Segura‐Carretero A, Ibáñez E. Optimization of microwave-assisted extraction and pressurized liquid extraction of phenolic compounds from Moringa oleifera leaves by multiresponse surface methodology. Electrophoresis. 2016; 37(13): 1938-1946. ISSN 1522-2683. [https://doi.org/10.1002/elps.201600071].
67. Finkel T, Holbrook, NJ. Oxidants, oxidative stress and the biology of ageing. Nature. 2000; 408: 239–247. ISSN 0028-0836. [http://dx.doi.org/10.1038/35041687].
68. Pojer E, Mattivi F, Johnson D, Stockley CS. The case for anthocyanin consumption to promote human health: a review. Compr Rev Food Sci Food Saf. 2013; 12: 483-508. ISSN 1541-4337. [https://doi.org/10.1111/1541-4337.12024].
69. Azad SB, Ansari P, Azam S, Hossain SM, Shahid MI, Hasan M et al. Anti-hyperglycaemic activity of Moringa oleifera is partly mediated by carbohydrase inhibition and glucose-fibre binding. Biosci Rep. 2017; 37: 1-11. ISSN 1573-4935. [https://doi.org/10.1042/BSR20170059].
70. Natsir H, Wahab AW, Laga A, Arif AR. Inhibitory activities of Moringa oleifera leaf extract against α-glucosidase enzyme in vitro. J Phys Conf Ser. 2018; 979: 1-6. ISSN 1742-6596. [https://iopscience.iop.org/article/10.1088/1742-6596/979/1/012019].
71. Tang Y, Choi EJ, Han WC, Oh M, Kim J, Hwang JY et al. Moringa oleifera from Cambodia Ameliorates Oxidative Stress, Hyperglycemia, and Kidney Dysfunction in Type 2 Diabetic Mice. J Med Food. 2017; 20(5): 502-510. ISSN 1096-620X. [https://doi.org/10.1089/jmf.2016.3792].
72. Olayaki LA, Irekpita JE, Yakubu MT, Ojo OO. Methanolic extract of Moringa oleifera leaves improves glucose tolerance, glycogen synthesis and lipid metabolismo metabolismo in alloxan-induced diabetic rats. J Basic Clin Physiol Pharmacol. 2015; 26(6): 585-593. ISSN 2191-0286. [https://doi.org/10.1515/jbcpp-2014-0129].
73. Attakpa ES, Sangaré MM, Béhanzin GJ, Ategbo JM, Seri B, Khan NA. Moringa oleifera Lam. stimulates activation of the insulin-dependent akt pathway antidiabetic effect in a Diet-Induced Obesity (DIO) mouse model. Folia Biol. 2017; 63: 42-51. ISSN 0015-5500. [https://fb.cuni.cz/file/5837/fb2017a0008.pdf].
74. Latif AAE, Bialy BESE, Mahboub HD, Eldaim MAA. Moringa oleifera leaf extract ameliorates alloxan-induced diabetes in rats by regeneration of cells and reduction of pyruvate carboxylase expression. Biochem Cell Biol. 2014; 92(5): 1-7. ISSN 0829-8211. [https://doi.org/10.1139/bcb-2014-0081].
75. Yassa HD, Tohamy AF. Extract of Moringa oleifera leaves ameliorates streptozotocin-induced Diabetes mellitus in adult rats. Acta Histochem. 2014; 116(5): 844-854. ISSN 0065-1281. [https://doi.org/10.1016/j.acthis.2014.02.002].
76. Bamagous GA, Al Ghamdi SS, Ibrahim IAA, Mahfoz AM, Afify MA, Alsugoor MHM et al. Antidiabetic and antioxidant activity of ethyl acetate extract fraction of Moringa oleifera leaves in streptozotocin-induced diabetes rats via inhibition of inflammatory mediators. Asian Pac J Trop Biomed. 2018; 8 (6): 320-327. ISSN 2221-1691. [https://doi.org/10.4103/2221-1691.235327].
77. Aju BY, Rajalakshmi R, Mini S. Protective role of Moringa oleifera leaf extract on cardiac antioxidant status and lipid peroxidation in streptozotocin induced diabetic rats. Helyion. 2020; 6: 1-7. ISSN 2405-8440. [https://doi.org/10.1016/j.heliyon.2019.e02935].
78. Irfan HM, Asmawi MZ, Khan NAK, Sadikun A, Mordi MN. Anti-diabetic activity-guided screening of aqueous-ethanol Moringa oleifera extracts and fractions: identification of marker compounds. Trop J Pharm Res. 2017; 16(3): 543-552. ISSN 1596-5996. [https://www.ajol.info/index.php/tjpr/article/view/154252].
79. Waterman C, Rojas-Silva P, Tumer TB, Kuhn P, Richard AJ, Wicks S et al. Isothiocyanate-rich Moringa oleifera extract reduces weight gain, insulin resistance and hepatic gluconeogenesis in mice. Mol Nutr Food Res. 2015; 59 (6): 1003-1024. ISSN 1613-4133. [https://doi.org/10.1002/mnfr.201400679].
80. Ara N, Rashid M, Amran S. Comparison of Moringa oleifera leaves extract with Atenolol on serum triglyceride, serum cholesterol, blood glucose, heart weight, body weight in adrenaline induced rats. Saudi J Biol Sci. 2008; 15 (2): 253-258. ISSN 1319-562X. [http://www.columbusmoringa.com/wp-content/uploads/2014/03/].
81. Divi SM, Bellamkonda R, Dasireddy SK. Evaluation of antidiabetic and antihyperlipedemic potential of aqueous extract of Moringa oleifera in fructose fed insulin resistant and stz induced diabetic wistar rats: a comparative study. Asian J Pharm Clin Res. 2012; 5 (1): 67-72. ISSN 0974-2441. [https://pdfs.semanticscholar.org/ddaf/d1c294d57f34e9791f89927d5d6c213f9e12.pdf].
82. Omabe M, Nwudele B, Omabe KN, Okorocha AE. Anion Gap Toxicity in alloxan induced type 2 diabetic rats treated with antidiabetic noncytotoxic bioactive compounds of ethanolic extract of Moringa oleifera. J Toxicol. 2014; 1-7. ISSN 1687-8191. [https://doi.org/10.1155/2014/406242].
83. Oseni OA, Idowu ASK. Inhibitory activity of Aqueous extracts of Horseradiash Moringa oleifera (Lam.) and Nutmeg Myristica fragrans (Houtt) on Oxidative Stress in Alloxan induced Diabetic Male Wistar Albino Rats. Am J Biochem Mol Biol. 2014; 4 (2): 64-75. ISSN 2150-4210. [http://dx.doi.org/10.3923/ajbmb.2014.64.75].
84. Irfan HM, Asmawi MZ, Khan NAK, Sadikun A. Effect of ethanolic extract of Moringa oleifera Lam. leaves on body weight and hyperglycemia of diabetic rats. Pak J Nutr. 2016; 15 (2): 112-117. ISSN 1680-5194. [http://dx.doi.org/10.3923/pjn.2016.112.117].
85. Olurishe C, Kwanashie H, Zezi A, Danjuma N, Mohammed B. Chronic administration of ethanol leaf extract of Moringa oleifera Lam. (Moringaceae) may compromise glycaemic efficacy of Sitagliptin with no significant effect in retinopathy in a diabetic rat model. J Ethnopharmacol. 2016; 194: 895-903. ISSN 0378-8741. [https://doi.org/10.1016/j.jep.2016.10.065].
86. Tuorkey MJ. Effects of Moringa oleifera aqueous leaf extract in alloxan induced diabetic mice. Interv Med Appl Sci. 2016; 8(3): 109-117. ISSN 2061-1617. [https://doi.org/10.1556/1646.8.2016.3.7].
87. El-Desouki NI, Basyony MA, Hegazy MM, El-Aama MS. The antidiabetic effect of Moringa oleifera leaves extract on some biochemical parameters of diabetic rats induced alteration in cytoskeletal desmin of cardiomyocytes. Res J Pharm Biol Chem Sci. 2017; 8(1): 1585-1598. ISSN 0975-8585. [https://www.researchgate.net/publication/323884808].
88. Joung H, Kim B, Park H, Lee K, Kim H, Sim H, et al. Fermented Moringa oleifera Decreases Hepatic Adiposity and Ameliorates Glucose Intolerance in High-Fat Diet-Induced Obese Mice. J Med Food. 2017; 20(5): 439-447. ISSN 1096-620X. [https://doi.org/10.1089/jmf.2016.3860].
89. Omodanisi EI, Aboua YG, Ogunti OO. Assessment of the Anti-Hyperglycaemic, Anti-Inflammatory and Antioxidant Activities of the Methanol Extract of Moringa oleifera in Diabetes-Induced Nephrotoxic Male Wistar Rats. Molecules. 2017; 22:1-16. ISSN 1420-3049. [https://doi.org/10.3390/molecules22040439].
90. Paula PC, Sousa DOB, Oliveira JTA, Carvalho AFU, Alves BGT, Pereira ML et al. A protein isolate from Moringa oleifera leaves has hypoglycemic and antioxidant effects in alloxan-induced diabetic mice. Molecules. 2017; 22(271): 1-15. ISSN 1420-3049. [https://doi.org/10.3390/molecules22020271].
91. Khan W, Parveen R, Chester K, Parveen S, Ahmad S. Hypoglycemic Potential of Aqueous Extract of Moringa oleifera Leaf and In Vivo GC-MS Metabolomics. Front Pharmacol. 2017; 8: 1-16. ISSN 1663-9812. [https://doi.org/10.3389/fphar.2017.00577].
92. Amelia D, Santoso B, Purwanto B, Miftahussurur M, Joewono HT, Budiono. Effects of Moringa oleifera on insulin levels and folliculogenesis in polycystic ovary syndrome model with insulin resistance. Immunol Endocr Metab Agents Med Chem. 2018; 18: 22-30. ISSN 1875-6115. [https://doi.org/10.2174/1871522218666180426100754].
93. Azevedo IM, Araújo-Filho I, Teixeira MMA, Moreira MDFC, Medeiros AC. Wound healing of diabetic rats treated with Moringa oleifera extract. Acta Cir Bras. 2018; 33(9): 799-805. ISSN 0102-8650. [http://dx.doi.org/10.1590/s0102-865020180090000008].
94. Nazir S, Sulistyo J. Functional properties of glycoside synthesized using polyphenolic extract of Moringa oleifera catalyzed through transglycosylation reaction. J Appl Pharm. Sci. 2018. 9(5): 58-64. ISSN 2231-3354. [http://dx.doi.org/10.7324/JAPS.2019.90507].
95. Muzumbukilwa WT, Nloot M, Owira PMO. Hepatoprotective effects of Moringa oleifera Lam. (Moringaceae) leaf extracts in streptozotocin-induced diabetes in rats. J Funct Foods. 2019; 57: 75-82. ISSN 1756-4646. [https://doi.org/10.1016/j.jff.2019.03.050].