ARTIGO DE PESQUISA
Parâmetros bioquímicos e morfológicos em ratos diabéticos tratados com extratos de Ora-Pro-Nóbis (Pereskia aculeata)
Biochemical and morphological parameters in diabetic rats treated with extracts of Ora-Pro-Nóbis (Pereskia aculeata)
Resumo
Diabetes mellitus (DM) é um sério problema de saúde pública global. As complicações do DM corroboram com elevadas taxas de morbimortalidade. Assim, diversas espécies de plantas têm sido estudadas quanto suas propriedades medicinais com potencial utilização no tratamento do DM e/ou suas complicações. Este estudo avaliou os efeitos dos extratos da folha (EF-OPN) e casca (EC-OPN) de ora-pro-nóbis (Pereskia aculeata) sobre parâmetros bioquímicos (glicemia, triglicerídeos, colesterol total, creatina, ureia, AST e ALT, e peroxidação lipídica) e histológicos (coração, fígado e rins) em animais com DM. A indução de DM tipo 1 (glicemia > 200 mg/dl) em ratos Wistar machos foi feita com Aloxana (150 mg/kg/ml). Os animais foram distribuídos em 4 grupos: (1) sem DM, (2) com DM, (3) com DM tratados com o EF-OPN e (4) com DM tratados com o EC-OPN. O tratamento foi feito por gavagem (300 mg/Kg/dia), durante 4 semanas. Após esse período, os parâmetros foram avaliados. O EC-OPN preveniu o aumento de triglicérides, AST, ALT e ureia, além da peroxidação lipídica (p < 0,05). Os resultados sugerem um potencial para o EC-OPN em prevenir típicas complicações do DM, melhorando o perfil lipídico, hepático e renal, bem como atenuando o estresse oxidativo.
- Palavras-chave:
- Pereskia aculeata.
- Diabetes mellitus.
- AST.
- Ureia.
- Estresse oxidativo.
Abstract
Diabetes mellitus (DM) is a serious global public health problem. DM complications corroborate with high morbidity and mortality rates. Thus, several plant species have been studied regarding their medicinal properties with potential use in the treatment of DM and/or its complications. This study evaluated the effects of leaf (LE-OPN) and bark (BE-OPN) extracts from ora-pro-nóbis (Pereskia aculeata) on biochemical parameters (glycemia, triglycerides, total cholesterol, creatine, urea, AST and ALT, and lipid peroxidation) and histology (heart, liver and kidneys) in animals with DM. Induction of type 1 DM (glycemia > 200 mg/dl) in male Wistar rats was performed with Alloxane (150 mg/kg/ml). The animals were divided into 4 groups: (1) without DM, (2) with DM, (3) with DM treated with LE-OPN and (4) with DM treated with BE-OPN. The treatment was done by gavage (300 mg/kg/day) for 4 weeks. After this period the parameters were evaluated. BE-OPN prevented the increase in triglycerides, AST, ALT, and urea, in addition to lipid peroxidation (p < 0.05). The results suggest a potential for BE-OPN to prevent typical complications of DM, improving the lipid profile, liver, and kidney, as well as attenuating oxidative stress.
- Keywords:
- Pereskia aculeata.
- Diabetes mellitus.
- AST.
- Urea.
- Oxidative stress.
Introdução
Diabetes mellitus (DM) é mundialmente considerado um problema de saúde pública, devido à alta prevalência com ∼400 milhões de pessoas vivendo com DM atualmente, um número que vem aumentando cada vez mais, sendo estimado que ∼600 milhões de pessoas apresentarão a doença em 2045. No Brasil é estimado ∼12 milhões de pessoas vivendo com DM (prevalência de ∼8%), valor que pode variar consideravelmente seguindo específicos critérios e ferramentas epidemiológicas de mensuração[1,2]. Esse aumento está associado a diversos fatores, como o crescimento populacional em alguns países, maior expectativa de vida, hábitos alimentares deletérios, sedentarismo, excesso de peso, bem como a transição demográfica com consequente envelhecimento populacional, dentre outros[1]. Além disso, o DM está entre as principais causas de mortalidade na maioria dos países desenvolvidos, apresentando um número maior até mesmo que aqueles de óbitos causados por algumas doenças infectocontagiosas, tais como AIDS, tuberculose e malária[1].
As complicações do DM estão divididas em microvasculares (retinopatia, cegueira, nefropatia, neuropatia) e macrovasculares (doença coronariana, doença cerebrovascular e doença arterial periférica), sendo as doenças cardiovasculares as principais causas de morte entre os pacientes com DM[1,3-5]. Diante da importância de estudos que envolvam a busca por novas estratégias terapêuticas para pessoas vivendo com DM, incluindo estratégias que possam atuar na prevenção de suas complicações crônicas, diversas espécies de plantas têm sido estudadas e, alguns efeitos são destacados além do hipoglicemiante, tais como os efeitos antioxidante e antidislipidêmico[4-6].
Pereskia aculeata, popularmente conhecida como ora-pro-nóbis (OPN), "carne dos pobres" ou "carne verde", é uma planta pertencente à família Cactaceae da mata atlântica brasileira, e possui propriedades antioxidantes e antimicrobiana[7]. A composição de sua farinha foi previamente estudada[8], apresentando compostos bioativos, tais como β-caroteno, licopeno, compostos fenólicos, vitamina c, que possuem excelente ação antioxidante. Por exemplo, carotenoides (β-caroteno e licopeno) podem proteger os lipídios de peroxidação induzida por peróxido de hidrogênio (H2O2)[9]. A vitamina C além de atuar como antioxidante (prevenção da oxidação de proteínas e LDL) pode estimular a vasodilatação endotelial e prevenir a disfunção endotelial associada à aterosclerose, hipertensão arterial sistêmica (HAS), a hipercolesterolemia, ou ao DM[10]. Os compostos fenólicos também apresentam marcante ação antioxidante, inclusive tal ação se destaca como propicia a prevenir as complicações do DM induzidas por danos oxidativos[4,5,11].
Neste contexto, este estudo avaliou o impacto do tratamento de ratos diabéticos com o extrato da folha (EF-OPN) ou da casca (EC-OPN) de OPN, avaliando os parâmetros bioquímicos [glicemia; perfil lipídico (triglicerídeos e colesterol total); funções: renal (creatina e ureia) e hepática (aspartato aminotransferase e alanina aminotransferase); e análise de peroxidação lipídica] e morfológicos (análises histológicas do fígado, rins e coração), incluindo entre estes, mensurações de típicas complicações do DM.
Materiais e Métodos
Aspectos éticos
Todos os experimentos envolvendo animais foram conduzidos de acordo com as recomendações do "Guide for the Care and Use of Laboratory Animals", constante no National Institutes of Health [NIH], Washington DC: The National Academy Press, 2011 [PubMed]. O estudo foi aprovado pelo comitê de ética em pesquisa animal da Universidade José do Rosário Vellano (UNIFENAS-Alfenas), sob parecer #10A/2020. Este estudo não envolve qualquer espécie ameaçada de extinção e/ou protegida e nenhuma permissão específica foi requerida quanto ao uso do material vegetal.
Coleta e identificação do material vegetal
As folhas e cascas da árvore de Pereskia aculeata Mill. (nomenclatura de acordo com o The International Plant Names Index [http://www.ipni.org/]) foram coletadas em 15 de outubro de 2020, na cidade de Alfenas, MG/Brasil, coordenadas: Latitude -21.452589, Longitude -45.945469 e Altitude 2805,12 ft. O clima desta região é classificado como húmido temperado, com um verão quente e inverno seco (tipo Cwa na classificação de Köppen). A identificação taxonômica do material vegetal foi realizada no Laboratório de Farmacobotânica e Farmacognosia da Universidade José do Rosário Vellano e a exsicata foi depositada no Herbário UALF da Universidade Federal de Alfenas (UNIFAL-MG), sob número 3237.
Preparo dos extratos de Pereskia aculeata
Neste estudo foram utilizados dois tipos de extratos provenientes de P. aculeata (OPN), o extrato da folha (EF-OPN) e o da casca (EC-OPN). Ambos os extratos hidroetanólicos foram obtidos através do método de extração por percolação exaustiva[12]. O processo teve início com o umedecimento antecipado de 200 gramas da casca ou folhas de P. aculeata durante 2 horas fora do percolador. Em seguida, o percolador foi preenchido com os respectivos materiais vegetais umedecidos e adicionou-se álcool 70% (v/v), deixando-os em maceração por 7 dias. A vazão do percolado ficou em 1,0 ml/min/Kg. Os extratos hidroetanólicos obtidos foram levados ao rota-evaporador sob pressão reduzida e temperatura controlada (∼45ºC) para concentração do extrato líquido. Após a concentração, os extratos foram liofilizados no liofilizador L101 (Liotop). Assim, foram obtidos os extratos secos, sendo, posteriormente, armazenados em frasco âmbar com manutenção no estado dessecados; até o momento de uso quando foram diluídos em água nas devidas doses para administração por gavagem aos animais, bem como para as triagens fitoquímicas.
Perfil fitoquímico e capacidade antioxidante in vitro
Para avaliar o teor de fenóis totais nos extratos de OPN, a partir de 10 mg/ml de cada extrato (EF-OPN ou EC-OPN), o reagente de Folin-Ciocalteau foi usado, com as leituras realizadas em espectrofotômetro UV-Vis no comprimento de onda de 760 nm, com ácido gálico como padrão, sendo o resultado expresso em gramas (g) equivalente em ácido gálico (EAG)/100 g de extrato[12]. A quantificação de flavonoides totais foi realizada pela reação dos extratos com cloreto de alumínio 5% (AlCl3), avaliados por espectrofotometria no UV-Vis (420 nm), utilizando como padrão a quercetina, sendo os resultados expressos em g de quercetina (EQ)/100 g de extrato. A atividade antioxidante in vitro foi determinada pelo teste da capacidade sequestrante do radical 2,2-difenil-1-picril-hidrazil (DPPH), com as leituras realizadas no comprimento de ondas de 517 nm em espectrofotômetro UV-Vis, e os resultados são apresentados em porcentagem (%) da atividade antioxidante dos extratos, comparados ao controle di-terc-butil metil fenol ou hidroxitolueno butilado (BHT)[12].
Parte experimental
Animais
Foram utilizados 40 ratos da linhagem Wistar, machos, de 6 a 9 semanas, com peso corporal inicial próximo de 250 gramas, fornecidos pelo Biotério da Universidade José do Rosário Vellano. Os animais foram mantidos em ambiente com controle de temperatura e por um tempo de 12 horas no ciclo claro-escuro. Todos os animais foram mantidos em gaiolas com cama de maravalha, no total de 2 a 5 animais por gaiola. Eles foram alimentados com ração peletizada e água filtrada, ad libitum, sendo submetidos a um período de adaptação de 10 dias.
Indução do DM tipo 1
Para induzir o DM tipo 1 foi administrado, por via intraperitoneal, o agente diabetogênico Aloxana monoidratada (Sigma-Aldrich Inc, St Louis, MO, USA) na dose de 150 mg/Kg/ml, dissolvido em salina 0,9% (pH 4,5). Dez (10) animais receberam injeção intraperitoneal de salina, compondo o grupo controle (animais sem DM, glicemia abaixo de 200 mg/dl). Os níveis de glicose e peso dos animais foram avaliados uma semana após a indução da DM, para determinar se os animais estavam diabéticos. Os animais que apresentaram glicemia acima de 200 mg/dl foram considerados diabéticos[3-5], totalizando 30. A glicose sanguínea foi avaliada com um glicosímetro comercial usando sangue total da veia da cauda[3-5].
Desenho Experimental
Após indução do DM (grupos DM e DM tratados, totalizando 30 animais) ou administração de salina (grupo sem DM, 10 animais), todos os grupos foram mantidos sob uma dieta padrão (Ração comercial) e água ad libitum. Os grupos foram divididos da seguinte forma: grupos controles, grupos 1. [10 animais sem DM, recebendo placebo (água) durante 4 semanas] e 2. [10 animais com DM, recebendo placebo (água) durante 4 semanas], e; os grupos tratados, 3. [10 animais com DM, que receberam através do processo de gavagem, uma dose diária de 300 mg/Kg do extrato das folhas de P. aculeata (EF-OPN), por 4 semanas] e 4. [10 animais com DM, que receberam através do processo de gavagem, uma dose diária de 300 mg/Kg do extrato da casca de P. aculeata (EC-OPN), por 4 semanas]. Neste intervalo e no intervalo pré-tratamento (semana de indução do DM e 4 semanas de tratamento, totalizando 5 semanas), os consumos de ração e água foram monitorados, e os pesos também aferidos. Após as 4 semanas de tratamento os ratos foram eutanasiados e as amostras biológicas coletadas, visando a avaliação dos parâmetros bioquímicos [glicemia; perfil lipídico (triglicerídeos e colesterol total); funções: renal (creatina e ureia) e hepática [aspartato aminotransferase (AST) e alanina aminotransferase (ALT)]; e análises da peroxidação lipídica] e morfológicos (análises histológicas do fígado, rins e coração).
Eutanásia dos animais e obtenção das amostras biológicas
O método de indução de morte se deu por aprofundamento anestésico para depressão bulbar, e, após isso, os animais foram armazenados em sacos plásticos com capacidade e resistência compatíveis com o peso, que foram identificados e mantidos em freezer até a coleta das amostras para análises. Em resumo, após 4 semanas de tratamento, os animais foram mantidos em jejum por 16 horas e, em seguida anestesiados usando Tiopental e o sangue foi coletado por punção cardíaca. Para obtenção do soro, as amostras de sangue coletadas em tubos siliconizados (sem aditivo) foram centrifugadas a 1500 x g por 10 minutos, em temperatura ambiente, e o soro foi separado, sendo imediatamente utilizado para a determinação da glicemia de jejum, da função renal, da função hepática e do perfil lipídico. Em seguida, os animais foram submetidos à eutanásia e os órgãos que foram utilizados para análises histológicas retirados[3-5].
Determinação de glicose sanguínea, perfil lipídico, e funções hepática e renal
Através de análises laboratoriais do soro dos animais, avaliou-se a glicose sanguínea (sem jejum e após 16 horas de jejum), e o perfil lipídico foi traçado a partir da análise laboratorial de triglicerídeos (TG) e colesterol total (CT). Foram avaliados também marcadores de função renal (creatinina e ureia) e hepática (AST e ALT). As análises de TG, CT, creatinina, ureia, AST e ALT no soro foram feitas através do método enzimático colorimétrico de ponto final, com os níveis de creatinina determinados pelo método de Jaffé modificado utilizando kits adquiridos comercialmente, em um procedimento calibrado com o material de referência SRM 914 do National Institute of Standards and Technology (NIST). Os níveis de ALT e AST foram determinadas no soro, pelo método cinético UV[3-5].
Avaliação da peroxidação lipídica no soro
A peroxidação lipídica foi determinada pela medida dos produtos de oxidação que reagem com o ácido tiobarbitúrico (TBARS), conforme previamente descrito[3,5]. Alíquotas do plasma (150 µl) foram misturadas com 750 µl de ácido fosfórico 1,22 M, mais 1350 µl de água deionizada e 750 µl de ácido tiobarbitúrico (TBA, 0,67%). A seguir, as amostras foram aquecidas em banho de água fervente (95°C), durante 1 hora. Após o resfriamento em banho de gelo (4°C), foi adicionado em cubeta com capacidade de 3 ml, 1800 µl de metanol, mais 200 µl de NaOH 1M e 1000 µl de amostra. A concentração de TBARS foi estimada a partir da curva padrão de dialdeído malônico (MDA; da hidrólise do 1,1,3,3 tetrametoxipropano). Assim o conteúdo de MDA/TBARS foi aferido por fluorimetria usando um Varian Cary Eclipse (λexcitação = 532 nm; λemissão = 563 nm). Os resultados foram expressos em nmoles de MDA/g de proteína, sendo o teor de proteína total na amostra mensurado pelo método de Bradford, usando albumina como padrão.
Análise Histológica
Para avaliar as alterações morfológicas, o fígado, rins e coração foram fixados em formalina 10% em tampão neutro (48 horas); em seguida, os espécimes fixados foram processados pela técnica convencional por embebimento em parafina. As séries de secções de 3 µm de espessura foram tomadas no mesmo plano e depositadas sobre lâminas, e coradas com hematoxilina e eosina (H&E) e analisadas em um MO (Nikon, TNB-04T-PL)[3].
Análises dos dados
Os dados foram submetidos ao teste de normalidade de Shapiro-Wilk, e ao teste de homogeneidade de variâncias de Bartlett, considerando o nível nominal de 5% de significância. Após checar os pressupostos para a utilização da análise de variância (ANAVA), os grupos foram comparados, em relação ao consumo de água, consumo de ração, peso e creatinina. Foi utilizado ensaio fatorial com dois fatores (4 grupos e 5 semanas) em um delineamento inteiramente ao acaso (DIC), sendo os grupos: sem DM, com DM, DM tratado com EF-OPN ou com EC-OPN; nos tempos: após confirmar a indução do DM, após uma semana de tratamento, após duas semanas de tratamento, após três semanas de tratamento e após quatro semanas de tratamento, totalizando 20 parcelas experimentais. O teste de comparações múltiplas de Tukey foi utilizado ao nível nominal de 5% de significância. Para a análise dos dados da creatinina, utilizou-se um delineamento inteiramente ao acaso, desbalanceado, considerando os quatro grupos supracitados. A comparação entre os grupos relativos às variáveis glicose, colesterol, triglicerídeos, ALT, AST e ureia, foi realizada pelo teste não-paramétrico de Kruskall-Wallis, ao nível nominal de 5% de significância. Este teste foi aplicado visto que os dados não se adequam as pressuposições da análise de variância, sendo mais robusto nestas condições, por utilizar a mediana como medida de tendência central. O teste de comparações múltiplas de Dunn foi utilizado para mostrar diferenças entre os grupos em relação às variáveis supramencionadas. Para todas as análises estatísticas foi utilizado o software R®.
Resultados e Discussão
O presente estudo avaliou a influência dos extratos da folha (EF-OPN) e da casca (EC-OPN) de ora-pro-nóbis (P. aculeata) sobre os parâmetros bioquímicos, histológicos e o estresse oxidativo de animais com DM tipo 1. Primeiramente, analisou-se a influência do consumo de água, ração e peso nos grupos, como possíveis interferências no desfecho do tratamento.
Com relação ao consumo de água e ração e, o peso corporal, nos diferentes grupos, o teste de normalidade de Shapiro-Wilk não refutou a hipótese de que os dados seguem uma distribuição normal, para ao consumo de água, (p = 0,8371), consumo de ração, (p = 0,4682), peso, (p = 0,5701). Com homogeneidade das variâncias (teste de Bartlett) para o consumo de água, (p = 0,1040), consumo de ração, (p = 0,3468), peso, (p = 0,9009). Assim, observou-se através da ANAVA que houve diferença significativa entre os grupos (p < 0,01), mas não houve significância estatística entre o efeito das semanas no consumo de água (p = 0,3910), consumo de ração, (p = 0,5954) e no peso (p = 0,8169). A TABELA 1 apresenta as médias do consumo de água (ml) para cada grupo durante as 5 semanas (semana de indução do DM mais 4 semanas de tratamento). Pode-se observar que os grupos de animais com DM tratados com EF-OPN ou EC-OPN apresentaram as maiores médias de consumo de água (ml), diferindo dos grupos sem e com DM não tratados.
| Grupos | Médias* ± (EP) | ||
|---|---|---|---|
| Consumo de água (ml) | Consumo de ração (g) | Peso (g) | |
| Animais sem DM | 169,00 a (32,05) | 106,60 b (4,93) | 327,76 b (9,15) |
| Animais com DM | 436,70 b (32,05) | 85,81 a (4,93) | 255,60 a (9,15) |
| Animais com DM + EF-OPN | 640,30 c (32,05) | 128,70 c (4,93) | 248,77 a (9,15) |
| Animais com DM + EC-OPN | 563,25 c (32,05) | 119,75 c (4,93) | 256,12 a (9,15) |
| Consumo em todos os grupos entre semanas de tratamento | |||
| Após indução do DM | 428,25 a (35,83) | 105,14 a (5,51) | 281,97 a (10,23) |
| Com uma semana de tratamento | 402,00 a (35,83) | 115,00 a (5,51) | 270,55 a (10,23) |
| Com duas semanas de tratamento | 454,75 a (35,83) | 107,50 a (5,51) | 265,91 a (10,23) |
| Com três semanas de tratamento | 493,87 a (35,83) | 115,37 a (5,51) | 274,04 a (10,23) |
| Com quatro semanas de tratamento | 482,69 a (35,83) | 108,06 a (5,51) | 267,84 a (10,23) |
| *Médias seguidas da mesma letra, minúscula, nas colunas, podem ser consideradas estatisticamente iguais pelo teste de Tukey. EP: Erro padrão da média; DM: Diabetes mellitus tipo 1; EF-OPN: extrato da folha de ora-pro-nóbis; EC-OPN: extrato da casca de ora-pro-nóbis. EF-OPN ou EC-OPN: 300 mg/Kg/dia/4 semanas. | |||
É essencial avaliar o consumo de água e ração, bem como mensurar o peso dos animais ao longo de um estudo no qual tais variáveis possam influenciar nos desfechos dos tratamentos monitorados[3-5], evitando-se assim possíveis associações que confundem as interpretações. Como observado, o consumo de água aumentou nos animais com DM, devido a polidipsia[3,5], bem como o consumo de ração, devido a polifagia[3,5]. Por outro lado, a não congruência para um associado aumento de peso entre grupos descarta a influência de tais variáveis no desfecho dos tratamentos com EC-OPN e EF-OPN, além de que não houve influência dos tratamentos nos consumos, também corroborado pela homogeneidade nos consumos e peso ao longo das semanas.
Com relação aos parâmetros bioquímicos aqui avaliados (glicose, colesterol, triglicerídeos, ALT, AST, creatinina e ureia), TABELA 2, ao testar a hipótese de normalidade para estas variáveis, apenas creatinina apresentou distribuição normal, com variância que atende aos pressupostos para uso de ANAVA, tendo sido observado por este teste seguido de Tukey que os grupos foram estatisticamente iguais (p = 0,4888). Não atendendo as necessidades de distribuição normal e/ou homogeneidade das variâncias, as demais variáveis foram consideradas de maneira descritiva através de suas medianas, e o teste não paramétrico de Kruskall-Wallis e o teste de Dunn apontaram quando houve diferenças significativas entre elas (TABELA 2).
O evento bioquímico primário e patognomônico do DM, a hiperglicemia, não foi atenuada pelos tratamentos aqui efetuados (p > 0,05, TABELA 2). No entanto, com relação as complicações do DM associadas ao perfil lipídico (colesterol, triglicerídeos), hepático (AST e ALT) e renal (creatinina e ureia), pode ser observado que o EC-OPN preveniu a hipertrigliceridemia (p < 0,05, TABELA 2), e os aumentos das enzimas marcadoras de danos hepático, AST e ALT (p < 0,05, TABELA 2), bem como no marcador de danos renais, ureia (p < 0,05, TABELA 2). O mesmo desfecho não foi observado para o EF-OPN (TABELA 2).
| Variáveis/Grupos | Média | Mediana | Desvio padrão |
|---|---|---|---|
| Glicemia | |||
| Glicose (mg/dl) | |||
| Animais sem DM | 144,24 | 147,20 a | 32,55 |
| Animais com DM | 490,15 | 490,15 b | 41,82 |
| Animais com DM + EF-OPN | 394,63 | 439,44 b | 136,58 |
| Animais com DM + EC-OPN | 384,76 | 452,71 b | 150,84 |
| Perfil lipídico | |||
| Colesterol (mg/dl) | |||
| Animais sem DM | 42,51 | 44,44 a | 3,78 |
| Animais com DM | 67,25 | 67,25 b | 11,69 |
| Animais com DM + EF-OPN | 64,74 | 60,66 b | 15,96 |
| Animais com DM + EC-OPN | 64,14 | 57,65 b | 15,49 |
| Triglicerídeos (mg/dl) | |||
| Animais sem DM | 47,69 | 47,69 a | 10,80 |
| Animais com DM | 202,81 | 202,81 b | 31,99 |
| Animais com DM + EF-OPN | 178,14 | 133,84 b, c | 166,73 |
| Animais com DM + EC-OPN | 98,14 | 79,99 a | 69,09 |
| Marcadores de função hepática | |||
| ALT (U/L) | |||
| Animais sem DM | 47,55 | 47,55 a | 9,88 |
| Animais com DM | 140,87 | 140,87 b | 9,39 |
| Animais com DM + EF-OPN | 129,96 | 121,50 b, c | 56,73 |
| Animais com DM + EC-OPN | 79,25 | 79,24 a | 16,29 |
| AST (U/L) | |||
| Animais sem DM | 96,19 | 99,48 a | 14,58 |
| Animais com DM | 166,40 | 166,40 b | 33,51 |
| Animais com DM + EF-OPN | 180,26 | 125,40 b, c | 81,52 |
| Animais com DM + EC-OPN | 86,50 | 83,91 a | 5,93 |
| Marcadores de função renal | |||
| Creatinina (mg/dl) | |||
| Animais sem DM | 2,15 a | 2,11 | 0,20 |
| Animais com DM | 2,35 a | 2,35 | 0,37 |
| Animais com DM + EF-OPN | 2,45 a | 2,45 | 0,45 |
| Animais com DM + EC-OPN | 2,51 a | 2,51 | 0,27 |
| Ureia (mg/dl) | |||
| Animais sem DM | 53,47 | 53,47 a | 3,28 |
| Animais com DM | 119,60 | 119,60 b | 7,40 |
| Animais com DM + EF-OPN | 116,40 | 117,69 b, c | 103,96 |
| Animais com DM + EC-OPN | 98,69 | 98,70 a | 18,24 |
| *Médias (ANAVA/Tukey) ou medianas (Kruskall-Wallis/Dunn) seguidas da mesma letra, minúscula, nas colunas, podem ser consideradas estatisticamente iguais. DM: Diabetes mellitus tipo 1; EF-OPN: extrato da folha de ora-pro-nóbis; EC-OPN: extrato da casca de ora-pro-nóbis. EF-OPN ou EC-OPN: 300 mg/Kg/dia/4 semanas. | |||
Os parâmetros bioquímicos aqui avaliados estão relacionados àqueles majoritariamente descritos na literatura quanto aos marcadores de complicações do DM[3-5], sendo fundamental, a prevenção de eventos potencialmente deletérios associados as taxas de morbimortalidade na doença. Por exemplo, avaliar o perfil lipídico em tais modelos experimentais é fundamental, uma vez que a síndrome metabólica em humanos representa um grupo de fatores de risco, dentre eles a obesidade abdominal, hipertensão, hiperglicemia e dislipidemia[13,14], ocorrendo em pacientes com DM[14]. Além disso, o DM pode ser um fator de risco para o desenvolvimento e progressão da complicação hepática crónica, nesse sentido, havendo necessidade de substâncias que possam diminuir tal complicação[15]. A doença também é um fator preponderante na insuficiência renal crônica, exacerbada pela lipoperoxidação nos rins, comprometendo a função renal dos pacientes[16].
De nota, como avaliado no presente estudo, o perfil fitoquímico de OPN evidenciou marcante presença de fenóis totais, com médias (± DP) de: EF-OPN = 0,4 (± 0,12) g EAG/100g de extrato, EC-OPN = 0,02 (± 0,02) gEAG/100 g de extrato e; flavonoides, com médias (± DP) de: EF-OPN = 1,8 (± 0,5) g EQ/100g extrato e EC-OPN = 14 (± 3,5) g EQ/100 g extrato. Consequentemente, marcantes atividades antioxidante in vitro foram observadas, com médias (± DP) de: EF-OPN = 45,38% (± 3,21%) e EC-OPN = 28,58% (± 6,2%), comparados ao padrão BHT = 99,78% (± 0,09%). Dados da literatura apontam para consideráveis quantidades desta classe de metabólitos secundários em OPN[6,7], os quais se relacionam as bioatividades aqui descritas, quanto a prevenção de complicações do DM[4,5,8].
Em congruência com o perfil fitoquímico e a capacidade antioxidante in vitro exercida pelos extratos de OPN, o EC-OPN também preveniu a peroxidação lipídica no soro dos animais, um dano oxidativo normalmente associado ao H2O2 (FIGURA 1, p < 0,05).
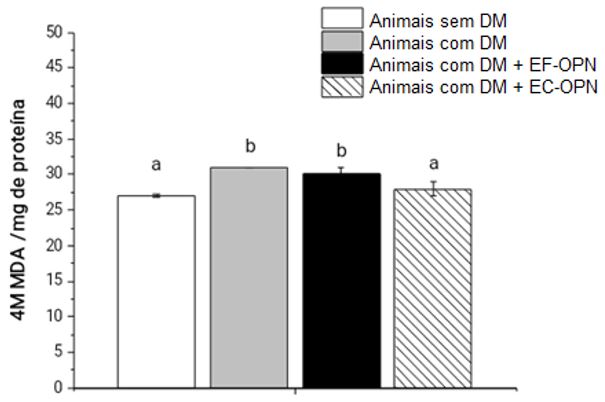
O DM e suas complicações apresentam origem multifatorial, mas marcadamente, a hiperglicemia crônica é um fator que ativa a via dos polióis. Tal via eleva a produção do açúcar sorbitol, consequentemente, este aumento, leva a um desequilíbrio com marcante diminuição na defesa antioxidante[17,18], o que pode ocasionar um estresse oxidativo, com possíveis danos a importantes biomoléculas, tais como os danos induzidos pelo H2O2 em lipídeos, sendo que os flavonoides e outros antioxidantes podem atenuar tais danos[19,20]. Além disso, a própria hiperglicemia é um estímulo para a produção de oxidantes em diferentes tipos celulares, o que agrava ainda mais um possível quadro de estresse oxidativo[5]. Neste sentido, diversos trabalhos têm demonstrado que a OPN possui um considerável teor de compostos fenólicos, corroborando os achados do presente estudo, especialmente flavonoides[6,7], que podem prevenir complicações crônicas do DM induzidas por oxidantes[4,5]. Ainda, embora não observado no presente estudo, os flavonoides podem prevenir a hiperglicemia em modelos experimentais de DM [21,22], ao atuar inibindo a alfa-glicosidase, uma enzima que facilita a absorção da glicose e aumentando sua concentração sanguínea[22].
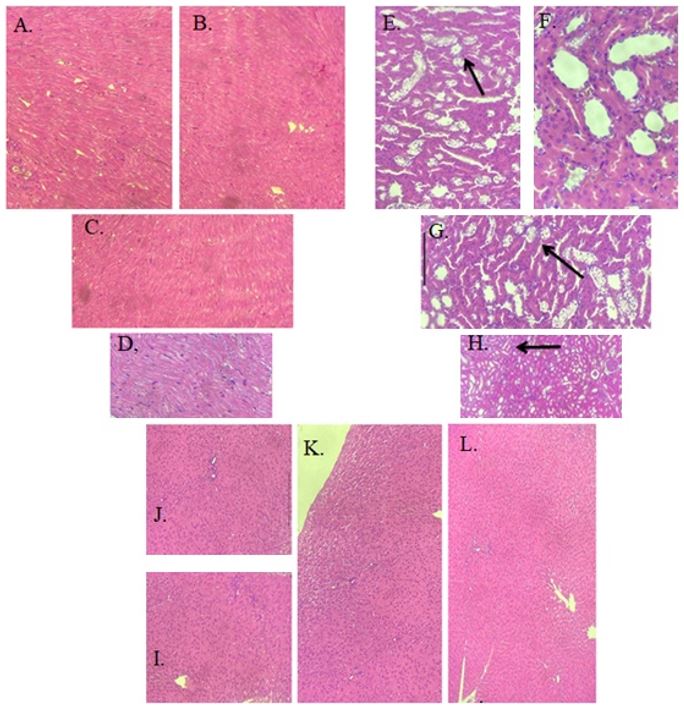
Com relação as características morfológicas dos animais, a FIGURA 2 (A, B, C e D) mostram as análises histológicas do coração; 2 (E, F, G e H) rins; e 2 (I, J, K e L) fígado. No coração e fígado não foram evidenciadas alterações significativas entre os grupos de animais com DM e sem DM, bem como entre estes e os grupos tratados, com todos eles apresentando histologia preservada. Nos rins, os animais diabéticos não tratados apresentaram necrose tubular aguda de leve a moderada (FIGURA 2F), bem como os tratamentos não atenuaram tais alterações (FIGURA 2G e 2H). Estes achados para o coração e fígado apontam para o fato que danos teciduais extensivos podem requerer maior tempo de complicações funcionais durante o DM não controlado, desde que o presente estudo avaliou o impacto da doença apenas durante 4 semanas, constituindo-se uma limitação que deve ser melhor investigada.
Conclusão
O tratamento dos animais diabéticos com quaisquer dos extratos de OPN não preveniu a hiperglicemia e, consequentemente, não interferiu com algumas manifestações típicas deste evento bioquímico, tais como poliúria, polidipsia e perda de peso. Por outro lado, embora não sendo hipoglicemiante, o EC-OPN promoveu efeitos positivos sobre complicações do DM, uma vez que os animais com DM tratados tiveram uma melhoria no perfil lipídico (triglicerídeos); hepático (AST e ALT) e renal (ureia). Ainda, tal extrato foi capaz de atenuar o dano oxidativo, uma outra complicação do DM, mensurados pela peroxidação lipídica. Estes achados indicam um potencial do EC-OPN, mas é crucial que haja estudos que investiguem mais detalhadamente estes efeitos, também em outros modelos experimentais, com foco também em possíveis estudos de toxicidade e ensaios clínicos.
Fontes de Financiamento
Não houve financiamento.
Conflito de Interesses
Os autores declaram não haver quaisquer conflitos de interesses referentes ao presente manuscrito.
Agradecimentos
Ao Programa de Bolsas de Iniciação Científica da UNIFENAS.
Colaboradores
Concepção do estudo: BCCS; GBSB.
Curadoria dos dados: CDC; BCCS; GBSB.
Coleta de dados: JPLJ; GLC; GF; KOLR; MCT; SCO; AEFMF; ACFL.
Análise dos dados: RBVS; ACFL; CDC; BCCS; GBSB.
Redação do manuscrito original: BCCS; GBSB; CDC.
Redação da revisão e edição: CDC.
Referências
1. SBD - Sociedade Brasileira de Diabetes. Diretrizes da Sociedade Brasileira de Diabetes: 2019-2020. São Paulo: Clannad. ISBN: 978-85-93746-02-4. [https://www.saude.ba.gov.br/wp-content/uploads/2020/02/Diretrizes-Sociedade-Brasileira-de-Diabetes-2019-2020.pdf].
2. Damasceno AC, Cerdeira CD, de Souza BL et al. Dispensação de insulina em uma unidade do sistema único de saúde em um município Brasileiro no sul de Minas Gerais. Rev Univer Vale Rio Verde. 2018; 16(1): 1-9. [http://dx.doi.org/10.5892/ruvrd.v16i1.4324].
3. Brito AR, Ravazi GF, Oliveira APP, Cerdeira CD et al. Nitroxides improve biochemical profiling and prevent injuries in the organs of Type 1 diabetic rats. Rev Port Endocrinol Diabetes Metab. 2019; 14(2): 128-136. [https://doi.org/10.26497/ao180019].
4. Silva AB, Lopes GDS, Neves TVB, Barros GBS, Reis LFC, Salles BCC et al. Extrato etanólico das folhas de Raphanus sativus L. Var. oleífera Metzg (nabo forrageiro): efeitos antihiperglicêmico, antidislipidêmico e antioxidante em ratos com Diabetes Mellitus tipo 1. Rev Fitos. Rio de Janeiro. 2019; 13(1): 38-48. [http://dx.doi.org/10.17648/2446-4775.2019.654].
5. Silva AR, Cerdeira CD, Brito AR et al. Green banana pasta diet prevents oxidative damage in liver and kidney and improves biochemical parameters in type 1 diabetic rats. Arch Endocrinol Metab. 2016; 60(4): 355-366. [http://dx.doi.org/10.1590/2359-3997000000152] [https://pubmed.ncbi.nlm.nih.gov/26910629/].
6. Garcia JAA, Corrêa RCG, Barros L et al. Phytochemical profile and biological activities of' Ora-pro-nobis' leaves (Pereskia aculeata Miller), an underexploited superfood from the Brazilian Atlantic Forest. Food Chemistry. 2019; 294: 302-308. [http://dx.doi.org/10.1016/j.foodchem.2019.05.074] [https://pubmed.ncbi.nlm.nih.gov/31126467/].
7. Moraes TV, Souza MRA, Rocha CB, Moreira RFA. Composição química da espécie Pereskia aculeata Miller: uma análise bibliométrica. Braz J Surgery Clinical Res. 2018; 22(3): 19-23. ISSN: 2317-4404. [https://www.mastereditora.com.br/periodico/20180504_105558.pdf].
8. Menezes Filho ACP, Oliveira Filho JM, Christofoli M, Castro CFS. Atividade antioxidante e compostos bioativos em espécies de um fragmento de Cerrado goiano tipo cerradão. Colloquium Agrariae Goiás. 2019; 15(1): 1-8. [http://dx.doi.org/10.5747/ca.2019.v15.n1.a264].
9. Cozzolino SMF, Cominetti C. Bases Bioquímicas e Fisiológicas da Nutrição: nas diferentes fases da vida, na saúde e na doença. 1ª ed. Barueri: Manole. 1257p. 2013. ISBN: 978-85-204-3177-1.
10. Manganaris GA, Goulas V, Vicente AR, Terry LA. Berry antioxidants: small fruits providing large benefits. J Sci Food Agric. 2014; 94(5): 825-33. [http://dx.doi.org/10.1002/jsfa.6432] [https://pubmed.ncbi.nlm.nih.gov/24122646/].
11. Jaouhari JT, Lazrek HB, Jana M. The hypoglycaemic activity of Zygophyllum gaetulum extracts in alloxan-induced hyperglycaemic rats. J Ethnopharmacol. 2000; 69: 17-20. [http://dx.doi.org/10.1016/s0378-8741(99)00064-1] [https://pubmed.ncbi.nlm.nih.gov/10661879/].
12. Cerdeira CD, da Silva JJ, Netto MFR et al. Talinum paniculatum: a plant with antifungal potential mitigates fluconazole-induced oxidative damage-mediated growth inhibition of Candida albicans. Rev Colomb Cienc Quím Farm. 2020; 49(2): 401-431. [http://dx.doi.org/10.15446/rcciquifa.v49n2.89704].
13. Fuchs SC, Silva AA. Hipertensão arterial e diabetes Mellitus: uma visão global. Rev Bras Hipertens. 2011; 18(3): 83-88. ISSN 1519-7522. [https://pesquisa.bvsalud.org/portal/resource/pt/lil-706335].
14. Menezes BD, Mendes DL, Reis HG, Cerdeira CD, Santos GB. Acompanhamento farmacoterapêutico de uma paciente de 49 anos com transtorno afetivo bipolar apresentando síndrome metabólica: relato de caso. Rev Farm Gener. 2020; 2(2): 42-54. ISSN: 2675-1364. [https://publicacoes.unifal-mg.edu.br/revistas/index.php/revistafarmaciageneralista/article/view/1272].
15. Giestas S, Giestas A, Agostinho C. Doença hepática e diabetes Mellitus – uma relação bi-direcional. Rev Port Diab. 2015; 10(4): 158-166. ISSN 1646-3994. [http://www.revportdiabetes.com/wp-content/uploads/2017/11/RPD-Vol-10-n%C2%BA-4-Dezembro-2015-Artigo-de-Revis%C3%A3o-p%C3%A1gs-158-166.pdf].
16. Mafra D, Abdalla DSP, Cozzolino SMF. Peroxidação lipídica em pacientes com insuficiência renal crônica. Rev Nutr. 1999; 12(3): 205-212. [https://doi.org/10.1590/S1415-52731999000300001]
17. Giacomini MM, Hahn S, Siqueira LO. Análise de correlação do perfil lipídico e dano oxidativo em pacientes diabéticos. Rev Ciênc Farm Bás Apl. 2013; 34(2): 251-255. ISSN 1808-4532. [https://rcfba.fcfar.unesp.br/index.php/ojs/article/view/222].
18. Reis JS, Veloso CA, Mattos RT et al. Estresse Oxidativo: Revisão da Sinalização Metabólica no Diabetes Tipo 1. Arq Bras Endocrinol Metab. 2008; 52(7): 1096-1105. [https://doi.org/10.1590/S0004-27302008000700005]
19. Pietta PG. Flavonoids as antioxidants. J Nat Prod. 2000; 63(7): 1035-1042. [https://doi.org/10.1021/np9904509] [https://pubmed.ncbi.nlm.nih.gov/10924197/].
20. Gonçalves ICV, Cerdeira CD, Camara EP et al. Tempol improves lipid profile and prevents left ventricular hypertrophy in LDL receptor gene knockout (LDLr-/-) mice on a high-fat diet. Rev Port Cardiol. 2017; 36(9): 629-638. [http://dx.doi.org/10.1016/j.repc.2017.02.014] [https://pubmed.ncbi.nlm.nih.gov/28826937/].
21. Huang PK, Lin SR, Chang CH et al. Natural phenolic compounds potentiate hypoglycemia via inhibition of Dipeptidyl peptidase IV. Sci Rep. 2019; 9(1): 15585. [https://doi.org/10.1038/s41598-019-52088-7].
22. Huo Y, Winters WD, Yao DA-LIN. Prevention of diet-induced type 2 diabetes in the C57BL/6J mouse model by an antidiabetic herbal formula. Phytother Res. 2003; 17: 48-55. [https://doi.org/10.1002/ptr.1078] [https://pubmed.ncbi.nlm.nih.gov/12557247/].