Artigo de Pesquisa
Desenvolvimento de formulações de uso tópico contendo extrato bruto de Tabernaemontana catharinensis A.DC. (Apocynaceae)
Development of topical formulations containing crude extract of Tabernaemontana catharinensis A. DC. (Apocynaceae)
Resumo
Este estudo teve como objetivo o desenvolvimento e a avaliação da estabilidade de diferentes bases farmacêuticas contendo o extrato bruto de Tabernaemontana catharinensis A.DC. (Apocynaceae). O material vegetal foi cadastrado no Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado, cadastro AB06FBA. A estabilidade física e química de duas bases distintas de pomadas foi estudada através de testes de características organolépticas, ciclo gelo-degelo, determinação de pH, determinação do tamanho de partícula e determinação da espalhabilidade. Na análise das características organolépticas ambas pomadas apresentaram algumas modificações, porém aceitáveis, ao fim do ciclo gelo-degelo a pomada vaselinada com extrato apresentou uma pequena separação de fases, já a pomada iônica hidrofílica com extrato permaneceu estável. Nas análises de pH ocorreram oscilações nos valores, no entanto ambas permaneceram dentro das faixas indicadas. A análise granulométrica foi estável durante o período do estudo, assim como o teste da espalhabilidade, principalmente em relação a pomada iônica hidrofílica com extrato. Frente aos resultados, percebeu-se que a pomada iônica hidrofílica com extrato se mostra promissora para novos estudos, por outro lado, deve-se repensar na formulação da pomada vaselinada com extrato.
- Palavras-chave:
- Tabernaemontana catharinensis.
- Veículos farmacêuticos.
- Estabilidade.
- Cicatrização.
Abstract
This study aimed to development and the evaluation of the stability of different pharmaceutical bases containing the crude extract of Tabernaemontana catharinensis A. DC. (Apocynaceae). The vegetable material was registered in register in the National System for the Management of Genetic Heritage and Associated Traditional Knowledge, registration AB06FBA. The physical and chemical stability of two ointment distinct bases were studied through tests of organoleptic characteristics, ice-thawing cycle, pH determination, particle size determination and spreadability determination. In the analysis of organoleptic characteristics both ointments presented some modifications, but acceptable, at the end ice-thawing cyclo the vaseline ointment with extract presented a small separation of phases, already the hydrophilic ionic ointment with extract remained stable. In the pH analyzes oscillations in the values occurred, however both remained within the indicated ranges. The particle size analysis was steady during the period of the study, as well as the test of the spreadability, mainly in relation to hydrophilic ionic ointment with extract. Front to the results, is perceived that the hydrophilic ionic ointment one with extract if shows promising for new studies, on the other hand, must be rethink in the formularization of the vaseline ointment one with extract.
- Keywords:
- Tabernaemontana catharinensis.
- Pharmaceutical vehicles.
- Stability.
- Healing.
Introdução
A grande biodiversidade da flora brasileira tem colocado em discussão a relevância e o uso do ponto de vista econômico e social das plantas medicinais brasileiras. O conhecimento científico aponta o seu potencial para originar novos elementos terapeuticamente ativos e promissores para o desenvolvimento tecnológico de produtos fitoterápicos[1]. O aumento do interesse por produtos naturais pode ser explicado pelas pesquisas científicas que comprovam a segurança e a eficácia desses produtos e, também, o fato de que, por muito tempo, a população mundial utilizou-os exclusivamente como agentes terapêuticos[2].
As plantas medicinais são utilizadas atualmente na indústria farmacêutica como matérias-primas para a extração de precursores ou princípios ativos, basicamente para a produção de xaropes, chás, tinturas, extratos secos e fluidos, sendo muito cogitados como recursos terapêuticos[2].
A Tabernaemontana catharinensis A.DC. (Apocynaceae) é conhecida popularmente como pele de cobra, cobrina, jasmim ou leiteira de dois irmãos e pertence à família Apocynaceae. Há relatos de cerca de 99 espécies diferentes de Tabernaemontana, onde, 44 ocorrem no Brasil, Paraguai, Uruguai e Argentina, sendo bem conhecidas pela presença de alcaloides triterpenoides pentacíclicos e indólicos, flavonoides e fenóis totais. Esses compostos são responsáveis por diversas atividades farmacológicas, dentre elas, atividade antibacteriana, hipoglicêmica, analgésica e cardiotônica[3].
Popularmente a T. catharinensis é utilizada em forma de infusão ou chá como antídoto para picadas de cobra, vermífugo, para alívio de dores de dente, eliminação de verrugas e também como anti-inflamatório[4]. Na Argentina é usada popularmente para a cura de infecções dos olhos, garganta, desinfecção de feridas, bem como, diarreia causada por parasitas[5].
Estudos realizados com o extrato hidroalcóolico de T. catharinensis em feridas cutâneas em ratos, demonstraram uma melhora na proliferação vascular e endotelial, indicando um potencial ação cicatrizante conferida ao extrato[6].
O processo de cicatrização se dá devido a uma série de eventos moleculares e celulares, os quais agem em conjunto para reconstituir o tecido lesado, sendo que o uso de plantas como um tratamento complementar ou alternativo para a cicatrização de feridas vem crescendo continuadamente[5].
Para o desenvolvimento de novas formulações é necessário o conhecimento em relação às particularidades químicas, biológicas, físicas e físico-químicas de todas as substâncias que serão utilizadas na preparação[7]. Requer a realização de diversos ensaios para assegurar a produção de um produto com qualidade, eficácia e segurança, sendo principalmente os ensaios de estabilidade da formulação, os quais podem ser variados conforme o seu período de duração[8,9].
São diversos os fatores que podem afetar a estabilidade de um produto, podem ser classificados intrínsecos, quando são ocasionados por fatores da própria formulação, como, incompatibilidades químicas, incompatibilidades físicas, ou extrínsecos, como, temperatura, umidade, luz, oxigênio, microrganismos, as embalagens e a vibração durante os transportes[10].
A estabilidade também é um fator considerável para a penetração ou absorção cutânea que o produto irá apresentar[11]. A aplicação tópica possui diversas características vantajosas, como, evitar o efeito de primeira passagem, a fácil aceitação pelo paciente e facilidade de pausa no tratamento[12].
Assim, partindo-se do pressuposto de que os estudos de estabilidade representam uma importante ferramenta para o desenvolvimento de novas formulações, aliado aos conhecimentos sobre a planta T. catharinensis, com suas diversas propriedades terapêuticas já comprovadas e, por ser amplamente cultivada na região sul do Brasil, tornando-a de fácil acesso, buscou-se o desenvolvimento e avaliação da estabilidade do extrato bruto de T. catharinensis em diferentes bases farmacêuticas.
Materiais e Métodos
Material vegetal, reagentes e adjuvantes farmacêuticos
Como material vegetal foram utilizadas as folhas de T. catharinensis, as quais foram coletadas no município de Santa Rosa – Rio Grande do Sul. O material vegetal foi identificado pelo Biólogo Renato Zacchia através de uma exsicata e o material testemunho foi depositado no herbário do Departamento de Biologia da UFSM sob o registro SMDB 19.500.
O material vegetal foi cadastrado no Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado (SISGEN), cadastro nº AB06FBA.
Os reagentes e demais adjuvantes necessários para o desenvolvimento do trabalho foram: lauril sulfato de sódio, propilenoglicol, álcool cetoestearílico, vaselina sólida, metilparabeno, propilparabeno, butilhidroxitolueno (BHT) e vaselina líquida disponíveis do laboratório de farmacotécnica da Universidade.
Obtenção do extrato bruto
As folhas de T. catharinensis foram secas e trituradas manualmente, logo após, os extratos foram obtidos por maceração hidroalcóolica, empregando etanol a 70% em diferentes recipientes fechados, os quais foram submetidos a agitações manuais diárias, pelo período de um mês. Ao final desse período, o conteúdo foi filtrado em algodão, e colocado em evaporador rotatório para eliminação do etanol, com posterior secagem em estufa em temperaturas inferiores a 40ºC.
Identificação de metabólitos secundários
Realizou-se a identificação de flavonoides pela Reação de Shinoda, a qual consiste em medir 2 mL do extrato hidroalcóolico, transferir para um tubo de ensaio, adicionando em torno de 6 fragmentos de magnésio metálico, logo em seguida, adiciona-se 1 mL de HCl concentrado e observa-se a coloração rósea – avermelhada[13].
A identificação de compostos fenólicos foi realizada pela Reação de Folin-Denis onde se colocou 2,5 mL de extrato em tubo de ensaio, secou-se em banho-maria, e, logo após, adicionou-se ao resíduo 1 ml do reagente de Folin-Denis e, por fim, adicionou-se 8 mL de carbonato de sódio 20%. Neste ensaio, em caso positivo para compostos fenólicos observa-se coloração azul[13].
Já para a identificação de alcaloides foi aquecido à fervura 20 mL de extrato hidroalcóolico + 20 mL de ácido clorídrico 1% até evaporação do etanol, e deixou-se esfriar em temperatura ambiente. Logo após, alcalinizou-se o meio com amônio diluída (hidróxido de amônio 320 mL para água purificada q.s.p 1000 mL), verificando-se o pH, devendo estar 8,0 e 9,0. Em seguida, colocou-se o filtrado em funil de separação, acrescentou-se cerca de 20 mL de clorofórmio, agitou-se e abriu-se a torneira para a saída de gases. Separou-se então a fração contendo clorofórmio, a qual contém alcaloides, e acrescentou-se 5 mL de ácido clorídrico 1% e agitou-se. A fração aquosa ácida foi colocada em tubo de ensaio e adicionada 3 gotas de reagente de Dragendorff em cada tubo de ensaio. Deve-se observar a presença de turvação e/ou precipitação com alteração da cor para vermelho – tijolo[13].
Para a identificação de saponinas transferiu-se 100 mg do extrato bruto seco de T. catharinensis para um tubo de ensaio, colocou-se 10 mL de água purificada, agitou-se por 15 segundos e deixou-se o tubo em repouso por 15 minutos. Em caso de positivo para saponinas deve-se observar a presença de espuma permanente[14].
Produção das bases farmacêuticas
Em função da finalidade do produto a ser desenvolvido ser destinado ao tratamento de feridas, as bases selecionadas são de baixo potencial irritativo. Desse modo, optou-se pela escolha dessas bases, as quais estão descritas na TABELA 1[15].
Camponogara e colaboradores[16] desenvolveram um gel com extrato bruto de T. catharinensis na concentração 3%, onde realizaram estudos de estabilidade, os quais se mostraram estáveis. Diante disso, escolheu-se a concentração 3% para incorporação nas bases farmacêuticas.
| Componentes | Formulações | |||
| PVC | PVE | PIC | PIE | |
| Extrato bruto T. catharinensis | - | 3% | - | 3% |
| Vaselina Líquida | 30% | 30% | - | - |
| Butilhidroxitolueno (BTH) | 0,02% | 0,02% | 0,05% | 0,05% |
| Vaselina Sólida | qsp 100% | qsp 100% | 12,5 | 12,5 |
| Lauril Sulfato de Sódio | - | - | 0,5% | 0,5% |
| Propilenoglicol | - | - | 6 | 6 |
| Álcool cetoestearílico | - | - | 4 | 4 |
| Metilparabeno | - | - | 0,008% | 0,008% |
| Propilparabeno | - | - | 0,012% | 0,012% |
| Água purificada | - | - | qsp 100% | qsp 100% |
| Legenda: PVC = Pomada vaselina controle; PVE = Pomada vaselinada com extrato vegetal; PIC = Pomada iônica hidrofílica controle; PIE = Pomada iônica hidrofílica com extrato vegetal. | ||||
Para a produção da pomada base iônica hidrofílica aqueceu-se a fase aquosa (propilenoglicol, metilparabeno, álcool cetoestearílico, lauril sulfato de sódio e água purificada) a 70ºC e fase oleosa (BHT, vaselina sólida e propilparabeno) a 65ºC. Após, verteu-se a fase aquosa sobre a fase oleosa sob constante agitação. O extrato bruto de T. catharinensis foi dissolvido em 15 mL de propilenoglicol e incorporado à formulação.
Para a produção da pomada vaselinada primeiramente dissolveu-se o BHT em pequena quantidade de vaselina líquida, logo após, adicionou-se a vaselina sólida e, por fim, o restante da vaselina líquida, sob constante agitação até a formação da pomada. O extrato bruto de T. catharinensis foi dissolvido em 15 mL de propilenoglicol e incorporado à formulação.
Antes de iniciar o estudo das formulações, as amostras foram submetidas ao teste de centrifugação, onde foram centrifugadas a 3000 rpm durante 30 minutos[10].
Características Organolépticas
As formulações foram avaliadas em relação às mudanças na aparência, cor e odor nos períodos compreendidos no teste de ciclo gelo-degelo e os resultados classificados de acordo com critérios qualitativos descritos na TABELA 2[10].
| Determinação da aparência |
|
| Determinação da cor |
|
| Determinação do odor |
|
Ciclo gelo-degelo
Neste ensaio, as amostras foram submetidas a condições extremas de temperatura de forma alternada.
As amostras foram colocadas em estufa (40 ± 2 ºC), por sete dias, e, após, mantidas em geladeira (5 ± 2 ºC), pelo mesmo tempo. Após esse período, voltaram novamente à estufa (40 ± 2 ºC) e permaneceram por mais sete dias, completando um ciclo de 21 dias. No final deste período, as amostras foram submetidas à ação de centrifuga (Centribio® 80-2B) a 3.000 rpm por 30 minutos[17].
Foram considerados os seguintes critérios:
- Sem separação de fases;
- Leve separação de fases;
- Produto com 50% de separação;
- Produto com mais de 50% de separação.
Determinação do pH
A avaliação do pH foi realizada diretamente nas pomadas nos períodos de t24h, t7d, t14d e t21d, utilizando potenciômetro (Digimed® Dm -22) previamente calibrado com solução tampão pH 4,0 e 7,0[18]. Utilizou-se as análises de variância (ANOVA) para calcular as variâncias entre os resultados obtidos.
Determinação do tamanho de partícula
Empregou-se o teste de análise granulométrica utilizando microscópio óptico equipado com micrômetro ocular, em aumento de 100 vezes, no qual cada divisão corresponde a 1,0 mm, usou-se o diâmetro de Feret como parâmetro de medição (mede a distância entre duas tangentes dispostas em lados opostos da partícula, paralelas em relação a uma determinada direção, ou seja, permite a medida do comprimento das partículas). As amostras foram diluídas em uma solução constituída por água e propilenoglicol (1:1), na proporção 1:30, analisando-se, no mínimo 100 gotículas/partículas[19-21].
O diâmetro médio aritmético das partículas determinado para cada uma das análises feitas com as formulações de pomada iônica hidrofílica com extrato foi feito relacionando a frequência absoluta das partículas em cada faixa de tamanho conforme a equação (1). Onde: d = diâmetro (µm); n = número de partículas em cada faixa de diâmetro; p = índice relacionado ao tamanho de determinada partícula; f = frequência em que uma partícula ocorre em determinada faixa de tamanho. Emprega-se p=1 e f = 0 quando o diâmetro é obtido usando-se comprimento e a frequência por número de partículas, respectivamente.
 (1)
(1)
Determinação da espalhabilidade
Esse ensaio foi realizado nas amostras nos períodos do ciclo gelo-degelo (t24h, t7d, t14d e t21d). O método consiste em colocar uma placa de vidro (20 cm x 20 cm) sobre um papel milimetrado; e, acima deste emprega-se uma placa molde com um orifício ao meio para introduzir a amostra, nivelando com a ajuda de uma espátula. Após a placa molde é retirada e, sobre a amostra, é adicionada uma placa com peso (g) conhecido. A superfície compreendida é calculada após 60 segundos, através do diâmetro formado. A espalhabilidade é considerada como o ponto onde a adição de peso não altera nos valores dos diâmetros.
A espalhabilidade foi calculada segundo a equação 1, onde: Ei = espalhabilidade da amostra para peso i (mm²) e d = diâmetro médio (mm)[22]:
 (1)
(1)
Resultados e Discussão
Identificação de metabólitos secundários e produção das bases farmacêuticas
É fundamental para o desenvolvimento de produtos fitoterápicos que o material vegetal tenha sua autenticidade comprovada, o que pode ser feito por meio de ensaios de verificação da descrição da planta e por ensaios físicos e químicos.
Desse modo, após realizada a identificação botânica da planta, iniciou-se a obtenção do extrato bruto, e posterior identificação de alguns metabólitos secundários; alcaloides, compostos fenólicos, flavonoides e saponinas, seguindo as literaturas descritas. Todos os resultados foram positivos, indicando a presença destes componentes no extrato bruto de
T. catharinensis
Boligon e colaboradores[23] quantificaram grandesuantidades de alcaloides no extrato bruto das folhas de T. catharinensis, assim como, quantidades significativas de flavonoides e ácidos fenólicos. Outros estudos realizados por Camponogara e colaboradores[24] mostraram a presença desses mesmos compostos fitoquímicos e a associação com sua atividade anti-inflamatória.
Os flavonoides representam grande parte das substâncias com atividades farmacológicas nas plantas, atuam com papel importante na cicatrização de feridas, agindo como antioxidantes e anti-inflamatórios, elevando a eficácia da reparação tecidual[25,26]. Janning e colaboradores [6] realizaram estudos de cicatrização com o extrato hidroalcóolico de T. catharinensis em feridas cutâneas em ratos, mediante análises microscópicas e macroscópicas, onde seus resultados apontam que o extrato hidroalcóolico pode possuir ação sobre a proliferação endotelial e vascular, sugerindo propriedades cicatrizantes.
As saponinas em soluções aquosas sob agitação formam uma espuma abundante e persistente, devido a sua estrutura apresentar uma parte hidrofílica formada por um ou mais açúcares e uma parte lipofílica chamada de sapogenina ou aglicona[27].
Portanto, após a identificação da planta e de alguns dos seus metabólitos secundários, produziu-se as pomadas e fez-se o teste de centrifugação anteriormente ao início das demais análises, onde, após os 30 minutos de centrifugação ambas as pomadas permaneceram intactas.
Características Organolépticas
As características organolépticas foram analisadas através dos parâmetros: cor, odor e aparência e classificadas usando escala qualitativa, conforme descrito na TABELA 2. Os resultados para este parâmetro estão na TABELA 3.
| t24h | t07d | t14d | t21d | ||||||||||
| Amostras | Cor | Aparência | Odor | Cor | Aparência | Odor | Cor | Aparência | Odor | Cor | Aparência | Odor | |
| PVC | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | |
| 3 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | |
| PVE | 1 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 2 | 1 |
| 2 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | |
| 3 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | |
| PIC | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| 3 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| PIE | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 2 |
| 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 2 | |
| 3 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2 | 1 | 2 | 2 | |
| Legenda: t24h = 24 horas após a fabricação. t07d, t14d, t21d = 07, 14 e 21 dias após a fabricação. PVC = Pomada vaselinada controle. PVE = Pomada vaselinada + extrato. PIC = Pomada iônica hidrofílico controle. PIE = Pomada iônica hidrofílica + extrato. | |||||||||||||
Ao finalizar a produção das amostras (t0), as mesmas encontravam-se brilhantes, consistentes, com odor característico da planta e cores esverdeadas, própria dos extratos produzidos a partir de folhas.
Após as análises realizadas pelo período de 21 dias com alternadas temperaturas, percebe-se que a pomada vaselinada com extrato em ambos os dias que estavam em estufa (t07d e t21d) apresentaram mudanças na sua aparência com uma pequena perda na sua consistência. Do mesmo modo, no t21d duas das suas amostras controle apresentaram pequena turvação no seu aspecto.
A vaselina possui baixo ponto de fusão, o que explica a perda de consistência e mudança no aspecto nos dias em que as amostras foram mantidas em temperaturas mais elevadas[22].
Já a pomada iônica hidrofílica com extrato apresentou mudanças na sua aparência em apenas uma das suas amostras (t21d), onde houve uma ligeira separação das fases, por outro lado, o seu controle permaneceu inalterado durante todo o processo de análise.
Quanto ao odor percebeu-se mudança apenas na pomada iônica hidrofílica com extrato no t14d e t21d, as quais tiveram uma pequena perda do odor original, o qual era característico da planta.
Referente a cor, todas as amostras de ambas as pomadas e seus controles permaneceram inalterados por todo o período do estudo. A pomada iônica hidrofílica com extrato possuía uma cor verde abacate, devido a cor da pomada sem a presença do extrato ser branca, a qual neutralizou a cor do mesmo, já a pomada vaselinada por ser mais transparente, com a incorporação do extrato ficou verde escuro, cor característica do extrato da planta.
As características organolépticas ajudam a determinar a aceitação do produto pelo consumidor. Sabe-se que em baixas temperaturas as amostras podem sofrer algumas alterações físicas como, precipitação e cristalização. Já em temperaturas mais elevadas podem ocorrer reações físico-químicas ocasionando mudanças quanto à cor, odor e aspecto do produto. Outra explicação para problemas gerados em baixas ou altas temperaturas podem ser por não-conformidades na fabricação ou armazenamento do produto[10].
Segundo o Guia da Estabilidade de Produtos Cosméticos[10], pequenas mudanças na cor e odor são aceitáveis em temperaturas elevadas, da mesma maneira, sob condições extremas de temperatura são toleráveis pequenas alterações no aspecto do produto.
Ciclo gelo-degelo
Após o término do ciclo gelo-degelo as amostras foram colocadas em tubos Falcon® e submetidas ao teste de centrifugação à 3.000 rpm pelo período de 30 min.
Ao final do teste observou-se que nas amostras de pomada iônica hidrofílica com extrato não apresentou separação de fases, mas em contrapartida houve uma pequena formação de espuma, a qual pode ser explicada pela presença de saponinas no extrato bruto da planta, conforme se percebeu no ensaio de verificação desse metabólito secundário. Já as amostras da pomada iônica hidrofílica controle não apresentaram alterações, mantendo a estabilidade física.
Por outro lado, o mesmo não se aplicou a pomada vaselinada com extrato, onde ocorreu uma leve separação de fases, já seu controle manteve-se inalterado.
Para Firmino e colaboradores[28], o teste de centrifugação permite analisar a estabilidade física das amostras, indicando se após condições extremas de acondicionamento haverá ou não uma tendência à separação dos componentes.
Em caso de positividade é indicado repensar na formulação, pois a separação de fases é um indício de uma instabilidade entre os componentes. A instabilidade pode se apresentar de diversas formas, sendo elas, floculação, coalescência, inversão de fase e cremagem[10].
Diante disso, percebe-se que a pomada vaselinada com extrato teve uma instabilidade antecipada, com uma leve separação de fases prejudicando assim a qualidade final do produto.
Determinação do pH
Os resultados das análises de pH das amostras de pomadas com extrato vegetal e seus controles encontram-se na TABELA 4.
| Valores de pH - ± DP (DPR%) | ||||
| Tempo | Pomada iônica hidrofílica | Pomada vaselinada | ||
| Controle | Extrato | Controle | Extrato | |
| t24h | 5,99 ± 0,044 (0,73) | 5,42 ± 0,047 (0,87) | 5,39 ± 0,485 (9,00) | 5,05 ± 0,208 (4,11) |
| t07 | 7,31 ± 0,021 (0,3) | 5,74 ± 0,067 (1,159) | 4,63 ± 0,047 (1,019) | 5,25 ± 0,049 (0,938) |
| t14 | 6,29 ± 0,803 (12,75) | 5,82 ± 0,064 (1,09) | 6,26 ± 0,207 (3,30) | 5,37 ± 0,142 (2,65) |
| t21 | 6,50 ± 0,218 (3,347) | 5,35 ± 0,277 (5,183) | 5,83 ± 0,214 (3,667) | 5,18 ± 0,096 (1,856) |
| F | 5,53 | 7,45 | 17,67 | 2,78 |
| P | 0,023 | 0,010 | 0,00068 | 0,109 |
| Legenda: pH = média das 3 amostras de pH. DP = Desvio Padrão. DPR = Desvio Padrão Relativo. t24 = 24 horas após fabricação. t07, t14 e t21 = 07, 14 e 21 dias após a fabricação. F.05(3) = 4,06. P = > 0,05. | ||||
As análises de variância (ANOVA) dos resultados obtidos após as análises de pH demonstraram variâncias significativas (P < 0,05) em ambas as amostras. No entanto, pode-se perceber que nas amostras que continham o extrato bruto a média dos valores de pH ficaram na faixa de valores de 5,0 ao 6,0.
Em estudos realizados por Camponogara e colaboradores[16], com o gel contendo o extrato bruto de T. catharinensis, apresentaram valores próximos aos encontrados neste estudo, os quais permaneceram na faixa de pH de 5,0 a 6,0, num mesmo período de duração.
Pode-se ressaltar que os resultados encontrados no início e ao final do estudo se assemelham e que o fato de apenas as amostras da pomada vaselinada com extrato e seu controle apresentarem ligeiras mudanças no aspecto das pomadas, pode ser um indício de que houve algum problema em relação ao aparelho utilizado para as análises.
A verificação dos valores de pH nas formulações possibilita avaliar alterações nas amostras que nem sempre são percebidas visualmente, podendo indicar algum problema na estabilidade dos componentes da formulação, ou algum problema oriundo da fabricação, os quais poderão acarretar em problemas futuros na qualidade, eficácia e segurança do produto[10].
Os valores de pH das formulações cosméticas para uso tópico devem ser próximos ao da pele humana, entre 4,5 e 6, o qual pode variar dependendo de vários fatores como, o local do corpo humano e a idade do paciente[29,30]. Através dos valores encontrados pode-se ver que ambas as amostras contendo o extrato bruto estão com o pH na faixa indicada, podendo ser aplicadas sobre a pele.
Determinação do tamanho de partícula
A análise granulométrica foi empregada para monitorar o tamanho e a distribuição de tamanho de gotículas e/ou partículas, o que permite verificar possíveis variações de estabilidade durante o período de estudo.
Em função da natureza da formulação da pomada vaselinada, com e sem extrato, ser bastante lipofílica, esse ensaio só foi realizado nas amostras de pomada iônica hidrofílica, que apesar de ser uma pomada, apresenta em sua composição adjuvantes com capacidade emulsificante, ocasionando a formação de gotículas.
Durante o período do estudo as amostras analisadas de pomada iônica hidrofílica com e sem extrato mostraram-se estáveis, com as gotículas no intervalo de 0,5 mm, ou seja, todas as gotículas apresentavam diâmetro menor que 1 mm.
Nas mesmas amostras analisou-se a presença de partículas sólidas. Uma das vantagens da medida do diâmetro particular por microscopia é que este permite observar o formato e o tamanho das partículas, observando a presença de cristais e possíveis alterações polimórficas.
A FIGURA 1 apresenta a distribuição percentual das partículas analisadas por faixas de tamanhos. É possível perceber que a maior parte das partículas durante todo o período de estudo permaneceu na faixa de 1,5 a 3,5 mm. Estas apresentavam aspecto cristalino com formato retangular com as bordas arredondadas. Percebendo-se as partículas somente na amostra com o extrato, pode-se supor que restaram partículas sólidas do extrato após o processo de secagem em estufa e ressuspensão em propilenoglicol.
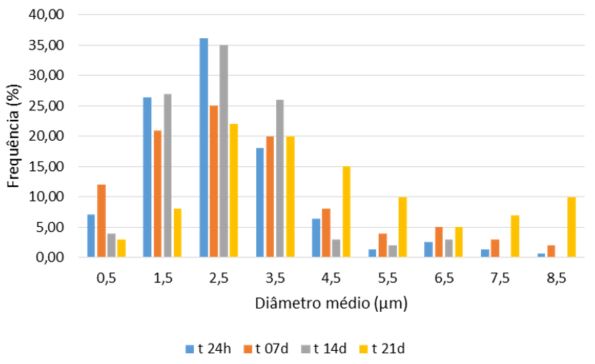
Os resultados para os diâmetros médios (dmédio), calculado para as amostras analisadas foram: t24h = 2,65 mm, t07d = 3 mm, t14d = 2,65 mm e t21d = 4,31 mm. Esses números demonstram uma pequena variação, mas com uma tendência de aumento do diâmetro, o que é condizente com as alterações também observadas na avaliação das características organolépticas que demonstraram tendência de alterações no final do ensaio. No entanto, na análise desses dados, em conjunto com os demais ensaios, observou-se que o valores de pH mantiveram-se próximos, bem como o ciclo gelo-degelo e espalhabilidade que tiveram resultados satisfatórios.
Determinação da espalhabilidade
Os resultados das análises de espalhabilidade encontram-se nos GRÁFICOS 1, 2, 3 e 4.




A espalhabilidade é uma das características importantes a se considerar para que um paciente tenha melhor adesão ao tratamento. Associada à outras análises permite comparar diferentes formulações. Assim, ao observar-se os GRÁFICOS 1 e 2 percebe-se que a espalhabilidade da pomada iônica hidrofílica com o extrato é menor que o seu controle. Porém, nota-se também que durante o período do estudo a pomada iônica hidrofílica com o extrato manteve os seus valores próximos, principalmente no primeiro dia (t24h) e último dia de estudo (t21d), apresentando, então, resultados satisfatórios, e menor variação comparado ao controle.
Da mesma maneira, comparando os dados obtidos da pomada vaselinada com extrato (GRÁFICO 4) e seu controle (GRÁFICO 3), percebe-se que a espalhabilidade da pomada vaselinada com extrato é menor que seu controle. Por outro lado, constata-se que ocorreu uma diminuição na espalhabilidade durante o estudo, comparando os dados iniciais (t24h) com os finais (t21d), observando-se a relação entre o armazenamento e a redução dos valores de espalhabilidade.
A espalhabilidade pode ser definida como a competência da formulação de se espalhar sob uma superfície com aplicação de uma força. É um fator essencial para as formulações farmacêuticas de uso tópico, estando relacionada com a aplicação no local de ação[22]. Bons resultados para essa análise levam a uma melhor aceitação pelo consumidor, visto que, será mais fácil a aplicação do produto na pele lesionada[31].
Diante disto, analisando-se os resultados obtidos para a espalhabilidade das formulações percebe-se que a pomada iônica hidrofílica com extrato apresenta um resultado melhor para a espalhabilidade do que a pomada vaselinada com extrato.
Conclusão
A obtenção do extrato bruto se deu de forma positiva, assim como a identificação dos metabólitos secundários, os quais já eram esperados, conferindo então, diversas ações farmacológicas ao extrato.
Frente aos resultados obtidos nas análises de estabilidade percebe-se, que a pomada vaselinada com extrato bruto de T. catharinensis apresentou pequenas alterações na estabilidade física, como uma pequena perda na sua consistência, leve separação de fases no teste de centrifugação, mostrando que é necessário se repensar na formulação, não sendo promissora para continuação de estudos.
Por outro lado, a pomada iônica hidrofílica com extrato bruto de T. catharinensis apresentou bons resultados nos estudos de estabilidade, visto que, as características organolépticas permaneceram dentro do aceitável para as condições do teste; não houve separação de fases no teste de centrifugação (ciclo gelo-degelo); os valores de pH são compatíveis com o pH cutâneo; na análise granulométrica observou-se uma pequena variação, com uma tendência ao aumento do diâmetro das partículas. A análise da espalhabilidade foi considerada satisfatória. Sendo assim, apresenta-se como uma fórmula promissora para novos estudos, podendo se repensar em ajustes nas quantidades de alguns componentes da formulação. Do mesmo modo, se torna promissora por suas diversas atividades terapêuticas, uma vez que é rica em metabólitos secundários com propriedades cicatrizantes, o que permite sua utilização em feridas diabéticas não cicatrizadas.
Fontes de Financiamento
Nenhuma.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
Ao Professor Renato Zacchia pela identificação botânica da espécie.
Colaboradores
Concepção do estudo: CPK; MP
Curadoria dos dados: CPK; MP
Coleta de dados: TS; MSG
Análise dos dados: CPK; TS; MP
Redação do manuscrito original: TS, CPK; MSG
Redação da revisão e edição: MP; CPK.
Referências
1. Bassani VL, Gonzáles OG, Petrovick PR. Desenvolvimento Tecnológico de Produtos Fitoterápicos. Rev Fitos. 2005; 1(1): 14-7. [acesso em: 18 out. 2021]. [https://doi.org/10.32712/2446-4775.2005.15] [http://revistafitos.far.fiocruz.br/index.php/revista-fitos/article/view/15].
2. Bott RF. Influência do processo de obtenção, condições de armazenamento e propriedades físico-químicas sobre a estabilidade de extratos secos padronizados de plantas medicinais. Ribeirão Preto; 2008. Tese de Doutorado [Ciências Farmacêuticas] - Universidade de São Paulo, USP. Ribeirão Preto; 2008. Disponível em: [https://teses.usp.br/teses/disponiveis/60/60137/tde-02102008-164411/publico/Simplificada.pdf].
3. Boligon AA, Piana M, Schawnz TG, Pereira RP, Rocha JBT, Athayde ML. Chromatographic analysis and antioxidant capacity of Tabernaemontana catharinensis. Nat Prod Commun. 2014; 9:. [acesso em: 18 out. 2021]. ISBN: 1934578X1400900. [https://doi.org/10.1177/1934578X1400900119].
4. Boligon AA, Freitas RB de, Brum TC de, Piana M, Belke BV, Rocha JBT da R et al. Phytochemical constituents and in vitro antioxidant capacity of Tabernaemontana catharinensis A. DC. Free Radic Antioxid. 2013; 3: 77-80. [acesso em: 18 out. 2021] [https://www.antiox.org/index.php/fra/article/view/192]
5. Moreski DB, Bueno FG, Leite-Mello EVS. Ação cicatrizante de plantas medicinais: um estudo de revisão. Arq Ciênc saúde UNIPAR. 2018; 22. [acesso em: 18 out. 2021] [https://doi.org/10.25110/arqsaude.v22i1.2018.6300].
6. Janning D, Albuquerque CAC, Barauna SC. Avaliação preliminar do extrato hidroalcóolico de Tabernaemontana catharinensis no processo de cicatrização de feridas em pele de ratos (Rattus norvegicus). Rev Eletr Farm. 2011; 8(3): 12. [acesso em: 18 out. 2021]. Disponível em: [https://doi.org/10.5216/ref.v8i3.15803].
7. Pascoa H. Desenvolvimento e caracterização de microemulsão à base de óleo de sucupira (P. emarginatus Vog. Fabaceae) e avaliação da atividade antiinflamatória tópica. Goiânia; 2012. Dissertação de Mestrado [Programa de Pós-graduação em Ciências Farmacêuticas] - Universidade Federal de Goiás, UFG. Goiânia; 2012. [http://repositorio.bc.ufg.br/tede/handle/tede/7384].
8. Silva SAM, Valarini MFC, Chorilli M, Venturini A, Leonardi GR. Atividade antioxidante do extrato seco de cacau orgânico (Theobroma cacao) - Estudo de estabilidade e teste de aceitação de cremes acrescidos deste extrato. Rev Ciênc Farm Básica Apl. 2013; 34: 493–501. [acesso em: 18 out. 2021] [https://repositorio.unesp.br/bitstream/handle/11449/133738/ISSN1808-4532-2013-34-04-493-501.pdf].
9. Souza ABC, Frasson APZ. Influência do armazenamento na estabilidade de condicionadores capilares. Rev Contexto Saúde [Online]. 2013; 10: 51-8. [acesso em: 18 out. 2021]. Disponível em: [https://doi.org/10.21527/2176-7114.2010.19.51-58].
10. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. ANVISA. Guia de Estabilidade de Produtos Cosméticos. 52p. 1ª ed. (Série Qualidade em Cosméticos; v. 1). Brasília: ANVISA; 2004. ISBN 85-88233-15-0. Disponível em: [https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/cosmeticos/manuais-e-guias/guia-de-estabilidade-de-cosmeticos.pdf].
11. Leonardi GR, Chorilli M. Dermofarmácia: Bases dermocosméticas, microemulsões & lipossomas. 112p. São Paulo: RX Editora; 2008. ISBN: 8588682052.
12. Ubaid M, Ilyas S, Mir S, Khan AK, Rashid R, Khan MZU et al. Formulation and in vitro evaluation of carbopol 934-based modified clotrimazole gel for topical application. An Acad Bras Ciênc. 2016; 88(4): 2303-17. [acesso em: 18 out. 2021]. [https://doi.org/10.1590/0001-3765201620160162].
13. Costa AF. Farmacognosia: da planta ao medicamento. 6ª ed. Lisboa: Fundação Calouste Gulbenkian; 2002. ISBN: 9789723101409.
14. Alves FS. Estudo fitoquímico e avaliação de toxicidade dos extratos de Furcraea cubensis frente a Artemia salina Leach. João Pessoa; 2017. Trabalho de Conclusão de Curso [Departamento de Química] - Universidade Federal da Paraíba, UFPB. João Pessoa. 2017. [https://repositorio.ufpb.br/jspui/handle/123456789/15946].
15. Batistuzzo JAO, Itaya M, Eto Y. Formulário Médico Farmacêutico. 5ª ed. São Paulo: Atheneu; 2015. ISBN: 9788574541099.
16. Camponogara C, Casoti R, Brusco I, Piana M, Boligon AA, Cabrini DA et al. Tabernaemontana catharinensis leaves effectively reduce the irritant contact dermatitis by glucocorticoid receptor-dependent pathway in mice. Biomed Pharmacother. 2019; 109: 646-57. [acesso em: 18 out. 2021]. [https://doi.org/10.1016/j.biopha.2018.10.132].
17. Friedrich M, Primo FT, Funck JAB, Laporta LV, Alves MP, Bittencourt CF et al. Avaliação da estabilidade físico-química de creme não iônico inscrito no Formulário Nacional. Lat Am J Pharm. 2007; 26(4): 558. [acesso em: 18 out. 2021]. [http://www.latamjpharm.org/trabajos/26/4/LAJOP_26_4_2_2_5423D7P136.pdf].
18. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. ANVISA. Farmacopeia Brasileira. vol. 2. 6ª ed. Brasília: 2019. Disponível em: [https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/farmacopeia-brasileira/arquivos/7989json-file-1].
19. Pasqualoto KFM, Funck JAB, Silva FEB, Kratz CP. Utilização de probitos como instrumento estatístico simples à avaliação da distribuição de tamanho de partículas de dois tipos de celulose microcristalina. Rev Bras Farm [Impresso]. 2005; 86: 31-4.
20. Sinko PJ. Micrométrica. Martin físico-farmácia e ciências farmacêuticas. 5ª ed., Porto Alegre: Artmed; 2008, 810 p. ISBN: 9788536313290.
21. Alves MP, Funck JAB, Bittencourt CF, Silva MAS. Desenvolvimento e avaliação da estabilidade de bases dermatológicas não iônicas para incorporação de fármacos. Rev Pharm Tech [Impresso] 1999; 3: 40-5.
22. Borghetti GS, Knorst MT. Desenvolvimento e avaliação da estabilidade física de loções O/A contendo filtros solares. Rev Bras Ciênc Farm. 2006; 42(4): 531-7. [acesso em: 18 out. 2021]. [https://doi.org/10.1590/S1516-93322006000400008].
23. Boligon AA, Piana M, Kubiça TF, Mario DN, Dalmolin TV, Bonez PC et al. HPLC analysis and antimicrobial, antimycobacterial and antiviral activities of Tabernaemontana catharinensis A. DC. J Appl Biomed. 2015; 13(1): 7-18. [acesso em 18 out. 2021]. [https://doi.org/10.1016/j.jab.2014.01.004].
24. Camponogara C, Casoti R, Brusco I, Piana M, Boligon AA, Cabrini DA et al. Tabernaemontana catharinensis leaves exhibit topical anti-inflammatory activity without causing toxicity. J Ethnopharmacol. 2019; 231: 205-16. [acesso em 18 out. 2021]. [https://doi.org/10.1016/j.jep.2018.11.021].
25. Bueno MJA. Manual de plantas medicinais e fitoterápicos utilizados na cicatrização de feridas. Pouso Alegre; 2016. Dissertação de Mestrado Profissional [Ciências Aplicadas à Saúde] - UNIVÁS. Disponível em: [https://www.univas.edu.br/Egressos_Web/26.pdf].
26. Macedo JL, Pereira IC, Oliveira ASSS, Magalhães MJS. Eficácia da fitoterapia no processo de cicatrização tecidual de pacientes com diagnóstico de Diabetes mellitus. ReOnFacema. 2017; 3: 396-400. [acesso em 18 out. 2021]. [https://www.facema.edu.br/ojs/index.php/ReOnFacema/article/view/182/85].
27. Schenkel EP, Gosmann G, Athayde ML. Saponinas. In: Simões CMO et al. (Orgs.). Farmacognosia: da planta ao medicamento. 6th ed., Porto Alegre: Editora UFRGS; Florianópolis: Editora UFSC; 2007, p. 711-40.
28. Firmino CR, da Costa MC, Andrela ALB, Soares VCG. Avaliação da qualidade de bases farmacêuticas manipuladas no município de Jundiaí–SP. Rev Multidisc Saúde.. 2011; 3: 2-14. [acesso em: 18 out. 2021]. [https://revistas.anchieta.br/index.php/RevistaMultiSaude/article/view/921].
29. Rasche WD. Formulação e análise de gel-creme hidratante facial. Lajeado; 2014. Trabalho de Conclusão de Curso [Curso Técnico em Química] - Centro Universitário UNIVATES. Lajeado. 2014. Disponível em: [https://www.univates.br/tecnicos/media/artigos/Willian_Rasche.pdf].
30. Melo MO de, Campos PMM. Função de barreira da pele e pH Cutâneo. Cosm Toiletr (Brasil). 2016; 28: 34-8. [acesso em: 18 out. 2021]. Disponível em: [https://cosmeticsonline.com.br/ct/painel/class/artigos/uploads/84b9a-_CT283_DIGITALFINAL.pdf].
31. Souza J, Silva DM, Simonetti E, Kauffmann C, Castro LC. O uso de micro-ondas no preparo de emulsão e influência na estabilidade. Rev Cienc Farm Basica Apl. 2013; 34:. [acesso em: 18 out. 2021]. Disponível em: [http://rcfba.fcfar.unesp.br/index.php/ojs/article/view/201].