Artigo de Pesquisa
Descoberta de fármacos a partir de produtos naturais e a abordagem Molecular Power House (MPH)
Natural Product-based Drug Discovery and the Molecular Power House (MPH) Approach
Resumo
A descoberta de fármacos a partir de produtos naturais vivencia uma nova era graças ao uso de tecnologias de ponta e abordagens integradas para superar as dificuldades inerentes à pesquisa com produtos naturais. Estes são substâncias químicas altamente complexas e inovadoras produzidas pela biota, em especial organismos sésseis como plantas e micro-organismos, e representam a principal fonte de inspiração de novos fármacos. Resultante do reavivado interesse na descoberta de medicamentos à base de produtos naturais, novas abordagens para a identificação, caracterização, e reabastecimento de produtos naturais estão sendo desenvolvidas, que podem endereçar alguns dos desafios relacionados ao desenvolvimento de fármacos inspirados em moléculas da biodiversidade. Almeja-se a capacidade de detecção e caracterização de novos produtos naturais bioativos, concomitantemente à redução dos custos e tempo para obtenção destas moléculas. Para isto, é necessário inovar nos processos e nas tecnologias aplicadas à descoberta de fármacos a partir de produtos naturais. A abordagem Molecular Power House (MPH) apresentada neste trabalho faz uso de tecnologias integradas como uma forma de superar gargalos clássicos da pesquisa com produtos naturais de plantas, alinhada ao acesso à maior biodiversidade do planeta, posicionando o Brasil no cenário mundial de descoberta de fármacos inovadores.
- Palavras-chave:
- Descoberta e Desenvolvimento de Fármacos.
- Produtos Naturais.
- Biodiversidade Brasileira.
- Molecular Power House.
- Cristalografia.
- Metabolômica.
Abstract
Natural product-based drug discovery is experiencing a new era thanks to the use of cutting-edge technologies and integrated approaches to overcome the difficulties inherent to natural products research. These are highly complex and innovative chemical substances produced by the biota, in particular sessile organisms such as plants and microorganisms, and represent the main source of inspiration for new drugs. The increasing interest in the discovery of medicines based on natural products has pushed the development of new approaches for the identification, characterization and resupply of natural products, which can address some of the challenges related to the development of drugs inspired by molecules from the biodiversity. The aim is to detect and characterize new bioactive natural products, at the same time as reducing costs and time to obtain these molecules. For this, it is necessary to innovate in the processes and technologies applied to the discovery of drugs from natural products. The Molecular Power House (MPH) approach presented in this work makes use of integrated technologies as a way to overcome classic bottlenecks in plant natural products research, which aligned with access to the greatest biodiversity on the planet, positions Brazil in the global scenario of discovering innovative drugs.
- Keywords:
- Drug Discovery and Development.
- Natural Products.
- Brazilian Biodiversity.
- Power House.
- Crystallography.
- Metabolomics.
Introdução
Os primeiros relatos de uso de ingredientes naturais para fins terapêuticos datam de cerca de 2.500 AC. No entanto, os primeiros fármacos sintéticos como o hidrato de cloral (1832) surgiram no século XIX, e somente se tornaram predominantes após a segunda guerra mundial. Ainda hoje, mais de 50% dos fármacos disponíveis são derivados de ou inspirados em produtos naturais[1].
A despeito do reconhecido potencial de descoberta de estruturas moleculares inovadoras, as dificuldades inerentes à pesquisa com produtos naturais levaram a indústria farmacêutica a investir em metodologias sintéticas, tais como química combinatória e síntese paralela, com a produção de milhares de compostos para avaliação e desenvolvimento. Embora muitos fármacos inovadores tenham surgido assim, as abordagens sintéticas não conseguiram superar o poder dos produtos naturais como inspiração para novos fármacos[1].
Existem características fundamentais entre compostos sintéticos imaginados (por nós humanos) ao longo de algumas décadas, e produtos naturais que evoluíram durante milhões de anos para desempenharem uma função biológica específica. Uma delas é a estrutura química, comumente tridimensional em produtos naturais, proporcionando interações privilegiadas com as moléculas biológicas, tais como proteínas e enzimas, que representam os alvos para tratamento de doenças. Por outro lado, compostos sintéticos muitas vezes possuem uma estrutura mais planar, podendo limitar essas interações com os alvos biológicos. Por isso, químicos sintéticos e medicinais têm procurado se inspirar em produtos naturais, criando moléculas híbridas, ou moléculas com estruturas mais tridimensionais, surgindo assim um movimento de desenvolvimento de novas metodologias dedicadas à síntese de arquiteturas mais complexas, visando alcançar um espaço químico similar ao dos produtos naturais[2].
A FIGURA 1A traz a representação do espaço químico dos produtos naturais, dos fármacos já aprovados para uso humano, de moléculas bioativas (fármacos avançados na cadeia de desenvolvimento, mas ainda não aprovados para uso humano), e de bibliotecas químicas comerciais de origem sintética. É notável a inclusão de moléculas mais complexas na coleção de produtos naturais e a limitação desta complexidade química nas coleções sintéticas. Também chama a atenção que os fármacos aprovados e as moléculas bioativas contemplam também moléculas complexas, podendo indicar que a complexidade é um fator importante para a viabilidade de estruturas químicas como fármacos, sendo que há muitos casos que não atendem as regras dos 5 de Lipinski para fármacos de administração oral.
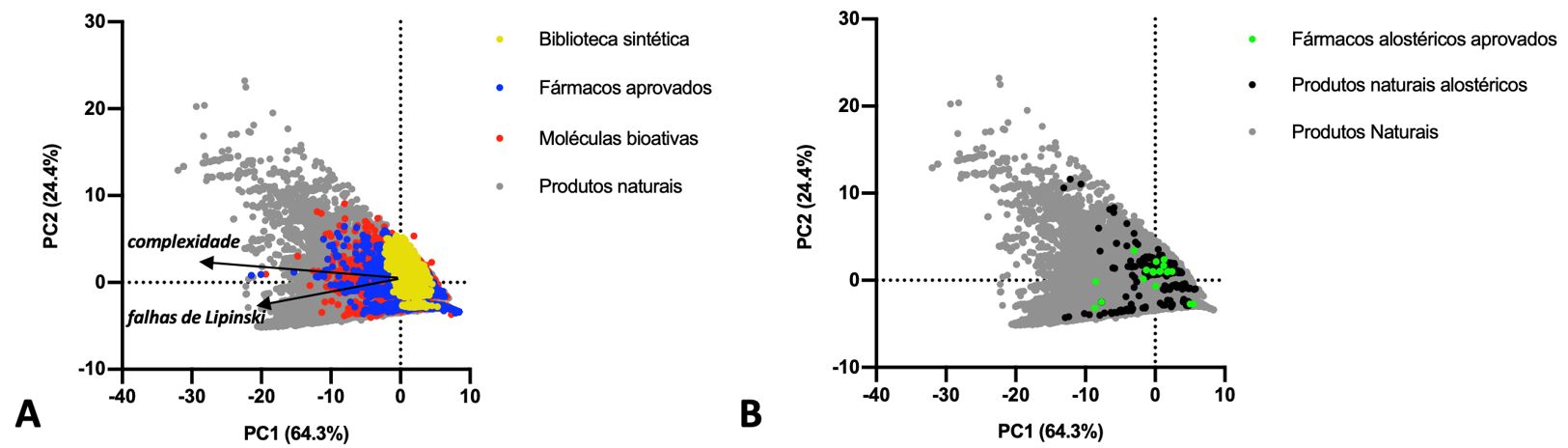
O espaço químico é representado via análise de componentes principais (PCA) das moléculas que compõe cada coleção, sendo cada molécula representada por um ponto no gráfico. As variáveis consideradas foram os descritores moleculares de cada molécula analisada. A PCA foi construída seguindo o descrito por Bruder e colaboradores[3]. As variáveis de complexidade foram agrupadas em um único vetor para melhor visualização. Este aponta para os quadrantes PC1< 0. Desta forma, o quadrante oposto (PC1> 0) contém moléculas pequenas, planares e de baixa complexidade. O vetor de falhas de Lipinski também aponta para os quadrantes PC1< 0, sendo as moléculas mais propensas a biodisponibilidade oral localizadas nos quadrantes opostos (PC1 >0). (A) Estão representadas a biblioteca química UNPD-ISDB[4], contemplando 208.240 produtos naturais (cinza), 2.274 fármacos aprovados (azul) e 9.197 candidatos a fármaco disponíveis no DrugBank[5] (vermelho), e 20.000 moléculas da biblioteca ChemBridge, como exemplo de biblioteca comercial de origem sintética (amarelo). (B) Adicionalmente estão representados os fármacos alostéricos aprovados (n=19, verde)[6] e os produtos naturais alostéricos (n=225, preto)[3].
Há uma tendência também na exploração do mecanismo de regulação alostérica de proteínas por fármacos em proteínas complexas, conservadas e de alto interesse clínico[3,7-12]. Estas novas oportunidades para o desenvolvimento dos fármacos do futuro requerem moléculas diversas e, muitas vezes, complexas. A FIGURA 1B traz a análise do espaço químico, representando também os fármacos alostéricos já aprovados[6] e os produtos naturais reportados como inibidores alostéricos de proteínas de interesse farmacêutico[3]. Fica novamente evidente a importância da diversidade química dos produtos naturais para busca e desenvolvimento de novos fármacos inovadores.
Todavia, há ainda muito que a Natureza possa nos ensinar no contexto aqui exposto, principalmente em relação a novas moléculas e arquiteturas químicas. Para tornar a identificação e o desenvolvimento de novas moléculas bioativas mais eficientes, é preciso superar os gargalos atrelados à descoberta de novos produtos naturais bioativos. Historicamente, o mapeamento de substâncias químicas produzidas por organismos vivos e a avaliação da atividade biológica destas requer o isolamento em alto grau de pureza destas substâncias, bem como a obtenção de quantidades suficientes (~10 mg) para executar os diversos ensaios que visam determinar a estrutura química e caracterizar a atividade biológica dos produtos naturais. Isto envolve a obtenção de extratos da fonte natural na faixa de dezenas de gramas, bem como processos intensivos de purificação que fazem uso de litros de solventes orgânicos, entre outros consumíveis. A pureza e a quantidade obtida do produto natural purificado também vão garantir a qualidade das análises químicas visando a elucidação estrutural, bem como a atividade biológica, e com isso, a identificação do composto bioativo. Universidades e centros de pesquisa têm assim conseguido milhares de moléculas para avaliação de atividades biológicas nas mais diversas áreas terapêuticas ao longo dos anos. No entanto, estima-se a existência de milhões de produtos naturais[13], sendo muitos ainda desconhecidos.
Como dito anteriormente, quantidades suficientes do produto natural são necessárias para conseguir todas as informações relevantes para a validação da bioatividade, e isso pode se tornar um grande gargalo no desenvolvimento de novos fármacos a partir de produtos naturais. Os principais problemas neste ponto são: o acesso à amostra natural em quantidade; o tempo dedicado ao isolamento do composto bioativo e; a reprodutibilidade da preparação. É difícil rastrear o organismo de origem (planta, fungo ou micro-organismo) para repor o estoque, uma vez que o local e o período do ano da coleta do material, por exemplo, podem influenciar sua composição química, e estas informações nem sempre estão disponíveis. Além disto, muitos dos produtos naturais ainda desconhecidos são substâncias químicas produzidas em quantidades muito pequenas pelos organismos da biota. Geralmente, são minoritários nos extratos de produtos naturais, tornando sua detecção, identificação e isolamento um grande desafio. Por exemplo, o isolamento do taxol levou mais de dois anos desde a descoberta que extratos de Taxus brevifolia exerciam importante ação anticâncer.
Considerando que existem muitas proteínas alvo para doenças para as quais ainda não se encontraram moléculas capazes de modular sua função, que produtos naturais são a grande fonte de novas moléculas bioativas, e que a indústria de fármacos é cada vez mais competitiva, almeja-se a capacidade de detecção e caracterização de novos produtos naturais bioativos, concomitantemente à redução dos custos e tempo para obtenção destas novas e inovadoras substâncias químicas. Para isto, é necessário inovar também nos processos e nas tecnologias aplicadas à descoberta de fármacos a partir de produtos naturais.
A abordagem MPH (Molecular Power House), realizada em colaboração entre o CNPEM e a Phytobios, visa explorar exatamente estes pontos, viabilizando a descoberta de novos fármacos a partir de produtos naturais da biodiversidade brasileira, o principal diferencial do Brasil, gerando informações de alto valor com a aplicação da alta tecnologia. Neste artigo, serão apresentadas as principais abordagens em uso na plataforma MPH, com ênfase no rastreamento e mapeamento de produtos naturais produzidos por plantas brasileiras, identificação e caracterização dos produtos naturais bioativos, gerando informação para o desenvolvimento de novos fármacos, e estratégias sustentáveis para a produção dos insumos de origem vegetal. Uma breve introdução aos processos de descoberta e desenvolvimento de fármacos será dada, visando contextualizar o problema e principal contribuição dos produtos naturais para inovação na cadeia de desenvolvimento de novos fármacos.
Processo de descoberta e desenvolvimento de novos fármacos
A descoberta e desenvolvimento (DD) de fármacos é um processo de alto custo e risco. Em média, o desenvolvimento de um novo fármaco leva 20 anos, com custos médios na ordem de 1 bilhão de dólares[14].
O processo de descoberta e desenvolvimento de fármacos pode ser organizado em 3 grandes etapas: Descoberta, Desenvolvimento e Registro (FIGURA 2A).
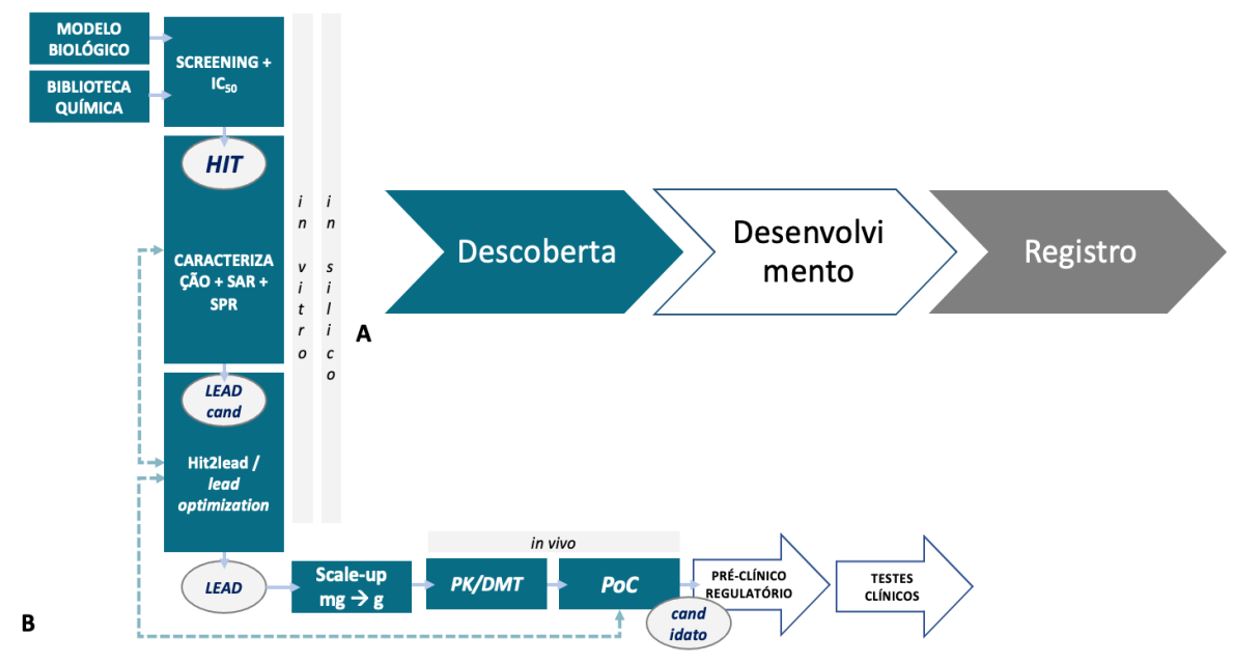
A etapa de Descoberta é a etapa que mais contribui para a inovação. Esta etapa envolve a obtenção da molécula protótipo do princípio ativo do novo medicamento, o fármaco-candidato. Vários estudos experimentais e computacionais são empregados, partindo da triagem de milhares de moléculas em um dado modelo biológico da doença, obtendo-se as moléculas de partida (hits), passando por etapas de caracterização e otimização do hit em um lead, e finalmente obtendo-se o fármaco-candidato, validado em experimentos exploratórios em modelos animais (FIGURA 2B). O fármaco-candidato é uma molécula eficaz e segura nos modelos in vitro e animais, e sua obtenção constitui o sucesso da execução da fase de Descoberta.
O fármaco-candidato passará então à fase de escalonamento e aos estudos regulatórios em modelos animais e, em seguida, aos estudos clínicos em seres humanos, todos estes constituindo a etapa de Desenvolvimento.
Inovação, interdisciplinaridade e tecnologias como diferenciais para a etapa de Descoberta
A etapa de Descoberta é em geral realizada na academia, institutos de pesquisa e centros de pesquisa em inovação radical de indústrias farmacêuticas. É uma etapa multidisciplinar que envolve o conhecimento biológico e químico sobre o fármaco e sobre a biologia da doença, sendo desempenhado em geral por biólogos, químicos, farmacêuticos, médicos ou profissionais de áreas correlatas. Atualmente, a etapa de Descoberta vem contando também com o papel dos informatas (químio/bio e cientistas da computação/informação), uma vez que mais e mais a etapa de descoberta de um novo princípio ativo envolve a geração e mineração de grandes bases de dados. Novas disciplinas vêm sendo também inseridas, como a física voltada para imageamento biológico, usando novos recursos para obter imagens de alta resolução de moléculas, proteínas, células e organismos inteiros.
Os síncrotrons de quarta geração, como o Sirius (LNLS-CNPEM, Campinas, Brasil) têm cada vez mais importância nesta etapa, mostrando em alta definição a biologia da doença no início da etapa de Descoberta e, ao final destes projetos, a interação do lead com o alvo biológico e seu efeito no organismo. A cristalografia de proteínas, que também utiliza raios X e fontes de luz sincrotron, tem papel central na etapa da Descoberta de plataformas DD modernas, pois gera imagens tridimensionais da proteína alvo em complexo com hits e leads, viabilizando o planejamento racional de moléculas baseado na estrutura do receptor biológico (SBDD: structure-based drug design).
Outro diferencial de plataformas de Descoberta de fármacos é o uso de produtos naturais como moléculas para triagem ou moléculas de partida. Como já mencionado, os produtos naturais sempre tiveram e continuam tendo papel importante na descoberta de novas estruturas químicas e novos modos de ação para o desenvolvimento de fármaco-candidatos.
Dito isto, a combinação de produtos naturais e tecnologias modernas, como as oferecidas por fontes de luz sincrotron, aliada a formação e mineração de base de dados correlacionais traz diferenciais competitivos únicos para a etapa de Descoberta. A abordagem MPH utiliza esta combinação para inovar na área farmacêutica no Brasil, empregando a biodiversidade brasileira e as tecnologias disponíveis no CNPEM, como o Sirius e a plataforma computacional NP³.
Material e Métodos
Para este relato foram selecionadas as etapas principais da abordagem MPH (Molecular Power House), desenvolvida pelo CNPEM e a Phytobios para descoberta de novos fármacos a partir da biodiversidade brasileira usando alta tecnologia brasileira. Os métodos serão descritos na seção "Resultados", juntamente com a apresentação de cada etapa chave da abordagem MPH. São também incluídas informações relevantes a partir da experiência de desenvolvimento de projetos em parceria com a indústria farmacêutica.
Resultados e Discussão
A abordagem MPH para a descoberta de fármacos a partir da biodiversidade e novas tecnologias brasileiras
A abordagem MPH (Molecular Power House) visa viabilizar a descoberta de novos produtos naturais bioativos, atuando desde a etapa da coleta de exemplares da biota até a produção dos leads e fármacos-candidatos, gerando no processo, importante informação molecular sobre o produto natural e seu mecanismo de ação. Isto garante a geração da informação química e biológica para embasar o desenvolvimento de novos fármacos, otimizando os processos da fase de Descoberta. Assim aproximam-se o tempo e custo da etapa de descoberta de leads a partir dos produtos naturais dos processos empregados em programas embasados em bibliotecas sintéticas, porém usando toda a diversidade química dos produtos naturais. A partir daí, abordagens sintéticas, semissintéticas ou de extração dos hits e leads a partir da fonte natural são empregadas, garantindo a realização das etapas de otimização dos hits e leads, provas de conceito e estudos regulatórios in vivo (FIGURA 3 ).
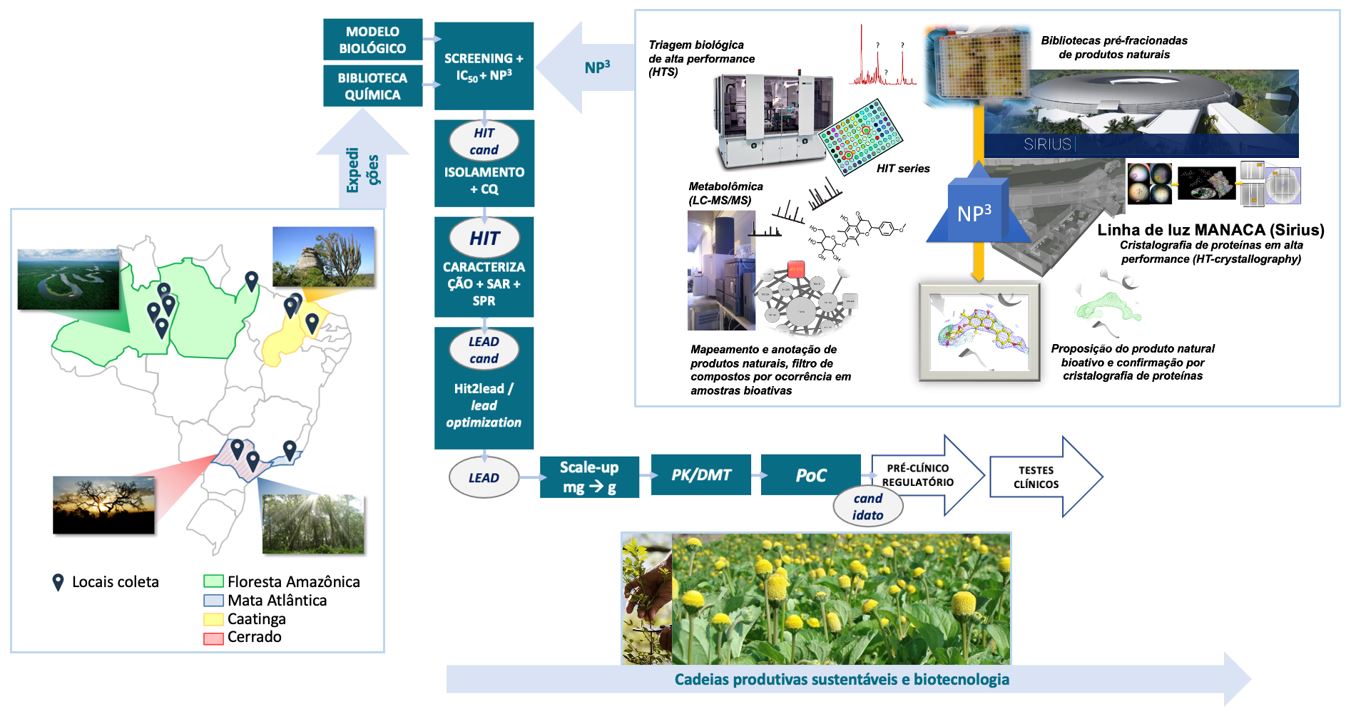
Coletas profissionalizadas com rastreabilidade das amostras e processo de produção
A primeira etapa deste processo é garantir expedições em campo rastreáveis para coleta, avaliação e reposição dos compostos produzidos pela biota. A Phytobios desenvolveu um protocolo para padronizar procedimentos de acesso, coleta e produção de amostras de componentes da flora no âmbito da parceria MPH. O objetivo deste protocolo foi fornecer informações práticas para o planejamento e a execução da amostragem, incluindo a escolha das áreas, boas práticas de manejo e a atenção à legislação, auxiliando assim nos processos de tomada de decisão sobre os melhores procedimentos a serem adotados nas atividades de coleta de flora e nos cuidados que devem ser tomados com os ambientes onde estão as espécies manejadas. O protocolo das expedições de campo e coleta do material vegetal é apresentado no Material Suplementar.
Preparação dos extratos vegetais
Para preparação dos extratos brutos foi escolhido etanol como solvente padrão, por garantir a extração de um amplo espectro de compostos, mesmo que alguns deles sejam extraídos com menor eficiência. As modernas técnicas de isolamento e elucidação estrutural, associadas aos ensaios bioguiados de alto desempenho, ou HTS (do inglês, high throughput screening) e técnicas de cristalografia permitiram esta escolha de ter um solvente único para preparação dos extratos brutos. Os extratos são então concentrados e a água residual eliminada para seguir nas próximas etapas do processo.
Processo de fracionamento e construção de bibliotecas pré-fracionadas
Os benefícios do pré-fracionamento para os esforços de triagem têm sido discutidos anteriormente em publicações científicas. Para ensaios bioquímicos de HTS, o uso de bibliotecas pré-fracionadas reduz significativamente o número de compostos presentes em amostras ativas e auxilia no isolamento e a elucidação estrutural. Por exemplo, a biblioteca do National Program for Natural Products Discovery (NPNPD), uma biblioteca pré-fracionada pertencente ao US National Cancer Institute (NCI), é composta de sete frações por produto bruto extrato, e mostrou conter algo entre 2 a 28 compostos por fração quando analisados por detectores LC-MS-ELSD[15].
Nós também mostramos recentemente, que bibliotecas pré-fracionadas trazem benefícios, tanto na detecção química, como da atividade biológica de amostras naturais[16]. As frações enriquecidas reduzem a complexidade das amostras (FIGURA 4A) e evidenciam compostos minoritários, bioativos e raros (FIGURA 4B). A FIGURA 4B traz o espaço químico dos produtos naturais conhecidos detectados na biblioteca de plantas brasileiras MPH, utilizando amostras de extratos brutos e frações enriquecidas. É evidente a expansão do espaço químico proporcionado pelas frações enriquecidas, principalmente na direção de moléculas mais complexas, ainda no espaço dos fármacos e moduladores alostéricos raros (FIGURA 4 B).
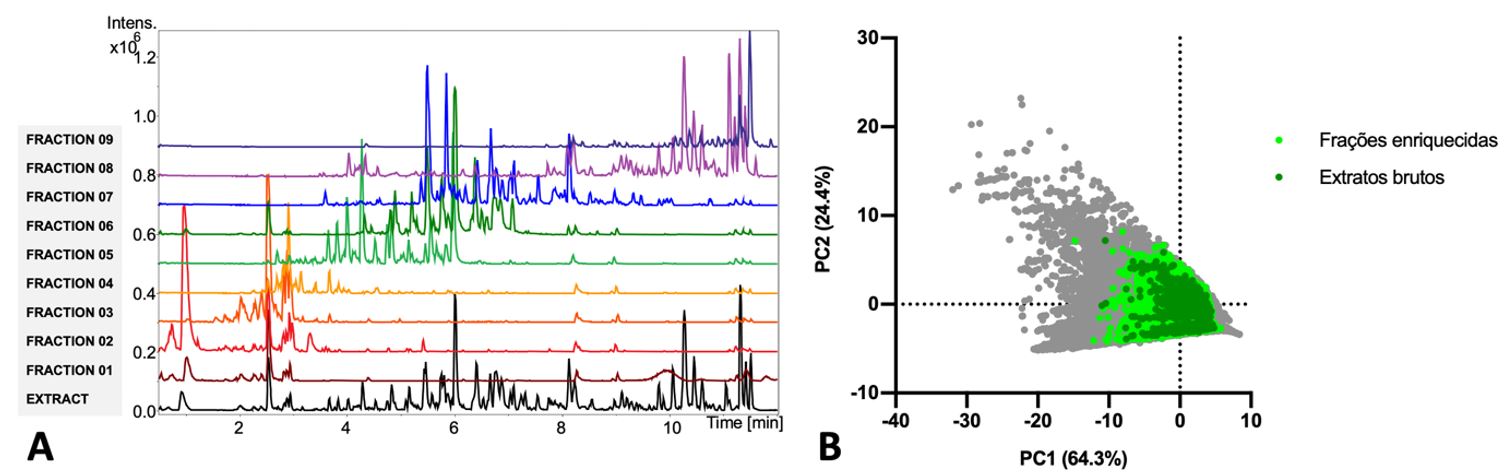
Nesta análise as frações foram geradas por cromatografia líquida de fase reversa em sistema HPLC preparativo. Os extratos brutos e frações enriquecidas gerados foram ressuspensos em DMSO, a concentração de 10 mg/ml, e analisados por cromatografia líquida acoplada a espectrômetro de massas. Os espectros de fragmentação obtidos foram contrastados com espectros de produtos naturais depositados nas bases de dados GNPS e UNPD-ISDB. As anotações das estruturas (65% dos espectros) foram consideradas para extração dos descritores moleculares dos produtos naturais e avaliação por análise de componentes principais.
A abordagem NP³ para prospecção de moléculas bioativas a partir de bibliotecas pré-fracionadas de produtos naturais
A instrumentação, hoje disponível, permite a avaliação em alto rendimento (high throughput) e com alta sensibilidade de alguns parâmetros físico-químicos e biológicos das moléculas naturais, sem a necessidade de isolamento das moléculas e a partir de uma quantidade muito pequena da amostra natural (<µg). Técnicas como espectrometria de massas, ensaios biológicos em escala de nanolitros e cristalografia de proteínas em larga escala são hoje, realidade e estão disponíveis no Brasil, como o acelerador de partículas Sirius (LNLS-CNPEM, Campinas, SP, Brasil).
Estas técnicas, altamente sensíveis, são complementares e revelam a fórmula molecular, a distribuição espacial e a atividade biológica de moléculas naturais, mesmo que em misturas (forma de como são extraídas dos organismos da biota). Porém, os dados obtidos individualmente são imensos e incompletos. No entanto, aplicando abordagens de mineração de dados e relação ortogonal entre as diferentes informações obtidas por tais técnicas experimentais, é possível convoluir a informação, retornando a composição e a estrutura química da molécula bioativa oriunda da biodiversidade, além de sua conformação e modo de interação com a proteína alvo. Isto retorna as informações desejadas sobre novas moléculas da biodiversidade no contexto de descoberta de fármacos, em poucas etapas experimentais e quantidades ínfimas da amostra da biodiversidade.
A plataforma computacional NP³, que é um conjunto de algoritmos capazes de tratar os 3 dados experimentais e, em comparação com bancos de dados correlacionais, retorna a estrutura química e modos de interação do produto natural bioativo com a proteína alvo (FIGURA 5 ).
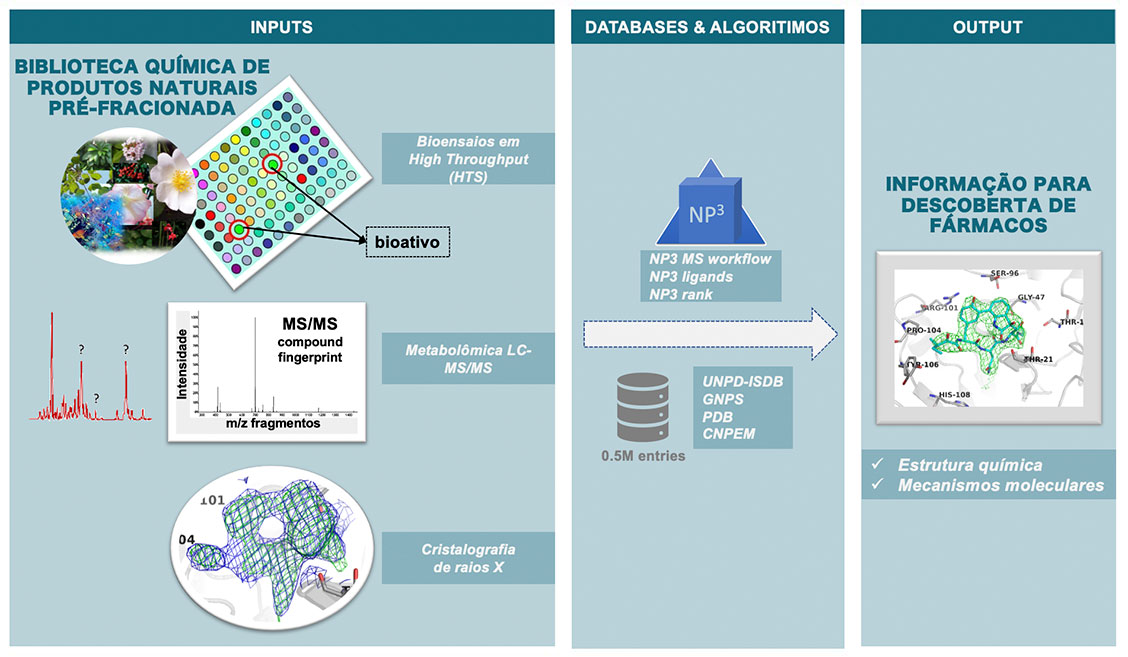
Conhecer a composição das amostras da biota é, portanto, um primeiro desafio. Esta etapa vem sendo facilitada por abordagens de metabolômica baseadas em espectrometria de massas[16-18]. O escaneamento das amostras da biota por cromatografia líquida acoplada a espectrometria de massas (LC-MS/MS) provém informação da massa exata, espectro de fragmentação e tempo de retenção cromatográfico como os parâmetros físico-químicos que descrevem cada molécula em uma amostra da biodiversidade. Os seguintes parâmetros são extraídos de análises LC-MS/MS:
- massa exata: fórmula química (composições químicas mais prováveis para uma dada molécula);
- espectro de fragmentação: forma de quebra de uma dada molécula, indicando seus fragmentos mais estáveis (fingerprint molecular);
- tempo de retenção cromatográfico: revela a interação da molécula com matriz conhecida; no caso de coluna de fase reversa (C18), indica a polaridade das moléculas e separa isômeros moleculares (mesma fórmula química, porém diferente arranjo espacial, conferindo diferente interação com a matriz cromatográfica).
A partir dos dados LC-MS/MS obtidos pode-se construir base de dados correlacionais anotadas, contendo os espectros MS/MS de produtos naturais conhecidos e desconhecidos. Bases de dados públicas também são disponíveis, como UNPD-ISDB4 (~300 mil espectros MS/MS calculados in silico a partir de produtos naturais conhecidos e depositados no UNPD) e GNPS5 (~10 mil espectros MS/MS experimentais de produtos naturais). O CNPEM também está construindo um banco de dados MS/MS de amostras da biodiversidade (~6 mil amostras naturais, contendo ~50 mil espectros MS/MS) e moléculas sintéticas ou naturais comerciais (~10 mil moléculas isoladas obtidas comercialmente).
Para correlacionar um novo fingerprint MS/MS com o base de dados utiliza-se como unidade de correlação um score de similaridade (MQScore) entre espectros MS/MS. Alguns algoritmos estão disponíveis para isto, como o desenvolvido no CNPEM e disponível sob licença GNU: NP³ MS workflow (INPI BR512021000074-9) https://github.com/danielatrivella/NP³_MS_Workflow.
Em paralelo às análises químicas das amostras naturais, almeja-se conhecer a bioatividade das amostras naturais e, em particular, qual substância que confere esta atividade biológica. Esta etapa é facilitada pela abordagem NP³, através da avaliação de coleções de produtos naturais pré-fracionadas por HTS (high throughput screening), onde milhares de amostras da biodiversidade são avaliadas de uma só vez em ensaio bioquímico ou celular. Como resultado, a cada amostra natural avaliada é retornado um valor de bioatividade, como % de inibição da proteína ou % de efeito em células. Para aferição ainda mais quantitativa da atividade biológica nas diferentes amostras naturais da série cromatográfica presente na biblioteca química pré-fracionada (vide FIGURA 4), faz-se curvas de diluição seriada destas amostras, ainda em escala miniaturizada, extraindo-se os valores de potência (IC50 ou EC50, por exemplo) de cada amostra da série bioativa.
Comparando-se a presença de cada fingerprint químico LC-MS/MS com os valores de atividade biológica em cada amostra da série cromatográfica,extrai-se o coeficiente de correlação de atividade biológica (BCC: bioactivity correlation coeficient) para cada fingerprint químico (produto natural), correlacionando a bioatividade observada com a quantidade de cada produto natural detectado por espectrometria de massas em cada amostra da biodiversidade analisada. O BCC é calculado por correlação de Spearman e é realizado automaticamente pelo algoritmo NP³ MS workflow, módulo biocorrelation, desenvolvido no CNPEM. Com isto, obtém-se um ranking de produtos naturais candidatos a explicar a bioatividade observada nesta série cromatográfica. Ademais, os fingerprints químicos são comparados à base de dados de espectros MS/MS, onde pode-se então realizar a anotação de estruturas químicas correspondentes a estes fingerprints químicos, iluminando a estrutura química e classes de produtos naturais presentes nas amostras bioativas.
Uma complementação importante da abordagem NP³ é o uso de cristalografia de proteínas no processo de elucidação e proposição do produto natural bioativo em uma dada amostra bioativa da biota. Utilizando o pipeline instalado na abordagem NP³ é possível capturar o produto natural bioativo diretamente em cristais da proteína alvo, revelando sua estrutura tridimensional e o sítio de interação com a proteína alvo. O produto natural bioativo, contido na mistura de moléculas naturais desconhecidas da amostra da biota, é diretamente capturado no cristal da proteína alvo por meio da técnica de captura cristalográfica, sem necessidade de isolamento a partir da amostra da biota. A captura cristalográfica consiste em incubar o cristal da proteína com a amostra natural bioativa. Este experimento é realizado em escala de microlitros, consumindo poucos microgramas da amostra natural. Os experimentos de difração de raios X são realizados em estações experimentais, como a linha Manacá do SIRIUS (LNLS-CNPEM), um acelerador de elétrons de última geração, que entrou recentemente em operação no CNPEM, em Campinas-SP. Os dados de cristalografia de proteínas provêm o mapa de densidade eletrônica da proteína, o qual é utilizado para calcular sua estrutura atômica em 3 dimensões. Na abordagem NP³, a densidade eletrônica remanescente revela a presença do produto natural bioativo ligado à proteína, seu sítio e posições atômicas de interação com a proteína alvo (FIGURA 5, input cristalografia de proteínas).
Dados ortogonais de espectrometria de massas e cristalografia de proteínas resultam na sugestão da molécula bioativa, seu potencial de inovação e novidade química e biológica (FIGURA 5, output). A abordagem NP³ utiliza um mínimo da amostra (~100 µg), sem necessidade de isolamento do produto natural, pois as técnicas empregadas, em si, conseguem analisar individualmente os produtos naturais, mesmo que em misturas complexas de amostras da biota. Tão importante quanto à escala reduzida, é a escala de tempo da abordagem NP³, sendo que o procedimento completo pode ser realizado em 1 semana.
Para confirmar a estrutura química e atividade biológica do produto natural sugerido pela abordagem NP³, é válido investir no isolamento desta substância natural. Porém, isto só é realizado para os produtos naturais que de fato se mostrarem inovadores, tanto em relação a estrutura química, quanto ao sítio e modo de interação com o alvo biológico (proteína).
Os estudos confirmatórios e de caracterização adicional do produto natural bioativo selecionado pode requerer muito material de partida (dezenas de gramas do extrato natural) e muito trabalho de laboratório (meses de etapas de separação que requerem solventes orgânicos). Ao mesmo tempo, o trabalho de isolamento do produto natural deve ser acompanhado de reavaliação da atividade biológica das amostras geradas, o que infere uma sincronia de experimentos químicos e biológicos. Na abordagem clássica de descoberta de produtos naturais bioativos, a substância de interesse só é revelada após a conclusão deste longo e laborioso processo. Nestes casos, muitas vezes a molécula não tem potencial de inovação - não é nova, atua por mecanismo de ação indesejado (tóxico ou já com outras moléculas disponíveis no mercado), é de obtenção inviável (por fonte sintética ou natural), ou tem propriedades farmacocinéticas não ideais para prosseguir na cadeia de desenvolvimento. Por isso, é essencial conhecer de antemão quem é o produto natural bioativo da amostra da biota e seu potencial de inovação na área terapêutica de estudo, antes de partir para os esforços de isolamento e caracterização adicional do produto natural bioativo. Esta é a informação essencial que a abordagem NP³ traz, rapidamente e em escala miniaturizada, focando os esforços e dificuldades inerentes à pesquisa em produtos naturais apenas às amostras da biota e produtos naturais com potencial de inovação.
Estratégias de aproveitamento da informação e potencial de inovação
A informação que um complexo cristalográfico alvo: proteína com atividade confirmada oferece é extremamente valiosa para a descoberta e o desenvolvimento de fármacos. Na hipótese de que o produto natural hit apresente bom potencial de obtenção da fonte natural, ou por síntese (ou até semi-síntese), estratégias de avaliação de análogos por estudos in silico (docking e SBDD) podem ser conduzidas. A síntese dos análogos com maior potencial visa melhorar tanto a afinidade pelo alvo, quanto suas propriedades e farmacocinéticas, uma vez que estas são diretamente correlacionadas à estrutura química dos compostos.
Estratégias de aproveitamento da fonte natural para a produção de novos análogos para avaliação biológica, por semi-síntese, podem ser também contempladas. Na hipótese contrária, a síntese total pode ser empregada, porém com limitações inerentes à complexidade dos produtos naturais.
Alternativamente, as características do sítio de ligação da molécula hit ainda podem ser aproveitadas para realizar triagens virtuais (por computador) de bibliotecas comerciais, procurando então novos hits, desta vez baseados em estruturas químicas mais acessíveis do ponto de vista sintético. Em ambos os casos - derivados do produto natural hit ou novas classes químicas - ciclos de otimização podem iniciar, onde cada ciclo aponta quais porções das moléculas proporcionam alta afinidade e/ou parâmetro farmacológico adequado. Estas análises são chamadas de relação estrutura-atividade (SAR, do inglês structure activity relationship) e/ou estrutura-propriedade (SPR, do inglês structure property relationship). Vale então destacar novamente a importância dos produtos naturais como fonte de inspiração para novos fármacos, sejam eles derivados da estrutura química inicial ou tenham estes sido produzidos de novo a partir das informações valiosas fornecidas pelo modo de interação com o alvo biológico envolvido na doença. Um exemplo de aplicação destas estratégias é ilustrado na FIGURA 6, a exemplo de projeto de inovação em desenvolvimento em parceria com a Unidade de Inovação Radical do Aché Laboratórios (Guarulhos, SP, Brasil), em alinhamento ao Programa Bioprospera® do Aché [19], sendo co-financiado pela EMBRAPII ( FIGURA 6 A).
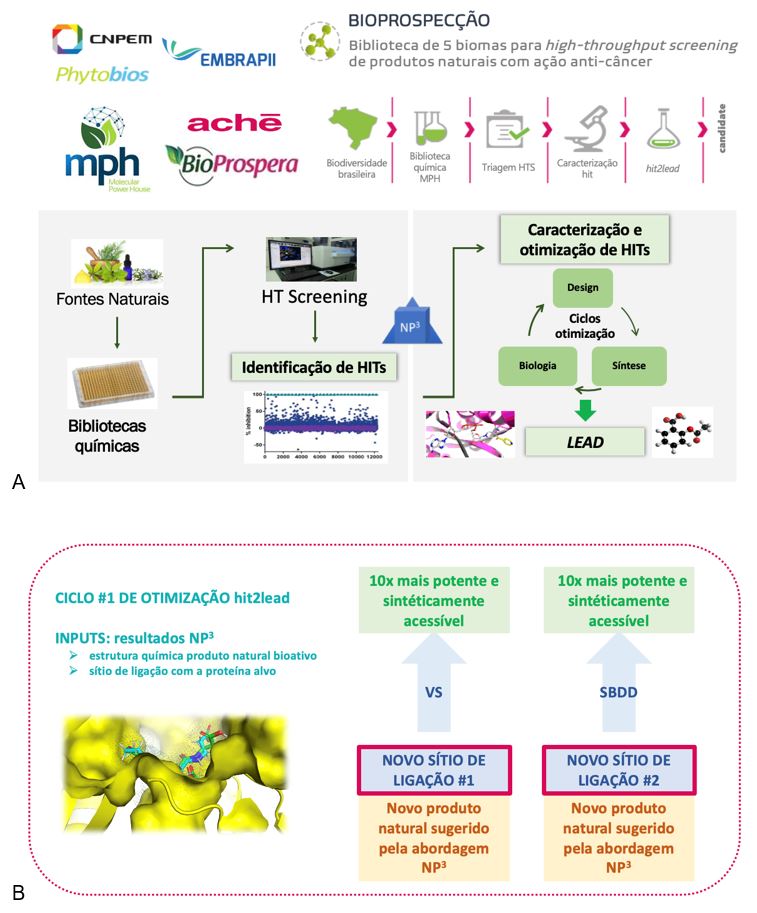
O projeto ilustrado na FIGURA 6 iniciou da triagem da biblioteca pré-fracionada MPH, passando pela abordagem NP³ para a descoberta de produtos naturais bioativos e novos sítios de ligação na proteína alvo. Duas classes de produtos naturais foram identificadas após a triagem da biblioteca MPH. Os estudos cristalográficos mostraram a ligação destes produtos naturais em dois sítios distintos da proteína alvo (sítio #1 e sítio #2) - FIGURA 6B. Estes achados são inéditos, relacionando novos sítios e modos de ligação de pequenas moléculas com a proteína alvo, assim como novas classes químicas de ligantes desta proteína.
As informações estruturais obtidas para sítio de ligação #1 foram empregadas para triagem virtual de moléculas comerciais, visando melhorar as propriedades físico-químicas do produto natural hit e sua potência de ligação ao alvo. Foi encontrada uma molécula com boas propriedades de fármaco e fácil obtenção sintética, e que ainda demonstrou melhora de potência ao alvo isolado e células modelos em 10 vezes.
Para o sítio #2, as informações estruturais foram utilizadas para desenhar racionalmente novas moléculas da mesma classe química, porém com propriedades físico-químicas superiores e maior potência de inibição da proteína e das células alvo. Ambos os parâmetros foram otimizados em relação ao produto natural que inspirou a série química. Mais importante, o sítio de ligação desta nova classe de produtos naturais a este alvo terapêutico mostra um novo mecanismo de regulação alostérica do alvo, sendo totalmente inovador.
A colaboração com Aché Laboratórios, que possui um programa específico para pesquisa e desenvolvimento de produtos naturais, denominado Bioprospera® [19], tem permitido o desenvolvimento de uma abordagem translacional para a biblioteca MPH, por meio do planejamento racional de fármacos a partir de hits identificados na biblioteca MPH visando identificar inibidores potentes, seletivos e com boas propriedades farmacocinéticas para os alvos de interesse. Além disso, a definição do "Perfil de Produto Alvo" para os candidatos à fármaco, em conexão ao desenho de ensaios e métodos de screening focados em avaliar o potencial desses candidatos, tem guiado a identificação de moléculas que possam ser utilizadas no contexto da refratariedade de tumores às terapias atuais, ou mesmo na avaliação do potencial sinérgico dessas moléculas com as terapias vigentes.
Reabastecimento (resupply) de compostos hits e a importância da rastreabilidade
No entanto, nem sempre a informação obtida em escala miniaturizada pode ser diretamente utilizada para inspirar novos leads e, muitas vezes, o produto natural em si já representa uma molécula otimizada para avançar na cadeia de desenvolvimento de novos fármacos. Faz-se então necessário o reabastecimento (resupply) de extratos, o que também é contemplado na abordagem MPH.
O resupply dos extratos selecionados nas etapas miniaturizadas do projeto é necessário para etapas de confirmações da estrutura química e bioatividade da descoberta. Esta etapa de confirmação requer gramas dos extratos para o isolamento de miligramas do produto natural isolado. Já nos casos em que produto natural per se será avançado para as etapas de identificação do alvo (em caso de prospecção a partir de ensaios fenotípicos), estudos em células e testes em animais, é necessário obter gramas do produto natural isolado, requerendo, em geral, quilos dos extratos.
Na plataforma MPH, a questão do resupply é mapeada já na etapa das expedições de campo iniciais. Isto ocorre por meio de um procedimento de coleta padronizado (vide material suplementar), que reúne ferramentas de rastreabilidade incluindo, entre outros, o registro preciso do local e condições climáticas da coleta e identificação assertiva da espécie botânica coletada. Este procedimento de coleta, aliado ao registro da assinatura química das amostras por espectrometria de massas, resulta em uma robusta base de dados das expedições e espécimes, que são fundamentais para garantir a rastreabilidade das amostras e compostos bioativos, bem como do reabastecimento de extratos selecionados ao longo do projeto.
Vale também comentar que, apesar de todo esforço de rastreabilidade, fatores externos como queimadas, mudanças climáticas, negociações de áreas podem continuar sendo fatores de risco para o resupply. O gerenciamento destes riscos traz retornos do ponto de vista do potencial de novidade para estruturas moleculares inéditas nos biomas brasileiros. Em adição, a robusta base de dados constituída desde a primeira coleta da espécie permite, além de localizar a espécie em seu local original de coleta, encontrar localizações adicionais alternativas, ou ainda, ampliar a fonte do produto natural de interesse para espécies relacionadas por quimiotaxonomia. Contudo, estas são algumas das abordagens empregadas na Plataforma MPH para contornar os principais riscos inerentes ao resupply de produtos naturais.
Por fim, a capacidade de adquirir quantidades suficientes dos produtos naturais bioativos para fases posteriores do desenvolvimento, como a pré-clínica, está melhorando. Porém, ainda existem desafios que requerem otimização e processos individualizados para extração e isolamento do produto natural bioativo em escala. A plataforma MPH expande alternativas para o escalonamento da produção de insumos naturais, visando resolver os problemas do reabastecimento, mesmo considerando as particularidades dos diferentes extratos vegetais e a escala de quilogramas necessária para as etapas finais da fase de Descoberta. A Phytobios instalou um laboratório no Piauí para preparação de extratos em escala de bancada. Mais recentemente, conta com um laboratório construído no âmbito do Grupo Centroflora em Campinas-SP, para aumento da escala da produção customizada dos extratos em escala piloto de gramas e quilogramas.
Cadeias produtivas sustentáveis
Já na escala de produção industrial do IFA, a Centroflora, indústria nacional da qual a Phytobios é vinculada, também prospecta a formação de cadeias produtivas sustentáveis como uma abordagem importante tanto para fornecimento do insumo natural quanto para o desenvolvimento econômico das regiões ricas em biodiversidade através da bioeconomia. Um exemplo de uma molécula comercial obtida a partir de esforços em torno de uma cadeia de suprimentos sustentável é a pilocarpina do Jaborandi. Quando é possível utilizar a molécula isolada para semi-síntese de ingredientes farmacêuticos ativos, o impacto socioambiental pode ser de grande relevância. O mercado de jaborandi tem desempenhado importante papel econômico criando oportunidades de emprego e proporcionando uma renda importante conectando coletores à indústria farmacêutica.
Estima-se que o extrativismo do jaborandi correspondeu à maior receita para milhares de famílias do Nordeste/Norte brasileiro durante o pico de extração (1970-1980) no Maranhão e no Pará. Apesar das flutuações de mercado e da redução nas áreas onde ocorre naturalmente, o jaborandi ainda é coletado, principalmente em áreas silvestres. No geral, essas atividades permanecem economicamente viáveis porque o preço da pilocarpina sofreu um aumento significativo (até 36%) nas últimas duas décadas, quando a capacidade de oferta de pilocarpina diminuiu enquanto sua demanda não[20]. Além disso, a pilocarpina é atualmente o oitavo ingrediente farmacêutico mais exportado do Brasil, alcançando cerca de US$ 6,8 milhões ano[21]. Entre as estratégias para preservar a sustentabilidade desta cadeia produtiva está aumentando o número de áreas cultivadas e estabelecimento de reservas naturais para manter diversidade genética e viabilidade populacional[22].
A experiência adquirida no Brasil, com estas cadeias produtivas, abre portas para o estabelecimento de novas cadeias produtivas voltadas às plantas com novas ações medicinais, as quais começam a serem descobertas através da abordagem tecnológica e integrada para a descoberta de novos fármacos a partir de produtos naturais descrita aqui. Isto permitirá o estabelecimento de novos 'cultivares', produção agroecológica ou extrativismo sustentável, tendo impactos no desenvolvimento socioambiental do Brasil bem como para a inovação farmacêutica no país.
Conclusão
Os recentes desenvolvimentos científicos, avanços tecnológicos e tendências de pesquisa apresentados indicam claramente que os produtos naturais continuarão entre as fontes mais importantes de novos medicamentos também no futuro. O estabelecimento de plataformas integradas, como a plataforma MPH, é de fundamental importância para avançar na pesquisa e inovação farmacêutica a partir de produtos naturais, embasando também o estabelecimento de cadeias sustentáveis. Estas atividades e perspectivas têm impacto direto no desenvolvimento científico e econômico, na inovação e na sustentabilidade dos biomas brasileiros, através da bioeconomia direcionada pela inovação farmacêutica. Apesar do alto investimento necessário e dos riscos inerentes à etapa de Descoberta de novos fármacos, a busca por solução para doenças que não tem cura (necessidades médicas não atendidas) é incessante. A natureza pode trazer respostas e também gerar retorno sobre os investimentos realizados. A junção de tecnologias de ponta em uma abordagem integrada à maior biodiversidade do planeta traz para o Brasil a oportunidade de figurar no cenário mundial de descoberta de novos fármacos.
Agradecimentos
Esta pesquisa usou os laboratórios do Laboratório Nacional de Biociências (LNBio) e do Laboratório Nacional de Luz Síncrotron (LNLS), que são parte do Centro Nacional de Pesquisa em Energia e Materiais (CNPEM), uma organização social supervisionada pelo Ministério da Ciência, Tecnologia e Inovações (MCTI).
DBBT também agradece ao Instituto Serrapilheira (projeto número: Serra-1709-19681) e a Empresa Brasileira de Apoio à Pesquisa e Inovação Industrial (EMBRAPII, projeto número: PC NP 1708.0006) pelo apoio financeiro.
Referências
1. Newman DJ, Cragg GM. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 2020; 83: 770-803. [CrossRef] [PubMed].
2. Cremosnik GS, Liu J, Waldmann H. Guided by evolution: from biology oriented synthesis to pseudo natural products. Nat Prod Rep. 2020; 37: 1497-1510. [CrossRef] [PubMed].
3. Bruder M, Polo G, Trivella DBB. Natural allosteric modulators and their biological targets: molecular signatures and mechanisms. Nat Prod Rep. 2020: 37. [CrossRef] [PubMed].
4. Allard PM, Péresse T, Bisson J, Gindro K, Marcourt L, Pham VC et al. Integration of molecular networking and in-silico MS/MS fragmentation for natural products dereplication. Anal Chem. 2016; 88: 3317-3323. [CrossRef] [PubMed].
5. Wishart DS, Feunang YD, Guo AC, Lo EJ, Marcu A, Grant JR et al. DrugBank 5.0: a major update to the DrugBank database for 2018. Nucleic Acids Res. 2018; 46: D1074-D1082. [CrossRef] [PubMed].
6. Lu S, He X, Ni D, Zhang J. Allosteric modulator discovery: from serendipity to structure-based design. J Med Chem. 2019; 62: 6405-6421. [CrossRef] [PubMed].
7. Flemming A. Allosteric phosphatase inhibitor puts brake on cancer cells. Nat Rev Drug Discov. 2016; 15: 530-531. [Link].
8. Drag M, Salvesen GS. Emerging principles in protease-based drug discovery. Nat Rev Drug Discov. 2010; 9: 690-701. [CrossRef] [PubMed].
9. Ni D, Lu S, Zhang J. Emerging roles of allosteric modulators in the regulation of protein-protein interactions (PPIs): a new paradigm for PPI drug discovery. Med Res Rev. 2019; 39: 2314-2342. [CrossRef] [PubMed].
10. Coughlin Q, Hopper AT, Blanco M-J, Tirunagaru V, Robichaud AJ, Doller D. Allosteric modalities for membrane-bound receptors: insights from drug hunting for brain diseases. J Med Chem. 2019; 62: 5979-6002. [CrossRef] [PubMed].
11. Liu X, Lu S, Song K, Shen Q, Ni D, Li Q et al. Unraveling allosteric landscapes of allosterome with ASD. Nucleic Acids Res. 2020; 48: D394-D401. [CrossRef] [PubMed].
12. Nussinov R, Tsai CJ. Allostery in disease and in drug discovery. Cell. 2013; 153: 293-305. [CrossRef] [PubMed].
13. Mushtaq S, Abbasi BH, Uzair B, Abbasi R. Natural products as reservoirs of novel therapeutic agents. EXCLI J. 2018; 17: 420-451. [CrossRef] [PubMed].
14. Wouters OJ, McKee M, Luyten J. Estimated research and development investment needed to bring a new medicine to market, 2009-2018. JAMA. 2020; 323: 844. [CrossRef] [PubMed].
15. Thornburg CC, Britt JR, Evans JR, Akee RK, Whitt JA, Trinh SK et al. NCI Program for natural product discovery: a publicly-accessible library of natural product fractions for high-throughput screening. ACS Chem Biol. 2018; 13: 2484-2497. [CrossRef] [PubMed].
16. de Felício R, Ballone P, Bazzano CF, Alves LFG, Sigrist R, Infante GP et al. Chemical Elicitors Induce Rare Bioactive Secondary Metabolites in Deep-Sea Bacteria under Laboratory Conditions. Metabolites. 2021; 11: 107. [CrossRef] [PubMed].
17. Wang M, Carver JJ, Phelan VV, Sanchez LM, Garg N, Peng Y et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking. Nat Biotechnol. 2016; 34: 828-837. [CrossRef] [PubMed].
18. Trivella DBB, De Felicio R. The tripod for bacterial natural product discovery: Genome mining, silent pathway induction, and mass spectrometry-based molecular networking. mSystems. 2018: 3. [CrossRef] [PubMed].
19. Aché Laboratories. Report 2020. 2020. [Link]
20. Brasil. Ministério do Planejamento, Orçamento e Gestão – MPOG. Instituto Brasileiro de Geografia e Estatística - IBGE. Produção da extração vegetal e da silvicultura. 2014; 29:1-56. ISBN 0103-8435. [Link].
21. Grabher C. A governança e a sustentabilidade do extrativismo do jaborandi na Amazônia e transição para o Cerrado e a Caatinga. Porto Alegre. 2015. Dissertação de Mestrado. [Programa de Pós-Graduação em Desenvolvimento Rural] - Faculdade de Ciências Econômicas. Universidade Federal do Rio Grande do Sul, UFRGS, Porto Alegre. 2015. [Link].
22. Caldeira CF, Giannini TC, Ramos SJ, Vasconcelos S, Mitre SK, Pires JP et al. Sustainability of Jaborandi in the eastern Brazilian Amazon. Perspect. Perspect Ecol Conserv. 2017; 15: 161-171. [CrossRef].