Artigo de Pesquisa
Variação das propriedades físico-químicas de extratos de Bidens pilosa L. Asteraceae (picão preto)influenciada pelo processo extrativo
Variation of the physico-chemical properties of extracts of Bidens pilosa L. Asteraceae (hairy beggartick) influenced by the extractive process
Resumo
Com a intenção de propiciar embasamento para introdução de maior número de espécies vegetais e seus derivados nos compêndios farmacêuticos nacionais, foram realizadas análises físico-químicas, cromatográficas e quantitativas do marcador em extratos obtidos de partes aéreas de Bidens pilosa L. Asteraceae (picão preto), espécie com atividades antioxidante, antibacteriana, anti-inflamatória, antitumoral, antimalárica, imunomoduladora, hepatoprotetora, cicatrizante, entre outras. A partir de extratos hidroetanólicos (EtOH:H2O 77:23), hidroglicólicos (PEG:H2O 1:1) e aquosos, obtidos por maceração (1:10), foram avaliados a densidade, pH, resíduo seco, perfil cromatográfico (CCD) e teor de flavonoides (espectrofotometria). As análises mostraram que os extratos de maiores densidades foram os aquosos (0,9954 g/mL) e hidroglicólicos (1,0418 g/mL). Os extratos hidroglicólicos (pH=6,32) e hidroetanólicos (pH=6,29) se apresentaram mais ácidos que os aquosos (pH=6,95). Maiores resíduos secos foram apresentados pelos extratos hidroetanólicos (2,40%) e hidroglicólicos (2,70%) em comparação com os aquosos (0,53%). Quercetina foi identificada, por CCD, em todos os extratos testados e maior diversidade de substâncias foi evidenciada nos extratos hidroetanólicos e hidroglicólicos. Maiores teores de flavonoides foram evidenciados nos extratos hidroetanólicos e hidroglicólicos (0,009%; 0,008% respectivamente), em comparação com os aquosos (0,003%). Apesar disto, os extratos aquosos apresentam maior seletividade para a extração do marcador pesquisado.
- Palavras-chave:
- Fitoterapia.
- Medicamentos fitoterápicos.
- Extratos vegetais.
Abstract
In order to provide the basis for the introduction of a larger number of plant species and their derivatives in the national pharmaceutical compendia, physicochemical, chromatographic and quantitative analyzes of the marker were performed in extracts obtained from Bidens pilosa L. Asteraceae (hairy beggartick) aerial parts, species with antioxidant, antibacterial, anti-inflammatory, antitumor, antimalarial, immunomodulatory, hepatoprotective, healing activities, among others. From hydroethanolic (EtOH: H2O 77:23), hydroglycolic (PEG:H2O 1:1) and aqueous extracts obtained by maceration (1:10), the density, pH, solid content, chromatographic profile (TLC) and total flavonoid content (spectrophotometry) were evaluated. The analyzes showed that the highest density extracts were aqueous (0.9595 g / mL) and hydroglycolic (1.0418 g / mL). Hydroglycolic (pH = 6.32) and hydroethanolic (pH = 6.29) extracts showed more acids than aqueous ones (pH = 6.95). Higher dry residues were presented by hydroethanolic (2.40%) and hydroglycolic (2.70%) extracts compared to aqueous (0.53%). Quercetin was identified by TLC in all extracts tested and greater diversity of substances was evidenced in hydroethanolic and hydroglycolic extracts. Higher flavonoid contents were found in hydroethanolic and hydroglycolic extracts (0.009%; 0.008% respectively) than in aqueous extracts (0.003%). In spite of this, the aqueous extracts are more selectively extracted for the researched marker.
- Keywords:
- Phytotherapy.
- Phytotherapeutic Drugs.
- Plant Extracts.
Introdução
A partir dos anos 1990, o Brasil iniciou um processo de modernização das monografias relacionadas aos insumos vegetais constantes nos compêndios técnicos da área farmacêutica, incluindo principalmente, a Farmacopeia Brasileira, com o intuito de elevar a qualidade dos medicamentos de origem vegetal (fitoterápicos). Observou-se, na 4ª, 5ª e 6ª edições da Farmacopeia Brasileira, a inserção de inúmeras espécies medicinais brasileiras e a modernização das técnicas de análises descritas[1,2].
No entanto, este trabalho ainda não está completo. Muitas espécies com valor terapêutico encontram-se excluídas, devido ao grande número com uso farmacêutico existente no Brasil. Sendo assim, este tipo de trabalho poderá levar um longo período para ser finalizado[2,3].
É neste sentido que ocorre a necessidade e importância de se obter informações analíticas relacionadas às espécies medicinais e extratos derivados delas que não estejam descritos nestes compêndios.
Incluem-se nesta situação inúmeras espécies, como, por exemplo, Bidens pilosa L. - Asteraceae (picão preto), com ampla distribuição em regiões tropicais e subtropicais do globo[4], com várias alegações terapêuticas, como ação antioxidante, antibacteriana, anti-inflamatória, antitumoral, antimalárica, imunomoduladora, hepatoprotetora, cicatrizante, entre outras[4-6]. Tem potencial para ser usada no SUS, pois se encontra na lista de plantas de interesse (RENISUS). No entanto, não está incluída na Farmacopeia Brasileira.
Vários tipos de constituintes químicos foram isolados desta espécie. Entre eles estão os acetilenos e flavonoides. Estas duas categorias parecem ser as principais responsáveis em relação às atividades farmacológicas observadas para a espécie[4-6].
B. pilosa também faz parte da composição de produto antialérgico, onde está associada a outros extratos vegetais[7]. Na área cosmética, observa-se que os extratos desta planta são utilizados em produtos que atuam no rejuvenescimento da pele, com aumento da elasticidade e diminuição de manchas e rugas[8,9].
Ressalta-se que preparações constituídas, entre outros ativos, de extratos hidrolisados desta planta, já foram patenteadas e têm indicação para tratamento de dermatite atópica [10] e para uso no tratamento da obesidade, reduzindo o peso corpóreo e no ganho de massa muscular [11]. Outra patente descreve o uso de seus extratos, em associação, na formulação de um mucoadesivo, com finalidade anti-inflamatória, no tratamento de estomatites e mucosites induzidas por radioterapia ou quimioterapia[12].
Fica reforçado, deste modo, que o estudo dos extratos desta espécie, do ponto de vista físico-químico, poderá apoiar e dar maior confiabilidade às utilizações que se fizer com ela, facilitando a inclusão de sua monografia nas próximas edições da farmacopeia nacional.
No âmbito da manipulação farmacêutica, a utilização de extratos vegetais na composição de formulações é muito frequente. Para cada espécie vegetal podem ser produzidos diversos tipos de extratos, os quais podem ter características físicas e químicas quali e quantitativas diversas. Isto é dependente de vários fatores. Um dos mais importantes é a escolha do solvente que será utilizado no processo extrativo. Dependendo da polaridade do solvente e sua seletividade para alguns tipos de constituintes vegetais, podem ser obtidos extratos mais, ou menos, ricos nestes princípios ativos.
Técnicas descritas na 6a edição da Farmacopeia Brasileira[13] podem ser utilizadas para sua produção e incluem, entre outras, a maceração para obtenção de soluções extrativas, como, por exemplo, as tinturas, sendo frequentemente utilizadas na fitoterapia. Podem ser preparadas a partir da utilização de uma parte da droga vegetal para dez partes do solvente, usando misturas hidroalcoólicas (água em mistura com etanol ou com propilenoglicol, em diversas proporções). Os extratos obtidos usando o propilenoglicol como líquido extrator são usualmente denominados glicólicos ou hidroglicólicos, quando em mistura com água.
Análises farmacêuticas tendo como objetivo o controle de qualidade de insumos vegetais se embasam numa tríade que está relacionada com identificação botânica da espécie utilizada, ensaios visando avaliar a pureza do produto e avaliação quali e quantitativa de sua composição química.
Esses ensaios devem ser realizados a partir das drogas vegetais ou de extratos produzidos a partir delas. Para os extratos, alguns desses testes estão descritos na Farmacopeia Brasileira (6ª edição)[13], com a finalidade da caracterização físico-química, que envolvem a avaliação da densidade, pH, resíduo seco, perfil cromatográfico, entre outros.
Neste contexto, o presente trabalho objetiva a avaliação de alguns parâmetros físico-químicos de diversas soluções extrativas obtidas a partir de partes aéreas de B. pilosa, que poderão ser utilizados para avaliar a qualidade de insumos vegetais desta espécie.
Material e Métodos
Droga vegetal
Através do cultivo desta espécie foram obtidas as partes aéreas de B. pilosa[14]. Este material foi colhido, secado através de ar aquecido (até 12% de umidade residual) e cominuído (granulometria de 0,8 mm), obtendo-se a droga vegetal.
Soluções extrativas
Foram preparadas a partir da droga vegetal, conforme descrição da Farmacopeia Brasileira 6a edição[13], para obtenção de tinturas, por maceração.
No preparo das soluções extrativas, as drogas vegetais foram maceradas com I. etanol:água 77:23 (v/v); II. propilenoglicol:água 1:1 (v/v); III. água, na proporção de 1 parte de droga vegetal para 10 partes do solvente.
A droga vegetal foi misturada com o solvente de extração e deixada em repouso num recipiente fechado, durante sete dias, com agitação diária.
Por prensagem e filtração, o marco foi separado da solução extrativa, obtendo-se os extratos hidroetanólicos (EtOH:H2O), hidroglicólicos (PEG:H2O) e aquosos utilizados nas diversas avaliações.
Este procedimento foi repetido, para cada um dos extratos, obtendo-se três amostras (n=3).
Densidade relativa
Obteve-se o valor da densidade relativa conforme descrito na Farmacopeia Brasileira 6ª edição[13], com uso de picnômetro (10 mL), a 20oC. O valor da densidade relativa foi calculado pelo quociente entre a massa da solução extrativa e a massa de água contida no picnômetro. As análises de cada uma das soluções extrativas foram realizadas em triplicata.
pH
Foi realizada a técnica descrita na Farmacopeia Brasileira, 6ª edição [13], que prevê a aferição do aparelho com as leituras de soluções-tampão (pH = 4,0 e pH = 7,0). A leitura do pH foi realizada utilizando aparelho de marca Tecnophon modelo mPA-210, usando 10 ml das soluções extrativas. As análises para cada uma das amostras foram realizadas em triplicata e as leituras assinaladas não variaram mais do que ± 0,05 de unidade.
Resíduo seco
A obtenção do resíduo seco dos extratos foi realizada tendo como base o descrito na Farmacopeia Brasileira, 6ª edição[13], com amostras de 2 g de solução extrativa. Procedeu-se a evaporação, primeiramente em banho de água quente, em cápsulas de porcelana com 10 ml de capacidade e previamente pesadas. A dessecação foi concluída na estufa, a 105oC, durante 3 horas, deixando resfriar em dessecador e posterior pesagem. O valor do resíduo seco foi calculado em porcentagem. As análises para cada uma das soluções extrativas foram realizadas em triplicada.
Perfil cromatográfico
Foi utilizado 1 mL de etanol:água (50:50 v/v) para solubilizar pequena quantidade do resíduo seco (0,1 g), obtido anteriormente. Esta solução foi utilizada como amostra para obter o perfil cromatográfico, usando a cromatografia em camada delgada. Foi utilizada cromatoplaca de gel de sílica, como fase estacionária e mistura de acetato de etila: clorofórmio: ácido acético (80:19:1), como fase móvel. Também foi aplicada separadamente na placa, na forma de banda, 30 µL da solução amostra e 10 µL da solução referência constituída de 10 mg de quercetina solubilizada em 10 mL de metanol. Desenvolveu-se a cromatografia em percurso de aproximadamente 10 cm. A revelação foi realizada com nebulização com vanilina sulfúrica e posterior aquecimento a 110oC, na estufa[13,15].
Teor de flavonoides
A análise quantitativa para flavonoides totais nestes extratos foi realizada tendo como base o método que se fundamenta numa reação cromática dos compostos flavonoides. Sendo assim, houve o doseamento dos constituintes totais, que possuem a mesma propriedade química. Na dosagem dos flavonoides empregou-se a espectrofotometria, usando como padrão a quercetina, conforme técnica descrita por Borella et al.[14,15] e Singh et al.[16], na qual há pré-purificação através de partição da solução extrativa com tetracloreto de carbono e posterior reação com cloreto de alumínio.
Análise estatística
Os resultados das determinações descritas foram submetidos à análise de variância (ANOVA), seguida pelo teste de comparações múltiplas de Tukey-Kramer (p < 0,05).
Resultados e Discussão
Após desenvolvimento das metodologias descritas, os resultados estão apresentados na FIGURA 1 e TABELA 1.
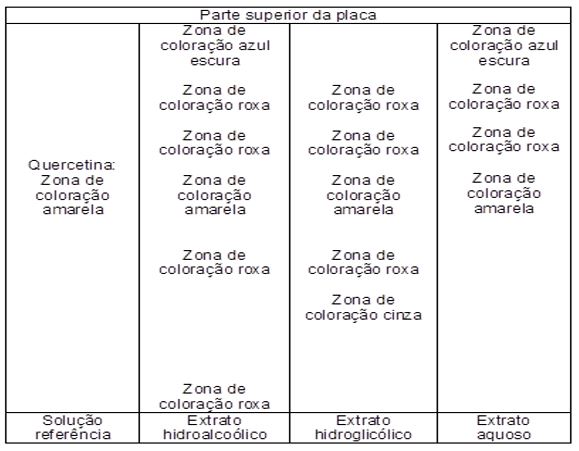
Condições cromatográficas: fase estacionária: sílica GF254; fase móvel: acetato de etila: clorofórmio: ácido acético 80:19:1; revelador: vanilina sulfúrica com aquecimento.
TABELA 1: Valores médios obtidos para propriedades físico-químicos, quantificação de flavonoides e índice de seletividade para extratos de B. pilosa.
| Extrato | Densidade relativa g/mL |
pH | Resíduo Seco % m/m |
Teor de flavonoides totais % m/m | Índice de seletividade % Flav/Resíduo Seco |
| Hidroetanólico EtOH:H2O 77:23 |
0,8741a (0,23) | 6,29a (0,09) | 2,40a (13,01) | 0,009a (6,63) | 0,004 |
| Hidroglicólico PEG:H2O 1:1 |
1,0418b (0,47) | 6,32a (0,24) | 2,70a (23,20) | 0,008a (3,67) | 0,003 |
| Aquoso | 0,9954c (1,35) | 6,95b (0,21) | 0,53b (35,49) | 0,003b (25,60) | 0,006 |
| n = 3; p < 0,05 – ANOVA seguido pelo teste de comparações múltiplas de Tukey-Kramer. Médias seguidas pelas mesmas letras minúsculas, nas colunas, não diferem estatisticamente entre si. Teor de flavonoides totais estimados como Quercetina. Número entre parênteses refere-se ao coeficiente de variação x 100. | |||||
Os resultados apresentados no perfil cromatográfico mostraram que o marcador utilizado (quercetina) foi detectado sutilmente em todos os extratos produzidos. Os perfis dos extratos hidroetanólicos e hidroglicólicos mostraram maior número de zonas de coloração, evidenciando maior diversidade de substâncias presentes, em comparação com aquosos, que apresentaram menor número, detectáveis pela revelação com vanilina sulfúrica (FIGURA 1).
Nas demais análises também foram observadas diferenças nos critérios físico-químicos analisados nos extratos produzidos. Diferenças significativas nas densidades dos extratos foram evidenciadas, principalmente devido às características dos líquidos extratores utilizados no processo de extração (TABELA 1).
O pH detectado nas avaliações, para todos os extratos testados, apresentaram-se ácidos. Isto sugere que houve a extração de princípios ativos com esta característica, o que incluem várias categorias de substâncias, inclusive os polifenois, entre eles, os flavonoides. Observa-se que os extratos hidroetanólicos e hidroglicólicos apresentaram resultados estatisticamente mais ácidos em comparação com aquele que foi utilizado como solvente somente água (TABELA 1).
Outros dados de interesse nestas análises foram àqueles relacionados com o resíduo seco apresentado pelos diversos extratos. Observou-se que os resultados apresentados pelos extratos hidroetanólicos e hidroglicólicos foram estatisticamente superiores àqueles apresentados pelos aquosos (TABELA 1). Estes números sugerem maior eficiência destes solventes na extração dos diversos componentes presentes no pulverizado dos tecidos de B. pilosa.
Esta conjectura parece consolidada, pelo menos para a categoria dos flavonoides, com a análise quantitativa destes princípios ativos nos extratos testados. Observou-se que os extratos hidroetanólicos e o hidroglicólicos apresentaram as maiores concentrações desta categoria de substâncias, quando comparado com os aquosos (TABELA 1).
Estes resultados parecem corroborar com aqueles encontrados por Silva[17], que obteve a maior concentração de flavonoides totais (0,24%) em extratos hidroetanólicos das folhas, na fase de frutificação das plantas e a menor (0,17%) em extratos aquosos, preparados por infusão.
Cortés‐Rojas et al.[18] testaram variações no processo extrativo para partes aéreas de B. pilosa e obtiveram melhor desempenho (0,4%) quando utilizaram maceração, com uso de solvente hidroetanólico (62,7:37,3), em agitação, à 66,2oC, por 30 minutos.
Observa-se que as concentrações citadas são muito superiores àquelas encontradas neste trabalho. É de se salientar, no entanto, que estes trabalhos não usaram como referência as descrições farmacopêicas para produção de extratos (tinturas por maceração, na proporção 1:10), as quais, via de regra, resultam em soluções extrativas mais diluídas, pois o processo de maceração, como está descrito, não é exaustivo.
Outro fato que pode explicar estes valores desiguais é a própria característica de variabilidade das drogas vegetais de B. pilosa, utilizadas nos diversos trabalhos[19,20].
Calculando-se o índice de seletividade para flavonoides destes líquidos extratores (teor de flavonoides/resíduo seco), observou-se que, apesar do extrato aquoso apresentar a menor concentração de flavonoides, a água foi o solvente mais seletivo para esta categoria de princípios ativos, em comparação com os outros dois testados (etanol:água 77:23 e propilenoglicol: água 1:1) (TABELA 1).
Conclusão
A partir das análises realizadas, observou-se que os resultados referentes aos extratos hidroetanólicos e hidroglicólicos, em relação à sua composição química (resíduo seco e teor de flavonoides), foram estatisticamente semelhantes entre si e superiores aos aquosos. Por outro lado, o extrato aquoso apresentou maior seletividade para a extração dos flavonoides presentes nesta espécie.
No entanto, nas condições que foi obtido o perfil cromatográfico (CCD), percebeu-se alguma diferenciação entre os componentes que estão presentes em cada um destes extratos, sendo que os hidroetanólicos e hidroglicólicos apresentaram maior número de zonas de coloração, quando comparado com os aquosos, sendo que o marcador utilizado (quercetina) foi sutilmente visualizado em todos eles.
As concentrações do marcador nos extratos produzidos neste trabalho foram inferiores àquelas disponíveis na literatura, para esta espécie. Este fato pode ser parcialmente explicado pelas diferentes técnicas extrativas e pelas características das drogas vegetais de B. pilosa, utilizadas nos diversos trabalhos.
Fontes de Financiamento
Própria (Centro Universitário Barão de Mauá).
Conflito de Interesses
Não há conflito de interesses.
Colaboradores
Concepção do estudo: JCB
Curadoria dos dados: JCB
Coleta de dados: BFBO
Análise dos dados: JCB; BFBO
Redação do manuscrito original: JCB; BFBO
Redação da revisão e edição: JCB.
Referências
1. Nemitz M, Mallmann L, Steppe M. Evolução dos métodos quantitativos empregados para plantas medicinais ao longo das edições da farmacopeia brasileira. Rev Eletr Farm. [online]. 2016; 13(1): 18-27. [acesso em: 16 out. 2021]. [https://doi.org/10.5216/ref.v13i1.31789].
2. Oliveira MDT, Rodrigues E, Casu L, Benítez G, Leonti M. The historical development of pharmacopoeias and the inclusion of exotic herbal drugs with a focus on Europe and Brazil. J Ethnopharmacol. [online]. 2019; 240: 111891. [acesso em: 16 out. de 2021]. [https://doi.org/10.1016/j.jep.2019.111891].
3. Souza-Moreira TM, Salgado HRN, Pietro RCRL. O Brasil no contexto de controle de qualidade de plantas medicinais. Rev Bras Farmacogn [online]. 2010; 20(3): 435-440. [acesso em: 16 out. 2021]. [https://doi.org/10.1590/S0102-695X2010000300023].
4. Brasil. Ministério da Saúde. Departamento de Assistência Farmacêutica e Insumos Estratégicos. Monografia da espécie Bidens pilosa (Picão – preto). 73p. Brasília; 2015. [acesso em: 16 out. 2021]. [http://portalarquivos.saude.gov.br/images/pdf/2017/setembro/11/Monografia-Bidens.pdf].
5. Gilbert B, Alves LF, Favoreto R. Bidens pilosa L. Asteraceae (Compositae; subfamília Heliantheae). Rev Fitos. [online]. 2014; 8(1): 53-67. [acesso em: 16 out. 2021]. [https://www.arca.fiocruz.br/handle/icict/15136].
6. Xuan TD, Khanh TD. Chemistry and pharmacology of Bidens pilosa: an overview. J Pharm Investig [online]. 2016; 46(2): 91-132. [acesso em: 16 out. 2021]. [http://dx.doi.org/10.1007/s40005-016-0231-6].
7. Corren J, Lemay M, Lin Y, Rozga L, Randolph RK. Clinical and biochemical effects of a combination botanical product (ClearGuard™) for allergy: a pilot randomized double-blind placebo-controlled trial. Nutrition J [online]. 2008; 7(1): 20. [acesso em: 16 out. 2021]. [http://dx.doi.org/10.1186/1475-2891-7-20].
8. Degelo GC. Estudo do efeito do extrato hidroglicólico de Bidens pilosa na expressão de genes relacionados à integridade da pele. 67p. Botucatu. 2010. Dissertação de Mestrado [Programa de Pós-graduação em Ciências Biológicas] – UNESP, Botucatu. 2010. [acesso em: 16 out. 2021]. [https://repositorio.unesp.br/bitstream/handle/11449/92438/degelo_gc_me_botib.pdf]
9. Ereno D. Beleza retocada. Rev Pesq Fapesp. [online]. 2011; 190: 70-5. [acesso em: 16 out. 2021]. [https://revistapesquisa.fapesp.br/beleza-retocada/].
10. Horiuchi M, Seyama Y. Improvement of the anti-inflammatory and anti-allergic activity of Bidens pilosa L. var. radiata Scherff treated with enzyme (cellulosine). J health Sci. [online]. 2008; 54(3): 294-301. [acesso em: 16 out. 2021]. [https://doi.org/10.1248/jhs.54.294].
11. Yang WC, Chang LT, Liang YC. - inventores; depositante. Beneficial effect of Bidens pilosa on fat decrease and muscle increase. U.S. Patente no. 16/068,125, 3 jan. 2019; [acesso em: 16 out. 2021]. [https://patentimages.storage.googleapis.com/fb/3c/7e/d8c162b51e19d8/US20190000904A1.pdf].
12. Bozinis MCV, Lima EM, Batista AC, Maretto RN, De Mendonça EF. - inventores; depositante. Soluble, stable, anti-inflammatory, proliferative, protective and mucoadhesive pharmaceutical compositions; use thereof for treating mucositis conditions and method for producing same; base pharmaceutical composition for preparing the pharmaceutical compositions and method for producing same. U.S. Patente no 15/522, 763, de 9 nov. 2017. [acesso em: 16 out. 2021]. [https://patentimages.storage.googleapis.com/2c/09/0c/9b1d82e8f6a3d4/US20170319642A1.pdf].
13. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Farmacopeia Brasileira. 6ª ed. Volume I e II. Brasília; 2019 [acesso em: 16 out. 2021]. [https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/farmacopeia-brasileira].
14. Borella JC, Borella PH, Gastaldi MD, Miranda CES. Bidens pilosa - picão preto: influência da adubação orgânica e da luminosidade na produtividade e no teor de flavonoides. Rev Fitos. [online]. 2019; 13(4): 261-269. [acesso em: 16 out. 2021]; [http://dx.doi.org/10.32712/2446-4775.2019.761].
15. Borella JC, Fontoura A. Avaliação do perfil cromatográfico e do teor de flavonoides em amostras de Baccharis trimera Less DC., Asteraceae (carqueja) comercializadas em Ribeirão Preto, SP, Brasil. Rev Bras Farmacogn. [online]. 2002; 12(2): 63-67. [acesso em: 16 out. 2021]. [https://www.researchgate.net/publication/262517887].
16. Singh G, Passari AK, Singh P, Leo VV, Subbarayan S, Kumar B et al. Pharmacological potential of Bidens pilosa L. and determination of bioactive compounds using UHPLC-QqQ LIT-MS/MS and GC/MS. BMC Complement Med Ther. [Online]. 2017; 17(1): 492-508. [acesso em: 16 out. 2021]. [http://dx.doi.org/10.1186/s12906-017-2000-0].
17. Silva FL. Contribuição à farmacognosia de Artemisia annua L. e Bidens pilosa L. (Asteraceae). Acompanhamento da variação de metabólitos secundários em diferentes fases fenológicas, órgãos e extratos vegetais, aspectos botânicos e avaliação da atividade antileishmania in vitro.236p. São Paulo, 2008.Dissertação de Mestrado [Programa de Pós-Graduação em Fármacos e Medicamentos] - Universidade de São Paulo, USP, São Paulo, 2008. [acesso em: 16 out. 2021]. [https://teses.usp.br/teses/disponiveis/9/9138/tde-18092017-143745/en.php].
18. Cortés‐Rojas DF, Souza CRF, Oliveira WP. Optimisation of the extraction of phenolic compounds and antioxidant activity from aerial parts of Bidens pilosa L. using response surface methodology. Int J Food Sci Technol [online]. 2011; 46(11): 2420-2427. [acesso em: 16 out. 2021]. [https://doi.org/10.1111/j.1365-2621.2011.02765.x].
19. Cortés-Rojas DF, Chagas-Paula DA, Da Costa FB, Souza CR, Oliveira WP. Bioactive compounds in Bidens pilosa L. populations: a key step in the standardization of phytopharmaceutical preparations. Rev Bras Farmacogn [online]. 2013; 23(1): 28-35. [acesso em: 16 out. 2021]. [https://doi.org/10.1590/S0102-695X2012005000100].
20. Cortés-Rojas DF, Souza CRF, Oliveira WP. Assessment of stability of a spray dried extract from the medicinal plant Bidens pilosa L. J King Saud Univ. [online]. 2016 28(2): 141-146. [acesso em: 16 out. 2021]. [https://doi.org/10.1016/j.jksues.2014.04.004].