PESQUISA E DESENVOLVIMENTO / RESEARCH AND DEVELOPMENT
Pesquisa e Desenvolvimento de Fitoterápicos: Relatos de Experiência em Indústria Farmacêutica Nacional
Research and Development of Phytomedicines: Report of Experience on a Brazilian Pharmaceutical Company
Resumo
Relata-se experiência profissional de cinco anos em uma empresa farmacêutica brasileira. Nesse período, montou-se uma equipe técnica e buscou-se o desenvolvimento de uma linha fitoterápica a partir de literatura científica, aproveitamento de estudos nacionais já realizados bem como com ajustes de pesquisas internacionais ao padrão regulatório brasileiro. Como resultados desta atividade profissional foram desenvolvidos cinco fitoterápicos: cápsulas duras com extrato de isoflavonas agliconas de soja (Glycine max), resultado de parceria com outra empresa e universidade; comprimidos de extrato padronizado de incenso (Boswellia serrata) indicados em patologias inflamatórias intestinais; comprimidos de extrato padronizado de garra do diabo (Harpagophytum procumbens) indicados em patologias reumáticas; cápsulas gelatinosas moles com óleo essencial de hortelã-pimenta (Mentha piperita) recomendadas na fase espástica da síndrome do intestino irritável; e, por fim, pomada com extrato padronizado das cascas de barbatimão (Stryphnodendron adstringens) indicada como cicatrizante em escaras de graus I e II. Apesar das dificuldades e complexidade de cumprimento dos requisitos da cadeia de pesquisa e desenvolvimento, o presente relato mostra ser possível esta atividade, com geração de produtos fitoterápicos seguros, eficazes e de qualidade compatível com as exigências regulatórias nacionais e internacionais.
- Palavras chave:
- Pesquisa e desenvolvimento.
- isoflavona aglicona.
- incenso.
- garra do diabo.
- óleo de hortelã-pimenta.
- barbatimão..
Abstract
It is reported five years of professional experience in a Brazilian pharmaceutical company. During this period, was set up a technical team and we sought to develop a line of phytomedicines from scientific literature, use of national studies already made adjustments as well as international research at the Brazilian regulatory standard. As a result of this professional activity included five herbal drugs: hard capsules with the extract of soy aglycones isoflavones in interaction with other company and university; tablets standardized extract of frankincense (Boswellia serrata) indicated in inflammatory bowel diseases; tablets of standardized extract of devil’s claw (Harpagophytum procumbens) given in rheumatic diseases; soft gelatin capsules with essential oil of peppermint (Mentha piperita) recommended in spastic phase of irritable bowel syndrome; and finally ointment with standardized extract from the bark of barbatimão (Stryphnodendron adstringens) as indicated in healing of decubitus ulcers stages I and II. Despite the difficulties and complexity of compliance with the requirements of the chain of research and development, this report shows that activity is possible, with the generation of herbal products with safe, effective and quality levels compatible with the national and international regulatory requirements.
- Keywords:
- Research and development.
- aglycon soy.
- frankincense.
- devil’s claw.
- peppermint oil.
- barbatimao..
Introdução
A natureza tem sido uma fonte inesgotável de substâncias químicas importantes à vida humana, fornecendo alimentos, corantes, ingredientes cosméticos, bem como sendo imprescindível na área de medicamentos. Assim, há inúmeros casos relevantes como substâncias farmacologicamente ativas e amplamente presentes em medicamentos, como a digoxina, morfina, taxol, dentre inúmeros outros exemplos; e como medicamentos fitoterápicos destacam-se os à base de extratos clássicos de Panax ginseng, Valeriana officinalis, Ginkgo biloba, etc. e mais recentemente medicamentos à base das espécies Pelargonium sidoides, Hedera helix, Petasites hybridus, dentre outros (Marques, 2010).
O Brasil tem algumas poucas espécies relevantes nesse cenário de desenvolvimento farmacêutico, como os casos das espécies ipeca e jaborandi, as sementes do guaraná e mais recentemente, a partir do impulso gerado pelo financiamento do programa de plantas medicinais da extinta Central de Medicamentos nos anos 1980, consolidaram-se algumas espécies genuinamente nacionais como a espinheira-santa e o guaco.
Esse cenário, no entanto, tem se modificado, embora lentamente, com a participação de empresas farmacêuticas modernas (Mukherjee e Houghton, 2009), frente a novas áreas sendo abertas, como a inclusão da fitoterapia no Sistema Único de Saúde e o envolvimento de novos prescritores, como tem ocorrido com os profissionais nutricionistas (Brasil, 2006a; CFN, 2007).
Dados de Mercado
O mercado mundial de medicamentos derivados de plantas é estimado para de cerca de 26 bilhões de dólares em 2011 (Saklani e Kutty, 2008), valor que representa apenas cerca de 3% do mercado global de medicamentos. Ao mercado brasileiro estima-se uma participação de cerca de 2,5% do valor mundial, projetando-se um faturamento na faixa de R$ 1,0 bilhão (Carvalho et al., 2008).
De modo similar ao mercado farmacêutico sintético, também o segmento fitoterápico é concentrado em algumas empresas e produtos; assim, apresentam-se na TABELA 1 os valores dos vinte principais produtos do mercado brasileiro pelo faturamento no ano de 2006, responsáveis por mais de 67% do faturamento global do segmento (Freitas, 2007).
| Rk | Produto | % | milh/R$ | Rk | Produto | % | milh/R$ | ||
|---|---|---|---|---|---|---|---|---|---|
| 1° | Tamarine | 13,85 | 74,8 | 11° | Vecasten | 2,29 | 12,4 | ||
| 2° | Eparema | 6,37 | 34,4 | 12° | Tanakan | 2,04 | 11,0 | ||
| 3° | Naturetti | 6,06 | 32,7 | 13° | Equitam | 1,90 | 10,3 | ||
| 4° | Tebonim | 4,55 | 24,6 | 14° | Giamebil | 1,81 | 9,8 | ||
| 5° | Plantaben | 4,24 | 22,9 | 15° | Serenus | 1,72 | 9,3 | ||
| 6° | Abrilar | 3,39 | 18,3 | 16° | Novarrutina | 1,68 | 9,1 | ||
| 7° | Metamucil | 3,21 | 17,3 | 17° | Valeriane | 1,68 | 9,1 | ||
| 8° | Pasalix | 3,19 | 17,2 | 18° | Climadil | 1,53 | 8,3 | ||
| 9o | Passiflorine | 2,57 | 13,9 | 19o | Calman | 1,52 | 8,2 | ||
| 10° | Maracugina | 2,45 | 13,2 | 20° | Hemovirtus | 1,41 | 7,6 | ||
| 20 principais produtos | Faturamento de 67,4% | ||||||||
| Demais produtos (± 340) | Faturamento de 32,6% | ||||||||
| Fonte: Adaptado de Freitas (2007) | |||||||||
Desse quadro, destaca-se o espaço ocupado por produtos laxativos, com o 1°, 3° e 5° lugares, e pelos ansiolíticos, os quais respondem, respectivamente, por 27,4% e 13,1% do total do mercado fitoterápico nacional, com mais de 200 milhões de reais de faturamento. A presença de um produto para problemas hepatobiliares é igualmente marcante, com a 2a colocação e excelente faturamento, bem como também os produtos à base de extratos de Ginkgo biloba, para insuficiência venosa cerebral, e, por fim, apenas um produto para infecções das vias respiratórias e outro de ação fito-hormonal.
Assim, apesar da indiscutível predominância de espécies exóticas no mercado brasileiro, já é visível a presença de iniciativas em P&D com plantas nativas. O medicamento Giamebil®, produzido a partir de extratos da espécie Mentha crispa L. para parasitoses intestinais, é certamente o fitoterápico pioneiro do mercado brasileiro, desenvolvido por interação universidade - empresa na região nordeste do país, contando com um faturamento expressivo na casa dos 10 milhões de reais por ano (Marques, 2010).
Apesar dessas iniciativas, uma das grandes dificuldades nesta área de P&D sempre foi o mito do alto custo do desenvolvimento de medicamentos, que é freqüentemente colocado com base em produtos sintéticos no padrão extremo de sofisticação e estimado na casa dos 800 milhões de dólares (Calixto e Siqueira Jr., 2008; European Federation of Pharmaceutical Industries and Associations, 2011), o que seria praticamente impeditivo para a maioria das empresas farmacêuticas nacionais. Esse valor mitificado, no entanto, tem sido desconstruído por vários segmentos e colocado em níveis bem mais acessíveis. Nesse sentido, Kandil (2004), um pesquisador do mundo árabe, comenta sobre este tema:
“O exagero no custo do desenvolvimento de medicamentos serve aos interesses internacionais de duas formas: para justificar os altos preços de seus medicamentos e para desencorajar companhias farmacêuticas de países em desenvolvimento a investir na descoberta de novos medicamentos devido aos custos proibitivos” (Kandil, 2004, p. 544).A experiência brasileira recente de desenvolvimento de um produto anti-inflamatório tópico à base do óleo essencial da espécie Cordia verbenaceae (Acheflan®), embora de fato não seja o primeiro fitoterápico genuinamente nacional como se apregoa, tem relevância tanto pela qualidade da suas pesquisas quanto pelo exemplo concreto do custo real de um desenvolvimento nacional. De fato, o valor investido nas pesquisas desse produto tem sido divulgado na faixa de R$ 15 milhões e executado no prazo de 7 anos (FENAFAR, 2010), muito abaixo do valor estratosférico citado anteriormente, e que necessita ser eliminado dos discursos dos formadores de opinião desta área por ser equivocado e politicamente manipulado, constituindo um desserviço ao esforço nacional na área de pesquisa e desenvolvimento de medicamentos.
Desse modo, a pesquisa e desenvolvimento de fitoterápicos parecem ser possíveis a qualquer empresa farmacêutica a custos reais e acessíveis. Exemplos de desenvolvimentos nacionais recentes têm confirmado esse conceito (TABELA 2) e constituem-se em fatores de estímulo a que novas empresas adentrem a esse campo inovador.
| Produto | Espécie | Forma Farmacêutica | Unidades | Us$ milhões |
|---|---|---|---|---|
| Giamebil | Mentha crispa | comprimidos | 487.000 | 4,6 |
| Acheflan | Cordia verbenacea | creme | 479.000 | 3,7 |
| Acheflan | Cordia verbenacea | aerosol | 195.000 | 1,5 |
| Kronel | Schinus terebenthifolius | sabão líquido | 400.000 | 3,3 |
| Imunomax | Uncaria tomentosa | gel labial | 11.000 | 0,4 |
| Kronel | Schinus terebenthifolius | gel vaginal | 50.000 | 0,4 |
| Fonte: IMS, 2004. | ||||
Uma contribuição efetiva para esses desenvolvimentos tem sido a construção do marco regulatório fitoterápico brasileiro, iniciado em 1995 com a Portaria SVS nº 6 e seqüenciado com as Resoluções Anvisa RDC 17 de 2000, RDC 48 de 2004 e a atual RDC 14 de 2010. Em todos esses atos, o fitoterápico foi estabelecido no Brasil como medicamento com adaptação das exigências às peculiaridades técnicas dessa classe e também com algumas flexibilidades importantes, como o conceito de tradicionalidade via lista positiva ou pontuação por literaturas recomendadas (Carvalho et al., 2007).
Aproximação com o Segmento Farmacêutico
A atividade profissional voltada à P&D e com foco em produtos de mercado (Marques, 1992, 1998) levou à aproximação com empresas farmacêuticas interessadas em ocupar esses espaços para produtos inovadores.
Uma empresa farmacêutica nacional propôs consultoria a um dos autores no ano de 2003, inicialmente de forma pontual, seguida por um contrato fixo mensal. Nesse período, foi possível consolidar na prática a parceria envolvendo profissional da academia e empresas farmacêuticas, um fato desejado, mas raramente efetivado. Essa consolidação se concretizou na oferta para compor um cargo criado na estrutura administrativa da empresa, denominado Diretoria de Assuntos Fitoterápicos a partir de janeiro de 2004.
Como primeira medida, montou-se uma equipe técnica com a contratação de dois outros farmacêuticos, ambos com experiência anterior em empresas fabricantes e distribuidoras de extratos e de plantas para chás alimentícios. O passo seguinte foi a definição dos caminhos para a ousada tarefa de desenvolver produtos inovadores e criar uma linha fitoterápica numa empresa farmacêutica nacional. Assim, definiu-se a seguinte estratégia de pesquisa e desenvolvimento:
a) aproveitar a literatura nacional e internacional para registro simplificado;
b) prospectar desenvolvimentos nacionais não aproveitados industrialmente;
c) ajustar ofertas internacionais ao padrão regulatório brasileiro.
Desse modo, de 2004 a 2008 foram desenvolvidas várias atividades e registrados cinco fitoterápicos, criando-se, então, a linha Fitomedicina, mostrando ser possível a aproximação universidade - empresa e o desenvolvimento de fitoterápicos inovadores a custos acessíveis.
Descritivo dos Produtos Desenvolvidos Isoflavona aglicona de soja (Glycine max L. - Leguminosae)
Uma das áreas de interesse da empresa era a ginecologia, o que nos levou à busca de produtos para os sintomas do climatério. Os riscos mostrados pelo Women's Health Initiative Study (2002) aumentaram a valorização do emprego dos chamados fito-hormônios presentes principalmente na soja e em outras espécies.
Um levantamento de mercado realizado em 2004 mostrou a existência de produtos diversos nessa área, tanto alimentos de várias formas e apresentações, bem como alguns produtos fitoterápicos registrados. No entanto, apesar da presença de marcas de empresas importantes, a comercialização à época era de cerca de 500 mil unidades e US$ 8 milhões, valores absolutamente abaixo da importância terapêutica desses produtos frente à expectativa do número de pacientes.
Esse perfil parecia relacionar-se à baixa aderência das pacientes à terapêutica com produtos de isoflavona de soja, decorrente de alguma provável heterogeneidade de efeitos. Aprofundando o tema, verificou-se que as isoflavonas, por serem moléculas heterosídicas, necessitam ser digeridas para, então, absorvidas e promoverem os efeitos terapêuticos. Como na idade onde se estabelece o climatério ocorre grande prevalência de quadros de disbiose intestinal (Almeida et al., 2009), as pacientes provavelmente não estavam conseguindo digerir a isoflavona, que acabava sendo eliminada nas fezes, obviamente sem produzir os efeitos esperados.
Esforços para liberação das formas aglicônicas das isoflavonas têm sido feitas, tais como a adição da enzima beta-glicosidase, diminuída nos quadros de disbiose, a extratos de soja. Estudo clínico comparativo do uso de extrato comum versus extrato adicionado de enzima (Isoflavin beta e Isoflavin beta plus - empresa Galena) não mostrou diferenças entre os grupos, mantendo-se a conhecida heterogeneidade de efeitos sobre os sintomas do climatério (Carneiro et al., 2006) e mostrando não ser esse o caminho tecnológico ao problema das isoflavonas.
A solução foi, enfim, encontrada num pedido de patente de processo da Universidade de Campinas, envolvendo a hidrólise prévia das moléculas de isoflavonas glicosiladas com enzima beta-glicosidase, liberando-se as isoflavonas agliconas diretamente no extrato a ser ingerido (figura 1), evitando-se as deficiências digestivas e garantindo-se, teoricamente, os efeitos clínicos do produto (Park et al., 2001). Essa tecnologia foi depositada como patente e licenciada a uma empresa farmacêutica chamada Steviafarma Industrial, da cidade de Maringá (Bueno, 2004).

Assim, buscou-se uma parceria comercial com a empresa licenciante, a qual estava em fase de montagem de equipe de promoção médica para o lançamento do fitoterápico chamado Aglicon-soy®. Desse modo, formalizou-se contrato de promoção e comercialização do produto, que foi lançado na forma de cápsulas de extrato seco padronizado a 40% em isoflavonas, porém garantindo-se ao mesmo, no mínimo, 55% em genisteína, a principal isoflavona aglicônica presente na soja (Figura 2).

Tratava-se de um produto simples, similar a outros existentes em mercado, mas inovador por focar e resolver um problema de absorção, fundamental para o sucesso terapêutico pretendido. Por outro lado, promovia a geração da cadeia produtiva e gerava royalties à universidade e aos pesquisadores envolvidos. Apesar de tal perspectiva, após dois anos de comercialização, por motivos comerciais, houve rompimento do contrato de parceria comercial, retornando o produto Aglicon-soy à empresa Steviafarma Farmacêutica.
Incenso (Boswellia serrata Roxb. ex Colebr. - Burseraceae)
O segundo produto da linha Fitomedicina foi registrado com o nome de Védica®. Trata-se de um extrato padronizado da gomo-resina do incenso, espécie Boswellia serrata Roxb. ex Colebr. - Burseraceae, milenarmente utilizada na medicina Ayurvédica indiana como produto de ação anti-inflamatória.
Como a empresa atua fortemente na área da proctologia, tendo inclusive um medicamento à base do fármaco sulfasalazina, e tendo em vista a existência de inúmeros estudos comprovando efeitos dessa planta como anti-inflamatório em doenças inflamatórias intestinais, decidiu-se por seu desenvolvimento.
A busca por extratos junto aos importadores mostrou oferta de possibilidades, mas com contradições nas especificações de qualidade das matérias primas. À época, inexistia monografia oficial sobre a gomoresina que apontasse os requisitos de qualidade a ser seguidos; em vista disso, realizou-se a montagem das especificações a partir da literatura disponível, principalmente a monografia da empresa Natural Remedies Private Limited (Boswellia, 2001). Relatase nesse documento a presença nessa droga vegetal de 3-8% de óleos essenciais, 60-70% de resina e 2735% de gomas; na fração resinosa estão presentes triterpenos pentacíclicos denominados ácidos boswélicos, dos quais destaca-se o ácido 3-acetil-11-ceto-beta-boswellico (AKBA) como marcador e ativo farmacológico principal (Figura 3).
O extrato comercial era adquirido de empresa indiana via distribuidor/importador nacional e a matéria prima vinha padronizada em, no mínimo, 60% de ‘ácidos totais’; como tal padronização é absolutamente genérica e também tendo em vista a definição clínica da presença do marcador AKBA em, no mínimo 0,7% (Gupta et al., 1997, 2001), definiu-se por ambas especificações em conjunto (ácidos min. 60% e AKBA min. 0,7%) para os lotes de matéria prima (extrato seco).

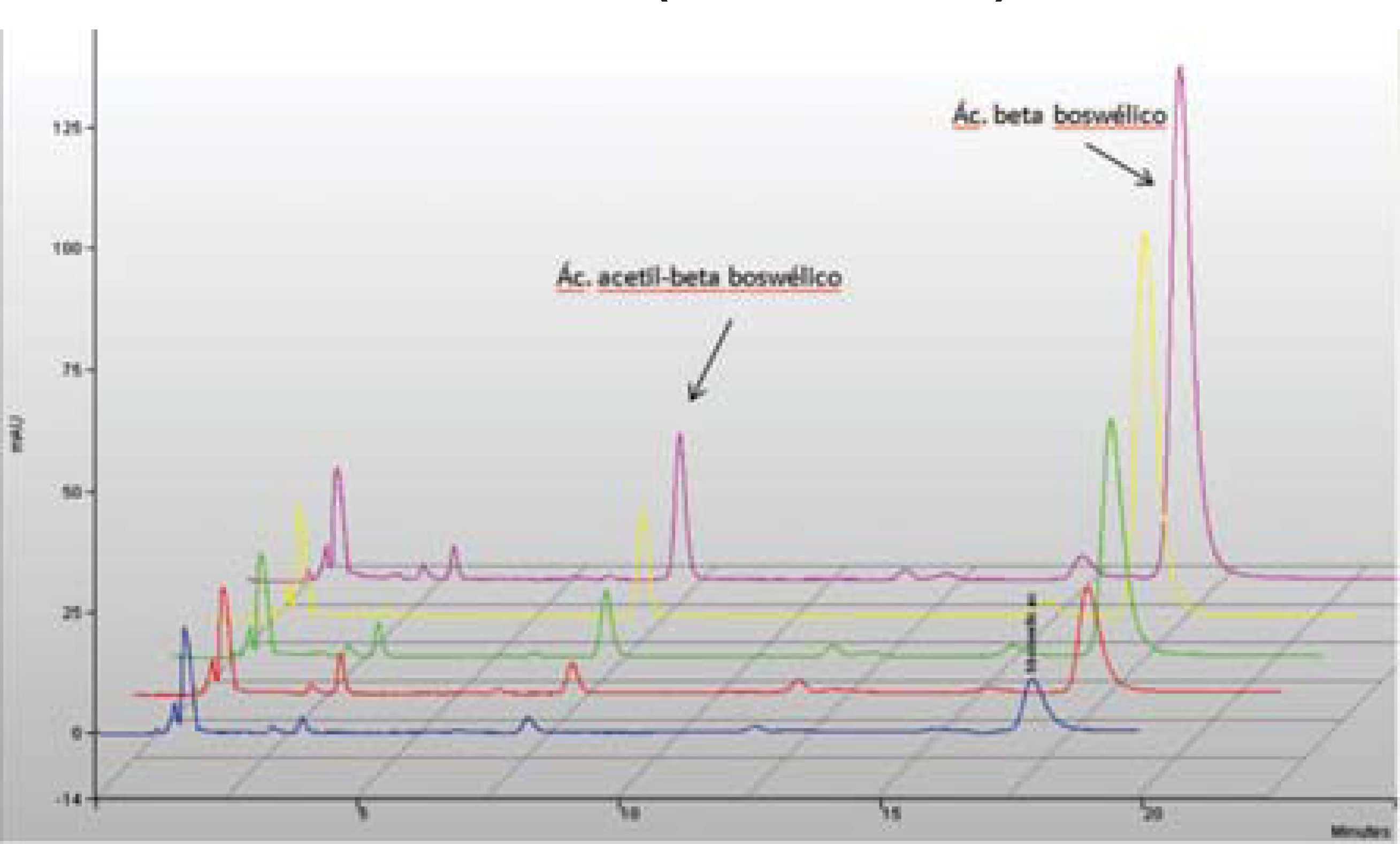
Houve desenvolvimento e validação de metodologia analítica realizada em parceria com a Universidade Federal do Paraná, tanto para método titulométrico de ácidos totais quanto por cromatografia líquida de alta eficiência utilizando-se a substância AKBA como marcador. Afalta de monografia oficial levou ao acréscimo de outra substância (ácido beta boswélico) como um segundo marcador, desenvolvido em paralelo ao primeiro, por ser majoritária no extrato, deixando-se tais dados em reserva, se porventura o órgão regulador exigisse a ampliação do número de marcadores no produto (Figura 4). Tais dados compuseram uma tese de doutorado dessa instituição (Perez, 2009).
Este fitoterápico apresenta um diferencial interessante frente a concorrentes de ação anti-inflamatória, pois seu mecanismo de ação direciona-se à inibição seletiva da enzima 5-lipoxigenase (LOX), inibindo-se desse modo a síntese da classe dos leucotrienos, particularmente o LTB4 (Ammon, 1996). No contexto atual, onde os inibidores das ciclooxigenases, principalmente da COX2, encontram-se desacreditados por riscos e efeitos adversos graves, produtos que atuam diferentemente tendem a destacar-se.
Extratos de B. serrata mostraram-se ainda capazes de promover inibição específica da 5-LOX, sem interferência nas COX e outras LOX, perfil que diminui o risco de efeitos adversos. Além disso, Boswellia serrata inibe também a enzima elastase leucocitária, protease dos leucócitos envolvida na destruição crônica de tecidos associada à inflamação, artrite e enfisema, o que lhe permite atribuir potencialidades terapêuticas na área da pneumologia, particularmente na doença pulmonar obstrutiva crônica (Ammon, 1996).
O produto foi finalizado na forma de comprimidos com 350 mg de extrato seco, que fornecem 2,45 mg de AKBA/comprimido (figura 5). Os estudos clínicos recomendam a administração de 3 comprimidos ao dia junto às refeições e estas preferencialmente com alimentos gordurosos, o que promove maior absorção dos ativos (Sterk et al., 2004).
Em termos de contra-indicações e reações adversas, o extrato de B. serrata é contra-indicado na gravidez e amamentação, podendo promover gastrite e refluxo gastroesofágico, queimação retroesternal, náuseas, flatulência abdominal, dor epigástrica, anorexia e dermatite.

Portanto, entende-se ser a gomo-resina de B. serrata um fitoterápico de grande potencial; apresenta densa tradicionalidade em várias regiões, está modernamente estudado, com eficácia comprovada em patologias reumáticas e doenças inflamatórias intestinais, além de outras possibilidades terapêuticas a ser completadas. Apresenta mecanismo de ação seletivo e específico (5-LOX e elastase), devendo consolidar-se na fitoterapia brasileira e mesmo mundial.
Garra do diabo (Harpagophytum procumbens D.C. - Pedaliaceae)
Este produto foi denominado Arpadol®, correspondendo às raízes tuberosas da espécie popularmente conhecida como ‘garra do diabo’, nome decorrente do fato de suas sementes serem grandes e espinhosas, equivalente ao que chamaríamos no Brasil de ‘carrapicho’. É de origem africana, principalmente das regiões da Namíbia e muito presentes no deserto do Kalahari. Trata-se de uma droga vegetal oficial constante de várias farmacopéias, de composição química bastante conhecida, expressa na presença principalmente de iridóides (0,5-3,0%), devendo apresentar no mínimo 1% do iridóide harpagosídeo, o ativo marcador químico e principal agente farmacológico da droga

Avaliando-se o mercado de produtos à base de garra do diabo, nota-se ser um fitoterápico antigo no Brasil, presente em diversos registros no banco de dados da Anvisa; no entanto, é difícil de ser encontrado nas farmácias, não é propagado junto aos prescritores e não aparece nos levantamentos de mercado, evidenciava algum problema interferente na sua evolução em mercado.
O conjunto de estudos disponíveis na literatura sobre esta espécie é denso, com inúmeros estudos pré-clínicos (em edema de pata, formalina, tail-flick, etc.) bem como pelo menos 30 estudos clínicos em patologias reumáticas como osteoartrite e lombalgias, sendo 15 revisões sistemáticas. Os estudos mostram eficácia comparada a de fármacos sintéticos usuais, mas principalmente maiores benefícios em termos de segurança, com ocorrência de efeitos adversos leves principalmente gastrointestinais (Stewart e Cole, 2005).
Em termos de mecanismos de ação, parecem ser do tipo misto, com inibição das vias enzimáticas das ciclo e lipooxigenases, supressão da expressão da óxido nítrico sintetase, inibição de citocinas pró-inflamatórias, diminuição do efeito de metaloproteinases, analgesia por redução da PGE2, bem como também por atividade antioxidante (Chrubasik e Eisenberg, 1999; Fiebich et al., 2001). Portanto, em conjunto, o produto expressa ações anti-inflamatórias, analgésicas e citoprotetoras articulares.
Apesar desse ‘padrão ouro’ em termos documentais, os produtos à base desta espécie se mostravam clinica e comercialmente insignificantes, situação aparentemente incompatível com seu potencial farmacológico e terapêutico.
O estudo dessa situação levantou a hipótese de problemas de dosagens dos extratos secos. Assim, revendo-se cuidadosamente a literatura (ex.: ESCOP, 1997), nota-se a recomendação da oferta de produtos que forneçam doses diárias de harpagosídeo na faixa de 50-100 mg por dia. Os extratos comerciais disponíveis no Brasil apresentam-se com especificações de 5% em iridóides totais expressos em harpagosídeo; no entanto, especificamente sobre esse ativo, tais extratos ofertam apenas 1,6% do mesmo, exigindo-se ingestões de3,1 a 6,2 g de extrato por dia.
Um dos produtos registrados na Anvisa e amplamente comercializado, conforme site da empresa produtora, declara conter 200 mg de extrato seco por comprimido, correspondendo a 10 mg de iridóides totais calculados como harpagosídeo. Ingerindo-se 1 comprimido 2-3 vezes ao dia, conforme recomendado, tal produto oferta aos pacientes de 6,4 a 9,6 mg de harpagosídeo por dia, uma dose absolutamente abaixo do limite mínimo recomendado cientificamente.
Para solucionar tal evidente problema técnico, buscamos extratos concentrados no marcador farmacológico. Tal extrato foi encontrado num fornecedor da Alemanha, com o qual se fechou contrato para fornecimento de extrato padronizado a 5% em harpagosídeo (mais de 10% em iridóides totais). Com essa matéria prima formulou-se produto na forma de comprimidos de 400 mg, os quais, ofertados três vezes ao dia, fornecem 60 mg de harpagosídeo, dose dentro da faixa ideal para obtenção dos efeitos terapêuticos.
Em outro aspecto, a conferência da literatura sobre esta espécie mostra também artigos científicos com resultados negativos, o que a princípio levanta dúvidas sobre a efetividade dessa droga vegetal. Um desses materiais (Soulimani et al., 1994) mostra claramente que o harpagosídeo é um fitofármaco com instabilidade em meio ácido, explicando porque em alguns estudos não se conseguem efeitos positivos com administração de produtos via oral. Para adequar o produto a tal característica, incluiu-se na formulação a aplicação, após compressão, de um polímero gastroresistente, incluindo-se o teste de desintegração de duplo pH no teste de estabilidade (TABELA 3).
| Fases do teste | Condições | Resultados |
|---|---|---|
| HCl 0,1 N | ||
| Fase ácida | Min. 60 minutos | > 60 min. |
| Fase básica | Tampão pH 7,5 Máx. 30 minutos | 10 min., 45 seg 15 min., 20 seg 22 min., 48 seg |
Portanto, finalizou-se o desenvolvimento do produto, lançado em apresentação com 30, 60 e 90 comprimidos de 400 mg gastroresistente (Figura 7). Cumpridos todos os requisitos técnicos, o sucesso comercial deste desenvolvimento é potencial.

Hortelã-pimenta (Mentha piperita L. - Labiatae)
Este produto corresponde a cápsulas gelatinosas moles de óleo essencial de hortelã pimenta (Mentha piperita L.), tendo sido comercialmente denominado de Mentaliv®. Esta espécie é mundialmente utilizada com propriedades digestivas e antiespasmódicas, sendo talvez uma das plantas medicinais de mais ampla e disseminada tradição de uso.
Quimicamente, a espécie contém taninos e flavonóides, mas, principalmente, óleos essenciais, os quais constituem matéria prima específica, com monografias distintas da droga vegetal sumidades floridas de hortelã. Esse óleo essencial é constituído de vários mono e sesquiterpenos, dos quais destacam-se o mentol com 30-55% e a mentona com 14-32% (WHO, 1999).
O óleo essencial foi adquirido de distribuidores gerais do mercado brasileiro, obtendo-se lotes de origem inglesa, inexistindo no país fornecedor de matéria prima local, embora o Brasil tenha sido, no passado, um dos grandes fornecedores mundiais de hortelã pimenta. Esses lotes foram avaliados segundo monografia da British Pharmacopoeia (1998), realizando-se desenvolvimento e validação de metodologia de controle de qualidade por cromatografia gasosa, utilizando-se esses dois marcadores, mentol e mentona.
Em termos de indicações, o efeito antiespasmódico da hortelã, do tipo antagonista de cálcio, facilmente obtido dos chás comuns de folhas da planta, no óleo essencial torna-se muito mais expressivo, tendo sido avaliado clinicamente na fase espástica da chamada síndrome do intestino irritável, uma patologia comum tratada clinicamente na gastroenterologia (Hãnsel, Tyler e Schultz, 2002).
Os estudos clínicos do óleo de hortelã nessa síndrome existem num volume surpreendente para o padrão fitoterápico comum, com mais de 10 estudos clínicos disponíveis, publicados em revistas médicas conhecidas e respeitadas, tais como os estudos de Dew, Evans e Rhodes (1984), Evans e colaboradores (1982), Pittier e Ernst (1998), dentre outros.
No entanto, como no produto anterior, há a recomendação técnica de que sejam formulados em cápsulas gelatinosas moles com gastrorresistência (Kline et al., 2001; Liu et al., 1997). Os motivos dessa exigência decorrem do efeito colateral azia, que ocorre em função do efeito relaxante do óleo essencial sobre o esfíncter gastroesofágico inferior, a partir do que ocorrem as eructações tão comuns após a ingestão de chás de hortelã. No entanto, como tal efeito adverso torna-se intolerável em tratamento prolongado, como exigido no tratamento da síndrome do intestino irritável, torna-se obrigatória a formulação do produto na forma gastrorresistente.
Tal formulação envolveu a aplicação de um polímero sintético sobre a cápsula gelatinosa mole, realizada em empresa terceirizadora dessa tecnologia. No entanto, durante a etapa de estabilidade, os três lotes piloto sofreram trincas no polímero sobreposto às cápsulas, talvez pelo fato das cápsulas serem flexíveis e os polímeros formarem uma camada sólida rígida. Apenas na terceira produção, com medidas extremas no controle de umidade da sala de revestimento e ampliação da concentração de plastificante no polímero, os resultados adequados foram obtidos, demonstrando as dificuldades tecnológicas na produção de cápsulas gelatinosas moles gastrorresistentes.
Em relação às doses do produto, os estudos clínicos existentes levaram à sua inclusão na Resolução Anvisa RE 89 (Brasil, 2004a), que regula o registro de produtos fitoterápicos de registro simplificado. O produto, portanto, foi desenvolvido na forma de cápsulas gelatinosas moles gastrorresistentes contendo 200 mg de óleo essencial.
A resolução RE 89, conforme determinam outras regras legais da área, exige que se expresse a correspondência em marcador contida na quantidade de derivado colocada na forma farmacêutica, no caso, as 200 mg de óleo essencial. Assim, com base na especificação dos marcadores citada na resolução (mentol 30-55% e mentona 14-32%) calculou-se como presentes no produto 60-110 mg de mentol e de 28-54 mg de mentona. Assim, esses dados foram incluídos em bula e cartucho do produto, bem como em toda a documentação do dossiê para registro.
Ao ser peticionado o pedido de registro à Anvisa, a avaliação desses dados gerou uma diligência específica, dentre outros itens, questionando a forma adotada para a expressão de ativos e exigindo sua definição em um determinado valor fixo com variação de 90-110%, como usual para qualquer medicamento. Entrou-se, assim, numa dúvida técnica inédita: como expressar um valor fixo de marcadores se a matéria prima os exprime em faixas?
Entendendo tratar-se de um tema novo aos envolvidos, tanto à empresa quanto aos técnicos da área regulatória, a equipe decidiu questionar essa posição óbvia e clássica solicitando que o tema fosse avaliado junto à CATEF - Câmara Técnica de Fitoterápicos, composta por pesquisadores de instituições públicas e certamente mais aberta à discussão técnica heterodoxa que se haveria de realizar.
Um questionamento formal foi enviado às Anvisa e Catef baseado nos próprios regulamentos, tanto nas monografias farmacopêicas oficiais adotadas para o controle das matérias primas quanto na monografia da própria RE 89, ambas estabelecendo faixas para os dois marcadores do óleo de menta. Ao definir-se um ponto qualquer da faixa, se estaria adotando um requisito acima do exigido naqueles regulamentos.
O assunto foi avaliado pelos técnicos da Catef, os quais julgaram tal novidade técnica de expressão de ativos segundo o racional próprio da área, emitindo-se o parecer com o seguinte teor:
Portanto, este assunto demonstrou a necessidade clara de se fundamentar adequadamente os temas e pleitos, encaminhando-os para discussões amplas e coerentes à busca do progressivo acúmulo de experiências na área, tanto nas empresas quanto no órgão regulador, a quem parabenizamos pela flexibilidade e coerência neste assunto.
Desse modo, o produto foi registrado como de venda livre (sem prescrição médica obrigatória), em apresentações de 10, 20, 30, 40 e 60 unidades, indicadas para a fase espástica da síndrome do intestino irritável com recomendação da ingestão de uma cápsula 3 vezes ao dia (Figura 8).

Barbatimão (Stryphnodendron adstringens [Mart.] Coville - Leguminosae)
Este produto, o quinto da linha em discussão, referese a uma pomada com extratos das cascas de barbatimão, uma das espécies mais tradicionais da fitoterapia brasileira, presente em praticamente todos os livros de uso popular de plantas medicinais de nosso país, e citada desde os tempos do império.
É uma espécie típica do cerrado brasileiro, originalmente denominadas ‘uabatimó’, termo indígena que significa ‘casca que aperta’, em decorrência de sua forte adstringência. Essa droga vegetal está inscrita na Farmacopéia Brasileira 1 e 2as edições (Pharmacopéia, 1926; Farmacopéia, 1959), com os dados usuais de caracterização botânica e testes fitoquímicos direcionados à classe dos taninos.
Os estudos iniciais partiram de financiamento do Programa de Plantas Medicinais da Central de Medicamentos do Ministério da Saúde, o qual patrocinou estudos químicos e farmacológicos junto ao Programa de Pós-graduação em Biotecnologia da Universidade de Ribeirão Preto - UNAERP, sob a coordenação da Profa. Dra. Suzelei de Castro França. Vários estudos foram realizados, particularmente nas áreas de química, farmacologia, toxicologia e também de coleta de germoplasma e avaliação da variabilidade genética e química.
Em termos químicos, a universidade produziu extratos hidroalcoólicos (a 30%) das cascas e os padronizou em fenóis totais e taninos, expressos nas concentrações de mínimo 60% em fenóis totais dos quais, pelo menos, 80% deles representado por taninos totais. A metodologia utilizada para tais avaliações foi a farmacopêica, empregando-se reagente de Folin-Ciocalteau para fenóis totais e precipitação com pó-de-pele levemente cromado para os taninos totais (Farmacopéia, 1959).
O estudo de cicatrização em roedores mostrou resultados muito interessantes e peculiares. Assim, elaborou-se o produto na forma farmacêutica pomada, incorporando-se à mesma o extrato de barbatimão nas concentrações de 1, 3, 6 e 10% (m/m). Todas essas quatro formulações foram testadas em modelos de cicatrização em roedores, obtendo-se resultados distintos de acordo com os teores. Desse modo, a formulação de 1% não mostrou eficácia frente ao controle; a de 10% mostrou cicatrização rápida por formação de uma crosta superficial, deixando o ferimento não cicatrizado abaixo desta, o qual geralmente infectava e tornava-se purulento. De modo distinto, as concentrações de 3 a 6% mostraram-se adequadas, melhorando o processo cicatricial de modo mais efetivo que o grupo controle. A peculiaridade desse achado embasou pedido de patente da UNAERP para formulações contendo extrato das cascas de barbatimão com propriedades cicatrizantes (Oliveira, 2003).
A literatura já apontava a esse efeito cicatrizante das cascas, embora sem detalhes quanto à concentração adequada para que tal ocorresse. Os estudos anteriores mostravam também efeitos antiinflamatórios à casca, bem como efeitos cicatrizantes de pele, de úlceras gástricas, e ainda antimicrobianos (Neves et al., 1992; Panizza et al., 1988; Hernandes et al., 2001; Mitsui et al., 2001).
O estudo de Viera, Mello e Mello (1998) confirmava o efeito cicatrizante de uma pomada a 2,5% de extrato seco de barbatimão, com aumento na formação de tecido de granulação, proliferação de fibroblastos, neocapilarização, produção de colágeno e reepitelização. Outro estudo (Palazzo et al., 2001) avaliou o efeito cicatrizante em termos de metáfases e extensão da área reepitalizada, mostrando serem esses bons parâmetros indicativos dos efeitos cicatrizantes para esta espécie (Figura 9).

Com os resultados obtidos, elaborou-se forma farmacêutica (pomada) na concentração de 3% de fenóis totais e realizou-se uma avaliação clínica direcionada a escaras de decúbito. Os resultados clínicos foram tão expressivos que permitiu à UNAERP a montagem de um ambulatório de escaras e ao seu referenciamento regional para atendimento de escaras de pacientes do Sistema Único de Saúde.
A UNAERP, motivada pelo conjunto de resultados, peticionou pedido de registro de medicamento fitoterápico junto à Anvisa; no entanto, a inexistência de laboratório industrial certificado em termos de boas práticas de fabricação dentro das instalações da instituição, impossibilitou a concretização desse anseio.
Ao se tomar conhecimento desse contexto, formalizou-se proposta de parceria à UNAERP, dando condições de aproveitamento industrial ao conjunto de dados técnicos tão bem elaborados pela universidade. Desse modo, ocorreu o licenciamento de pedido de patente dessas informações da UNAERP ao laboratório farmacêutico, a quem coube finalizar os estudos de formulação, estabilidade e registro junto à Anvisa, bem como a respectiva produção e comercialização do produto, repassando-se à UNAERP um determinado percentual de royalties decorrentes do lucro líquido de vendas do medicamento.
Durante a finalização do desenvolvimento, a equipe confrontou-se com outro desafio: o atendimento à legislação da biodiversidade - Medida Provisória 2186 (Brasil, 2001). Tal norma teve origem na Convenção da Diversidade Biológica, apresentando conceitos básicos referentes à propriedade dos recursos naturais pelo próprio país, acesso autorizado a tais recursos com vistas à repartição dos benefícios originados do seu uso.
Apesar da pesquisa com o barbatimão ser anterior à vigência da medida provisória, e sendo esta uma das críticas mais contundentes que lhe é feita, ou seja, a tentativa de vigorar de forma retroativa, a empresa decidiu atender às suas exigências. Como o TAP - Termo de Anuência Prévia, documento inicial exigido pela MP, inexistia à época do início da pesquisa, montou-se contrato de repartição de benefícios remetendo a assinatura atual à autorização informal feita pelo proprietário da terra onde a espécie foi originalmente coletada.
Fez-se coleta de exsicata, depósito em herbário fiel depositário e buscou-se toda a documentação solicitada pelo Conselho de Gestão do Patrimônio Genético - CGEN, órgão encarregado de gerenciar os pedidos de autorização de acesso à biodiversidade.
O contrato de repartição de benefícios foi formalizado pela universidade, que realizou as pesquisas iniciais, com o dono da terra, definindo-se em conjunto uma série de benefícios não financeiros, tais como ajuda na montagem de uma coleção de espécies nativas, treinamento em recursos humanos, aquisição de alguns equipamentos de secagem, etc.
Assim, montou-se o processo com os documentos exigidos e peticionou-se ao Ministério do Meio Ambiente para tramitação. O pedido tramitou durante um ano, sofreu duas exigências e foi acompanhado pessoalmente por membro da equipe para monitoramento e intervenção. Dessa experiência, notou-se ser crucial ao sucesso do pedido a regularidade da documentação de propriedade da terra, com cópia autenticada do título de propriedade, bem como a exata indicação de onde se localiza tal propriedade; no caso em questão, a inclusão de croqui elaborado localmente mostrando detalhes e limites exatos da propriedade facilitaram a avaliação pelos técnicos do CGEN.
Por outro lado, notou-se a dificuldade de entendimento, por parte de membros do CGEN, das etapas de produção de extrato seco ou validação de controle de qualidade, exigidas pela legislação de registro, que porventura sejam feitas à parte de forma terceirizada; tais etapas complementares ao desenvolvimento de produtos foram entendidas por alguns membros como um novo acesso à biodiversidade, o que exigiria novo pedido de autorização e novo trâmite, obviamente complicando e protelando inoportunamente a autorização necessária.
Assim, após um ano de tramitação, duas exigências pontuais e duas reuniões onde o processo foi avaliado, a UNAERP obteve aprovação de seu pedido (retroativo) de acesso à biodiversidade e desenvolvimento tecnológico, em conjunto com a empresa farmacêutica, expressa na Deliberação nº 163 (Brasil, 2006b). Assim, embora se trate de uma legislação irracional, burocrática e totalmente inadequada à realidade brasileira, a experiência citada mostra ser possível, mesmo assim, o seu cumprimento em prazo exeqüível para permitir o desenvolvimento de produtos fitoterápicos brasileiros.
Superado esse obstáculo de porte, a equipe confrontou-se com outro desafio: a espécie de barbatimão em utilização encontra-se em risco de extinção, o que colocava em cheque todo o futuro do projeto. Buscou-se parceria com a empresa Centroflora, produtora de extratos secos, que partiu à busca da matéria prima (cascas) e obteve, com respaldo legal do Ibama, acesso a volume de cascas suficientes para 3 anos de pesquisas e mesmo de produção industrial.
Em paralelo, formalizou-se parceria com pesquisadora da UNAERP da área de agronomia, Profa. Ana Maria Soares Pereira, que realizou viagens para coleta de sementes, as quais foram estudadas em termos de germinação e desenvolvimento de mudas. Tal atividade desdobrou-se em patrocínio a uma Oscip chamada Ecocerrado Brasil, em Minas Gerais, que recebia as sementes ou mesmo as mudas obtidas pela UNAERP, completava seu desenvolvimento e fazia sua disseminação em propriedades da região, desse modo contribuindo à manutenção da espécie e à sustentabilidade do projeto (Figura 10).

Após essas etapas, consideradas limites para a sequência do projeto, realizou-se também novo estudo toxicológico pré-clínico, completando-se algumas etapas do estudo anterior, frente às exigências regulatórias, particularmente da Resolução RE 90 (Brasil, 2004b). Assim foram realizados os seguintes estudos:
- Toxicologia aguda em ratos, vias oral e dérmica
- Toxicologia de 90 dias em ratos, via dérmica
- Toxicologia de 90 dias em coelhos, via dérmica
- Teste de irritação dérmica em coelhos
- Teste de irritação ocular em coelhos
Todos os experimentos confirmaram a total segurança pré-clínica do produto, com DL50 acima de 5 g/kg e ausência de manifestações de toxicidade, mortalidade ou alterações nos testes laboratoriais ou histopatológicos (Figura 11). Esse conjunto de dados permitiu a elaboração de um dossiê toxicológico pré-clínico específico, totalmente documentado com resultados laboratoriais e histopatológicos, o qual foi anexado ao processo de registro à Anvisa (UNAERP, 2006).

Em relação à parte clínica, o foco do produto eram escaras, que são ferimentos surgidos por compressão física gerando úlceras de pressão ou decúbito, muito presentes em pacientes acamados, idosos, para e tetraplégicos. Tais ferimentos mostram-se em vários níveis (I a IV) conforme sua gravidade e profundidade. Assim, buscou-se avaliar o produto nas escaras de graus mais leves, entendendo-se que, se fosse efetivo em tais ferimentos, evidentemente o seria igualmente para ferimentos leves e superficiais ocorrentes no cotidiano de todas as pessoas.
Assim, recuperando a extensa base tradicional das cascas de barbatimão, presentes nos principais livros da fitoterapia brasileira como Pio Correa, Raul Coimbra, Simões e colaboradores, dentre inúmeros outros; com base também nos vários estudos pré-clínicos de cicatrização existentes na literatura em modelos in vivo e em tecidos, decidiu-se aproveitar dados das observações clínicas realizadas pela UNAERP ao longo de muitos anos em seu ambulatório de escaras.
Assim, recuperando a extensa base tradicional das cascas de barbatimão - presentes nos principais livros da fitoterapia brasileira como Pio Correa, Raul Coimbra, Simões e colaboradores, dentre inúmeros outros - e com os vários estudos pré-clínicos de cicatrização existentes na literatura em modelos in vivo e em tecidos, decidiu-se aproveitar dados das observações clínicas realizadas pela UNAERP ao longo de muitos anos em seu ambulatório de escaras.
O projeto foi aprovado em comitê de ética institucional, envolveu 27 pacientes de faixa etária variada, apresentando um total de 51 úlceras, aos quais aplicou-se a pomada com o extrato seco de barbatimão. O estudo confirmou ser a pomada efetiva na cicatrização das escaras dos pacientes, com maior eficácia nas escaras de nível I e II, embora 100% das lesões tenham cicatrizado completamente no período de tratamento (UNAERP, 2004; Minatel et al., 2010).
Desse modo, o desenvolvimento do produto foi finalizado com validação analítica ao extrato, ao produto acabado, produção de lotes piloto e estudo de estabilidade. O registro foi peticionado à Anvisa com base em vários pontos da legislação, compondo um perfil documental global envolvendo referências constantes da RE 88 de 2004 (2 pontos), apresentação de estudos próprios conforme RDC 48 de 2004 - item 8.2, bem como dezenas de referências diversas sobre botânica, agronomia, química, farmacologia e clínica disponíveis na literatura, compondo um volume substancial de documentação técnico-científica para o registro de fitoterápico tradicional.
Portanto, em dezembro de 2007, o registro deste produto inovador nacional, de grande tradição, foi emitido pela Anvisa. O produto recebeu a denominação comercial de Fitoscar®, sendo comercializado na forma de pomada 60 mg do extrato por grama, em bisnagas de 10, 20, 30 e 50 g, recomendada para uso tópico 2 a 3 vezes ao dia (figura 12).

Conclusões
A partir desse conjunto enorme de dados das mais diversas áreas, tenta-se mostrar que é totalmente possível desenvolver fitoterápicos no Brasil, a custos acessíveis e em empresas nacionais de porte médio, no mínimo, tendo em vista os investimentos necessários. Em termos de faturamento, a linha igualmente cumpriu a expectativa projetada, com valores maiores ou menores que o esperado, mas na média gerando à empresa valores substanciais que tanto recuperaram o investimento quanto permitem contribuição efetiva no faturamento geral (TABELA 4).
| Produto | Faturamento previsto | Faturamento executado | ||
|---|---|---|---|---|
| Unid/ano | Fat R$/ano | Unid/ano | Fat R$/ano | |
| Aglicon-soy 60 cps | 35.000 | 1.925.000 | desconti nuado | descontinuado |
| Arpadol 30 comp | 180.000 | 3.510.000 | 411.924 | 12.377.000 |
| Mentaliv 60 comp | 15.600 | 790.000 | 65.748 | 2.038.000 |
| Védica 60 comp | 5.000 | 270.000 | 2.811 | 176.000 |
| Fitoscar 60 mg/g | 50.000 | 1.860.000 | 69.739 | 1.775.000 |
| Total faturamento | 285.600 | ± 8.355.000 | 550.222 | ± 16.346.000 |
Os prazos, porém, não são antecipáveis pela complexidade técnica envolvida em praticamente todas as etapas da cadeia de P&D, o que protelou a obtenção dos registros para 3-4 anos após o início das atividades e o lançamento da linha completa para outros tantos anos, em decorrência de estratégias específicas do setor de marketing.
Em outro aspecto, apesar do sucesso no desenvolvimento dos produtos e na obtenção dos respectivos registros, a estrutura da área foi extinta em 2009, com incorporação dos produtos à linha usual da empresa, sem grande distinção em termos de origem fitoterápica.
Essa desestruturação teve vários motivos, alguns bastante subjetivos, mas certamente a demora na finalização decorrente da complexidade do desenvolvimento foi um dos aspectos envolvidos. Em paralelo, as empresas nacionais são assediadas por empresas internacionais que oferecem produtos totalmente desenvolvidos, com literatura publicada e matérias primas acessíveis, o que esmorece a intenção inicial de investimentos em desenvolvimentos locais.
E, por fim, foi possível notar que as empresas nacionais mostram-se às vezes motivadas com a biodiversidade, mas sem um compromisso específico com a área, com seu potencial gerador de riqueza e nacionalidade, permanecendo predominantemente com o entendimento de que é, apenas, mais uma fonte de matérias primas para novos produtos.
Agradecimentos
Agradecemos e reconhecemos a colaboração da equipe técnica da empresa de todas as áreas, farmacotécnica, controle, garantia da qualidade, produção, médica e regulatória, vendas, etc., em especial à farmacêutica Cecília Elena de Figueiredo Ognibene, bem como aos fornecedores de serviços e produtos, sem as quais estas atividades de desenvolvimento não seriam possíveis.
Referências
Almeida, L.B.; Marinho, C.B.; Souza, C.S. e Cheib, V.B.P. 2009 - Disbiose intestinal. Revista Brasileira de Nutrição Clínica, v. 24, n. 1, p. 58-65.
Ammon, H.P.T. 1996 - Salai Guggal - Boswellia serrata: from an herbal medicine to a non-redox inhibitor of leukotriene biosynthesis. European Journal of Medical Research, v. 1,p. 369-370.
Boswellia Serrata Master Document. 2001 - Bangalore (Índia): Natural Remedies Private Limited, 10/05/2001. Disponível em: <http://www.allianceingredients.com/pdfdocs>. Acesso em: 07 ago 2006.
Brasil 2001 - Presidência da República. Medida Provisória no. 2186-16 de 23 de Agosto de 2001. Regulamenta o inciso II do § 1o e o § 4o do art. 225 da Constituição, os arts. 1o, 8o, alínea “j”, 10, alínea “c”, 15 e 16, alíneas 3 e 4 da Convenção sobre Diversidade Biológica, dispõe sobre o acesso ao patrimônio genético, a proteção e o acesso ao conhecimento tradicional associado, a repartição de benefícios e o acesso à tecnologia e transferência de tecnologia para sua conservação e utilização, e dá outras providências. Diário Oficial da União.
Brasil 2004a - Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução - RE 89, de 16 de março de 2004. Publica lista de produtos fitoterápicos para registro simplificado. Diário Oficial da União.
Brasil 2004b - Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RE 90, 16 de março de 2004. Publica regulamento para estudos de toxicologia pré-clínica de produtos fitoterápicos. Diário Oficial da União.
Brasil 2006a - Decreto Presidencial nº 5813 de 22 de junho de 2006. Aprova a Política Nacional de Plantas Medicinais e Fitoterápicos e institui Grupo de Trabalho Interministerial, no prazo de 120 dias, sob a coordenação do Ministério da Saúde, elaborar o Programa Nacional de Plantas Medicinais e Fitoterápicos. Diário Oficial da União.
Brasil 2006b - Ministério do Meio Ambiente. Conselho de Gestão do Patrimônio Genético. Deliberação nº 163 de 28.09.2006. Concede à Universidade de Ribeirão Preto - UNAERP, autorização de acesso a amostra de componente do patrimônio genético para a finalidade de bioprospecção e desenvolvimento tecnológico, de acordo com os termos do projeto intitulado “Estudo clínico com forma farmacêutica fitoterápica contendo extrato de planta do gênero Stryphnodendron”, sob a coordenação da pesquisadora Dra. Suzelei de Castro França.
British Pharmacopoeia 1998 - HMSO, Londres, p. 1323-1324.
Bueno, R. 2004 - Agência de Inovação Unicamp licencia 1a patente: Steviafarma vai comercializar isoflavona desenvolvida por Yong Kun Park. Publicada em 10 de junho 2004. Disponível em: <http://www.inovacao.unicamp.br/report/news-isoflavona.shtml> Acesso em: 20 abr. 2011.
Calixto, J.B. e Siqueira Jr., J.M. 2008 - Desenvolvimento de Medicamentos no Brasil: Desafios. Gazeta Médica da Bahia, v. 78, suplemento 1, p.98-106. Disponível em: <http://www.gmbahia.ufba.br/index.php/gmbahia/article/viewFile/269/260> Acesso em: 20 de abr. 2011.
Câmara Técnica de Fitoterápicos (CATEFj/online 2007. Resposta a questionamento sobre concentração de marcadores de óleo de menta (mensagem pessoal). Mensagem recebida por luis.marques@ apsen.com.br em 01.08.2007.
Carneiro, L.M.R.; Francisco, C.; Franco, P.A. e Marques, L.C. 2006 - Avaliação sintomática de pacientes usuárias de isoflavonas da Farmácia Reativa de Araraquara (SP): estudo aberto e preliminar. JBF - Jornal Brasileiro de Fitomedicina, v. 4, p. 11-15.
Carvalho, A.C.B.; Balbino, E.E.; Maciel, A. e Perfeito, J.P.S. 2008 - Situação do registro de medicamentos fitoterápicos no Brasil. Revista Brasileira de Farmacognosia, v. 18, n. 2, p. 314-319.
Carvalho, A.C.B.; Nunes, D.S.G.; Baratelli, T.G.; Shuqair, N.S.M.S.A.Q. e Netto, E.M. 2007 - Aspectos da legislaçâo no controle dos medicamentos fitoterápicos. T&C Amazônia, v. 5, n.11, p. 26-32.
Chrubasik, S. e Eisenberg, E. 1999 - Treatment of rheumatic pain with kampo medicine in Europe. Part 1. Harpagophytum procumbens. Pain Clinic, v. 11, n. 3, p. 171-178.
Conselho Federal de Nutricionistas - CFN 2007 - Resolução CFN N°402/2007. Regulamenta a prescrição fitoterápica pelo nutricionista de plantas in natura frescas, ou como droga vegetal nas suas diferentes formas farmacêuticas, e dá outras providências. Diário Oficial da União do dia 06 ago. 2007, seção I, p. 121.
Dew, M.J.; Evans, B.K. e Rhodes, J. 1984 - Peppermint oil for the irritable bowel syndrome: a multicentre trial. The British Journal of Clinical Practice, v. 38, p. 394-398.
European Federation of Pharmaceutical Industries and Associations (EFPIA) 2011 - A highly regulated industry. Disponível em: <http://www.efpia.org/content/Default.asp?PagelD=361>. Acesso em: 18jul 2011.
European Scientific Cooperative on Phytotherapy (ESCOP). 1997 - Monographs on the medicinal uses ofplantdrugs. Exeter, UK: ESCOP.
Evans, B.K.; Levine, D.F.; Mayberry, J.F.; Rees, W.D.W.; Rhodes, J.; Cardiff, T.J.T. 1982 - Multicentre trial of peppermint oil capsules in irritable bowel syndrome. Scandinavian Journal of Gastroenterology, 17, A503.
Farmacopéia dos Estados Unidos do Brasil. 1959. 2a edição. Indústria Gráfica Siqueira, São Paulo.
FENAFAR - Federação Nacional dos Farmacêuticos. 2010 - País deixa de gerar US$ 5 bí por ano com fitoterápicos. Disponível em: <http://www.fenafar.org.br/portal/medicamentos/62-medicaments/527-pais-dei-xa-de-gerar-us-5-bi-por-ano-com-fitoterapicos.html>. Acesso em: 20 Jul 2011.
Fiebich, B.L.; Heinrich, M.; Hiller, K.O. e Kammerer, N. 2001 - Inhibition of TNF-alpha synthesis in LPS-stimulated primary human monocytes by Harpagophytum extract SteiHap 69. Phytomedicine, v. 8, p. 28-30.
Freitas, A. 2007 - Estrutura de mercado do segmento de fitoterápicos no contexto atual da indústria farmacêutica brasileira. Ministério da Saúde / OPAS, Brasília.
Gupta, I.; Parihar, A.; Malhotra, P.; Singh, G.B.; Lüdtke, R.; Safayhi, H. e Ammon, H.P. 1997 -Effects of Boswellia serrata gum resin in patients with ulcerative colitis. European Journal of Medical Research, v. 2, n. 1, p. 37-43.
Gupta, I.; Parihar, A.; Malhotra, P.; Gupta, S.; Lüdtke, R.; Safayhi, H. e Ammon, H.P. 2001 - Effects of gum resin of Boswellia serrata in patients with chronic colitis. Planta Medica, v. 67, p. 391-395.
Hãnsel, R.; Tyler, V.E. e Schultz, V. 2002. Fitoterapia racional: um guia de fitoterapia para as ciências da saúde. Editora Manole, São Paulo.
Hernandes, L; Pereira, L.C.M.S.; Pallazo, F.; Palermo, D. e Mello, J.C.P. 2001 - Fitoterapia x cicatrização cutânea: aplicação de pomada com extrato de barbatimão [Stryphnodendron adstringens (Martius) Coville] em feridas cutâneas. Ill Seminário do Centro de Ciências da Saúde da UEM, p. 73, Maringá.
Houghton, P.J. e Mukherjee, P.K. 2009 - The worldwide Phenomenon of Increased use of Herbal Products: Opportunities and Threats. In: Houghton, P.J. e Mukherjee, P.K. (ed.) Evaluation of herbal medicinal products, cap. 1. Pharmaceutical Press, Londres.
IMS - International Medical Statistics 2004 - Pharmaceutical Market Brazil. IMS, Suiça
IMS - International Medical Statistics 2011 - Pharmaceutical Market Brazil. IMS, Suiça.
Kandil, O. 2004 - The pharmaceutical industry in the Arab world challenger, controversies and future outlook. Drug Discovery Today, v. 9, n. 13, p. 543-545.
Kline, R.M.; Kline, J.J.; Di Palma, J. e Barbero, G.J. 2001 - Enteric-coated, pH-dependent peppermint oil capsules for the treatment of irritable bowel syndrome in children. The Journal of Pediatrics, v. 138, p. 125-128, 2001.
Liu, J.H.; Chen, G.H.; Yeh, H.Z.; Huang, C.K.; Poon, S.K. 1997 - Enteric-coated capsules in the treatment of irritable bowel syndrome: a prospective randomized trial. Journal of Gastroenterology, v. 32, n. 6, p. 765-768.
Marques, L.C. 1992 - Produção e comercialização de fitoterápicos no Paraná: uma abordagem de vigilância sanitária. Curitiba, 232p. Dissertação (Mestrado) Curso de Pós-graduação em Botânica, Setor de Ciências Biológicas, Universidade Federal do Paraná.
Marques, L.C. 1998 - Avaliação da ação adaptógena das raízes de Pfaffia glomerata (Spreng.) Pedersen - Amaranthaceae. São Paulo, 145p. Tese (Doutorado) - Escola Paulista de Medicina Universidade Federal de São Paulo.
Marques, L.C. 2010 - Fitoterápicos: perspectivas de novos e antigos produtos. In: Haraguchi, L. M. M. e Carvalho, O. B. Plantas medicinais. Secretaria Municipal do Verde e do Meio Ambiente, São Paulo.
Minatel, D.G.; Pereira, A.M.S.; Chiaratti, T.M.; Pasqualin, L.; Oliviera, J.C.N.; Couto, L.B.; Lia, R. C.C.; Cintra, J.M.; Bezzon, M.F.A. e Franca, S.C. 2010 - Estudo clínico para validação da eficácia de pomada contendo barbatimão (Stryphnodendron adstringens (Mart.) Coville) na cicatrização de úlceras de decúbito. Revista Brasileira de Medicina, v. 67, n. 7, p. 250 -256.
Mitsui, M.L.; Nakamura, C.V.; Toledo, C.E.M.; Dias Filho, B.P. e Mello, J.C.P. 2001 - Atividade antibacteriana in vitro das subtrações obtidas de Stryphnodendron adstringens (barbatimão). X Encontro Anual de Iniciação Científica da UEPG, Ponta Grossa.
Neves, C.L.C.; Neto, J.J.; Ifa, D.R.; Fracasso, J.F.; Silva, R.F.P. e Lepera, E.Z.P. 1992 - Estudo dos Efeitos Farmacológicos de Hamamélis e Barbatimão. XII Simpósio de Plantas Medicinais do Brasil, p.12, Curitiba.
Oliveira, E.E. 2003 - Formulação de Medicamento Natural (Composição para uso tópico contendo extrato de planta do gênero Stryphnodendron; seu processo de preparação e sua aplicação). PI0300440-6, depositada em 25/02/2003.
Palazzo, F.; Palermo, D.B.; Mello, J.C.P. e Hernandez, L. 2001 - Proliferação celular em feridas cutâneas de ratos Wistar tratados com Stryphnodendron adstringens (barbatimâo). X Encontro Anual de Iniciação Científica da UEPG, Ponta Grossa.
Panizza, S.; Rocha, A.B.; Gecchi, R. e Souza-Silva, R.A.P. 1998 - Stryphnodendron barbatiman (Velloso) Martius: teor em taninos na casca e sua propriedade cicatrizante. Revista de Ciências Farmacêuticas, v. 10, p. 101-106.
Park, Y.K.; Aguiar, C.L.; Alencar, S.M. e Scamparini, A.R.P. 2001 - Biotransformações de isoflavonas de soja. Biotecnologia, Ciência & Desenvolvimento, v. 20, mai/jun, p. 12-14.
Perez, E. 2009 - Obtenção de extrato padronizado de Mucuna pruriens (L.) DC. e controle de qualidade de matéria-prima e produto contendo Boswellia serrata Roxb.: desenvolvimento e validação de metodologias analíticas por CLAE. Tese (Doutorado). Programa de Pós-graduação em Química, Setor de Ciências Exatas, Universidade Federal do Paraná, Curitiba.
Pharmacopéia dos Estados Unidos do Brasil 1926. 1a edição. Companhia Editora Nacional, São Paulo.
Pittier, M.H. e Ernst, E. 1998 - Peppermint oil for irritable bowel syndrome: a critical review and metaanalysis. The American Journal of Gastroenterology, v. 93, n. 7, p. 1131-1135.
Saklani, A. e Kutty, S.K. 2008 - Plant-derived compounds in clinical trials. Drug Discovery Today, v. 13, n. 3-4, p. 161-171.
Soulimani, R.; Younos, C.; Mortier, F. e Derrieu, C. 1994 - The role of stomachal digestion on the pharmacological activity of plant extracts. Canadian Journal of Physiology and Pharmacology, v. 72, n. 12, p. 1532-1536.
Sterk, V.; Büchele, B. e Simmet, T. 2004 - Effect of food intake on the bioavailability of boswellic acids from a herbal preparation in healthy volunteers. Planta Medica, v. 70, n. 12, p. 1155-1160.
Stewart, K.M. e Cole, D. 2005 - The commercial harvest of Devil's claw [Harpagophytum spp.) in southern Africa: the Devil's in the details. Journal of Ethnopharmacology, v. 100, n. 3, p. 225-236.
Universidade de Ribeirão Preto - UNAERP. 2004 - Ambulatório de escaras. Estudo clínico da utilização do barbatimão (Stryphnodendron polyphyllum e Stryphnodendron adstringens) na cicatrizaçâo de úlceras isquêmicas. Ribeirão Preto.
Universidade de Ribeirão Preto - UNAERP. 2006 - Laboratório Experimental Animal. Estudo toxicológico pré-clínico em ratos e coelhos de extrato seco padronizado das cascas de barbatimâo (Stryphnodentron adstringens [Mart.] Coville) isolado e formulado em pomada a 3% em polifenóis totais. Ribeirão Preto.
Vieira, PC.; Mello, J.C.P. e Mello, E.V.S. 1998 - Cicatrizaçâo cutânea após aplicação tópica de Nebacetin e barbatimão em feridas de ratos: estudo clínico e histológico. Encontro Anual de Iniciação Científica, p. 207, Maringá.
Women’s Health Iniciative. 2002 - Whi HRT Update. Disponível em: <http://www.nhlbi.nih.gov/whi/upda-te_ht2002.pdf.> Acesso em: 10 maio 2011.
World Health Organization (WHO). 1999 - WHO Monographs on selected medicinal plants. Geneva: WHO, v.1,p. 188-198.