FITOQUÍMICA / PHYTOCHEMISTRY
Padronização de uma Amostra de Extrato Etanólico de Própolis Verde
Standardization of an Ethanolic Sample of Green Propolis
Resumo
A própolis, uma substância resinosa produzida pelas abelhas melíferas a partir de exsudatos coletados em diferentes partes das plantas, tem sido utilizada há séculos na medicina popular devido as suas propriedades terapêuticas. Este trabalho descreve a padronização de um extrato etanólico de própolis verde, onde foram identificados os compostos químicos por CLAE (Cromatografia líquida de alta eficiência), caracterização fitoquímica por cromatografia em camada delgada (CCD), teor de sólidos solúveis, teor de fenóis e flavonóides totais e atividade antioxidante por 2,2-difenil-1-picrilhidrazil (DPPH). Este extrato etanólico de própolis verde (EEPV) analisado posteriormente será estudado como agente virucida. Os resultados encontrados evidenciam que este EEPV está dentro dos padrões requisitados pelo Ministério da Agricultura, Pecuária e Abastecimento, apresentando 9,35% de teor de sólidos solúveis, atividade antioxidante com CE50% de 9,80 pg/mL, duas classes fitoquímicas, polifenóis e flavonóides, identificadas pela CCD, altos níveis de fenóis e flavonóides totais (12.93 e 6,05% respectivamente), comprovados por CLAE, o qual identificou altas concentrações de ácidos fenólicos (ácido p-cumárico, ácido diprenil-hidroxicinâmico, derivados do ácido cinâmico), os quais são atribuídos as propriedades antibacteriana, antioxidante, antiviral e virucida.
- Palavras chave:
- CLAE.
- caracterização fitoquímica.
- sólidos solúveis.
- fenóis totais.
- flavonóides totais..
Abstract
Propolis, a resinous substance produced by honeybees from exudates collected from different plant parts have been used for centuries in folk medicine due to its therapeutic properties. This work describes the standardization of an ethanol extract of green propolis, where the chemicals were identified by HPLC (high performance liquid chromatography), phytochemical characterization by thin layer chromatography (TLC), soluble solids, phenols and flavonoids and total antioxidant activity 2,2-diphenil-1-picrylhydrazyl (DPPH). The ethanol extract of green propolis (EEPV) will be discussed later studied as a virucidal agent. The results show that this EEPV is within the standards required by the Ministry of Agriculture, Livestock and Supply, with 9.35% of total soluble solids, antioxidant activity with EC50% of 9.80 mg/mL, two classes phytochemicals, polyphenols and flavonoids, identified by TLC, high levels of phenolics and flavonoids (12.93 and 6.05% respectively) as shown by HPLC, which identified high concentrations of phenolic acids (p-coumaric acid, hydroxycinnamic acid diprenyl, acid derivatives cinamics), which are assigned the antibacterial, antioxidant, antiviral and virucidal.
- Keywords:
- HPLC.
- phytochemical characterization.
- soluble solids.
- total phenols.
- total flavonoids..
Introdução
A própolis, uma substância resinosa produzida pelas abelhas melíferas a partir de exsudatos coletados em diferentes partes das plantas, tem sido utilizada há séculos na medicina popular devido as suas propriedades terapêuticas (Fischer et al, 2008). Nos últimos 30 anos, a própolis tem sido objeto de intensos estudos farmacológicos e químicos no controle de enfermidades, através do conhecimento de sua composição e propriedades bioativas (Sforcin, 2007; Lustosa et al, 2008) tais como atividade antibacteriana, anti-inflamatória, antifúngica, antitumoral, imunomoduladora, antioxidantes, antiviral, virucida, entre outros, embora muitos dos seus mecanismos de ação ainda sejam desconhecidos. A atividade e os componentes da própolis variam de acordo com sua origem geográfica (Markham, etal., 1996; Kujumgievetal, 1999).
Quimicamente, a própolis apresenta diversos compostos, sendo que na denominada de “verde” estão presentes vários compostos fenólicos. Recentemente, foi demonstrada a tipificação das amostras de própolis no Brasil, associando-as a atividades biológicas específicas (Ribeiro, Jesus e Marcucci, 2008).
Além de todas as características mencionadas, a própolis é utilizada freqüentemente tanto na área da medicina humana quanto na área veterinária, com obtenção de bons resultados terapêuticos. Com isso não se pode relegar a própolis a uma categoria de modismo terapêutico, tendo em vista que suas virtudes são reconhecidas há séculos, sendo relatadas em muitos trabalhos que demonstram diferentes tipos de atividade biológica e aplicações em diversas terapias (Pereira et al., 2002; Helfenberg, 1908; Mizuno, linuma e Kato, 1987). Trata-se de uma medicina alternativa, chamada de Apiterapia, devido às suas várias propriedades terapêuticas e biológicas, segundo trabalhos científicos do mundo inteiro (Coloni et al., 2007). No entanto, a fim de ser aceito oficialmente pelo Ministério da Agricultura, Pecuária e Abastecimento (MAPA), deve-se estabelecer a identidade e os requisitos mínimos de qualidade do extrato de própolis para que se garanta a segurança e eficácia (Brasil, 2001; Bankova, 2005). Neste sentido o objetivo deste trabalho foi determinar a padronização de um extrato etanólico de própolis verde, que posteriormente será estudado como agente virucida.
Materiais e Métodos
Os experimentos foram desenvolvidos no Laboratório de Produtos Naturais do Programa de Mestrado Profissional em Farmácia da Universidade Bandeirante deSâo Paulo-UNIBAN.
Obtenção do extrato etanólico da própolis verde (EEPV)
O EEPV foi obtido através da mistura de aproximadamente 75 g de própolis bruta triturada fornecida pela Prodapys, com 250 mL de álcool etílico (p.a.) (ou na mesma proporção) em erlenmeyers de 500 mL, estes permaneceram em um shaker orbital a uma agitação de 160 rpm a uma temperatura de 40°C por 18h. Após esse procedimento, a amostra foi armazenada em freezer por 1 a 2 horas, para a redução do teor de gordura no extrato e posteriormente filtrada para a separação da porção insolúvel. A porção insolúvel (retida no filtro) foi seca em uma capela com ventilação, overnight. Junto às porções insolúveis foi adicionado álcool etílico (p.a.) e devolvido ao shaker para uma nova extração. Repetindo o procedimento. O solvente foi evaporado em rotaevaporador a temperatura de 70°C até a obtenção do extrato mole da própolis.
Identificação dos compostos da amostra. Cromatografia líquida de alta eficiência do EEPV.
Uma quantidade de 150 mg do extrato mole foi solubilizada em 5 mL de metanol, 2 mL desta amostra foi filtrada em filtro Millipore (0,20 μιτι) e armazenada em um “vial”, para a análise por cromatografia líquida de alta eficiência (CLAE) utilizando-se o cromatógrafo LaChrom, modelo D-70005. Para determinar a composição química da amostra da própolis por CLAE, empregou-se uma coluna com 18 cadeias de carbono em fase reversa (Lichrochart Lichrospher 100 RP 18, 12,5 x 0,4 cm, diâmetro de partícula de 5pm Merck) e um gradiente linear (fluxo de 1 mL/min.) composto de metanol e água acidificada com 5% de ácido fórmico. O volume injetado foi de 20 μl_. Foi utilizado um detector de rede de diodos na detecção dos picos. O tempo máximo de análise foi de 60 minutos e a detecção foi efetuada em comprimentos de onda de 280 e 340 nm. O programa utilizado para a análise de dados foi o Merck-Hitachi modelo D-7000 (Chromatography Data Station - DAD Manager).
Caracterização fitoquímica do EEPV Cromatografia em camada delgada.
As análises foram realizadas em relação às seguintes substâncias naturais: flavonóides (reação com AICI3), cumarinas (reação com KCl), alcalóides (reagente de Dragendorff), saponinas (anisaldeído), triterpenos (reação de Liebermann-Buchard) (Costa, 1982), heterosídeos cadioativos, polifenóis e taninos. Obteve-se os perfis cromatográficos, em cromatografia de camada delgada em placas de sílica gel 60G, com base de alumínio e indicadorfluorescente.
Para a preparação das amostras, 1 mg do EEPV foi solubilizado em 1 mL de metanol. Os sistemas de eluentes empregados foram selecionados de acordo com o grupo fitoquímico que foi pesquisado. As amostras analisadas foram aplicadas a aproximadamente 1 cm da base inferior da placa, com auxilio de um capilar. Após a aplicação das amostras sobre as placas, as mesmas foram introduzidas nas cubas previamente saturadas, contendo fase móvel adequada, para cada classe fitoquimica. Foram utilizadas cubas de vidro com fundo chato com as paredes laterais internas recobertas com papel filtro (deixando uma abertura para a observação da fase móvel), para facilitar sua saturação com os vapores do solvente. O solvente sobe por capilaridade até que esteja a 2 cm da extremidade superior. Ao ascender, o solvente arrasta os compostos menos adsorvidos na fase estacionária, separando-os dos mais adsorvidos. A linha de chegada da fase móvel foi marcada e a placa foi colocada em local arejado para ocorrer a secagem e posterior revelação. Os eluentes e reveladores utilizados estão descritos na TABELA 1.
| Classe fitoquimica | Eluente | Amostras Analisadas | Agente revelador | |
|---|---|---|---|---|
| Amostra padrão | Amostra avaliada | |||
| Cumarinas | Tolueno e éter saturado com 10% de ácido acético | Extrato de Guaco | EEPV | KOH 10% + luz UV |
| Flavonóides | Acetato de etila, ácido fórmico, ácido acético glacial e água | Extrato de Calêndula | EEPV | AICI3 1% + luz UV |
| Alcalóides | Acetato de etila, metanol e água | Extrato de Jaborandi | EEPV | Reativo de Draggendorf |
| Triterpenos | Hexano e acetato de etila | Óleo Essencial de Citronela | EEPV | Reativo de Liebermann-Buchar |
| Heterosídeos cardioativos | Acetato de etila, metanol e água | Extrato de Espirradeira | EEPV | Reagente de Kedde |
| Saponinas | Clorofórmio, metanol e água | Extrato de Carqueja | EEPV | Anilsadeido + 5 min a 105°C |
| Polifenóis | Hexano e acetato de etila | Extrato desidratado de Própolis Verde | EEPV | K3Fe(CN)6 1% + FeCI3 2% + luz UV |
| Taninos | Tolueno, n-butanol, ácido acético e água. | Extrato de Espinheira Santa | EEPV | K3Fe(CN)6 1% + FeCI3 2% + luz UV |
Teor de sólidos solúveis da própolis verde
Pesou-se um becker de 50 mL e anotou-se o peso. Com auxílio de uma proveta mediu-se 20 mL do extrato e depositou-se no becker e este levado à estufa a 60°C até a secura. O becker foi retirado e resfriou-se o mesmo. Pesou-se e repetiu-se a operação até peso constante. O procedimento foi realizado em triplicata. Para fins de cálculo foi utilizada a fórmula abaixo.
% sólidos solúveis (m/v) = (m1-b)x100/Va
Onde: b = massa do becker.
m1 = massa final do becker com o extrato seco, após secagem.
Va = Volume da alíquota do extrato, a ser seco.
Análises espectrofotométricas Determinação de fenóis totais
Para a quantificação de fenóis totais utilizou-se o método de Folin, utilizando o reagente Folin-Ciocalteau, e a leitura por espectrofotometria. Este método funciona através da quantificação da substância a ser testada, necessária para inibir a oxidação do reagente. Preparou-se uma solução estoque, da seguinte forma, 0,05 g do extrato seco, dissolvido em etanol, transferindo-o para um balão volumétrico de 25 mL e completou-se o volume com água. A partir deste ponto o procedimento foi realizado em triplicata. Transferiu-se uma alíquota de 0,2 mL da solução estoque, para um balão volumétrico de 10 mL, contendo aproximadamente 5 mL de água destilada e adicionou-se o reagente de Folin-Ciocalteu. Agitou-se por alguns segundos e no intervalo de 1 a 8 minutos acrescentou-se 1,2 mL da solução tampão carbonato-tartarato de sódio a 20% (carbonato de sódio). Completou-se o volume do balão volumétrico com água até próximo ao menisco. A solução foi mantida em um banho-maria a 20°C. Após 2 horas, fez-se o ajuste do volume final a 20°C, agitando-se por alguns segundos e fez-se a leitura no espectrofotômetro a 760 nm.
Determinação de flavonóides totais
A quantificação do teor de flavonóides totais foi realizada por espectrofotometria utilizando-se cloreto de alumínio, como reagente de deslocamento. O método espectrofotométrico para quantificar flavonóides totais baseia-se na propriedade do cátion alumínio de formar complexos estáveis com os flavonóides, evitando a interferência de outras substâncias fenólicas.
A partir da solução estoque do procedimento anterior, retirou-se uma alíquota de 0,2 mL desta solução e transferiu-se para um balão volumétrico de 10 mL, contendo aproximadamente 5 mL de metanol. Adicionou-se 0,2 mL de cloreto de alumínio (AlCl3) e completou-se o volume até próximo ao menisco com metanol. Agitou-se a solução e esta foi mantida em banhomaria por 30 minutos a 20°C. Após esse período fez-se o ajuste do volume. A leitura foi feita a 425 nm. As análises foram feitas em triplicatas.
Atividade antioxidante - DPPH
A atividade antioxidante foi avaliada empregando-se o radical DPPH (2,2-difenil-1-picrilhidrazil) em amostras de própolis, realizada através de medidas espectrofotométricas do consumo do radical, na presença de substâncias antioxidantes. A partir do extrato seco da amostra, preparou-se uma solução estoque a 1%, desta solução estoque tomou-se 100 μL e colocou-se em um balão volumétrico de 10 mL e completou-se com etanol. Preparou-se diferentes diluições do extrato de própolis a 0,0002% da seguinte forma, organizou-se 9 tubos enumerados de 0 a 8, adicionando álcool, solução de própolis e DPPH em cada tubo. O tubo de número zero foi o controle, ou seja, apenas DPPH e etanol. Ao adicionar o DPPH no tubo zero, contou-se 1 minuto e adicionou-se o DPPH no segundo tubo e assim sucessivamente até o tubo 8. Agitando os tubos de tempo em tempo. Após 30 minutos da adição de DPPH no primeiro tubo, realizou-se a leitura no espectrofotômetro a 517 nm, em triplicata, sempre obedecendo 1 minuto de intervalo entre cada amostra.
Resultados e Discussão
Cromatografia líquida de alta eficiência do EEPV
Os compostos fenólicos foram quantificados com o uso de padronização interna por meio de cromatografia de fase líquida de alta eficiência. O perfil cromatográfico da amostra está apresentado na FIGURA 1. Nota-se, altas concentrações de ácido p-cumárico, Artepillin C e derivados do ácido cinâmico. Segundo Akao e colaboradores (2003), atividades biológicas extremamente importantes, como por exemplo, atividade virucida de extratos etanólicos desse tipo de própolis podem ser atribuídas principalmente à presença destes ácidos fenólicos.
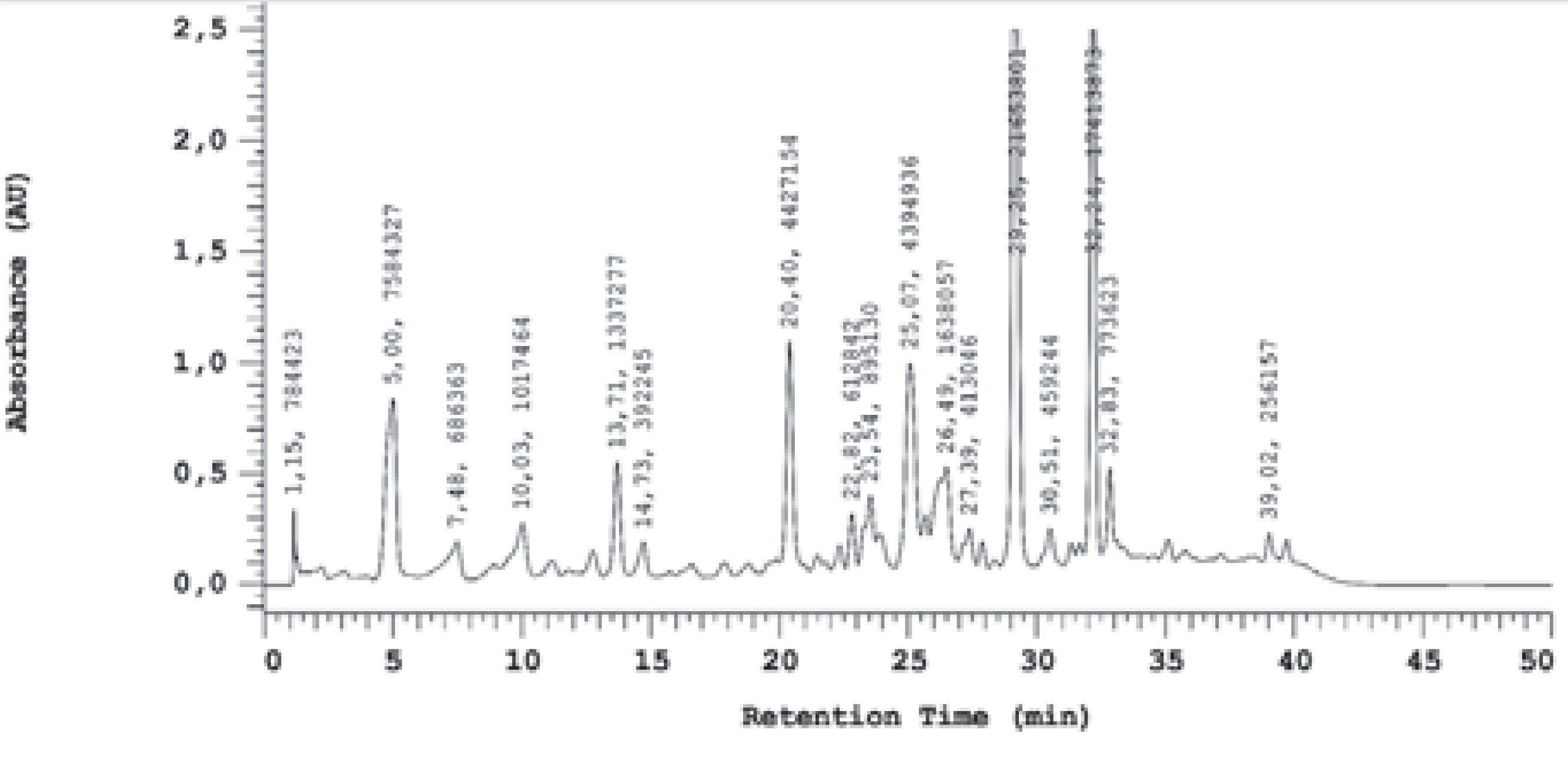
| Nome | Tempo de Retenção | Concentração no EEPV(mg/g) |
|---|---|---|
| Ácido cafeico | 2,88 | 0,87 |
| Ácido p- cumárico | 4,49 | 20,98 |
| Ácido cafeico (derivado 1) | 7,11 | 6,46 |
| Ácido cafeico (derivado 2) | 9,5 | 7,32 |
| Ácido 3,5-diprenil-4-hidroxicinâmico (derivado 1) | 12,73 | 7,61 |
| Ácido cafeico (derivado 3) | 14,12 | 3,27 |
| Ácido 3,5-diprenil-4-hidroxicinâmico (derivado 2) | 17,69 | 1,05 |
| Ácido 3-prenil-4- hidroxicinâmico | 19,13 | 9,92 |
| 2,2-dimetil-6-carboxiete- nil-2H-1-benzopirano | 20,91 | 0,91 |
| Ácido 3,5-diprenil-4-hidroxicinâmico (derivado 3) | 22,2 | 1,54 |
| Ácido 3,5-diprenil-4-hidroxicinâmico (derivado 4) | 25,14 | 5,88 |
| Ácido 3,5-diprenil-4-hidroxicinâmico (derivado 5) | 25,97 | 0,82 |
| Ácido 3,5-diprenil-4-hidroxicinâmico (Artepillin C) | 27,86 | 27,46 |
| Ácido cinâmico (derivado 1) | 30,94 | 11,91 |
| Ácido 6-propenóico-2,2- dimetil-8-prenil-2H-1- benzopirano | 31,52 | 2,47 |
Caracterização fitoquímica do EEPV Cromatografia em camada delgada (CCD).
Ao realizar a leitura das placas, observou-se apenas a presença de duas classes de metabólitos secundários no EEPV avaliado, sendo a classe dos polifenóis e flavonóides. As análises por CCD, baseadas na comparação das manchas reveladas, sendo estas iguais e de mesmo tamanho que das amostras padrão (Sousa et al., 2007a).
Teor de sólidos solúveis da própolis verde
Quanto ao teor de sólidos solúveis, considerando a metodologia utilizada, são aceitáveis valores acima de 7% (Brasil, 2001; Akao et al., 2003). Avaliando-se o resultado obtido para a análise do teor de sólidos solúveis percebe-se que a amostra apresenta 9,35% de teor de sólidos solúveis, atendendo as normas em vigor.
Análises espectrofotométricas Determinação de fenóis e flavonóides totais
A TABELA 2 traz os resultados dos ensaios espectrofotométricos realizados com a própolis para determinação de seus teores de flavonóides e fenóis totais. A média do teor de fenóis totais encontrado na amostra investigada foi de 12,93% (m/m), atendendo ao requisito mínimo do Ministério da Agricultura, que é de 5%. Da mesma forma ocorreu com o teor de flavonóides totais, que na amostra investigada apresentou o valor de 6,048% (m/m), sendo que o requisito mínimo do Ministério da Agricultura é de 0,5% (Brasil, 2001).
| Análise | Teor médio ± Desvio Padrão | Requisito do Ministério |
|---|---|---|
| Fenóis totais | 12,93±1,06 | Mínimo de 5% |
| Flavonóides totais | 6,05 ± 0,61 | Mínimo de 0,5% |
| Atividade antioxidante-DPPH | ||
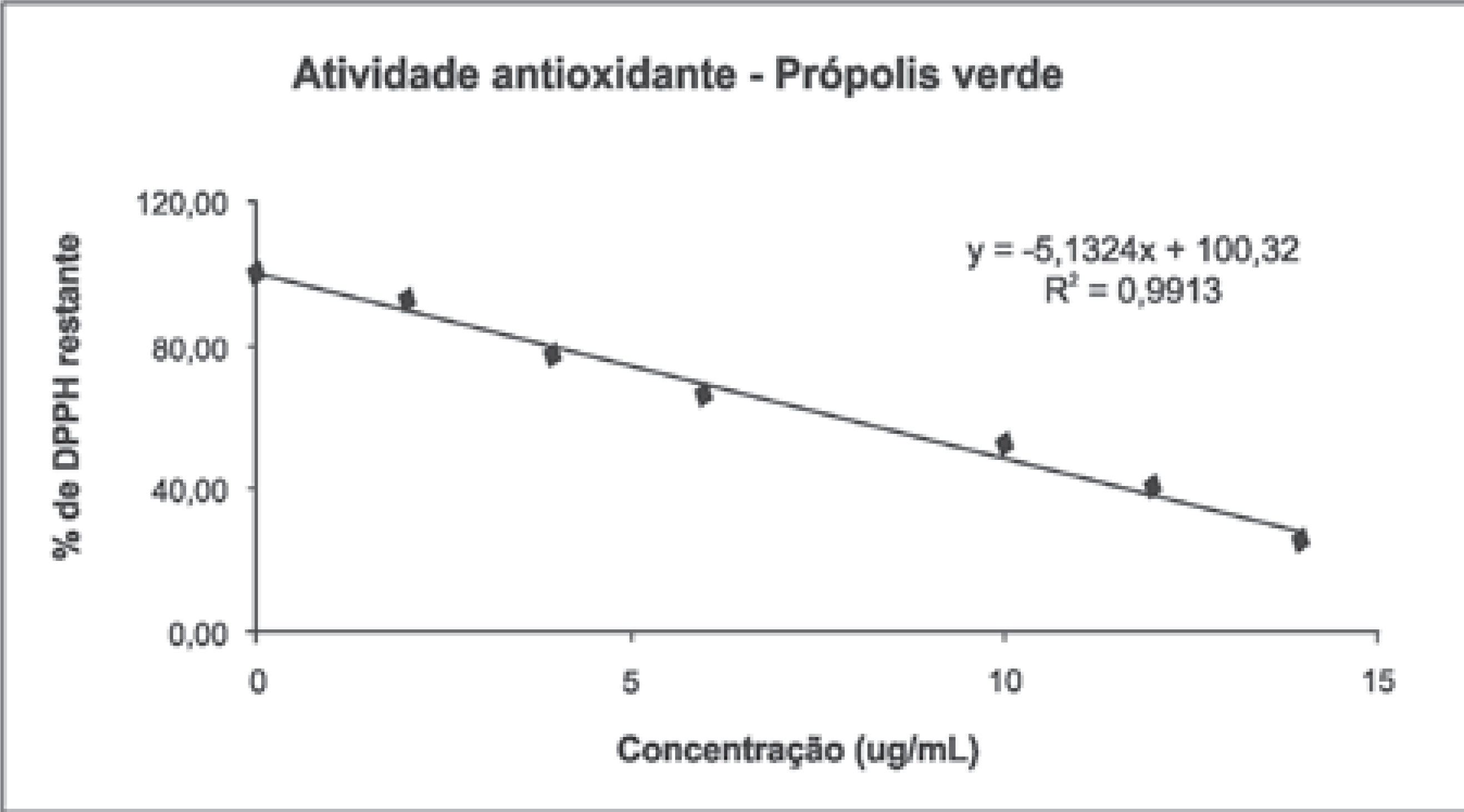
A quantidade de antioxidante necessária para decrescer a concentração inicial de DPPH em 50% é denominada concentração efetiva (CE50). Quanto maior o consumo de DPPH por uma amostra, menor será a sua CE50 e maior a sua atividade antioxidante. Neste experimento a CE50 da amostra do extrato etanólico foi de 9,80 pg/mL, o que indica uma ótima atividade antioxidante. A atividade antioxidante de compostos fenólicos deve-se principalmente às suas propriedades redutoras e estrutura química. Estas características desempenham um papel importante na neutralização ou seqüestro de radicais livres e quelação de metais de transição, agindo tanto na etapa de iniciação como na propagação do processo oxidativo. Os intermediários formados pela ação de antioxidantes fenólicos são relativamente estáveis, devido à ressonância do anel aromático presente na estrutura destas substâncias (Sousa et al., 2007b).
Conclusão
Pode-se concluir que o EEPV avaliado está dentro dos padrões requisitados pelo MAPA, com altos níveis de fenóis e flavonóides totais, o que indica altas concentrações de ácidos fenólicos, os quais são atribuídos as propriedades antibacteriana, antioxidante e antiviral (Volpi e Bergonzini, 2006), por tanto, está apto a ser utilizado para a determinação da atividade virucida a ser pesquisada posteriormente.
Agradecimentos
Somos gratos à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - pelo suporte financeiro; Apis Nativa Produtos Naturais Ltda - Prodapys - Araranguá, SC - Brasil, pelo fornecimento da própolis bruta; Laboratório de Produtos Naturais do Programa de Mestrado Profissional em Farmácia da Universidade Bandeirante de São Paulo - UNIBAN - pelo treinamento prestado.
Referências
Akao, Y.; Maruyama, H.; Matsumoto, K.; Ohguchi, K.; Nishizawa, K.; Sakamoto, T; Araki, Y; Mishima, S.; Nozawa, Y. 2003 - Cell growth inhibitory effect of cinnamic acid derivatives from propolis on human tumor cell lines. Biological & Pharmaceutical Bulletin, v. 26, n. 7, p. 1057-1059.
Bankova, V. 2005 - Chemical diversity of propolis and the problem of standardization. Journal of Ethnopharmacology, v. 100, n.1-2, p.114-117.
Brasil 2001. Ministério da Agricultura. Instrução Normativa nº 3 - ANEXO VI - Regulamento técnico para fixação de identidade e qualidade de própolis. Diário Oficial da República Federativa do Brasil. Brasília, 19 jan. 2001.
Coloni, R.D.; Lui, J.F; Santos, E.; Cavalcante Neto, A.; Zanato, J. A. F. e Silva, L.RG.; Malheiros, E.B.; 2007 - Extrato etanólico de própolis sobre o ganho de peso, parâmetros de carcaça e pH cecal de coelhos em crescimento. Biotemas, v. 20, n. 2, p. 59-64.
Costa, A. 1982. Farmacognosia. 2a edição. Volume 3. Fundação Calouste Grilbenkian, Lisboa.
Fischer, G.; Hübner, S.O.; Vargas, G.D. e Vidor, T. 2008 - Imunomodulação pela própolis. Arquivos do Instituto Biológico, v. 75, n. 2, p. 247-253.
Helfenberg, K.D. 1908. The Analysis of Beeswax und Propolis. Chemiker - Zeitung, cap. 31, n. 987.
Kujumgiev, A.; Tsvetkova, I.; Serkedjieva, Y.; Bankova, V; Christov, R. e Popov, S. J. 1999 - Antibacterial, antifungal and antiviral activity of propolis of different geographic origin. Journal of Ethnopharmacology, v. 64, n.3, p. 235-240.
Lustosa, S.R.; Galindo, A.B.; Nunes, L.C.C., Randau, K.P e Rolim Neto, P.J. 2008 - Própolis: atualizações sobre a química e a farmacologia. Revista Brasileira de Farmacognosia, v. 18, n. 3, p. 447-454.
Markham, K.E.; Mitchel, K. A.; Wilkins, A. L; Daldy, J. A. e Lu, Y. 1996 - HPLC and GC-MS. Identification of the major organic constituents in New Zealand propolis. Phytochemistry, v. 42, p. 205 -211.
Mizuno, M.; linuma, M. e Kato, I.I. 1987 - Useful ingredients and biological activity of propolis. Fragrance Journal, v. 15, n. 2, p. 20-28.
Pereira, A.S.; Seixas, F.R.M.S. e Aquino Neto, F.R. 2002 - Própolis: 100 Anos de Pesquisa e suas Perspectivas Futuras. Química Nova, v. 25, n. 2, p. 321-326.
Ribeiro, F.L.; Jesus, P.T. e Marcucci, M.C. 2010 - Composição química e atividade biológica da própolis tipificada - I Jornada de Iniciação Científica UNIBAN - Disponível em <http://www.uniban.br/pesquisa/ini-ciacao_cientifica/pdf/ciencias_vida/farmacia/composi-cao_tipificada.pdf,> Acesso em: 27 jun. 2010.
Sforcin, J. M. 2007 - Propolis and the immune system: a review. Journal of Ethnopharmacology, v. 113, n.1, p. 1-14.
Sousa, J.P.B.; Furtado, N.A.J.C.; Jorge, R.; Soares, A.E.E. e Bastos, J.K. 2007a - Perfis físico-químico e cromatográfico de amostras de própolis produzidas nas microrregiões de Franca (SP) e Passos (MG), Brasil. Brazilian Journal of Pharmacognosy, v. 17, n.1, p. 85-93.
Sousa C.M.M.; Silva, H.R.; Vieira-Jr., G.M.; Ayres, M.C.C.; Costa, C.L.S., Araújo, D.S.; Cavalcante, L.C.D.; Barros, E.D.; Araújo, P.B.M.; Brandão, M.S. e Chaves, M.H. 2007b - Fenóis totais e atividade antioxidante de cinco plantas medicinais. Química Nova, v. 30, n. 2, p. 351-355.
Volpi, N. e Bergonzini, G. 2006 - Analysis of flavonoids from propolis by on-line HPLC-electrospray mass spectrometry. Journal of Pharmaceutical and Biomedical Analysis, v. 42, n.3, p. 354-361.