Artigo de Pesquisa
Avaliação das atividades de suscetibilidade e sinergismo com o óleo essencial de Laurus nobilis (Lauraceae) e fármacos antimicrobianos contra cepas bacterianas
Evaluation of susceptibility and synergism activities with Laurus nobilis (Lauraceae) essential oil and antimicrobial drugs against bacterial strains
Resumo
Os estudos para o desenvolvimento de novos fármacos não acompanham o mesmo ritmo que cresce a resistência bacteriana. O uso do óleo essencial poderá auxiliar nesse processo, possui uma grande diversidade de compostos aromáticos com características antimicrobianas, podendo ser utilizados de forma sinérgica, para potencializar o efeito do fármaco. O presente trabalho justifica-se pela importância de testar in vitro os óleos essenciais, frente às cepas bacterianas Staphylococcus aureus ATCC 25923, Streptococcus pyogenes ATCC 19615, Pseudomonas aeruginosas ATCC 27853 e a Escherichia coli ATCC 25922, com o intuito de enaltecer a pesquisa de plantas medicinais. Os objetivos da pesquisa consistem em: avaliar a atividade antimicrobiana do óleo essencial de Laurus nobilis L. sobre cepas bacterianas; extrair o óleo essencial; comparar a eficácia do óleo essencial em relação a antibióticos convencionais; testar o efeito inibitório do óleo comercial de Louro, Laurus nobilis L., e o extraído. O teste de suscetibilidade com os óleos essenciais de forma isolada, não apresentou resultado esperado, mas o óleo comercial apresentou uma pequena vantagem contra o óleo extraído, porém o teste de sinergismo realizado com o óleo extraído e os antibióticos revelaram uma efetividade considerável para as bactérias Escherichia coli e Staphylococcus aureus.
- Palavras-chave:
- Óleo essencial.
- Antimicrobiano.
- Sinergismo.
- Plantas medicinais.
- Laurus nobilis L.
Abstract
Studies for the development of new drugs do not keep pace with increasing bacterial resistance. The use of essential oil can help in this process since it has a great diversity of aromatic compounds with antimicrobial characteristics, so they can be used synergistically to enhance the effect of the drug. This paper is justified by the importance of testing in vitro of essential oils already known as the original substance front the strains bacterial, Staphylococcus aureus ATCC 25923, Streptococcus pyogenes ATCC 19615, Pseudomonas aeruginosas ATCC 27853 and Escherichia coli ATCC 25922, to praise the research of medicinal plants. The research objectives: evaluate the activity antimicrobial of the Essential Oil of Laurus nobilis L. on strains bacterial, to extract the essential oil; to compare the effectiveness of using essential oil to conventional antibiotics; test the inhibitory effect of commercial oil of Laurel, Laurus nobilis L., and the extracted one. Susceptibility testing with oils essential in isolated ways did not present an expected result against the bacterial strains used. The commercial oil showed a small advantage against the extracted oil. However, the synergism test made with the extracted oil with antibiotics has shown considerable effectiveness for bacteria Escherichia coli and Staphylococcus aureus.
- Keywords:
- Essential oil.
- Antimicrobial.
- Synergism.
- Medicinal plants.
- Laurus nobilis L.
Introdução
As plantas medicinais possuem uma enorme gama de ativos biológicos, despertando assim o interesse de muitos pesquisadores e da indústria farmacêutica. O Brasil, por possuir uma riquíssima biodiversidade, pode conter princípios ativos e contribuir enormemente para essas pesquisas[1].
A Agência Nacional de Vigilância Sanitária (ANVISA) através da Resolução RDC Nº 19, de 9 de março de 2010, regulamentou o uso caseiro de algumas ervas medicinais, recomenda e populariza este conhecimento tradicional. A resolução também está procurando explicar como as plantas medicinais devem ser usadas para garantir efeitos terapêuticos[2].
O louro possui grandes propriedades medicinais, algumas já conhecidas na medicina popular como: estimulante, antisséptica e sedativa[3].
As cepas bacterianas para a pesquisa foram escolhidas com o intuito de abrangência e também de maior incidência clínica, sendo as Gram-positivas, as bactérias Staphylococcus aureus e a Streptococcus pyogenes, e as bactérias Gram-negativas a Pseudomonas aeruginosas, e a Escherichia coli.
Os objetivos do presente trabalho são: testar o efeito inibitório do óleo essencial comercial e do extraído de Laurus nobilis L.;realizar antibiograma para avaliar o efeito do óleo sobre cepas bacterianas; para comparar a eficácia em relação a antibióticos convencionais; e a verificação de um possível sinergismo entre os fármacos e o óleo essencial.
Material e Método
A pesquisa classificou-se como: experimental, quantitativa e exploratória, onde se abordou a utilização de óleo essencial de Laurus nobilis L. sobre cepas bacterianas, e a quantificação da sua eficiência contra elas, com a expectativa de aprofundar os conhecimentos sobre a ação do óleo.
O trabalho foi realizado nos Laboratórios da Saúde do Centro Universitário do Vale do Iguaçu – Uniguaçu, União da Vitória, Paraná.
Procedimento de pesquisa
As etapas da pequisa foram: A certificação da amostra botânica; obtenção do material botânico, compra de insumos e cepas para a pesquisa; processo de hidrodestilação por método Clevenger; realização do antibiograma, teste de sucetibilidade e de sinergismo e o processamento dos resultados obtidos.
Certificação e obtenção do material botânico
O material botânico foi colhido de uma residência, situada na cidade de Três Barras, no estado de Santa Catarina, localizada no Planalto Norte Catarinense, situada numa altura de 802 metros do nível do mar, sendo suas coordenadas geográficas, latitude 26°07'23.1"S, longitude 50°18'16.0"W.
A certificação da amostra botânica foi realizada pela Prof.ª Mayara Alves Shroder Fontana, corpo docente do Curso de Agronomia do Centro Universitário do Vale do Iguaçu, da cidade de União da Vitória, Paraná, sobre o nº 107/2021.
Método de obtenção/extração de óleo essencial
Procedimento I Folhas Secas
As folhas foram colhidas no mês de agosto, lavadas e postas para secar, durante um período de 7 dias, foram secas a sombra e em temperatura ambiente (~25ºC) para evitar a proliferação de microrganismos, Posteriomente, foi realizada a moagem do material botânico manualmente, para facilitar a hidrodestilação; e utilizados 100g de folhas e 200 mL de água destilada como solvente. As folhas e a água foram armazenadas no balão de vidro de 200 mL e postas para fervura no aparelho Clevenger, num período de 4 horas.
Procedimento II Folhas Frescas
Testou-se na segunda metodologia, a utilização de folhas frescas para a obtenção do óleo essencial, que ocorreu da seguinte forma: as folhas foram colhidas no mês de setembro, lavadas e postas para o escoamento da água para que, no dia seguinte fosse realizada a extração do óleo; as folhas passaram pela moagem do material botânico manualmente; foram utilizados 100 g de folhas e 200 mL de água destilada como solvente; as folhas e a água foram armazenadas no balão de vidro de 200 mL e postas para fervura no aparelho Clevenger, num período de 4 horas.
Após os procedimentos, o óleo foi armazenado em um recipiente de vidro escuro de cor âmbar, devido os óleos essenciais serem fotossensíveis e perderem suas propriedades em contado com a luz exterior. Em seguida, levado ao refrigerador numa temperatura de aproximadamente 4°C, para que suas propriedades fossem preservadas.
Procedimento III Óleo Essencial Comercial
Para a pesquisa, foi adquirido um óleo essencial comercial, onde em sua composição, apresenta: Laurus nobilis, Linalol, Eugenol, Limonene. País de origem: Turquia, a fornecedora: Arte dos Aromas, lote U160, validade 06/2023.
Onde se encontra no status ATIVO, regularizado através do Processo ANVISA no número 25351.442791/2020-44, e autorização nº 2.02.849-4, válido até 20 de maio de 2030.
Cepas bacterianas
As cepas bacterianas para a pesquisa foram escolhidas com o intuito de abrangência, divididas em quatro grupos de bactérias distintas. Foram adquiridas de um Laboratório de Análises Clínicas Dr. Willy Carlos Jung, na cidade de União da Vitória - PR.
As bactérias Gram-positivas, Staphylococcus aureus ATCC 25923 e Streptococcus pyogenes ATCC 19615, as bactérias Gram-negativas Pseudomonas aeruginosas ATCC 27853 e a Escherichia coli ATCC 25922.
Cultura Bacteriana
Os microrganismos foram cultivados em Ágar Macconkey e Ágar Sangue para crecimento das colônias em seus meios seletivos, as bactérias Gram-positivas em Ágar Sangue, e as bactérias Gram-negativas em Ágar Macconkey: As bactérias foram inoculadas nos meios de cultura seletivos com uma alça calibrada de 1µL, pela técnica de semeadura por esgotamento, após a semeadura, foram encaminhadas para uma estufa microbiológica numa temperatura de 37ºC, permaneceram um período de 24 horas, após esse tempo, foram armazenadas em refrigerador em temperatura de 2ºC a 8ºC para preservar as colônias e, posteriomente, prosseguir com o antibiograma.
Antibiograma
As cepas e os meios de cultura foram retiradas do refrigerador 30 minutos antes de execução da técnica, para atingir a temperatura ambiente, com uma alça calibrada de 1 µL, devidamente flambada e resfriada, coletando-se uma colônia de cada bactéria, que foram dissolvidas em tubos de ensaios, com a solução de Cloreto de Sódio ( NaCl 0,9%) até atingirem a escala 0,5 de Mac Farland (1,5 x 108 células), em seguida, com um swab estéril na suspenção bacteriana, foi umidificado e semeado em placa de Ágar Muller Hinton Sangue 5%, em todas as direções, para a formação do tapete bacteriógico, o auxílio de uma pinça flambada e resfriada, anexou-se 5 discos de antibióticos dispersos no ágar, foram incubadas em uma estufa a 37ºC, num período de 24 horas e, posteriormente, foi aferido o diâmetro dos halos, com o auxílio de um paquímetro digital de 150 mm com graduação de 0,01 mm.
Antibióticos e Discos de Antimicrobianos
Os antibióticos são fármacos cujo objetivo é a eliminação dos microrganismos, sem comprometimento para o hospedeiro. Nem todos os antimicrobianos levam a morte dos microrganismos, alguns se restringem a parar mecanismos de reprodução e induzir morte por senescência[4].
Para esta pesquisa foram utilizados os discos de antimicrobianos descritos na TABELA 1. Os discos de antimicrobianos são utilizados para os testes de sensibilidade in vitro, são discos circulares de 6 mm, impregnados com quantidades determinadas de antibióticos[5].
| Antibiótico | Mecanismo de ação |
| Ampicilina | A ampicilina é um antibiótico com efeito bactericida e seu espectro de atividade inclui bactérias gram-positivas e bactérias gram-negativas. A penicilina inibe competitivamente a transpeptidase responsável pela reticulação dos componentes da parede celular. Devido à instabilidade do complexo mucopeptídeo, efeitos osmóticos prejudiciais podem causar a lise do organismo após um determinado período de incubação [6]. |
| Amoxicilina | A amoxicilina é uma aminopenicilina semissintética do grupo beta-lactâmico. Sua ação depende de sua capacidade em atingir e unir-se às proteínas que ligam penicilinas localizadas nas membranas citoplasmáticas bacterianas. Inibe a divisão celular e o crescimento, produz lise e elongação de bactérias sensíveis [7]. |
| Cefalexina | A cefalexina é a cefalosporina de primeira geração, que atua preferencialmente sobre bactérias Gram-positivas e raramente atua sobre bactérias Gram-negativas. É um antibiótico β-lactâmico que inibe a síntese da parede bacteriana ao se ligar a uma ou mais proteínas de ligação. O resultado é a formação de paredes celulares defeituosas com pressão osmótica instável [8]. |
| Ciprofloxacino | A ciprofloxacino tem atividade in vitro contra uma variedade de microrganismos Gram-negativos e Gram-positivos. Essa ação da ciprofloxacino é à inibição da topoisomerase bacteriano tipo II (DNA girase) e topoisomerase IV. É necessário para a replicação, transcrição, reparo e recombinação do DNA bacteriano [9]. |
| Tetraciclina | A tetraciclina é um agente bacteriostático de amplo espectro. Sua função é inibir a síntese de proteínas de bactérias sensíveis e bloquear a combinação de transporte de RNA. Esses microrganismos são os mensageiros do complexo ribossômico 30S. Atua sobre bactérias Gram-positivas e bactérias Gram-negativas [10] . |
| Fonte: autor, 2021. | |
Teste de suscetibilidade e sinergismo
Juntamente com o antibiograma, foi realizado o teste de suscetibilidade dos óleos essenciais, na placa de Ágar Muller Hinton, onde foram semeadas as bactérias e anexados dois discos de papel embebidos com óleo essencial de Laurus nobilis, "C" e "E", comercial e extraído, respectivamente. Com o intuito de verificar a eficácia do óleo essencial isolada, frentes às bactérias.
Para o teste de sinergismo, os discos de antimicrobianos foram encharcados com óleo essencial de Laurus nobilis L.extraído e, logo, em seguida implantados nos meios de cultura Ágar Muller Hinton com as bactérias inoculadas para o teste.
Resultados e Discussão
Extração do óleo essencial
O resultado utilizando o Procedimento I, foi a não obtenção do óleo essencial. Algumas pesquisas utilizaram esse método para realizar a extração do óleo essencial. "Foram secas à sombra, em temperatura ambiente [..]. "O óleo essencial foi extraído por hidrodestilação em aparelho tipo Clevenger, por quatro horas."[3]. Já no outro Procedimento II, utilizando folhas frescas, foi realizada a extração de 50 µL de óleo essencial de Laurus nobilis, de cor ligeiramente amarelada.
Em outras pesquisas, obtiveram o resultado semelhante a segunda metodologia utilizada nesta pesquisa. "O óleo essencial foi obtido das folhas frescas do louro por hidrodestilação usando aparelho tipo Clevenger por 2 horas"[11].
Composição Química
O Laurus nobilis L.apresenta em sua composição fitoquímica: pectinas, taninos, açúcares, ácidos graxos, terpenos, entre os principais (TABELA 2): Geraniol, Linalol, Cineol, Eugenol, Pineno, entre outros compostos aromáticos onde sua concentração varia de acordo com o solo e estação de colheita da folhas[12].
| Estrutura Química | Descrição do Composto |
FIGURA 1: Geraniol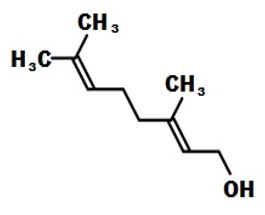 |
Geraniol é encontrado em muitas espécies de flores, são estruturalmente semelhantes ao citronelol, por ter característica hidrofóbica, o geraniol pode se juntar aos lipídios da membrana celular, destruir estruturas e torná-las mais permeáveis. A perda de componentes celulares pode indicar danos graves e irreversíveis à membrana celular das bactérias [13]. |
FIGURA 2: Linalol |
O Linalol é caracterizado por monoterpeno alcoólico terciário acíclico naturalmente encontrado na forma de monoterpeno, existem em dois estereoisômeros, 3R-(-) - Linalol e 3S - (+) - Linalol, tem odores distintos, com diferentes propriedades químicas e efeitos biológicos [14]. |
FIGURA 3: Cineol |
O Cineol é o composto majoritário no óleo essencial de Laurus nobilis L., é um monoterpeno apresentando-se em misturas complexas com outros numerosos terpenos que compõe os óleos essenciais extraídos das folhas. O 1,8-cineol, possui alto índice terapêutico, contém propriedades antissépticas, antibacteriana, antifúngica, agindo contra alguns dos mais importantes patogênicos hospitalares [15]. |
FIGURA 4: Eugenol |
Eugenol faz parte dos compostos aromáticos conhecidos da essência de cravo. Há muitas atividades biológicas entre as quais podemos citar são: antifúngica, antibacteriana, antiparasitária, analgésica, anti-inflamatória, antioxidantes, entre outros [16]. |
FIGURA 5: Pineno |
O Pineno tem dois isômeros estruturais com pequenas variações, α-pineno e β-pineno. Um estudo realizado em 2007, testou a ação antimicrobiana de α e β-pineno, contra bactérias gram-positivas, nas quais os componentes de ambos têm demonstrado uma eliminação total do inóculo das bactérias em um período máximo de 24 horas [17] . |
| Fonte: autor, 2021. | |
Antibiograma
Após o período de encubação, iniciou-se o processo de identificação de sensibilidade, onde se obteve os seguintes resultados mostrados na TABELA 3, onde contém todos os valores dos halos obtidos em todos os testes empregados na pesquisa.
| Teste | Bactérias Fármacos |
E. coli Diam.(mm) | S. aureus Diam.(mm) | P. aeruginosas Diam. (mm) | S. pyogenes Diam. (mm) |
| O. E. | Laurus nobilis L. (extraído) | 7,27 | 7,10 | 0,00 | 0,00 |
| Laurus nobilis L. (comecial) | 11,86 | 10,70 | 7,30 | 0,00 | |
| ANTIBIOGRAMA | Ampilicilina | 0,00 | 16,50 | 0,00 | 0,00 |
| Amoxicilina | 22,73 | 29,70 | 0,00 | 0,00 | |
| Cefalexina | 19,50 | 25,40 | 0,00 | 0,00 | |
| Ciproflaxacino | 38,30 | 26,20 | 34,60 | 0,00 | |
| Tetraciclina | 27,50 | 31,10 | 15,8 | 0,00 | |
| SINERGISMO | Ampilicilina + O.E. | 20,20 | 35,50 | 0,00 | 0,00 |
| Amoxicilina + O.E. | 21,90 | 34,50 | 0,00 | 0,00 | |
| Cefalexina + O.E. | 18,10 | 28,20 | 0,00 | 0,00 | |
| Ciproflaxacino + O.E. | 41,50 | 40,60 | 33,70 | 0,00 | |
| Tetraciclina + O.E. | 30,00 | 34,00 | 14,20 | 0,00 | |
| Fonte: autor, 2021. | |||||
De acordo com os manuais de antibiograma da fabricante Laborclin, os resultados expressados nos halos de inibição do antibiograma, estão de acordo com os padrões esperados nos teste de sensibilidade a antibióticos, para cada microrganismo estudado.
Teste de Suscetibilidade
De acordo com os halos de inibição encontrardos na TABELA 3, a comparação entre os óleos essenciais, observa-se que o óleo comercial apresentou um maior poder de inibição contra a maior parte das bactérias, sendo elas a Escherichia coli (11,86 mm), Staphylococcus aureus (10,70 mm), Pseudomonas aeruginosas (7,30 mm), respectativamente. Já o óleo extraído apresentou valores inferiores, a Escherichia coli (7,27 mm), Staphylococcus aureus (7,10 mm), não sendo eficaz contra a Pseudomonas aeruginosas.
E, ambos os óleos, não foram eficazes como a bactéria Streptococcus pyogenes. Vale ressaltar que, nenhuma das pesquisas anteriores envolvendo Laurus nobilis, foi citado o uso da bactéria Streptococcus pyogenes.
Um estudo feito por Crispima e Lacerda[18], discutiu sobre a atuação do óleo essencial de Melaleuca alternifolia, emostrou que também não foi efetivo contra a Streptococcus pyogenes ATCC19615, não se obteve halo de inibição contra o microrganismo.
Um estudo feito por Fernandez[11], o óleo esencial de Laurus nobilis L. inibiu fortemente a bactéria Gram-negativa Escherichia coli (24,50mm) e teve ação moderada contra a S. aureus (18,9mm) e não foi efetiva contra a bactéria P. aeruginosas.
Comparando esta pesquisa com a feita por Fernandez[11], nota-se que houve um encurtamento nos halos de inibição, isso pode levar a diversos motivos, que vai desde a composição do óleo, volatilidade dos compostos o que torna uma substância não estável, época de colheita das folhas e meios de extração.
Com esses resultados, o óleo essencial de Laurus nobilis L.não é eficaz o suficiente para inibir as cepas bacterianas testadas, em comparação com fármacos sintéticos, que levam a vantagem de serem substâncias de concentrações estáveis.
Teste de Sinergismo
É notavel que, o óleo essencial extraído, utilizado de forma isolada, não é eficiente em inibir os microrganismos. Porém, no teste de sinergismo, potencializou o efeito da maioria dos fármacos utilizados na pesquisa.
Para o microrganismo Staphylococcus aureus, no teste de sinergismo comparando o Antibiograma, apresentou os seguintes resultados: Amoxicilina no Antibiograma apresentou 29,70 mm, no sinergismo aumentou para 35,50 mm; Ampilicilina no Antibiograma de 15,50 mm, passou para 34,50 mm, Cefalexina no Antibiograma de 25,40 foi para 28,20 mm, o Ciplofluxacino no Antibiograma 26,20 mm passou para 40,60 mm, já a Tetraciclina apresentou no antibiograma 31,10 atingiu 34,00 mm.
A interação entre o óleo essencial e os fármacos utilizados, potencializou o efeito de todos os fármacos testados na bactéria Staphylococcus auerus ATCC 25923 (GRÁFICO 1).

Já na Escherichia coli ATCC 25922 (GRÁFICO 2) houve uma inibição pacial na atividade dos fármacos: Amoxicilina no Antibiograma 22,73 mm retraiu para 21,90 mm, Cefalexina no Antibiograma de 19,50 mm baixou para 18,10 mm, não prejudicando a sua eficácia contra as bactérias e um aumento no halo do Ciprofloxacino no Antibiograma 38,30 mm passou para 41,50 mm e Tetraciclina no Antibiograma 27,50 mm passou para 30,00 mm .
Porém, no fármaco Ampilicilina, onde não houve nenhuna inibição no antibiograma, o teste do sinergismo potencializou seu efeito positivamente, passando a inibir com o halo de 20,20 mm, tornando a bactéria novamente sensível com a presença do fármaco combinada com o óleo essencial.

Na bactéria Pseudomonas aeruginosas ATCC 25923 (GRÁFICO 3), houve uma discreta diminuição dos halos dos fármacos Ciprofloxacino no Antibiograma de 34,60 mm retraiu para 33,70 mm e Tetraciclina de 15,80 mm passou para 14,20 mm no sinergismo, os demais fármacos permaneceram ineficazes contra microrganismo.

A Streptococcus pyogenes ATCC 19615 demonstrou-se resistente a todos os testes empregados.
Um estudo feito por Oliveira et al.[1], mostou a interferência de óleos essenciais com antibióticos, onde utilizou-se o óleo essencial de diversas plantas e antibióticos como Ampilicilina e Tetraciclina, também utilizados nesta pesquisa. As bactérias utilizadas no trabalho desses autores, foram Escheirichia coli, Staphylococcus aureus, Pseudomonas aeruginosas, onde obteve-se resultados semelhantes a essa pesquisa.
Nessa pesquisa, mostrou que há in vitro um sinergismo positivo entre o óleo esssencial de Laurus nobilis L.e fármacos bactericidas e bacteriostáticos, ampliando os halos de inibição nas maiorias dos microrganismos, provando que há um sinergismo do óleo essencial de Laurus nobilis L. com os fármacos estudados.
Os antibióticos bactericidas tem como objetivo destruír a membrana celular, ocasionando lise e estravazando o conteúdo citoplasmático. Já os antibióticos bacteriostáticos têm como ação adentrar a membranda e agir na sintese de RNA e DNA bacteriano, fazendo com que o microrganismo pare de replicar e ocorra a morte por senescência.
Um dos fatores que explica a ação antimicrobiana do óleo essencial, são os monoterpenos e sesquiterpenos com anéis aromáticos e grupos fenólicos, capazes de formar ligação de hidrogênio com os sítios ativos de enzimas alvos e, assim fragilizando a membrana plasmática das bactérias e, também, outros compostos presentes nos óleos como álcoois, aldeídos e ésteres que também contribuem com esse efeito [11].
Conclusão
O uso de plantas medicinais no combate a doenças é uma prática milenar onde nos remete desde o início das primeiras civilizações humanas. Com o passar dos anos, os efeitos terapêuticos dessas plantas ganharam o viés científico, que, através de práticas laboratoriais, foram comprovadas ou não suas propriedades medicinais.
O presente estudo mostrou, através da realização do antibiograma, foram testadas as propriedades antimicrobianas do óleo essencial de Laurus nobilis L., de forma isolada no teste de suscetibilidade mostrou, ainda, que, com o passar dos anos comparando com pesquisas passada feita por outros autores, as suas propriedades foram retraídas tanto do óleo essencial extraído como do comercial, apresentaram uma perda da sua efetividade com os compostos aromáticos, não sendo efetivo como os antibióticos sintéticos. Isso é possível por diversos motivos entre os quais já citados principalmente, a extração do óleo, estado vegetativo, condições do solo, entre outros fatores que contribuem diretamente no desempenho antimicrobiano do óleo essencial de Laurus nobilis L.
Em comparação com os fármacos, o óleo essencial de Laurus nobilis, apresenta uma desvantagem por ser uma substância volátil, perdendo facilmente a sua concentração, isso prejudica de forma direta a ação antimicrobiana. Entretanto, de forma sinérgica, o óleo essencial Laurus nobilis L.combinado com fármacos antimicrobianos, ampliou de forma considerável os valores dos halos de inibição dos antibióticos bactericidas e bacteriostáticos.
Com isso, podemos concluir que há necessidade de novos estudos futuros, para que sejam testados em outros microrganismos, outros fármacos, e até mesmo com óleo essencial de outras plantas, para que os efeitos sejam observados. E também realizados testes in vivo, para que sejam observadas a farmacocinética e a farmacodinâmica dos compostos aromáticos nos organismos vivos.
Referências
1. Oliveira RAG et al. Estudo da inferência de óleos essenciais sobre a atividade de alguns antibióticos usados na clínica. Rev Bras Farmacog. 2006; 16(1): 77-82. [https://doi.org/10.1590/S0102-695X2006000100014]. [Acesso em: 06 jul. 2021].
2. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. ANVISA. Resolução RDC nº 10, de 9 de março de 2010. Disponível em: [https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/res0010_09_03_2010.html]. [Acesso em: 21 mar. 2021].
3. Morais LAS, Gonçalves GG, Castanha RF, Scramin S. Caracterização fitoquimica de óleos essenciais de louro proveniente de material nacional e importado. 2010. Hort Bras. 28: S124-S1228. Disponível em: [http://www.abhorticultura.com.br/EventosX/Trabalhos/EV_4/A3050_T5110_Comp.pdf]. [Acesso em: 10 mar. 2021].
4. Murray PR, Rosenthal, Ken S, Pfaller MA. Microbiologia médica – 8ª ed. Rio de Janeiro: Grupo Editorial Nacional. Publicado pelo Selo Editor Guanabara Koogan Ltda., 2020. 848 p. ISBN: 853528575X.
5. Becton Dickinson and Company. Padrão de turvação preparado BBL. Ireland, p. 3. 2010. Disponível em: [https://legacy.bd.com/europe/regulatory/Assets/IFU/US/8808421(0205)_ptc.pdf]. [Acesso em: 26 ago. 2021].
6. EMS, Ampilicilina: comprimidos. Responsável técnico Ronoel Caza de Dio. Hortolândia/SP: EMS S/A, 2014. Disponível em: [https://www.ems.com.br/arquivos/produtos/bulas/bula_ampicilina_10003_1436.pdf]. Acesso em: 10 set. 2021.
7. Germed, Amoxicilina: Pó suspensão oral. Responsável técnico Ronoel Caza de Dio. São Bernardo do Campo, SP: Germed Farmacêutica Ltda., 2021. Disponível em: [https://docs.google.com/viewerng/viewer?url=https://cdn.remediobarato.com/pdf/b5fc5327eb8705dc31425599b796d833.pdf]. Acesso em: 08 set. 2021.
8. EMS, Cefalexina: Comprimidos. Responsável técnico Ronoel Caza de Dio. Hortolândia/SP: EMS S/A, 2016. Disponível em: [https://www.ems.com.br/arquivos/produtos/bulas/bula_cefalexina_10203_1445.pdf]. [Acesso em: 10 set. 2021].
9. Halexistar, Ciprofloxacino: Solução para infusão 2 mg/mL. Responsável técnico Caroline Fagundes do Amaral Lenza. Goiânia, GO: Halexistar, 2019. Disponível em: [https://www.halexistar.com.br/static/arquivos/downloads/ciprofloxacino-bula-profissional-1561816.pdf]. [Acesso em: 03 set. 2021].
10. Donaduzzi P, Tetracliclina: Cápsula de 500 mg. Responsável técnico Dr. Luiz Donaduzzi. Toledo, PR: Prati Donaduzzi, 2012. Disponível em: [https://www.pratidonaduzzi.com.br/produtos/fracionaveis?task=download&file=bula_medicamento&id=477]. [Acesso em: 3 set. 2021].
11. Fernandez CMM. Avaliação da composição química e atividades biológicas do óleo essencial de Laurus nobilis L. (Lauraceae). Cascavel. 2014. 52 f. Dissertação de Mestrado [Curso de Mestrado em Ciências Farmacêuticas] - Universidade Estadual do Oeste do Paraná, Cascavel, 2014. Disponível em: [http://tede.unioeste.br/handle/tede/3826]. [Acesso em: 10 mar. 2021].
12. Lorenzi H, Matos FJA. Plantas Medicinais no Brasil Nativas e Exóticas, 2ª ed. São Paulo: Instituto Plantarum, 2008. Disponível em: [https://www.agencia.cnptia.embrapa.br/gestor/bioma_caatinga/catalogo/REC000gbpasrvf02wx5ok07shnq94etlj3h.html]. [Acesso em: 05 set. 2021].
13. Coutinho H et al. Atividade antimicrobiana in vitro de Geraniol e Cariofileno sobre Staphylococcus aureus. Rev Cub Pl Med. 2015, 20(1): ene. ISSN 1028-4796. Disponível em: [http://revplantasmedicinales.sld.cu/index.php/pla/article/view/128]. [Acesso em: 07 mar. 2021].
14. Rosa MSS et al. Antileishmanial Activity of a Linalool-Rich Essential Oil from Croton cajucara. Antimicrob Agents Chemother. Washington. 2003; 47(6): 1895-1901. Disponível em: [https://doi.org/10.1128/AAC.47.6.1895-1901.2003] [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC155815/] [Acesso em: 05 abr. 2021].
15. Mochi VT. Efeito da temperatura de secagem no rendimento do óleo essencial e teor de 1,8-cineol presente nas folhas de Eucalyptus. Campinas. 2005. 91 f. Tese de Doutorado [em Engenharia Química] - Universidade Estadual de Campinas, UNICAMP, Campinas, SP, Brasil. 2005. Disponível em: [https://bdtd.ibict.br/vufind/Record/CAMP_1bb72277a5983d441801d3ffe6c19c15]. [Acesso em: 07 ago. 2021].
16. Sousa Neto OL. O uso do eugenol como agente antimicrobiano para a agroindústria. Pombal, 2018. 25 f. Dissertação de Mestrado Profissional [Programa de Pós-Graduação em Sistemas Agroindustriais, Centro de Ciências e Tecnologia Agroalimentar] - Universidade Federal de Campina Grande, UFCG, Pombal, PB, Brasil, 2018. Disponível em: [http://dspace.sti.ufcg.edu.br:8080/jspui/handle/riufcg/2330] [Acesso em: 10 ago. 2021].
17. Leite AM et al. Efeito inibitório de eugenol, b-pineno e a-pineno sobre o crescimento de bactérias Gram-positivas potencialmente causadoras de endocardite infecciosa. Rev Bras Cienc Farmac. 2007; 43(1): 121-126. ISSN 1516-9332. Disponível em: [https://www.scielo.br/j/rbcf/a/rcxTZB5M5gxnVyRPvxGQbhB/?lang=en] [Acesso em: 20 ago. 2021].
18. Crispima GJB, Lacerda MCRN. Análise da ação bacteriolítica da Melaleuca alternifólia nas principais bactérias de interesse médico. Anhanguera. 2014. 10 f. Ensaios Cienc Cienc Biol Agrar Saúde. 2014; 18(2): 67-75, Faculdade Anhanguera de Brasília, DF, Brasil. Disponível em: [https://www.redalyc.org/pdf/260/26042164001.pdf]. [Acesso em: 05 set. 2021].