Artigo de Pesquisa
Aspectos anatômicos e da composição do óleo essencial da folha de Triphasia trifolia (Burm. F.) P. Wilson (Rutaceae)
Anatomical aspects and composition of the essential oil from leaf of Triphasia trifolia (Burm. F.) P. Wilson (Rutaceae)
Resumo
Triphasia trifolia (Rutaceae) é uma espécie utilizada na medicina popular. O óleo essencial encontrado nas folhas e frutos possui diversas atividades biológicas. Os objetivos desse estudo foram descrever morfoanatomicamente a folha de T. trifolia, identificando caracteres que pudessem auxiliar na sua morfo-diagnose e avaliar a composição química do óleo essencial extraído por fase sólida, acoplada a CG/MS, das suas folhas. Trata-se de uma espécie subarbustiva, com ramos espinhosos e folhas trifolioladas. A lâmina foliar possui epiderme unisseriada, hipoestomática com estômatos anomocíticos. Há grande quantidade de cristais prismáticos bem evidentes nas células de diversas estruturas da folha. O mesofilo é dorsiventral, onde se observam cavidades secretoras de óleo essencial. O sistema vascular na nervura mediana possui a mesma conformação do pecíolo. A análise do óleo essencial da folha revelou a presença de diversos metabólitos, sendo sabineno e β-pineno os majoritários.
- Palavras-chave:
- Triphasia trifolia.
- Rutaceae.
- Anatomia foliar.
- Óleo essencial.
Abstract
Triphasia trifolia (Rutaceae) is a species used in folk medicine. The essential oil found in leaves and fruits has several biological activities. The objectives of this study were to morphoanatomically describe the leaf of T. trifolia, identifying characters that could help in its morphodiagnosis and addition to evaluating the chemical composition of the essential oil extracted by solid phase, coupled to GC/MS, from its leaves. It is a sub-shrubby species, with thorny branches and trifoliate leaves. The leaf blade has a uniseriate, hypostomatic epidermis with anomocytic stomata. There are a lot of prismatic crystals that are very evident in cells from different structures of the leaf. The mesophyll is dorsiventral, where essential oil secretory cavities are also observed. The vascular system in the midrib has the same shape as the petiole. The analysis of the essential oil of the leaf revealed the presence of several metabolities, being sabinene and β-pinene the major ones.
- Keywords:
- Triphasia trifolia.
- Rutaceae.
- Leaf anatomy.
- Essential oil.
Introdução
A família Rutaceae é constituída por cerca de 158 gêneros e 1849 espécies conhecidas, incluídos os taxa infraespecíficos[1]. Somente no Brasil, ocorrem 194 espécies, sendo 106 endêmicas[2]. Em sua grande maioria, os integrantes desta enorme família possuem uma elevada importância econômica tanto por seus óleos essenciais quanto seus usos no aspecto alimentício, como, por exemplo, o gênero Citrus, onde se encontram diversos representantes amplamente conhecidos como a laranja, tangerina, limão, cidras, toranjas e as limas[3].
A família é caracterizada ainda pela diversidade de metabólitos secundários, incluindo os terpenóides, furocumarinas e alguns alcalóides, que apresentam toxicidade contra insetos e atividade anti-alimentar[4]. Alcaloides furoquinolínicos, derivados do ácido antranílico, são os tipos de alcaloides mais encontrados e com maior variedade estrutural na família Rutaceae[5].
Do ponto de vista morfológico, a família Rutaceae, em geral, é caracterizada por indivíduos que se apresentam na forma de arbusto ou árvores, frequentemente possuem espinhos, com suas folhas em disposição alterna ou quando menos frequentemente oposta, compostas e raramente simples. Possuem inflorescência de maioria cimosa, apresentando uma única flor, frequentemente perfumadas de forma actinomorfa e diclamídea. Suas flores são em sua maioria pentâmeras ou tetrâmeras, diclamídeas, cíclicas e hermafroditas. O androceu é constituído por cerca de 8 a 10 estames, podendo possuir até um número maior (gênero Citrus), livres e soldados entre si, onde formam grupos (Citrus). O ovário das flores desta família se localiza de forma súpera, assente em um disco glandular proeminente, possuindo cerca de 5 carpelos e 5 lóculos[3-6].
Seus frutos são geralmente bacáceos, porém há espécies que possuem os tipos: drupa, cápsula ou folículo. Podem também apresentar formas capsulares ou um tipo específico denominado hesperídio, que é um tipo de fruto indeiscente com um grande desenvolvimento de células papiliformes que formam o endocarpo, tornando-se suculentas e acabam por invadir a loja englobando suas sementes[3].
Muitos membros de sua família são também utilizados na medicina popular, sendo consumidos tanto de forma in natura quanto na forma de chás, banhos, infusões e até na culinária, como, por exemplo, o gênero Ruta (arruda), Zanthoxylum (mamica) e Pilocarpus (jaborandi). Sua distribuição se estende por todo o globo, porém as espécies pertencentes a essa família são mais comuns e mais adaptadas em regiões de climas tropicais e subtropicais. No Brasil, a família está representada por aproximadamente 32 gêneros e acerca de 194 espécies[2-7].
O gênero Triphasia pertencente à subtribo Triphasiinae e, por sua vez, subordinada à tribo Citreae, está representado apenas por três espécies reconhecidas até então, sendo essas: Triphasia brassii (C.T.White) Swingle, originária da Papua Nova Guiné, Triphasia trifolia (Burm.f) P. Wilson, objeto deste trabalho e Triphasia grandifolia Merr, tendo sua origem nas Filipinas. O termo Triphasia tem sua origem no idioma grego, onde "tripha" se traduz como triplo, fazendo uma referência à disposição das folhas da espécie[8].
Triphasia trifolia (Burm.f) P. Wilson (Rutaceae) (FIGURA 1) é nativa da região que compreende a Papuasia (região botânica que compreende as Ilhas Aru, Papua Nova-Guiné e Salomão), Bangladesh e Ilhas Marianas[8]. Frequentemente é utilizada como planta ornamental, uma vez que possui porte arbustivo, e até como cerca viva, já que possui espinhos ao longo de seus ramos. Por se adaptar muito bem em ambientes tropicais foi introduzida em diversos países, tais como: El Salvador, Guiana Francesa, Guatemala, Panamá, República Dominicana, Brasil, entre outros[8].

T. trifolia é um arbusto ramificado extremamente aromático, com suas folhas em tom de verde-escuro, de formato obovado e levemente lanceolado, de pecíolo curto, onde suas flores brancas exalam um odor muito característico dos cítricos, e seus frutos, que quando bem maduros, revela um tom vermelho brilhante[5]. T. trifolia também é utilizada como planta medicinal, sendo utilizada contra gripe, afecções respiratórias ou problemas pulmonares[9], dores intestinais[10], doenças parasitárias[3], até atividade anticolinestérica[11], sendo o grupo químico das cumarinas presentes em muitas espécies da família, a principal fonte destas atividades biológicas.
O uso de plantas medicinais, na grande maioria das vezes, se caracteriza como a única ou principal fonte de uso terapêutico para algumas comunidades ao redor do mundo[12].
A etnobotânica configura-se como a ciência que estuda e analisa as diversas manifestações e ensinamentos populares existentes em relação ao uso e consumo de plantas. É por meio dessas relações que se pode traçar o perfil de uma determinada comunidade e seus hábitos relacionados ao uso de plantas[13]. Cerca de 80 a 90% da população mundial consumiu algum tipo de planta medicinal nas últimas décadas, o que levou ao aumento dos estudos acerca das plantas que possuem um vasto repertório de substâncias químicas que possuem alguma atividade medicinal[14]. Fomentar pesquisas nesta área possibilita a ampliação de trabalhos relacionados ao uso sustentável da biodiversidade local, permeado pela valorização e pelo aproveitamento de todo o conhecimento empírico de povos ancestrais que permanecem vivos até os dias de hoje.
Trabalhos que abordam os aspectos morfológicos e anatômicos, junto com a análise dos constituintes químicos fornecem uma visão muito mais completa, do ponto de vista farmacognóstico, mas podem também auxiliar no esclarecimento de aspectos relacionados à sua adaptação no meio onde vegetam, dependendo da abordagem adotada. Infelizmente, trabalhos dessa natureza são muito escassos entre espécies da família Rutaceae. No Brasil, destacam-se a análise de cítricos, como no estudo anatômico e análise da composição química do óleo essencial de Citrus limettioides[15], no estudo da anatomia foliar, caulinar e análise dos constituintes químicos dos óleos essenciais das folhas e cascas dos frutos de Citrus medica L.[16]. Estudos envolvendo os órãos reprodutivos são ainda mais escassos. Nesse sentido, pode-se mencionar a análise morfo-anatômica e da composição química dos óleos essenciais das folhas, flores e frutos de Hortia oreadica[17] e o estudo morfolóico e anatômico do fruto e da semente em desenvolvimento de Pilocarpus pennatifolius Lem. (Rutaceae)[18].
Nesse contexto, os objetivos desse trabalho foram descrever morfoanatomicamente a folha de T. trifolia, identificando caracteres que possam auxiliar na sua morfo-diagnose, e avaliar a composição química do óleo essencial extraído por fase sólida, acoplada a CG/MS, das suas folhas.
Material e Método
O material botânico foi coletado no horto do Instituto Federal de Educação, Ciência e Tecnologia do Rio de Janeiro (IFRJ), localizado no campus Nilópolis (FIGURA 2), onde ocorrem dois indivíduos que vegetam contíguos no mesmo canteiro, sob as mesmas condições de iluminação solar, temperatura, irrigação e solo. Foi feita uma exsicata da planta estudada que, posteriormente, foi registrada no herbário da UFRJ, sob o número de depósito RFA 45.422.
Cortes histológicos (nervura mediana, bordo e pecíolo)
Para o estudo morfoanatômico, folhas completamente expandidas do quinto ou sexto nó foram coletadas. Posteriormente, fragmentos foliares foram diafanizados com hipoclorito de sódio 5% em estufa aquecida a 60°C durante 10 min, seguida por três lavagens em água destilada, durante 5 min cada, sob aquecimento em estufa a 60°C[19]. Foram obtidos fragmentos da nervura mediana, bordo foliar com região intercostal e pecíolos inteiros.
Inclusão em parafina e microtomia
Os fragmentos botânicos foram submetidos ao processo de parafinização e desparafinização, obedecendo a série etanólica preconizada por Johansen[20] que consiste na desidratação gradual do material botânico onde, de hora em hora, aumentava-se a gradação alcoólica do meio, começando com álcool 70%, depois 80%, 90%, 100% (duas vezes), seguindo com a solução álcool 100% : xilol (3:1), álcool 100% : xilol (1:1), álcool 100% : xilol (1:3) e, finalmente, xilol puro. Após essa etapa, o processo seguiu com a adição de raspas de parafina e a subsequente retirada de pequenas alíquotas da solução de xilol, até que o material ficasse embebido apenas por parafina líquida derretida. Essa etapa transcorreu ao longo de 24 horas em estufa (Brasdonto modelo 5)[20]. Em seguida, o material foi emblocado em formas de alumínio que foram submetidas a choque térmico em banho de gelo, sendo os blocos mantidos refrigerados até o seu uso.
Cortes seriados foram obtidos em um micrótomo rotativo Yadi modelo YD-315 com navalhas de aço descartáveis da marca Leica®. Os cortes, após sua obtenção, foram acondicionados sobre lâmina de vidro contendo adesivo de Haupt.
Desparafinização, coloração, montagem e microscopia
Para a etapa de coloração dos cortes, toda a parafina precisa ser previamente removida. Para tanto, o procedimento se iniciou com imersão das lâminas em xilol puro durante cerca de 10 minutos. Em seguida, a série hidratante seguiu com a solução de xilol + álcool 100% (1:1), xilol + álcool etílico 100% (1:2), álcool etílico 100%, 90%, 80% e 70%, seguido de um banho de água destilada, todos por 5 minutos[20]. Uma vez realizado o processo de desparafinização do material botânico, os cortes foram submetidos a coloração por azul de Astra e safranina aquosa (safrablau), na proporção 9:1[21]. Lâminas permanentes foram montadas usando-se Bálsamo do Canadá sintético como meio de montagem[19]. Lâminas semipermanentes, utilizando glicerina 50% em água, como meio de montagem, também foram confeccionadas, quando necessário[19,20].
A avaliação preliminar da presença de metabólitos na lâmina foliar e no pecíolo de T. trifolia foi realizada por meio da utilização dos reagentes Sudam III (para presença de lipídios e óleos voláteis), lugol (para amido), fluoroglucina (lignina) e pela solução de cloreto férrico a 5% em água (compostos fenólicos)[19]. Para a realização dos testes, foram realizados cortes à mão livre que, em seguida, foram montados entre lâmina e lamínula usando-se os reagentes como meio de montagem. Para realização de eventuais medições foi utilizada régua micrométrica PZO (100 µm), inserida em uma das lentes oculares. Para descrição do material e registro das fotomicrografias foram utilizados o microscópio fotônico binocular Ernst Leitz modelo dfv HM-LUX, Wetzlar, Alemanha e microscópio fotônico trinocular Alltion, modelo ABM 103, (Wuzhou, China), com câmera fotográfica digital acoplada, onde foram obtidos registros fotográficos em diferentes aumentos (40, 64, 100, 160, 400 ou 640X). Para observações referentes à morfologia externa foi utilizado o microscópio estereoscópico binocular Astral Científica, modelo Edutec 505 (Curitiba, Brasil), nos aumentos de 20X e 40X.
Microextração em fase sólida acoplada a cromatografia gasosa e massas (SPME/CGMS)
Para o estudo dos compostos voláteis do óleo essencial das folhas de T. trifolia uma microextração de fase sólida acoplada à cromatografia gasosa (SPME-CG) foi utilizada. Essa técnica permite que, associado à cromatografia gasosa (CG), possa detectar, avaliar e identificar substâncias presentes em seu analito. Para a realização desta extração, a amostra (fragmentos foliares) foi submetida a uma análise pelo aparelho Shimadzu QP-2010, acoplado a cromatografia gasosa com massas (GC-MS), utilizando uma fibra absorvente para captar os compostos voláteis da folha[22].
Resultados e Discussão
Aspectos morfoanatômicos
Trata-se de uma espécie subarbustiva[23], com ramos longos, finos e espinhosos. Os espinhos ocorrem junto às folhas, mais frequentemente na posição estipular (FIGURA 1). As folhas são compostas, trifolioladas, sem estípulas, de filotaxia alterna. O folíolo central é obovado a levemente lanceolado, com margem lisa e ápice emarginado. Os dois folíolos laterais são menores, possuindo as mesmas características.
O pecíolo é curto (FIGURA 3). No pecíolo, a epiderme é unisseriada, de paredes celulósicas, por vezes espessadas e com a presença de tricomas tectores simples e curtos (FIGURA 4). Em meio ao parênquima clorofiliano, podem ocorrer cristais, aleatoriamente distribuídos pelas células parenquimáticas do pecíolo. Esses cristais possuem dimensões, geralmente, menores no pecíolo, em relação à lâmina foliar (FIGURA 5). É amplamente conhecido que essas inclusões citoplasmáticas ficam armazenadas no vacúolo e são constituídas por oxalato de cálcio. Podem ainda ocorrer cavidades secretoras de óleo. Essas cavidades são muito raras no pecíolo, em meio ao parênquima e frequentes na lâmina foliar. O sistema vascular apresenta uma forma de anel descontínuo, interrompido por células parenquimáticas (FIGURA 6). O floema é discreto e as fibras perivasculares pouco perceptíveis.
Tanto no pecíolo quanto na lâmina foliar a cutícula é discreta. Possui aproximadamente 2 μm de espessura, reagindo positivamente ao Sudam III na lâmina foliar. Os tricomas tectores presentes em T. trifolia (FIGURA 4) são muito pouco frequentes nas duas faces da epiderme. Na região do pecíolo, os tricomas, apesar de escassos, ocorrem na face adaxial.
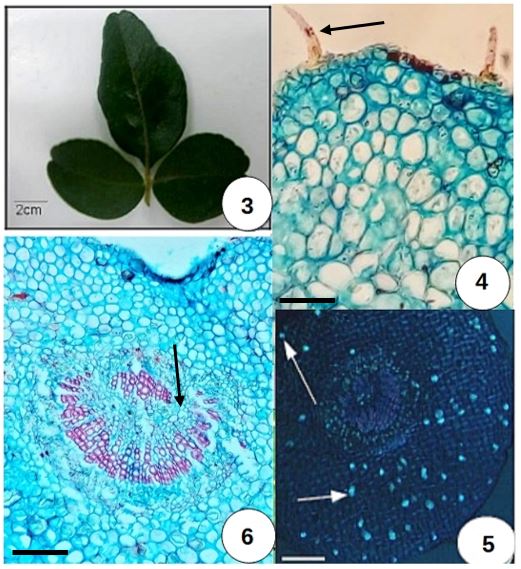
A lâmina foliar possui epiderme unisseriada. Os tricomas tectores unicelulares, apesar de serem bem escassos, podem ser observados na face abaxial. Na região da nervura mediana podem ocorrer com mais frequência, também na face abaxial.
Nas faces adaxial e abaxial, as paredes anticlinais possuem traçado sinuoso (FIGURA 7 e 8). A folha é hipoestomática. Secções paradérmicas e transversais permitiram concluir que os estômatos são anomocíticos, corroborando com o trabalho de Abdullah e colaboradores[24]. Os estômatos são muito pequenos, com aproximadamente 13 μm de largura por 14 μm de comprimento (FIGURA 8).
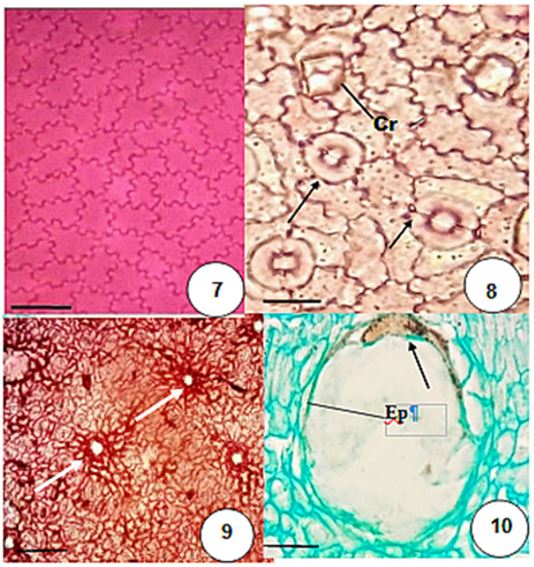
Por vezes, os pólos das células-guarda podem se espessar, inclusive nas cristas estomáticas (FIGURA 8).
A epiderme também é acompanhada pela hipoderme e pelo parênquima paliçádico, que se encontra voltada para a face adaxial (FIGURA 11). Cristais prismáticos são encontrados aleatoriamente, tanto nas células epidérmicas (FIGURA 8 acima) quanto na hipoderme e nas demais células do parênquima fundamental (FIGURA 11 e 13). Esses cristais prismáticos podem ocorrer tanto nas células epidérmicas quanto no nível da hipoderme, sendo possível sua visualização por transparência (FIGURAS 8 e 11). Esses cristais estão aleatoriamente distribuídos nos vacúolos das células parenquimáticas do pecíolo e da lâmina foliar e possuem tamanhos variados. A hipoderme é unisseriada, mais evidente na face adaxial quando comparada à face abaxial. O mesofilo se configura como dorsiventral (FIGURA 11), o que também foi observado outro trabalho em que se estudava a anatomia de T. triphasia cultivada por meio de cultura de tecidos, onde também se observaram algumas cavidades secretoras[24]. Tais características como tipo de estômato anomocítico, bem como a presença de cavidades secretoras são características comuns às folhas de espécies pertencentes a outros gêneros, como Citrus limettioides[15], Hortia oreadica[17] Pilocarpus micropyllus[25]. Em C. medica foram encontrados estômatos paracíticos[16].
As cavidades secretoras são estruturas anatômicas características das espécies da família Rutaceae[9-26]. Em T. trifolia são amplas, com epitélio bem delimitado. Em geral, as células epiteliais são tabulares e estreitas (FIGURA 10), porém, por vezes podem mostrar-se mais proeminentes. Essas células secretam o conteúdo oleífero (FIGURAS 10 e 14) cuja análise será apresentada mais adiante. Podem ocorrer tanto na região intercostal quanto no bordo foliar, além da região da nervura mediana. Pirani e colaboradores [23] descreveram pontuações translúcidas ao longo da folha, característica da presença de glândulas oleíferas predominante em espécies desta família. O teto das cavidades secretoras, bem como cristais prismáticos, pode ser visto em vista frontal (FIGURA 9), já que ocorrem em meio às células do parênquima paliçádico ou lacunoso (FIGURA 11), podendo inclusive, ocupar a região da hipoderme.
O parênquima paliçádico de T. trifolia possui cerca de 1-2 camadas e o lacunoso, aproximadamente 5-6. Os cristais prismáticos, nessa região, concentram-se principalmente nas células do parênquima lacunoso. Este arranjo dorsiventral dos tecidos no mesofilo é típico da grande maioria das famílias de Eudicotiledôneas[26]. Segundo Esau[26], em folhas de Cirtus, como C. limon, o parênquima paliçádico compacto contrasta com o lacunoso que é frouxo, além das cavidades lisígenas que são comuns no mesofilo. Na região da nervura mediana, o sistema vascular possui a mesma conformação do pecíolo (FIGURA 6).
O sistema vascular apresenta frequentemente forma de um anel descontínuo (FIGURAS 12-13), o que também é observado na região do pecíolo. Na lâmina foliar, xilema, floema e fibras perivasculares são mais proeminentes na região da nervura mediana. São esses elementos de vaso que, junto com as fibras, reagem positivamente ao teste com floroglucina. Cristais e cavidades secretoras também podem ocorrer nessa região. A nervação é tipicamente reticulada.
O bordo é preenchido majoritariamente por células parenquimáticas com alguns feixes vasculares que podem alcançar a margem. Podem ser observadas cavidades secretoras e a hipoderme que também acompanha a epiderme nessa porção da lâmina foliar (FIGURA 14). Cristais também podem, eventualmente, ser encontrados. Tal característica é comum em espécies pertencentes de Citrus[15,16,26].
Na nervura mediana de Citrus medica foram encontrados, na lâmina foliar, dois feixes vasculares colaterais côncavos, um central maior e outro de menor calibre, formando um arco aberto, com faixa esclerenquimática externa ao floema, interrompida por células parenquimáticas, bem semelhantes ao que foi descrito em T. trifolia.
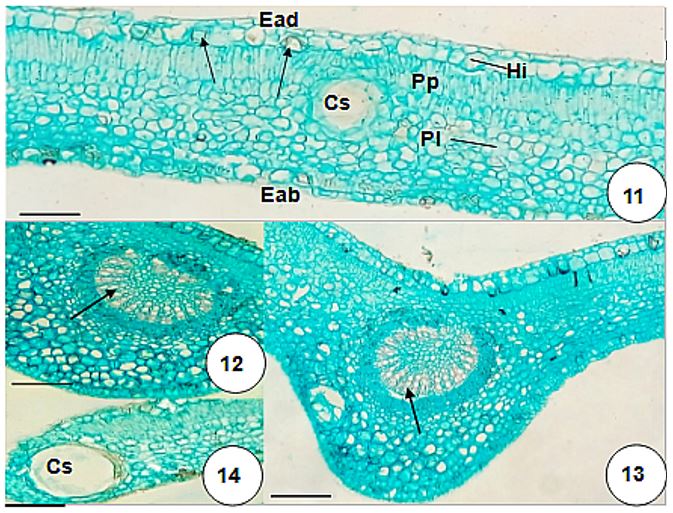
No entanto, no pecíolo, o sistema vascular de C. medica possui forma de arco com as extremidades invaginadas. Já em C. limettioides, a nervura mediana possui feixe com as peco circular e calotas esclerenquimáticas em ambas as faces[15,16]. Tal qual na espécie em estudo, podem ocorrer cristais prismáticos em toda a região da nervura principal.
Aspectos relativos à composição do óleo essencial
Na avaliação prévia dos caracteres organolépticos, era evidente o odor de limão obtido ao fracionar as folhas e os frutos. Esse conteúdo oleífero, contido nas cavidades secretoras, foi analisado.
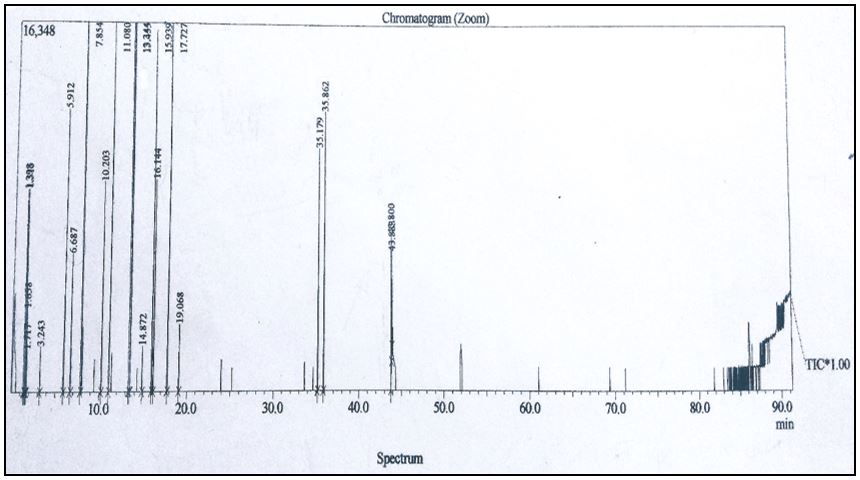
A análise do óleo essencial, após separação dos componentes do óleo volátil por meio cromatografia gasosa, acoplada à espectrometria de massa (CG-MS), foi realizada por meio de microextração em fase sólida. Dessa maneira foi possível identificar a presença de hexanal, n-dodecanal, n-decanal, α-felandreno, sabineno, β-pineno, β-felandreno, ρ-cimeno, limoneno, ɣ-terpineno, mirceno e α-bergamoteno (FIGURA 15), sendo sabineno e β-pineno os metabólitos majoritários (FIGURA 16). Em um trabalho realizado por Santos et al.[11], o extrato aquoso das folhas de T. trifolia foi submetido a cromatografia gasosa acoplada a espectrometria de massas (CG-MS) e revelou, como constituintes majoritários, os metabólitos da classe dos monoterpenos, sendo os mais abundantes o sabineno e o mirceno. Tais diferenças, observadas na composição do óleo essencial, refletem uma resposta dos indivíduos desta espécie às diferentes condições ambientais e regionais em que estão inseridos, o que foi relatado tanto no trabalho de Gurib-Fakim et al.[9] quanto no de Pino et al.[27]. Muitos destes constituintes, encontrados no indivíduo estudado, como β-pineno, mirceno e o limoneno são mencionados na literatura por serem componentes de plantas medicinais produtoras de óleo essencial. Em Citrus medica, por exemplo[16], o limoneno é um dos componentes majoritários nas folhas e o principal componente na "casca" dos frutos, sendo essa espécie popularmente utilizada como anti-inflamatória, anti-histamínica, diurética e calmante.
De modo geral, as cumarinas e terpenos são caracterizados como sendo os marcadores químicos da família Rutaceae, uma vez que são encontrados amplamente nos gêneros que compõem a família[28-29]. Esta família é conhecida por suas características odoríferas, justificado por estruturas anatômicas denominadas cavidades secretoras, onde há o depósito dos óleos essenciais metabolizados pela planta[5].
Conclusão
Considerando os resultados obtidos no presente trabalho, pode-se concluir que a caracterização morfológica e anatômica de suas folhas revelou a presença de caracteres típicos da família Rutaceae, como a presença das cavidades secretoras no pecíolo e, principalmente, na lâmina foliar. O conjunto dos caracteres descritos pode contribuir para a determinação da sua identidade botânica. A composição química de suas folhas e frutos vêm sendo explorada de maneira tímida pela comunidade científica. O odor de limão é justificado pela presença de limoneno. Contudo, recomenda-se uma investigação fitoquímica mais acurada, em relação à presença de cumarinas. Com os resultados obtidos durante esse trabalho, conclui-se também que os constituintes químicos analisados variam de acordo com diversos fatores, onde a planta está inserida, tais como: temperatura, oferta luminosa, hídrica, localização geográfica e o clima.
Agradecimentos
Ao Instituto Federal de Educação, Ciência e Tecnologia do Rio de Janeiro – IFRJ, campus Nilópolis, pela infraestrutura necessária à realização do trabalho e pela verba de pesquisa obtida por meio dos editais PROCIÊNCIA.
Referências
1. The Plant List. Version 1.1. 2013. Disponível em: [http://www.theplantlist.org] [Acesso em: 18 nov. 2021].
2. Pirani JR, Groppo M. Rutaceae. In: Lista de Espécies da Flora do Brasil. Instituto de Pesquisa Jardim Botânico do Rio de Janeiro. Disponível em: [http://reflora.jbrj.gov.br/jabot/floradobrasil/FB212]. [Acesso em: 18 nov. 2021].
3. Joly AB. Botânica: Introdução à Taxonomia Vegetal, 1ª ed.; Companhia Editora Nacional, SP, 1997.
4. Abaul J, Phîlogene E, Bourgeois P, Poupat C, Ahond A, Potier P. Contribution à la Connaissance des Rutacées américaines: Étude des Feuilles de Triphasia trifolia. J Nat Prod. 1994; 57(6): 846-848. [https://doi.org/10.1021/np50108a028].
5. Sackett TE. Furanoquinolines of the Rutaceae and their role in plant-lepidopteran interactions. 2000. Thesis Master of Science. Department of Botany, University of British Columbia, Vancouver, Canada. [file:///C:/Users/PC/Downloads/ubc_2000-0559.pdf].
6. Solereder H. Systematic anatomy of the dicotyledons. Oxford: Claredon Press; 1908.
7. Forzza RC, Leitman PM, Costa A, Carvalho AA, Peixoto AL, Walter BMT et al. Catálogo de plantas e fungos do Brasil. Vols. 1 e 2. Jardim Botânico do Rio de Janeiro. 2010. ISBN 978-85-88742-43-7.
8. IPNI [www.ipni.org]. [Acesso em: 25 set. 2021].
9. Gurib-Fakim A, Sewraj MD, Narod F, Menut C. Aromatic plants of Mauritius: volatile constituents of the essential oils of Coleus aromaticus Benth., Triphasia trifolia (Burm.f.) and Eucalyptus kirtoniana F. Muell. J Essent Oil Res. 1995; 7(2): 215-218. [https://doi.org/10.0.4.56/10412905.1995.9698504].
10. Chopra RN et al . Glossary of Indian medicinal plants. New Delhi: CSI; 1956.
11.Santos RP, Trevisan MTS, Silveira ER, Pessoa ODL, Melo VMM. Composição química e atividade biológica das folhas e frutos de Triphasia trifolia. Quím Nova. 2008; 31(1): 53-58. ISSN 1678-7064. [https://doi.org/10.1590/S0100-40422008000100011]. [Acesso em: 10 Out. 2021].
12. Maciel MAM, Pinto AC, Veiga VF, Grynberg NF, Echevarria A. Plantas medicinais: a necessidade de estudos multidisciplinares. Quím Nova. 2002; 25(3): 429-438. ISSN 1678-7064. [https://doi.org/10.1590/S0100-40422002000300016]. [Acesso em: 10 Out. 2021].
13. Martins AG, Rosário DL, Barros MN, Jardim MAG. Levantamento etnobotânico de plantas medicinais, alimentares e tóxicas da Ilha do Combu, Município de Belém, Estado do Pará, Brasil. Rev Bras Farmacog. João Pessoa. 2005; 86(1): 21-30. [https://repositorio.museu-goeldi.br/handle/mgoeldi/184].
14. Iniyavan M, Sangeetha D, Saravanan S, Parimelazhagan T. Evaluation of antioxidant and pharmacological properties of Psychotria nilgiriensis Deb & Gang. Food Sci Biotechnol. 2012; 21: 1421–1431. [https://doi.org/10.1007/s10068-012-0187-x].
15. Lopes LTA, Paula JR, Tresvenzol LMF, Bara MT, Fiuza TS. Estudo anatômico e análise da composição química do óleo essencial da Citrus limettioides Tanaka. 1-15. [http://www.sbpcnet.org.br/livro/63ra/conpeex/pibic/trabalhos/LARISSA_.PDF]. [Acesso em: 14 mar. 2022].
16. Santos DL, Pereira TCL, Ferreira HD, Tresvenzol LMF, Ferri PH, Paula JR et al. Estudo da anatomia foliar e caulinar e análise dos constituintes químicos dos óleos essenciais das folhas e cascas dos frutos de Citrus medica L. Eletronic J Pharm. 2016; 13(3): 229-247. [Acesso em: 14 mar. 2022].
17. Santos DL, Ferreira HD, Paula JR, Sá S, Ferri PH, Fiuza TS. Estudo morfo-anatômico de Hortia oreadica e análise da composição química dos óleos essenciais das folhas, flores e frutos. Fronteiras: J Social Technol Environ Sci. 2020; 9(2): 328-347. [Acesso em: 14 mar. 2022]. [http://dx.doi.org/10.21664/2238-8869.2020v9i2.p328-347].
18. Souza A, Mourão KSM, Souza LA. Morfologia e anatomia do fruto e da semente em desenvolvimento de Pilocarpus pennatifolius Lem. (Rutaceae). Rev Bras Bot. 2005; 28(4): 745-754. [Acesso em: 14 mar. 2022].
19. Kraus JE, Arduin M. Manual básico de métodos em morfologia vegetal. Seropédica/RJ. Editora Universidade Rural; 1997.
20. Johansen DA. Plant microtechnique. New York: McGrawHill Book; 1940.
21. Bukatsch F. Azul de Astra e Safranina. In: Kraus J, Arduin M. (Eds.). Manual Básico de Métodos em Morfologia Vegetal. Edur, Seropédica, Rio de Janeiro, p. 26. 1972.
22 Tholl D, Boland W, Hansel A, Loreto F, Roese U, Schnitzler JP. Practical approaches to plant volatile analysis. Plant J Cell Molec Biol. 2006; 45: 540-60. [https://doi.org/10.0.4.87/j.1365-313X.2005.02612.x].
23. Pirani JR. (coord.). Rutaceae In: Wanderley MGL, Shepherd GJ, Giulietti MAM, Bittrich TS, Kameyama VC. (eds.). Flora Fanerogâmica do Estado de São Paulo. Instituto de Botânica, São Paulo. 2002; 2: 281-308.
24. Abdullah S, Taha RM, Hasbullah NA, Mohamed N, Elias H, Haron NW. Tissue Culture, Anatomical and morphological studies of Triphasia trifolia (Burm.f.) P. Wilson. Acta Horticulturae. 2008; 111-118.. [http://dx.doi.org/10.17660/ActaHortic.2013.975.11]. [cited 2021 Oct 1]
25. Oliveira F. Akisue G. Akisue MK. Farmacognosia. Ed. Atheneu, São Paulo/ Rio de Janeiro, 412 p. 1991.
26. Esau K. Anatomia das plantas com sementes. São Paulo, Edgard Blücher, 1974, 1976. reimpressão. 293 p. Ilust.
27. Pino JÁ, Marbot R, Fuentes V. Aromatic plants from Western Cuba. VI Composition of the Leaf Oils of Murraya exotica L., Amyris balsamifera L., Severinia buxifolia (Poir.) Ten. and Triphasia trifolia (Burm. f.) P. Wilson. J Essential Oil Res. 2006; 18(1): 24-28. [http://dx.doi.org/10.1080/10412905.2006.9699376].
28. Campelo LML, Sá CG, Feitosa CM, Sousa GF, Freitas RM. Constituintes químicos e estudos toxicológicos do óleo essencial extraído das folhas de Citrus limon Burn. (Rutaceae). Rev Bras Pl Med. 2013; 15(4 suppl. 1): 708-716. [Acesso em: 10 Out. 2021]. [https://doi.org/10.1590/S1516-05722013000500011].
29. Barrera CAC, Parra J, Súarez LEC. Caracterización quimica del aceite esencial e identificación preliminar de metabolitos secundários de la especie Raputia heptaphylla (Rutaceae). Rev Elem. 2014; 4(4): 31-39. e-ISSN 2248-5252. [https://dialnet.unirioja.es/servlet/articulo?codigo=5085372].