Revisão
Exploração da biodiversidade brasileira como fonte de insumos farmacêuticos ativos vegetais (IFAVs): desafios da indústria farmacêutica nacional
Exploitation of brazilian biodiversity as a source of active plant pharmaceutical ingredients (APPIs): challenges for the national pharmaceutical industry
Resumo
Embora o Brasil seja um país megabiodiverso, a sua exploração em prol do desenvolvimento de medicamentos ainda é baixa. Nesse contexto, o objetivo desse trabalho foi apresentar e analisar os principais desafios da indústria farmacêutica nacional acerca da exploração consciente da biodiversidade nativa como fonte de insumos ativos farmacêuticos vegetais (IFAVs). Foi realizada uma descrição narrativa com dados coletados nas principais bases de dados e em documentos oficiais até outubro de 2021. Os resultados demonstraram que os 341 fitoterápicos registrados na ANVISA, compreendem 88 espécies vegetais, destas, apenas 20% nativas e que houve perda do conhecimento científico-biológico acerca das espécies nativas em virtude de sucessivos ciclos econômicos e que a indústria farmacêutica brasileira, caracterizada pela produção de medicamentos, importação de IFAs e baixos investimentos em PD&I, necessita modificar esse perfil. Com base nos trabalhos analisados foi possível concluir que o Brasil deve assumir a produção de IFAs e superar a defasagem em investimentos e inovação nesta área e, que o país possui potencial para receber investimentos para a produção de IFAVs com a condição de promover políticas que favoreçam a inovação, inserir tecnologias verdes, proteger a propriedade intelectual dos inventores e garantir segurança jurídica aos investidores e/ou pesquisadores.
- Palavras-chave:
- Biodiversidade.
- Inovação.
- Indústria farmacêutica.
- Insumos farmacêuticos.
- Ativos vegetais.
Abstract
Although Brazil is a megabiodiverse country, its exploitation in favor of drug development is still low. The objective of this work is to present and analyze the main challenges of the national pharmaceutical industry regarding the conscious exploitation of native biodiversity as a source of active pharmaceutical plant ingredients (APPI). A narrative description was conducted with data collected in the main databases and in official documents until October 2021. The results showed that the 341 herbal medicines registered at ANVISA, comprise 88 plant species, only 20% are native and that there was a loss of scientific-biological knowledge about the native species due to successive economic cycles and that the Brazilian pharmaceutical industry, characterized by the production of medicines, import of APIs and low investments in RD&I, needs to change this profile. Based on the analyzed works, it is possible to conclude that Brazil must assume the production of APIs and overcome the lag in investments and innovation in this area, and that the country has the potential to receive investments for the production of IFAVs on condition of promoting policies that favor innovation, inserting green technologies, protecting the intellectual property of inventors and guaranteeing legal certainty for investors and/or researchers.
- Keywords:
- Biodiversity.
- Innovation.
- Pharmaceutic industry.
- Pharmaceutical ingredients.
- Plant actives.
Introdução
A biodiversidade é conceituada como a variabilidade genética entre diferentes formas de vida incluindo espécies de origens e ecossistemas distintos[1]. O potencial da biodiversidade em fornecer compostos ativos, estruturas base para o desenvolvimento de insumos farmacêuticos ativos (IFAs) é enorme. Esse potencial pode ser exemplificado pelo fato que de 1981 até 2019 cerca de 25% dos fármacos aprovados para uso humano foram obtidos de fontes naturais, com ou sem modificações[2].
Apesar do uso terapêutico das plantas medicinais ser tão antigo quanto o surgimento das primeiras civilizações, o advento da medicina moderna acabou provocando um decaimento na sua utilização para fins de saúde e consequente desqualificação do conhecimento popular, principalmente devido a interesses mercantilistas[3]. Esse desinteresse refletiu na publicação das três primeiras farmacopeias brasileiras com o número de monografias sobre plantas medicinais reduzindo de 42% na primeira (1926)[4], para apenas 5% na terceira (1977)[5]. Após esse período, houve um interesse renovado em espécies vegetais, muito provavelmente devido as recomendações da Organização Mundial da Saúde (Conferência de Alma-Ata, 1978)[6], o que culminou em 17% de monografias de plantas medicinais na quarta edição (1994)[7] e um volume exclusivo sobre essas espécies na edição mais atual (2019) que contém 149 monografias[8].
O Brasil é o maior país da América do Sul e possui a maior biodiversidade do mundo, cerca de 20%. São mais de 116.000 espécies de animais e mais de 200.000 espécies vegetais espalhadas por seis biomas terrestres (Pampa, Mata Atlântica, Cerrado, Pantanal, Caatinga e Amazônia) e três grandes ecossistemas marinhos[9]. Apesar da extensa biodiversidade no território brasileiro, a sua exploração em prol do desenvolvimento de medicamentos ainda é baixa, visto que os processos inovativos e tecnológicos em conjunto com o baixo investimento na área, são insuficientes. Este fato pode ser observado pelo baixo número de medicamentos fitoterápicos advindos da biodiversidade nativa registrados em comparação com outros países. Cerca de 70% dos fitoterápicos encontrados no mercado farmacêutico nacional contém espécies vegetais não nativas[10]. Ainda, esses medicamentos representam apenas 5% do mercado farmacêutico brasileiro[11]. Apesar da biodiversidade brasileira ser considerada uma fonte rica de substâncias biologicamente ativas para o emprego como potenciais fármacos, o interesse na exploração dessa biodiversidade é quase que exclusivo de empresas internacionais[12].
Situados em um cenário onde mudanças econômicas em direção a bioeconomia, se fazem necessárias, programas de pesquisa em preservação e políticas públicas são de extrema importância[13]. Nesse sentido, insere-se o conceito de bioeconomia como a produção de recursos biológicos renováveis e a conversão destes e seus subprodutos em produtos de valor agregado como alimentos, rações, medicamentos (à partir do acesso ao patrimônio genético, a biodiversidade) e bioenergia[14].
O panorama da fitoterapia no Brasil ganhou força com a publicação da Política Nacional de Plantas Medicinais e Fitoterápicos (PNFPM)[15] e a Política Nacional de Práticas Integrativas e Complementares (PNPIC), em 2006, esta última atualizada em 2015[16]. Ainda, o marco regulatório da biodiversidade[17] veio para minimizar os riscos da exploração não controlada da biodiversidade, regulamentando acesso ao patrimônio genético, proteção e acesso aos conhecimentos tradicionais associados. As legislações sanitárias, por sua vez, foram atualizadas trazendo conceitos internacionalmente harmonizados de controle de qualidade, segurança e eficácia[18].
Apesar dos avanços, ainda há um longo caminho a ser percorrido no sentido da promoção do uso responsável da biodiversidade pela indústria farmacêutica. Dado o enorme potencial da exploração da biodiversidade em prol da pesquisa, desenvolvimento, inovação e produção de medicamentos ainda existem muitas lacunas a serem preenchidas apesar dos avanços observados nos últimos anos. Dessa forma, o objetivo deste trabalho foi apresentar e analisar os principais desafios da indústria farmacêutica nacional acerca da exploração consciente da biodiversidade nativa como fonte de IFAVs tanto para a produção de medicamentos fitoterápicos quanto para o descobrimento de novos fármacos.
Material e Métodos
A proposta deste trabalho foi redigir uma descrição narrativa acerca dos principais desafios a serem enfrentados pela indústria farmacêutica brasileira no que diz respeito a exploração da biodiversidade como fonte de IFAVs. O levantamento dos dados foi realizado de abril até outubro de 2021 utilizando cinco bases de dados disponíveis: Scopus, Pubmed, Web of Science, Science Direct e SciELO. Os documentos (leis, resoluções, políticas públicas específicas e afins) e sites oficiais também foram consultados para a coleta de dados. As teses de doutorado e dissertações de mestrado sobre o tema foram incluídas através do catálogo de teses de dissertações da CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior). Para realizar a busca dos artigos na literatura científica, foram utilizados os descritores: "medicinal plants", "innovation", "patents", "intellectual property", "herbal medicine", "brazilian biodiversity", "phytotherapy", "brazilian pharmaceutic market", "bioeconomy" em inglês e português. Os artigos que não consideraram o cenário farmacêutico brasileiro acerca da produção de IFAVs a partir da biodiversidade foram automaticamente excluídos. É importante ressaltar que os dados relativos à pesquisa de fitoterápicos registrados na ANVISA foram obtidos através de busca direta no website.
Resultados e Discussão
Cenário atual
Em 2021 havia 341 medicamentos fitoterápicos registrados na Agência Nacional de Vigilância Sanitária (ANVISA), destes 314 fitoterápicos simples (apenas uma espécie vegetal) e 27 compostos (mais de uma espécie vegetal). Ao total, 88 espécies vegetais distintas são utilizadas na produção destes medicamentos, sendo aproximadamente 20% espécies nativas do Brasil.
Em relação a IFAVs isolados da biodiversidade brasileira podemos citar alguns casos de sucesso como o captopril, desenvolvido a partir de um peptídeo isolado do veneno da Bothrops jararaca (jararaca); a naftoquinona, lapachol, isolada pela primeira vez de Handroanthus impetiginosus (Mart ex DC.) (ipê-roxo), utilizado no século 19 para tratar casos de malária, que serviu de protótipo para a síntese do fármaco antimalárico atovaquona[19].
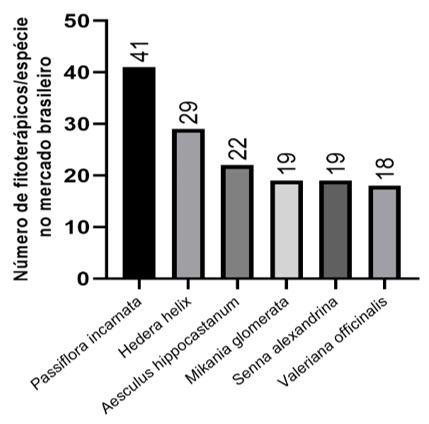
As espécies predominantes nos fitoterápicos inseridos no mercado brasileiro estão representadas na FIGURA 1, sendo destas apenas Mikania glomerata Spreng. (guaco), nativa do país.
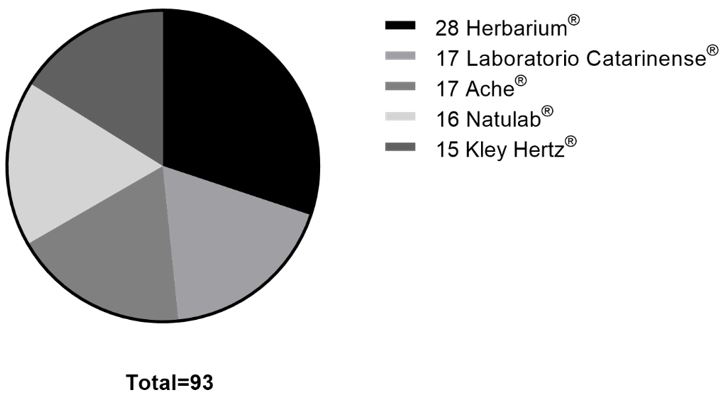
O Brasil possui aproximadamente 441 laboratórios farmacêuticos regularizados (20,18% de origem internacional e 79,82% de origem nacional), 68 são produtores de fitoterápicos, a maioria, localizados nas regiões sul-sudeste[20]. Destaca-se a empresa Herbarium® com uma fatia de cerca de 8% do mercado de medicamentos fitoterápicos (FIGURA 2). Surpreendentemente não há laboratórios farmacêuticos na região Norte apesar dessa área ser uma das mais ricas em biodiversidade, com a presença da floresta amazônica. Os dados demonstraram o potencial deste mercado a ser explorado. Com o intuito de estimular o uso de matérias-primas advindas da região norte, foram definidas as zonas francas verdes, que garantem benefícios fiscais aquelas indústrias que se instalem e utilizem matérias-primas dos estados do Norte (Amapá, Amazonas, Acre e Rondônia) a fim de estimular o desenvolvimento e produção de medicamentos fitoterápicos nesses estados[21].
Desafios a serem enfrentados pela Indústria Farmacêutica Nacional
Um país megabiodiverso que não investe nos seus recursos naturais
O Brasil detém a maior biodiversidade do planeta com cerca de 20% das espécies vivas ocorrendo no seu território. Em extensão territorial o país possui 8.516 milhões de km² que abarca seis biomas terrestres: Amazônia, Caatinga, Cerrado, Mata Atlântica, Pantanal e Pampa[22].
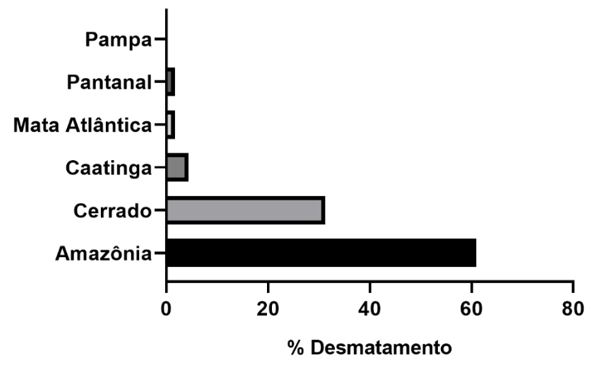
Apesar da rica biodiversidade, a vegetação nativa tem sofrido um processo intenso e contínuo de destruição resultante de diferentes ciclos econômicos[23] (FIGURA 3). O interesse econômico nos recursos naturais brasileiros data do período da colonização (Caesalpinia echinata Lam. (Fabaceae), pau-brasil. A área costeira brasileira começou a ser explorada desde seu descobrimento e, atualmente cerca de 72% da população vive nessa região que concentra 80% do Produto Interno Bruto (PIB) Nacional. Com essa ocupação a área costeira, que abriga o bioma Mata Atlântica, hoje possui apenas 12,4% da sua área original com vegetação[24].
Os biomas Cerrado e Mata Atlântica são considerados pontos críticos devido a acelerada perda da diversidade biológica em função da urbanização, agricultura e estilo de vida. A vegetação sofre o impacto da expansão da pecuária, produção de etanol, monoculturas como a da soja (Glycine max L. Merr.) e a construção de grandes hidroelétricas[24].
Os biomas citados nos parágrafos anteriores possuem várias espécies que estão ameaçadas de extinção e, dessa forma, o conhecimento científico-biológico corre o risco de ser perdido visto que apenas cerca de 0,5% das 300.000 espécies são reconhecidas e catalogadas[26]. Além disso, considerando a perda do conhecimento tradicional associado ao uso dessas espécies, estruturas únicas que poderiam ser potenciais IFAVs, fitofármacos ou componentes de medicamentos fitoterápicos, podem ser extintas. Essa situação necessita ser revertida e através de pesquisas interdisciplinares envolvendo, químicos, biólogos, farmacêuticos, botânicos e farmacologistas dedicados a exploração racional e conservação da biodiversidade brasileira[27].
A produção industrial local de fitoprodutos, se existente, poderá distribuir benefícios além dos royalties, estimulando assim o desenvolvimento da biotecnologia, melhoramento genético e propagação em regiões onde o impacto da produção industrial e do meio ambiente possa ser direcionado para a proteção do meio ambiente. Esses benefícios possuem potencial de serem repassados para parceiros locais por meio de programas nacionais, estimulando assim a agricultura local. É necessário direcionar a cadeia produtiva com o intuito de facilitar a articulação ampla dos interesses e prioridades nacional, regional e local para garantir as condições de competitividade, sobrevivência e inovação nesse processo. Não se pode deixar de mencionar que a construção de condições para o desenvolvimento de fitoprodutos a partir dos biomas brasileiros poderá ser benéfica, visto que os conhecimentos científicos e tácito se somarão a cultura e ao uso tradicional[28].
Especificamente focando em IFAVs, o Brasil apresenta duas características fundamentais para o desenvolvimento desses produtos a partir da biodiversidade vegetal: uma biodiversidade enorme e o uso tradicional de plantas medicinais difundido. O país conta com mais de 305 etnias indígenas que se comunicam em cerca de 270 idiomas diferentes, além de diversas comunidades tradicionais e locais (quilombolas, caiçaras, seringueiros, entre outros) e agricultores familiares que possuem conhecimentos tradicionais únicos associados a biodiversidade[29].
No entanto, o número de fármacos derivados de espécies vegetais da biodiversidade brasileira e da medicina tradicional do país é modesto. Algumas hipóteses podem ser pontuadas sobre os motivos pelos quais existem poucos produtos da biodiversidade brasileira no mercado, dentre elas: (i) grande oligopolização do setor de medicamentos e fármacos no plano nacional e internacional, que acaba por inibir investimentos de laboratórios de menor porte; (ii) alto custo de processos de PD&I e legislação da área que acaba levando a uma grande incerteza de retorno dos investimentos realizados; (iii) ausência de uma política industrial e tecnológica efetiva para estímulo de pesquisas e exploração econômica da biodiversidade brasileira como fonte de IFAs; (iv) falta de legislações especificas de direito de propriedade industrial, permitindo um maior investimento dos laboratórios brasileiros na produção de medicamentos a partir da biodiversidade[30].
O Brasil possui uma base científica sólida para a pesquisa em plantas medicinais, resultante de aproximadamente 70 anos de fomentos governamentais em universidades públicas e institutos de pesquisa. Esse fato resultou em um número grande de artigos científicos de qualidade na literatura científica, porém parece existir uma correlação negativa entre número de artigos científicos com foco na biodiversidade brasileira e número de produtos inovadores no mercado[31]. As publicações científicas podem ser consideradas importantes indicadores de conhecimento da área e a falta de estudos sobre plantas medicinais e serviços de fitoterapia no Brasil constitui um dos principais desafios para a implementação definitiva da fitoterapia no Brasil. Apesar de várias iniciativas de sucesso, há poucas informações sobre plantas genuinamente oriundas da biodiversidade brasileira acerca do uso terapêutico, segurança e eficácia, protocolos de controle de qualidade e ensaios clínicos[10,32].
Indústria Farmacêutica Nacional e Inovação
O setor farmacêutico consiste em um ramo da economia que agrupa atividades envolvidas na produção, comercialização e transporte de farmoquímicos, medicamentos e produtos farmacêuticos. Esse setor é caracterizado por grandes investimentos em pesquisa, desenvolvimento e inovação e pela sua base científica bem consolidada[33].
O mercado anual de medicamentos vale cerca de 1,1 trilhões de dólares, sendo que aproximadamente 41% desses medicamentos são originados direta ou indiretamente de produtos naturais, incluindo plantas (25%), microrganismos (13%) e animais (~ 3%). Os produtos naturais constituem uma fonte bastante significativa de fármacos ou protótipos de fármacos para o desenvolvimento das indústrias farmacêuticas. Alguns exemplos claros, que viraram carros chefe de indústrias farmacêuticas são as estatinas (anticolesterol), o captopril e o enalapril (anti-hipertensivos), a ciclosporina e o tacrolimus (imunossupressores)[31].
Vargas e colaboradores[33] descreveram a indústria farmacêutica internacional como um oligopólio que se baseia em ciência e no qual sua diferenciação se dá por meio da PD&I. De acordo com os autores, o setor farmacêutico vem sofrendo alterações nas últimas décadas em virtude da concorrência, que é alicerçada em algumas tendências importantes: (i) aumento do mercado mundial de produtos farmacêuticos; (ii) aumento da pressão de indústrias multinacionais pela expiração de patentes; (iii) redução da produtividade dos setores de PD&I, reduzindo a entrada no mercado de produtos inovadores com alto valor agregado; (iv) crescimento da oferta de genéricos e por fim; (v) alterações dos marcos regulatórios. Além disso, se observa redução de investimentos em PD&I e aumento dos preços de medicamentos, pelo processo de financeirização das indústrias farmacêuticas multinacionais[34]. Tais mudanças no mercado farmacêutico internacional exercem impacto direto no mercado farmacêutico nacional, caracterizado pela produção de medicamentos, importação de IFAs e baixo investimento em PD&I[35]. Apesar de figurar entre os dez maiores mercados mundiais, o país não foi capaz de integrar a cadeia farmacêutica com tecnologia e inovação[20].
Pelo exposto acima, as alterações de mercado fazem com que a indústria farmacêutica brasileira apresente um papel marginal no setor farmacêutico mundial[36]. O aumento da concorrência provocou no país uma maior concentração industrial, desenvolvimento acentuado de empresas nacionais quanto a oferta local de medicamentos, muito em função da produção de genéricos, e o baixo investimento em PD&I. Dados de 2014, apontam que os investimentos tanto das indústrias farmacêuticas nacionais quanto internacionais instaladas no país, são de percentuais ainda baixos de 4,9 e 1,4%, respectivamente, em relação a receita líquida de vendas[37]. O baixo investimento em PD&I pelas indústrias farmacêuticas nacionais se relaciona intimamente com a ausência do perfil inovador dessas empresas e, por consequência, com a participação quase nula no mercado de produtos inovadores. Por outro lado, o mercado brasileiro de medicamentos movimentou R$ 76,98 bilhões (US$ 15,02 bilhões) em 2020[20].
Para superar a defasagem da inovação de medicamentos, tanto de fitoterápicos ou de medicamentos com ativos sintéticos, o Brasil necessita assumir a produção dos IFAs. Durante a pandemia do coronavírus foi possível perceber que o país é totalmente dependente do mercado externo. Para tanto, é extremamente necessário que o Brasil coloque em prática um sistema nacional de inovação, fortalecendo a tríplice aliança entre empresas, universidades e/ou institutos de pesquisa e governo.
Analisando a inovação no Brasil desde os primeiros passos, podemos compreender parcialmente por que o país se encontra nessa situação de defasagem. A partir da 2ª Conferência Nacional da Ciência, Tecnologia e Inovação (2001), o Brasil passou a incorporar o termo na sua política. A 3ª Conferência Nacional da Ciência, Tecnologia e Inovação (2005), por sua vez, enfatizou o potencial de inovação para o desenvolvimento da indústria nacional, dinamização das economias regionais e diminuição das desigualdades[38]. Em 2004, ocorreu a aprovação da Lei da inovação nº 10.973[39], alterada pela Lei nº 13.243/2016[40] e regulamentada pelo Decreto nº 9.283/2018[41], e da Lei do Bem nº 11.196/2005[42] no ano seguinte. Essas leis foram criadas para estabelecer mecanismos com o intuito de facilitar a circulação de pesquisadores entre dois atores da tríplice aliança (instituições de pesquisa e/ou universidades e empresas) [38,43]. Assim, almejava-se redução significativa na burocracia envolvida em atividades de pesquisa científica, com a finalidade de proporcionar maior articulação entre agentes de pesquisa com empresas de cunho inovador. Dentre as mudanças impostas pelas referidas leis podemos citar: a formalização de institutos de ciência e tecnologia (ICT´S) privadas, formação de núcleos de inovação tecnológica (NITs), diminuição de entraves para a importação de insumos para P&D e formalização de estímulo à atividade inovadora.
O Estado considera que um panorama favorável à inovação ocorra por meio de apoio a arranjos territoriais, com a formação de Ecossistemas de Inovação, ou incentivo a interação entre os atores do Sistema de Inovação Brasileiro. O decreto nº 9.283/2018 institucionaliza o Sistema Nacional de Ciência, Tecnologia e Inovação[41] sob o regime da Estratégia de Ciência, Tecnologia e Inovação (ENCTI) (2016-2022) pelo Ministério da Ciência, Tecnologia e Inovação (MCTI) objetiva nortear ações que contribuam para o desenvolvimento nacional através de iniciativas que valorizem o avanço do conhecimento e da inovação.
Diante do exposto, podem-se elencar os pilares fundamentais do sistema de inovação no Brasil como: pesquisa, infraestrutura, financiamento, recursos humanos e inovação. A partir do fortalecimento desses pilares é que a promoção da expansão, consolidação e integração do sistema nacional de inovação pode ocorrer. A ENCTI visava colocar o Brasil em um patamar diferenciado de desenvolvimento tecnológico a longo e médio prazo, com o intuito de superar o atraso em relação a outros países. Além disso, pode-se afirmar que quanto maior o número de interações entre grandes empresas, governo, principalmente agências de fomento como o CNPq e a FINEP, por exemplo, e ICT´s maior será a probabilidade de gerar inovação. O fortalecimento dessas instituições e principalmente a descentralização de suas ações é fundamental, não apenas para reduzir o atraso tecnológico, mas também reduzir as desigualdades[44].
Apesar de todas as políticas em prol da inovação citadas anteriormente, poucas delas foram colocadas efetivamente em prática, fazendo com que o país não possua um sistema com características inovadoras. Não se pode deixar de citar o desmonte do Sistema Nacional de Ciência, Tecnologia e Inovação pelo governo atual (2018-2022), que inclui o contingenciamento e corte de verbas do CNPq, por exemplo. A proposta orçamentaria para 2021, revelou decréscimo de investimentos públicos de R$ 75 bilhões em 2014 para R$ 25,1 bilhões em 2020. Recentemente, o CNPq, sofreu um corte orçamentário de 92%, cerca de R$ 690 milhões de reais. Cita-se, ainda, a CAPES com recursos que despencaram de R$ 7,7 bilhões (2015) para R$ 2,9 bilhões (2021). Somado a isso, universidades e institutos federais acumulam perdas sucessivas nos seus recursos.
Outro ponto a ser mencionado em relação a ausência de inovação e independência do Brasil na área de medicamentos é a falta do Complexo Econômico-Industrial da Saúde (CEIS) atuante. O conceito de CEIS foi desenvolvido na década de 2000 para demonstrar a relação indissociável entre saúde e desenvolvimento, considerando a saúde, o sistema de produção e de inovação com parte indissociável de um padrão de desenvolvimento[45].
Indústria Farmacêutica Nacional e Medicamentos da Biodiversidade vegetal
A Portaria nº 22, de 30 de outubro de 1967, publicada pelo Serviço Nacional de Fiscalização de Medicina e Farmácia constituiu o primeiro ato normativo a estabelecer regras para o emprego de preparações fitoterápicas no Brasil, muito em função aos efeitos adversos apresentados pela talidomida. Nessa época, para se obter o registro e licença de comercialização de um produto fitoterápico era necessária a apresentação de um relatório contendo informações sobre a produção, controle, eficácia e segurança desse produto. Apesar de uma fundamentação técnica adequada, a Portaria não foi capaz de organizar o segmento da indústria nacional de fitoterápicos[46].
No início dos anos 80, o Ministério da Saúde definiu Diretrizes e Prioridades de Investigação em Saúde, dentre elas o estudo aprofundado das plantas medicinais. Com o intuito de estimular os estudos de eficácia e segurança das plantas medicinais e fitoterápicos utilizados no país, em 1982 foi implementado o "Programa de Pesquisa de Plantas Medicinais da Central de Medicamentos do Ministério da Saúde" (PPPM/CEME).
Em 1991, o Conselho Federal de Medicina (CFM) reconheceu a Fitoterapia como método farmacêutico e em 1995, a Secretaria de Vigilância Sanitária do Ministério da Saúde, instituiu e normatizou o registro de produtos fitoterápicos, influenciada pelas regulamentações da OMS da época (1991), para que países membros estabelecessem suas regulamentações sobre a fitoterapia[47]. O conceito de medicamento fitoterápico (herbal medicine) começou a ser discutido apenas na década de 90, o que se tinha anteriormente era o uso de preparações empregando plantas medicinais.
A Portaria nº 06, de 31 de janeiro de 1995, da Secretaria de Vigilância Sanitária[48] se constituiu um marco regulatório importante dos fitoterápicos brasileiros, sendo a primeira norma moderna a regulamentar essa classe de medicamentos. Essa Portaria concedeu a Indústria Farmacêutica prazos de 5 anos para a comprovação da inexistência de toxicidade e 10 anos para a comprovação da eficácia dos produtos que já estavam no mercado. A sua atualização se deu por meio da RDC nº 17/2000[49], RDC nº 48/2004[50] e mais recentemente RDC nº 26/2014[18]. Além de ser um marco regulatório, a Portaria também regulamentou a isenção de registro previsto na lei nº 6360, de 23 de setembro de 1976[51], no caso de fitoterápicos descritos em monografias da farmacopeia brasileira ou outro compêndio oficial aceito.
A partir da publicação da Portaria nº 06/1995, muitas indústrias de fitoterápicos se viram obrigadas a retirar seus produtos do mercado e destas algumas encerraram suas atividades, revelando uma lacuna significativa entre realidade de infraestrutura e formação de recursos humanos do setor e as exigências de qualidade requeridas pelos órgãos regulatórios. Uma das principais barreiras encontradas, foi a limitação analítica das empresas para seus produtos no sentido de que a quantificação dos marcadores químicos escolhidos era dificultada pela complexidade da composição química dos medicamentos, que em sua maioria era composto de mais de uma espécie vegetal. Outro ponto a ser citado foi a dificuldade em encontrar laboratórios especializados que oferecessem os ensaios de toxicidade e segurança[46].
Em 2006, foi aprovada a Política Nacional de Práticas Integrativas e Complementares (PNPIC), apresentando-se como um instrumento que reunia as diretrizes do SUS e uma proposta inovadora que considerava as práticas de saúde não convencionais e trazia uma concepção ampliada do processo saúde-doença, reconhecendo o importante papel do usuário do serviço como ator e participante dessa dinâmica. A PNPIC foi formulada, aplicada e implementada de forma transversal com o intuito de trazer avanços para a área de saúde no país. Essa política se baseou dentro outros fatores, nas recomendações da OMS aos Estados membros para a formulação de políticas visando a integração de sistemas médicos complexos e recursos terapêuticos (Medicina Tradicional e Complementar/Alternativa ou Práticas Integrativas Complementares) aos Sistemas Oficiais de Saúde. Ainda, se relaciona com a política nacional de plantas medicinais e medicamentos fitoterápicos (PNPMF) visto que esta estabelece diretrizes para toda a cadeia produtiva, fortalece ações/serviços com planta medicinais e fitoterápicos.
A PNPMF teve como base a conferência de Alma-Ata (1978)[6] da OMS que estimula a atenção primária à saúde, as recomendações da OMS para o uso de plantas medicinais e fitoterápicos (herbal medicines), a convenção sobre a diversidade biológica (uso sustentável da biodiversidade, repartição justa e equitativa de benefícios provenientes de recursos genéticos), a constituição Federal[52] e Lei 8080/1990[53] (condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes), as recomendações das conferências nacionais de saúde e políticas nacionais voltadas para plantas medicinais e fitoterápicos, o potencial do Brasil para o desenvolvimento do setor de plantas medicinais e fitoterápicos e por fim, necessidade de inserção do desenvolvimento sustentável na formulação e implementação de políticas públicas.
Apesar de importantes, as iniciativas governamentais para impulsionar toda a cadeia produtiva de fitoterápicos fracassaram em parte, muito provavelmente devido aos recursos limitados, ausência de coordenação com a agência regulatória brasileira (ANVISA), desatualização da política pública relacionada a plantas medicinais e fitoterápicos (PNPMF), implementação fracassada das diretrizes da PNPMF, entre outros.
Não há um consenso mundial nas legislações acerca de fitoterápicos e plantas medicinais. Devido a particularidades regionais, há uma variedade de sistemas regulatórios para fitoterápicos e preparações a base de plantas medicinais e esses sistemas não podem ser considerados como certo ou errado. Por exemplo, a regulamentação no Canadá utiliza o termo "produtos naturais para a saúde" para um extenso grupo de produtos que incluem vitaminas e minerais. Nos Estados Unidos, por outro lado, o termo "botânicos" é aplicado, embora poucos produtos medicinais sejam aprovados nessa categoria, sendo a maioria do mercado denominado de "suplementos alimentares"[54].
Na União Europeia, os produtos são divididos em duas categorias: suplementos ou medicamentos. Os suplementos alimentares estão regulamentados como alimentos sob a diretiva 2002/46/EC[55]. Os medicamentos fitoterápicos, por sua vez, são classificados como medicamentos e regulamentados pela diretiva na União Europeia 2004/24/EC[56]. A segurança, eficácia e autorizações pré-mercado são ditadas pela Agência Europeia de Medicamentos (EMA)[57]. Os cidadãos na União Europeia possuem diferentes opções para o acesso a medicina tradicional chinesa, embora essas opções possam diferir em detalhes a nível nacional. Além disso, a Diretoria Europeia para a qualidade de medicamentos e cuidados em saúde (EDQM) promove a implementação e monitoramento da aplicação de padrões de qualidade em produtos medicinais[58]. Os padrões harmonizados são publicados na Farmacopeia Europeia após adoção pela Comissão.
A norma atual que regulamenta os medicamentos fitoterápicos no Brasil é a RDC nº 26/2014[18], como exposto anteriormente. Entretanto, atualmente a ANVISA está propondo harmonização regulatória com a Comissão Europeia, o que pode vir a ser mais um entrave no setor nacional de fitoterápicos. Partindo-se do princípio que o conceito de extrato da farmacopeia brasileira difere do conceito de extrato utilizado pela comunidade europeia, se a legislação brasileira for efetivamente harmonizada com aquela existente na União Europeia, as empresas terão que fazer uma readequação em seus produtos que já estão no mercado e provavelmente alguns produtos não voltarão as prateleiras, em virtude da crise econômica brasileira e a inviabilidade de modificar toda uma linha de produção. Assim, a harmonização poderia provocar efeitos semelhantes àqueles provocados pela Portaria nº 06/1995, enfraquecendo a indústria nacional de fitoterápicos. A convergência regulatória, por outro lado, poderia trazer vantagens por respeitar as particularidades de cada país. Ainda, dentro do próprio país a implementação de políticas públicas que respeitem a biodiversidade sociocultural local traria grandes ganhos.
Cabe lembrar que a maioria das legislações da ANVISA em relação a fitoterápicos e plantas medicinais trata de espécies vegetais exóticas, o que não fortalece a cadeia produtiva nacional de medicamentos da biodiversidade. O Brasil possui tecnologia, recursos humanos totalmente capacitados para o desenvolvimento desses produtos, porém os entraves regulatórios e políticos como a falta de implementação de políticas públicas, acabam por desestimular as empresas e as pessoas que trabalham no setor. Alguns passos importantes para o fortalecimento da cadeia produtiva de fitoterápicos estão apresentados na FIGURA 4.
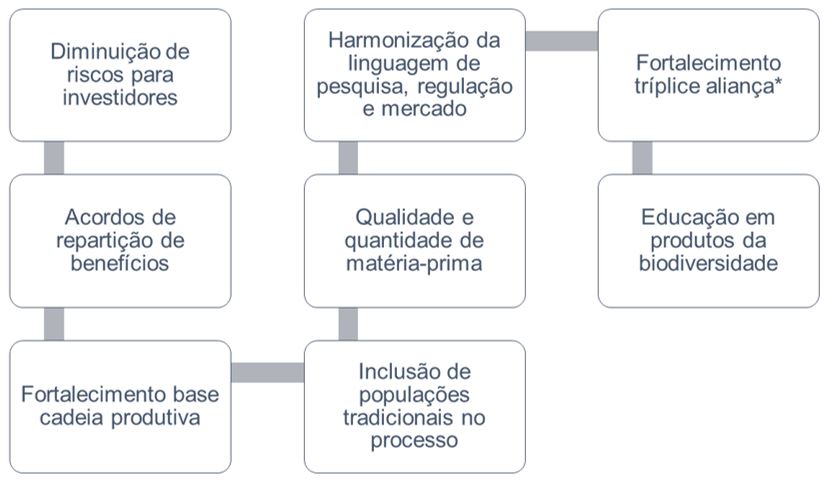
*Tríplice aliança: aliança entre instituições de pesquisa e/ou universidades e empresas.
Evidências sugerem que ao longo das décadas de 1990 e de 2010 o número de fármacos aprovados pelo FDA sofreu redução. Foram aprovados 45 fármacos na década de 1990 e 21 na década de 2010[60]. Isso fez com que as indústrias farmacêuticas ficassem sob pressão para aumentar o número de medicamentos lançados no mercado, e como resultado, muitas empresas farmacêuticas acabaram por abandonar seus programas de investimento de fármacos a partir da biodiversidade[61]. Algumas razões para esse abandono já foram citadas anteriormente, outras incluem baixos rendimentos e rotas sintéticas muito extensas ou por vezes inexistentes para alcançar a estrutura molecular[62].
Em face da biodiversidade brasileira, o mercado nacional de fitoterápicos é modesto[11]. Observou-se uma redução de 72% no número de registros no Brasil ente os anos de 2009 à 2015[36]. A despeito da redução do número de produtos comercializados, o valor de mercado de fitoterápicos no Brasil aumentou nos últimos anos, sendo as principais classes terapêuticas os hipnóticos e sedativos (U$ 83,1 milhões), e os expectorantes (U$ 72,6 milhões). Nesse contexto, podemos perceber que até mesmo plantas que estão incluídas na lista de registro simplificado da ANVISA[63] ainda não possuem fitoterápico na prateleira das farmácias, como por exemplo Allium sativum L., Mentha x piperita L., Pimpinella anisum L., e Sambucus nigra L. confirmando o enorme potencial ainda a ser explorado nessa área[10].
Além do desenvolvimento de novos fármacos e medicamentos, a exploração da biodiversidade brasileira para fins medicinais inclui a validação de plantas medicinais e seu desenvolvimento como medicamentos. Nesse sentido, a ANVISA possui um papel muito importante para que o medicamento chegue na população com qualidade, segurança e eficácia. Como produtos relevantes lançados no mercado nos últimos anos podemos citar Acheflan® (Cordia curassavica (Jacq.) Roem. & Schult.), Melagrião® (Mikania glomerata Spreng.) e Fitoscar® (Stryphnodendron adstringens (Mart.) Coville). Não podemos deixar de mencionar que dentre os 12 fitoterápicos presentes na Lista de Medicamentos Essenciais do SUS, 7 são produzidos a partir de espécies exóticas [64]. Além disso, das 41 espécies citadas nas listas de registro simplificado da ANVISA, apenas 6 (14,63%) são nativas[63].
Propriedade intelectual
Além de o Brasil ser o sétimo maior mercado farmacêutico mundial em faturamento, o país é um dos maiores mercados da América Latina. O consumo de medicamentos no varejo representa cerca de 70% do faturamento da indústria farmacêutica.
O setor dos genéricos é um dos que mais cresce no Brasil. A política governamental se baseia em promover a produção nacional dos genéricos, medicamentos essenciais, vacinas e de insulina. Para tanto, investimentos foram realizados na produção local, tecnologia e fármacos para o tratamento de problemas de saúde como doenças do sistema cardiovascular, anti-infecciosos, medicamentos para combater doenças intestinais e do sistema nervoso central. Assim o mercado de genéricos se tornou altamente rentável no Brasil com valores de aproximadamente 9,8 bilhões de dólares em 2019, porém sem qualquer tipo de processo inovativo[20].
Apesar de o mercado farmacêutico brasileiro ser interessante e possuir a presença de indústrias nacionais e multinacionais de alto poder de inovação, o escritório de representação comercial dos Estados Unidos colocara o Brasil na "lista de observação", isto é, na lista de países que chamam atenção por violarem os direitos de propriedade intelectual e o cumprimento das leis[65]. Alguns pontos chave dessa posição do Brasil consistem em padrões de patenteabilidade, proteção de dados, controle de preços governamentais e revisão inapropriada das patentes farmacêuticas de aplicação pela ANVISA. Embora não exista uma barreira declarada, em relação a patenteabilidade a respeito de invenções secundárias e polimórficas no estatuto de propriedade intelectual brasileiro, essas invenções têm sido contestadas pela ANVISA desestimulando as empresas farmacêuticas em proteger seus produtos[66].
A patente pode ser conceituada como um título de propriedade temporária sobre uma invenção ou modelo de utilidade, outorgado pelo Estado aos titulares, ou outras pessoas físicas ou jurídicas, detentoras de direito sobre criação. De posse deste direito, o inventor ou detentor da patente fica autorizado de impedir terceiros, sem seu consentimento, de produzir, usar, colocar à venda, vender ou importar produto objeto de sua patente e/ou processo ou produto obtido diretamente por processo por ele patenteando[67].
O uso do sistema de patentes para a proteção do patrimônio genético e/ou conhecimento tradicional é um tema bastante controverso. Qualquer grau de uniformidade multilateral na proteção da propriedade intelectual via sistema de patentes esbarra em barreiras diplomáticas nos escritórios do WTO (World Trade Organization) e WIPO (World Intellectual Property Organization), com a falta de consenso durante discussões sobre a obrigação da divulgação da fonte da diversidade genética ou conhecimento tradicional através do sistema de patentes. Entretanto, muitos países em desenvolvimento descrevem suas próprias legislações para o acesso ao patrimônio genético, por vezes, inefetivas para evitar a exploração da biodiversidade local por outros[68].
De acordo com MYERS e colaboradores[26], 44% de todas as plantas vasculares e 35% de todas as espécies dos quatro grupos de vertebrados são confinados em apenas 25 pontos de biodiversidade (hotspots), que compreendem apenas 1,4% da superfície do planeta terra. Dentre os 25 pontos analisados, a maioria está localizada em territórios pouco desenvolvidos ou em desenvolvimento, onde a biodiversidade é raramente convertida em riqueza econômica.
No Brasil, os processos de obtenção IFAVs (extratos ou compostos isolados) podem ser patenteados e, com isso, a produção nacional de fitoterápicos pode se beneficiar da proteção intelectual por meio do sistema de patentes regido pela Lei de Propriedade Industrial nº 9279/1996[69,70]. Em diversos países, o patenteamento do extrato de plantas per se e não apenas do processo de sua obtenção, é possível, sendo um dos fatores apontados por autores pelos quais há tantos casos de patenteamento de produtos da biodiversidade brasileira fora do Brasil[71].
Para que uma patente seja concedida, a anterioridade é importante, facilitando em qual aspecto o produto poderá ser patenteado e quais outras invenções sobre o mesmo tema já existem, além de poder proporcionar avanços no produto da patente a ser pleiteada. Além disso, requisitos mínimos (atividade inventiva, aplicabilidade industrial e novidade) na redação da patente além dos requisitos técnicos formais, tais como requerimento, relatório descritivo, reivindicações, desenhos (se necessário) devem ser cumpridos. No entanto, apesar das instruções normativas do INPI que fornecem as diretrizes de redação de patentes, a qualidade da redação de patentes depositadas para fitoterápicos e o entendimento do que é patenteável ou não, não são obedecidos na maioria dos casos [69,70].
De acordo com levantamento realizado por França et al.[72], 1977 pedidos de patentes depositados no Brasil foram publicados entre 1995-2017, no âmbito da tecnologia relacionada a fitoterápicos. Destas, 876 pedidos tinham prioridade de publicação no Brasil, sendo 1106 pedidos (55,9%) com prioridade não brasileira, ou seja, de inventores de outros países. Os países com maior número de patentes depositadas no Brasil, além do próprio, foram Estados Unidos (432), França (102), Alemanha (78), Reino Unido (49), Itália (46), Japão (45), República da Coréia (32), sendo todos os países citados detentores de programas de proteção para fitoterápicos em seus territórios. Uma possibilidade relatada pelos autores em relação ao baixo número de patentes depositadas por brasileiros, é que os inventores tenham preferido depositar o primeiro pedido de patente (prioridade) em outro país, o que ocasionaria a diminuição dos documentos com prioridade computados.
No mesmo trabalho citado no parágrafo anterior, ficou evidenciada a baixa participação de empresas nos pedidos de patente (17%) e baixa interação com outros atores em cotitularidade (2%). No Brasil, destacam-se os inventores independentes (43%), individuais autônomos ou vinculados a alguma instituição ou empresa, como os que mais depositam patentes no setor de fitoterápicos. Os inventores independentes não contam com a capacitação oferecida pelos NITs e por sua estrutura, no acompanhamento dos depósitos de pedidos de patente. Esse fato ajuda a explicar o porquê de 377 depósitos apenas 4 pedidos alcançaram sucesso. Além disso, a MP 2186-16[73], onde havia a instrução que a solicitação de acesso a componente do patrimônio genético deveria ser por instituição e não pessoa física levou ao arquivamento de muitas patentes depositadas por inventores independentes.
Nas últimas décadas, uma redução significativa dos investimentos da indústria farmacêutica em produtos derivados da biodiversidade foi observada. Esse interesse reduzido ocorreu devido a um conjunto de fatores políticos, técnicos e econômicos[74]. Politicamente, conflitos entre dinâmica industrial e PD&I de países desenvolvidos e abundância de recursos naturais de países em desenvolvimento se tornaram importantes. Países como o Brasil, tentaram se defender da biopirataria com a promulgação de leis, como Lei da biodiversidade nº 13.123/2015[17]. Grandes empresas farmacêuticas reduziram de maneira substancial seus programas de bioprospecção em função da insegurança jurídica da exploração da biodiversidade e dificuldade em se estabelecer contratos de repartição de benefícios de acordo com as leis locais[60]. Do ponto de vista técnico, o surgimento de tecnologias inovadoras para a descoberta de novos fármacos e as limitações da pesquisa a partir de produtos naturais, que serão discutidas mais adiante, levaram a diminuição de interesse na biodiversidade.
As empresas brasileiras possuem conhecimento das demandas de mercado e as universidades detém o conhecimento científico, recursos humanos qualificados e infraestrutura necessária para contribuir de forma significativa para a evolução tecnológica do setor produtivo[75]. No entanto, ao longo dos anos apenas dois produtos com base em plantas medicinais foram desenvolvidos 100% a partir da biodiversidade, o Imunomax® (Uncaria tomentosa (Willd. Ex Schult.) DC., Herbarium®) e o Acheflan® (Cordia curassavica (Jacq.) Roem. & Schult., Ache®)[76], sendo o último um dos fitoterápicos mais prescritos no Brasil[11]. Apesar disso, a patente do Acheflan® (PI0419105-6) não está relacionada ao fitoterápico, mas sim o uso do princípio ativo da planta, o α-humuleno. Pode-se perceber que a maioria das patentes concedidas em relação a fitoterápicos não se traduzem em medicamentos no mercado.
O reconhecimento e a repartição justa dos benefícios da exploração dos recursos genéticos (biodiversidade) e/ou conhecimento tradicional é apoiado por pesquisas globais e iniciativas sustentáveis. A geração de lucros a partir da biodiversidade deve ser alinhada com os objetivos de desenvolvimento sustentável da ONU e o protocolo de Nagoya para o acesso a recursos genéticos e distribuição justa e equalitária dos benefícios obtidos da exploração da biodiversidade. Especificamente no Brasil, a Lei da biodiversidade nº 13.123/2015 almeja a regulação do acesso do patrimônio genético brasileiro e a repartição justa de benefícios para a preservação e uso sustentável da biodiversidade brasileira.
Qualquer atividade que anseie o acesso da biodiversidade brasileira está sujeita ao registro eletrônico no Sistema Nacional de Gestão do Patrimônio Genético (SisGen), que não requer o consentimento prévio do acesso. Entretanto, pesquisadores estrangeiros são permitidos a acessar a biodiversidade brasileira apenas se forem associados a alguma instituição de pesquisa nacional, seja ela pública ou privada[77].
Todavia, em muitos casos a identificação de algum produto da biodiversidade como genuinamente brasileiro é um empecilho e uma brecha que muitos pesquisadores estrangeiros utilizam para acessar o patrimônio genético sem qualquer tipo de regulamentação.
Um dos maiores desafios atuais é a construção de políticas de uso sustentável com base na lei da biodiversidade mencionada anteriormente. Em 2016, foi disponibilizado pelo Instituto Nacional de Propriedade Industrial (INPI) o programa Patentes Verdes como um serviço de exame prioritário de patentes relacionadas a tecnologias verdes. Essa iniciativa possibilita a identificação de novas tecnologias que possam ser utilizadas pela sociedade de maneira rápida e dinâmica, estimulando o seu licenciamento e incentivando a inovação no país.
Bioeconomia
A bioeconomia consiste em um modelo de produção industrial que se baseia no uso de recursos biológicos. Não se trata de um segmento econômico ou uma inovação científica específica, mas inclui todas as atividades econômicas derivadas de produtos biológicos e processos que poderão contribuir para o desenvolvimento de soluções sustentáveis e eficientes para os desafios enfrentados no mundo atual como alimentos, químicos, materiais, energia, produção, saúde e proteção ambiental[78].
Dados da Organização para a Cooperação e Desenvolvimento Econômico (OCDE) estimam que a bioeconomia movimente no mercado mundial cerca de 2 trilhões de euros gerando cerca de 22 milhões de empregos. Ainda, estima-se que até 2030 a bioeconomia responderá por aproximadamente 3% do produto interno bruto dos países membros da OCDE, um percentual que pode potencialmente ser muito maior no Brasil devido a elevada biodiversidade[79]. Somado a esse fato, as atividades do setor de bioeconomia estão no centro de vários dos objetivos de desenvolvimento sustentável propostos pela ONU, incluindo segurança alimentar e garantia de acesso à energia e a saúde. Atualmente, a bioeconomia faz parte de ações estratégicas de mais de 40 países[80].
O principal objetivo da bioeconomia é fornecer soluções em prol da sustentabilidade nos sistemas de produção para que os recursos fósseis e não sustentáveis possam ser substituídos[81]. Em relação ao atual modelo de economia, a bioeconomia se propõe a utilização intensiva de conhecimentos científicos e tecnológicos a partir de áreas estratégicas de ponta como genômica, bioinformática, química de renováveis, tecnologia da informação, nanotecnologia, entre outras. A mudança da sistemática econômica mundial é importante para evitar o colapso[13]. Em um país megabiodiverso como o Brasil, investir em um modelo econômico baseado no uso sustentável dos recursos naturais é de suma importância. Se explorados conscientemente, os recursos naturais podem contribuir de forma primordial para impulsionar a bioeconomia nacional. A possibilidade de integração entre diferentes elos da cadeia produtiva, por exemplo, agricultura e indústria possibilita a busca de soluções inovadoras e sustentáveis, que garantam a manutenção da biodiversidade e a proteção ambiental.
O Brasil pode vir a ser um líder na transição econômica visto que possui todas as condições para implementar esse modelo sustentável, tais como a maior biodiversidade mundial, condições climáticas e extensão territorial adequadas. Para tanto, a infraestrutura deve ser melhorada e tecnologias verdes necessitam ser incorporadas na indústria e a agricultura. Atualmente, a economia brasileira se baseia basicamente na exportação de commodities (ex.: soja), o que em última análise, desvia a atenção de ações importantes que deveriam ser o cerne das decisões em investimentos estruturais e institucionais. O sucesso da exportação de commodities não se traduziu em conhecimento, visto que a participação global de exportação de alto valor agregado quase não mudou nos últimos 20 anos[82].
De acordo com a Associação Brasileira de Indústrias Farmacêuticas, o desenvolvimento do setor farmacêutico nacional deve ser baseado na seguinte equação: estímulo da produção local e da inovação, estabelecimento de um ambiente favorável para pesquisa clínica nacional e adoção de políticas públicas que favoreçam o acesso a medicamentos[20]. A inovação é o parâmetro chave para o sucesso no desenvolvimento de fitoterápicos e duas novas abordagens podem ser exploradas para o desenvolvimento de produtos competitivos. A primeira, é baseada na exploração das propriedades antifragilidade de fitoterápicos em alinhamento com os conceitos de sistemas biológicos. Através dessa abordagem, os efeitos farmacológicos de fitoterápicos podem ser demonstrados, incluindo os efeitos de sinergismo. A segunda abordagem inclui a implementação de conceitos de economia circular para a produção de fitoterápicos, incluindo o uso de subprodutos para o desenvolvimento de novos agentes terapêuticos. Os fitoterápicos são particularmente aplicados ao conceito da economia circular visto que toda a cadeia de produção pode ser afetada e beneficiada com a sua produção. A economia circular é definida como uma transição do modelo linear (possuir, produzir, utilizar e descartar) para um modelo circular (restaurador e regenerador)[83,84]. De acordo com a ONU, a economia circular pode ser vista como um meio de progressão em direção ao desenvolvimento sustentável através de Metas Para o Desenvolvimento Sustentável (SDG), sendo intimamente relacionada com o conceito de bioeconomia.
Conclusão
Os biomas brasileiros, em conjunto, reúnem um potencial de diversidade química imensurável. Estima-se que os quatro principais biomas, Amazônia, Mata Atlântica, Cerrado e Pantanal possuam um potencial de descoberta de 40 mil, 20 mil, 11 mil e 923 moléculas farmacologicamente ativas, respectivamente. Dessa forma, os fitoterápicos e plantas medicinais possuem um potencial para abrir o mercado internacional de produtos da sociobiodiversidade brasileira, se explorados conscientemente.
Este artigo dedicou-se a demonstrar um breve panorama da atual situação da indústria farmacêutica brasileira no que diz respeito a exploração da riquíssima biodiversidade existente no território em prol do desenvolvimento de IFAVs, sejam eles para a produção de medicamentos fitoterápicos ou no emprego em medicamentos como moléculas isoladas.
Diante do exposto no artigo, a questão a ser respondida é o porquê de o Brasil não conseguir implementar propriamente seus programas governamentais para que a exploração da biodiversidade de forma consciente e com inovação atrelada, seja um dos principais caminhos para a independência nacional em relação aos IFAs. Um dos principais entraves está na falta de uma legislação específica que permita a exploração do patrimônio genético brasileiro de uma forma segura e consciente. A Lei da biodiversidade nº 13123/2015 trouxe progressos no quesito exploração da biodiversidade brasileira. Entretanto, ainda existem várias lacunas a serem preenchidas como, por exemplo, o conhecimento genético (informação sobre a origem genética do metabolismo de seres vivos); conhecimento tradicional associado; consentimento do detentor do conhecimento do uso tradicional para seu uso para fins de pesquisa e inovação; acesso ao material proveniente da biodiversidade para pesquisa científica e desenvolvimento tecnológico.
O Brasil possui um potencial enorme para o recebimento de investimentos no sentindo de exploração da biodiversidade para o desenvolvimento IFAVs. Porém, para esses investimentos se tornarem concretos, é imperativo a implementação de políticas que favoreçam a inovação, encorajando investimentos e expandindo as trocas de experiências cientificas entre pesquisadores nacionais e internacionais. Adicionalmente, a adoção de uma agenda que proteja adequadamente a propriedade intelectual é de suma importância [82]. A lei da biodiversidade estabeleceu em 2015 o marco regulatório para a exploração da biodiversidade brasileira. Apesar da lei ainda contar com alguns aspectos que prejudicam a pesquisa científica principalmente as instituições públicas, estabelece a segurança necessária para os parceiros produzirem produtos, garantindo a repartição de benefícios para a conservação e uso sustentável da biodiversidade.
Dada a biodiversidade brasileira, os investimentos em direção a bioeconomia são bastante importantes. A transformação dessa vantagem, devido aos recursos naturais locais, em vantagem competitiva exige investimentos, aplicação de conhecimentos e estudos estratégicos para tornar o país uma potência em bioeconomia. A quantificação do valor econômico da biodiversidade permite a proposição de políticas públicas no sentido da sua conservação e uso sustentável, inserindo essa atividade em um modelo de desenvolvimento que traga benefícios sociais e econômicos.
Parece evidente, assim, que a alteração do marco legal de acesso a biodiversidade é condição necessária, mas não suficiente, para o real aproveitamento do patrimônio genético brasileiro pela indústria farmacêutica. A remoção dessa barreira provavelmente evidenciará outros problemas ainda latentes no país, que podem ser enfrentados em melhores condições pela articulação institucional coesa entre as diversas partes interessadas – empresas, academia, governo e comunidades tradicionais.
Fontes de Financiamento
Nenhuma.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
Os autores agradecem a Fundação Oswaldo Cruz (Fiocruz), Farmanguinhos e especialmente ao Curso de Especialização em Inovação em Medicamentos da Biodiversidade. Este artigo é resultado do trabalho de conclusão de curso da primeira autora e assim, os autores agradecem as valiosas contribuições da banca examinadora.
Colaboradores
Concepção do estudo: GM; BMR
Curadoria dos dados: GM
Coleta de dados: GM
Análise dos dados: GM
Redação do manuscrito original: GM
Redação da revisão e edição: BMR.
Referências
1. Rawat US, Agarwal NK. Biodiversity: concept, threats and conservation. Environ Conserv. 2015; 16(3): 19-28. [https://doi.org/10.36953/ECJ.2015.16303].
2. Newman DJ, Cragg GM. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 2020; 83(3): 770-803. [https://doi.org/10.1021/acs.jnatprod.9b01285].
3. de Figueredo CA, Gurgel IGD, Gurgel Junior GD. A política nacional de plantas medicinais e fitoterápicos: construção, perspectivas e desafios. Physis. 2014; 24(2): 381-400. [https://doi.org/10.1590/S0103-73312014000200004].
4. Brasil. Farmacopeia Brasileira, 1ª Edição. 1926. 1173p. Disponível em: [http://antigo.anvisa.gov.br/documents/33832/261726/1_edicao.pdf/fef00ec7-a9b3-4fdd-a42d-60f0573b433b]. [acesso em: 20 nov. 2021].
5. Brasil. Farmacopeia Brasileira, 2ª Edição. 1977. 658p. Disponível em: [http://antigo.anvisa.gov.br/documents/33832/261691/2_edicao.pdf/a00e0113-ff72-4468-818e-926cdab4fd84]. [acesso em: 20 nov. 2021].
6. Organização Mundial da Saúde (OMS). Declaração de Alma-Ata sobre Cuidados Primários. República Soviética do Cazaquistão. 1978. 3p. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/declaracao_alma_ata.pdf]. [acesso em: 20 nov. 2021].
7. Agência Nacional de Vigilância Sanitária (ANVISA). Farmacopeia Brasileira. Vol. 2. 4ª Edição. 1994. 1563 p. Disponível em: [http://antigo.anvisa.gov.br/documents/33832/260748/4_edicao_parte2.pdf/c598c8e3-638c-40c5-a2c6-a2d791d888e9]. [acesso em 20 nov. 2021].
8. Agência Nacional de Vigilância Sanitária (ANVISA). Farmacopeia Brasileira. Vol. 2. Plantas Medicinais, 6ª edição. 2019. 739p. Disponível em: [http://portal.anvisa.gov.br/documents/33832/259143/Plantas+medicinais+Pronto.pdf/1b7220eb-a371-4ad4-932c-365732a9c1b8]. [acesso em: 20 nov. 2021].
9. Brasil. Ministério do Meio Ambiente. Biodiversidade. 2021. Disponível em: [https://www.gov.br/mma/pt-br/assuntos/biodiversidade]. [acesso em: 20 nov. 2021].
10. Carvalho ACB, Lana TN, Perfeito JPS, Silveira D. The Brazilian market of herbal medicinal products and the impacts of the new legislation on traditional medicines. J Ethnopharmacol. 2018; 212 (May 2017): 29-35. [https://doi.org/10.1016/j.jep.2017.09.040].
11. Dutra RC, Campos MM, Santos ARS, Calixto JB. Medicinal plants in Brazil: Pharmacological studies, drug discovery, challenges and perspectives. Pharmacol Res. 2016; 112: 4-29. [http://dx.doi.org/10.1016/j.phrs.2016.01.021].
12. Barreiro EJ, Bolzani VDS. Biodiversidade: fonte potencial para a descoberta de fármacos. Quim Nova. 2009; 32(3): 679-88. [https://doi.org/10.1590/S0100-40422009000300012].
13. Valli M, Russo HM, Bolzani VS. The potential contribution of the natural products from Brazilian biodiversity to bioeconomy. An Acad Bras Cienc. 2018; 90(1): 763-78. [https://doi.org/10.1590/0001-3765201820170653].
14. Comissão Europeia. Inovação para um Crescimento Sustentável: Bioeconomia para a Europa. In: Comunicação da Comissão ao Parlamento Europeu, ao Conselho e ao Comitê Econômico e Social das Regiões. 2012. p.1-11. Disponível em: [https://eur-lex.europa.eu/legal-content/PT/ALL/?uri=CELEX%3A52012DC0060]. [acesso em: 22 nov 2021].
15. Brasil. Ministério da Saúde. Política Nacional de Plantas Medicinais e Fitoterápicos. 2006. 60p. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/politica_nacional_fitoterapicos.pdf]. [acesso em 22 nov 2021].
16. Brasil. Ministério da Saúde. Política Nacional de Práticas Integrativas e Complementares no SUS. 2ª edição, 2015. 98 p. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/politica_nacional_praticas_integrativas_complementares_2ed.pdf]. [acesso em: 22 nov 21].
17. Brasil. Lei nº 13.123, de 20 de maio de 2015. dispõe sobre o acesso ao patrimônio genético e dá outras providências. 2015. 17p. Disponível em: [http://www.planalto.gov.br/ccivil_03/_ato2015-2018/2015/lei/l13123.htm]. [acesso em: 22 nov 2021].
18. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da Diretoria Colegiada (RDC) no 26, de 13 de maio de 2014. Dispõe sobre o registro de medicamentos fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos. 2014. 34p. Disponível em: [https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2014/rdc0026_13_05_2014.pdf]. [acesso em: 23 nov 2021].
19. Skirycz A, Kierszniowska S, Méret M, Willmitzer L, Tzotzos G. Medicinal bioprospecting of the Amazon rainforest: A modern Eldorado? Trends Biotechnol. 2016; 34(10): 781-90. [http://dx.doi.org/10.1016/j.tibtech.2016.03.006].
20. Sindicato da Indústria de Produtos Farmacêuticos (SINDUSFARMA). Perfil da indústria farmacêutica e aspectos relevantes do setor. 2020. 9p. Disponível em: [https://sindusfarma.org.br/uploads/Publicacoes/Perfil_IF2020_PORT.pdf]. [acesso em: 23 nov 2021].
21. Brasil. Lei nº 11.898, de 8 de Janeiro de 2009. Institui o Regime de Tributação Unificada - RTU na importação, por via terrestre, de mercadorias procedentes do Paraguai; e altera as Leis nos 10.637, de 30 de dezembro de 2002, e 10.833, de 29 de dezembro de 2003. 2009. 5p. Diponível em: [http://www.planalto.gov.br/ccivil_03/_ato2007-2010/2009/lei/L11898.htm]. [acesso em: 24 nov 2021].
22. Brasil. Ministério do Meio Ambiente. Biodiversidade Brasileira. 2021. Disponível em: [https://antigo.mma.gov.br/biodiversidade/biodiversidade-brasileira.html]. [acesso em: 23 nov 2021].
23. Braga FC. Brazilian traditional medicine: Historical basis, features and potentialities for pharmaceutical development. J Tradit Chinese Med Sci. 2020; 8: S44-S50. [https://doi.org/10.1016/j.jtcms.2020.06.005]
24. Fundação SOS Mata Atlântica. Relatório anual SOS Mata Atlântica. 2020. Disponível em: [https://www.sosma.org.br/sobre/relatorios-e-balancos/]. [acesso em: 3 dez 2021].
25. Projeto de Mapeamento Anual do Uso e Cobertura da Terra no Brasil (MapBiomas). 2020. Disponível em: [https://mapbiomas.org/o-projeto]. [acesso em: 3 dez 2021].
26. Myers N, Mittermeier RA, Mittermeier CG, da Fonseca G, Kent J. Biodiversity hotspots for conservation priorities. Nature. 2000; 403:853-858. [https://doi.org/10.1038/35002501]
27. Silva JMC. Megadiversidade: os desafios científicos para a conservação da biodiversidade no Brasil. Conserv Inter Brasil. 2009; 5: 1-114. Disponível em: [https://www.conservation.org/docs/default-source/brasil/Megadiversidade_desafios_cientificos.pdf]. [acesso em: 3 dez 2021].
28. Villas Bôas GDK, Gadelha CAG. Oportunidades na indústria de medicamentos e a lógica do desenvolvimento local baseado nos biomas brasileiros: Bases para a discussão de uma política nacional. Cad Saúde Púb. 2007; 23(6): 1463-1471. [https://doi.org/10.1590/S0102-311X2007000600021]
29. Brasil. Ministério do Meio Ambiente (MMA). Patrimônio Genético e Conhecimentos Tradicionais Associados. 2021. Disponível em: [ https://antigo.mma.gov.br/patrimonio-genetico.html ]. [acesso em: 3 dez 2021].
30. Rodrigues W. Competitividade e mudança institucional na cadeia produtiva de plantas medicinais no Brasil. Interações. 2016; 17: 267-277. [https://doi.org/10.20435/1984042X2016210]
31. Calixto JB. The role of natural products in modern drug discovery. An Acad Bras. Ciênc. 2019; 91: 1-7. [https://doi.org/10.1590/0001-3765201920190105].
32. Leite PM, Camargos LM, Castilho RO. Recent progess in phytotherapy: A Brazilian perspective. Eur J Integr Med. 2021; 41(August 2020): 101270. [https://doi.org/10.1016/j.eujim.2020.101270].
33. Vargas M, Gadelha CA, Maldonado JM, Barbosa PR. Reestruturação na indústria farmacêutica mundial e seus impactos na dinâmica produtiva e inovativa do setor farmacêutico brasileiro. In: Anais do XV Encontro Nacional de Economia Política 2010. p.1-24. Disponível em: [https://www.researchgate.net/publication/267179584].
34. Lazonick W, Hopkins M, Jacobson K, Sakinc ME, Tulum O. US Pharma's Financialized Business Model. SSRN Electron J. 2017; 60: 1-25. [https://dx.doi.org/10.2139/ssrn.3035529].
35. Castro RA, Albiero ALM. O mercado de matérias primas para indústria de fitoterápicos. Rev Fitos. 2016; 10(1): 59-72. [https://doi.org/10.5935/2446-4775.20160006].
36. Rodrigues P, Costa R, Kiss C. A evolução recente da Indústria Farmacêutica Brasileira nos limites da subordinação econômica. Physis. 2018; 28(1): 1-22. [https://doi.org/10.1590/S0103-73312018280104].
37. Hasenclever L, Paranhos J, Costa CR, Cunha G, Vieira D. The Brazilian phytotherapics industry: Challenges and opportunities. Cienc e Saude Coletiva. 2017;22(8):2559–69. [https://doi.org/10.1590/1413-81232017228.29422016].
38. Balbachevsky E. Processos decisórios em política científica, tecnológica e de inovação no Brasil: análise crítica. Cent Gestão Insumos Estratégicos. 2010; Nota técnica: 1-37. Disponível em: [https://www.cgee.org.br/documents/10195/734063/NT_ElizabethBalbachevsky_Final_6204.pdf/a9572815-01de-4dd9-9e4d-7a50e6d64a54?version=1.0]. acesso em 5 dez 2021.
39. Brasil. Lei nº 10.973, de 2 de dezembro de 2004. Dispões sobre incentivos à inovação e à pesquisa científica e tecnológica no ambiente produtivo e dá outras providências. 2004. 17p. Disponível em: [http://www.planalto.gov.br/ccivil_03/_ato2004-2006/2004/lei/l10.973.htm]. [acesso em 05 dez 2021].
40. Brasil. Lei nº 13.243, de 11 de janeiro de 2016. Dispõe sobre estímulos ao desenvolvimento científico, à pesquisa, à capacitação científica e tecnológica e à inovação e dá outras providências. 2016. 13 p. Disponível em: [http://www.planalto.gov.br/ccivil_03/_ato2015-2018/2016/lei/l13243.htm]. [acesso em: 15 dez 2021].
41. Brasil. Decreto nº 9.283, de 7 de fevereiro de 2018. Regulamenta e estabelece medidas de incentivo à inovação e à pesquisa científica e tecnológica no ambiente produtivo. 2018. 31 p. Disponível em: [http://www.planalto.gov.br/ccivil_03/_ato2015-2018/2018/decreto/d9283.htm] [acesso em: 15 dez 2021].
42. Brasil. Planalto. Casa Civil. Lei nº 11.196, de 21 de novembro de 2005. dispõe sobre incentivos fiscais para a inovação tecnológica; e dá outras providências. 2005. 52 p. Disponível em: [http://www.planalto.gov.br/ccivil_03/_ato2004-2006/2005/lei/l11196.htm]. [acesso em: 15 dez 2021].
43. Freitas RL. O processo de acompanhamento e avaliação das transferências voluntárias de recursos do CNPq em parceria com as FAP. Brasília, 2014. Dissertação de Mestrado Profissional [Programa de Pós-Graduação em Desenvolvimento Sustentável] Universidade de Brasília, UNB. Brasília, 2014. [http://dx.doi.org/10.26512/2014.10.D.18469].
44. Matos GP, Teixeira CS. Uma análise sobre o Sistema Nacional de Inovação do Brasil. Rev Eletr Alto Val Itajaí. 2019; 8(13): 73-83. [https://doi.org/10.5965/2316419008112019073].
44. Gadelha CAG. O Complexo Econômico-Industrial da Saúde no Brasil hoje. Nexo J. Mai 2020; 1-3. [https://www.nexojornal.com.br/ensaio/debate/2020/O-Complexo-Econ%C3%B4mico-Industrial-da-Sa%C3%BAde-no-Brasil-hoje]
46. Oliveira DR, Oliveira ACD, Marques LC. O estado regulatório dos fitoterápicos no Brasil: Um paralelo entre a legislação e o mercado farmacêutico (1995–2015). Visa Deb. 2016; 4(4): 139-48. [https://doi.org/10.22239/2317-269X.00806]
47. Organização Mundial da Saúde (OMS). Pautas para la evaluacion de medicamentos herbarios. 1991. 5p. Disponível em: [https://apps.who.int/iris/handle/10665/61330]. [acesso em: 16 dez 2021].
48. Brasil. Secretaria de Vigilância Sanitária (ANVISA). Portaria no 6, de 31 de janeiro de 1995. Regulamenta o registro de fitoterápicos. 1995. Disponível em: [http://www.ibama.gov.br/component/legislacao/?view=legislacao&legislacao=98243]. [acesso em: 16 dez 2021].
49. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da Diretoria Colegiada (RDC) n° 17, de 24 de fevereiro de 2000. Dispõe sobre o registro de medicamentos fitoterápicos. 2000. 5p. Disponível em: [https://www.diariodasleis.com.br/busca/exibelink.php?numlink=1-9-34-2000-02-24-17] . [acesso em 17 dez 2021].
50. Diretoria Colegiada. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da Diretoria Colegiada RDC Nº 48, de 16 de março de 2004. Dispõe sobre o registro de medicamentos fitoterápicos. D.O.U. 2005; 1(2): 74-79. Disponível em: [https://doi.org/10.32712/2446-4775.2005.28]. [http://revistafitos.far.fiocruz.br/index.php/revista-fitos/article/view/28]. [acesso em 18 dez 2021].
51. Brasil. Planalto. Casa Civil. Lei nº 6.360, de 23 de setembro de 1976. Dispõe sobre a Vigilância Sanitária a que ficam sujeitos os Medicamentos, as Drogas, os Insumos Farmacêuticos e Correlatos, Cosméticos, Saneantes e Outros Produtos, e dá outras Providências. 1976. 18p. Disponível em: [http://www.planalto.gov.br/ccivil_03/leis/l6360.htm]. [acesso em: 04 jan 2022].
52. Brasil. Planalto. Casa Civil. Constituição da República Federativa do Brasil. 1988. 168p. Disponível em: [http://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm]. [acesso em: 04 jan 2022].
53. Brasil. Planalto. Casa Civil. Lei nº 8.080, de 19 de setembro de 1990. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências. 1990. 16p. Disponivel em: [http://www.planalto.gov.br/ccivil_03/leis/l8080.htm]. [acesso em 04 jan 2022].
54. Knoess W, Wiesner J. The globalization of traditional medicines: perspectives related to the European Union regulatoryr environment. Engineering. 2019; 5(1): 22-31. [https://doi.org/10.1016/j.eng.2018.11.012].
55. Parlamento Europeu. Comissão Europeia. Diretiva 2002/46/CE do parlamento europeu e do conselho de 10 de Junho de 2002. Relativa à aproximação das legislações dos Estados-Membros respeitantes aos suplementos alimentares. J O Comunidades Eur. 2002; 45(183): 51-57. [https://eur-lex.europa.eu/legal-content/PT/TXT/PDF/?uri=CELEX:32002L0046&from=DA].
56. Parlamento Europeu. Comissão Europeia. Diretiva 2004/24/CE do Parlamento Europeu e do Conselho de 31 de Março de 2004. J O União Eur. 2004; 47(136): 85-60. [https://eur-lex.europa.eu/legal-content/PT/TXT/PDF/?uri=CELEX:32004L0024&from=LV].
57. Parlamento Europeu. Comissão Europeia. Diretiva 2001/83/CE do Parlamento Europeu e do Conselho de 6 de novembro de 2001 pelo qual se estabelece código comunitário sobre medicamentos para uso humano. J O União Eur. 2001; 174: 1-62. [https://eur-lex.europa.eu/legal-content/PT/TXT/PDF/?uri=CELEX:32001L0083&from=EN].
58. European Medicines Agency (EMA). European Directorate for the Quality of Medicines and Human Health. 2018. Disponível em: [https://www.ema.europa.eu/en/partners-networks/international-activities/multilateral-coalitions-initiatives/european-directorate-quality-medicines-healthcare-edqm-council-europe]. [acesso em: 6 jan 2022].
59. Vialli A. Fitoterápicos: por uma política industrial verde. Página 22. 2021; 1-9. Disponível em: [https://pagina22.com.br/2021/06/23/fitoterapicos-amazonicos-por-uma-politica-industrial-verde/]. [acesso em: 6 jan 2022].
60. Kingston DG. Modern natural products drug discovery and its relevance to biodiversity conservation. J Nat Prod. 2010; 74: 496-511. [https://doi.org/10.1021/np100550t].
61. McChesney JD, Venkataraman SK, Henri JT. Plant natural products: Back to the future or into extinction? Phytochemistry. 2007; 68(14): 2015-22. [https://doi.org/10.1016/j.phytochem.2007.04.032].
62. Lamottke K, Ripoll C, Walczak R. The roots of innovation. EBR - Eur Biopharm Rev. 2011; (Winter): 52-6. [https://www.researchgate.net/publication/260943788_The_Roots_of_Innovation].
63. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Instrução Normativa Nº 02, de 13 de maio de 2014. Publica a "Lista me medicamentos fitoterápicos de registro simplificado" e a "lista de produtos tradicionais fitoterápicos de registro simplificado". 2014. 32p. Disponível em: [http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2014/int0002_13_05_2014.pdf]. [acesso em: 07 jan 2022].
64. Brasil, Ministério da Saúde. Relação Nacional de Medicamentos Essenciais (RENAME). 2020. 217 p. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/relacao_medicamentos_rename_2020.pdf]. [acesso em: 07 jan 2022].
65. United States Trade Representative (USTR). USTR releases Annual Special 301 Report on Intellectual Property Protection. 2021. Disponível em: [https://ustr.gov/about-us/policy-offices/press-office/press-releases/2021/april/ustr-releases-annual-special-301-report-intellectual-property-protection]. [acesso em: 08 jan 2022].
66. Gosain R. Update on Brazil's pharma patent landscape. Pharm Pat Anal. 2016; 5(6): 385-90. [https://doi.org/10.4155/ppa-2016-0017].
67. Brasil. Instituto Nacional da Propriedade Industrial (INPI). Patentes. 2022. Disponivel em: [https://www.gov.br/inpi/pt-br/servicos/perguntas-frequentes/patentes]. [acesso em: 10 jan 2022].
68. Zorzal PB, Hauegen RC, Pimenta FP. Biodiversity and the patent system: The Brazilian case. J Intellect Prop Law Pract. 2020; 15(10): 829-37. [https://doi.org/10.1093/jiplp/jpaa125].
69. Brasil. Instituto Nacional da Propriedade Industrial (INPI). Instrução normativa nº 030/2013. Estabelecimento de normas gerais de procedimentos para explicitar e cumprir dispositivos da Lei de Propriedade Industrial - Lei nº 9279, de 14 de maio de 1996, no que se refere às especificações dos pedidos de patente. Disponível em: [https://www.gov.br/inpi/pt-br/assuntos/patentes/in_030_in_17_2013_exame_tecnico_versao_final_03_12_2013-1-_1_0.pdf]. [acesso em: 16 jan 2022].
70. Brasil. Instituto Nacional da Propriedade Industrial (INPI). Instrução normativa nº 031/2013. Estabelece normas gerais de procedimentos para explicitar e cumprir dispositivos da Lei de Propriedade Industrial - Lei no 9279, de 14 de maio de 1996, no que se refere às especificações formais dos pedidos de patente. Disponível em: [https://www.itp.org.br/uploads/2018/07/19/agitec/Instru____o-Normativa-031-2013.pdf]. [acesso em: 16 jan 2022].
71. Alves FN. Desafio para a inovação em fitomedicamentos no contexto da indústria farmacêutica nacional. Rev Fitos. 2005; 1: 18-29. [https://www.arca.fiocruz.br/handle/icict/19126].
72. França E de, Vasconcellos AG. Patentes de fitoterápicos no Brasil: Uma análise do andamento dos pedidos no período de 1995-2017. Cad Ciência Tecnol. 2018; 35(3): 329-59. [https://seer.sct.embrapa.br/index.php/cct/article/view/26367].
73. Brasil. Medida Provisória nº 2186-16, de 2001. Dispõe sobre o acesso ao patrimônio genético. 2001. 5 p. Disponível em: [http://www.planalto.gov.br/ccivil_03/mpv/2186-16.htm]. [acesso em: 13 jan 2022].
74. Harvey AL, Edrada-Ebel R, Quinn RJ. The re-emergence of natural products for drug discovery in the genomics era. Nat Rev Drug Discov. 2015; 14(2): 111-29. [https://doi.org/10.1038/nrd4510].
75. Carlo J, Berni A, Perlin AP. Interação Universidade-Empresa para a inovação e a transferência de tecnologia. Rev Gestão Univ América Lat - GUAL. 2015; 8(2): 258-77. [https://doi.org/10.5007/1983-4535.2015v8n2p258].
76. Pimentel V, Vieira V, Felipe TM, João F, Pieroni P. Biodiversidade brasileira como fonte da inovação farmacêutica: uma nova esperança? Rev BNDES. 2015; (43): 41-89. [http://web.bndes.gov.br/bib/jspui/handle/1408/5602].
77. da Silva M, Oliveira DR . The new Brazilian legislation on access to the biodiversity (Law 13,123/15 and Decree 8772/16). Brazilian J Microbiol. 2018; 49(1): 1-4. [https://doi.org/10.1016/j.bjm.2017.12.001].
78. Serviço Brasileiro de Apoio às Micro e Pequenas Empresas (SEBRAE). Bioeconomia, inovação e sustentabilidade em cadeias produtivas. 2020. Disponível em: [https://www.sebrae.com.br/sites/PortalSebrae/ufs/rj/sebraeaz/bioeconomia-inovacao-e-sustentabilidade-em-cadeias-produtivas,357bcde5d61b3610VgnVCM1000004c00210aRCRD]. [acesso em: 13 jan 2022].
79. Organização para a Cooperação e Desenvolvimento Econômico (OECD). The Bioeconomy to 2030. Designing a policy agenda 2009. Disponivel em: [https://www.oecd.org/futures/long-termtechnologicalsocietalchallenges/thebioeconomyto2030designingapolicyagenda.htm]. [acesso em: 17 jan 2022].
80. El-Chichakli B, von Braun J, Lang C, Barben D, Philp J. Five cornerstones of a gloal bioeconomy. Nature. 2016; 535: 221-3. [https://doi.org/10.1038/535221a].
81. Philp J. The bioeconomy, the challenge of the century for policy makers. New Biotechnol. 2018; 40:11-9. [https://doi.org/10.1016/j.nbt.2017.04.004].
82. Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA). Bioeconomia. 2021. Disponível em: [https://www.embrapa.br/tema-bioeconomia/sobre-o-tema]. [acesso em: 23 jan 2022].
83. Braga FC. Paving new roads towards biodiversity-based drug development in Brazil: Lessons from the past and future perspectives. Rev Bras Farmacogn. 2021; 31(5): 505-518. [https://doi.org/10.1007/s43450-021-00181-2].
84. Macarthur E. Towards the circular economy. Ellen MacArthur Foundation. 2015. p. 26-29. [https://www.werktrends.nl/app/uploads/2015/06/Rapport_McKinsey-Towards_A_Circular_Economy.pdf].