Artigo de Pesquisa
Produção de biomassa e dos óleos voláteis de Melissa officinalis L. (erva-cidreira) em função da adubação e da sazonalidade
Biomass and volatile oil production of Melissa officinalis L. (lemon balm) under different fertilizations and seasonality
Resumo
O estudo sobre adubação e a sazonalidade faz-se necessário, pois podem influenciar na produção de biomassa e na qualidade e quantidade dos óleos voláteis produzidos por plantas medicinais. A pesquisa teve como objetivo identificar o manejo agrícola e época no ano apropriados para a colheita com melhor qualidade dos óleos voláteis de Melissa officinalis submetida ao delineamento experimental inteiramente casualizado (DIC), sendo adubações orgânica e convencional, cultivo controle, com e sem adição micronutrientes e colheitas no outono, inverno, primavera e verão. Os óleos voláteis foram extraídos das folhas de erva-cidreira por hidrodestilação e determinados por cromatografia gasosa acoplada ao espectrômetro de massas (GC-MS). A produção de biomassa foi maior no manejo orgânico nas primeiras colheitas (outono e inverno). O rendimento do óleo essencial (0,02%) não foi influenciado pelo manejo agrícola, entretanto apresentou menor rendimento no inverno (0,003%). A adubação convencional favoreceu a produção dos constituintes majoritários neral (33,9–37,5%) e geranial (54,1–59,3%) nas colheitas do outono, da primavera e do verão. Este trabalho contribui para ampliar o conhecimento do cultivo da espécie e para a Política Nacional de Práticas Integrativas e Complementares, voltadas à implementação da Fitoterapia no Sistema Único de Saúde.
- Palavras-chave:
- Melissa officinalis.
- Biomassa.
- Adubação.
- Sazonalidade.
- Óleo essencial.
- GC/MS.
Abstract
Fertilization and seasonality study are necessary because they can influence the biomass production and the volatile oils quality of medicinal herbs. The work aimed to identify the agriculture management and seasonality appropriate for the lemon balm harvest with the best volatile oils quality submitted under the experimental design completely randomized (CRD), with organic and conventional fertilization, control cultivation with and without microelements and four harvests (autumn, winter, spring, and summer). Volatile oil was extracted from Melissa officinalis leaves by hidrodistillation method and analyzed by gas chromatography coupled to a mass spectrometer (GC-MS). Biomass production was higher in fertilized treatments and showed higher growth in organic management in the first harvest (autumn and winter). The agriculture management did not influence the oil production yield (0.02%), however it presented smaller amount in the winter (0.003%). Conventional fertilization favors the neral (33.9–37.5%) and geranial (54.1–59.3%) production in the autumn, spring, and summer seasons. In this sense, the data contribute to expand the knowledge of the lemon balm cultivation and to the National Policy on Integrative and Complementary Practices, aimed at the implementation of Phytotherapy in the Health System.
- Keywords:
- Melissa officinalis.
- Biomass.
- Fertilization.
- Harvest seasonality.
- Essential oil.
- GC/MS.
Introdução
Para garantir o acesso seguro e o uso racional de plantas medicinais e fitoterápicos é importante promover pesquisas, regulamentar o cultivo, identificar princípios ativos, bem como, investigar a correlação entre os fatores que afetam a formação, o crescimento e as características medicinais das plantas[1].
Melissa officinalis L. (Lamiaceae), conhecida popularmente como erva-cidreira ou melissa, é de origem asiática e europeia, e cultivada em quase todo o Brasil[2]. É uma espécie regulamentada junto à Agência Nacional de Vigilância Sanitária (ANVISA), e em consequência disso, passa a ter sua demanda bastante aumentada[3]. A obtenção dessa planta adquire então uma grande importância, uma vez que haverá a necessidade de aumentar sua produção. A própria Política Nacional de Plantas Medicinais e Fitoterápicos (PNPMF) já indicava essa necessidade com o estabelecimento de diretrizes voltadas à parte agronômica das plantas medicinais.
Popularmente é utilizada para problemas respiratórios, cardiotônicos, antidepressivo, controlar doenças do sistema nervoso central e mental, como estresse, insônia e ansiedade[2,4,5]. Estes últimos aumentaram consideravelmente nos últimos anos, tornando-se doenças prevalentes que afetam uma grande porcentagem da população[6], a qual tem cada vez mais recorrido a plantas medicinais disponível que pode executar a mesma ação terapêutica com menos efeitos colaterais, dependência ou tolerância do que os medicamentos sintéticos[7].
O cultivo de melissa tem crescido em importância econômica no setor produtivo de plantas medicinais, devido ao elevado valor econômico que seus óleos voláteis têm alcançado no mercado, principalmente pelo baixo teor de princípios ativos[8]. Estudos evidenciam a presença de óleos voláteis ricos em citral (neral e geranial), os quais são na maioria das vezes responsáveis pelos efeitos sedativos[8], como citronelal e geraniol, além de mucilagens, taninos, saponinas, os quais são utilizados para produção de medicamentos, cosméticos, aromatizantes na culinária e em licores[9-12].
As condições de solo, clima, origem geográfica, época de colheita, adubação e horário de colheita podem afetar consideravelmente a produção e a qualidade dos óleos voláteis[7,13,14]. Experimentos têm demostrado que a adubação, a sazonalidade, a irradiação, o sombreamento e o espaçamento podem influenciar no rendimento da biomassa e na qualidade dos óleos voláteis em plantas aromáticas[2,15-24].
Neste sentido, visando aumentar o conhecimento agronômico da espécie M. officinalis e contribuir com as discussões das Políticas Nacionais de implantação de Plantas Medicinais e Fitoterápicos, voltadas à implementação da Fitoterapia no Sistema Único de Saúde, o objetivo desse trabalho foi avaliar o manejo e a época do ano apropriados para a colheita com melhor qualidade dos óleos voláteis. Para essa avaliação foi necessário analisar a produção de biomassa, o rendimento do óleo volátil e o teor dos constituintes majoritários de Melissa officinalis em função do manejo e da sazonalidade.
Material e Métodos
As mudas de melissa foram obtidas a partir da propagação por sementes comerciais. A produção das mudas foi conduzida em uma estufa, na Fazenda Experimental da Faculdade Integrada Cantareira – FIC, na Serra da Cantareira, Mairiporã, SP. As mudas foram produzidas e condicionadas em bandejas de poliestireno expandido de 200 células, preenchidas com substratos comerciais Biomix® (orgânico) e Tropstrato® (convencional). As mudas permaneceram em estufa por 60 dias após a semeadura e então foram transplantadas para vasos plásticos com capacidade de 0,1 m3 de solo e área de 0,5 m2. O espaçamento utilizado foi de 22,5 cm entre plantas. Em cada vaso foram plantadas três mudas em uma linha central com 90 cm de comprimento (FIGURA 1).

Os experimentos foram conduzidos de janeiro de 2013 a janeiro de 2014 numa área da Escola Municipal de Jardinagem (23°35'S, 46°39'O) do Departamento de Educação Ambiental e Cultura de Paz e da Universidade Aberta do Meio Ambiente e Cultura de Paz (DEA/UMAPAZ) que está localizada no Parque Ibirapuera, em São Paulo, SP (FIGURA 2).

A amostragem de solo foi realizada antes da instalação dos experimentos na faixa de 0 a 20 cm de profundidade, segundo metodologia da Embrapa[25]. A amostra coletada foi encaminhada para análises no laboratório do Centro de Apoio Tecnológico Cantareira – CEATEC, cujas análises granulométricas e químicas encontram-se na TABELA 1.
| Granulometria | |||||||
| argila | silte | areia total | areia grossa | areia fina | |||
| ------------------------------- g kg-1 ------------------------------- | |||||||
| 473 | 236 | 256 | 125 | 134 | |||
| Características químicas | |||||||
| pH(1) | MO(2) | H + Al(3) | K+ | Ca+2 | Mg+2 | SB(4) | CTC(5) |
| CaCl2 | g dm-3 | --------------------------- mmolc dm-3 --------------------------- | |||||
| 7,4 | 15 | 15 | 3,5 | 64 | 8 | 76 | 91 |
| P | S | B | Cu+2 | Fe+2 | Mn+2 | Zn+2 | V(6) |
| --------------------------------- mg dm-3 ---------------------------------- | % | ||||||
| 1 | 30 | 0,1 | 0,1 | 8 | 1 | 2,1 | 83 |
| Legenda: (1)Acidez ativa. (2)Matéria orgânica. (3)Acidez potencial. (4)Soma de bases. (5)Capacidade de troca catiônica efetiva. (6) Saturação por bases. | |||||||
A recomendação de adubação foi feita com base na análise do solo, utilizando o programa para Cálculo de Equilíbrio de Base e os nutrientes foram adequados na faixa mínima segundo Albrecht[26]. Como não existe recomendação de adubação para o cultivo de Melissa officinalis para o Estado de São Paulo, o modelo de recomendação seguiu os padrões do Boletim Técnico 100 do Instituto Agronômico de Campinas (IAC) para o cultivo da hortelã[27]. A melissa e a hortelã pertencem à mesma família, Lamiaceae, são perenes, herbáceas, possuem alturas semelhantes, se destacam na produção de óleos essenciais e não florescimento nas condições climáticas do Brasil, apresentam espaçamento semelhante e produção de biomassa. Além dessas características, possui aplicação no tratamento da ansiedade[28,29].
O modelo experimental utilizado foi em canteiros com delineamento inteiramente casualizados (DIC), segundo Costa[30], em esquema fatorial 2 x 3 x 4, sendo duas adubações (orgânica e convencional), três sistema de cultivo (controle, com e sem adição dos micronutrientes B, Cu, Mn, Zn e Mo) e quatro épocas de colheita (outono, inverno, primavera e verão) com quatro repetições (FIGURA 3).

Foram alocados nas parcelas: solo controle com as mudas do condicionamento orgânico e do condicionamento convencional (SL-1 e SL-2, respectivamente), solo com adubação orgânica (2 t ha-1 de cama de frango/30 t ha-1 de composto orgânico) com e sem adição de microelementos (SL-3 e SL-4) e solo com adubação convencional (30 t ha-1 de NPK, 6:14:8/30 t ha-1 de composto orgânico) com e sem adição microelementos (SL-5 e SL-6). As concentrações dos microelementos utilizadas nos experimentos foram: B (5,25 mg dm-3), Cu (7,5 mg dm-3), Mn (25 mg dm-3), Zn (9,5 mg dm-3) e Mo (0,125 mg dm-3).
A irrigação foi feita com aspersor giratório tipo espiga e a capina foi feita de forma manual sempre que necessária. As amostras foram coletas cortadas a 10 cm do solo e colhidas às 17 horas. A primeira colheita foi realizada em abril de 2013 (outono), a segunda colheita em julho de 2013 (inverno), a terceira colheita em outubro de 2013 (primavera) e a quarta colheita em janeiro de 2014 (verão). Os dados médios de precipitação, temperatura e insolação durante os meses de estudo foram obtidos da Estação Meteorológica do Instituto de Astronomia, Geofísica e Ciências Atmosféricas da USP – IAG/USP[31,32] e estão apresentados na FIGURA 4.

Neste período de cultivo da espécie (2013-2014), pode-se observar nos primeiros trimestres que antecedem a primeira colheita valores médios de temperatura, precipitação e insolação de 21°C, 188 mm e 146 h, respectivamente. O trimestre seguinte que antecede a segunda colheita tivemos 17°C, 84 mm e 132 h; terceiro trimestre valores de 18°C, 74 mm e 156 h e último trimestre que antecede a quarta colheita valores de 22°C, 158 mm e 193 h (FIGURA 4).
Após a colheita, as amostras de melissa foram acondicionadas em sacos de papel e levadas para o laboratório para o cálculo de biomassa fresca total da parte aérea. Em seguida, as folhas foram separadas para a extração dos óleos voláteis, acondicionadas em sacos plásticos e armazenadas, sob refrigeração de aproximadamente -20ºC[7], para posterior extração dos seus óleos, através da técnica de hidrodestilação em aparelho tipo Clevenger modificado, segundo a Farmacopeia Brasileira[33]. A exsicata da espécie encontra-se depositada no Herbário Municipal de São Paulo sob numeração PMSP 15923.
Para a extração, foram utilizados em média 28,5 ±10,7 g de folhas do sistema controle, 53,6 ± 11,6 g de folhas do sistema orgânico e 28,6 ± 12,3 g de folhas do sistema convencional. As folhas foram cortadas em pequenos pedaços e colocadas em balão de fundo redondo de capacidade de 1000 mL e foram adicionados 500 mL de água destilada. O período de extração foi de 4 horas após as primeiras gotas dos óleos voláteis condensarem. Ao final do processo, o óleo volátil foi coletado, acondicionado em "vial" de vidro e quantificado seu rendimento (R%), expresso em base úmida (biomassa fresca) considerando a relação entre a massa do óleo volátil (MOV) e da biomassa fresca (MBF), conforme fórmula R% = (MOV/MBF)x100[8,24] e mantido em freezer -15°C até a análise dos seus constituintes.
A análise qualitativa foi conduzida em cromatógrafo a gás acoplado ao espectrômetro de massas (GC/MS, Shimadzu, QP-5000), dotado de coluna capilar de sílica fundida OV - 5 (30 m x 0,25 mm x 0,25 μm, Ohio Valley Specialty Chemical, Inc.), operando a 70 eV, hélio como gás de arraste (1,7 mL min-1), com programa de temperatura: 60 a 120ºC em 3ºC min-1. O óleo volátil foi diluído em hexano e foi injetado 1 µL de solução. Os compostos majoritários neral, geranial e citronelal foram identificados a partir da comparação dos tempos de retenção dos componentes das soluções padrão (citronelal e citral, 95% - Sigma Aldrish®) e os constituintes citronelol, nerol, e geraniol foram identificados por meio da análise comparativa de seus índices de retenção linear obtido por meio da injeção de uma mistura padrão de n-alcanos (C7H16C40H82 Sigma Aldrich®, 98%) e dados da literatura[34-36].
Os resultados apresentados correspondem à média de quatro determinações para cada um dos seis tratamentos. Foram feitas análises de variância (com teste F), testes de média (t-Student e Tukey a 95% de confiança) e análises multivariadas (Análise de Agrupamento Hierárquico e Análise de Componente Principal). A fim de evitar interferências das unidades de medida nas análises de componentes principais e de agrupamento, os dados foram padronizados, obtendo-se média = 0 e variância = 1, segundo Arumungam[37]. Para realização das análises estatísticas foi utilizado o software Statistica 7.0[38] e para construção das estruturas químicas foi utilizado o software ACD/ChemSketch[39].
Resultados e Discussão
Os compostos químicos estudados foram os aldeídos monoterpênicos (citronelal, neral e geranial) e os álcoois monoterpênicos (citronelol, nerol e geraniol) (FIGURA 5).

Na FIGURA 6 está apresentada a sobreposição dos cromatogramas das soluções padrão, no qual se verifica um pico com tempo de retenção de 12,62 minutos para o padrão de citronelal; um pico com tempo de retenção de 16,49 minutos, correspondente ao neral; e outro pico com tempo de retenção de 17,82 minutos, correspondente ao geranial.

A produção de biomassa, o teor dos compostos majoritários do óleo essencial e o rendimento do óleo essencial de melissa foram analisados em função da adubação e da sazonalidade.
Os resultados de biomassa (BM) em função do manejo agrícola foram submetidos à análise de agrupamento hierárquico (FIGURA 7). Atribuindo-se o valor 20 para a distância de ligação (Dlig) no dendrograma, foi possível identificar três grupos.

Na FIGURA 8 são apresentadas, em Box-Plot, as médias e amplitudes das biomassas frescas totais (em grama) de melissa submetidas aos diferentes manejos e épocas do ano. Observou-se que, as biomassas frescas dos manejos orgânico e convencional foram superiores ao controle para todas as épocas do ano coletadas. De acordo com a literatura [40,41], a aplicação de matéria orgânica aumenta a capacidade de retenção de água, promove à redução da densidade aparente, o aumento da porosidade total, forma agregados capazes de reduzir a erosão e aumenta a capacidade de absorção do solo.

Os resultados da análise de variância (ANOVA) e os valores médios estão apresentados na TABELA 2. Para os manejos aplicados foi encontrada diferença significativa (p<0,05) para a biomassa, a qual apresentou maior produção média no manejo orgânico em relação ao manejo convencional. Estes resultados estão de acordo com trabalhos na literatura [16,42], que mostram que o cultivo de melissa apresentou bom desenvolvimento e produtividade em resposta à adubação orgânica em relação à adubação convencional.
| Fontes de variação | GL1 | Biomassa | Rendimento | Citronelal | Neral | Geranial | Citronelol | Nerol | Geraniol |
| ---------------------------- Quadrados médios ---------------------------- | |||||||||
| Manejo | 2 | 160283* | 0,0001ns | 809* | 51ns | 120ns | 848* | 2,8ns | 25,5ns |
| Sazonalidade | 3 | 2186ns | 0,002* | 2514* | 1090* | 2140* | 1764* | 2,9ns | 91,8* |
| Manejo x Sazonalidade2 | 5 | 8747* | 0,00008ns | 255ns | 112* | 247* | 796* | 1,8ns | 26,0ns |
| Manejos | Médias (%), exceto biomassa (em g m-2) | ||||||||
| Controle | 60,9b | 0,02a | 19,9a | 32,8a | 48,5a | 3,0b | 1,8a | 4,4a | |
| Orgânico | 632,7a | 0,02a | 5,1b | 33,8a | 50,8a | 17,5a | 1,4a | 4,4a | |
| Convencional | 310,7c | 0,02a | 13,3ab | 31,1a | 53,9a | 4,7b | nd | 2,7a | |
| Sazonalidade | |||||||||
| Outono | 374,9a | 0,02b | 1,7b | 33,9a | 55,5a | 1,8b | 0,8a | 5,0a | |
| Inverno | 353,6a | 0,003c | 32,3a | 16,9b | 30,9b | 25,0a | 4,4a | 8,8a | |
| Primavera | 304,2a | 0,02b | 8,9b | 35,7a | 54,1a | 1,0b | 1,4a | 0,6b | |
| Verão | 306,3a | 0,04a | 2,1b | 37,5a | 59,3a | 0,4b | 0,1a | 1,2b | |
| Média | 345,5 | 0,02 | 12,7 | 31,3 | 51,2 | 6,9 | 1,7 | 4,4 | |
| cv | 72352 | 0,0003 | 146 | 84 | 162 | 213 | 5 | 28 | |
| Literatura | 449-2416 [43,44] | 0,02-0,48 [6,8,9,17,20,23,45,46] | 2-40 [6,12,43,46] | 4-60 [6,43,47] | 6-45 [6,43,47] | 3,9-8,5 [43] | 0,53-4,39 [8] | 0,3-1,6 [43,47] | |
| KIlit. | 1153 | 1240 | 1270 | 1226 | 1228 | 1255 | |||
| KIcalc. | 1154 | 1250 | 1282 | 1224 | 1229 | 1260 | |||
| Legenda: *Significativo a 5%. nsnão significativo. Médias seguidas de mesma letra não diferem entre si, pelo teste de Tukey, a 5% de probabilidade. 1Graus de liberdade. 2Interação manejo x sazonalidade. nd – não determinado. KIlit. – Indice de Kovats na literatura, Adams [35]. KIcalc. – Indice de Kovats calculado. | |||||||||
O rendimento médio para biomassa variou de 632,7 g m-2 (adubação orgânica) para 310,7 g m-2 (adubação convencional). Não há muitas pesquisas a respeito de cultivo orgânico de Melissa officinalis. De acordo com Seider-Lozykowska et al.[43], o rendimento de biomassa fresca variou de 449-2416 g m-2. Zorovski[44] reportou o rendimento de biomassa fresca entre 918-989 g m-2.
O manejo agrícola não influenciou nos rendimentos dos óleos voláteis extraídos. Resultados semelhantes foram apresentados por Sodré[20], no qual, o rendimento de óleo volátil não apresentou diferença significativa entre os sistemas adubados e os controles. O rendimento de óleo volátil encontrado no nosso estudo (0,02-0,04%) está de acordo com aqueles reportados na literatura[6,8,9,17,20,23,45,46]. Algumas espécies da família Lamiaceae apresentam variação nos rendimentos dos óleos voláteis, como o manjericão, já outras espécies são indiferentes à adubação, como o tomilho. Esta divergência nas observações reflete a diversidade de fatores que influenciam o metabolismo vegetal, que é resultado da interação de fatores genéticos, bióticos e abióticos, podendo ainda, um fator prevalecer sobre o outro [48].
Os teores dos constituintes neral, geranial, nerol e geraniol não apresentaram diferença significativa entres os manejos aplicados, por outro lado, o manejo orgânico apresentou a menor concentração de citronelal e a maior concentração de citronelol (p<0,05). Resultados semelhantes foram encontrados por Luz[16]. Os resultados dos teores médios dos constituintes citronelal, neral e geranial estão de acordo com a literatura[6,12,43,47].
A produção de biomassa não sofreu influência da sazonalidade. A sazonalidade influenciou de maneira significativa (p<0,05) o rendimento do óleo volátil e o teor de citronelal, neral, geranial, citronelol e geraniol. No inverno as amostras de melissa apresentaram os menores rendimentos (0,003%), concordando com os resultados de Silva[49] e que obteve rendimento insuficiente para a época do inverno. E no verão foram obtidos os maiores rendimentos (0,04%), valores próximos ao mínimo de teor de óleo volátil, que deve ser 0,05% para a espécie[6]. Seider-Lozykowska et al.[46] reportaram que o aumento da temperatura média influenciou positivamente no rendimento do óleo volátil. Maiores e menores temperaturas médias foram observadas nas 4ª e 2ª colheitas, respectivamente (FIGURA 4).
Efeito da sazonalidade sobre os óleos voláteis de melissa também foram ilustrados (FIGURA 9).
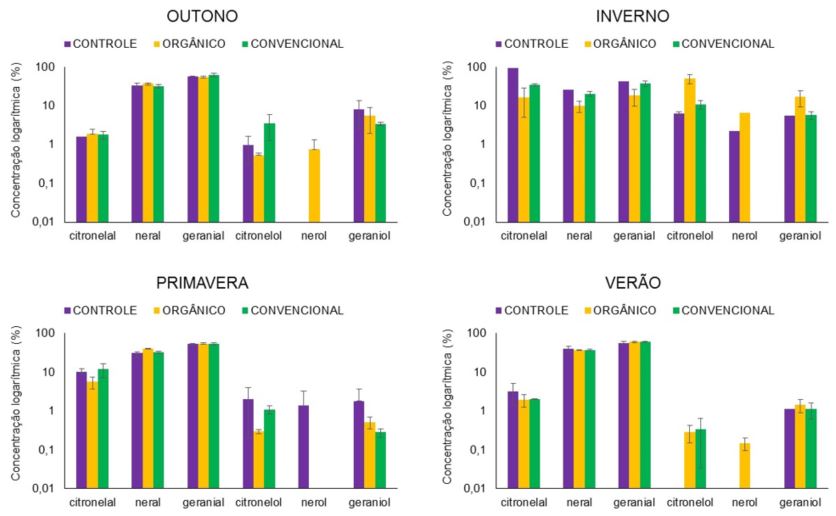
As colheitas no outono, primavera e verão proporcionaram ganho nos teores dos constituintes majoritários (neral e o geranial) e menores teores dos constituintes citronelol, nerol e geraniol. Fator importante ao se considerar um óleo comercial, cuja a exigência seja apresentar em sua composição química neral, geranial e citronelal como majoritários, e preferencialmente, a ausência de alcoóis terpênicos, tais com citronelol, nerol e geraniol[11]. No entanto, na colheita do inverno houve diminuição no teor de neral e geranial, e aumento de citronelal, citronelol, nerol e geraniol. Estes resultados estão de acordo com Luz[16], Silva[49] e Furlan[50]. Seider-Lozykowska et al.[46] reportaram que o aumento da insolação afetou positivamente a concentração de citral. Maiores insolações médias foram observadas nas 1ª,3ª e 4ª colheitas (FIGURA 4).
As interações entre os fatores manejo x sazonalidade e as variáveis biomassa, neral, geranial e citronelol são ilustradas na FIGURA 10.

A produção de biomassa foi maior no tratamento orgânico e menor no convencional na colheita do outono. O manejo orgânico apresentou menores teores de neral e geranial e maiores teores de citronelol, na colheita do inverno.
Os dados obtidos foram submetidos à análise de componente principal (PCA). Observa-se na FIGURA 11, que as duas primeiras componentes, PC1 e PC2, permitiram uma explicação de 52%.

A PC1 explica 34,58% da variância dos dados e a análise conjunta permite inferir que os compostos majoritários neral e geranial, e o teor do óleo volátil estão melhores correlacionados possuindo valores acima de 0,7. Há uma pequena correlação de 0,5 para a época do verão. No verão houve um aumento, em média, no rendimento do óleo volátil. Por outro lado, estes compostos estão inversamente correlacionados com o inverno e com o manejo orgânico, os quais apresentaram as menores concentrações, conforme visto na FIGURA 10. Os compostos citronelol, nerol, geraniol e a época do inverno estão mais bem correlacionados com valores acima de 0,6 e há uma pequena correlação de 0,3 com o manejo orgânico. Observou-se que no inverno houve aumento na produção dos compostos citronelol e geraniol; e o composto citronelol apresentou produção, em média, maior no manejo orgânico. A PC2 explica 17,39% da variância dos dados e pode-se observar que o manejo orgânico está correlacionado diretamente com a produção de biomassa (0,9) e inversamente com a produção de citronelal (-0,6). Este composto apresentou, em média, maiores concentrações no manejo controle e convencional e menor concentração no manejo orgânico. Análise de Componente Principal (PCA) também indicou relação entre diferentes fertilizações em Lippia origanoides[51] e Dracocephalum moldávica[52] e a sazonalidade em Rosmarinus officinalis[53] e os compostos do óleo volátil.
Os cromatogramas dos óleos voláteis de melissa em função do sistema controle, orgânico e convencional estão apresentados na FIGURA 12.

Conclusão
O cultivo de Melissa officinalis responde à adubação orgânica com esterco aviário e à adubação convencional para a produção de biomassa. A adubação convencional apresentou-se mais apropriada para produção dos constituintes majoritários citronelal, neral e geranial no óleo volátil de melissa quando cultivadas nas épocas do outono, da primavera e do verão. No entanto, sob a perspectiva de implementação da Fitoterapia no SUS, há necessidade de se expandir os estudos, envolvendo maior número de coletas, extrações, umidade relativa, regime de ventos, horário de colheita, espessura da folha e, ainda, a localização dos óleos voláteis em diferentes órgãos da mesma planta.
Fontes de Financiamento
Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (Processo nº 141977/2012-4).
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo financiamento desta pesquisa e ao IPEN-CNEN/SP. Ao Prof. Marcos Victorino, aos colaboradores do Herbário Municipal de São Paulo, da Escola de Jardinagem e da Secretaria do Verde e do Meio Ambiente pelo suporte com nosso estudo.
Colaboradores
Concepção do estudo: FVS; PSCS
Curadoria dos dados: FVS; MRF; PSCS
Coleta de dados: FVS
Análise dos dados: FVS; MRF; PSCS
Redação do manuscrito original: FVS
Redação da revisão e edição: MRF; PSCS.
Referências
1. Brasil. Ministério da Saúde. Programa Nacional de Plantas Medicinais e Fitoterápicos. Brasília; 2009. ISBN: 978-85-334-1597-3. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/programa_nacional_plantas_medicinais_fitoterapicos.pdf]. [acesso em: 23 mar. 2022].
2. Miraj S, Kopaei R, Kiani S. Melissa officinalis L.: a review study with an antioxidant prospective. J Evid Based Compl Altern Med. 2017; 22(3): 385-394 [https://doi.org/10.1177/2156587216663433].
3. Brasil. Agência Nacional de Vigilância Sanitária - RDC nº 10, de 9 de março de 2010. Dispõe sobre a notificação de drogas vegetais junto à Agência Nacional de Vigilância Sanitária (ANVISA) e dá outras providências. D.O.U - Diário Oficial da União, Brasília, 10 mar. 2010; Seção 1, p.52-59. [https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/res0010_09_03_2010.html].
4. Sodré ACB, Luz JMQ, Haber LL, Marques MOM, Rodrigues CR, Blank AF. Organic and mineral fertilization and chemical composition of lemon balm (Melissa officinalis) essential oil. Braz J Pharmacogn. 2011; 22(1): 40-44. [https://doi.org/10.1590/S0102-695X2011005000186].
5. Katar D, Katar N, Aydin D. Determination of yield and essential oil composition of different lemon balm (Melissa officinalis L.) genotypes. Turk J Field Crops. 2021; 26(2): 210-217. [https://doi.org/10.17557/tjfc.1036637].
6. Petenatti ME, Petenatti EM, del Vitto LA, Téves MR, Caffini NO, Marchevsky EJ et al. Evaluation of macro and microminerals in crude drugs and infusions of five herbs widely used as sedatives. Braz J Pharmacogn. 2011; 21(6): 1144-1149. [https://doi.org/10.1590/S0102-695X2011005000129].
7. Pandey AK, Savita. Harvesting and post-harvest processing of medicinal plants: Problems and prospects. Pharma Innovation. 2017; 6(12): 229-235. [https://www.thepharmajournal.com/archives/2017/vol6issue12/PartD/6-11-73-833.pdf]. [acesso em: 25 mar. 2022].
8. Silva TC, Bertolucci SKV, Carvalho AA, Tostes WN, Alvarenga ICA, Pacheco FV et al. Macroelment omission in hydroponic systems changes plant growth and chemical composition of Melissa officinalis L. essential oil. Jarmap. 2021; 24(12): 100297. [https://doi.org/10.1016/j.jarmap.2021.100297].
9. Özyigit Y, Uçar E, Tütüncü B, İndibi I, Turgut K. The Effect of Different Nitrogen Doses on Yield and Some Yield Components of Melissa officinalis subsp. L. altissima (Sibthr. et Smith) Arcang. Turk L Agric Res. 2016; 3(2): 139-144. [https://www.researchgate.net/publication/316258531].
10. Salamon I, Kryvtsova MV, Trush KI, Fandalyuk AI, Spivak MJ. Agro-ecological cultivation, secondary metabolite characteristics and microbiological tests of lemon balm (Melissa officinalis) - the variety Citronella. Regulat Machan Biosyst. 2019; 10(2): 264-268. [https://doi.org/10.15421/021940].
11. Blank AF, Fontes SM, Oliveira AS, Mendonça MC, Silva-Mann R, Arrigoni-Blank MF. Produção de mudas, altura e intervalo de corte em melissa. Hortic Bras. 2005; 23(3): 780-784. [https://doi.org/10.1590/S0102-05362005000300018].
12. García-Risco MR, Mouhid L, Salas-Pérez L, López-Padilla A, Santoyo S, Jaime L et al. Biological Activities of Asteraceae (Achillea millefolium and Calendula officinalis) and Lamiaceae (Melissa officinalis and Origanum majorana) Plant Extracts. Plant Foods Hum Nutr. 2017; 72: 96-102. [https://doi.org/10.1007/s11130-016-0596-8].
13. Sales JF, Pinto JEBP, Botrel PP, Silva FG, Correa RM, de Carvalho JG. Acúmulo de massa, teor foliar de nutrientes e rendimento de óleo essencial de hortelã-do-campo (hyptis marrubioides EPL.) cultivado sob adubação orgânica. Biosci J. 2009; 25(1): 60-68. [https://seer.ufu.br/index.php/biosciencejournal/article/view/6785].
14. Blank AF, Fontes SM, Filho JLSC, Alves PB, Silva Mann R, Mendonça MC et al. Influência do horário de colheita e secagem de folhas no óleo essencial de melissa (Melissa officinalis L.) cultivada em dois ambientes. Rev Bras Pl Med. Botucatu. 2005; 8 (1): 73-78. Disponível em: [https://www1.ibb.unesp.br/Home/Departamentos/Botanica/RBPM-RevistaBrasileiradePlantasMedicinais/artigo14_v8_n1.pdf]. [acesso em: 25 mar. 2022].
15. Brant RS, Pinto JEBP, Rosa LF, Albuquerque CJB, Ferri PH, Corrêa RM. Crescimento, teor e composição do óleo essencial de melissa cultivada sob malhas fotoconversoras. Ciênc Rural. 2009; 39(5): 1401-1407. ISSN 0103-8478. [https://doi.org/10.1590/S0103-84782009005000083].
16. Luz JMQ, Silva SM, Habber LL, Marquez MOM. Produção de óleo essencial de Melissa officinalis L. em diferentes épocas, sistemas de cultivo e adubações. Rev Bras Pl Med. 2014; 16(3): 552-560. [https://doi.org/10.1590/1983-084X/11_130].
17. Meira MR, Martins ER, Manganotti SA. Crescimento, produção de fitomassa e teor de óleo essencial de melissa (Melissa officinalis L.) sob diferentes níveis de sombreamento. Rev Bras Pl Med. 2012; 14(2): 352-357. [https://doi.org/10.1590/1983-084X/11_130].
18. Aoyama EM, Indriunas A, Furlan MR. Produção de folhas em Melissa officinalis L. (Lamiaceae) em Taubaté, São Paulo. Rev Biociênc. 2011; 17(1): 57- 65. ISSN 14157411. Disponível em: [http://periodicos.unitau.br/ojs/index.php/biociencias/article/view/1239]. [acesso em: 25 mar. 2022].
19. Wanderer M, Franke LB, Barros IBI. Germinação de sementes de melissa com diferentes origens. Rev Bras Agroecol. 2007; 2(1): 1114-1117. Disponível em: [https://revistas.aba-agroecologia.org.br/rbagroecologia/article/view/6494]. [acesso em: 25 mar. 2022]:
20. Sodré ACB, Haber LL, Luz JMQ, Marques MOM, Rodrigues CR. Adubação orgânica e mineral em melissa. Hortic Bras. 2013; 31(1): 147-152. Disponível em: [http://www.abhorticultura.com.br/biblioteca/arquivos/Download/Biblioteca/pmse5011c.pdf] [acesso em: 19 mar. 2022].
21. Santos MF, Mendonça MC, Carvalho Filho JLS, Dantas IB, Silva-Mann R, Blank AF. Esterco bovino e biofertilizante no cultivo de erva-cidreira-verdadeira (Melissa officinalis L.). Rev Bras Pl Med. 2009; 11(4): 355-359. [https://doi.org/10.1590/S1516-05722009000400001].
22. Gomes EN, Moretele D, Biasi LA, Koehler HS, Kanis LA, Deschamps C. Pant densities and hearvest times on productive and physilogical aspects of Stevia rebaudiana Bertoni grown in southern Brazil. An Acad Bras Cienc. 2018; 90(4): 3249-3264. [http://dx.doi.org/10.1590/0001-3765201820170510].
23. Katar D, Gürbüz B. The effect of different plant densities and nitrogen doses on drug leaf yield and some features of lemon balm (Melissa officinalis L.). J Agric Sci. 2008: 14(1): 78-81. Disponível em: [https://dergipark.org.tr/en/download/article-file/1509442]. [acesso em: 19 mar. 2022].
24. Elguy LGP, Trevisan ACD, Coelho MP, Oliveira YEC, Madureira LAS. Manejo de biomassa e compostos majoritários de óleos essenciais de espécies do Bioma Pampa. Rev Fitos. 2021; 15(3): 333-345. [https://doi.org/10.32712/2446-4775.2021.1065].
25. Donagema GK, de Campos DVB, Calderano SB, Teixeira WG, Viana JHM. Manual de métodos de análise de solos. 2ª edição. Embrapa Solos; 2011. ISSN 1517-2627.
26. Albrecht WA. Soil reaction (pH) and balanced plant nutrition. Colorado: Western Soils Company; 1967.
27. Raij BV, Cantarella H, Quaggio JÁ, Furlani AMC. Recomendações de adubação e calagem para o Estado de São Paulo. 2nd ed. Campinas, IAC; 1997. ISSN 0100-3100.
28. Santos RS, Silva SS, Vasconcelos TCL. Aplicação de plantas medicinais no tratamento da ansiedade: uma revisão da literatura. Braz J Dev. 2021; 7(5): 52060-52074. [https://doi.org/10.34117/bjdv7n5-550].
29. Meira M, Souza S, Martins E. Plantas medicinais, produção e cultivo da Melissa officinalis no brasil. EnciBio. 6(10). Disponível em: https://conhecer.org.br/ojs/index.php/biosfera/article/view/4680. [acesso em: 21 jul. 2022].
30. Costa JR. Técnicas Experimentais aplicadas às Ciências Agrárias. Embrapa Agrobiologia; 2003. 120 p. ISSN 1517-8498.
31. Boletim Climatológico Anual da Estação Meteorológica do IAG/USP/ Seção Técnica de Serviços Meteorológicos – Instituto de Astronomia, Geofísica e Ciências Atmosféricas da Universidade de São Paulo. Disponível em: [http://www.estacao.iag.usp.br/Boletins/2013.pdf]. [acesso em: 25 mar. 2022].
32. Boletim Climatológico Anual da Estação Meteorológica do IAG/USP/ Seção Técnica de Serviços Meteorológicos – Instituto de Astronomia, Geofísica e Ciências Atmosféricas. Universidade de São Paulo - USP. Disponível em: [http://www.estacao.iag.usp.br/Boletins/2014.pdf]. [acesso em 25 mar. 2022].
33. Brasil. Farmacopeia Brasileira. 6ª ed. Brasília; 2022. Disponível em: [https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/farmacopeia-brasileira]. [acesso em: 25 mar. 2022].
34. McLafferty FW, Stauffer DB. Registry of Mass Spectral Data. 2nd ed. New York: Wiley- Interscience; 1989. ISBN: 9780471628866
35. Adams RP. Identification of Essential Oil Components by Gas Cromatography/Mass Spectroscopy. 4th ed. Carol Stream: Allured Pub Corp; 2007.
36. Viegas MC, Bassoli DG. Utilização do índice de retenção linear para caracterização de compostos voláteis em café solúvel utilizando GC-MS e coluna HP-innowax. Quim Nova. 2007; 30(8): 2031-2034. [https://doi.org/10.1590/S0100-40422007000800040].
37. Arumugam R, Kannan RRR, Jayalakshmi J, Manivannan K, Karthikai Devi G, Anantharaman P. Determination of element contents in herbal drugs: Chemometric approach. Food Chem. 2012; 135(4): 2372-2377. [https://doi.org/10.1016/j.foodchem.2012.07.040].
38. StatSoft, Inc. 2004. STATISTICA (data analysis software system). Version 7.
39. ACD Chemsketch 2012. Versão 12.0. Desenvolvimento de Química Avançada, 2012.
40. Alleoni LRF, de Beauclair EGF. Cana-de-açúcar cultivada após milho e amendoim, com diferentes doses de adubo. Sci Agric. 1995; 52(3): 409-415. [https://doi.org/10.1590/S0103-90161995000300001].
41. Chagas JH, Pinto JEBP, Bertolucci SKV, Santos FM, Botrel PP, Pinto LBB. Produção da hortelã-japonesa em função da adubação orgânica no plantio e em cobertura. Hortic Bras. 2011; 29(3): 412-417. [https://doi.org/10.1590/S0102-05362011000300026].
42. Sousa AH, Maracajá PB, Junior JCS, Vasconcelos EW, Maia CE. Produção de biomassa na parte aérea da erva cidreira (Melissa ssp.) em função de doses de esterco bovino, húmus de minhoca, composto orgânico e NPK em casa de vegetação. Rev Biol Ciênc Terra. 2003; 3(2): 10. ISSN 1519-5228. [https://www.redalyc.org/articulo.oa?id=50030207].
43. Seidler-Lozykowska K, Mordalski R, Kucharski W, Kedzia E, Nowosad K, Bocianowski J. Effect of organic cultivation on yield and quality of lemon balm herb (Melissa officinalis L.). Acta Sci Pol Hortorum Cultus. 2015; 14(5): 55-67. [https://czasopisma.up.lublin.pl/index.php/asphc/article/view/2618].
44. Zorovski P, Popov V, Gerogieva T. Development and production of fresh and dried leaf biomass of lemon balm (Melissa officinalis) under organic fertilizers treatment. Sci Paper Ser A Agron. 2020; 63(2): 253-260. ISSN 2285-5785. [http://agronomyjournal.usamv.ro/index.php/scientific-papers/past-issues?id=1181].
45. Ayanoglu F, Arslan M, Hatay A. Effects of Harvesting Stages, Harvesting Hours and Drying Methods on Essential Oil Content of Lemon Balm Grown in Eastern Mediterranean. Int J Bot. 2005; 1(2): 138-142. [https://doi.org/10.3923/ijb.2005.138.142].
46. Seidler-Lozykowska K, Zawirska-Wojtasiak R, Wojtowicz E, Bocianowski J. Essential oil content and its coposition in herb of lemon balm (Melissa officinalis L.) breeding strains. J Essent Oil Res. 2017; 29(4): 351-356 [https://doi.org/10.1080/10412905.2016.1278407].
47. Mokhtarzadeh S, Demirci B, Goger G, Khawar KM, Kirimer N. Characterization of volatile components in Melissa officinalis L. under in vitro conditions. J Essent Oil Res. 2016; 29(4): 299-303. [https://doi.org/10.1080/10412905.2016.1216900].
48. Duarte AR. Variabilidade química dos óleos essenciais e do teor de fenóis em folhas e frutos da jabuticabeira (Myrciaria cauliflora). 83f. Goiânia. 2012. Tese de Doutorado [Programa de Pós-graduação em Química] – Instituto de Química. Universidade Federal de Goiás-UFG. Goiânia. 2012. [https://repositorio.bc.ufg.br/tede/bitstream/tde/1024/1/Tese-AlessandraRodriguesDuarte.pdf].
49. Silva SM. Sistema e época de cultivo na produção agronômica e de óleo essencial de Melissa officinalis. 48f. Belo Horizonte; 2011. Dissertação de Mestrado [Programa de Pós Graduação em Agronomia] - Universidade Federal de Uberlândia-UFU. Belo Horizonte, MG. 2011. [https://repositorio.ufu.br/handle/123456789/12148].
50. Furlan MR, Martins RCC, Rodrigues E, Scalco N, Negri G, Lago JHG. Variação dos teores de constituintes voláteis de Cymbopogon citratus (DC) Staf, Poaceae, coletados em diferentes regiões do Estado de São Paulo. Braz J Pharmacogn. 2010; 20 (5): 686-691. [https://doi.org/10.1590/S0102-695X2010005000026].
51. Teles S, Pereira JA, de Oliveira LM, Malheiro R, Machadoc SS, Lucchesec AM et al. Organic and mineral fertilization influence on biomass and essential oil production, composition and antioxidant activity of Lippia origanoides H.B.K. Ind Crops Prod. 2014; 59: 169-176. [https://doi.org/10.1016/j.indcrop.2014.05.010].
52. Nasiri Y. Crop productivity and chemical compositions of dragonhead (Dracocephalum moldavica L.) essential oil under different cropping patterns and fertilization. Ind Crops Prod. 2021; 171: 113920. [https://doi.org/10.1016/j.indcrop.2021.113920].
53. Rathore S, Mukhia S, Kapoor S, Bhatt V, Kumar R, Kumar R. Seasonal variability in essential oil composition and biological activity of Rosmarinus officinalis L. accessions in the western Himalaya. Sci Rep. 2022; 12(3305): [https://doi.org/10.1038/s41598-022-07298-x].