FARMACOLOGIA/PHARMACOLOGY
Canavalia ensiformis (L.) DC (Fabaceae)
Resumo
A Canavalia ensiformis é uma leguminosa com ampla distribuição tropical. É bastante utilizada em agricultura como cobertura verde para enriquecer o solo de nutrientes. Devido ao seu elevado valor nutricional suas sementes são empregadas na alimentação do gado e suas folhas na alimentação humana. Ela é bastante resistente às variações das condições ambientais, insetos e microorganismos. Seus principais componentes biologicamente ativos são proteínas, peptídeos, enzimas ou derivados de aminoácidos e dentre os quais é importante chamar a atenção para concanavalina A, urease, canatoxina, jaburetox, serino-proteases e L-canavanina / L-canalina. Estes compostos apresentam importantes funções bioquímicas e suas atividades biológicas têm sido objeto de intensas investigações. Além disso, estes principais componentes purificados de sementes de C. ensiformis exercem importantes efeitos farmacológicos, auxiliando assim na compreensão da fisiologia dos organismos, como também no tratamento de diversas patologias.
- Palavras chave:
- Canavalia ensiformis.
- feijão-de-porco.
- constituintes químicos.
- efeitos farmacológicos.
Abstract
Canavalia ensiformis is a widely distributed tropical legume. It is extensively used in agriculture as a green cover for the nutritional enrichment of soils. Due to the high nutritional values the seeds are used to feed cattle and the leaves are food for humans. It is quite resistant to changes in environmental conditions, insects and microorganisms. The major compounds of C. ensiformis are biologically active proteins, peptides, enzymes or amino acid derivatives. Among these compounds it is important to mention concanavalin A, ureases, canatoxin, jaburetox, serine proteases, glycosidases and L-canavanina/L-canalina. These compounds play important biochemical roles in the plant and, their activities have been the subject of intense investigations. In addition, these major compounds extracted from seeds of C. ensiformis have important pharmacological effects, thereby aiding in the understanding of physiology of organisms and in the treatment of various pathologies.
- Keywords:
- Canavalia ensiformis.
- jack bean.
- chemical constituents.
- pharmacological effects.
Introdução
A Canavalia ensiformis (L.) DC, conhecida como feijão-de-porco ou "jack bean" em inglês, é uma planta arbustiva, que pertence à família Fabaceae. O gênero Canavalia Adans por sua vez, compreende cerca de 70 a 75 espécies de plantas nativas de várias regiões do Novo Mundo. A C. ensiformis é de origem centro-americana, bastante cultivada em regiões tropicais e subtropicais de todo o mundo. É encontrada em estado silvestre nas Antilhas e nas zonas africanas e asiáticas. É uma leguminosa anual ou bianual, herbácea, muito rústica, rasteira, apresentando um crescimento ereto e determinado de inicio lento podendo atingir 1,2 m de altura e é amplamente cultivada nos países tropicais como cobertura verde. Suas folhas são alternadas, trifolioladas com folíolos grandes elíptico-ovais, de cor verde-escura brilhante, com nervuras bem salientes. Suas inflorescências são axilares em racemos grandes e suas flores são grandes, com corola de cor violácea ou roxa. Suas vagens são achatadas, largas e compridas, coriácea, bivalvas com estrias longitudinais e possui de 4 a 18 sementes. Estas sementes são grandes, de forma arredondada-ovalada, de cor branca ou rosada com hilo oblongo de cor parda, rodeado de uma zona de cor castanha, com uma lingüeta de cor branca (Rodrigues, 2004).
Esta espécie é resistente às altas temperaturas e à seca, mas não suporta as geadas e é tolerante ao sombreamento parcial. Desenvolve-se bem em solos ácidos e adapta-se praticamente a todos os tipos de solos (argilosos, arenosos), inclusive aqueles pobres em fósforo. A planta é excepcionalmente resistente ao ataque de insetos, esta resistência é atribuída à presença de metabólitos secundários, como a canavanina (Rosenthal e Dahlman, 1986) e às uréases e seus metabólitos (Stanisçuaski e Carlini, 2012). A C. ensiformis é também utilizada como adubação verde e no controle à erosão. O seu plantio pode ser solteiro ou consorciado com milho, café, citrus e outras culturas. É uma planta que cobre bem o solo e apresenta importante efeito alelopático às invasoras, atuando eficientemente no controle de ervas daninhas como a tiririca (Cyperus rotundus). Tem convivido, sem maiores problemas, com a presença de viroses. É hospedeira da mosca-branca (Bemisia tabaci), transmissora do vírus do mosaico dourado do feijoeiro e de outras viroses do feijoeiro comum Wutke e colaboradores, (2007).
Desde as épocas pré-colombianas a C. ensiformis foi cultivada como alimento humano e de animais domésticos. Nos dias atuais também é considerada comestível: suas folhas são usadas como verdura, e suas sementes são cozidas como feijão comum, embora tenham que passar por tratamento prévio para eliminar as várias toxinas da planta. Seu valor nutricional é muito grande, pois possui cerca de 300g de proteínas e 600g de carboidratos por quilo de semente, além de possuir excelentes características agronômicas (Udedibie e Carlini, 1998).

Principais substâncias isoladas
Estudos fitoquímicos demonstraram a presença de diversas biomoléculas derivadas do metabolismo secundário ou especial, particularmente em folhas e sementes de C. ensiformis, como os polifenóis, taninos condensados, fitatos (Agbede e Aletor, 2005), flavonóides como demetilptercarpanos (Lampard, 1974), alcalóides, glicosídeos cianogênicos, saponinas e terpenóides (Udedibie e Carlini, 1998). Além disso, várias outras substâncias do metabolismo primário foram também isoladas, purificadas e dentre elas os mais diversos tipos de carboidratos, especialmente as hemiceluloses e heteropolissacarídeos (Ghali, Youssef e Abdel Mobdy, 1974) e lipídeos com ácidos graxos de cadeia longa (Sridhar e Seena, 2006). Contudo, o que sempre chamou a atenção dos estudiosos de C. ensiformis, foi o expressivo conteúdo de proteínas e seus derivados em seus órgãos, e a grande diversidade de suas respectivas funções. Enzimas, glicoproteínas, polipeptídeos e compostos provenientes do metabolismo de aminoácidos são os mais importantes componentes da C. ensiformis. Tais moléculas têm sido extensiva mente estudadas e dentre elas podemos destacar a concanavalina A, ureases, canotoxina, jaburetox-2Ec, proteases, N-glicanases, α-manosidase e L-canavanina / L-canalina. Este trabalho tem como objetivo comentar sobre as principais características químicas destas substâncias e também de suas propriedades farmacológicas.
Concavalina A
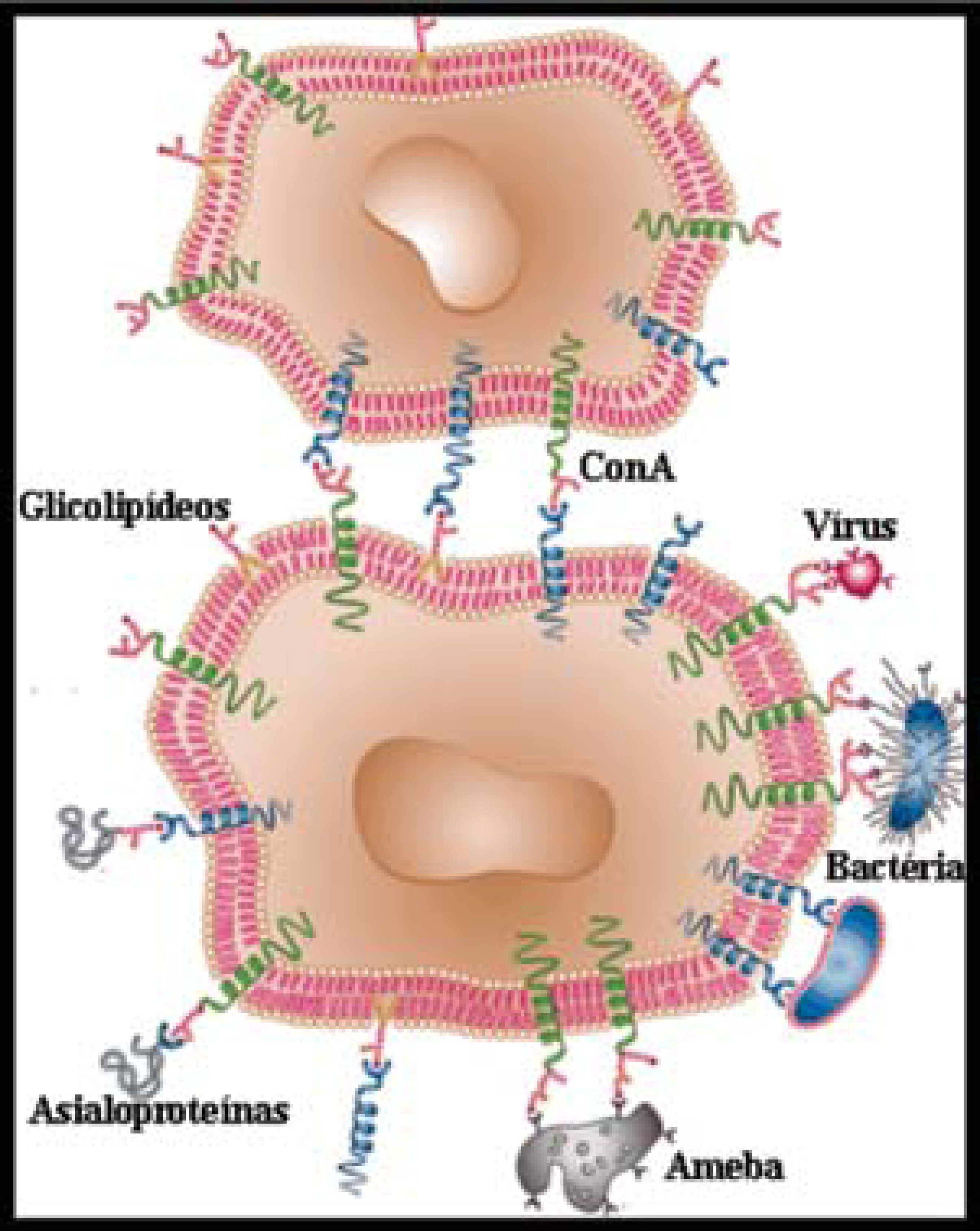
Aconcanavalina A(ConA) é a substância mais conhecida e estudada de C. ensiformis e, é também uma das proteínas mais investigadas da natureza. É uma glicoproteína de 110 kDa formada por quarto subunidades idênticas de 27 kDa unidas por pontes de hidrogênio e eletrostáticas Kanellopoulos e colaboradores, (1996). Foi a primeira hemaglutinina ou lectina de planta isolada e também a primeira lectina comercializada. É amplamente usada para caracterizar glicoproteínas e outros compostos glicosilados na superfície de células, para purificar macromoléculas contendo açucares por cromatografia de afinidade (Saleemuddin e Qayyum, 1991), bem como para estudar a regulação da resposta imune celular (Trowbridge, 1973). É importante lembrar que as lectinas são glicoproteínas que interagem de modo muito específico com carboidratos na superfície de células e a ConA é capaz de se ligar à resíduos de açúcares internos e não reduzidos de α-D-manose, metil-α-D-manose, α-D-glicose e metil-α-D-glicose. Inicialmente foi observado que esta lectina precipitava glicogênio, mucoproteínas, eritrócitos de certas espécies de animais, emulsões glicolipí-dicas, grânulos de amido, leveduras e determinadas bactérias (Sumner e Howell, 1936). Foi também capaz de promover a aglutinação de células leucêmicas, transformadas por vírus, por carcinógenos químicos e por irradiação X, mas não aglutinava células normais usadas como controle (Inbar e Sachs, 1969). É muito conhecida por sua grande capacidade mitogênica estimulando assim, distintas populações de células T e B, especialmente de linfócitos T-supressores (Trowbridge, 1973). Foi também observado que a conA ligava-se a glicoproteínas e glicolipídeos da superfície de muitas células incluindo leucócitos, queratinócitos, hepatócitos e um grande número de linhagens celulares transformadas e não transformas Ballerstadt e colaboradores, (2006).
Pela grande capacidade e especificidade de ligação a resíduos de carboidratos na superfície das células a ConA media importantes efeitos farmacológicos. Ela induz morte de linhagens de células cancerosas direcionando-as para a apoptose ou para autofagia, inibe a angiogênese de tumores e, além disso estudos in vivo demonstraram que esta lectina também pode levar as células tumorais à morte por estimulação da resposta imune celular tumoricida Li e colaboradores, (2011). Em modelo experimental de hepatoma, foi observado que a ConA ativou a infiltração de linfócitos no fígado, matando as células tumorais e inibindo a formação do nódulo tumoral. Após a destruição da célula cancerosa e ativação dos linfócitos, a imunidade de memória foi estabelecida Lei e Chang, (2009).
A ConA foi utilizada em muitos ensaios pré-clínicos e mostrou-se bastante eficaz como indutora de morte de uma enormidade de células tumorais in vitro, mas ensaios in vivo com camundongos e hamsters demonstraram importante hepatotoxicidade da ConA, com formação aumentada de radicais livres do oxigênio Miyagi e colaboradores, (2004). A modificação da estrutura da ConA com o objetivo de reduzir a toxidade sem alterar a porção ativa da proteína e/ou a utilização de fragmentos peptídicos provenientes da hidrólise desta glicoproteína são estratégias que tem sido utilizadas nos novos ensaios clínicos. Resultados promissores, que incluíram a significante diminuição da massa tumoral, o aumento da sobrevida e cura de animais de experimentação já foram obtidos Li e colaboradores, (2011). Portanto, a elucidação do mecanismo molecular da ConA na indução da morte de células tumorais abriu uma nova perspectiva para o desenvolvimento de novos agentes anticâncer baseados em produtos naturais.
Ureases
Em plantas, a hidrólise da ureia é de fundamental importância para o metabolismo, pois é o principal composto nitrogenado de transporte e de estocagem de nitrogênio. Portanto, a função primária das ureases é permitir que as plantas utilizam a ureia como fonte de nitrogênio para a síntese de aminoácidos, proteínas, bases nitrogenadas, ácidos nucléicos e demais compostos nitrogenados e também na utilização da reserva protéica das sementes durante a germinação. Além disso, a amônia proveniente da hidrólise da ureia tem efeitos tóxicos contra microorganismos, insetos e predadores, constituindo assim um mecanismo adicional de proteção da planta (Witte, 2011). Por outro lado, a ureia é um dos fertilizantes nitrogenados mais usados no mundo, e a grande atividade das ureases de planta infelizmente acarreta um importante problema econômico e ambiental pela liberação de quantidades anormais de amônia na atmosfera (Sirko e Brodzik, 2000).
A urease (EC 3.5.1.5; ureia amidohidrolase) é uma níquel-enzima que catalisa a hidrólise da ureia em duas moléculas de amônia e uma de dióxido de carbono. São encontradas em todos os organismos vivos desde mamíferos até bactérias, mas são abundantes em plantas, particularmente nas espécies das famílias Leguminosae e Cucurbitaceae (Hogan, Swift e Done, 1983). Muitas espécies de leguminosas têm altos níveis de ureases em suas sementes, e dentre as proteínas extraídas de C. ensiformis (peso seco) pelo menos 0.15% corresponde ao conteúdo desta enzima (Polacco e Sparks, 1982). Bioquimicamente, a urease de C. ensiformis é a enzima mais estudada e melhor caracterizada dentre todas as ureases já descritas e foi a primeira enzima a ser cristalizada. A cristalização da urease de C. ensiformis rendeu a James Sumner (1887-1955) da Universidade de Cornell, o prêmio Nobel de Química em 1946 e representou uma contribuição fundamental para a enzimologia moderna, pois revelou a natureza protéica das enzimas (Follmer, 2008). Em C. ensiformis três isoformas da urease foram descritas: 1) A jack bean urease do tipo I (JBURE-I), que foi a primeira enzima descrita. É a principal e a mais abundante dentre as ureases; 2) A canatoxina, que é a isoforma neurotóxica e possui cerca de 30% da atividade ureolítica da JBURE-I e a 3) A jack bean urease do tipo II (JBURE-II), a menor das ureases com 78 kDa e também a menos conhecida, pois foi descrita muito recentemente Mulinari e colaboradores, (2011).
A JBURE-I existe predominantemente como um homotrímero que pode se associar formando hexâmeros de subunidades idênticas de 90 kDa contendo dois átomos de níquel por subunidade protéica. A sequência de aminoácidos da JBURE-I é estreitamente relacionada a sequências de todas as ureases bacterianas sugerindo uma origem evolucionária comum, embora as ureases de bactérias não apresentem o conhecido efeito inseticida das ureases de C. ensiformis (Follmer, 2008). A canatoxina é a isoforma muito tóxica da urease. Ela é capaz de provocar convulsões e morte em animais de experimentação quando injetados intraperitonealmente. Ao contrário da JBURE-I, a canatoxina é uma proteína dimérica com subunidades idênticas de 95 kDa (Carlini e Guimarães, 1981). Além de exibirem as mesmas funções, as ureases de C. ensiformis apresentam importante homologia entre suas sequências de aminoácidos e de suas estruturas 3D. Toda esta semelhança se deve ao fato de que elas derivam de sequências gênicas em comum, possivelmente de um rearranjo ou transposição de fragmentos gênicos semelhantes (Demartini, Carlini e Thelen, 2011). A ativação do efeito tóxico ou inseticida de JBURE-I e da canatoxina se dá através da hidrólise de uma ligação peptídica sensível a cisteíno-proteases do tipo catepsina no trato digestivo de determinados insetos. Desta hidrólise, é liberado um peptídeo de aproximadamente 10 kDa proveniente das enzimas nativas. Este peptídeo, denominado de Jaburetox-2Ec, exibe potente atividade inseticida contra diversos hemípteros, dípteros e coleópteros, incluindo aqueles resistentes a ureases. Insetos que utilizam proteases digestivas do tipo serino-proteases como a tripsina e quimiotripsina, clivam a urease de modo distinto da catepsina e não formam o Jaburetox-2Ec e consequentemente estes insetos não são afetados pela atividade inseticida destas enzimas (Stanisçuaski e Carlini, 2012). As ureases de C. ensiformis e seus derivados peptídicos com atividade inseticida definitivamente apresentam grande potencial de aplicação para o desenvolvimento de estratégias alternativas na proteção de culturas comercialmente relevantes contra insetos e pestes.
A principal isoforma da urease de C. ensiformis, JBURE-I, também foi capaz de inibir o crescimento vegetativo e a germinação de diversas espécies de fungos filamentosos fitopatogênicos como Rhizoctonia solani, Fusarium solani, Fusarium oxysporum, Trichoderma sp., Trichoderma pseudokoningii, Trichoderma viride, Penicillium sp., Colletotrichum musae, Curvularia lunata, Penicillium herguei, Colletotrichum gloeosporioides e Aspergillus glaucus em concentrações nM. É importante chamar a atenção que esta enzima constitui uma importante estratégia de defesa da C. ensiformis contra predadores e patógenos durante as fases iniciais de germinação e crescimento da planta e esta atividade tóxica não se relaciona com a atividade enzimática sobre a ureia, ou seja, é uma enzima multifuncional que possui diferentes domínios com atividades biológicas diversas Becker-Ritt e colaboradores, (2007).
Além das atividades ureolítica, inseticida e fungicida, as ureases de C. ensiformis desempenham outras funções biológicas. Como a JBURE-II foi recentemente descrita, as ações farmacológicas desta isoforma ainda não foram descritas, ao contrário para as isoformas JBURE-I e canatoxina. A canatoxina quando administrada intraperitonealmente foi capaz de induzir dificuldade respiratória, convulsão e morte em ratos e, em doses sub convulsivantes estimulou a liberação de gonadotropinas e insulina na corrente sanguínea, promoveu efeitos pro-inflamatórios, bradicardia e hipotensão. In vitro, a canatoxina também se mostrou um potente secretagogo em diversos sistemas celulares isolados e em doses nanomolares, induziu a secreção e agregação plaquetária, secreção de dopamina e serotonina de sinaptosomas de cérebros de ratos, liberação de histamina de mastócitos e secreção de insulina de ilhotas de Langerhans isoladas. A maioria destes efeitos envolveu a ativação do metabolismo do ácido araquidônico principalmente da via das lipoxigenases (Olivera-Severo, Wassermann e Carlini, 2006). Apesar dos importantes efeitos farmacológicos da canatoxina in vitro e em animais de experimentação, ainda não foram reportados estudos clínicos em humanos utilizando esta enzima. Já, as atividades ureolítica e inseticida destas ureases têm sido exploradas com muito sucesso em agricultura, reforçando assim, a importância da C. ensiformis como fonte de produtos bioativos.
Enzimas proteolíticas e seus inibidores
As proteases ou peptidases (E.C. 3.4) são enzimas que hidrolisam ligações peptídicas em proteínas ou peptídeos. Estas enzimas mediam e regulam processos essenciais para a manutenção da vida e morte de um organismo, como por exemplo, digestão e assimilação das moléculas alimentares, degradação de protéinas nos lisosomas e nos proteasomas, cascatas de coagulação, fibrinólise, complemento e as de sinalização intracelular, degradação de moléculas da matriz extracelular, apoptose e ativação de hormônios dentre outras funções (Silva-Lopez, 2010). Estas enzimas estão presentes em todos os organismos vivos e em todas as suas organelas e são adaptadas às condições ambientais onde atuam e por isso, são moléculas muito diversificadas e são classificadas em 5 principais classes e distribuídas em clãns e famílias de acordo com suas sequências de aminoácidos e mecanismo de ação (Rawlings, Barrett e Bateman, 2012). Diversas classes de proteases já foram descritas em sementes de leguminosas e são importantes em qualquer fase do desenvolvimento das plantas (Pacheco e Silva-López, 2012). Em C. ensiformis, a atividade proteolítica só foi estudada em sementes quiescentes e em nenhuma outra espécie do gênero Canavalia. Foram isoladas, purificadas e caracterizadas cineticamente três enzimas: 1) Uma asparaginil endopeptidase de 37 kDa com características de cisteíno-proteases responsável pelo processamento e maturação da concanavalina A Abe e colaboradores, (1993); 2) Uma serino-protease do tipo tripsina com peso molecular 41 kDa, apresentando uma ótima resistência a 60°C, atividade máxima em pH 9,0, inibição por inibidores de quimiotripsina e atividade importantemente modulada por íons Oshikawa e colaboradores, (2000) e 3) Uma outra serino-protease com características cinéticas e bioquímicas distintas das proteases descritas anteriormente, mas apresentando massa molecular de 28 kDa. Esta última protease demonstrou importante similaridade de sequência primária com as metalo-enzimas e proteínas ligadoras de cálcio, que são propriedades também da sedolisinas, uma família especial de serino-proteases ainda não descrita em plantas. Estudos cinéticos demonstraram que esta enzima pertence à família das tripsinas (Demartini, Wlodawer e Carlini, 2007). Embora as funções destas duas últimas proteases ainda não tenham sido esclarecidas, a grande atividade enzimática e a importante resistência a altas temperaturas das mesmas, chamam a atenção para as importantes funções metabólicas destas enzimas na fisiologia da C. ensiformis e também para o grande potencial de aplicabilidade destas proteases de C. ensiformis.
Os inibidores de proteases controlam a atividade das enzimas proteolíticas e se sua atividade não for estritamente controlada, estas enzimas podem digerir o conteúdo protéico de células e tecidos, gerando importantes danos que pode levar o organismo à morte. Os inibidores de ocorrência natural são peptídeos de tamanho variável e classificados de acordo com o tipo de proteases que inibem e sua sequência de aminoácidos (Silva-López, 2009). Os inibidores de serino-proteases, principalmente os de tripsina, são abundantes da natureza e particularmente em plantas das famílias Leguminosae e Gramineae (Losso, 2008). Tais inibidores aumentam a resistência da planta a parasitos, insetos, larvas, microorganismos e pragas. O papel destes inibidores nas interações planta-microrganismo ainda não está muito claro, mas considera-se que atuem retardando a proteólise das paredes celulares e de proteínas da membrana, reduzindo a desorganização celular e dificultando a atuação de patógenos. São expressos geralmente nas sementes e grãos e seus papéis fisiológicos incluem a regulação da atividade das proteases endógenas, imobilização das proteínas de reserva, proteção contra as enzimas proteolíticas de parasitos e insetos (Silva-López, 2009). Diversas pesquisas estão sendo conduzidas com o objetivo de avaliar os efeitos dos inibidores de serino-proteases de plantas no tratamento de diversas patologias humanas. Um notável exemplo são os inibidores de tripsina da soja (Glycine max) que estão em estudos clínicos de fase II para o tratamento de adenocarcinoma de mama (Clemente e Domoney, 2006). De sementes de C. lineata foram purificados três inibidores de serino-proteases: Um inibidor de subtilisina de 6,5k Da, apresentando excelente estabilidade em valores extremos de pH e temperatura que demonstrou alta homologia com inibidor I da batata Katayama e colaboradores, (1994) e dois inibidores do tipo Kunitz de 22 kDa Terada e colaboradores, (1994). Já em C. gladiata três inibidores de serino-proteases da família Bowman Birk foram purificados com importante atividade contra células leucêmicas Park e colaboradores, (2000). Embora ainda não tenha sido descrita nenhuma atividade de inibidores de proteases em C. ensiformis é importante chamar a atenção para esta classe de substâncias que desempenham importantes funções biológicas e são, sem dúvida, potenciais agentes quimioterápicos para o tratamento de uma grande diversidade de doenças.
Glicosidases
A atividade das glicosidases, enzimas que participam da síntese e degradação de polissacarídeos e de glicoproteínas, é bastante alta em C. ensiformis . Exemplo disso é a atividade da N-glicanase (EC 3.5.1.52) que catalisa a remoção de oligossacarídeos no complexo de Golgi durante o processamento pós-traducional da concanavalina A (Sheldon, Keen e Bowles, 1998). Outro exemplo são as α-manosidases ou manohidrolase (E.C. 3.2.1.24), que em C. ensiformis estão envolvidas na via de glicosilação de proteínas e catalizam a hidrólise de ligações glicosídicas que envolvem resíduos terminais de manoses em mananas. Esta manosidase é uma enzima glicosilada, composta por duas subunidades protéicas de massas moleculares de 44 e 66 kDa, formando um tetrâmero de aproximadamente 220 kDa. Foi observado que esta enzima estimula a proliferação de linfócito B de camundongos (Einhoff e Rüdiger, 1998) e inibe a formação de nódulos multicelulares em células de cultura de adenocarcinoma de mama exibindo assim, um discreto efeito anticâncer Arcaro e colaboradores, (2004).
L-canavanina/L-canalina
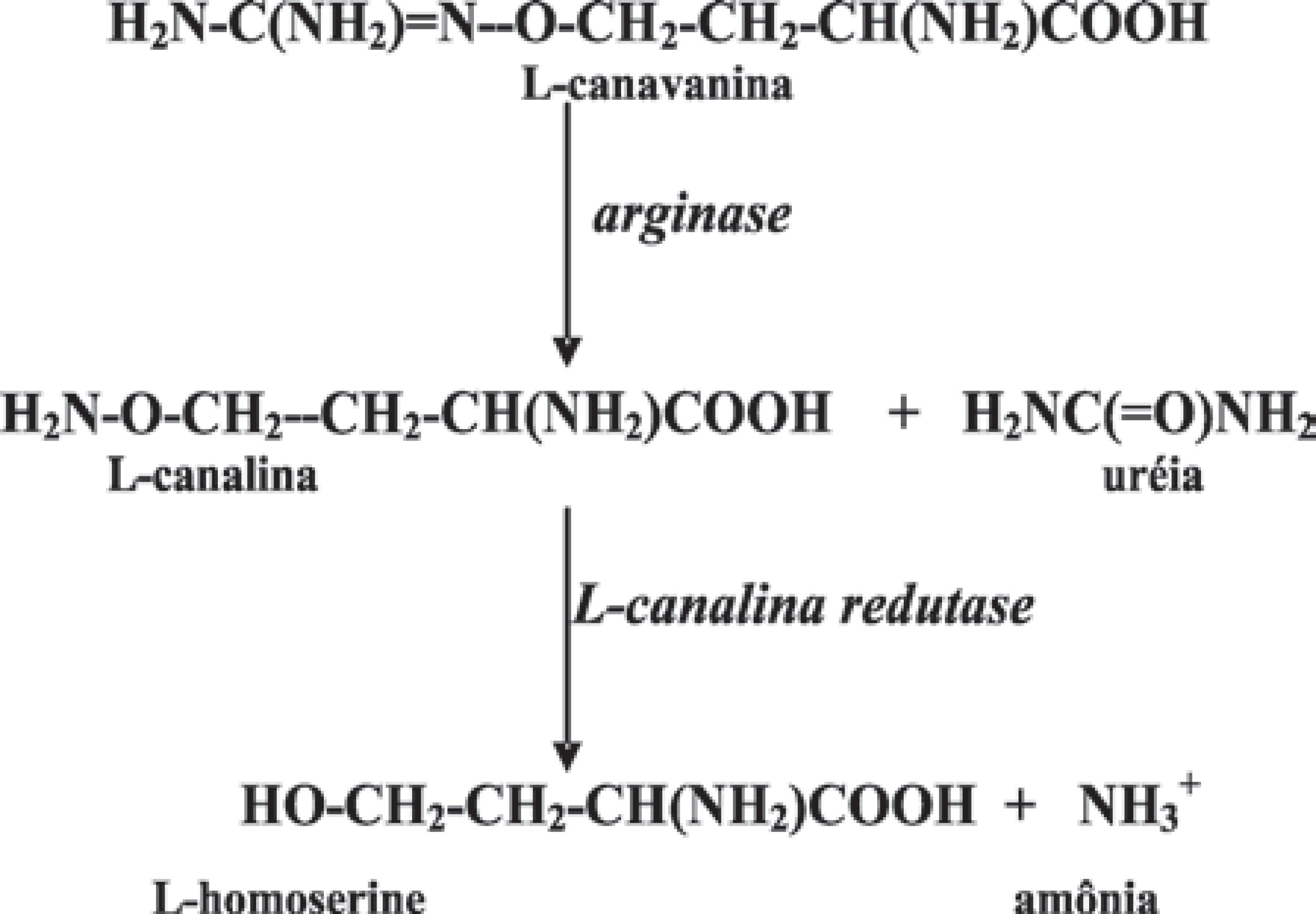
Ao contrário dos outros componentes de C. ensiformis descritos nesta revisão, que são proteínas ou peptídeos, a L-canavanina ou ácido 2-amino-4-(guanidino oxil) butírico, é um aminoácido não-proteíco, análogo estrutural da arginina e encontrado em membros da família Leguminosae. A L-canavanina é estocada nas sementes e pode perfazer mais de 10% do peso seco da semente e de 90% do nitrogênio alocado na forma de aminoácidos livres e é hidrolisada pela arginase (E.C. 3.5.3.1) para formar L-canalina. É importante ressaltar que as ureases e as arginases são universalmente distribuídas em legumes acumuladores de L-canavanina / L-canalina como na C. ensiformis (Rosenthal, 1992).
A canalina é um produto natural muito tóxico com propriedades inseticida sobre larvas e insetos adultos de diversos insetos, induzindo efeitos neurotóxicos irreversíveis. Sua toxicidade resulta da reatividade com grupos carbonilas de aldeídos ou de certos cetoácidos para formar oximas. Foi observado que a L-canalina reage com a ligação piridoxal fosfato das enzimas que ligam a vitamina B6 e com as transaminases da ornitina, como: ornitina-oxo aminotransferase e L-ornitina:2-oxo aminotransferase, inibindo significantemente a atividade de todas estas enzimas (Melangeli, Rosenthal e Dalman, 1997). Assim como a canalina, a canavanina possui efeito inseticida, ademais, é potente repelente devido ao seu sabor e o sabor dos alimentos para todos os animais é um importante fator para detectar e evitar a ingestão de moléculas tóxicas Mitri e colaboradores, (2009). Além disso, vale ressaltar que estudos demonstraram os efeitos tóxicos da L-canavanina e seu metabólito, L-canalina, sobre células tumorais, chamando a atenção para o papel anti-câncer destas substâncias. O importante é que o efeito tóxico da canavanina sobre as células cancerosas não foi devido à conversão de seu metabólito e sim ao efeito pro-apoptótico que induz nestes tipos celulares (Vynnytska e colaboradores, 2011). Além disso, foi reportado que a L-canavanina melhora o quadro fisiológico de septicemia, que é um estado sistêmico inflamatório caracterizado pela disfunção da musculatura lisa vascular levando a hipotensão, inadequada perfusão tecidual, falência mútipla dos órgãos, produção exagerada de radicais livres do oxigênio e consumo de anti-oxidantes endógenos com inibição de enzimas antioxidantes como a superóxido dismutase (SOD) e glutatione peroxidase (GSH-Px) e morte. A sepsis também resulta de um aumento de mediadores como: interleucina-1 (IL-1), Il-10, IL-12, fator de necrose tumoral (TNF-α) e moléculas que induzem a produção de óxido nítrico (iNOS), que é a molécula chave responsável por diversos aspectos da sepsis. É sabido que a L-canavanina é um potente análogo estrutural da L-arginina inibindo competitivamente as enzimas da síntese do iNOS. Portanto, o tratamento de animais septicêmicos com canavanina melhorou significantemente o quadro vascular deste estado, diminuiu os níveis de TNF-α, IL-1, 11-10, IL-12, iNOS plasmático e aumentou a atividade das enzimas SOD e GSH-Px quando comparado ao groupo controle sem a L-canavanina Haidara e colaboradores, (2010). Todas essas evidências sugerem que a L-canavanina pode ser usada como coadjuvante no tratamento de determinados tipos de cânceres e em quadros septicêmicos, reforçando assim a idéia de que a C. ensiformis é uma importante fonte de moléculas com grande potencial biotecnológico e farmacológico.
Referências
Abe, Y; Shirane, K.; Yokosawa, H.; Matsushita, H.; Mitta, M.; Kato, I.; Ishii, S. 1993 - Asparaginil endopeptidase of Jack Bean Seeds. The Journal of Biological Chemistry, v. 268, n. 5, p. 3525-3529.
Agbede, J.O.; Aletor, V.A. 2005 - Studies of the chemicals compositions and proteins quality evaluations of differently processed Canavalia ensiformis and Mucuna pruriens seed flours. Journal of Food Composition Analysis, v.18, p. 89-103.
Arcaro, K.F.; Wang, J.; Otis, C.N.; Zuckerman, B.M. 2004 - Beta-galactosidase and alpha-mannosidase inhibit formation of multicellular nodules in breast cancer cell cultures. Anticancer Research, v. 24, p. 139-144.
Ballerstadt, R.;Evans, C.; McNichols, R.; Gowda, R. 2006 - Concanavalin A for in vivo glucose sensing: A biotoxicity review. Biosensors and Bioelectronics, v.22, p.275-284.
Becker-Ritt, A.B.; Martinelli, A.H.; Mitidieri, S.; Feder, V.; Wassermann, G.E.; Santi, L.; Vainstein, M.H.; Oliveira, J.T.; Fiúza, L.M.; Pasquali, G.; Carlini, C.R. 2007 - Antifungal activity of plant and bacterial ureases. Toxicon, v.50, p.971-983.
Carlini, C.R.; Guimarães, A.J. 1981 - Isolation and characterization of a toxic protein from Canavalia ensiformis (jack bean) seeds, distinct from concanavalin A. Toxicon, v.19, p. 667-676.
Clemente, A.; Domoney, C. 2006 - Biological significance polymorphism in legume protease inhibitor the Bowman-Birk family. Current Protein Peptide Science, v.7, p.201-216.
Demartini, D.R.; Carlini, C.R.; Thelen, J.J. 2011 - Global and targeted proteomics in developing jack bean (Canavalia ensiformis) seedlings: an investigation of urease isoforms mobilization in early stages of development. Plant Molecular Biology, v.75, p.53-65.
Demartini, D.R; Wlodawer, A.; Carlini, C.R.A. 2007 - Comparative study of the expression of serine proteinases in quiescent seeds and in developing Canavalia ensiformis plants. Journal of Experimental Botany, v. 58, p. 521-532.
Einhoff, W.; Rüdiger, H. 1988 - The alpha-mannosi-dase from Canavalia ensiformis seeds: chemical and kinetic properties and action on animal lymphocytes. Biological Chemistry Hoppe Seyler, v.369, p.165-169.
Follmer, C. 2008 - Insights into the role and structure of plant ureases. Phytochemistry, v.69, p.18-28.
Ghali, Y; Youssef, Y; Abdel Mobdy, E. 1974 - Structure of hemicelluloses isolated from Canavalia ensiformis and Triticum aestivum straws. Phytochemistry, v.13, p.605-610.
Haidara, M.A.; Morsy, M.D.; Abdel-Razek, H.A.; Mikhailidis, D.P.; Isenovic, E.R. 2010 - Effects of L-canavanine and ozone on vascular reactivity in septicemic rats. Journal of Physiological Biochemistry, v.66, p.255-264.
Hogan, M.E.; Swift, I.E.; Done, J. 1983 - Urease assay and ammonia release from leaf tissues. Phytochemistry, v.22, p.663-667.
Inbar, M.; Sachs, L. 1969 - Interaction of the carbohydrate-binding protein concanavalin A with normal and transformed cells. Proceedings of the National Academy of Sciences USA, v.63, p.1418-1425.
Kanellopoulos, P.N.; Pavlou, K.; Perrakis, A.; Agianian, B.; Vongias, C.E.; Mavrommatis, C.; Soufi, M.; Tucker, P.A.; Hamodrakas, S.J. 1996 - The crystal structure of the complexes of concanavalin A with 4’-nitrophenyl-alpha-D-mannopyranoside and 4’-nitro-phenyl-alpha-D-glucopyranoside. Journal of Structure Biology, v.116, p.345-355.
Katayama H, Soezima Y, Fujimura S, Terada S, Kimoto E . 1994 - Property and amino acid sequence of a subtilisin inhibitor from seeds of beach Canavalia (Canavalia lineata). Bioscience, Biotechnology and Biochemistry, v.58, p.2004-2008.
Lampard J.F. 1974 - Demethylhomopterocarpin: An antifungal compound in Canavalia ensiformis and Vigna unguiculata following infection. Phytochemistry, v.13, p. 291-292.
Lei, H.Y.; Chang, C.P. 2009 - Lectin of concanavalin A as an anti-hepatoma therapeutic agent. Journal of Biomedical Science, v.19, p.16:10.
Li, W.W.; Yu, J.Y.; Xu, H.L., Bao, J.K. 2011 - Concanavalin A: a potential anti-neoplastic agent targeting apoptosis, autophagy and antiangiogenesis for cancer therapeutics. Biochemistry and Biophysics Research Communications, v.414, p. 282-286.
Losso, J.N. 2008 - The biochemical and functional food properties of the bowman-birk inhibitor. Critical Revision of Food Science Nutritional, v.48, p.94-118.
Melangeli C, Rosenthal GA, Dalman DL. 1997 - The biochemical basis for L-canavanine tolerance by the tobacco budworm Heliothis virescens (Noctuidae). Proceedings of the National Academy of Sciences USA, v.94, p.2255-2260.
Mitri C, Soustelle L, Framery B, Bockaert J, Parmentier ML, Grau Y. 2009 - Plant insecticide L-canavanine repels Drosophila via the insect orphan GPCR DmX. PLoS Biology, v.30, p.e1000147.
Miyagi, T; Takehara, T; Tatsumi, T; Suzuki, T; Jinushi, M.; Kanazawa, Y; Hiramatsu, N.; Kanto, T; Tsuji, S.; Hori, M.; Hayashi, N.C. 2004 - Concanavalin A injection activates intrahepatic innate immune cells to provoke an antitumor effect in murine liver, Hepatology, v.40, p.1190-1196.
Mulinari, F.; Becker-Ritt, A.B.; Demartini, D.R.; Ligabue-Braun, R.; Stanisguaski, F.; Verli, H.; Fragoso, R.R.; Schroeder, E.K.; Carlini, C.R.; Grossi-de-Sa, M.F. 2011 - Characterization of JBURE-llb isoform of Canavalia ensiformis (L.) DC urease. Biochimistry and Biophysic Acta. v 1814, p.1758-1768.
Olivera-Severo, D.; Wassermann, G.E.; Carlini, C.R. 2006 - Ureases display biological effects independent of enzymatic activity: is there a connection to diseases caused by urease-producing bacteria? Brazilian Journal of Medical Biology Research, v.39, p.851-861.
Oshikawa, K. Aoki, K.; Yoshino, Y; Terada, S. 2000 - Purification and characterization of a basic amino acid-specific peptidase from seeds of Jack bean (Canavalia ensiformis). Bioscience, Biotechnology, and Biochemistry, v.64, p. 2186-2192.
Pacheco, J.S.; Silva-López, R.E. 2012 - Study of proteolytic activity of the tropical legume Crotalaria spectabilis. Zeitschrift für Naturforschung C v.37, no prelo.
Park, S.S.; Sumi, T; Ohba, H.; Nakamura, O.; Kimura, M. 2000 - Complete amino acid sequences of three proteinase inhibitors from white sword bean (Canavalia gladiata). Bioscience, Biotechnology, and Biochemistry, v. 64, p.2272-2275.
Polacco J.C.; Sparks Jr, R.B. 1982. Patterns of urease synthesis in developing soybeans. Plant Physiology, v.70, p.189-194.
Rawlings, N.D.; Barrett, A.J.; Bateman, A. 2012 - MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Research, v.40, p.D343-350.
Rodrigues, J.E.L.F. 2004 - A importância do feijão de porco (Canavalia ensiformis) como cultura intercalar em rotação com milho e feijão caupi em cultivo de coqueirais no município de Ponta-de-Pedras/Marajó-PA. Embrapa Amazônia Oriental, v.1, p. 96.
Rosenthal, G.A. 1992 - Purification and characterization of the higher plant enzyme L-canaline reductase. Proceedings of the National Academy of Sciences USA, v.89, p.1780-1784.
Rosenthal, G.A; Dahlman, D.L. 1986 - L-Canavanine and protein synthesis in the tobacco hornworm Manduca sexta. Proceedings of the National Academy of Sciences USA, v.83, p.14-18.
Saleemuddin, M.; Qayyum, H. 1991 - Concanavalin A: A useful ligand for glycoenzyme immobilization—A review. Enzyme and Microbial Technology, v.13, p.290-295.
Sharon, N.; Lis, H. 2004 - History of lectins: from hemagglutinins to biological recognition molecules. Glycobiology, v.14, p.53R-62R.
Sheldon, P.S.; Keen, J.N.; Bowles, D.J. 1998 - Purification and characterization of N-glycanase, a concanavalin A binding protein from jackbean (Canavalia ensiformis). Biochemistry Journal, v.15, p.13-20.
Silva-López, R.E. 2009 - Proteases Inhibitors Originated from Plants: Useful Approach for Development of New Drug. Revista Fitos. v.4, p.108-119.
Silva-López, R.E. 2010 - Leishmania proteases: new targets for rational drug development. Química Nova, v.33, p.1541-1548.
Sirko, A.; Brodzik, R. 2000 - Plant ureases: roles and regulation. Acta Biochimica Polonica,v.47, p.1189-1195.
Sridhar, K.R.; Seena S. 2006 - Nutritional and antinutritional significance of four unconventional legumes of the genus Canavalia - A comparative study. Food Chemistry, v. 99, p.267-288.
Stanisçuaski F, Carlini CR. 2012 - Plant ureases and related peptides: understanding their entomotoxic properties. Toxins, v.4, p.55-67.
Sumner, J.B.; Howell S.F. 1936 - Identification of hemagglutinin of jack bean with concanavalin A. Journal of Bacteriology, v.32, p.227-237.
Terada S, Fujimura S, Katayama H, Nagasawa M, Kimoto E. 1994 - Purification and characterization of two Kunitz family subtilisin inhibitors from seeds of Canavalia lineata. Journal of Biochemistry, v 115, p.392-396.
Trowbridge, I.S. 1973 - Mitogenic properties of pea lectin and its chemical derivatives. Proceedings of the National Academy of Sciences USA, v.70, p.3650-3654.
Udedibie, A.B.I.; Carlini, C.R. 1998 - Questions and answers to edibility problem of the Canavalia ensiformis seeds - A review. Animal Feed Science and Technology, v.74, p.95-106.
Vynnytska, B.O.; Mayevska, O.M.; Kurlishchuk, Y.V.; Bobak, Y.P.; Stasyk, O.V 2011 - Canavanine augments proapoptotic effects of arginine deprivation in cultured human cancer cells. Anticancer Drugs, v.22, p.148-157.
Witte, C.P. 2011 - Urea metabolism in plants. Plant Science, v.180, p.431-438.
Wutke, E.B.; Ambrosano, E.J.; Razera, L.F.; Medina, P.F.; Carvalho, L.H.; Kikuti, H. 2007 - Bancos comunitários de sementes de adubos verdes: informações técnicas. Ministério da Agricultura, Pecuária e Abastecimento.