ARTIGO DE PESQUISA
Atividade antifúngica das folhas de Garcinia gardneriana (Planch. & Triana) Zappi frente a Cryptococcus neoformans e Cryptococcus gattii
Antifungal activity of Garcinia gardneriana (Planch. & Triana) Zappi leaves against Cryptococcus neoformans and Cryptococcus gattii
Resumo
A criptococose é uma infecção fúngica que pode levar a quadros clínicos graves como pneumonia e meningoencefalite. Atualmente, existem poucas opções terapêuticas para o tratamento de infecções fúngicas sistêmicas, e o aumento da resistência aos fármacos está em ascensão. Nesse sentido, os produtos naturais são uma importante fonte para a descoberta e desenvolvimento de novos fármacos. O presente trabalho objetivou investigar a atividade anticriptocócica in vitro de Garcinia gardneriana. As folhas foram utilizadas para obtenção do extrato etanólico, frações, cera epicuticular e do triterpeno lupeol. A concentração inibitória mínima (CIM) e a concentração fungicida mínima (CFM) foram avaliadas frente a doze linhagens de Cryptococcus neoformans e Cryptococcus gattii. Entre as frações testadas, a fração hexano (FHGG) foi a que apresentou melhor atividade antifúngica. A FHGG e o lupeol (isolado de FHGG) apresentaram valores de CIM e de CFM entre 12,5 a 100 µg/mL e entre 25 a 100 µg/mL, respectivamente. Foi realizada a avaliação de citotoxicidade utilizando células de macrófagos murinos e o lupeol apresentou valor de índice de seletividade maior que 1. Assim, acredita-se que o lupeol seja uma molécula interessante para prosseguimento nos estudos, visto que apresentou interessante atividade anticriptococócica.
- Palavras-chave:
- Garcinia gardneriana.
- Atividade antifúngica.
- Cryptococcus spp.
Abstract
Cryptococcosis is a fungal infection that can lead to serious illnesses such as pneumonia and meningoencephalitis. Currently, there are few therapeutic options for the treatment of systemic fungal infections and drug resistance is increasing. In this regard, natural products are a source of lead compounds in drug discovery research. This study aimed to investigate the anticryptococcal activity of Garcinia gardneriana in vitro. We obtained the ethanolic extract, fractions, epicuticular wax, and triterpene lupeol From the leaves. The minimum inhibitory concentration (MIC) and minimum fungicidal concentration (MFC) were evaluated against twelve strains of Cryptococcus neoformans and Cryptococcus gattii. The hexane fraction (FHGG) showed the best antifungal activity. FHGG and lupeol (isolated from FHGG) showed MIC and MFC values between 12.5 to 100 µg/mL and 25 to 100 µg/mL, respectively. We determined the cytotoxicity against murine macrophage cells. Lupeol has a selectivity index value greater than 1. Thus, we suppose the lupeol is a candidate for further studies since it exhibited significant anticryptococcal activity.
- Keywords:
- Garcinia gardneriana.
- Antifungal activity.
- Cryptococcus spp.
Introdução
O gênero Cryptococcus engloba mais de 70 espécies de fungos, no entanto, apenas duas espécies são responsáveis pela maioria dos casos de doenças em humanos: C. neoformans e C. gattii[1]. A criptococose, doença causada por esses micro-organismos, é uma doença sistêmica que pode ser subaguda ou crônica[2]. As formas clínicas mais comuns de manifestação da criptococose são pneumonia e meningite criptococócica[1]. A infecção pulmonar pode evoluir para disseminação hematogênica, com tropismo para o sistema nervoso central (SNC). Na neurocriptococose, os principais sintomas são confusão mental, cefaleia e febre[2]. No entanto, existe a possibilidade de ocorrer também lesões em outros órgãos e tecidos, demonstrando disseminação dos fungos[1]. A forma cutânea ocorre em 15% dos casos e pode gerar lesões acneiformes, úlceras, entre outros[2].
Para pacientes com a síndrome da imunodeficiência adquirida (SIDA), a criptococose é a principal causa da meningite fúngica, com mais de 81% de mortalidade global. As mortes ocorrem em maior número na África Subsaariana, onde chegam a uma taxa de mortalidade de 70%[3]. A América Latina possui uma incidência estimada de 5.300 casos/ano, dentre esses, Colômbia e Brasil se destacam em maior incidência, com números entre 1.001 e 2.500 casos/ano[4].
No Brasil, a criptococose foi a primeira infecção oportunista a aparecer em cerca de 4,4% dos casos nos pacientes diagnosticados com SIDA entre os anos de 2000 a 2012. A região Sudeste foi a que apresentou os maiores índices de criptococose associada à SIDA (8 a 12% de casos)[5]. No Brasil, a criptococose é a micose sistêmica com o segundo maior número de internações entre os anos de 1998 e 2006 (registrando 4.055 internações nesse período), conforme dados do Sistema de Informação Hospitalar do Sistema Único de Saúde (SUS)[6]. Com relação a mortalidade no ano de 2020, foram registrados 120 casos de óbito por criptococose no país[7].
Os fármacos utilizados no tratamento da criptococose têm sido um tema recorrente em diversos estudos, principalmente, no tocante à eficácia do tratamento. Atualmente, três classes de fármacos antifúngicos podem ser utilizadas: azóis (cetoconazol, itraconazol, fluconazol e voriconazol), polienos (anfotericina B), e um fármaco da classe das pirimidinas, a 5-flucitosina. Entretanto, alguns destes apresentam altas taxas de falha no tratamento das infecções fúngicas e o surgimento de resistência a fungos é um problema crescente[2]. Ademais, tratar a neurocriptococose não é tarefa simples, devido à presença da barreira hematoencefálica que causa limitação da difusão de fármacos nos tecidos cerebrais[1]. O alto custo do tratamento, o surgimento de linhagens resistentes aos fármacos disponíveis e a dificuldade em desenvolver novos antifúngicos representam desafios no tratamento da criptococose[8].
Tradicionalmente, os produtos naturais desempenham um papel crucial na descoberta e desenvolvimento de novos fármacos. Os metabólitos secundários de plantas constituem valiosas fontes de substâncias ativas nesse processo de busca por compostos inovadores[9].
A família Clusiaceae é rica em metabólitos com atividades biológicas variadas, principalmente antifúngicas, anti-inflamatórias, antimicrobianas, antivirais e antidepressivas[10]. G. gardneriana (Planch. & Triana) Zappi (Sinonímia Rheedia gardneriana Planch. & Triana pertence à família Clusiaceae e é conhecida popularmente como bacupari. A espécie é nativa da Mata Atlântica, sendo também encontrada na Austrália, Ásia, zonas tropicais da África e da Polinésia[10]. Nas suas folhas já foi descrita a presença de flavonoides, benzofenonas, terpenos e xantonas. Substâncias isoladas de G. gardneriana têm demonstrado atividades analgésica e anti-inflamatória[10], além de atividades antibacteriana, antiparasitária e antifúngica[11].
Dada a importância clínica atual da criptococose e a promissora utilização dos produtos naturais no desenvolvimento de fármacos, o presente trabalho visa o estudo da atividade antifúngica in vitro das folhas de G. gardneriana frente a linhagens de C. neoformans e C. gattii.
Materiais e Métodos
Linhagens e desenho experimental
Neste trabalho foram utilizadas seis linhagens de C. neoformans e seis linhagens de C. gattii (QUADRO 1). Os isolados foram mantidos em ágar Sabouraud dextrose (SDA) a 4°C. Antes de cada teste, as linhagens foram cultivadas em SDA por 72 h a 35°C. Foram feitos experimentos de triagem com as frações oriundas do extrato etanólico de G. gardneriana para escolha da fração mais ativa, utilizando-se duas linhagens: C. gattii ATCC WM161 e C. neoformans ATCC H99. A fração hexano (FHGG) foi escolhida para os experimentos posteriores, pois apresentou melhores resultados no teste de concentração inibitória mínima (CIM). A FHGG foi submetida a sucessivos métodos cromatográficos para obtenção do seu componente majoritário (lupeol), que foi utilizado juntamente com a fração para os demais experimentos. Todos os experimentos foram executados em pelo menos duas duplicatas realizadas em dias diferentes.
| Linhagens de C. neoformans | Genótipo/sorotipo | Origem |
|---|---|---|
|
ATCC 28957 (ATCC ® 28957 ™) ATCC 62066 (ATCC ® 62066 ™) ATCC H99 (ATCC ® 208821 ™) ATCC WM628 (ATCC ® MYA-4566 ™) ATCC WM629 (ATCC ® MYA-4567 ™) ATCC WM626 (ATCC ® MYA-4565 ™) |
ND/Sorotipo D ND/Sorotipo A VN I / A VN III / AD VN IV / D VN II / A |
Clínica; lesão óssea humana Clínica; França Clínica; Nova York Clínica; Austrália Clínica; Austrália Clínica; Austrália |
| Linhagens de C. gattii | Genótipo/Sorotipo | Origem |
|
ATCC 32068 (ATCC ® 32608 ™) ATCC WM179 (ATCC ® MYA-4560™) ATCC WM161 (ATCC ® MYA-4562 ™) ATCC R265 (ATCC ® MYA-4093 ™) ATCC WM779 (ATCC ® MYA-4563 ™) ATCC WM178 (ATCC ® MYA-4561 ™) |
VG III / C VG I / B VG III / B VG IIa / B VG IV / C VG II / B |
Clínica; Califórnia Clínica; Austrália Ambiental; San Diego Clínica; Canadá Veterinária; África do Sul Clínica; Austrália |
| NOTA: ATCC: American Type Culture Collection; ND: Não determinado. | ||
Local de coleta, identificação e preparo
Folhas de G. gardneriana foram coletadas no município de Governador Valadares/MG, identificadas pelo botânico Vinícius Antônio de Oliveira Dittrich (Universidade Federal de Juiz de Fora) e depositadas sob o número CESJ 70502 no Herbário Leopoldo Krieger, da Universidade Federal de Juiz de Fora, Juiz de Fora/MG. O presente trabalho foi registrado no Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado - SisGen, sob o número de registro A58097B. As folhas foram dispostas em bandejas e secas até peso constante em estufa de ar circulante com temperatura controlada em torno de 45°C. As folhas foram trituradas/pulverizadas em moinho de facas.
Obtenção do extrato bruto e frações
Cerca de 1,2 kg de folhas trituradas de G. gardneriana foram submetidas à extração por maceração exaustiva em etanol 96º GL (96% v/v) por 7 dias. O extrato foi filtrado em papel de filtro qualitativo e concentrado em evaporador rotatório sob pressão reduzida, a 50ºC, obtendo-se o extrato etanólico bruto de G. gardneriana (EEGG).
Cerca de 70 g do extrato etanólico bruto foi diluído em água/metanol (95:5 v/v) e submetido à partição com solventes em série eluotrópica para obtenção das frações n-hexano (FHGG), acetato de etila (FAGG), diclorometano (FDGG) e butanol (FDGG). Todas as frações foram concentradas em evaporador rotatório sob pressão reduzida a 50ºC, até secura.
A cera epicuticular de Garcinia gardneriana (CEGG) foi extraída por imersão das folhas frescas (8 g) em acetona por 2 min. O extrato foi concentrado em evaporador rotatório em pressão reduzida a 50ºC, obtendo-se 127 mg de cera epicuticular.
Isolamento e identificação do lupeol
FHGG foi submetida à cromatografia líquida à vácuo (CLV), utilizando sílica-gel 60G como fase estacionária e n-hexano com volumes crescentes de acetato de etila como fase móvel. Foram obtidas 21 frações que foram analisadas por cromatografia em camada delgada (CCD) e agrupadas de acordo com sua similaridade cromatográfica.
As frações 13, 14 e 15, obtidas na CLV, foram agrupadas devido à semelhança cromatográfica e submetidas à cromatografia em coluna clássica (CC) utilizando n-hexano como fase móvel. A partir dessa coluna, foi possível isolar o componente majoritário de FHGG, identificado como lupeol através de espectros de 1H RMN e 13C RMN, bem como através de comparação com dados da literatura [12,13]. Lupeol: 1H-NMR (CDCl3, 300 MHz) d 4,67 (1H, d, J = 2,4, H-29a), 4,55 (1H, d, J = 2,4 Hz, H-29b), 3,17 (1H, dd, J = 10,8; 5,2, H-3), 2,36 (1H, dt, J = 10,7; 6,0, H-19), 1,71 (3H, s, H-30), 1,70 (1H, sp, H-2a), 1,66 (1H, sp, H-2b), 1,01 (3H, s, H-26), 0,96 (3H, s, H-27), 0,92 (3H, s, H-23), 0,81 (3H, s, H-25), 0,77 (3H, s, H-28), 0,74 (3H, s, H-24). 13C-NMR (CDCl3, 100 MHz) d 38,7 (C-1), 27,4 (C-2), 79,0 (C-3), 38,9 (C-4), 55,3 (C-5), 18,3 (C-6), 34,3 (C-7), 40,8 (C-8), 50,4 (C-9), 37,2 (C-10), 20,9 (C-11), 25,1 (C-12), 38,0 (C-13), 42,8 (C-14), 27,4 (C-15), 35,5 (C-16), 43,0 (C-17), 48,3 (C-18), 48,0 (C-19), 151,0 (C-20), 29,8 (C-21), 40,0 (C-22), 27,9 (C-23), 16,0 (C-24), 18,0 (C-25), 16,1 (C-26), 14,6 (C-27), 15,4 (C-28), 109,3 (C-29), 19,3 (C-30).
Determinação da concentração inibitória mínima (CIM)
A determinação das concentrações inibitórias mínimas do EEGG, da CEGG, das frações de G. gardneriana e do lupeol foram realizadas através do método da microdiluição em caldo, conforme proposto pelo documento M27-A3 do "Clinical and Laboratory Standards Institute" com modificações[14]. O inóculo fúngico foi preparado em solução salina estéril na concentração de 1x106 a 5x106 UFC/mL. Em seguida, o inóculo foi diluído em caldo Roswell Park Memorial Institute (RPMI) - 1640 de modo a alcançar a concentração final de 1x10³ a 5x10³ UFC/mL[14]. Para avaliar a concentração inibitória mínima (CIM) de EEGG, das frações FHGG, FAGG, FDGG, FBGG, da CEGG e do lupeol, uma solução inicial de cada amostra foi solubilizada em dimetilsulfóxido (DMSO) de modo a obter a concentração de 1000 μg/mL. Posteriormente, foram realizadas diluições seriadas utilizando o caldo RPMI – 1640 e, obteve-se contrações finais de 100 μg/mL a 0,195 μg/mL. Para cada experimento foi realizado um controle negativo contendo 200 μL de RPMI – 1640 e um controle positivo contendo 100 μL de RPMI 1640 e 100 μL de inóculo fúngico, conforme descrito anteriormente. As microplacas foram incubadas a 35ºC durante 72 horas e realizada a leitura visual dos resultados[14].
Foi considerada a CIM aquela que inibiu 100% do crescimento fúngico. Para fins de comparação com um fármaco com reconhecida ação antifúngica, também foi realizado o teste de suscetibilidade inibitória mínima das 12 linhagens frente ao fluconazol, conforme descrito pelo protocolo M27-A3 da CLSI[14]. Para o fluconazol (FLC) foi considerada a CIM que inibiu 50% do crescimento fúngico, sendo determinada através de leitura visual e comparando com os controles de crescimento.
Determinação da concentração fungicida
Após a determinação da CIM, as alíquotas de 100 μL foram removidas dos poços em que houve 100% de inibição visual do crescimento fúngico, subcultivadas em ASD, incubadas a 35ºC por 72 horas. As amostras foram cultivadas em duplicatas. A concentração fungicida mínima (CFM) foi definida como a menor concentração onde não se observou visualmente crescimento de colônia fúngica na placa de Petri. Foi considerada como fungicida aquele extrato/fração/cera cujo a CFM foi igual ou superior a CIM, e como fungistática, quando a CFM foi maior que a CIM[15].
Avaliação da citotoxicidade
O ensaio para avaliar a citotoxicidade do EEGG, da FHGG e do lupeol frente a macrófagos J774A.1 foi feito pelo método colorimétrico do MTT (corante brometo de 3-(4,5-dimetil-2-tiazolil) -2,5-difenil-2H-tetrazólio - Sigma, St, Louis, MO, USA)[16].
Macrófagos J774A.1 foram cultivados em meioRPMI 1640 contendo 10% de soro bovino fetal, 0,5% de solução penicilina/estreptomicina (10.000 UI/mL, 10.000 mg/mL, respectivamente) e 1% de aminoácidos essenciais. Depois de atingirem a confluência, as garrafas foram raspadas e as células inseridas em placas de 96 poços na concentração de 2x105 células/mL para o experimento de viabilidade por MTT. Essas células foram incubadas em atmosfera úmida de 5 % de CO2 a 37°C[16].
A viabilidade dos macrófagos J774A.1 foi analisada pelo método colorimétrico do MTT. Após 48 horas, o sobrenadante da cultura celular de macrófagos tratados com EEGG, FHGG, e lupeol nas concentrações 100 μg/mL, 50 μg/mL, 25 μg/mL, 5 μg/mL, 0,5 μg/mL e 0,1 μg/mL foi descartado e 100 μL de RPMI-1640 foram inseridos em todos os poços, seguido de 10 μL de MTT (5 mg/mL). Essas placas foram então incubadas a 37°C na estufa com 5% de CO2. Após um período de 4 horas, a reação foi concluída com a remoção do meio de cultura e inserção de 100 µL de DMSO. A leitura foi realizada em leitor de microplaca Multiskan™ FC Microplate Photometer no comprimento de onda de 570 nm[16]. Os dados obtidos foram tabulados e analisados no software Prism version 6.0, onde posteriormente foi determinada a concentração citotóxica para 50%(CC50) dos macrófagos[12].
Resultados e Discussão
A triagem do extrato etanólico de G. gardneriana (EEGG), suas frações (FHGG, FAGG, FDGG e FBGG) e a cera epicuticular (CEGG) foi realizada utilizando uma linhagem de C. neoformans ATCC H99 (ATCC® 208821™) e uma linhagem de C. gattii ATCC WM161 (ATCC® MYA-4562™). Os resultados de CIM encontram-se entre 50 e 100 µg/mL, sendo possível observar melhores resultados para FHGG (TABELA 1).
| Extrato e frações | CIM(µg/mL) C. neoformans ATCC H99 | C. gattii ATCC WM161 |
|---|---|---|
| EEGG | 100 µg/mL | 100 µg/mL |
| FHGG | 50 µg/mL | 50 µg/mL |
| FDGG | 100 µg/mL | 50 µg/mL |
| FAGG | 100 µg/mL | 100 µg/mL |
| FBGG | 100 µg/mL | 100 µg/mL |
| CEGG | 100 µg/mL | 100 µg/mL |
| Nota: Valores da CIM determinada através de experimentos em duplicatas. A CIM corresponde à fração capaz de inibir o crescimento in vitro da respectiva linhagem. ATCC: American Type Culture Collection. Extrato etanólico de G. gardneriana (EEGG), fração hexano de G. gardneriana (FHGG),fração diclorometano de G. gardneriana (FDGG), fração acetato de etila de G. gardneriana (FAGG), fração butanol de G. gardneriana (FBGG) e cera epicuticular de G. gardneriana (CEGG). | ||
Diversos trabalhos propõem o uso de produtos naturais como alternativa para o tratamento de doenças, inclusive a criptococose. Folly et al.[16] avaliaram a atividade antifúngica das folhas de Xylosma prockia frente a linhagens de C. gattii e C. neoformans, obtendo valores de CIM inferiores a 100 mg/L. Barbosa Jr et al.[17] relataram que extratos aquosos de Ziziphus joazeiro (juazeiro), Poincianella pyramidalis (catingueira), Aideroxylon obtusifolium (quixabeira) e Hymenaea courbaril (jatobá), na concentração de 4 mg/mL, apresentaram atividade antifúngica frente a isolados clínicos de C. neoformans utilizando o método de difusão em disco. Dessa forma, ressalta-se a importância dos produtos naturais na busca por substâncias com atividade anticriptocócica.
FHGG foi submetida a sucessivos métodos cromatográficos que permitiram o isolamento do triterpeno lupeol (21 mg, FIGURA 1), identificado através de espectros de 1H RMN e 13C RMN e por comparação com dados na literatura[12,13].
O lupeol, isolado da fração hexano de G. gardneriana, é um triterpeno pentacíclico biologicamente ativo da família dos lupanos, encontrado naturalmente em frutas, vegetais e várias plantas medicinais. Nos vegetais, encontra-se principalmente no repolho branco, pimenta, pepino e tomate, e nas frutas e, também, na manga, figo, morango e uva vermelha[18]. O lupeol tem uma ampla gama de efeitos biológicos descritos, incluindo efeitos antitumorais, antimicrobianos, antidiabéticos, cardio e hepatoprotetores, além de atividade antioxidante e anti-inflamatória. Além disso, segundo Ramadwa[12] a mistura de lupeol e β-amirina demonstrou boa atividade contra C. neoformans e Candida albicans com CIM de 16 μg/mL para ambos os fungos, o que evidencia a relevância em avaliar a ação da substância frente a linhagens de C. neoformans e C. gattii.
A atividade anticriptocócica de FHGG e de lupeol foi avaliada através de ensaio de CIM frente a 12 linhagens de C. gattii e C. neoformans. Na TABELA 3, observa-se que os valores de CIM variaram de acordo com a linhagem testada, estando entre 12,5 e 100 µg/mL para FHGG e entre 12,5 e 50 µg/mL para lupeol.
Segundo Rios e Recio[19], extratos e frações de plantas que apresentam CIM ≤ 100 μg/mL são considerados fontes promissoras de substâncias com atividade antimicrobiana e abrem novas possibilidades para a descoberta de moléculas ativas.
| Linhagens | FHGG | CFM(µg/mL) Lupeol | FLC |
|---|---|---|---|
| C. neoformans | |||
| ATCC 28957 (ATCC ® 28957 ™) | 12,5 µg/mL | 12,5 µg/mL | 1 µg/mL |
| ATCC 62066 (ATCC ® 62066 ™) | 50 µg/mL | 50 µg/mL | 2 µg/mL |
| ATCC H99 (ATCC ® 208821 ™) | 50 µg/mL | 25 µg/mL | 2 µg/mL |
| ATCC WM628 (ATCC ® MYA-4566 ™) | 100 µg/mL | 50 µg/mL | 4 µg/mL |
| ATCC WM629 (ATCC ® MYA-4567 ™) | 50 µg/mL | 50 µg/mL | 4 µg/mL |
| ATCC WM626 (ATCC ® MYA-4565 ™) | 25 µg/mL | 50 µg/mL | 4 µg/mL |
| Média geométrica | 39,5 µg/mL | 39,5 µg/mL | 2,8 µg/mL |
| C. gattii | |||
| ATCC 32068 (ATCC ® 32068 ™) | 50 µg/mL | 25 µg/mL | 4 µg/mL |
| ATCC WM179 (ATCC ® MYA-4560™) | 50 µg/mL | 50 µg/mL | 4 µg/mL |
| ATCC WM161 (ATCC ® MYA-4562 ™) | 100 µg/mL | 50 µg/mL | 2 µg/mL |
| ATCC R265 (ATCC ® MYA-4093 ™) | 25 µg/mL | 12,5 µg/mL | 4 µg/mL |
| ATCC WM779 (ATCC ® MYA-4563 ™) | 50 µg/mL | 50 µg/mL | 8 µg/mL |
| ATCC WM178 (ATCC ® MYA-4561 ™) | 25 µg/mL | 25 µg/mL | 8 µg/mL |
| Média geométrica | 50 µg/mL | 35,4 µg/mL | 5 µg/mL |
| Nota: Valores da CIM determinada através de experimentos em duplicatas. A CIM corresponde a fração capaz de inibir o crescimento in vitro da respectiva linhagem ATCC: American Type Culture Collection. | |||
As concentrações fungicidas mínimas (CFM) de FHGG e lupeol foram avaliadas para as mesmas linhagens do ensaio de CIM. Os resultados descritos nas TABELAS 2 e 3 mostram que FHGG apresentou ação fungicida frente a três linhagens de C. neoformans (ATCC 62066, ATCC H99 e ATCC WM629) e a uma linhagem de C. gattii (ATCC WM161), uma vez que a CFM apresentou o mesmo valor da CIM (relação CIM:CFM 1:1). Já para três linhagens de C. neoformans (ATCC 28957, ATCC WM628 e ATCC WM626) e cinco linhagens ATCC de C. gattii (ATCC 32068, ATCC WM179, ATCC R265, ATCC WM779 e ATCC WM178) a fração apresentou atividade fungistática, já que o valor de CFM foi superior à CIM.
| Linhagens | FHGG | CFM(µg/mL) Lupeol | FLC |
|---|---|---|---|
| C. neoformans | |||
| ATCC 28957 (ATCC ® 28957 ™) | 25 µg/mL | 25 µg/mL | 2 µg/mL |
| ATCC 62066 (ATCC ® 62066 ™) | 50 µg/mL | 50 µg/mL | 4 µg/mL |
| ATCC H99 (ATCC ® 208821 ™) | 50 µg/mL | 50 µg/mL | 4 µg/mL |
| ATCC WM628 (ATCC ® MYA-4566 ™) | 100 µg/mL | 50 µg/mL | 8 µg/mL |
| ATCC WM629 (ATCC ® MYA-4567 ™) | 50 µg/mL | 100 µg/mL | 8 µg/mL |
| ATCC WM626 (ATCC ® MYA-4565 ™) | 100 µg/mL | 50 µg/mL | 4 µg/mL |
| Média geométrica | 62,5 µg/mL | 54,1 µg/mL | 4,6 µg/mL |
| C. gattii | |||
| ATCC 32068 (ATCC ® 32068 ™) | 100 µg/mL | 50 µg/mL | 8 µg/mL |
| ATCC WM179 (ATCC ® MYA-4560™) | 100 µg/mL | 100 µg/mL | 8 µg/mL |
| ATCC WM161 (ATCC ® MYA-4562 ™) | 100 µg/mL | 100 µg/mL | 4 µg/mL |
| ATCC R265 (ATCC ® MYA-4093 ™) | 100 µg/mL | 25 µg/mL | 8 µg/mL |
| ATCC WM779 (ATCC ® MYA-4563 ™) | 100 µg/mL | 50 µg/mL | 16 µg/mL |
| ATCC WM178 (ATCC ® MYA-4561 ™) | 50 µg/mL | 50 µg/mL | 16 µg/mL |
| Média geométrica | 91,6 µg/mL | 62,5 µg/mL | 10 µg/mL |
| Nota: Os valores da CFM determinada foram feitos através de experimentos em duplicatas. A CFM representa a fração capaz de inibir o crescimento in vitro da respectiva linhagem após realização da CIM, com nova incubação por 72 horas a 35ºC. ATCC: American Type Culture Collection. | |||
O lupeol apresentou ação fungicida sobre as linhagens ATCC 62066, ATCC WM628 e ATCC WM626 e fungistática sobre as linhagens ATCC H99, ATCC WM629 e ATCC 28957 de C. neoformans. Já para as linhagens de C. gattii, o efeito fungicida foi observado somente sobre ATCC WM779, e foi observada ação fungistática para as demais linhagens testadas.
O fluconazol apresentou ação fungistática frente a todas as linhagens de C. neoformans e C. gattii testadas, com exceção de C. neoformans ATCC WM626, para a qual apresentou atividade fungicida. Os dados estão de acordo com a literatura, com fluconazol apresentando atividade majoritariamente fungistática[20].
Análises da atividade fungicida/fungistática são recorrentes em estudos para desenvolvimento de fármacos. Folly et al.[16] avaliou essa atividade e mostrou que algumas frações extraídas de Xylosma prockya possuem ação fungicida contra diversas linhagens de C. neoformans e C. gattii.
A ação fungicida é desejável para os agentes antimicrobianos, principalmente, porque a ação fungistática apenas inibe o crescimento do micro-organismo. Dessa forma, agentes fungistáticos são menos interessantes clinicamente quando se pensa em desenvolver um fármaco antimicrobiano[21]. O fluconazol é um exemplo de agente fungistático, sendo raramente usado como monoterapia para tratar micoses sistêmicas, devido à elevada taxa de resistência a esse fármaco[2]. Dessa forma, é possível afirmar que os resultados encontrados para a FHGG e para o lupeol são relevantes, já que se observou um efeito fungicida contra três das seis linhagens testadas de C. neoformans. Além do mais, vale ressaltar que os valores de CFM para dez das doze linhagens testadas foram iguais ou superiores a 2 vezes o valor de CIM, o que ainda é considerado fungicida para alguns autores[15,22].
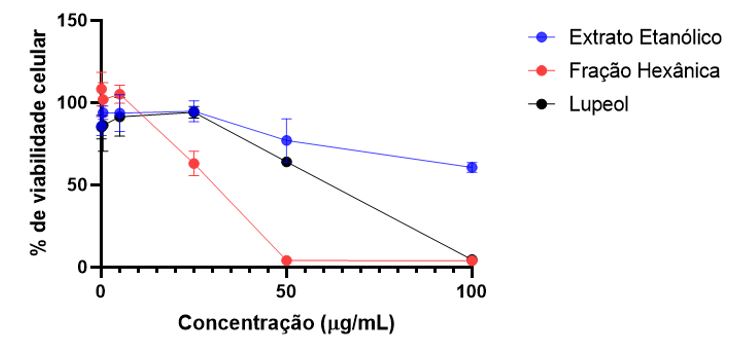
A FIGURA 2 mostra os resultados de porcentagem de viabilidade celular dos macrófagos murinos frente ao extrato etanólico, fração hexano e lupeol, onde foi possível calcular a CC50. De posse de dados de atividade biológica e informações sobre a citotoxicidade é possível calcular o índice de seletividade (IS), um parâmetro que demonstra a relação entre eficácia e segurança de um extrato ou substância, e pode ser obtido a partir da razão entre os valores CC50 e CIM[12]. Considerando as médias geométricas dos valores de CIM, o IS do lupeol foi 1,3 para C. neoformans e 1,5 para C. gatti. Para algumas linhagens, o IS do lupeol foi 4,22, o que indica alguma seletividade dos compostos contra os patógenos fúngicos[12].
Conclusão
Os experimentos realizados ajudaram a compreender que a FHGG e o lupeol analisados tiveram resultados relevantes, apresentando ação antifúngica in vitro contra as linhagens estudadas. O lupeol apresentou CIM abaixo dos valores citotóxicos para macrófagos J774. Para melhor compreender a atividade antifúngica das folhas de G. gardneriana, bem como os mecanismos de ação envolvidos, mais estudos são necessários. Assim, será possível avançar para modelos invertebrados e, posteriormente, testes em modelos murinos.
Fontes de Financiamento
Universidade Federal de Juiz de Fora - Programa BIC/UFJF - projeto 46803 aprovado no Edital XXXII BIC/UFJF- 19/20. FAPEMIG - Projeto APQ 00265/18 - Chamada 01/2018 - Demanda Universal e FAPEMIG - Projeto APQ 02648/18 - Chamada 01/2018 - Demanda Universal.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
Universidade Federal de Juiz de Fora e FAPEMIG.
Colaboradores
Concepção do estudo: KLL; GFF
Curadoria dos dados: ABC; BJT; CCSA; SBRC; KLL; GFF
Coleta de dados: ABC; DVMM; QSR; BJT; CCSA; SBRC; KLL; GFF
Análise dos dados: ABC; DVMM; QSR; MMA; BJT; CCSA; SBRC; KLL; GFF
Redação do manuscrito original: ABC; KLL; GFF
Redação da revisão e edição: MMA; KLL; GFF
Referências
1. Kwon-Chung KJ, Fraser JA, Doering TL, Wang Z, Janbon G, Idnurm A et al. Cryptococcus neoformans and Cryptococcus gattii, the etiologic agents of cryptococcosis. Cold Spring Harb Perspect Med [online]. 2014; 4(7): a019760. [acesso em: 23 mai. 2020]. Disponível em: [https://doi.org/10.1101/cshperspect.a019760].
2. Maziarz EK, Perfect JR. Cryptococcosis. Infect Dis Clin North Am [online]. 2016 mar; 30(1): 179-206. [acesso em: 27 mai. 2020]. Disponível em: [https://doi.org/10.1016/j.idc.2015.10.006] [https://pubmed.ncbi.nlm.nih.gov/26897067/].
3. Spadari CC, Wirth F, Lopes LB, Ishida K. New Approaches for Cryptococcosis Treatment. Microorganisms [online]. 2020; 8(4): 613. [acesso em: 4 mai. 2020]. Disponível em: [https://doi.org/10.3390/microorganisms8040613].
4. Rajasingham R, Smith RM, Park BJ, Jarvis JN, Govender NP, Chiller TM et al. Global burden of disease of HIV-associated cryptococcal meningitis: an updated analysis. Lancet Infect Dis [online]. 2017 aug; 17(8): 873-881. [acesso em: 2 mai. 2020]. Disponível em: [https://doi.org/10.1016/S1473-3099(17)30243-8] [https://pubmed.ncbi.nlm.nih.gov/28483415/].
5. Soares EA, Lazera, S, Wanke, B, Ferreira F, Oliveira AG, Coutinho ZF. Mortality by cryptococcosis in Brazil from 2000 to 2012: a descriptive epidemiological study. PLOS Negl Trop Dis [online]. 2019; 13(7): [acesso em: 2 mai. 2020]. Disponível em: [https://doi.org/10.1371/journal.pntd.0007569] [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6687200/].
6. Coutinho ZF, Wanke B, Travassos C, Oliveira RM, Xavier DR, Jr. Coimbra CE. Hospital morbidity due to paracoccidioidomycosis in Brazil (1998-2006). Trop Med Int Health [online]. 2015; May; 20(5): 673-680. [acesso em: 2 mai. 2020]. Disponível em: [https://doi.org/10.1111/tmi.12472] [https://pesquisa.bvsalud.org/portal/resource/pt/lil-772822].
7. Brasil, Ministério da Saúde. Banco de dados do Sistema Único de Saúde. Fonte: MS/SVS/CGIAE - Sistema de Informações sobre Mortalidade – SIM. DATASUS2020. [acesso em: 21 mar. 2022] Disponível em: [http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sim/cnv/obt10br.de].
8. Singulani JL, Galeane MC, Ramos MD, Gomes PC, Dos Santos CT, de Souza BM et al. Antifungal Activity, Toxicity, and Membranolytic Action of a Mastoparan Analog Peptide. Front Cell Infect Microbiol [online]. 2019; Dec 6; 9: 419. [acesso em: 02 set. 2021]. Disponível em: [https://doi.org/10.3389/fcimb.2019.00419] [https://pubmed.ncbi.nlm.nih.gov/31867293/].
9. Newman DJ, Cragg GM. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. J Nat Prod [online]. 2020 Mar 27; 83(3): 770-803. [acesso em: 14 ago. 2022]. Disponível em: [https://pubs.acs.org/doi/pdf/10.1021/acs.jnatprod.9b01285].
10. Espírito Santo BLSD, Santana LF, Kato Junior WH, de Araújo FO, Bogo D, Freitas KC et al. Medicinal Potential of Garcinia Species and Their Compounds. Molecules [online]. 2020; Oct. 1; 25(19): 4513. [acesso em: 01 set. 2021]. Disponível em: [https://doi.org/10.3390/molecules25194513] [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7582350/].
11. Rocha AP, Matos VP, Sena LHM, Pacheco MV, Ferreira RLC. Métodos para superação da dormência em sementes de Garcinia gardneriana (Planch. & Triana) Zappi. Ciênc Florest [online]. 2018; 28: 510-514. [acesso em: 01 set. 2021]. [https://doi.org/10.5902/1980509832031].
12. Ramadwa TE, McGaw LJ, Adamu M, Madikizela B, Eloff JN. Anthelmintic, antimycobacterial, antifungal, larvicidal and cytotoxic activities of acetone leaf extracts, fractions and isolated compounds from Ptaeroxylon obliquum (Rutaceae). J Ethnopharmacol [online]. 2021 Nov 15; 280: 114365. [acesso em: 15 ago. 2022]. Disponível em: [https://doi.org/10.1016/j.jep.2021.114365] [https://pubmed.ncbi.nlm.nih.gov/34175445/].
13. Shahlaei M, Ghanadian SM, Ayatollahi AM, Mesaik, MA, Abdalla, OM, Afsharypour S et al. Molecular modeling, structure activity relationship and immunomodulatory properties of some lupeol derivatives. Med Chem Res [online]. 2013; 22: 1795-1803. [acesso em: 15 ago. 2022]. Disponível em: [https://doi.org/10.1007/s00044-012-0183-y].
14. Clinical and Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved standard M27-A3, 3rd ed. Clinical and Laboratory Standards Institute, Wayne, PA, 2008. Disponível em: [https://clsi.org/].
15. Abedini A, Colin M, Hubert J, Charpentier E, Angelis A, Bounasri H et al. Abundant Extractable Metabolites from Temperate Tree Barks: The Specific Antimicrobial Activity of Prunus Avium Extracts. Antibiotics (Basel). 2020 Mar 4; 9(3): 111. Disponível em: [https://doi.org/10.3390/antibiotics9030111] [https://pubmed.ncbi.nlm.nih.gov/32143394/].
16. Folly MLC, Ferreira GF, Salvador MR, Sathler AA, da Silva GF, Santos JCB et al. Evaluation of in vitro Antifungal Activity of Xylosma prockia (Turcz.) Turcz. (Salicaceae) leaves against Cryptococcus spp. Front Microbiol [online]. 2020 Feb 6; 10: 3114. [acesso em: 15 ago. 2022]. Disponível em: [https://doi.org/10.3389/fmicb.2019.03114] [https://pubmed.ncbi.nlm.nih.gov/32117083/].
17. Barbosa Junior AM, Melo DLFM, Almeida FTC, Trindade RC. Estudo comparativo da susceptibilidade de isolados clínicos de Cryptococcus neoformans (Sanfelice, 1895) frente a alguns antifúngicos de uso hospitalar e extratos vegetais obtidos de plantas medicinais da região semiárida sergipana. Rev Bras Pl Med [online]. 2015; 17(1): 120-132. [acesso em: 6 fev. 2021]. Disponível em: [https://doi.org/10.1590/1983-084X/11_177].
18. Javed S, Mahmood Z, Khan, KM, Sarker S, Jarvaid A et al. Lupeol acetate as a potent antifungal compound against opportunistic human and phytopathogenic mold Macrophomina phaseolina. Sci Rep [online]. 2021; 11: 8417. [acesso em: 6 jan. 2022]. Disponível em: [https://doi.org/10.1038/s41598-021-87725-7].
19. Ríos JL, Recio MC. Medicinal plants and antimicrobial activity. J Ethnopharmacol [online]. 2005; 100(1-2): 80-84. [acesso em: 6 jan. 2022]. Disponível em: [https://doi.org/10.1016/j.jep.2005.04.025] [https://pubmed.ncbi.nlm.nih.gov/15964727/].
20. Silva PR, Rabelo RAS, Terra APS, Teixeira DNS. Susceptibilidade a antifúngicos de variedades de Cryptococcus neoformans isoladas de pacientes em hospital universitário. Rev Soc Bras Med Trop [online]. 2008; 41(2): 158-162. [acesso em: 8 jan. 2022]. Disponível em: [https://doi.org/10.1590/S0037-86822008000200005].
21. Hafidh RR, Abdulamir AS, Vern LS, Abu Bakar F, Abas F, Jahanshiri F et al. Inhibition of growth of highly resistant bacterial and fungal pathogens by a natural product. Open Microbiol J [online]. 2011; 5: 96-106. [acesso em: 25 nov. 2021]. Disponível em: [https://doi.org/10.2174/1874285801105010096] [https://pubmed.ncbi.nlm.nih.gov/21915230].
22. Gucwa K, Milewski S, Dymerski T, Szweda P. Investigation of the Antifungal Activity and Mode of Action of Thymus vulgaris, Citrus limonum, Pelargonium graveolens, Cinnamomum cassia, Ocimum basilicum, and Eugenia caryophyllus Essential Oils. Molecules. 2018 May 8; 23(5): 1116. Disponível em: [https://doi.org/10.3390/molecules23051116] [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6099571/]