REVISÃO
Hepatotoxicidade causada após uso oral de Aloe vera (L.)Burm. f. (Asphodelaceae): revisão integrativa
Hepatotoxicity caused after oral use of Aloe vera (L.)Burm. f. (Asphodelaceae): an integrative review
Resumo
O consumo da Aloe vera (L.)Burm. f. (A. vera) pode causar riscos à saúde. Assim, o objetivo deste trabalho consistiu em identificar e apresentar, a partir de uma revisão integrativa da literatura, as informações disponíveis sobre casos de hepatotoxicidade ocorridos após a ingestão de preparações de A. vera. A busca foi feita nas bases de dados PubMed, Scopus e Web of Science, com os descritores "hepatitis AND Aloe" e "liver AND Aloe", e oito artigos foram incluídos na revisão. Os indivíduos envolvidos nos relatos de casos de hepatotoxicidade aqui analisados eram, em sua maioria, mulheres (70%); apenas 30% eram idosos e 80% não apresentavam comorbidades. A automedicação foi a circunstância de exposição mais relatada (60%). Exposições do tipo crônica ou subcrônica foram as mais frequentes (90%), bem como o desenvolvimento de lesão do tipo hepatocelular (90%). Todos os casos receberam a classificação Roussel Uclaf Causality Assessment Method como provável ou definida. Curiosamente, a suspensão do uso gerou a cura de todos os pacientes. Concluiu-se, assim, que A. vera foi o agente responsável pela hepatotoxicidade em todos os casos, o que enfatiza a importância de uma orientação profissional especializada ao se utilizar preparações à base de plantas.
- Palavras-chave:
- Insuficiência hepática.
- Aloe.
- Suplementos nutricionais.
- Plantas medicinais.
- Toxicologia.
Abstract
The consumption of Aloe vera (L.) Burm.f. (A. vera) may present serious health risks. The objective of this study was to assess the available information on hepatotoxicity cases following the ingestion of A. vera preparations by means of an integrative literature review. Thus, using the descriptors "hepatitis AND Aloe" and "liver AND Aloe", a search through PubMed, Scopus and Web of Science databases yielded eight papers for review. Hepatotoxicity cases, as reported by such studies, concerned mostly women (70%) – only 30% of individuals thus intoxicated were elderly and 80% of them had no comorbidities. Self-medication was the most reported exposure circumstance (60%). Chronic or subchronic exposures were most frequent (90%), the development of hepatocellular lesions being reported as equally prevalent (90%). All cases were classified as probable or definite using the Roussel Uclaf Causality Assessment Method. Interestingly, the discontinuation of use yielded a cure in all patients, thus allowing for the conclusion that A. vera was the agent responsible for hepatotoxicity in all cases. Such results emphasize the importance of expert professional guidance when using herbal preparations.
- Keywords:
- Hepatic Insufficiency.
- Aloe.
- Dietary supplements.
- Medicinal plants.
- Toxicology.
Introdução
As plantas têm sido utilizadas por séculos para fins medicinais. Existem mais de 400 espécies do gênero Aloe, entre as quais a Aloe vera (L.)Burm.f.(A. vera), popularmente conhecida no Brasil como babosa, é uma das mais utilizadas em tratamentos em prol da saúde[1]. O uso dessa planta está associado à prevenção e ao alívio de inúmeras doenças devido as suas propriedades laxativa, analgésica, anti-inflamatória, antibacteriana, antiviral, dentre outras[2].
A folha da A. vera, parte da planta utilizada com fins medicinais, apresenta três camadas identificáveis: uma interna, uma intermediária e uma externa. A região interna constitui-se de células parenquimatosas, as quais produzem uma substância mucilaginosa conhecida como gel de A. vera, composta por cerca de 99% de água e, o restante, de polissacarídeos, aminoácidos, lipídios, esteróis, vitaminas e glucomananas[3].
A camada intermediária produz o látex, um exsudato amarelo e amargo comumente chamado de "seiva da Aloe", que contém, sobretudo, glicosídeos e antraquinonas, como a aloína[3]. Os feixes vasculares ali presentes atuam como um sistema de transporte de substâncias, tais como água e sais mineirais, e variam em sua quantidade, conforme o tamanho da folha[2].
A parte mais externa, também denominada casca, contém proteínas, carboidratos e gorduras. Ela consiste em múltiplas camadas de células intercaladas com cloroplastos, conferindo, assim, rigidez e proteção à planta[2].
O consumo crescente de produtos dietéticos, como aqueles que apresentam A. vera em sua composição, tem suscitado preocupação quanto à segurança de sua ingestão para a saúde humana, uma vez que muitas pessoas utilizam tais preparações sem a devida compreensão dos possíveis efeitos adversos. Ainda que a referida planta tenha sido considerada, por anos, um suplemento alimentar funcional isento de riscos, ressalva-se, com base em diversos estudos mais recentes, que ela pode não ser tão segura como se imaginava[4].
Há na literatura relatos sobre a ocorrência de prejuízos à saúde após o consumo oral de preparações à base de A. vera[4-6]; dentre os efeitos adversos, a hepatotoxicidade é um dos mais referidos. O primeiro caso de lesão hepática, descrito por Rabe et al.[7], ocorreu na Alemanha, em 2005. Depois dele, diversos trabalhos evidenciaram o potencial hepatotóxico da planta, tais como alguns estudos provenientes da Turquia[8], dos Estados Unidos[9], da Argentina[10] e da Coreia do Sul[1].
Em relação a outros efeitos tóxicos atribuídos à A. vera[6,11,12],chama a atenção o fato de que o extrato da folha inteira foi classificado pela Agência Internacional de Pesquisa em Câncer (IARC, do inglês International Agency for Research on Cancer) como um carcinógeno do grupo 2B, o que significa que ele é constituído por compostos possivelmente carcinogênicos aos humanos[13].
Os riscos associados à A. vera evidenciam que o uso racional de plantas medicinais configura, ainda, um desafio a ser enfrentado pelo sistema de saúde brasileiro. Dentre esses desafios, destaca-se a crença de que "o que é natural não faz mal à saúde", ignorando, assim, a possibilidade de ocorrência de eventos indesejáveis, bem como a prescrição e dispensação não regulamentadas, haja vista que os produtos à base de plantas, muitas vezes, são de venda livre[14].
Ademais, raramente o paciente associa, de imediato, a ocorrência de alguma adversidade ao produto utilizado, pelo fato de não considerar, muitas vezes, os produtos herbáceos como medicamentos. Isto corrobora as pessoas a sequer citarem o seu uso durante o atendimento por um profissional de saúde[14].
É fundamental, pois, que esses profissionais sejam capacitados para atuar na prescrição, dispensação, orientação e acompanhamento de pacientes com histórico de uso de plantas medicinais, tanto para garantir o sucesso terapêutico quanto para evitar, detectar ou mitigar possíveis eventos adversos[15].
Diante do exposto, o objetivo do estudo foi identificar e apresentar, a partir de uma revisão integrativa da literatura, as informações disponíveis sobre casos de hepatotoxicidade ocorridos após a ingestão de preparações de Aloe vera.
Metodologia
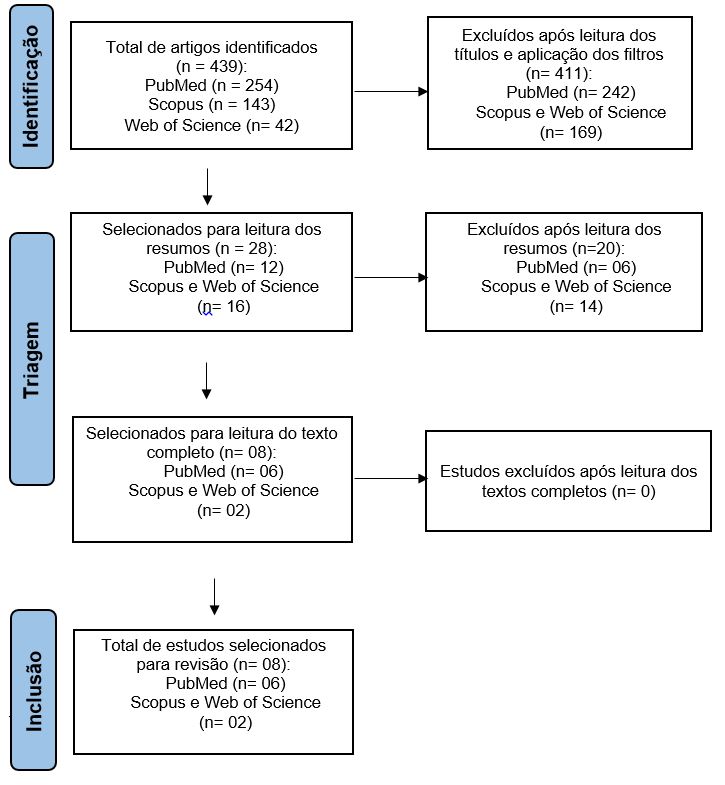
Este trabalho foi elaborado com base no método de revisão integrativa tal como preconizado por Mendes, Silveira e Galvão[16]. Os artigos foram selecionados através de buscas nas bases de dados eletrônicas disponíveis: PubMed (Medline), Scopus e Web of Science (via Portal Periódico da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - CAPES). Os descritores utilizados para a busca literária foram "hepatitis" (hepatite), "Aloe" e "liver" (fígado), sendo a combinação dos termos feita através do operador booleano AND (FIGURA 1).
Incluíram-se nas buscas relatos publicados entre 2002 e 2022, em português, inglês ou espanhol, com abordagem em humanos e que associassem o uso de preparações orais de A. vera a possíveis efeitos hepatotóxicos. Em contrapartida, foram excluídos estudos que envolvessem experimentação animal, qualquer outra via de administração que não a oral, ensaios clínicos, revisões de literatura e relatos de intoxicação associados ao uso de compostos isolados da A. vera e/ou combinados, por exemplo, a outras plantas ou medicamentos.
Foram analisadas e categorizadas as seguintes variáveis: características do(a) paciente (sexo, idade, presença de comorbidades e de fator de risco para hepatotoxicidade), exposição (circunstância da exposição, motivação para o uso, tempo de uso e tipo de exposição), sinais e sintomas da intoxicação, tipo de lesão hepática, pontuação Russel Uclaf Causality Assessment Method (RUCAM), tratamento e desfecho.
Definiu-se o tipo de exposição a partir da análise do tempo de uso da A. vera por cada indivíduo, conforme preconizado por Klaassen[17]. De acordo com o autor, as exposições de humanos a agentes tóxicos podem ser classificadas como aguda (quando ocorre uma única exposição), subcrônica (exposição repetida ao longo de várias semanas ou meses), ou crônica (quando ocorre repetidamente por muitos meses ou anos). Consideraram-se, assim, como intoxicação aguda os casos de exposição única; subcrônica, aqueles com até um mês de exposição; e crônica, todos os casos com mais de um mês de exposição.
A lesão hepática induzida por medicamentos, também conhecida como hepatite medicamentosa ou DILI (do inglês Drug Induced Liver Injury), é uma doença que afeta o funcionamento do fígado e se manifesta entre 5 a 90 dias após a exposição do paciente ao agente tóxico. Nos termos do Conselho das Organizações Internacionais de Ciências Médicas (CIOMS, do inglês Councils for International Organizations of Medical Sciences), a hepatite medicamentosa pode ser classificada de três formas: lesão hepatocelular, colestática ou mista, de acordo com o seu valor de razão (R)[18].
A lesão hepatocelular é definida por meio dos níveis séricos de alanina aminotransferase (ALT) duas vezes maior que o limite superior de normalidade (LSN), ou de razão (R) maior ou igual a 5. A razão (R) consiste na divisão de ALT pelos níveis séricos de fosfatase alcalina (FA). O tipo colestático, por sua vez, ocorre quando FA é maior que duas vezes o LSN ou quando R é maior ou igual a 2. Quando o nível de ALT for maior que duas vezes o LSN e R maior que 2 e menor que 5[19], a lesão será do tipo misto.
A pontuação RUCAM estabelece uma relação de causalidade entre um determinado agente tóxico e o desenvolvimento de hepatotoxicidade. Trata-se de um esquema de pontuação que classifica essa relação de cinco formas: definida ou altamente provável (pontuação > 8), provável (pontuação 6-8), possível (pontuação 3-5), improvável (pontuação 1-2) ou excluída (pontuação ≤ 0)[20].
Resultados e Discussão
O processo de seleção dos estudos primários encontrados para a revisão integrativa está apresentado a seguir (FIGURA 1).
Foram selecionados oito artigos para compor esta revisão integrativa. Dois desses estudos foram publicados na Coreia do Sul e três deles na Europa: um na Espanha, um na França e um na Alemanha. Da América do Norte e do Sul foram selecionadas duas publicações, uma dos Estados Unidos e outra da Argentina, respectivamente, ao passo que do chamado "país intercontinental" ou "euroasiático", como a Turquia, apenas uma atendeu aos critérios de seleção.
É possível notar que todos os estudos foram publicados a partir de 2005, dos quais apenas um está redigido em espanhol e, os demais, em língua inglesa (TABELA 1).
| ID | Autores | Título do artigo | Ano | País | Base de dados |
|---|---|---|---|---|---|
| 01 | Ha Na Yang, Dong Joon Kim, Young Mook Kim, Byoung Ho Kim, Kyoung Min Sohn, Myung Jin Choi e Young Hee Choi | Aloe-induced Toxic Hepatitis. | 2010 | Coreia do Sul | PubMed |
| 02 | Michelle M Bottenberg, Geoffrey C Wall, Roger L Harvey, e Shahid Habib | Oral Aloe vera–Induced Hepatitis. | 2007 | Estados Unidos | PubMed |
| 03 | Jeonghun Lee, Mi Sun Lee e Kwan Woo Nam | Acute Toxic Hepatitis Caused by an Aloe vera Preparation in a Young Patient: A Case Report with a Literature Review. | 2014 | Coreia do Sul | PubMed |
| 04 | Christian Rabe, Annemarie Musch, Peter Schirmacher, Wolfgang Kruis e Robert Hoffmann | Acute hepatitis induced by an Aloe vera preparation: A case report. | 2005 | Alemanha | Web of Science |
| 05 | Ozkan Kanat, Ahmet Ozet e Selmin Ataergin | Aloe vera-induced acute toxic hepatitis in a healthy young man. | 2006 | Turquia | Scopus |
| 06 | Paola Vázquez-Fernández, Ana Garayoa-Roca, Ramón Añón-Rodríguez, María Cabezas-Macián, Miguel Ángel Serra-Desfilis e Francisco Mora-Miguel | Aloe vera: Not always so beneficial in patients with chronic liver disease. | 2013 | Espanha | PubMed |
| 07 | Lucia Parlati, Cosmin Sebastian Voicana, Katy Perlemuter e Gabriel Perlemuter | Aloe vera-induced acute liver injury: A case report and literature review | 2016 | França | PubMed |
| 08 | José Curciarello, Silvia De Ortúzar, Silvia Borzi e Daniel Bosia | Hepatitis aguda grave asociada al consumo de té de Aloe vera | 2008 | Argentina | PubMed |
| Fonte: Elaborada pelos autores. | |||||
A TABELA 2 apresenta as características de sexo, idade, comorbidades e fatores de risco para hepatotoxicidade dos pacientes envolvidos nos relatos de casos analisados.
| ID | Características dos pacientes | ||
|---|---|---|---|
| Sexo | Idade (anos) | Comorbidades e outros fatores de risco para hepatotoxicidade | |
| 01 | Caso 1: Feminino Caso 2: Feminino Caso 3: Feminino |
Caso 1: 57 Caso 2: 62 Caso 3: 55 |
Caso 1: não possuía Caso 2: não possuía Caso 3: não possuía |
| 02 | Feminino | 73 | Não possuía |
| 03 | Feminino | 21 | Não possuía |
| 04 | Feminino | 57 | Não possuía |
| 05 | Masculino | 24 | Não possuía |
| 06 | Masculino | 49 | Doença hepática crônica causada pelo vírus da hepatite C (HCV) |
| 07 | Feminino | 68 | Diabetes Mellitus, hipertensão e dislipidemia |
| 08 | Masculino | 26 | Uso de álcool e drogas ilícitas dos 16 aos 20 anos de idade. |
| Fonte: Elaborada pelos autores. | |||
Apreende-se que, dos dez casos relatados, a maior parte envolveu mulheres (sete casos, 70%). Os achados desta revisão estão em concordância com os dados de consumo dos Estados Unidos, onde os suplementos dietéticos, dentre eles os herbais, são consumidos majoritariamente por mulheres[21] (TABELA 2).
Os resultados de um estudo conduzido por Elinav et al.[22] também corroboram esses achados: de 12 pacientes vítimas de hepatite aguda após o consumo de produtos Herbalife®, 11 eram do sexo feminino (91,6%). Herbalife® é uma marca que desenvolve e comercializa suplementos alimentares de origem natural[23], em cuja composição há, muitas vezes, plantas potencialmente hepatotóxicas[22].
Com relação à faixa etária, é possível observar que em 30% dos casos os pacientes tinham mais de 60 anos. Achado semelhante encontra-se em uma pesquisa realizada no estado da Paraíba, na qual constatou-se que a população de 60 a 79 anos foi a menos acometida por intoxicação por plantas (5,7% dos casos)[24].
Além disso, a maioria dos pacientes não possuía comorbidades, à exceção de dois casos, nos quais um deles, do sexo masculino, já possuía histórico de doença hepática (ID nº 06), e o outro, de uma mulher, apresentava Diabetes Mellitus, hipertensão e dislipidemia (ID nº 07).
Na tentativa de melhorar o seu quadro, o paciente do caso ID no 06 ingeriu uma preparação à base de A. vera com 99,7% de pureza durante dez dias. Após esse uso, no entanto, houve uma piora na lesão hepática[25].
No caso ID nº 08, o paciente já havia feito uso de álcool e de drogas ilícitas no passado, fatores de risco para o desenvolvimento de doença hepática. Durante três anos ingeriu chá de A. vera de forma esporádica, mas passou a tomá-lo diariamente cerca de quatro semanas antes da sua admissão hospitalar. Dado que o paciente em questão deixou de utilizar as referidas substâncias há aproximadamente seis anos e, após a interrupção do uso de A. vera, apresentou um quadro de melhora, foram excluídas outras possíveis causas de hepatite aguda. Nesses dois últimos casos, os autores sugerem que a causa mais provável para a ocorrência da hepatotoxicidade foi o consumo da preparação à base de A. vera[8].
Para cada um dos relatos mencionados, a TABELA 3 apresenta as características da exposição ao agente tóxico, como a circunstância da exposição, motivação pessoal para o uso, tempo de uso e o tipo de exposição (aguda, subcrônica e crônica).
| ID | Características da exposição | |||
|---|---|---|---|---|
| Circunstância | Motivação pessoal de uso | Tempo de uso | Tipo de exposição | |
| 01 | Caso 1: Indefinido Caso 2: Indefinido Caso 3: Indefinido |
Caso 1: Indefinido Caso 2: Paciente vendia o próprio produto Caso 3: Indefinido |
Caso 1: 6 meses Caso 2: 3 meses Caso 3: 5 meses |
Caso 1: Crônica Caso 2: Crônica Caso 3: Crônica |
| 02 | Automedicação | Constipação | 5 anos | Crônica |
| 03 | Automedicação | Emagrecimento | 1 mês | Subcrônica |
| 04 | Automedicação | Antienvelhecimento | 1 mês | Subcrônica |
| 05 | Automedicação | Desenvolvimento de uma "vida saudável" | 3 semanas | Subcrônica |
| 06 | Automedicação | Efeito hepatoprotetor | 10 dias | Subcrônica |
| 07 | Indefinido | Indefinido | Indefinido | Indefinido |
| 08 | Automedicação | Melhora da digestão | 3 anos | Crônica |
| Fonte: Elaborada pelos autores. | ||||
A automedicação foi a circunstância de exposição mais relevante (seis casos, 60%). Ela ocorre com mais frequência com os medicamentos de venda livre, como alguns analgésicos, antialérgicos, descongestionantes nasais, dentre outros. No caso dos fitoterápicos, o cenário não é diferente: no Brasil, esses produtos são isentos de prescrição e vendidos tanto em farmácias e drogarias quanto em lojas de produtos naturais, supermercados, feiras livres e até mesmo por meio eletrônico[26].
A livre comercialização desses produtos levanta preocupações quanto a sua segurança, qualidade e estabilidade, uma vez que não há garantia de que eles foram armazenados e transportados de forma correta. Além disso, o acesso facilitado possibilita que plantas hepatotóxicas como Piper methysticum, Camellia sinensis e, neste caso, a A. vera, sejam utilizadas livremente pela população, para quem os potenciais riscos que elas podem trazer à saúde humana são, muitas vezes, desconhecidos[26].
Nos Estados Unidos, a situação é semelhante: o chá verde (Camellia sinensis), planta comprovadamente hepatotóxica, é regulado como suplemento dietético, não recebendo o mesmo rigor na fiscalização e no controle de uso tal qual os produtos regulados como medicamentos recebem. Alguns estudos apontam que cerca de um terço, ou até mesmo metade da população norte-americana, utiliza suplementos dietéticos, dentre os quais aqueles à base de plantas. Isto demonstra a necessidade de formulação de políticas públicas que conscientizem a população a respeito dos riscos associados ao consumo desses produtos[26].
Os estudos apontam motivações pessoais diversas no uso da A. vera: melhora da constipação intestinal e da digestão, busca por um efeito emagrecedor, antienvelhecimento, efeito hepatoprotetor, melhora da qualidade de vida. Observa-se, todavia, que tais motivações são genéricas, isto é, não há menção à planta no combate a uma doença ou a um agravo específico[21].
No estudo conduzido por Elinav et al.[22], as motivações para o uso de suplementos dietéticos à base de plantas assemelham-se bastante com as relatadas pelos pacientes desta revisão integrativa. Naquela pesquisa, nove dos doze pacientes que desenvolveram hepatite aguda após o consumo de Herbalife® (75%) alegaram fazer uso desses produtos em busca de redução do peso corporal, enquanto os três restantes objetivaram uma "melhora do bem-estar"[22].
A perda de peso, motivo majoritário mencionado por Elinav et al.[22] e também por um dos pacientes desta revisão integrativa (TABELA 3, ID nº 03), é amplamente difundida pela Herbalife® em suas mídias digitais. Em uma página eletrônica oficial associada à marca, a Herbacorp, é possível encontrar inúmeras promessas de que o consumo de seus produtos levará à perda de peso[27]. Muitos deles apresentam plantas hepatotóxicas em sua composição, como a A. vera (babosa) e a Camellia sinensis (chá verde)[22].
Nos Estados Unidos, é proibido aos fabricantes de suplementos dietéticos que façam alegações médicas e promessas de eficácia e segurança no combate a doenças ou agravos como diabetes, hipertensão, dislipidemia, entre outros. A fim de contornar essa proibição, o marketing dessas empresas relaciona os supostos benefícios dos produtos a situações inespecíficas, como aumento de energia, libido, bem-estar, saúde do fígado ou emagrecimento[21], coincidentemente as mesmas relatadas pelos pacientes do presente trabalho (TABELA 3).
Isto evidencia o poder de influência que exerce o marketing das empresas de produtos naturais sobre a população, a qual, tendo livre acesso a eles, acaba por utilizá-los sem orientação médica, crentes de que não terão efeitos nocivos sobre a saúde humana[21].
Por outro lado, a frequência de exposição à toxicidade de certas plantas variou de poucos dias (dez) a alguns meses (seis). Assim, com base na classificação do tipo de exposição – aguda, subaguda e crônica – estabelecida por Klaasen[17], foram apreendidos cinco casos de exposição crônica, quatro de subcrônica e um indefinido. Em praticamente todos os casos, portanto, foi necessária a exposição repetida do paciente à A. vera para que lhe ocorresse o desenvolvimento de dano hepático, o que sugere que uma única exposição ao referido agente tóxico não seria capaz de induzir esse dano.
A TABELA 4 mostra as principais características relacionadas aos sinais e sintomas, ao tipo de lesão hepática, à pontuação RUCAM, ao tratamento e ao desfecho da intoxicação.
| ID | Sinais e sintomas na admissão hospitalar | Tipo de lesão hepática | Pontuação RUCAM | Tratamento | Desfecho |
|---|---|---|---|---|---|
| 01 | Caso 1: Dispepsia Caso 2: Fadiga e icterícia. Caso 3: Desconforto epigástrico |
Caso 1: Hepatocelular Caso 2: Hepatocelular Caso 3: Hepatocelular |
Caso 1: Provável Caso 2: Definida Caso 3: Provável |
Caso 1: Suspensão imediata do uso Caso 2: Suspensão imediata do uso Caso 3: Suspensão imediata do uso |
Caso 1: Alta hospitalar Caso 2: Alta hospitalar Caso 3: Alta hospitalar |
| 02 | Mal-estar geral, falta de apetite, náuseas, dor no ombro direito, perda de peso, icterícia, urina escura e fezes acólicas | Hepatocelular | Provável | Suspensão imediata do uso | Alta hospitalar |
| 03 | Desconforto abdominal, náusea, febre baixa, esplenomegalia leve | Hepatocelular | Definida | Suspensão imediata do uso | Alta hospitalar |
| 04 | Icterícia, fezes acólicas e desconforto abdominal no quadrante superior direito | Hepatocelular | Provável | Suspensão imediata do uso | Alta hospitalar |
| 05 | Icterícia, fadiga, desconforto abdominal superior direito, náuseas e vômitos | Hepatocelular | Provável | Suspensão imediata do uso | Alta hospitalar |
| 06 | Icterícia e dor no hipocôndrio direito | Colestático | Provável | Suspensão imediata do uso | Alta hospitalar |
| 07 | Assintomático. Descobriu a hepatite aguda ao realizar exames de rotina | Hepatocelular | Provável | Suspensão imediata do uso | Alta hospitalar |
| 08 | Síndrome gripal, dor abdominal e icterícia | Hepatocelular | Provável | Suspensão imediata do uso | Alta hospitalar |
| Fonte: Elaborada pelos autores. | |||||
Na maior parte dos casos os pacientes já apresentavam sintomas na admissão hospitalar (nove casos, 90%). Apenas um assintomático foi observado (ID nº 07), e a paciente só descobriu o dano hepático ao realizar um exame laboratorial de rotina, o que lhe possibilitou um diagnóstico precoce[28]. Os sintomas mais relatados foram icterícia, desconforto abdominal e náusea, característicos de uma lesão hepática[29]. Outros sintomas inespecíficos também foram manifestados pelos pacientes, como mal-estar geral, falta de apetite e febre.
Em relação ao tipo de lesão hepática (DILI), esta última pode ser classificada como lesão hepatocelular, colestática ou mista, conforme descrito na metodologia. A forma hepatocelular tende a ter um prognóstico mais grave do que as formas colestática e mista[18], além de ser a manifestação mais comum entre os três tipos[19].
A partir dos dados é possível notar que todos os relatos de intoxicação por A. vera incluídos nesse estudo mencionam o desenvolvimento de lesão hepática. Desta totalidade, a lesão do tipo hepatocelular foi a predominante (nove dos dez casos, ou 90%), sendo a forma mais grave da doença[18]. Apenas um caso (ID nº 06) apresentou dano colestático. Nota-se, a partir disso, que o uso de suplementos orais à base de A. vera tende a gerar uma lesão hepática de pior prognóstico e maior gravidade, qual seja, a hepatocelular.
Resultados semelhantes foram evidenciados por Santos et al.[30] em um estudo sobre o perfil dos casos de lesão hepática causada por plantas e suplementos dietéticos (em inglês, Herbs and Dietary Supplements – HDS) na América Latina. Ali, o tipo de DILI mais frequente também foi o hepatocelular, seguido do colestático e do misto. Na Espanha, a lesão hepatocelular é igualmente a mais relevante (92%) dentre os casos de intoxicação por HDS[31]. Achados semelhantes foram encontrados, ainda, por Lucena e Navarro[32] e por Ballotin et al.[33].
Com relação à pontuação RUCAM, observa-se que 80% dos casos tiveram relação de causalidade provável, e os 20% restantes, como definida, a pontuação mais alta desse sistema de classificação (TABELA 4). Diante disso, todos os relatos receberam classificações que indicam uma significativa relação de causalidade entre o uso oral de A. vera e o aparecimento de doença hepática.
O perfil de elevada causalidade entre o uso de produtos à base de plantas e o desenvolvimento de lesão hepática, estabelecida pelo referido sistema de classificação, já é bem elucidado na literatura. Um estudo avaliou as principais plantas utilizadas na Medicina Tradicional Chinesa e estabeleceu a pontuação RUCAM como provável para inúmeras plantas, dentre as quais a Camellia sinensis, Lycopodium serratum e outras, características da região asiática[33].
Nos dez casos o tratamento adotado foi a suspensão imediata do uso da A. vera, o que resultou na cura de 100% dos pacientes (TABELA 4). Em outras palavras, todos os pacientes apresentaram uma rápida melhora da hepatotoxicidade e receberam alta hospitalar após a interrupção do uso dessa planta. Os dados, portanto, fornecem fortes evidências de que a preparação de A. vera foi a responsável pelo desenvolvimento de hepatotoxicidade[5].
Situação semelhante ocorreu no estudo de Elinav et al.[22], segundo o qual uma paciente de 55 anos, que há 30 fazia tratamento com estatinas e metformina, desenvolveu um quadro agudo de hepatite após consumir um produto da Herbalife® que continha A. vera em sua composição. A interrupção do uso do produto resultou na recuperação completa do quadro clínico da paciente. No entanto, dois meses após a alta hospitalar, voltou a utilizá-lo por conta própria, o que desencadeou um segundo quadro de hepatite grave após um mês de uso. Novamente, a interrupção do uso do produto resultou em sua completa recuperação[22].
Frente aos casos de intoxicação por A. vera, esforços são feitos continuamente para descobrir os mecanismos responsáveis por sua hepatotoxicidade. Acredita-se que esse dano se liga ao fato de que o fígado é o principal órgão com ação desintoxicante para xenobióticos, estando, pois, mais exposto a esses agentes tóxicos do que os outros, já que o sangue da veia porta que drena a superfície do intestino flui diretamente para esse órgão. Assim, o tecido hepático é exposto a todas as substâncias ingeridas e absorvidas pela via porta-hepática[34].
Um dos possíveis componentes responsáveis por tal efeito tóxico é a emodina, uma antraquinona presente, sobretudo, no látex da A. vera. Evidências mostram que essa substância foi capaz de causar lesões no fígado de peixes zebras por meio da elevação dos níveis de proteínas pró-inflamatórias e pró-apoptóticas, ativando as vias do fator nuclear kappa B (NF-κB) e do gene P53, vias pró inflamatórias[35].
Em outro estudo feito em ratos, observou-se que a emodina foi capaz de induzir ao estresse oxidativo e, consequentemente, ao dano hepático. Desta forma, ela inibiu a atividade da proteína 2 associada à resistência a múltiplas drogas (MRP2), um importante transportador de efluxo de substâncias indutoras de estresse oxidativo, alterando o equilíbrio de redução-oxidação (REDOX) intracelular do fígado. Por conseguinte, houve depleção da glutationa reduzida, a qual participa dos mecanismos de defesa contra o estresse oxidativo, além da disfunção mitocondrial e ativação das vias apoptóticas, ocasionando a lesão nesse órgão por oxidação e morte celular[36].
A principal enzima responsável pela metabolização da emodina é a CYP3A4, e a diminuição da expressão dessa enzima parece agravar a toxicidade da emodina em células hepáticas humanas, o que indica que essa enzima microssômica é fundamental no processo de destoxificação dessa antraquinona[37]. Assim, faz-se necessário o investimento em novos estudos que elucidem os mecanismos de toxicidade dos componentes da A. vera.
Diante do exposto, o consumo de plantas medicinais de forma irracional é um tema que deve ser amplamente discutido, tanto no meio científico quanto entre os profissionais de saúde e a sociedade, a fim de esclarecer os perigos que a automedicação pode trazer à saúde humana e mitigar, cada vez mais, os efeitos nocivos decorrentes do uso arbitrário dessas plantas.
Uma das principais limitações para a execução desta revisão integrativa é o número reduzido de publicações sobre os casos de lesão hepática por A. vera, não refletindo de forma fidedigna a realidade. A subnotificação dos casos de intoxicação ainda constitui um desafio a ser superado em inúmeras instâncias hospitalares brasileiras, e corrobora a baixa quantidade de publicações.
Apesar disso, a presente revisão integrativa contribui para traçar um perfil dos casos de intoxicação hepática pela referida planta, possibilitando, com isso, a elaboração de políticas públicas direcionadas ao combate desse problema ainda presente no sistema de saúde brasileiro e mundial.
Conclusão
Os dados obtidos nesta revisão integrativa fornecem fortes evidências de que a A. vera foi o agente responsável pela hepatotoxicidade em todos os relatos de casos. Isto enfatiza a importância de uma orientação profissional especializada, inclusive farmacêutica, ao fazer uso de medicamentos fitoterápicos e preparações caseiras à base de plantas.
Devido ao aumento da popularidade e da utilização da A. vera, são necessários estudos em profundidade para investigar as reações adversas, as interações com medicamentos convencionais e outros possíveis efeitos tóxicos das preparações dessa planta, a fim de garantir o seu uso seguro.
Fontes de Financiamento
Nenhuma.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
Universidade Federal do Ceará.
Colaboradores
Concepção do estudo: MADF
Curadoria dos dados: HRFS
Coleta de dados: HRFS
Análise dos dados: HRFS; MADF; ACBP
Redação do manuscrito original: HRFS;
Redação da revisão e edição: MADF; ACBP.
Referências
1. Lee J, Lee MS, Nam KW. Acute toxic hepatitis caused by an Aloe vera preparation in a young patient: a case report with a literature review. Korean J Gastroenterol [online]. 2014; 64(1): 54. [acesso em: 9 nov 2022]. [https://doi.org/10.4166/kjg.2014.64.1.54].
2. Boudreau MD, Beland FA. An evaluation of the biological and toxicological properties of Aloe barbadensis (Miller), Aloe vera. J Environ Sci Health C [online]. 2006; 24(1): 103–54. [acesso em: 7 nov 2022]. [https://pubmed.ncbi.nlm.nih.gov/16690538/] [https://doi.org/10.1080/10590500600614303].
3. Bach DB, Lopes MA. Estudo da viabilidade econômica do cultivo da babosa (Aloe vera l.). Ciênc agrotec [online]. 2007; 31(4): 1136–44. [acesso em: 14 mar 2022]. Disponível em: [https://doi.org/10.1590/S1413-70542007000400029].
4. Guo X, Mei N. Aloe vera: A review of toxicity and adverse clinical effects. J Environ Sci Health C [online]. 2016; 34(2): 77–96. [acesso em: 10 out 2022]. [https://pubmed.ncbi.nlm.nih.gov/26986231/] [https://doi.org/10.1080/10590501.2016.1166826].
5. Pigatto PD, Guzzi G. Aloe linked to thyroid dysfunction. Arch Med Res [online]. 2005; 36(5): 608. [acesso em: 24 out 2022]. [https://doi.org/10.1016/j.arcmed.2005.03.022].
6. Jangra A, Sharma G, Sihag S, Chhokar V. The dark side of miracle plant-Aloe vera: a review. Mol Biol Rep [online]. 2022; 49(6): 5029–40. [acesso em: 9 mar 2023]. [https://pubmed.ncbi.nlm.nih.gov/35092563/][https://doi.org/10.1007/s11033-022-07176-9].
7. Rabe C, Musch A, Schirmacher P, Kruis W, Hoffmann R. Acute hepatitis induced by an Aloe vera preparation: A case report. World J Gastroenterol [online]. 2005; 11(2): 303–4. [acesso em: 16 fev 2022]. [https://doi.org/10.3748/wjg.v11.i2.303].
8. Kanat O, Ozet A, Ataergin S. Aloe vera-induced acute toxic hepatitis in a healthy young man. Eur J Intern Med [online]. 2006; 17(8):589. [acesso em: 3 abr 2022]. [https://doi.org/10.1016/j.ejim.2006.04.017].
9. Bottenberg MM, Wall GC, Harvey RL, Habib S. Oral Aloe vera-induced hepatitis. Ann Pharmacother [online]. 2007; 41(10): 1740–3. [acesso em: 2 fev 2022]. [https://doi.org/10.1345/aph.1K132].
10. Curciarello J, De Ortúzar S, Borzi S, Bosia D. Hepatitis aguda grave asociada al consumo de té de Aloe vera. Gastroenterol Hepatol [online]. 2008; 31(7):436–8. [acesso em: 13 fev 2022]. [https://doi.org/10.1157/13125590].
11. Asgharzade S, Rafieian-kopaei M, Mirzaeian A, Reiisi S, Salimzadeh L. Aloe vera toxic effects: expression of inducible nitric oxide synthase (Inos) in testis of Wistar rat. Iran J Basic Med Sci [online]. 2015; 18(10). [acesso em: 31 ago 2022]. [https://doi.org/10.22038/ijbms.2015.5459].
12. Boudreau MD, Mellick PW, Olson GR, Felton RP, Thorn BT, Beland FA. Carcinogenic activity by a whole-leaf extract of Aloe barbadensis miller (Aloe vera) in F344/N rats. Toxicol Sci [online]. 2013; 131(1): 26-39. [acesso em: 14 mar 2022]. [https://pubmed.ncbi.nlm.nih.gov/22968693/] [https://doi.org/10.1093/toxsci/kfs275].
13. Grosse Y, Loomis D, Lauby-Secretan B, Ghissassi FE, Bouvard V, Benbrahim-Tallaa L, et al. Carcinogenicity of some drugs and herbal products. Lancet Oncol [online]. 2013; 14(9): 807–8. [acesso em: 7 mar 2023]. [https://doi.org/10.1016/S1470-2045(13)70329-2].
14. Souza BWA, Barbosa DBP, Rosa JGN, Eduardo AMLN. A importância da atenção farmacêutica e farmácia clínica no uso racional de medicamentos fitoterápicos. Rev Inic Cient Ext [online]. 2019; 2(Esp.1): 49. [acesso em: 9 nov 2022]. EISSN: 2595-4261. Disponível em: [https://revistasfacesa.senaaires.com.br/index.php/iniciacao-cientifica/article/view/225].
15. Figueredo CAD, Gurgel IGD, Gurgel Junior GD. A Política Nacional de Plantas Medicinais e Fitoterápicos: construção, perspectivas e desafios. Physis [online]. 2014; 24(2): 381-400. [acesso em: 9 nov 2022]. [https://doi.org/10.1590/S0103-73312014000200004].
16. Mendes KDS, Silveira RC de CP, Galvão CM. Revisão integrativa: método de pesquisa para a incorporação de evidências na saúde e na enfermagem. Tex contex – enferm [online]. 2008; 17(4): 758–64. [acesso em: 8 fev 2022]. [https://doi.org/10.1590/S0104-07072008000400018].
17. Klaassen, CD. Casarett & Doull's Toxicology: The Basic Science of Poisons. 9th ed., Kansas: McGraw-Hill Professional Publishing; 2019. ISBN: 9780071847087.
18. Tajiri K, Shimizu Y. Practical guidelines for diagnosis and early management of drug-induced liver injury. World J Gastroenterol [online]. 2008; 14(44): 6774. [acesso em: 11 ago 2022]. [https://doi.org/10.3748/wjg.14.6774].
19. Hoofnagle JH, Björnsson ES. Drug-induced liver injury — types and phenotypes. Longo DL, organizador. N Engl J Med [online]. 2019; 381(3): 264-73. [acesso em: 11 ago 2022]. [https://doi.org/10.1056/NEJMra1816149].
20. Andrade RJ. Assessment of drug-induced hepatotoxicity in clinical practice: A challenge for gastroenterologists. World J Gastroenterol [online]. 2007; 13(3): 329. [acesso em: 12 fev 2022]. Disponível em: [https://doi.org/10.3748/wjg.v13.i3.329
21. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Liver injury from herbal and dietary supplements. Hepatology [online]. 2016; 65(1): 363-73. [acesso em: 18 ago 2022]. [https://doi.org/10.1002/hep.28813].
22. Elinav E, Pinsker G, Safadi R, Pappo O, Bromberg M, Anis E et al. Association between consumption of Herbalife® nutritional supplements and acute hepatotoxicity. J Hepatol [online]. 2007; 47(4): 514-20. [acesso em: 30 ago 2022]. [https://doi.org/10.1016/j.jhep.2007.06.016].
23. HERBALIFE [homepage na internet]. Sobre a Herbalife Nutrition [acesso em: 30 ago 2022]. [https://www.herbalife.com.br/sobre-a-herbalife/].
24. Silva KKF, Silva BHM, Andrade Júnior FP, Dantas BB. Caracterização do perfil das intoxicações por plantas entre as mesorregiões do estado da Paraíba. Div J [online]. 2021; 6(4): 3967–87. [acesso em: 10 fev 2022]. [https://doi.org/10.48017/dj.v6i4.1936]
25. Vázquez-Fernández P, Garayoa-Roca A, Añón-Rodríguez R, Cabezas-Macián M, Serra-Desfilis MÁ, Mora-Miguel F. Aloe vera: Not always so beneficial in patients with chronic liver disease. Rev Esp Enferm Dig. [online]. 2013; 105(7): 434–5. [acesso em: 11 fev 2022]. [https://pubmed.ncbi.nlm.nih.gov/24206557/] https://doi.org/10.4321/S1130-01082013000700012
26. Oliveira AVC, Rocha FTR, Abreu SR de O. Acute liver failure and self-medication. Arq Bras Cir Dig. [online]. 2014; 27: 294-7. [acesso em: 18 ago 2022]. [https://doi.org/10.1590/S0102-67202014000400016].
27. HERBACORP [homepage na internet]. 9 Super dicas para emagrecer com Herbalife [acesso em: 30 ago 2022]. Disponível em: [https://herbacorp.com.br/9-super-dicas-para-emagrecer-com-herbalife/].
28. Parlati L, Voican CS, Perlemuter K, Perlemuter G. Aloe vera-induced acute liver injury: A case report and literature review. Clin Res Hepatol Gastroenterol [online]. 2016; 41(4): e39-42. [acesso em: 15 fev 2022]. [https://doi.org/10.1016/j.clinre.2016.10.002].
29. Ormerod LP, Skinner C, Wales J. Hepatotoxicity of antituberculosis drugs. Thorax [Online]. 1996; 51(2): 111-3. [acesso em: 17 mar 2022]. [https://doi.org/10.1136/thx.51.2.111].
30. Santos G, Gasca J, Parana R, Nunes V, Schinnoni M, Medina‐Caliz I. Profile of herbal and dietary supplements induced liver injury in Latin America: A systematic review of published reports. Phytother Res [online]. 2021; 35(1): 6-19. [acesso em: 12 ago 2022]. [https://doi.org/10.1002/ptr.6746].
31.García-Cortés M, Borraz Y, Lucena MI, Peláez G, Salmerón J, Diago M et al. Liver injuries induced by "natural remedies": an analysis of cases submitted to the Spanish Liver Toxicity Registry. Rev Esp Enferm Dig [online]. 2008; 100(11): 688-95. [acesso em: 12 ago 2022]. [https://doi.org/10.4321/S1130-01082008001100004].
32. Navarro VJ, Lucena MI. Hepatotoxicity induced by herbal and dietary supplements. Semin Liver Dis [online]. 2014; 34(02): 172–93. [acesso em: 13 ago 2022]. [https://pubmed.ncbi.nlm.nih.gov/24879982/] [https://doi.org/10.1055/s-0034-1375958].
33. Ballotin VR, Bigarella LG, Brandão ABM, Balbinot RA, Balbinot SS, Soldera J. Herb-induced liver injury: Systematic review and meta-analysis. World J Clin Cases [online]. 2021; 9(20): 5490–513. [acesso em: 25 jul 2022]. [https://pubmed.ncbi.nlm.nih.gov/34307603/][https://doi.org/10.12998/wjcc.v9.i20.5490].
34. Sodani IJ. Histopathological changes of mice liver induced by an Aloe vera whole leaf extract. Iraqi J Sci [online]. 2022; 57(3B): 1906-17. [acesso em: 30 ago 2022]. EISSN: 2312-1637. Disponível em: [https://ijs.uobaghdad.edu.iq/index.php/eijs/article/view/6886].
35. Quan Y, Gong L, He J, Zhou Y, Liu M, Cao Z et al. Aloe emodin induces hepatotoxicity by activating NF-κB inflammatory pathway and P53 apoptosis pathway in zebrafish. Toxicol Lett [online]. 2019; 306: 66–79. [acesso em: 13 set 2022]. [https://doi.org/10.1016/j.toxlet.2019.02.007].
36. Liu DM, Yang D, Zhou CY, Wu JS, Zhang GL, Wang P et al. Aloe-emodin induces hepatotoxicity by the inhibition of multidrug resistance protein 2. Phytomedicine. [online]. 2020; 68: 153148. [acesso em: 5 mar 2022]. [https://doi.org/10.1016/j.phymed.2019.153148].
37. Hu YH, Quan ZY, Li DK, Wang CY, Sun ZX. Inhibition of CYP3A4 enhances Aloe-emodin induced hepatocyte injury. Toxicol in Vitro [online]. 2022; 79:105276. [acesso em: 30 ago 2022]. [https://doi.org/10.1016/j.tiv.2021.105276].