REVISÃO
Plantas medicinais com potencial para tratamento de transtornos de ansiedade e depressão: uma revisão integrativa
Medicinal plants with potential for treating anxiety and depression disorders: an integrative review
Resumo
A sociobiodiversidade pode contribuir para a inovação em medicamentos da diversidade vegetal brasileira. Este trabalho buscou reunir evidências de estudos clínicos sobre a efetividade da utilização de plantas medicinais e fitoterápicos no tratamento de transtornos de ansiedade e depressão. Assim, realizou-se uma revisão integrativa com seleção de plantas a partir da obra de Pio Corrêa (1926 – 1978) e nas bases de dados PubMed, Lilacs e Cochrane. Após a aplicação dos critérios de seleção, 43 artigos foram elencados e 12 plantas foram investigadas. Foi possível demonstrar efeitos ansiolíticos para as plantas açafrão (Crocus sativus), cimicífuga (Actaea racemosa), endro (Anethum graveolens), laranjeira(Citrus x aurantium), lúpulo (Humulus lupulus), maracujá (Passiflora incarnata), melissa (Melissa officinalis) e valeriana (Valeriana officinalis); antidepressivos para açafrão, cúrcuma (Curcuma longa), lúpulo e melissa; sedativos para açafrão, alface (Lactuca sativa), cidró (Aloysia citriodora), lúpulo, maracujá, melissa e valeriana. Portanto, a fitoterapia pode auxiliar no tratamento de transtornos de ansiedade e depressão nos cuidados da saúde mental, a partir das plantas da sociobiodiversidade brasileira. Contudo, a realização de mais investigações com ensaios clínicos se faz necessária, bem como investimentos em biotecnologia para garantir o desenvolvimento da inovação em medicamentos de origem vegetal.
- Palavras-chave:
- Fitoterapia.
- Biodiversidade.
- Saúde mental.
- Insônia.
- Ensaios clínicos.
Abstract
Sociobiodiversity can contribute to innovation in medicines from Brazilian plant diversity. This work sought to gather evidence from clinical studies on the effectiveness of using medicinal plants and herbal medicines in treating anxiety disorders and depression. Thus, an integrative review was carried out with a selection of plants from the work of Pio Corrêa (1926 - 1978) and through the PubMed, Lilacs and Cochrane databases. After applying the selection criteria, 43 articles were listed, and 12 plants were investigated. It was possible to demonstrate anxiolytic effects for saffron (Crocus sativus), cimicífuga (Actaea racemosa), dill (Anethum graveolens), orange (Citrus x aurantium), hops (Humulus lupulus), melissa (Melissa officinalis), passion fruit (Passiflora incarnata) and valeriana (Valeriana officinalis); antidepressants for saffron, curcuma (Curcuma longa), hops and melissa; sedatives for saffron, lettuce (Lactuca sativa), citron (Aloysia citriodora), hops, melissa, passion fruit and valeriana (Valeriana officinalis). Therefore, phytotherapy can help treat anxiety disorders and depression in mental health care, using plants from Brazilian sociobiodiversity. However, further investigations with clinical trials and investments in biotechnology are necessary to ensure the development of innovation in medicines of plant origin.
- Keywords:
- Phytotherapy.
- Biodiversity.
- Mental health.
- Insomnia.
- Clinical trials.
Introdução
A Organização Mundial da Saúde (OMS) afirma que 1 bilhão de pessoas no mundo vivem com algum transtorno mental. Desafios globais como desigualdade social, pandemia de Covid-19, guerra e crise climática são ameaças à saúde global[1]. De acordo com o estudo, a pandemia de Covid-19 desencadeou um aumento de 25% na prevalência de ansiedade e depressão em todo o mundo e a OMS recomenda que os países prestem mais atenção à saúde mental e façam um trabalho melhor no apoio psicossocial de suas populações[2].
A ansiedade constitui uma reação normal diante de situações que podem provocar medo, dúvida ou expectativa. Entretanto, quando a expectativa se torna apreensiva, ocorrendo na maioria dos dias pelo período mínimo de 6 meses, com diversos eventos ou atividades, tais como desempenho escolar ou profissional, o indivíduo pode estar acometido de transtorno de ansiedade generalizada[3].
O transtorno de ansiedade generalizada (TAG) caracteriza-se por sintomas ansiosos persistentes que afetam ampla variedade de comportamentos da pessoa nas mais diversas situações cotidianas. Essas manifestações podem variar ao longo da vida e incluem sintomas de tensão motora, como tremores, incapacidade para relaxar, fadiga e cefaleia; sintomas de hiperatividade autonômica, como palpitações, sudorese, tontura, ondas de frio ou calor, falta de ar e urgência miccional, e sintomas de hipervigilância, como insônia, irritabilidade e dificuldade de concentração[3].
A depressão é um transtorno do humor que se caracteriza por sintomas debilitantes como visões negativas de si mesmo, do mundo e do futuro, bem como pensamentos negativos recorrentes e incontroláveis que, várias vezes, giram em torno do eu[4]. Esse transtorno mental está associado a sentimentos de incapacidade, irritabilidade, pessimismo, isolamento social, perda de prazer, déficit cognitivo em que a memória e o raciocínio ficam prejudicados, com baixa autoestima e tristeza, que interferem na vida diária[5]. Deste modo, a utilização de plantas medicinais e fitoterápicos pode auxiliar no tratamento e prevenção de agravos da saúde mental das pessoas, por meio de estudos científicos e observações da medicina tradicional. As plantas medicinais possuem ampla capacidade de produzir moléculas com atividades biológicas, que podem ser empregadas para diversos fins terapêuticos, dentre elas a ação no sistema nervoso central, como no tratamento e/ou prevenção de transtornos psicossociais como ansiedade e depressão[6].
O acesso a medicamentos à base de plantas, de maneira geral, deve ser estimulado e ampliado. A indústria farmacêutica dispõe de um grande arsenal terapêutico para tratamento de ansiedade e depressão, entretanto sua maioria é constituída por fármacos que agem fortemente no Sistema Nervoso Central, gerando nos usuários vários efeitos adversos. A busca por alternativas mais seguras e efetivas encontra nas plantas medicinais uma fonte promissora. As plantas medicinais devidamente testadas podem servir como alternativas aos ansiolíticos tradicionais em pacientes que não conseguem adesão à terapia convencional, devido ao perfil de efeitos adversos que estes apresentam por serem, muitas vezes, restritivos à vida normal[7].
Por meio de uma análise detalhada, no portal online de todas as indústrias farmacêuticas do Brasil, Silva et al.[8] identificaram que dos 220 laboratórios farmacêuticos que atuam no país, apenas 29 unidades fabris produzem medicamentos fitoterápicos, correspondendo a 14,35%. Deste total de 14,35% dos laboratórios farmacêuticos que produzem fitoterápicos, 75,86% estão voltados para o tratamento da ansiedade e depressão, enquanto 24,14% estão voltados para outras indicações terapêuticas. Assim, uma pequena parcela está envolvida na produção de insumos ativos para as indústrias de fitoterápicos e na produção de medicamentos fitoterápicos.
O Brasil é considerado um dos países megadiversos mais importantes do planeta, com 15% a 20% do número total de espécies e com a flora mais diversa do mundo, conta com biomas mais ricos em número de espécies vegetais: a Amazônia, a Mata Atlântica e o Cerrado[9]. A biodiversidade constitui ainda a base para a estratégica indústria da biotecnologia, além de importante fonte de renda para comunidades locais[9]. Os medicamentos da biodiversidade constituem aqueles originados da diversidade genética, de espécies e de ecossistemas, sendo que os ecossistemas interferem diretamente na produção de metabólitos secundários[10] que podem ser utilizados na produção de fitoterápicos.
No Brasil, em 2006, foram publicadas duas importantes políticas: a Política Nacional de Práticas Integrativas e Complementares (PNPIC), com o objetivo de ampliar o atendimento na Atenção Primária à Saúde (APS) e contribuir para o fortalecimento dos princípios fundamentais do Sistema único de Saúde (SUS); e a Política Nacional de Plantas Medicinais e de Fitoterápicos (PNPMF), que visa garantir o acesso seguro e o uso racional das plantas medicinais e fitoterápicos de forma a ampliar as opções terapêuticas aos usuários[11,12].
O conhecimento da biodiversidade brasileira resulta do conhecimento de cada bioma e a produção deste conhecimento deve incluir uma perspectiva ecossistêmica. Destaca-se a criação, em 2009, do Sistema Nacional da Rede de Inovação em Medicamentos à base de plantas da biodiversidade brasileira (RedesFito), que está estruturado a partir dos principais biomas brasileiros e integra a Fundação Osvaldo Cruz (FIOCRUZ), em Farmanguinhos, Rio de Janeiro. As RedesFito promovem as condições necessárias para o gerenciamento das diferentes dimensões do conhecimento tradicional, sendo apoiadas nos Arranjos Ecoprodutivos Locais (AEPL) reconhecidos em cada bioma[13].
Neste contexto, o Brasil possui potencial enorme para o desenvolvimento da fitoterapia, com o uso de plantas medicinais vinculado ao conhecimento tradicional, além de tecnologia para validar cientificamente esse conhecimento[11]. Desta forma, considerando que a sociobiodiversidade pode contribuir para a inovação em medicamentos da diversidade vegetal brasileira, este trabalho tem por objetivo reunir evidências de estudos clínicos sobre a efetividade da utilização de plantas medicinais e fitoterápicos no tratamento de transtornos de ansiedade e depressão nos cuidados da saúde mental, a partir da obra de Pio Corrêa (1926 – 1978).
Metodologia
Critérios de busca
Este estudo utilizou uma abordagem de pesquisa qualitativa, de caráter exploratório e descritivo, por meio de uma revisão integrativa. A questão norteadora da pesquisa foi: "Quais plantas possuem potencial ansiolítico e antidepressivo, baseadas na obra de Pio Corrêa (1926 – 1978) e que apresentam embasamento científico?"
Inicialmente foi realizada uma busca de plantas potencialmente ansiolíticas e antidepressivas na obra de Manuel Pio Corrêa – Dicionário de Plantas Úteis do Brasil e das exóticas cultivadas, cujo levantamento popular ocorreu de 1926 a 1978[14–19] com monografias sobre a flora brasileira e que estão distribuídas em seis volumes, segundo ordem alfabética de nomes populares das plantas. Para a consulta nesta obra foram utilizados os seguintes descritores: "ansiedade", "afecções nervosas", "calmante", "depressão" "doenças nervosas", "insônia", "sedativo(a)", "sono", "nervoso(a)", "hipnótico(a)", "melancolia".
A nomenclatura científica de plantas foi atualizada conforme repositório digital The Plant List (http://www.theplantlist.org/) e Flora do Brasil 2020 (http://floradobrasil.jbrj.gov.br/). Após a atualização da nomenclatura, foram consultados documentos oficiais brasileiros em vigor como o Memento Fitoterápico da Farmacopeia Brasileira – MFFFB 2016[20] e o Formulário de Fitoterápicos da Farmacopeia Brasileira 2ª ed. – FFFB 2021[21], sob regulação da Agência Nacional de Vigilância Sanitária (ANVISA), cujos conteúdos são baseados em evidências científicas. Também foi consultada documentação da ANVISA referente a produtos fitoterápicos de uso tradicional - RDC N° 26, DE 13 DE MAIO DE 2014[22], a fim de garantir a segurança de utilização das espécies de plantas selecionadas.
A partir dessa seleção de plantas foi conduzida uma revisão nas bases de dados PubMed, Lilacs e Cochrane. Os descritores utilizados nas buscas foram os "nomes científicos das plantas", "ansiedade", "depressão", "insônia" e "ensaios clínicos" e termos correspondentes em inglês, utilizando os operadores booleanos "AND" e "OR".
Critérios de seleção dos artigos
Os critérios de inclusão corresponderam a: desenho do estudo/ estudos clínicos disponíveis na íntegra, nos idiomas inglês, português ou espanhol, sem restrição temporal e que abordassem o efeito ansiolítico, sedativo e/ou antidepressivo das plantas medicinais selecionadas. Foram excluídos artigos repetidos entre as bases de dados, estudos de revisão ou que não abordassem os usos das plantas medicinais relacionados ao sistema nervoso, e textos que não estivessem disponíveis para leitura na íntegra, visando assegurar rigor científico.
Seleção de evidências
A seleção de evidências foi realizada por dois revisores. Para o gerenciamento das referências e triagem dos estudos, os artigos selecionados foram transportados para o software Rayyan. A partir da triagem pela leitura dos títulos e resumos realizada de forma cega por dois pesquisadores, foi efetuada a leitura dos artigos na íntegra daqueles selecionados. Os dados registrados em planilha Excel® incluíram: autor/data; espécie vegetal; nome popular; família botânica; tipo de estudo; objetivo; forma de uso e posologia da planta; métodos de avaliação das propriedades das plantas; principais resultados e conclusões dos estudos.
Resultados e Discussão
A busca na obra de Pio Corrêa (1926 – 1978)[14–19] resultou em 99 plantas. Entretanto, ao serem utilizados critérios de exclusão considerando os termos que não estivessem associados ao sistema nervoso, resultaram 54 espécies. Das 54 espécies, após verificação na RDC N° 26, de 13 de maio de 2014[22], permaneceram 47 espécies, as sete espécies excluídas correspondem a espécies vegetais que não podem ser utilizadas na composição de produtos tradicionais fitoterápicos ou com restrições para o registro/notificação de medicamentos fitoterápicos e produtos tradicionais fitoterápicos. Das 47 espécies encontradas, apenas sete constam no FFFB 2021[21] e/ou no MFFB 2016[20]. Estas sete plantas tiveram os usos comparados aos referidos na obra de Pio Corrêa, sendo que somente cinco apresentam indicações terapêuticas semelhantes.
Para a revisão bibliográfica das 47 espécies foram consultadas as bases de dados PubMed, Lilacs e Cochrane, utilizando-se apenas ensaios clínicos. Doze plantas medicinais tiveram citação bibliográfica. Foram encontrados 895 resultados nas bases de dados, sendo PubMed (678), Lilacs (57) e Cochrane (160). Após leitura dos títulos e aplicação de critérios de elegibilidade, 59 artigos foram identificados para leitura completa, dos quais 43 artigos foram selecionados para compor este estudo. O fluxograma de seleção e aplicação dos critérios está apresentado na FIGURA 1.
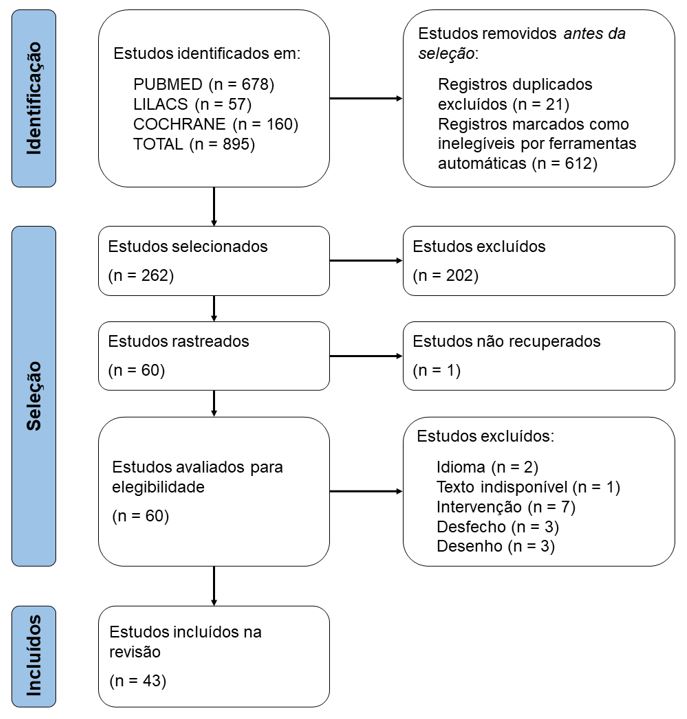
As 12 espécies incluídas nesta revisão correspondem a: Actaea racemosa L. (cimicífuga), Aloysia citriodora Paláu (cidró), Anethum graveolens L. (endro), Citrus x aurantium L. (laranjeira), Crocus sativus L. (açafrão), Curcuma longa L. (cúrcuma), Erythrina verna Vell. (E. mulungu Benth.) (mulungu), Humulus lupulus L. (lúpulo), Lactuca sativa L. (alface), Melissa officinalis L. (melissa), Passiflora incarnata L. (maracujá) e Valeriana officinalis L. (valeriana). Dessas 12 espécies, apenas o mulungu não mostrou efeito no ensaio clínico estudado. Os principais efeitos dessas plantas medicinais podem ser observados no QUADRO 1.
| Efeito | Plantas medicinais |
|---|---|
| Ansiolítico | açafrão, cimicífuga, endro, laranjeira, lúpulo, maracujá, melissa, valeriana. |
| Antidepressivo | açafrão, cúrcuma, lúpulo, melissa |
| Sedativo para tratamento de insônia e distúrbios do sono | açafrão, alface, cidró, lúpulo, maracujá, melissa, valeriana |
A eficácia das plantas investigadas nos estudos clínicos foi avaliada por meio de diversos questionários e escalas validados cientificamente para ansiedade, depressão e insônia, de acordo com o QUADRO 2. As medidas mais utilizadas conforme esta revisão são as seguintes: Escala de Depressão de Hamilton (HAM-D)[24–36], Escala de Avaliação de Ansiedade de Hamilton (HAM-A)[25,29,37], Inventário da Ansiedade Traço Estado de Spielberger (IDATE)[38–42], Inventário de Ansiedade de Beck (BAI)[37,43,44] e de Depressão de Beck[44] e Índice de qualidade do sono de Pittsburgh (PSQI)[43,45–52].
Os instrumentos que avaliam transtornos relacionados à ansiedade e depressão devem garantir confiança aos clínicos e pesquisadores para que estes realizem processos de triagem e diagnóstico com segurança, dando suporte às práticas clínicas e acadêmicas no planejamento e na eficácia das intervenções. Neste sentido, é importante que os profissionais conheçam as qualidades dos instrumentos para a avaliação dos diferentes transtornos e seleção do mais adequado instrumento para medir o que se deseja, conforme objeto de investigação[53].
| Transtorno | Medida/ Autor |
|---|---|
| Ansiedade | Avaliação do nível de ansiedade por parâmetros fisiológicos[54] |
| Escala Climatérica Verde (GCS, do inglês Green Climacteric Scale)[37,55] | |
| Escala Comportamental de Houpt[56] | |
| Escala de Ansiedade e Informação Pré-Operatória de Amsterdam (APAIS)[38] | |
| Escala de Ansiedade Odontológica Corah (DAS, do inglês Corah Dental Anxiety Scale)[57–59] | |
| Escala de Ansiedade, Depressão e Estresse-21 (DASS-21, do inglês Depression Anxiety Stress Scale-21)[49,60] | |
| Escala de Avaliação de Ansiedade de Hamilton (HAM-A, do inglês Hamilton Anxiety Rating Scale)[25,29,37] | |
| Escala de Avaliação do Comportamento de Frankl[56] | |
| Escala de Avaliação Numérica (NRS, inglês Numerical Rating Scale)[61] | |
| Escala Hospitalar de Ansiedade e Depressão (HADS, do inglês Hospital Anxiety and Depression Scale)[48,62] | |
| Escala Revisada de Ansiedade e Depressão Infantil (RCADS, do inglês Revised Child Anxiety and Depression Scale)[63] | |
| Escalas Analógicas Visuais (VAS, inglês Analogue Scale), Questionário de Saúde Geral-28 (GHQ-28, inglês General Health Questionnaire) para avaliação de sintomas psiquiátricos[64] | |
| Índice de Bem-estar Psicológico Geral (PGWBI, do inglês Psychological General Well-Being Index)[37] | |
| Inventário da Ansiedade Traço Estado de Spielberger (Idate ou Stai, do inglês Spielberger's State -Trait Anxiety Inventory)[38–42] | |
| Inventário de Ansiedade de Beck (BAI, do inglês Beck Anxiety Inventory)[37,43,44] | |
| Depressão | Escala de Depressão de Hamilton (HAM-D, do inglês Hamilton Rating Scale for Depression)[24–36] |
| Escala Revisada de Ansiedade e Depressão Infantil (RCADS, do inglês Revised Child Anxiety and Depression Scale)[63] | |
| Inventário de Depressão de Beck (BDI, do inglês Beck Depression Inventory)[44] | |
| Insônia | Índice de qualidade do sono de Pittsburgh (PSQI, do inglês Pittsburgh Sleep Quality Index)[43,45–52] |
| Índice de Severidade de Insônia (ISI)[43,45,52] |
Dos 43 trabalhos incluídos no estudo, conforme constam no QUADRO 3, todos foram realizados em humanos, citando-se: estudo clínico randomizado controlado (1), estudos clínicos randomizados controlados por placebo (6), estudos clínicos randomizados abertos controlados (2), estudos clínicos randomizados duplo-cegos controlados (10), estudos clínicos randomizados duplo-cegos controlados por placebo (18), estudo clínico randomizado cruzado duplo-cego controlado (1), estudos clínicos randomizados cruzados duplo-cegos controlados por placebo (2), estudos clínicos randomizados triplo-cegos controlados por placebo (2) e estudo clínico longitudinal (1).
Os estudos controlados (comparativos, duplo-cegos e randomizados) são considerados o padrão-ouro para a verificação da eficácia de medicamentos[65]. Para Faustino et al.[65] o melhor delineamento ocorre quando se compara a droga experimental com a droga-padrão e com o placebo, ou seja, compara a ação da substância-teste com o efeito conhecido e bem estabelecido de uma substância utilizada como controle ativo (droga-padrão), além de verificar (quantificar) uma parcela do efeito que, embora real, independe da ação específica da droga (efeito placebo). Esses autores afirmam que estudos que comparam somente droga experimental e placebo também são válidos, desde que seja observado um efeito superior da droga em relação ao placebo, como nos trabalhos encontrados nesta revisão com A. citriodora[45,50], C. aurantium[38,40], C. sativus[30,33,44,49,63,66], H. lupulus[60], L. sativa[51], M. officinalis[48,56,64,67] e V. officinalis[46,54]. Nem sempre os resultados são satisfatórios, pois outros aspectos importantes devem ser considerados no que dizem respeito ao número dos sujeitos envolvidos, ao critério utilizado para inclusão dos sujeitos na pesquisa e à especificação do produto empregado (preparação e dosagem), que podem ser fatores limitantes, produzindo resultados falsamente negativos[37,65]. A descrição dos estudos selecionados encontra-se resumidamente no QUADRO 3.
| Nome científico Família Nome popular |
Desenho do estudo | Objetivo do estudo | Forma de uso/ Posologia | Referência |
|---|---|---|---|---|
| Actaea racemosa L. Ranunculaceae CIMICÍFUGA |
Estudo clínico randomizado aberto controlado | Investigar a eficácia de extrato aquoso isopropanólico de cimicífuga em queixas climatéricas em comparação com estradiol transdérmico de baixa dose (TTSE2). | Administração oral de extrato aquoso isopropanólico (40 mg) do rizoma diariamente por 3 meses. | Nappi et al.[55] |
| Estudo clínico randomizado duplo-cego controlado por placebo | Examinar a eficácia ansiolítica de uma preparação específica de extrato de cimicífuga na redução dos sintomas do transtorno de ansiedade devido à menopausa. | Administração oral de 2 cápsulas contendo extrato seco de cimicífuga diariamente (32 mg ao dia) por 2 semanas e após 4 cápsulas (128 mg ao dia) até a 12ª semana. | Amsterdam et al.[37] | |
| Aloysia citriodora Paláu Verbenaceae CIDRÓ |
Estudo clínico randomizado controlado por placebo | Avaliar um suplemento dietético natural à base de plantas composto do extrato de Lippia citriodora, purificado em fenilpropanoides, no alívio do estresse e melhorando a qualidade do sono. | Administração oral de 1 cápsula contendo 400 mg do extrato padronizado (mínimo de 28% de fenilpropanoides totais) por dia 1 a 2 h antes de dormir por 2 meses. | Martinez-Rodriguez et al.[50] |
| Estudo clínico randomizado duplo-cego controlado por placebo | Avaliar a eficácia de A. citriodora em pacientes com insônia. | Administração oral de 10 mL do xarope (1,66 mg de óleo essencial total por 10 mL e quantidade total de flavonoides em termos de quercetina 3,22 mg por 10 mL) 1 h antes de dormir por 4 semanas. | Afrasiabian et al.[45] | |
| Anethum graveolens L. Apiaceae ENDRO |
Estudo clínico randomizado aberto controlado | Investigar os efeitos da semente de endro em decocto na ansiedade durante o trabalho de parto em comparação com a ocitocina. | Administração oral do extrato aquoso em decocção por 10 min de 10 g de sementes de endro em 100 mL de água uma vez no início da fase ativa do parto. | Hekmatzadeh et al.[68] |
| Citrus x aurantium L. Rutaceae LARANJEIRA |
Estudo clínico randomizado triplo-cego controlado por placebo | Comparar os efeitos da lavanda e da laranja amarga na ansiedade em mulheres na pós-menopausa. | Administração oral de cápsula contendo 500 mg de flores de laranja duas vezes ao dia (após o café da manhã e o jantar) por 8 semanas. | Farshbaf-Khalili et al.[40] |
| Estudo clínico randomizado duplo-cego controlado por placebo | Avaliar o efeito ansiolítico da flor de C. aurantium sobre a ansiedade pré-operatória. | Administração oral de 1mL kg-1 do extrato padronizado da flor de C. aurantium (CABd), contendo concentrações de flavonoides (29 mg mL-1), compostos fenólicos totais (33 mg mL-1) e linalol (0,01 mg mL-1), 12 horas antes da indução da anestesia. | Akhlaghi et al.[38] | |
| Crocus sativus L. Iridaceae AÇAFRÃO |
Estudo clínico randomizado duplo-cego controlado | Comparar a eficácia dos estigmas de C. sativus (açafrão) com Imipramina no tratamento da depressão leve a moderada. | Administração oral de 3 cápsulas contendo extrato seco (10 mg cada cápsula, total de 30 mg) ao dia por 6 semanas. | Akhondzadeh et al.[26] |
| Investigar o efeito antidepressivo da pétala de C. sativus em comparação com Fluoxetina em pacientes que sofrem de depressão após a realização de intervenção percutânea coronariana (ICP). | Administração oral de 2 cápsulas de SaffroMoods, IMPIRAN, contendo extrato de açafrão (15 mg cada cápsula, total de 30 mg) ao dia por 6 semanas. | Shahmansouri et al.[34] | ||
| Comparar a eficácia da pétala de C. sativus com fluoxetina no tratamento de pacientes ambulatoriais deprimidos. | Administração oral de cápsula de pétala de C. sativus contendo extrato padronizado (15 mg) 2 vezes ao dia (manhã e noite). | Akhondzadeh Basti et al.[36] | ||
| Comparar a tolerabilidade, segurança e eficácia do açafrão ao Citalopram no tratamento do transtorno depressivo maior com (TDM) com angústia ansiosa. | Administração oral de cápsula SaffroMood, IMPIRAN, contendo extrato de estigmas de açafrão (15 mg) 2 vezes ao dia por 6 semanas. | Ghajar et al.[29] | ||
| Comparar o efeito do açafrão e da Sertralina no transtorno depressivo maior com (TDM) entre idosos. | Administração oral de cápsula de açafrão (60 mg) uma dose pela manhã por 6 semanas. | Ahmadpanah et al.[24] | ||
| Comparar eficácia e segurança do açafrão e da Fluoxetina no tratamento de depressão pós-parto leve a moderada. | Administração oral de cápsula de açafrão (SaffroMood® IMPIRAN) contendo extrato de açafrão (15 mg) 2 vezes ao dia por 6 semanas. | Kashani et al.[32] | ||
| Comparar a eficácia do extrato hidroalcóolico de C. sativus (estigma) com fluoxetina no tratamento da depressão leve a moderada. | Administração oral de cápsula contendo extrato de estigmas de açafrão (15 mg, total de 30 mg) ao dia por 6 semanas. | Noorbala et al.[31] | ||
| Estudo clínico randomizado duplo-cego controlado por placebo | Avaliar os efeitos do extrato de açafrão para o tratamento de ansiedade e depressão. | Administração oral de cápsula contendo estigma de açafrão (50 mg) 2 vezes ao dia por 12 semanas. | Mazidi et al.[44] | |
| Avaliar os efeitos de açafrão na cognição, ansiedade e depressão na pós-cirurgia coronariana de revascularização do miocárdio (CABG). | Administração oral de cápsulas contendo extrato seco de estigmas de açafrão (15 mg) 2 vezes ao dia por 12 semanas. | Moazen-Zadeh et al.[62] | ||
| Avaliar a eficácia e segurança do açafrão (estigma de C. sativus) no tratamento do transtorno depressivo maior associado a ondas de calor pós-menopausa. | Administração oral de cápsula de açafrão SaffroMood®Green Plant Life, contendo extrato de estigmas de açafrão (15 mg) 2 vezes ao dia por 6 semanas. | Kashani et al.[33] | ||
| Avaliar a eficácia dos estigmas de C. sativus (açafrão) no tratamento da depressão leve a moderada. | Administração oral de cápsula de estigmas de açafrão contendo extrato seco (15 mg, total de 30 mg) ao dia por 6 semanas. | Akhondzadeh et al.[69] | ||
| Investigar a eficácia do affron®, um extrato padronizado de estigmas de C. sativus L. para melhorar humor, estresse, ansiedade e qualidade do sono em adultos saudáveis. | Administração oral de comprimido contendo extrato padronizado de estigmas (11 mg ou 14 mg affron®) 2 vezes ao dia (total de 22 mg ou 28 mg por dia), por 4 semanas. | Kell et al.[49] | ||
| Examinar a eficácia de um extrato padronizado de açafrão em jovens de 12–16 anos com sintomas de ansiedade e/ou depressão leve a moderada. | Administração oral de comprimido contendo extrato padronizado de açafrão (14 mg affron®) 2 vezes ao dia. | Lopresti et al.[63] | ||
| Avaliar a eficácia da pétala de C. sativus no tratamento da depressão leve a moderada. | Administração oral de 2 cápsulas contendo extrato seco da pétala (15 mg cada cápsula, total de 30 mg) ao dia por 6 semanas. | Moshiri et al.[30] | ||
| Curcuma longa L. Zingiberaceae CÚRCUMA |
Estudo clínico randomizado duplo-cego controlado | Comparar a eficácia e segurança da curcumina com a Fluoxetina em pacientes com transtorno depressivo maior (TDM). | Administração oral de cápsula de cúrcuma obtida de rizoma seco (500 mg, BCM-95 de Arjuna Natural Extracts, Kochi, Kerala, Índia) e fluoxetina (20 mg) individualmente ou sua combinação, 2 vezes ao dia (café da manhã e jantar) em intervalos de 12 h por 6 semanas. | Sanmukhani et al.[35] |
| Erythrina verna Vell. (E. mulungu Benth.) Fabaceae MULUNGU |
Estudo clínico randomizado paralelo triplo-cego controlado por placebo | Comparar os efeitos de P. incarnata, E. mulungu e Midazolam no controle da ansiedade em pacientes submetidos à extração de terceiros molares inferiores. | Administração oral de 2 cápsulas de P. incarnata contendo extrato padronizado (250 mg, total 500 mg), 2 cápsulas de E. mulungu (Matusa® 250 mg, total 500 mg) ou midazolam (15 mg), 60 minutos antes da cirurgia. | Da Cunha et al.[57] |
| Humulus lupulus L. Cannabaceae LÚPULO |
Estudo clínico longitudinal | Analisar o efeito sedativo do lúpulo como componente da cerveja sem álcool sobre o ritmo sono/vigília em uma população estressada pelo trabalho. | Ingestão moderada de cerveja sem álcool (San Miguel 0,0%) contendo lúpulo (333 mL com 0,0% de álcool) após a janta por 14 dias. | Franco et al.[41] |
| Estudo clínico randomizado duplo-cego cruzado controlado por placebo | Estudar os efeitos de um extrato seco de lúpulo em níveis de depressão, ansiedade e estresse em adultos jovens. | Administração oral de 2 cápsulas de lúpulo contendo extrato padronizado (0,2 g Melcalin®, total 0,4 g) à noite por 4 semanas. | Kyrou et al.[60] | |
| Lactuca sativa L. Asteraceae ALFACE |
Estudo clínico randomizado controlado por placebo | Avaliar os efeitos da semente de alface em gestantes para o tratamento da insônia. | Administração oral de cápsula contendo semente de alface (1000 mg contendo com 33,33% de óleo) à noite por 2 semanas. | Pour et al.[51] |
| Melissa officinalis L. Lamiaceae MELISSA |
Estudo clínico randomizado duplo-cego controlado por placebo | Determinar os efeitos da suplementação de Melissa sobre depressão, ansiedade, estresse e distúrbios do sono em pacientes com angina estável crônica (ACS). | Administração oral de 3 cápsulas contendo pó das partes aéreas (1 g, total 3 g) diariamente por 8 semanas. | Haybar et al.[48] |
| Avaliar a eficácia de M. officinalis em comparação com placebo para alívio de palpitação. | Administração oral cápsula contendo extrato seco das folhas (500 mg) 2 vezes ao dia (manhã e noite) (total 1000 mg) por 14 dias. | Alijaniha et al.[64] | ||
| Determinar a ação neurotrópica do extrato hidroalcóolico de M. officinalis no comportamento odontológico de meninas ansiosas com e sem experiência odontológica. | Administração oral de extrato hidroalcóolico (2,5 mg kg-1) em dose única 30 minutos antes da intervenção. | Pardo Aldave[56] | ||
| Estudo clínico randomizado duplo-cego controlado | Avaliar a eficácia de M. officinalis e L. angustifolia em comparação com a fluoxetina para o tratamento da depressão leve a moderada. | Administração oral de 2 cápsulas contendo folhas secas (500 mg cada) a cada 12h (total 2 g) por 8 semanas. | Araj-Khodaei et al.[28] | |
| Passiflora incarnata L. Passifloraceae MARACUJÁ |
Estudo clínico randomizado duplo-cego controlado por placebo | Investigar a eficácia do fitoterápico P. incarnata no sono humano, medido por meio de diários de sono validados por polissonografia (PSG). | Administração oral da infusão de 2 g de chá (folhas, caules, sementes e flores) de P. incarnata (Hilde Hemmes' Herbal Supplies Pty Ltda) para 250 ml de água fervente, à noite. | Ngan e Conduit[42] |
| Investigar o efeito da administração oral pré-operatória de P. incarnata sobre ansiedade, funções psicomotoras, sedação e hemodinâmica em pacientes submetidos a anestesia. | Administração oral de 700 mg 5 mL-1 do extrato aquoso (Xarope de Passiflora, Sandoz, Kocaeli, Turquia, contendo 2,8 mg de benzoflavona por 5 mL) 30 minutos antes da anestesia espinhal. | Aslanargum et al.[39] | ||
| Comparar o efeito de P. incarnata com placebo como pré-medicação ansiolítica. | Administração oral de comprimido de 500 mg Pasipay™ IranDarouk contendo 1,01 mg benzoflavone (BZF) 90 min antes da cirurgia. | Movafegh et al.[61] | ||
| Investigar efeitos do maracujá nos parâmetros do sono polissonográfico em indivíduos com transtorno de insônia. | Administração oral de 1 cápsula de 60 mg ao dia, contendo 60 mg de extratos de folhas (80%) e frutos (20%) de maracujá, durante 2 semanas. | Lee et al.[43] | ||
| Estudo clínico randomizado duplo-cego controlado | Comparar a eficácia do extrato de P. incarnata com Oxazepam no tratamento do transtorno de ansiedade generalizada. | Administração oral de 45 gotas ao dia do extrato líquido PassipayTM por 4 semanas. | Akhondzadeh et al.[25] | |
| Estudo clínico randomizado duplo-cego cruzado controlado | Comparar os efeitos de P. incarnata e Midazolam para o controle da ansiedade em pacientes submetidos à extração de terceiros molares inferiores. | Administração oral de comprimido (260 mg) 30 minutos antes do procedimento. | Dantas et al.[58] | |
| Estudo clínico randomizado paralelo triplo-cego controlado por placebo | Comparar os efeitos de P. incarnata, E.mulungu e Midazolam no controle da ansiedade em pacientes submetidos à extração de terceiros molares inferiores. | P. incarnata (500 mg), E. mulungu (500 mg) ou Midazolam (15 mg) foi administrado por via oral administrado 60 minutos antes da cirurgia. | Da Cunha et al.[57] | |
| Valeriana officinalis L. Caprifoliaceae VALERIANA |
Estudo clínico randomizado controlado | Avaliar a eficácia de um medicamento à base de valeriana para controlar a ansiedade durante a extração do terceiro molar inferior em comparação com um benzodiazepínico de referência (Midazolam). | Administração oral de cápsula (100 mg) de valeriana 60 minutos antes do procedimento cirúrgico. | Farah et al.[59] |
| Estudo clínico randomizado controlado por placebo | Explorar questões de viabilidade e eficácia em estudos de ervas sedativas para distúrbios do sono relacionados à artrite. | Administração oral de 6 cápsulas moles (100 mg) contendo ácido valerênico a 0,8% (600 mg no total) antes de dormir por 5 noites. | Taibi, Bourguignon et al.[70] | |
| Avaliar a eficácia de um suplemento de V. officinalis para dormir em pessoas com câncer que estavam em tratamento oncológico. | Administração oral de cápsula (450 mg) de valeriana por via oral antes de dormir por 8 semanas. | Barton et al.[47] | ||
| Avaliar a eficácia da V. officinalis no distúrbio do sono em pacientes com insuficiência cardíaca crônica (ICC) | Administração oral de 12 ml de xarope (contendo 60,04% de compostos fenólicos e 27,7% de flavonoides totais em mg mL-1) 1 h antes de dormir por 4 semanas. | Aliakbari e Rafieian[46] | ||
| Avaliar a eficácia de V. officinalis L. para o controle da ansiedade durante a cirurgia de terceiros molares. | Administração oral de cápsula (100 mg) de valeriana 1 h antes do procedimento cirúrgico. | Pinheiro et al.[54] | ||
| Estudo clínico randomizado duplo-cego cruzado controlado por placebo | Testar os efeitos do extrato de valeriana para melhorar o sono de mulheres idosas com insônia. | Administração oral de 3 cápsulas moles (100 mg) contendo extrato de raiz de valeriana Nature's Resource® (300 mg no total) 30 minutos antes de dormir por 2 semanas. | Taibi, Vitiello et al.[52] |
Este trabalho reuniu evidências científicas sobre os efeitos ansiolíticos, sedativos e/ou antidepressivos de doze espécies de plantas medicinais, utilizadas na forma de medicamento fitoterápico ou produto tradicional fitoterápico. Destaca-se que seis espécies citadas na obra de Pio Corrêa[14–19] são recomendadas por documentos oficiais regulamentados pela ANVISA, a saber: A. racemosa, P. incarnata e V. officinalis no MFFB 2016[20]; C. x aurantium, E.mulungu (E. verna), M. officinalis, P. incarnata e V. officinalis no FFFB 2021[21].
A espécie C. longa está citada no FFFB 2021 para tratar apenas distúrbios digestivos, que não estão relacionados ao sistema nervoso[21]. Das cinco espécies que foram citadas apenas na obra de Pio Corrêa[14–19], C. sativus foi a planta que apresentou maior número de estudos clínicos[14], enquanto as demais apresentaram poucos estudos clínicos: A. citriodora (2), Anethum graveolens (1), H. lupulus (2) e L. sativa (1).
Nos tópicos a seguir são apresentadas as plantas pesquisadas, conforme estudos investigados.
Actaea racemosa – CIMICÍFUGA
Dois estudos foram selecionados para avaliar a eficácia ansiolítica da A. racemosa em sintomas relacionados à menopausa. Nappi et al.[55] citam efeitos positivos do extrato contra ansiedade e depressão no tratamento de queixas climatéricas em mulheres que não podem ser tratadas ou simplesmente recusam estratégias convencionais. Entretanto, Amsterdam et al.[37] não encontraram efeito ansiolítico estatisticamente significativo de cimicífuga com placebo; o pequeno tamanho da amostra (n=20), a escolha de preparação e a dosagem usada podem ter sido fatores limitantes que produzem resultados falsamente negativos. Poucos efeitos adversos foram relatados, tais como: náusea[55], artralgia e edema[37]. O tratamento à base de A. racemosa utilizado no estudo de Nappi et al.[55] não afetou a função hepática e o perfil hormonal, sendo bem tolerado por quase todas as mulheres recrutadas na pós-menopausa.
Pio Corrêa[17] descreve que o rizoma da planta é estimulante, expectorante, sedativo e antiespasmódico, bom emenagogo, aconselhado também para as afecções reumáticas, dores de cabeça e hipocondria. Entretanto, no MFFB 2016[20] a cimicífuga é recomendada no alívio dos sintomas físicos e psíquicos relacionados ao climatério, como rubor, fogachos, transpiração excessiva, palpitações, alterações do humor, ansiedade e depressão.
Desse modo, nesta revisão os estudos selecionados apontam que essa planta está associada às queixas climatéricas em decorrência da menopausa, concordando com informações do MFFB 2016, tendo divergências com relação àquelas encontradas por Pio Corrêa. As principais classes químicas de A. racemosa citadas pela OMS correspondem a triterpenos (cimifugosídeo, 26-deoxiacteína, acteína, cimigenol e cimicifugosideo), alcaloides, taninos e ácidos fenólicos[71]. Evidências in vitro e in vivo demonstram que compostos dos extratos não se ligam aos receptores de estrogênio e, portanto, não exercem nenhum efeito estrogênico. Estudos com mulheres na pós-menopausa indicaram que substâncias com atividades semelhantes a neurotransmissores afetam beneficamente os sintomas da pós-menopausa, como ondas de calor. Alguns desses compostos químicos, tais como os triterpenos tipo acteína possuem atividade GABAérgica e um análogo da serotonina estão presentes, tendo sido identificados nos extratos. Essas atividades explicam os efeitos benéficos dos extratos nas queixas do climatério[71].
Aloysia citriodora – CIDRÓ
O potencial sedativo da A. citriodora foi investigado em dois estudos clínicos para melhorar a qualidade do sono. O consumo do extrato contendo fenilpropanoides (verbascosídeo) foi clinicamente comprovado para ajudar a reduzir a ansiedade e melhorar a qualidade do sono, sendo que um forte efeito na percepção da qualidade do sono foi observado em mulheres. Esse efeito é significativo na redução da ansiedade quando tomado continuamente pelo menos 2 meses[50]. No estudo de Afrasiabian et al.[45], as pontuações médias do Índice de Qualidade do Sono (PSQI global incluindo latência do sono, eficiência habitual do sono, disfunção diurna e a qualidade do sono) e o escore do Índice de Severidade de Insônia (ISI) melhoraram significativamente após 4 semanas de tratamento com A. citriodora quando comparado com o grupo placebo. Nesse último estudo, poucos efeitos adversos foram relatados como inquietação, tremor, sonolência e prurido localizado.
Pio Corrêa[15] enfatiza que folhas e flores da planta são forte e agradavelmente aromáticas, com cheiro de limão, tendo emprego como condimento e na medicina, tanto doméstica como científica, reputadas como antiespasmódicas, digestíveis e úteis contra as doenças nervosas (melancolia, hipocondria, histeria e afecções do coração). No que se refere ao emprego da planta para doenças nervosas citadas por Pio Corrêa, os estudos desta revisão estão em conformidade, uma vez que a ingestão oral de A. citriodora pode ser uma opção complementar para diminuir a ansiedade e melhorar a qualidade do sono, reduzindo a gravidade da insônia para pacientes com esse tipo de transtorno. Os efeitos sedativos se devem provavelmente aos monoterpenos presentes nas folhas de A. citriodora como linalol, cariofileno, limoneno[45] e citral (geranial e neral)[72].
Anethum graveolens – ENDRO
Apenas um estudo clínico foi encontrado para A. graveolens com gestantes que receberam extrato aquoso por decocção no início do trabalho de parto. O número de mulheres com traço grave (8,0%) e quase grave (14,0%) para estado de ansiedade foi menor que no grupo controle (p=0,050, p=0,041, respectivamente). A semente de endro pode ser usada como um tratamento eficaz para reduzir ansiedade durante o trabalho de parto, bem como para redução da duração do trabalho de parto, não apresentando reações adversas durante o período da observação[68]. Hekmatzadeh et al.[68]pontuam que a dor intensa do parto e a ansiedade têm consequências a longo prazo, com efeitos emocionais, que afetam negativamente a saúde mental da mãe, a relação entre mãe e bebê e o atraso na amamentação.
Esta planta é referenciada por Pio Corrêa[14] apenas como hipnótica, possivelmente se referindo ao seu efeito calmante. A droga vegetal consiste em frutos secos (sementes) de A. graveolens, contendo, no mínimo, 2,0% de óleo volátil, com 30,0% de carvona e 30,0% de dilapiol[73] e polifenóis na maioria taninos que possuem propriedades contrativas e aceleram o trabalho de parto[68]. Embora nesta revisão esses últimos autores recomendem o extrato aquoso de A. graveolens para tratar ansiedade em mulheres no início do trabalho de parto, mais estudos são necessários para comprovar a eficácia e segurança da sua administração, uma vez que a monografia desta planta conforme a OMS cita a possibilidade de efeitos teratogênicos, alertando que o uso das sementes durante a gravidez e a amamentação não é recomendado[74].
Citrus x aurantium – LARANJEIRA
O efeito ansiolítico das flores C. x aurantium foi avaliado em dois estudos clínicos. Em estudo clínico randomizado triplo-cego controlado por placebo realizado por Farshbaf-Khalili et al.[40], o extrato seco da laranjeira reduziu significativamente os escores médios do estado de ansiedade em comparação com o grupo controle (p=0,01) em mulheres na pós-menopausa, sugerindo que as flores da planta podem ser usadas para diminuir a ansiedade nessas mulheres. Os resultados desses autores mostram poucos efeitos adversos como náuseas, palpitações e dores de cabeça. Além disso, em estudo clínico randomizado duplo-cego controlado por placebo, o extrato pode se mostrar eficaz na redução da ansiedade pré-operatória em cirurgias de pequeno porte, pois os pacientes tratados com Citrus estavam significativamente menos ansiosos que o grupo controle, conforme IDATE e APAIS (p<0,05), sem efeitos adversos, sendo que um dos principais componentes do óleo essencial demonstrado por Cromatografia Gasosa foi o limoneno, que pode ser considerado ansiolítico[38].
As propriedades medicinais das folhas e flores de laranjeira, registradas por Pio Corrêa[17] são como sedativo do sistema nervoso e antiespasmódico. O FFFB 2021 cita as flores para auxiliar no alívio da ansiedade e insônia leves[21]. Os efeitos ansiolíticos encontrados nesta revisão estão de acordo com os citados por Pio Corrêa e o FFFB 2021. Tradicionalmente, C. x aurantium é usado como um medicamento alternativo em alguns países para tratar ansiedade, insônia e como anticonvulsivante, o que sugere ações depressoras do sistema nervoso central (SNC)[38]. No estudo clínico de Akhlaghi et al.[38], o extrato aquoso das flores de C. x aurantium foi significativamente eficaz como pré-medicação na redução da ansiedade antes de cirurgias de pequeno porte, pois a ansiedade pode influenciar negativamente o curso e o desfecho dos tratamentos cirúrgicos. Vários estudos clínicos são realizados com o óleo essencial de C. x aurantium na aromaterapia, apontando o seu potencial ansiolítico, entretanto nesta revisão o foco na aromaterapia não foi contemplado. O linalol e o limoneno presente nas flores de C. x aurantium são responsáveis pelo seu efeito sedativo e hipnótico[40].
Crocus sativus – AÇAFRÃO
O efeito antidepressivo do C. sativus foi avaliado em 14 estudos clínicos randomizados controlados, sendo esta planta com maior número de referências desta revisão.
A terapia de curto prazo (6 semanas) com cápsula de açafrão contendo extrato de estigmas florais mostrou a mesma eficácia antidepressiva em comparação com Imipramina em pacientes com depressão leve a moderada[26], Citalopram[29] e Sertralina[24] em pacientes com transtorno da depressão maior (TDM), Fluoxetina na melhoria de sintomas depressivos do pós-parto[32]. A terapia também pode ser feita com cápsula contento extrato de pétalas, tendo eficácia semelhante à Fluoxetina em pacientes com história prévia de intervenção percutânea coronariana (ICP) que sofriam de depressão[34] e no tratamento de depressão leve a moderada[31,36].
Em estudos clínicos com placebo, o extrato de estigmas de açafrão mostrou impacto significativo no tratamento do transtorno de ansiedade e depressão no período de 12 semanas[44]. Além disso, produziu um resultado significativamente melhor na escala de classificação de depressão de Hamilton, sendo positivo para o tratamento de depressão leve a moderada em 6 semanas[69]. O açafrão é considerado um tratamento seguro e eficaz na melhora de sintomas depressivos (p= 0,01) em mulheres saudáveis na pós-menopausa, e pode fornecer uma opção como fitoterápico na terapia alternativa e não hormonal no tratamento de mulheres com ondas de calor, com menos efeitos colaterais[33]. Também foi eficaz para melhorar o humor, estresse, ansiedade e qualidade do sono em adultos saudáveis em 4 semanas[49]. Embora a maioria dos estudos clínicos seja realizada, comumente, com pessoas idosas, Lopresti et al.[63] verificaram efeitos benéficos de um extrato padronizado de açafrão (affron®) para o tratamento de ansiedade e sintomas depressivos em adolescentes. O extrato de pétalas também foi eficaz no tratamento da depressão leve a moderada[30]. Apenas um estudo não mostrou significância do açafrão em relação ao placebo, não tendo efeito na cognição, ansiedade e depressão na pós-cirurgia coronariana de revascularização do miocárdio (CABG)[62].
Pio Corrêa[14] define que os estigmas florais têm efeito sedativo, sendo indicados na histeria. O termo "histeria" tanto pode designar um sintoma quanto uma doença, ou mesmo uma síndrome, uma vez que a imprecisão desse diagnóstico e a sua etiologia incerta dificultam a sua classificação. Atualmente, o termo histeria encontra-se em desuso na psiquiatria, embora se saiba que ela está associada a transtornos mentais[75]. C. sativus é uma planta que não consta nos documentos oficiais da Farmacopeia Brasileira (MFFB 2016 e FFFB 2021)[20,21] e que possui potencial para ser incluído, pois apresenta diversos estudos clínicos comprovando sua eficácia para tratar transtornos depressivos leve a moderados, com efeito semelhante a medicamentos benzodiazepínicos convencionais, como Imipramina[26], Citalopram[29], Sertralina[24], Fluoxetina[31,32,34,36], reduzindo efeitos colaterais causados por esses medicamentos. A parte mais utilizada da planta corresponde aos estigmas florais, entretanto as pétalas também podem ser empregadas conforme demonstrado por alguns autores[30,31,34,36]. Os principais constituintes citados pela OMS incluem óleos essenciais (0,4-1,3%) com α- e β-pineno, 1,8-cineol, picrocrocina (4%), safranal (obtido pela hidrólise da picrocrocina), carotenoides, como crocinas (2%) e dimetilcrocetina[76].
Curcuma longa – CÚRCUMA
Apenas um estudo clínico da C. longa foi encontrado nesta revisão. O efeito da eficácia e segurança da curcumina foi comparado com a Fluoxetina em três grupos de pacientes (n= 60) com transtorno depressivo maior (TDM). A medida de avaliação da escala HAM-D17 foi maior na combinação do grupo Fluoxetina e curcumina (77,8%) do que no grupo Fluoxetina (64,7%) e no grupo curcumina (62,5%), entretanto não foi estatisticamente significativo (p= 0,58), mostrando similaridade entre os três grupos. A curcumina pode ser um eficaz agente seguro quando utilizado como modalidade de tratamento em pacientes com TDM sem ideação suicida concomitante ou com outros transtornos psicóticos. Poucos efeitos adversos foram relatados: gastrite (16,6%), tontura (5,5%), ondas de calor (5,5%), náusea (5,5%) e fotossensibilidade (5,5%)[35].
No relato de Pio Corrêa[14], os rizomas da planta produzem embriaguez, sono e delírio em altas doses. Por outro lado, o FFFB 2021 cita a utilização dos rizomas da cúrcuma apenas como auxiliar no alívio de sintomas dispépticos, tais como sensação de plenitude, flatulência e digestão lenta; como colagogo e colerético; além da atividade anti-inflamatória[21]. Essa planta tem potencial para investigações como sedativa e antidepressiva, uma vez que a obra de Pio Corrêa segue na mesma linha do estudo clínico de Sanmukhani et al.[35]. Os constituintes químicos dos rizomas citados pela OMS correspondem ao óleo volátil (6%) de cor amarela a laranja (6%) composto por vários monoterpenos e sesquiterpenos, incluindo zingibereno, curcumeno, α- e β-turmerona entre outros. Os princípios de coloração (5%) são curcuminoides, 50–60% dos quais são uma mistura de curcumina, monodesmetoxicurcumina e bisdesmetoxicurcumina[77].
Erythrina verna (E. mulungu) – MULUNGU
Somente um estudo clínico do mulungu foi encontrado nesta revisão. Os efeitos de P. incarnata, E. mulungu e Midazolam foram comparados no controle da ansiedade em pacientes submetidos à extração de terceiros molares inferiores[57]. O estudo concluiu que não houve diferenças entre E. mulungu e placebo (p = 0,158), embora a amostra tenha sido representativa e constituída por 200 voluntários, sendo 131 mulheres com idade média de 24,3 anos e 69 homens com idade média de 25 anos.
O mulungu é planta referida por Pio Corrêa[18] como calmante das tosses nervosas, provocadora do sono e útil nas doenças do fígado. O FFFB 2021 cita a decocção da casca do caule como auxiliar no alívio da ansiedade e insônia leves[21]. Os principais constituintes químicos encontrados em Erythrina são esteroides e triterpenoides (β-sitosterol, estigmasterol, α-amirina, β-amirina, lupeol), flavonoides, alcaloides tetracíclicos (eritravina, 11-hidroxi-eritravina, eritrina, erisotrina, eritrartina, eritralina, erisotina, eritratidina), alcaloides indólicos (hipaforina) e ácido cinâmico[78]. Verifica-se a necessidade de mais estudos clínicos para comprovação do efeito ansiolítico e sedativo do mulungu.
Humulus lupulus – LÚPULO
Dois estudos clínicos foram localizados para H. lupulus. Em estudo clínico randomizado duplo-cego controlado por placebo, Kyrou et al.[60] verificaram que, em adultos jovens saudáveis relatando pelo menos sintomas leves de depressão, ansiedade e estresse, a suplementação diária com extrato seco de lúpulo pode melhorar significativamente todos esses sintomas durante um período de 4 semanas. Esses efeitos benéficos concordam com a recomendação de lúpulo para transtornos de ansiedade/humor e inquietação, conforme aprovado pela Comissão Alemã E., indicando que houve diminuição significativa na ansiedade com o uso do lúpulo comparado ao placebo (p=0,009). Já em estudo clínico longitudinal, Franco et al.[41] constataram que o consumo moderado de cerveja sem álcool favorece o descanso noturno, principalmente pelo seu teor de lúpulo como componente da bebida, além de outros benefícios comprovados para o organismo. Houve melhora na qualidade do sono noturno após a ingestão de cerveja no final do dia. Isso é ilustrado pela redução da latência do sono e a notável redução da mobilidade, alcançando assim um sono reparador que se refletiu em diminuição da ansiedade. Em ambos os estudos não foram relatados efeitos adversos.
Pio Corrêa[17] destaca que as inflorescências do lúpulo são empregadas como tônico amargo, sedativo ou narcótico. Nesta revisão, os estudos selecionados foram significativos na melhora de sintomas leves de depressão, ansiedade e estresse[60] e melhora na qualidade do sono com diminuição de ansiedade[41], estando em concordância com a citação de Pio Corrêa. Segundo a OMS os principais constituintes das inflorescências de lúpulo são substâncias amargas (15-25%), cujos constituintes químicos predominantes são humulona e lupulona e seus derivados relacionados, 2 a 10% e 2 a 6%, respectivamente; além da presença de óleo essencial (0,3–1,0%) contendo principalmente monoterpenos e sesquiterpenos, tais como β-cariofileno, farneseno, humuleno e β-mirceno[79].
Verifica-se a necessidade de mais investigações clínicas para H. lupulus, devido ao seu potencial efeito ansiolítico e sedativo, bem como no alívio de sintomas leves de estresse mental e para ajudar no sono, conforme preconizado pela Agência Europeia de Medicamentos - do inglês European Medicines Agency[80].
Lactuca sativa - ALFACE
Um estudo clínico foi encontrado nesta revisão indicando que as sementes de L. sativa podem ser utilizadas em gestantes para o tratamento da insônia. Segundo Pour et al.[51], a melhora na pontuação do PSQI foi significativamente maior em pacientes que receberam sementes de alface do que aqueles que receberam placebo (p=0,021). Os achados deste estudo sugerem que a semente de alface diminuiu a insônia durante a gravidez e pode ser recomendada como um remédio natural seguro para o tratamento da insônia relacionada à gravidez.
Pio Corrêa[14] descreve que o suco latescente extraído do caule antes da frutificação é calmante e narcótico, tendo sido usado para pessoas com sofrimento de insônia e palpitações. Ele se refere ao látex como "uma espécie de ópio com efeito menos violento e ação indireta". Desse modo, são sugeridos estudos clínicos para comprovação dos efeitos do látex relatados por Pio Corrêa e das sementes, pois somente um único ensaio clínico foi localizado nesta revisão.
Melissa officinalis – MELISSA
A eficácia sedativa e ansiolítica de extratos de M. officinalis no sistema nervoso foi abordada em cinco estudos clínicos. Dois estudos avaliaram extratos alcoólicos no comportamento de crianças ansiosas durante exame clínico odontológico, com resultados positivos da ação calmante ou sedativa. Pardo-Aldave[67] ao avaliarem a Escala Comportamental de Frankl, observaram que o extrato etanólico da planta apresentou maior efeito em relação ao placebo, sendo a dose de 6 mg kg-1 mais eficaz. O mesmo resultado também foi encontrado com extrato hidroalcóolico na dose de 2,5 mg kg-1[56]. Outros estudos abordaram o efeito das partes aéreas dessecadas para tratamento de depressão leve a moderada, tendo resultado semelhante à Fluoxetina e comprovando o efeito sedativo da melissa[28], com poucas reações adversas como tontura, boca seca e diminuição do apetite. Em pacientes com angina estável crônica (ACS), o grupo de intervenção que recebeu cápsulas da planta teve uma redução significativa em pontuações de depressão, ansiedade, estresse e distúrbios totais do sono, em comparação com o grupo placebo (p< 0,05)[48]. Além disso, o extrato seco da planta pode aliviar palpitação pela redução da frequência de episódios de palpitação(p=0,0001) e redução significativa do número de pacientes ansiosos em comparação com placebo (p=0,004)[64].
A planta é citada por Pio Corrêa[17] para combater as moléstias nervosas, fornecendo matéria-prima para a fabricação da famosa água de melissa. O FFFB 2021 recomenda a melissa como auxiliar no alívio da ansiedade e insônia leves, além de auxiliar no tratamento sintomático de queixas gastrintestinais leves, tais como distensão abdominal e flatulência[21]. Nesta revisão os estudos clínicos corroboram as indicações de Pio Corrêa e do FFFB 2021, com relação à eficácia sedativa e ansiolítica[28,48,56,64,67]. Os constituintes químicos característicos de melissa citados pela OMS são os ácidos hidroxicinâmicos [rosmarínico (até 6%), ácidos p-cumárico, caféico e clorogênico] e óleo essencial (0,02–0,37%) composto por mais de 40% de monoterpenos e mais de 35% de sesquiterpenos. Os componentes terpenoides mais significativos são o citral (mistura dos isômeros neral e geranial), citronelal, geraniol, nerol, linalol, acetato de farnesilo, humuleno (α-cariofileno), β-cariofileno e eremofileno. Outros constituintes incluem flavonoides, taninos e triterpenos ácidos (ácidos ursólico e oleanólico)[81].
Passiflora incarnata – MARACUJÁ
Sete estudos clínicos foram localizados para P. incarnata. A eficácia de P. incarnata no sono humano foi avaliada por meio de diários de sono validados por polissonografia (PSG), sendo significativamente melhor que o placebo em curto prazo (1 semana) com benefícios para adultos saudáveis com queixas leves na qualidade do sono[42] e transtorno de insônia[43]. O extrato de Passiflora mostrou efeito positivo da administração oral pré-operatória sobre ansiedade, em pacientes submetidos à anestesia, quando comparado com a linha de base, melhorando a pontuação do inventário do estado de ansiedade[39]. Em cirurgia ambulatorial, a administração oral de P. incarnata como pré-medicação reduz a ansiedade sem induzir sedação[61]. A eficácia ansiolítica do extrato das partes aéreas de P. incarnata na dose de 45 gotas ao dia foi comparada com Oxazepam (30 mg ao dia) no tratamento de ansiedade generalizada[25]. O extrato apresentou um início de ação mais lento, porém, não foi relatado prejuízo nas funções cognitivas e no desempenho no trabalho durante o uso, ao contrário do Oxazepam. Passiflora também apresentou efeito ansiolítico semelhante ao Midazolam, sendo seguro e eficaz para sedação consciente em pacientes adultos submetidos à extração de terceiros molares inferiores[57,58]. Alguns efeitos adversos foram encontrados como tontura, confusão, alergia leves[25,58], ataxia[25], relaxamento muscular, epistaxe[58] e sonolência[25,58,59].
O gênero Passiflora, na descrição de Pio Corrêa[16,18], contém substância idêntica à morfina e denominada passiflorina nas folhas e nas raízes, sendo essas muito empregadas como calmante. As folhas são usadas também para combater febres intermitentes, inflamações cutâneas, erisipela, sendo diaforéticas e referidas como anti-histéricas, além de anti-helmínticas. As indicações terapêuticas das folhas de P. incarnata recomendadas pelo MFFB 2016 e FFFB 2021 são como ansiolítico e sedativo leve para tratar insônia[20,21]. Portanto, nesta revisão os estudos selecionados apontam que essa planta está relacionada ao tratamento de transtornos de ansiedade e insônia, estando em consonância com informações de Pio Corrêa e dos documentos oficiais - MFFB 2016 e FFFB 2021[20,21]. Os principais constituintes químicos encontrados nas partes aéreas de Passiflora conforme a OMS são flavonoides (2,5%) (apigenina, luteolina, vitexina, crisina), glicosídeos cianogênicos (ginocardina) e alcaloides indólicos (harmano, harmol, harmina)[82].
Valeriana officinalis - VALERIANA
Seis estudos clínicos foram selecionados para V. officinalis, sendo quatro para tratar distúrbios do sono e dois para controlar a ansiedade.
O efeito do Midazolam com valeriana foi comparado durante a extração de terceiros molares, constatando que o Midazolam foi mais eficaz na redução dos parâmetros fisiológicos estudados[59]. Porém, a valeriana demonstrou efeito ansiolítico, proporcionando conforto e relaxamento necessários, sem sedação e menos sonolência do que o Midazolam. O efeito positivo da valeriana no controle da ansiedade também foi constatado por Pinheiro et al.[54] em comparação com placebo. Com relação a tratamento de distúrbio do sono em pacientes com insuficiência cardíaca crônica (ICC), os resultados de Aliakbari e Rafieian[46] indicaram que quanto ao tempo de espera para cair no sono, houve diferença significativa após a intervenção, de modo que foi menor nos grupos de intervenção em comparação com o grupo controle (p= 0,001), evidenciando melhora na qualidade do sono em pacientes com ICC que apresentam insônia. Os resultados desse estudo apoiam a eficácia relatada de V. officinalis no manejo clínico de insônia. Por outro lado, a Valeriana não mostrou eficácia nos estudos para redução dos distúrbios do sono em pessoas com artrite leve e artrose[52], em pessoas com câncer em tratamento oncológico[47] e em mulheres idosas relatando insônia[52].
Pio Corrêa[17] define que a ação da valeriana pode ser sedativa, antiespasmódica e ligeiramente narcótica. Ele relata que a ingestão do suco fresco da planta determina uma breve excitação nervosa, seguida de diminuição da sensibilidade e da energia da contração cardíaca, com consequente abaixamento da pressão arterial. Pio Corrêa complementa ainda que o emprego da valeriana é recomendado nos casos de exagerada excitabilidade psíquica e sensorial acompanhada ou não de espasmos convulsivos e de eretismo vascular, podendo ser usada também na insônia e nos estados excitativos de depressão nervosa, cansaço intelectual, neurose cardíaca ou nas que acompanham a menstruação, a gravidez, a menopausa e na histeria. Ademais, afirma sua ação sedativa nos casos de epilepsia, quando associada a outros medicamentos específicos. No MFFB 2016 a valeriana pode ser usada como sedativo moderado, hipnótico e no tratamento de distúrbios do sono associados à ansiedade[20]. No FFFB 2021[21] a planta é indicada como sedativo leve e indutor do sono. Dos estudos clínicos selecionados há concordância com as indicações de Pio Corrêa, no que se refere ao efeito sedativo e na melhora na qualidade do sono. A droga vegetal consiste dos órgãos subterrâneos (raízes, rizomas e estolões), secos, inteiros ou fragmentados, de V. officinalis[73] e as principais classes químicas segundo a OMS correspondem a monoterpenos, sesquiterpenos, epóxi-iridoides e valepotriatos[71].
Dos 43 trabalhos clínicos incluídos nesta revisão, a única forma de administração foi a oral, contendo extrato da espécie vegetal por meio de cápsulas, comprimidos, xaropes, infusões ou decocções. A via oral é a mais conveniente devido à praticidade na administração e segurança, sendo a principal via de uso de preparações da medicina tradicional na forma de chás por infusão ou decocção.
Um dos maiores problemas em pesquisar plantas com atividade terapêutica é a possível variação fitoquímica, mesmo entre exemplares pertencentes à mesma espécie[65]. Além disso, a forma com que a planta é processada também influencia o perfil fitoquímico, de maneira que dois medicamentos fitoterápicos contendo a mesma substância ativa podem apresentar qualidades diferentes e, assim, não serem considerados equivalentes terapêuticos. Por conseguinte, o ideal é trabalhar com extratos padronizados (com marcadores), possibilitando a reprodutibilidade dos resultados, uma vez que as ações farmacológicas de um medicamento de origem vegetal são altamente relacionadas com as especificações dos produtos empregados, assim os extratos, desde que padronizados possuem composição constante, o que pode não ocorrer com o material vegetal in natura ou mesmo em preparações extrativas brutas[65].
A avaliação da eficácia das plantas medicinais de maneira geral, conforme Mendonça Neto et al.[83], é uma tarefa complexa, uma vez que a composição química do preparado fitoterápico depende de vários fatores, tais como: fatores ambientais, fatores genéticos, tipo de solo, partes da planta utilizadas, época de colheita e métodos de preparação. Por outro lado, esses autores ressaltam que apesar das limitações na validação das propriedades farmacológicas das plantas no contexto da saúde mental, a fitoterapia pode auxiliar na redução de sintomas ansiosos e de insônia.
A partir das espécies levantadas para o sistema nervoso na obra de Pio Corrêa, na pesquisa bibliográfica de estudos clínicos e nos documentos oficiais, constatou-se a necessidade de aprofundamento e valorização da utilização de plantas da sociobiodiversidade, bem como a realização de mais investigações com ensaios clínicos. Neste sentido, sugere-se que os grupos de pesquisa de desenvolvimento tecnológico da indústria farmacêutica considerem a Convenção sobre a Diversidade Biológica e levem em conta o conceito de inovação em medicamentos da biodiversidade proposto pelas RedesFito, que define a inovação como um processo histórico, social e dinâmico[13].
Dessa forma, a contribuição das RedesFito na inovação em medicamentos de origem vegetal é de fundamental importância, pois a experiência concreta desses atores mostra a necessidade de mudanças estruturais iniciando com a criação de programas científicos que reconheçam o fato de que, quanto mais conhecimento houver sobre a biodiversidade, maior será o potencial da biotecnologia. As RedesFito, segundo Villas Bôas e Gilon[13], constituem um importante sistema de gestão e inovação em medicamentos da biodiversidade alicerçados na sustentabilidade dos sistemas ecoprodutivos. Ademais, essa rede de conhecimento é uma ferramenta poderosa para a implementação da Política de Ciência, Tecnologia e Inovação em Saúde sustentável e transversal.
Conclusão
Este trabalho reuniu evidências científicas sobre os efeitos ansiolíticos, sedativos e/ou antidepressivos de 12 espécies de plantas medicinais, utilizadas na forma de medicamento fitoterápico ou produto tradicional fitoterápico. Dessas 12 espécies, apenas o mulungu não mostrou efeito no único ensaio clínico estudado. Oito espécies apresentaram efeitos ansiolíticos (açafrão, cimicífuga, endro, laranjeira, lúpulo, maracujá, melissa, valeriana), quatro apresentaram efeitos antidepressivos (açafrão, cúrcuma, lúpulo, melissa) e sete apresentaram efeitos sedativos (açafrão, alface, cidró, lúpulo, maracujá, melissa, valeriana) comprovados nos estudos clínicos analisados.
A única forma de administração foi a oral, contendo extrato da espécie vegetal por meio de cápsulas, comprimidos, xaropes, infusões ou decocções. As plantas geralmente possuem menos efeitos adversos em relação aos medicamentos convencionais, entretanto é essencial a padronização dos preparados fitoterápicos assegurando a eficácia e a segurança na sua utilização.
Portanto, a fitoterapia pode auxiliar no tratamento de transtornos de ansiedade e depressão nos cuidados da saúde mental, a partir das plantas da sociobiodiversidade brasileira. Contudo, a realização de mais investigações com ensaios clínicos se faz necessária, bem como investimentos em biotecnologia para garantir o desenvolvimento da inovação em medicamentos de origem vegetal.
Fontes de Financiamento
Nenhuma.
Conflito de Interesses
Não há conflito de interesses.
Agradecimentos
As autoras agradecem à FIOCRUZ Farmanguinhos/RJ pela oportunidade de participação no curso de especialização em Inovação em Medicamentos da Biodiversidade, que culminou neste trabalho de revisão.
Colaboradores
Concepção do estudo: BMR
Curadoria dos dados: TMBG
Coleta de dados: TMBG
Análise dos dados: TMBG; BMR
Redação do manuscrito original: TMBG
Redação da revisão e edição: TMB
Referências
1. Organização das Nações Unidas (ONU). 1 bilhão de pessoas vivem com algum transtorno mental, afirma OMS | ONU News, 2022; [acesso 25 mar. 2023]. Disponível em: [https://news.un.org/pt/story/2022/06/1792702].
2. Organização Pan-Americana da Saúde (OPAS). Pandemia de COVID-19 desencadeia aumento de 25% na prevalência de ansiedade e depressão em todo o mundo. OPAS. 2022; [acesso 7 abr. 2023]. Disponível em: [https://www.paho.org/pt/noticias/2-3-2022-pandemia-covid-19-desencadeia-aumento-25-na-prevalencia-ansiedade-e-depressao-em].
3. Neto MRL, Elkis H. Psiquiatria Básica. 2ª ed. Porto Alegre: ARTMED/ Grupo A; 2007. 712p. ISBN 9788536309606
4. Gotlib IH, Joormann J. Cognition and depression: current status and future directions. Annu Rev Clin Psychol. 2010; 6(1): 285–312. Disponível em: [https://doi.org/10.1146/annurev.clinpsy.121208.131305].
5. Brasil. Na América Latina, Brasil é o país com maior prevalência de depressão. 2022; [acesso em: 7 abr. 2023]. Disponível em: [https://www.gov.br/saude/pt-br/assuntos/noticias/2022/setembro/na-america-latina-brasil-e-o-pais-com-maior-prevalencia-de-depressao].
6. Nobrega JCS, Batista AVA, Silva OS, Belchior VCS, Lacerda WA, Belchior SMS. Medicinal plants in the treatment of anxiety and depression: a review. Res Soc Dev. 2022; 11(1): e5511124024–e5511124024. Disponível em: [https://doi.org/10.33448/rsd-v11i1.24024].
7. Sousa RF de, Oliveira YR, Calou IBF. Ansiedade: aspectos gerais e tratamento com enfoque nas plantas com potencial ansiolítico. Revinter. 2018; 11(1). Disponível em: [https://doi.org/10.22280/revintervol11ed1.327].
8. Silva ELP, Soares JCF, Machado MJ, Reis IMA, Cova SC. Avaliação do perfil de produção de fitoterápicos para o tratamento de ansiedade e depressão pelas indústrias farmacêuticas brasileiras. Braz J Dev 2020; 6(1): 3119–35. Disponível em: [https://doi.org/10.34117/bjdv6n1-226].
9. Coradin L, Siminski A, Reis A. Espécies nativas da flora brasileira de valor econômico atual ou potencial: plantas para o futuro - Região Sul. Brasília: Ministério do Meio Ambiente (MMA); 2011. 934 p. Disponível em: [https://www.gov.br/mma/pt-br/assuntos/biodiversidade/fauna-e-flora/Regiao_Sul.pdf].
10. Villas Bôas G de K. Inovação em medicamentos da biodiversidade: uma mudança necessária nas políticas públicas. São Paulo: Editora Dialética; 2022. 204p. ISBN 978-65-252-2934-8. [https://doi.org/10.48021/978-65-252-2933-1].
11. Brasil. Ministério da Saúde. Política nacional de práticas integrativas e complementares no SUS: atitude de ampliação de acesso. Brasília: Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de Atenção Básica. 2015; [acesso em: 9 abr. 2023]. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/politica_nacional_praticas_integrativas_complementares_2ed.pdf].
12. Brasil. Ministério da Saúde. Política e programa nacional de plantas medicinais e fitoterápicos. Brasília: Ministério da Saúde. Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Assistência Farmacêutica. 2016; [acesso em: 9 abr. 2023]. Disponível em: [https://bvsms.saude.gov.br/bvs/publicacoes/politica_programa_nacional_plantas_medicinais_fitoterapicos.pdf].
13. Villas Bôas GK, Gilon C. Contribuição ao debate sobre o papel da inovação em medicamentos a partir da biodiversidade. Rev Fitos. 2016; 10(2): 103–14. Disponível em: [https://doi.org/10.5935/2446-4775.20160009].
14. Corrêa MP. Dicionário das plantas úteis do Brasil e das exóticas cultivadas. v. 1. Rio de Janeiro: Imprensa Nacional; 1984. 747p.
15. Corrêa MP. Dicionário das plantas úteis do Brasil e das exóticas cultivadas. v. 2. Rio de Janeiro: Imprensa Nacional; 1984. 707p.
16. Corrêa MP. Dicionário das plantas úteis do Brasil e das exóticas cultivadas. v. 3. Rio de Janeiro: Imprensa Nacional; 1984. 646p.
17. Corrêa MP. Dicionário das plantas úteis do Brasil e das exóticas cultivadas. v. 4. Rio de Janeiro: Instituto Brasileiro de Desenvolvimento Florestal; 1984. 765p.
18. Corrêa MP. Dicionário das plantas úteis do Brasil e das exóticas cultivadas. v. 5. Rio de Janeiro: Instituto Brasileiro de Desenvolvimento Florestal; 1984. 687p.
19. Corrêa MP. Dicionário das plantas úteis do Brasil e das exóticas cultivadas. v. 6. Rio de Janeiro: Instituto Brasileiro de Geografia e Estatística; 1984. 777p.
20. Brasil. Ministério da Saúde. Memento Fitoterápico da Farmacopeia Brasileira - 1ª ed. Brasília: Agência Nacional de Vigilância Sanitária. 2016; [acesso 25 mar. 2023]. Disponível em: [https://www.gov.br/saude/pt-br/composicao/sectics/daf/pnpmf/publicacoes/memento-fitoterapico-da-farmacopeia-brasileira/view]
21. Brasil. Ministério da Saúde. Formulário de Fitoterápicos da Farmacopeia Brasileira - 2ª ed. Brasília: Agência Nacional de Vigilância Sanitária. 2021; [acesso 25 mar. 2023]. Disponível em: [https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/formulario-fitoterapico/arquivos/2021-fffb2-final-c-capa2.pdf]
22. Brasil. Ministério da Saúde. Resolução da Diretoria Colegiada-RDC n° 26, de 13 de maio de 2014. Agência Nacional de Vigilância Sanitária – ANVISA. 2014; [acesso 25 mar. 2023]. Disponível em: [https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2014/rdc0026_13_05_2014.pdf].
23. PRISMA Statement. PRISMA Flow Diagram [Internet]. 2020; [acesso em: 23 abr. 2023]. Disponível em: [http://www.prisma-statement.org/PRISMAStatement/FlowDiagram.aspx].
24. Ahmadpanah M, Ramezanshams F, Ghaleiha A, Akhondzadeh S, Sadeghi Bahmani D, Brand S. Crocus sativus L. (saffron) versus sertraline on symptoms of depression among older people with major depressive disorders-a double-blind, randomized intervention study. Psychiatry Res. 2019; 282: 112613. Disponível em: [https://doi.org/10.1016/j.psychres.2019.112613].
25. Akhondzadeh S, Naghavi HR, Vazirian M, Shayeganpour A, Rashidi H, Khani M. Passionflower in the treatment of generalized anxiety: a pilot double-blind randomized controlled trial with oxazepam. J Clin Pharm Ther. 2001; 26(5): 363–7. Disponível em: [https://doi.org//10.1046/j.1365-2710.2001.00367.x] [https://PubMed.ncbi.nlm.nih.gov/11679026/].
26. Akhondzadeh S, Fallah-Pour H, Afkham K, Jamshidi AH, Khalighi-Cigaroudi F. Comparison of Crocus sativus L. and imipramine in the treatment of mild to moderate depression: a pilot double-blind randomized trial [ISRCTN45683816]. BMC Complement Altern Med. 2004; 4(1): 12. Disponível em: [https://doi.org/10.1186/1472-6882-4-12].
27. Akhondzadeh S, Tahmacebi-Pour N, Noorbala AA, Amini H, Fallah-Pour H, Jamshidi AH et al. Crocus sativus L. in the treatment of mild to moderate depression: a double-blind, randomized and placebo-controlled trial. Phytother Res. 2005; 19(2): 148‐151. Disponível em: [https://doi.org/10.1002/ptr.1647].
28. Araj-Khodaei M, Noorbala AA, Yarani R, Emadi F, Emaratkar E, Faghihzadeh S et al. A double-blind, randomized pilot study for comparison of Melissa officinalis L. and Lavandula angustifolia Mill. with Fluoxetine for the treatment of depression. BMC Complement Med Ther. 2020; 20(1): 207. Disponível em: [https://doi.org/10.1186/s12906-020-03003-5].
29. Ghajar A, Neishabouri S, Velayati N, Jahangard L, Matinnia N, Haghighi M et al. Crocus sativus L. versus citalopram in the treatment of major depressive disorder with anxious distress: a double-blind, controlled clinical trial. Pharmacopsychiatry. 2017; 50(04): 152–60. Disponível em: [https://doi.org/10.1055/s-0042-116159].
30. Moshiri E, Basti AA, Noorbala AA, Jamshidi AH, Hesameddin Abbasi S, Akhondzadeh S. Crocus sativus L. (petal) in the treatment of mild-to-moderate depression: a double-blind, randomized and placebo-controlled trial. Phytomedicine. 2006; 13(9–10): 607–11. Disponível em: [https://doi.org/10.1016/j.phymed.2006.08.006].
31. Noorbala AA, Akhondzadeh S, Tahmacebi-Pour N, Jamshidi AH. Hydro-alcoholic extract of Crocus sativus L. versus fluoxetine in the treatment of mild to moderate depression: a double-blind, randomized pilot trial. J Ethnopharmacol. 2005; 97(2): 281–4. Disponível em: [https://doi.org/10.1016/j.jep.2004.11.004].
32. Kashani L, Eslatmanesh S, Saedi N, Niroomand N, Ebrahimi M, Hosseinian M et al. Comparison of saffron versus fluoxetine in treatment of mild to moderate postpartum depression: a double-blind, randomized clinical trial. Pharmacopsychiatry. 2017; 50(02): 64-68 Disponível em: [https://doi.org/10.1055/s-0042-115306].
33. Kashani L, Esalatmanesh S, Eftekhari F, Salimi S, Foroughifar T, Etesam F et al. Efficacy of Crocus sativus (saffron) in treatment of major depressive disorder associated with post-menopausal hot flashes: a double-blind, randomized, placebo-controlled trial. Arch Gynecol Obstet. 2018; 297(3): 717–24. Disponível em: [https://doi.org/10.1007/s00404-018-4655-2].
34. Shahmansouri N, Farokhnia M, Abbasi SH, Kassaian SE, Noorbala Tafti AA, Gougol A, et al. A randomized, double-blind, clinical trial comparing the efficacy and safety of Crocus sativus L. with fluoxetine for improving mild to moderate depression in post percutaneous coronary intervention patients. J Affect Disord. 2014; 155: 216–22. Disponível em: [https://doi.org/10.1016/j.jad.2013.11.003].
35. Sanmukhani J, Satodia V, Trivedi J, Patel T, Tiwari D, Panchal B et al. Efficacy and safety of curcumin in major depressive disorder: a randomized controlled trial. Phytother Res. 2014; 28(4): 579–85. Disponível em: [https://doi.org/10.1002/ptr.5025].
36. Akhondzadeh Basti A, Moshiri E, Noorbala AA, Jamshidi AH, Abbasi SH, Akhondzadeh S. Comparison of petal of Crocus sativus L. and fluoxetine in the treatment of depressed outpatients: a pilot double-blind randomized trial. Prog Neuropsychopharmacol Biol Psychiatry. 2007; 31(2): 439–42. Disponível em: [https://doi.org/10.1016/j.pnpbp.2006.11.010].
37. Amsterdam JD, Yao Y, Mao JJ, Soeller I, Rockwell K, Shults J. Randomized, double-blind, placebo-controlled trial of Cimicifuga racemosa (black cohosh) in women with anxiety disorder due to menopause. J Clin Psychopharmacol. 2009; 29(5): 478‐483. Disponível em: [https://doi.org/10.1097/JCP.0b013e3181b2abf2].
38. Akhlaghi M, Shabanian G, Rafieian-Kopaei M, Parvin N, Saadat M, Akhlaghi M. Citrus aurantium blossom and preoperative anxiety. Braz J Anesthesiol. 2011; 61(6): 702–12. Disponível em: [https://doi.org/10.1016/S0034-7094(11)70079-4].
39. Aslanargun P, Cuvas O, Dikmen B, Aslan E, Yuksel MU. Passiflora incarnata Linneaus as an anxiolytic before spinal anesthesia. J Anesthesiol. 2012; 26(1): 39–44. Disponível em: [https://doi.org/10.1007/s00540-011-1265-6].
40. Farshbaf-Khalili A, Kamalifard M, Namadian M. Comparison of the effect of lavender and bitter orange on anxiety in postmenopausal women: A triple-blind, randomized, controlled clinical trial. Complement Ther Clin Pract. 2018; 31: 132–8. Disponível em: [https://doi.org/10.1016/j.ctcp.2018.02.004].
41. Franco L, Sánchez C, Bravo R, Rodríguez AB, Barriga C, Romero E et al. The sedative effect of non-alcoholic beer in healthy female nurses. Plos One. 2012; 7(7): e37290. Disponível em: [https://doi.org/10.1371/journal.pone.0037290].
42. Ngan A, Conduit R. A Double-blind, Placebo-controlled Investigation of the Effects of Passiflora incarnata (passionflower) herbal tea on subjective sleep quality. Phytother Res. 2011; 25(8):1 153–9. Disponível em: [https://doi.org/10.1002/ptr.3400].
43. Lee J, Jung HY, Lee SI, Choi JH, Kim SG. Effects of Passiflora incarnata Linnaeus on polysomnographic sleep parameters in subjects with insomnia disorder. Int Clin Psychopharmacol. 2020; 35(1): 29–35. Disponível em: [https://doi.org/10.1097/YIC.0000000000000291].
44. Mazidi M, Shemshian M, Mousavi SH, Norouzy A, Kermani T, Moghiman T et al. A double-blind, randomized and placebo-controlled trial of Saffron (Crocus sativus L.) in the treatment of anxiety and depression. J Complement Integr Med. 2016; 13(2). Disponível em: [https://doi.org/10.1515/jcim-2015-0043].
45. Afrasiabian F, Mirabzadeh Ardakani M, Rahmani K, Azadi NA, Alemohammad ZB, Bidaki R et al. Aloysia citriodora Palau (lemon verbena) for insomnia patients: A randomized, double-blind, placebo-controlled clinical trial of efficacy and safety. Phytother Res. 2019; 33(2): 350–9. Disponível em: [https://doi.org/10.1002/ptr.6228].
46. Aliakbari F, Rafieian M. The effectiveness of Valeriana officinalis on sleep disturbance in patients with chronic heart failure. Int J Pharm Investig. 2018; 8(3): 145‐150. Disponível em: [https://doi.org/10.4103/jphi.JPHI_43_18].
47. Barton DL, Atherton PJ, Bauer BA, Moore DF, Mattar BI, LaVasseur BI et al. The use of Valeriana officinalis (Valerian) in improving sleep in patients who are undergoing treatment for cancer: a phase iii randomized, placebo-controlled, double-blind study (NCCTG Trial, N01C5). J Support Oncol. 2011; 9(1): 24–31. Disponível em: [https://doi.org/10.1016/j.suponc.2010.12.008].
48. Haybar H, Javid AZ, Haghighizadeh MH, Valizadeh E, Mohaghegh SM, Mohammadzadeh A. The effects of Melissa officinalis supplementation on depression, anxiety, stress, and sleep disorder in patients with chronic stable angina. Clin Nutr ESPEN. 2018; 26: 47–52. Disponível em: [https://doi.org/10.1016/j.clnesp.2018.04.015].
49. Kell G, Rao A, Beccaria G, Clayton P, Inarejos-García AM, Prodanov M. affron® a novel saffron extract (Crocus sativus L.) improves mood in healthy adults over 4 weeks in a double-blind, parallel, randomized, placebo-controlled clinical trial. Complement Ther Med. 2017; 33: 58–64. Disponível em: [https://doi.org/10.1016/j.ctim.2017.06.001].
50. Martinez-Rodriguez A, Martinez-Olcina M, Mora J, Navarro P, Caturla N, Jones J. Anxiolytic effect and improved sleep quality in individuals taking Lippia citriodora extract. Nutrients. 2022, 14(1): 218. Disponível em: [https://doi.org/10.3390/nu14010218].
51. Pour ZS, Hosseinkhani A, Asadi N, Shahraki HR, Vafaei H, Kasraeian M, et al. Double-blind randomized placebo-controlled trial on efficacy and safety of Lactuca sativa L. seeds on pregnancy-related insomnia. J Ethnopharmacol. 2018; 227: 176–80. Disponível em: [https://doi.org/10.1016/j.jep.2018.08.001].
52. Taibi DM, Vitiello M V., Barsness S, Elmer GW, Anderson GD, Landis CA. A randomized clinical trial of valerian fails to improve self-reported, polysomnographic, and actigraphic sleep in older women with insomnia. Sleep Med. 2009; 10(3): 319–28. Disponível em: [https://doi.org/10.1016/j.sleep.2008.02.001].
53. Vanzeler MLA. Transtornos de ansiedade e avaliação psicológica: Instrumentos utilizados no Brasil. Rev Cient Multidisc Núcleo Conhec. 2020; 100–20. Disponível em: [https://doi.org/10.32749/nucleodoconhecimento.com.br/psicologia/instrumentos-utilizados].
54. Pinheiro MLP, Alcantara CEP, De Moraes M, De Andrade ED. Valeriana officinalis L. for conscious sedation of patients submitted to impacted lower third molar surgery: a randomized, double-blind, placebo-controlled split-mouth study. J Pharm Bioallied Sci. 2014; 6(2): 109‐114. Disponível em: [https://doi.org/10.4103/0975-7406.129176].
55. Nappi RE, Malavasi B, Brundu B, Facchinetti F. Efficacy of Cimicifuga racemosa on climacteric complaints: a randomized study versus low-dose transdermal estradiol. Gynecol Endocrinol. 2005; 20(1): 30–5. Disponível em: [https://doi.org/10.1080/09513590400020922].
56. Pardo Aldave K. Acción neurotrópica del extracto hidroalcohólico de Melissa officinalis (toronjil) en el comportamiento del niño ansioso con y sin experiencia dental. Kiru. 2009; 6(2): 64–71. Disponível em: [https://repositorio.usmp.edu.pe/handle/20.500.12727/1770].
57. Da Cunha RS, Amorim KS, Gercina AC, De Oliveira ACA, Dos Santos Menezes L, Groppo FC et al. Herbal medicines as anxiolytics prior to third molar surgical extraction. A randomized controlled clinical trial. Clin Oral Investig. 2021; 25(3): 1579–86. Disponível em: [https://doi.org/10.1007/s00784-020-03468-1].
58. Dantas L, de Oliveira-Ribeiro A, de Almeida-Souza L, Groppo F. Effects of Passiflora incarnata and midazolam for control of anxiety in patients undergoing dental extraction. Med Oral Patol Oral Cir Bucal. 2016; 22 (1): e95-101. Disponível em: [https://doi.org/10.4317/medoral.21140].
59. Farah GJ, Ferreira GZ, Danieletto-Zanna CF, Luppi CR, Jacomacci WP. Assessment of Valeriana officinalis L. (Valerian) for conscious sedation of patients during the extraction of impacted mandibular third molars: a randomized, split-mouth, double-blind, crossover study. J Maxillofac Surg. 2019; 77(9): 1796.e1-1796.e8. Disponível em: [https://doi.org/10.1016/j.joms.2019.05.003].
60. Kyrou I, Christou A, Panagiotakos D, Stefanaki C, Skenderi K, Katsana K, et al. Effects of a hops (Humulus lupulus L.) dry extract supplement on self-reported depression, anxiety and stress levels in apparently healthy young adults: a randomized, placebo-controlled, double-blind, crossover pilot study. Hormones. 2017; 16(2): 171–80. Disponível em: [http://www.hormones.gr/8688/article/effects-of-a-hops-%3Cem%3Ehumulus-lupulus%E2%80%A6.html].
61. Movafegh A, Alizadeh R, Hajimohamadi F, Esfehani F, Nejatfar M. Preoperative oral Passiflora incarnata reduces anxiety in ambulatory surgery patients: a double-blind, placebo-controlled study. Anesth Analg 2008; 106(6): 1728–32. Disponível em: [https://doi.org/10.1213/ane.0b013e318172c3f9].
62. Moazen-Zadeh E, Abbasi SH, Safi-Aghdam H, Shahmansouri N, Arjmandi-Beglar A, Hajhosseinn Talasaz A et al. Effects of saffron on cognition, anxiety, and depression in patients undergoing coronary artery bypass grafting: a randomized double-blind placebo-controlled trial. J Altern Complement Med. 2018; 24(4): 361–8. Disponível em: [https://doi.org/10.1089/acm.2017.0173].
63. Lopresti AL, Drummond PD, Inarejos-García AM, Prodanov M. affron®, a standardised extract from saffron (Crocus sativus L.) for the treatment of youth anxiety and depressive symptoms: a randomised, double-blind, placebo-controlled study. J Affect Disord. 2018; 232: 349–57. Disponível em: [https://doi.org/10.1016/j.jad.2018.02.070].
64. Alijaniha F, Naseri M, Afsharypuor S, Fallahi F, Noorbala A, Mosaddegh M et al. Heart palpitation relief with Melissa officinalis leaf extract: double blind, randomized, placebo controlled trial of efficacy and safety. J Ethnopharmacol. 2015; 164: 378–84. Disponível em: [https://doi.org/10.1016/j.jep.2015.02.007].
65. Faustino TT, Almeida RB, Andreatini R. Plantas medicinais no tratamento do transtorno de ansiedade generalizada: uma revisão dos estudos clínicos controlados. Rev Bras Psiquiatr. 2010; 32(4): 429–36. Disponível em: [https://doi.org/10.1590/S1516-44462010005000026].
66. Akhondzadeh S, Mostafavi SA, Keshavarz SA, Mohammadi MR, Hosseini S, Eshraghian MR. A placebo controlled randomized clinical trial of Crocus sativus L. (saffron) on depression and food craving among overweight women with mild to moderate depression. J Clin Pharm Ther. 2020; 45(1): 134‐143. Disponível em: [https://doi.org/10.1111/jcpt.13040].
67. Pardo-Aldave K, Díaz-Pizán ME, Villegas-Vilchez LF, Bernabé-Ortiz E. Efecto del extracto etanólico de Melissa officinalis (toronjil) en la modificación de la conducta del niño ansioso en la consulta dental. Rev Estomatol Herediana. 2014; 19(2): 91. Disponível em: [https://doi.org/10.20453/reh.v19i2.1827].
68. Hekmatzadeh SF, Bazarganipour F, Allan H, Aramesh S, Mohammadi J. Effects of boiled dill seed on anxiety during labor: a randomized clinical trial. Chin J Integr Med. 2020; 26(2): 100–5. Disponível em: [https://doi.org/10.1007/s11655-019-3222-4].
69. Akhondzadeh S, Tahmacebi-Pour N, Noorbala AA, Amini H, Fallah-Pour H, Jamshidi AH, et al. Crocus sativus L. in the treatment of mild to moderate depression: a double-blind, randomized and placebo-controlled trial. Phytother Res. 2005; 19(2): 148–51. Disponível em:[https://doi.org/10.1002/ptr.1647]
70. Taibi DM, Bourguignon C, Gill Taylor A. A feasibility study of valerian extract for sleep disturbance in person with arthritis. Biol Res Nurs. 2009; 10(4): 409–17. Disponível em: [https://doi.org/10.1177/1099800408324252]
71. World Health Organization. WHO monographs on selected medicinal plants. v. 2. Geneva, Switzerland: World Health Organization. 2002; 55–65. [acesso 26 mar. 2023]. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9241545372.pdf?sequence=2&isAllowed=y].
72. Hirai M, Ota Y, Ito M. Diversity in principal constituents of plants with a lemony scent and the predominance of citral. J Nat Med. 2022; 76(1): 254–8. Disponível em: [https://doi.org/10.1007/s11418-021-01553-7]
73. Brasil. Farmacopeia Brasileira. 6ª ed. – v. 2 - Monografias Plantas Medicinais. Brasília: Agência Nacional de Vigilância Sanitária. 2019; [acesso 26 mar 2023]. Disponível em: [https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/farmacopeia-brasileira/6a-edicao-volume-2]
74. World Health Organization. WHO monographs on selected medicinal plants. v. 3. Geneva, Switzerland: World Health Organization. 2007; 33–41. [acesso 26 mar. 2023]. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9789241547024_eng.pdf?sequence=3&isAllowed=y]
75. Ávila LA, Terra JR. Histeria e somatização: o que mudou? J Bras Psiquiatr. 2010; 59(4): 333–40. Disponível em: [https://doi.org/10.1590/S0047-20852010000400011]
76. World Health Organization. WHO monographs on selected medicinal plants. v. 3. Geneva, Switzerland: World Health Organization. 2007; 126–135. [acesso 24 abr. 2023]. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9789241547024_eng.pdf?sequence=3&isAllowed=y].
77. World Health Organization. WHO monographs on selected medicinal plants. v. 1. Geneva, Switzerland: World Health Organization. 1999 [acesso 14 abr. 2023]. p.115–124. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9241545178.pdf?sequence=1&isAllowed=y].
78. Gilbert B, Favoreto R. Erythrina sp. Fabaceae (Leguminosae, Faboideae). Rev Fitos. 2012; 7(03): 185–97. Disponível em: [https://doi.org/10.32712/2446-4775.2012.152].
79. World Health Organization. WHO monographs on selected medicinal plants. v. 3. Geneva, Switzerland: World Health Organization. 2007; 236–246. [acesso 26 mar. 2023]. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9789241547024_eng.pdf?sequence=3&isAllowed=y].
80. European Medicines Agency (EMA). Commnunity herbal monograph on Humulus lupulus L., flos. 2014; 7. [acesso em: 26 mar. 2023]. Disponível em: [https://www.ema.europa.eu/en/documents/herbal-monograph/final-community-herbal-monograph-humulus-lupulus-l-flos-revision-1_en.pdf].
81. World Health Organization. WHO monographs on selected medicinal plants. v. 2. Geneva, Switzerland: World Health Organization. 2002; 180–187. [acesso em: 14 abr. 2023]. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9241545372.pdf?sequence=2&isAllowed=y].
82. World Health Organization. WHO monographs on selected medicinal plants. v. 3. Geneva, Switzerland: World Health Organization. 2007; 257–267. [acesso em: 14 abr. 2023]. Disponível em: [https://apps.who.int/iris/bitstream/handle/10665/42052/9789241547024_eng.pdf?sequence=3&isAllowed=y].
83. Mendonça Neto IJ, Costa SSL, Barboza VN, Vale CMGC, Nunes FVA, Aires CAM et al. Plantas medicinais e fitoterápicos no cuidado da saúde mental em tempos de pandemia: uma revisão da literatura. Rev Med. 2022; 101(3): 1–13. Disponível em: [https://doi.org/10.11606/issn.1679-9836.v101i3e-183634].