REVISÃO
Potencial terapêutico da camomila (Matricaria chamomilla L., Asteraceae) no manejo da mucosite oral: revisão integrativa
Therapeutic potential of chamomile (Matricaria chamomilla L., Asteraceae) in the management of oral mucositis: integrative review
Resumo
O câncer é a doença que mais cresce no mundo, e o seu tratamento é às custas de diversos efeitos colaterais, dentre eles a mucosite oral. A mucosite oral impacta na qualidade de vida, podendo levar a hospitalização. Dentre os tratamentos para a mucosite oral estão a indicação de fitoterápicos para uso tópico e redução da sintomatologia. A Matricaria chamomilla L. Asteraceae, é uma das plantas medicinais mais promissoras para o manejo da mucosite oral, com potencial terapêutico significativo no tratamento desta e de outras afecções orais. Este trabalho tem o objetivo de investigar o potencial terapêutico da camomila (Matricaria chamomilla L. Asteraceae) no manejo da mucosite oral a fim de contribuir para a inovação de uma formulação farmacêutica para aplicação clínica. Foram analisados 48 estudos numa revisão integrativa. Dentre estes, 70,8% demonstraram que esta planta medicinal possui ação anti-inflamatória e com significativa redução na intensidade, severidade e duração das lesões orais. No entanto, os estudos não comprovaram a eficácia na prevenção ou incidência da mucosite oral, e a limitação se dá pela falta de um protocolo embasada e numa formulação farmacêutica padronizada que seja eficaz também no surgimento desta manifestação como efeito colateral a terapia antineoplásica.
- Palavras-chave:
- Matricaria chamomilla.
- Camomila.
- Estomatite.
- Mucosite oral.
- Quimioterapia.
- Radioterapia.
Abstract
Cancer is the fastest growing disease in the world, and its treatment is at the expense of several side effects, including oral mucositis. Oral mucositis impacts quality of life and may lead to hospitalization. Among the treatments for oral mucositis are the indication of herbal medicines for topical use and reduction of symptoms. Matricaria chamomilla L. Asteraceae is one of the most promising medicinal plants for the management of oral mucositis, with significant therapeutic potential in the treatment of this and other oral conditions. This work aims to investigate the therapeutic potential of chamomile (Matricaria chamomilla L. Asteraceae) in the management of oral mucositis to contribute to the innovation of a pharmaceutical formulation for clinical application. 48 studies were analyzed in an integrative review. Among these, 70.8% demonstrated that this medicinal plant has anti-inflammatory action and with a significant reduction in the intensity, severity, and duration of oral lesions. However, studies have not proven efficacy in the prevention or incidence of oral mucositis, and the limitation is due to the lack of a grounded protocol and a standardized pharmaceutical formulation that is also effective in the appearance of this manifestation as a side effect of antineoplastic therapy.
- Keywords:
- Matricaria chamomilla.
- Chamomile.
- Stomatitis.
- Oral mucositis.
- Chemotherapy.
- Radiotherapy.
Introdução
O câncer é a causa de adoecimento que mais cresce [1], sendo entendido como um conjunto de mais de 100 doenças celulares, causado por mutações e alterações nos mecanismos de regulação epigenética, ou seja, desregulação dos mecanismos moleculares e celulares[2–4].
Para o ano de 2025 são esperados mais de 20 milhões de casos novos com quantitativo de mortes provavelmente de 8,2 para 13 milhões por ano[5,6].
O tratamento do câncer inclui a quimioterapia, radioterapia, e cirurgia, podendo ser combinadas, a depender da suscetibilidade dos tumores a estas modalidades terapêuticas, bem como o transplante de medula óssea[7,8].
Dentre os efeitos colaterais do tratamento oncológico, a mucosite oral (MO) é a principal manifestação aguda da quimioterapia e ou radioterapia[8,9]. A MO impacta na qualidade de vida dos pacientes, e muitas vezes é necessário a interrupção parcial ou completa do tratamento oncológico, com complicações sistêmicas, e necessidade de hospitalização, com não rara evolução ao óbito[10–14].
Dentre uma considerável diversidade de plantas medicinais de uso odontológico, a camomila (Matricaria chamomilla L., Asteraceae) se destaca por suas características fitoquímicas e princípios ativos, a tornando uma das plantas medicinais mais estudadas, e com efeitos promissores na prevenção e tratamento da MO[11,15–18].
Na odontologia o uso de fitoterápicos é reconhecido pelo Conselho Federal de Odontologia, através da Resolução n° 082/2008-CFO, tornando viável a indicação e prescrição desses como tratamento complementar aos tratamentos convencionais existentes. Assim como na medicina, abrangendo a atenção secundária e terciária do Sistema Único de Saúde[19–21].
O Brasil é o país que possui a maior biodiversidade do mundo, com grande aceitação de uso de plantas medicinais pela população e rica sabedoria popular[22–24].
Cerca de 48% dos fármacos usados no tratamento de doenças advêm, direta ou indiretamente, de produtos naturais, principalmente plantas que constituem importante fonte para os medicamentos da biodiversidade[25,26]. Os medicamentos oriundos da biodiversidade são desenvolvidos a partir da inovação dinâmica, social, coletiva, histórica e biológica[26–28].
Assim, este estudo, por meio de uma revisão integrativa de literatura, tem o objetivo de sistematizar e avaliar o potencial terapêutico da camomila (Matricaria chamomilla L. Asteraceae) no manejo da MO, para que possa ser indicada com segurança pelos profissionais de saúde e inserida nos guidelines e protocolos de prevenção e tratamento de MO.
Mucosite Oral
A mucosite oral é um processo inflamatório que se dá pela ação citotóxica de quimioterápicos e da radiação ionizante, causando desconforto como ardência, eritema, dor, dificulta a alimentação e o autocuidado bucal. Normalmente as células epiteliais possuem boa regeneração, no entanto, devido ao tratamento com agentes antineoplásicos pode haver retardo e inibição dos processos celulares, com consequente surgimento de lesões como aftas, úlceras e descamação do tecido bucal[11].
Trata-se da principal manifestação aguda relacionada à quimioterapia (QT), bem como reação adversa aos efeitos da radiação ionizante. Estima-se que cerca de 60 a 85% dos pacientes sob transplante de células-tronco hematopoiéticas, 20 a 40% dos pacientes sob quimioterapia convencional e 100% dos pacientes sob radioterapia manifestarão algum grau de mucosite no decorrer do tratamento e após seu término[8,29].
As ulcerações são dolorosas, com impacto na qualidade de vida dos pacientes, podendo exigir a interrupção parcial ou completa do tratamento oncológico. Pode ainda, resultar em complicações sistêmicas, predisposição a infecções oportunistas e secundárias, muitas vezes com necessidade de internações hospitalares, com consequente evolução ao óbito[8,10,11,30].
Geralmente há acometimento das mucosas não queratinizadas do ventre da língua, assoalho bucal, palato mole e mucosa jugal que surgem entre o terceiro e sétimos dias após o início da administração do quimioterápico[29,31,32]. A redução da espessura do epitélio, promove fragilização da barreira mecânica de proteção, dificultando a higienização bucal, e dependendo da gravidade, ou grau da MO, pode levar a quadros de desnutrição e desidratação por redução da ingestão alimentar e hídrica, resultando em internações com elevados custos hospitalares, e comprometimento da sobrevida dos pacientes[9,14,33].
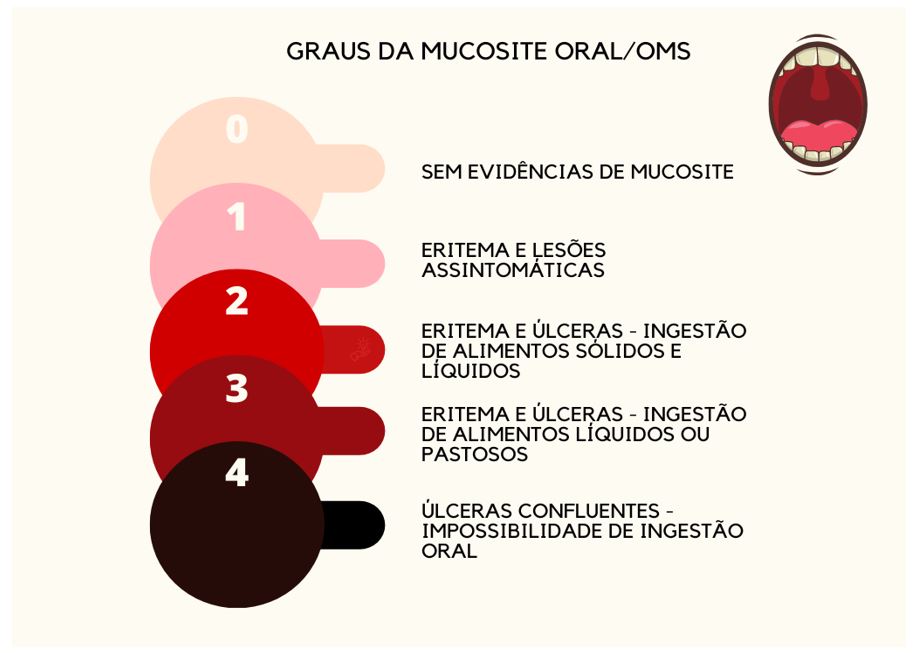
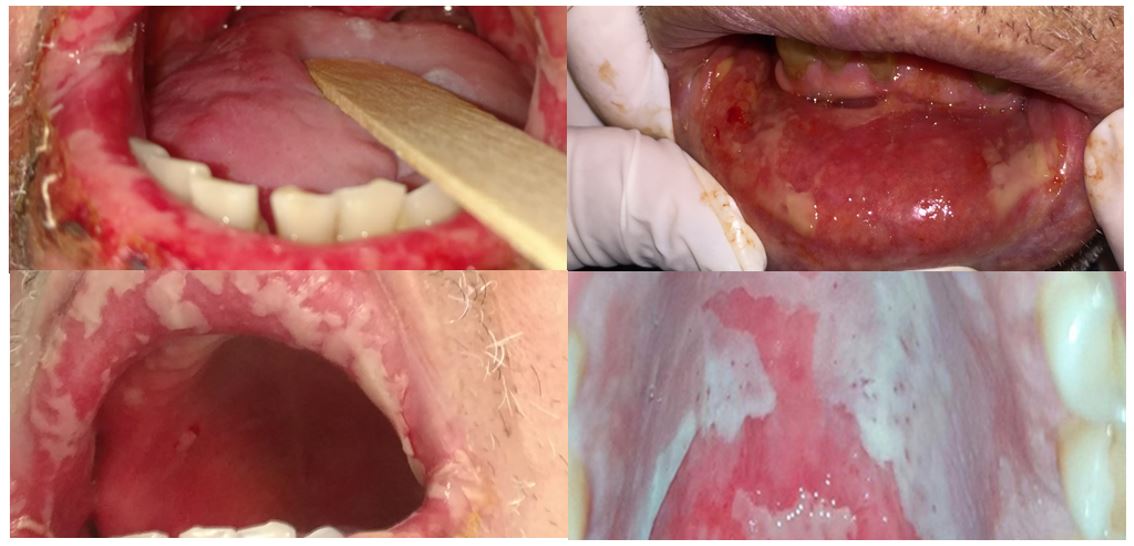
A MO é classificada segundo a Organização Mundial da Saúde (OMS) de graus 0 a 4 na escala de gravidade (FIGURA 1). Define-se grau 0 a apresentação de uma mucosa íntegra, com padrão de normalidade. Já no grau 1, há manifestação de ardência e eritema leve. No grau 2, os danos celulares e teciduais se manifestam, além do eritema, com pequenas ulcerações, dor localizada, e o paciente mantém a ingestão hídrica e alimentar. O grau 3 as úlceras são confluentes, recobertas por pseudomembranas de fibrina, eritema, edema, dor, e interfere na ingestão de alimentos sólidos. E, por fim, o grau 4 devido a presença de múltiplas lesões, dor, sangramento, ardência, dificuldade para abrir a boca, falar, deglutir, há a impossibilidade total de ingestão de alimentos sólidos e necessidade de dieta enteral ou parenteral (FIGURA 2)[30,33,34].
Devido a agressividade, a MO pode limitar o tratamento oncológico, a nutrição e a qualidade de vida dos pacientes, restringindo a nutrição adequada, ingestão hídrica, fala, sono, gerando transtornos de ansiedade e muitas vezes interrupção do tratamento com internações e necessidade de suporte nutricional[13,36–38].
Manejo e Tratamento da Mucosite Oral
O tratamento da MO consiste no reforço da higiene bucal; controle dos sintomas dolorosos; da xerostomia que é caracterizada pela sensação de ressecamento anormal podendo ser por redução na produção do fluxo, e/ou qualidade da saliva; e tratamento das infecções oportunistas que são muito comumente associadas a esta manifestação oral. A xerostomia é um sintoma subjetivo de secura bucal, sensação de sede, podendo ser acompanhada de dor e dificuldade na alimentação e utilização de próteses dentárias[11,37,39–42].
Normalmente são indicados enxaguatórios que contém anestésicos locais, antissépticos (digluconato de clorexidina), soro fisiológico com essas associações, glutamina, sucralfato, mas nem todos com dados suficientes para serem recomendados. Algumas substâncias como o cloridrato de benzidamida, (anti-inflamatório não esteroidal) possui evidência clínica 1 e 2, segundo as normas de orientação clínica da Multinational Association of Supportive Care in Cancer and International Society of Oral Oncology (MASCC/ISOO) para o tratamento da mucosite oral, como um dos fármacos recomendados que possui eficácia na sua prevenção e tratamento[42,43].
O enxaguatório bucal com sulfato morfina 0,2% tópico é sugerido para o alívio da dor associada à MO em pacientes com câncer que recebem radioterapia e quimioterapia[9,37,42]. Alguns autores sugerem doses maiores, como 1,0%, 2,0% e a 5.0% na composição do enxaguatório com sulfato de morfina relacionado à gravidade da MO, proporcionando alívio significativo da dor local[44].
A crioterapia oral, definida como o resfriamento da cavidade oral com gelo, água gelada, sorvete ou picolés, pode reduzir a incidência de MO em pacientes submetidos a quimioterapia, por provocar a vasoconstrição periférica dos vasos sanguíneos impedindo que as drogas quimioterápicas afetem as células epiteliais. Recomenda-se 30 minutos de crioterapia em infusões com 5-fluorouracil (5-FU), em transplantes de células tronco hematopoiéticas (TCTH) autólogo, e quando submetidos a altas doses de melfalano[42,45–47].
A MASCC/ISOO (Multinational Association of Supportive Care in Cancer and International Society of Oral Oncology) atualiza periodicamente os protocolos com recomendações para prevenção e tratamento da MO, e estes sugerem que os cuidados básicos de higiene oral devem ser reforçados aos pacientes em tratamento oncológico. As diretrizes atualizadas sugerem fortemente que os cuidados básicos de higiene oral devem ser reforçados aos pacientes em tratamento oncológico, pois a precária higiene oral, pode ser considerada um fator crítico para o desenvolvimento da MO[12,48]. A higiene bucal contribui na redução da gravidade da MO, bem como infecções do trato respiratório e possui impacto positivo na qualidade de vida dos pacientes uma vez que pode reduzir a disgeusia permitindo o reforço e prazer na alimentação e possui impacto positivo na qualidade de vida dos pacientes já que pode reduzir a disgeusia (sentido de paladar alterado ou prejudicado) permitindo o prazer na alimentação[36,49].
Até o momento, não há um protocolo definido para a orientação de higiene oral, por ser uma indicação individualizada. No entanto, nos últimos anos, as diretrizes deixaram de indicar a clorexidina (antisséptico químico, antifúngico e bactericida) para prevenção da MO, por ser agressivo aos tecidos orais nos casos de mucosite. A indicação da clorexidina se mantém claramente quando indicada para outras infecções orais, como doença periodontal[11,49].
Outras sugestões de tratamento para MO podem minimizar a sintomatologia (dor, ardência, queimação, agravamento da disgeusia e xerostomia) tais como fator estimulador de colônias de granulócitos (G-CSF), água bicarbonatada, água fenicada a 2%, solução salina, glutamina, mas não há dados suficientes para prevenção da MO[3,7,11,22,29,31,36,41,44-46,50-52].
A laserterapia de baixa potência (LLLT) é uma das terapêuticas mais eficazes para a prevenção e tratamento de MO[53]. Devido a sua ação biomoduladora, bioquímica, promove rápida reparação tecidual após a ação citotóxica dos quimioterápicos e destruição celular pela radiação ionizante. A LLLT promove ação analgésica, anti-inflamatória (por atuar na síntese de prostaglandinas) e antiedematosa. Além disso, tem efeito cicatrizante atuando na reparação dos tecidos, através da proliferação de fibroblastos, revascularização, produção de colágeno e elastina, bem como ativação de macrófagos, linfócitos acelerando o processo cicatricial[8,9,30,33,42,50]. O MASCC/ISOO recomenda a utilização da laserterapia de baixa potência (LLLT) na prevenção da mucosite oral nos pacientes em tratamento antineoplásico[37].
A suplementação com sulfato de zinco também tem sido recomendada por organizações internacionais de normatização da conduta clínica para a MO. O zinco é um oligoelemento essencial para processos de reparação tecidual, além de possuir ação antioxidante. Geralmente é prescrito por via oral, com vistas a prevenção de MO nos pacientes submetidos à radioterapia de cabeça e pescoço[42,50,54].
O mel tem sido indicado como recurso terapêutico para a prevenção de MO em pacientes que realizam tratamento com radioterapia associada ou não a quimioterapia[42]. O mel tem propriedades antibacterianas auxiliando no reparo do epitélio oral, proporcionando redução de infecções orais e aumento do fluxo salivar estimulando o sistema gustativo, como relatam estudos de revisão sistemática e estudos XXXX (com nível 1 e 2 de evidência) que destacam a eficácia e segurança no seu uso na prevenção e tratamento da MO[39,55,56].
Sintomas como xerostomia, disgeusia, candidíase devido a ação imunossupressora das drogas utilizadas, e infecções virais ou bacterianas podem ser minimizados com associação de higiene oral e utilização de fitoterápicos[36–38,48, 57].
Colutórios bucais à base de plantas foram eficazes em reduzir condições inflamatórias, e antimicrobianas próximos à clorexidina 0,12%, a depender da concentração e formulação apresentadas, contudo sem o efeito colateral associado aos colutórios com clorexidina[17,55,58].
A utilização de plantas medicinais e outros produtos de origem vegetal é uma das práticas complementares mais comumente utilizadas em pacientes oncológicos, e dentre uma considerável diversidade de plantas medicinais de uso odontológico, tais como: a babosa (Aloe vera L., Lamiaceae), a calêndula (Calendula officinalisL., Asteraceae), a malva (Malva L., Malvaceae), a cúrcuma (Curcuma longaL., Zingiberaceae), a casca de laranja doce (Citrus sinensis L., Rutaceae, ), o capim-limão (Cymbopogon citratus DC., Poaceae), entre outras, a camomila (Matricaria chamomilla L., Asteraceae) possui destaque por suas características fitoquímicas e princípios ativos[59–65].
No que concerne ao tratamento da MO, a camomila mostrou potencial preventivo e curativo sobre os efeitos colaterais induzidos pela quimioterapia, radioterapia e quimiorradioterapia[4,66].
A espécie vegetal camomila (Matricaria chamomilla L., Asteraceae)
A camomila é uma das plantas medicinais mais estudadas e citadas como medicinais em estudos qualitativos, sendo utilizada há séculos, incluída nas farmacopeias nacionais e internacionais, e possui efeitos promissores na prevenção e tratamento da MO[11,15–18].
A M. chamomilla L. pertence à família Asteraceae, tem como sinônimos encontrados na literatura, Chamomilla recutita L. Rauschert, Matricaria recutita L., Matricaria suaveolens L. (FFFB2)[63]. Dentre os nomes populares estão a camomila-comum, camomila vulgar, camomila legítima, camomila dos alemães, matricária, macela, maçanilha, chamomile (inglês), camomila branca, camomila, camomila azul (FIGURA 3)[67,68].
A camomila se distribui geograficamente no Norte Europeu, Europa Oriental, Ásia Ocidental, Mediterrâneo, Norte Africano, Estados Unidos da América, e pode ser cultivada em vários países, entre eles o Brasil[67].
Trata-se de uma planta herbácea, anual, aromática, com altura média de 30cm, caule subdividido e ereto, flores brilhantes de 1,5 cm de diâmetro. Possui sabor discretamente amargo e adocicado. As partes utilizadas da planta são as inflorescências, bem como toda a planta, que apresentam aroma agradável, adocicado e sabor ligeiramente amargo. Dentre as formulações farmacêuticas estão as infusões (extrato aquoso), extrato seco e solução hidroetanólica[60,67].
Apresenta-se como droga vegetal, extrato seco (cápsulas ou comprimidos padronizados em 1,2% de apigenina), óleo essencial, extrato fluido 1:1, infuso, tintura, e solução hidroetanólica a 45%[60,63,67].
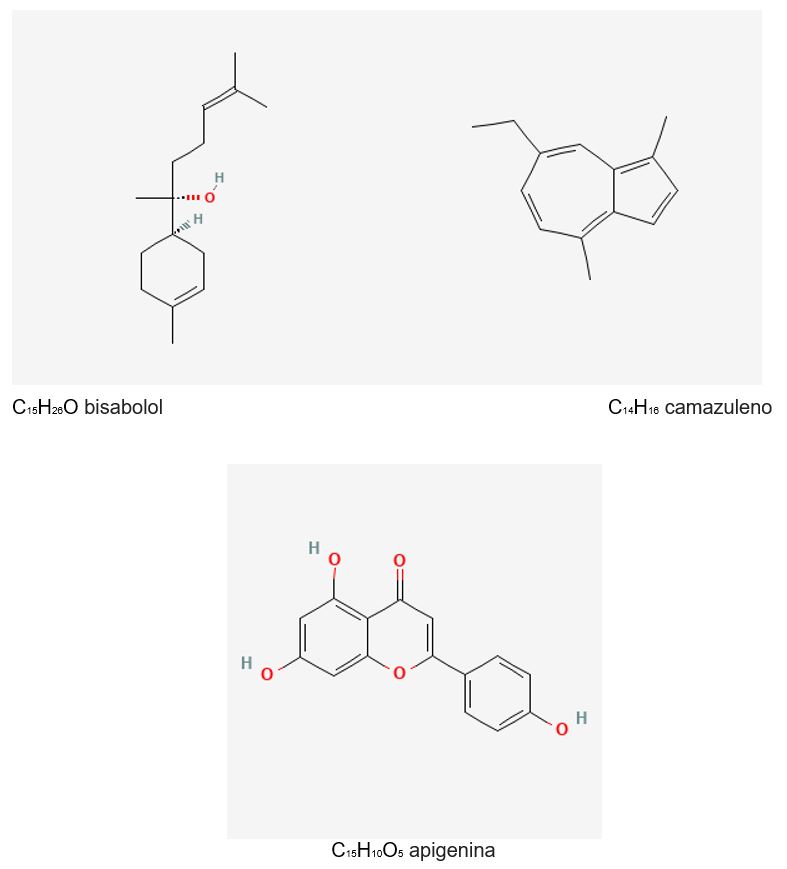
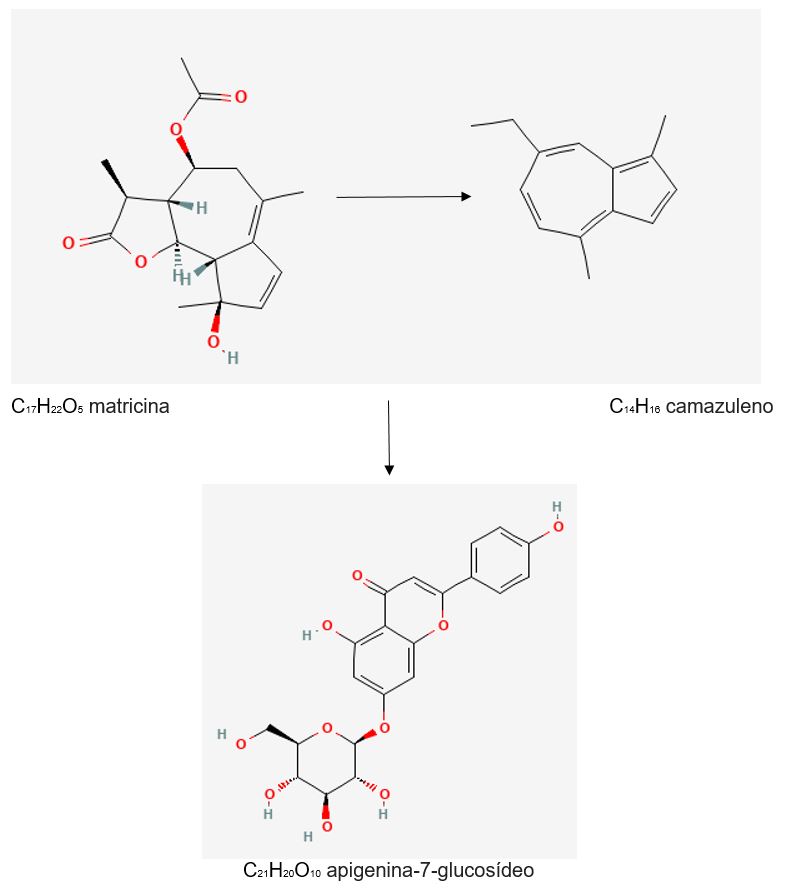
A camomila é rica em marcadores químicos, possuindo mais de 200 compostos químicos e metabólitos secundários como terpenoides, flavonoides, cumarina e alcaloides. Entre os compostos especiais e terapêuticos, tem-se a apigenina 7 glucosídeo, o α-bisabolol, os óxidos bisabolol A e B, sesquiterpenos, monoterpenos, alfa-camazuleno, espiroésteres, linalóis e cumarinas[25,34,60,63,67,69,70].

Fonte: Matricaria recutita, publicada em 1887, Franz Eugen Köhler, in Köhler's Medizinal-Pflanzen. Domínio público, retirado de Monteiro[61].
Atividade farmacológica e indicação terapêutica
A camomila é utilizada há séculos, uma das plantas mais citadas como medicinal em estudos qualitativos, nas farmacopeias e indicada para tratamento de doenças do trato gastrointestinal, dermatites, sedativa, distúrbios do sono, alterações dos sistemas circulatórios, urinários e nervosos, bem como as afecções da cavidade oral[60,62,68,71]. Esta planta medicinal possui ação antioxidante, antimicrobiana, anti-inflamatória, antitumoral, antiproliferativa, apoptótica, antitumoral, atividade de inibição da agregação plaquetária, entre outras, devido a presença do alfabisabolol, camazuleno, furfurale, quiterpenos e taninos[16,31,41,72].
Dentre os compostos químicos de destaque estão os flavonoides, dentre eles a apigenina se destaca pela comprovada ação anti-inflamatória e antitumoral in vitro e penetração na pele sob aplicação tópica. A apigenina age como quimioprotetor com comprovado efeito antioxidante, antimutagênico, antiviral, por regular todas as fases da carcinogênese[16,25,73-75].
Os sesquiterpenos bisabolanos oxidados são componentes presentes no óleo essencial representados pelo α-bisabolol, óxidos bisabolol A e B, também são associados à atividade anti-inflamatória. Estudos demonstram que o ácido carboxílico chamazuleno é um inibidor ativo da ciclooxigenase-2 (COX-2). E a matricina, outro composto químico presente na camomila inibe a expressão induzida por fator de necrose tumoral alfa (TNF-α)[66,69,76]. Além dos marcadores químicos já citados, possui outros componentes como os terpenos, linalol, limoneno, com diferentes atividades farmacológicas como antivirais, antibacterianos, anti-proliferativa, indução da apoptose de células neoplásicas, inibição da síntese de leucotrienos (chamazulenos) e reparação tecidual incluindo os tecidos da cavidade oral, e capazes de induzir a apoptose em células cancerosas[16,25,31,41,60,63,67,70,72,73,75]. A atividade anti-inflamatória seletiva para a COX-2 se dá pela ação do α-bisabolol, matricina e flavonoides. É sedativa com ação no sistema nervoso central com afinidade para o receptor benzodiazepínico central, destacando a ação neuroprotetora, anti-alérgica e anti tumoral. A ação antimicrobiana também é de responsabilidade do α-bisabolol); ação neuroprotetora; antialérgica; antitumoral[57,58,60,63,77].
Estudos têm investigado o uso da camomila no tratamento de úlceras aftosas menores, xerostomia, líquen plano, gengivite e candidíase oral. Resultados satisfatórios foram obtidos com o uso tópico do gel em orabase e soluções contendo apenas a camomila, ou em associação com outras plantas medicinais, para afecções orais[40,57,78,79].
A camomila (Matricaria chamomilla L.) tem sua efetividade comprovada como anti-inflamatória, cicatrizante e antimicrobiana em afecções da cavidade oral, com indicações na Odontologia. Devido aos seus componentes químicos, a camomila pode ser indicada como antifúngica, antioxidante, ansiolítica, anti-inflamatória em gengivites, estomaties, aftoses, bem como analgésica sendo segura para utilização nas erupções dentárias. As formas farmacêuticas mais utilizadas são os colutórios, pomadas, gel orabase, cremes e infusões. E ainda pode ser incorporada em formulações farmacêuticas em associações, tais como dentifrícios e enxaguatórios bucais[13,14,16-18,23-25,62,78].
No entanto, a utilização da camomila necessita ser realizada com cautela, pois parte da população faz uso de polifarmácia, e esta planta interage com anticoagulantes aumentando o risco de sangramento, e tendo potencial ação depressora do sistema nervoso central quando administrada em conjunto aos barbitúricos e outros sedativos. Também foram descritas interações farmacológicas com varfarina, estatinas e contraceptivos orais[60,71].
É de importância saber que a forma de cultivo e colheita da camomila interferem diretamente na obtenção dos melhores teores de óleo essencial, na sua qualidade, e compostos químicos presentes na planta[73].
Material e Método
Trata-se de uma revisão Integrativa não exaustiva da literatura, conforme o proposto por Whittemore e Knafl[80], em que a pesquisa na literatura foi realizada com o intuito de selecionar artigos que respondesse a seguinte pergunta: "Qual o potencial preventivo e terapêutico da camomila no manejo da mucosite oral?".
A busca dos artigos e trabalhos, do período de janeiro de 2010 a dezembro de 2021, foi realizada: no portal PubMed, que engloba o MEDLINE, quatro bibliotecas digitais (BVS/Lilacs, Cochrane SciELO, Web of Science) e um portal de periódicos (Portal de Periódicos da FIOCRUZ, especificamente a Revista Fitos), complementado pela busca manual nas citações dos estudos primários identificados quando necessário, nos idiomas português e inglês. Os descritores (DeCS) utilizados foram: matricaria (chamomilla OR recutita) OR (camomila OR camomile) AND (stomatitis OR mucositis) com caracteres booleanos AND e OR.
Critérios de Inclusão e Exclusão
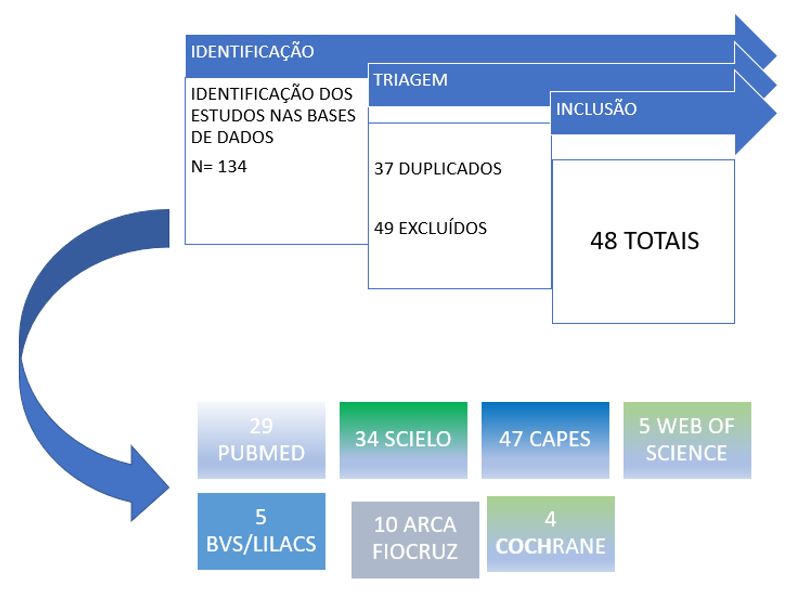
Foram incluídos artigos originais e secundários com textos completos e com descrição metodológica disponível de avaliação qualitativa ou quantitativa, estudo pré-clínicos, clínico e revisões, com acesso aberto nas bases científicas pesquisadas e com temática sobre a atividade farmacológica ou terapêutica da camomila e o seu uso na prevenção e/ou tratamento da mucosite oral. Foram excluídos os artigos com conteúdo diferente do proposto, duplicados e artigos incompletos (FIGURA 4).
Coleta de Dados
Os dados extraídos por um examinador e categorizados em uma tabela contendo as informações sobre autores, base de dados, ano de publicação, nível de evidência, compostos isolados, voucher, forma de apresentação e resultados encontrados. Caso algum estudo tenha sido publicado em diversas fontes, foi utilizado a de data mais recente.
Níveis da evidência, categorias e sistematização dos dados
Todos os artigos que descreviam alguma ação farmacológica atribuída à camomila foram anotados, bem como a ação terapêutica no manejo da mucosite oral foi agrupada nos resultados em tabelas. Esta informação foi importante para que se possa verificar alguma possível correlação entre a forma de apresentação e a eficácia do produto.
Ademais, outra informação que deve ser considerada foram os níveis de evidência dos artigos selecionados. Esse dado é importante para embasar o uso da planta medicinal estudada, e sugerir o protocolo de manejo na mucosite oral.
Os dados foram analisados e agrupados em um quadro para diferenciar os estudos em pré-clínicos, clínicos e revisões sistemáticas e de literatura. Além disso, para a construção do trabalho foi necessário acessar obras de referência sobre oncologia, câncer, mucosite oral, cuidados paliativos, fitoterapia, farmacologia, camomila, laserterapia e políticas públicas, como as legislações pertinentes ao assunto. Concomitante a isto, foram utilizados os guidelines e dados estatísticos do Instituto Nacional do Câncer José de Alencar (INCA), da Multinational Association of Supportive Care in Cancer (MASCC/ISOO) - study group for oral mucositis, da European Society for Medical Oncology (ESMO).
Após a categorização dos artigos primeiramente por resultados, forma de apresentação, e evidência, um ou mais produtos serão sugeridos de modo a aumentar as opções de uso da camomila no manejo da mucosite oral. Também será sugerido a forma de uso, posologia, e associação terapêutica com outras práticas clínicas.
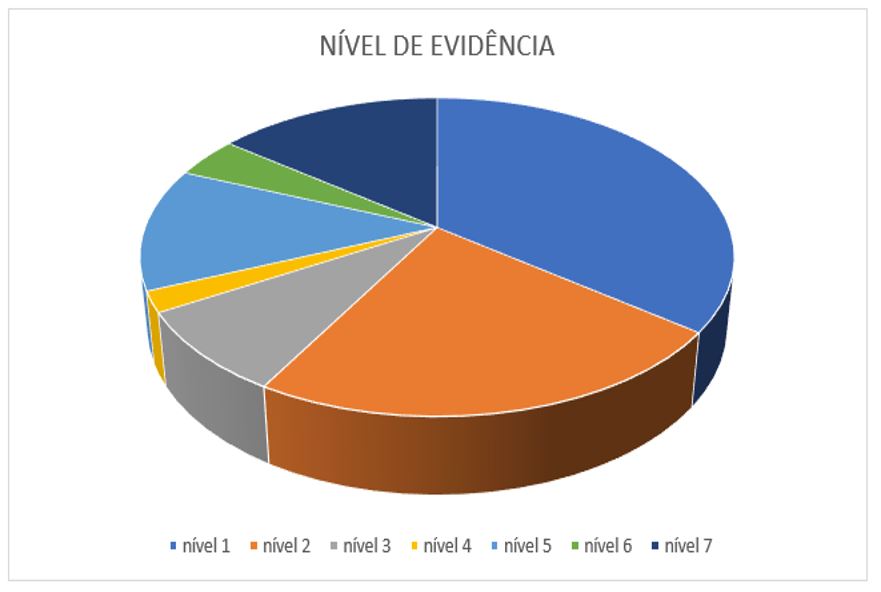
O nível de evidência dos estudos selecionados de acordo com os critérios de inclusão foi baseado principalmente no artigo publicado por Galvão na revista ACTA Paulista de Enfermagem em 2006[81,82].
Foram revisados e incluídos 48 estudos os quais a Matricaria chamomilla L. e suas sinonímias fossem o tema central, incluídos o manejo da mucosite oral ou citassem esta afecção oral. Os artigos foram incluídos nas tabelas que se seguem a fim de categorizar os níveis de evidência na literatura, as formas de apresentação da camomila utilizada ou associação com esta, a caracterização fitoquímica, terapêutica e farmacológica, número de Voucher ou registro da planta medicinal, e os resultados obtidos. E, finalmente, foi proposto um protocolo para manejo da mucosite oral em pacientes oncológicos sob quimioterapia e radioterapia, com produtos à base de camomila, e outras terapias complementares como a laserterapia e protocolos de higiene oral.
Resultados e Discussão
Os resultados obtidos estão elencados no QUADRO 1. Foram compilados os dados referente ao nome do autor, ano de publicação do estudo, tipo de pesquisa e nível de evidência relacionado, número de registro da planta medicinal, os principais componentes fitoquímicos, a principal ação farmacológica mencionada no estudo, o produto ou forma farmacêutica do estudo, as associações farmacêuticas ou comparações, e o principal resultado terapêutico subdividido em: antitumoral, intensidade ou severidade da MO, incidência ou capacidade de prevenção, ou ainda de ocorrência de MO, analgesia, redução de sangramento ou capacidade de hemostasia.
Dentre os 48 artigos incluídos neste estudo (QUADRO 1), observa-se que 13 destes (27,0%) são de estudos clínicos randomizados e 12 (25%) são revisões sistemáticas, o que abrange a maior parte dos artigos selecionados. O quadro ainda possui no seu elenco duas revisões sistemáticas com metanálise (4,1%), seis revisões de literatura (12,5%), uma revisão integrativa (2,0%), seis estudos clínicos (12,5%), cinco estudos pré-clínicos (10,4%), dois estudos in vitro (4,1%), e um relato de caso (2,0%).
De todos os estudos incluídos este trabalho (QUADRO 1), apenas quatro (8,3%) possuíam o número de registro (voucher) de material testemunho em herbário da Matricaria chamomilla L., podendo resultar em viés em relação as pesquisas clínicas, tendo visto que não houve padronização da identidade da planta medicinal, além de ser uma limitação para os estudos.
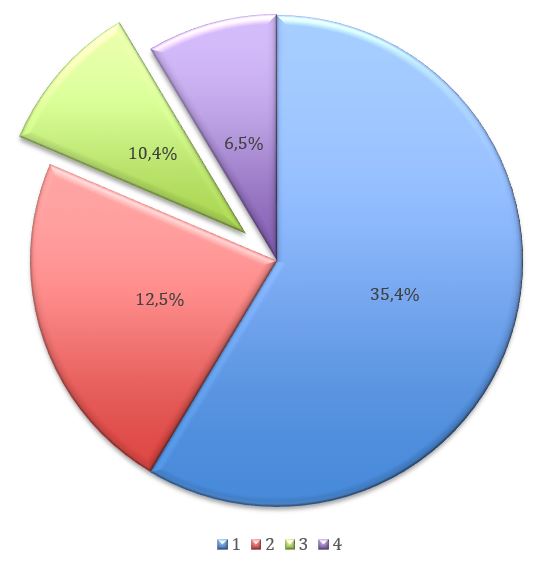
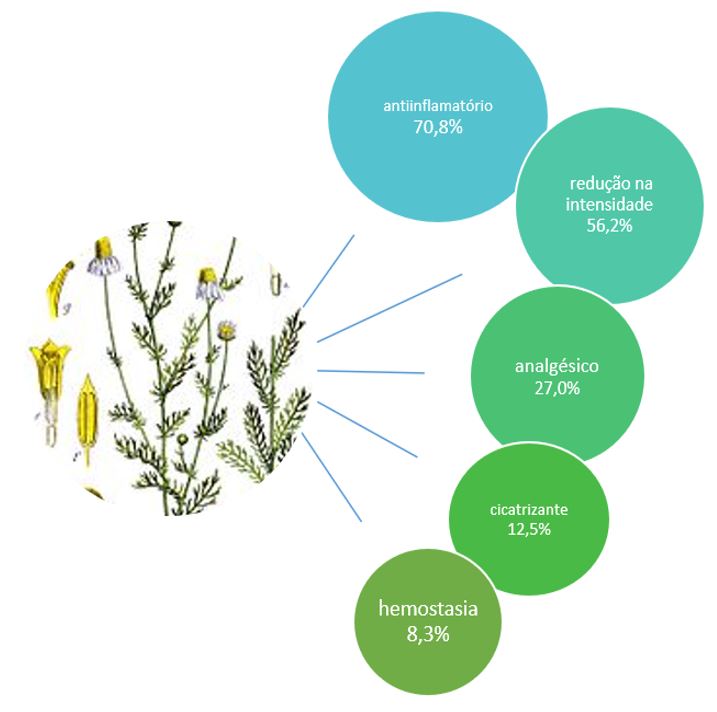
O componente químico mais destacado e citado entre os estudos incluídos (QUADRO 1, GRÁFICO 1) foram o camazuleno (18,7%), o alpha-bisabolol (22,9%), a apigenina (12,5%) e a matricina (12,5%). E a ação farmacológica mais comprovada e citada dentre os 48 artigos foi a ação anti-inflamatória da Matricaria chamomilla L. com 70,8% do total.
No que diz respeito a forma farmacêutica mais utilizada (QUADRO 1, GRÁFICO 2), o extrato hidroalcóolico foi o mais utilizado nos estudos e revisões com 35,4 %, seguido do gel com 12,5%, infusão com 10,4%, pomada e tintura-mãe ambos com 6,2%. Dois trabalhos mencionaram a utilização de enxaguatório[4,1], porém, não ficou claro de que se tratava de um extrato ou solução aquosa ou hidroalcoólica. Muitos estudos selecionados neste trabalho utilizaram produto farmacêutico industrial, ao todo foram 17 produtos (35,4%).
O resultado terapêutico (QUADRO 1, GRÁFICO 3) mais relevante foi a capacidade da Matricaria chamomilla L. de reduzir a intensidade ou severidade das lesões de MO com 56,2% das amostras, seguido do potencial analgésico com 27,0%. A incidência ou capacidade de prevenir a ocorrência de MO foi pouco demonstrada nos trabalhos com 14,5%, sugerindo que a utilização de produtos com camomila não reduz significativamente o surgimento desta manifestação bucal.
| AUTOR | ANO | TIPO DE ESTUDO E EVIDÊNCIA | VOUCHER | PRINCIPAIS COMPONENTES QUÍMICOS | AÇÃO FARMACOLÓGICA | PRODUTO | ASSOCIAÇÕES | RESULTADO TERAPÊUTICO |
|---|---|---|---|---|---|---|---|---|
| Al‐Dabbagh et al. | 2019 | EPC 7 | NI | polifenóis gálicos ácidos (GAE) | Anti-inflamatório | extrato etanólico | - | Anti mutagênico Anti tumoral |
| Almeida et al. | 2020 | RS 1 | NI | Anti-inflamatória | enxaguatório | Calendula Officinalis e Aloe Vera |
Redução na intensidade | |
| Aghamohammadi; Hosseinimehr | 2016 | RS 1 | NI | camazuleno | Anti-inflamatória Antiespasmódica Bactericida Sedativa |
enxaguatório | Outras plantas e mel | Reepitelização/ cicatrizante |
| Ardakani et al. | 2016 | ECR 2 | NI | α-bisabolol | Anti-inflamatória | extrato hidroalcóolico | Mentha piperita | Redução na intensidade Não reduziu incidência |
| Barreto et al. | 2020 | ECR 2 | NI | - | Anti-inflamatória antimicrobiano |
infusão não padronizada | - | Não reduziu incidência |
| Batista et al. | 2014 | ECR 2 | No. 35867. | α-bisabolol matricina camazuleno |
Anti-inflamatório | Extrato hidroalcoólico | Pomegranate (Punica granatum L.) | Redução do sangramento (hemostasia) |
| Braga A et al. | 2020 | ECR 2 | USP30- NF2527 |
apigenina-7-glicosídeo (0,108 mg) | - | extrato 1% | - | Redução na intensidade duração |
| Braga F et al. | 2015 | EC 2 | HRCB59831 >UNBA6034 |
apigenina-7-glucosídeo | Antimicrobiano | 0.5%, 1%, or 2% w/w liquid extract | - | Redução na incidência Intensidade Duração |
| Buentzel et al. | 2020 | RS 1 | NI | - | - | - | Salvia ofcinalis L. Calendula ofcinalis L. Thymus spp. | Analgesia |
| Dantas et al. | 2021 | RS 1 | NI | - | Anti-inflamatório | - | Reduziu intensidade | |
| Dantas; Lucena; Lima | 2020 | RS 1 | NI | - | Anti-inflamatório | - | - | Analgesia |
| Elhadad et al. | 2020 | ECR 2 | MR002 | camazuleno óxidos de bisabolol óxidos de α-bisabolol espiroésteres flavonóides |
Anti-inflamatório analgésico cicatrizante | extrato e gel (ambos a 3%) |
Miconazol oral gel | Analgesia |
| Eubank et al. | 2021 | RS 1 | NI | - | Analgésico Anti-inflamatório |
extratos de camomila (0,5 a 1%) versus *SAMITAL® *MUCOSYTE *MucotrolTM *QRLYD (produtos vegetais) |
Isatis indigotica Olea europaea Calendula Officinalis A. digitatae M. sylvestris |
Analgesia Redução da intensidade Redução da incidência |
| Fleming et al., | 2015 | EV 7 | NI | matricina camazuleno proazuleno |
Inibição do TNF-α pela matricina | extrato óleo essencial |
- | Anti-inflamatório |
| Giafferis et al. | 2017 | RL 5 | NI | - | Anti-inflamatório | OnCare Enxaguatório Bucal Hidratante® (Oncosmetic) |
Foeniculum vulgare Melaleuca alternifólia Malva sylvestris L. Calendula Officinalis |
Redução da intensidade Analgesia Redução da xerostomia |
| Goes et al. | 2016 | ECR 2 | NI | terpenóides camazuleno sesquiterpenos apigenina |
Anti-inflamatória Antimicrobiana |
extrato padronizado 1% (Nº do lote PROD 004257) | Clorexidina 0,12% |
Redução do sangramento - hemostasia |
| Gomes et al. | 2018 | RL 5 | NI | - | Anti-inflamatório | infusão pomada extrato hidroalcóolico |
- | Redução da Incidência Intensidade Analgesia |
| Holmes et al. | 2013 | EC 3 | NI | azuleno matricina α-bisabolol |
Anti-inflamatório | gel de camomila a 3% (Dilecta Compounding Pharmacy) |
Gel de gluconato de clorexidina a 1% (Dilecta© Compounding Pharmacy) |
Redução da Intensidade Analgesia |
| Khayyal et al. | 2019 | EPC 7 | NI | matricina apigenina‐7‐ o‐glucosídeo bisabolol oxido de α‐bisabolol |
Anti-inflamatória Antioxidante |
extrato (Farmacopéia Européia) | - | Analgesia Redução da Intensidade |
| Kato et al. | 2016 | EC 3 | NI | azuleno | Anti-inflamatório | Azunol gargle liquid 4% mouthwash (Nippon ShinyakuC., Ltd., Kyoto,Japa) |
- | Redução da Intensidade |
| Lins R et al. | 2013 | EC 3 | - | azuleno, matricina α-bisabolol |
Anti-inflamatório | extratos hidroalcóolicos (Farmacopéia Brasileira) | Schinus terebinthifolius (aroeira vermelha) Digluconato de clorexidina à 0,12% |
Redução do sangramento/ Hemostasia Redução na intensidade |
| Machado et al. | 2016 | RS 1 | NI | - | Anti-inflamatória | Myracrodruon urundeuva (aroeia do cerrado) Própolis |
Redução da intensidade | |
| Machado PVM et al. | 2017 | RC 4 | NI | - | - | Ad-Muc cream (Chamomilla recutita extract) | Laserterapia | Redução da intensidade |
| Marmitt et al. | 2015 | RS 1 | NI | - | Anti-inflamatório | - | Aloe vera Uncaria tomentosa Schinus terebenthifolius (aroeira vermelha) |
Anti-inflamatório |
| Marucci et al. | 2016 | ECR 1 | NI | flavonoides ácidos fenólicos |
- | Solução aquosa Faringel -(Cadigroup-Italy) | Placebo | Ineficácia na incidência |
| Monteiro e Fraga | 2021 | RI 5 | NI | - | Anti-inflamatória Antiviral Antifúngico |
Gel orabase Extrato aquoso (5%) Tintura |
- | Cicatrizante Hemostasia Analgesia |
| Morais et al. | 2021 | RSm 1 | NI | - | Anti-inflamatório | Pomada Gel Extratos |
Pistacia atlantica | Redução da intensidade |
| Morales-Bozo et al. | 2016 | ECR 1 | NI | - | Anti-inflamatório | Infusão padronizada: camomila 1 g + linhaça 30 g | Linum usitatissimum |
Analgesia Redução na intensidade Redução da xerostomia |
| Oliveira et al. | 2016 | EPC 7 | NI | α-bisabolol | Antiapoptótico | ADMUC® | ONCILON® (triancinolona) | Cicatrização Redução na Intensidade |
| Pavesi et al. | 2010 | EPC 7 | NI | α-bisabolol camazuleno |
Antibactericida Antifúngico Anti-inflamatório |
ADMUC® | Betametasona Celestone® (elixir) | Redução na Incidência Redução na intensidade |
| Pequeno et al. | 2018 | EV 7 | NI | - | Antifúngico | M. recutita extract 100 mg/mL extract 200 mg/mL extract 300 mg/mL |
Chlorhexidine 0.12% Sterilized saline solution |
Anti-inflamatório |
| Reis et al. | 2016 | ECR 2 | NI | - | - | - | Infusão congelada (em cubos de gelo) | Redução na incidência |
| Salehi et al. | 2020 | RL 5 | NI | - | - | Extrato seco Extrato hidroalcóolico |
Aloe vera Curcumina Licopeno Camelia Sinensis |
Redução na intensidade |
| Sampaio et al. | 2014 | EC 3 | NI | - | Anti-inflamatório Antimicrobiano |
Gel de camomila | Clorexidina gel à 1% | Redução da intensidade NÃO reduziu incidência |
| Santos et al. | 2019 | RL 5 | NI | α-bisabolol camazuleno | Antimicrobiano Anti-inflamatório Antioxidante |
- | - | Anti-inflamatória |
| Schimdt et al. | 2019 | EPC 7 | NI | - | Anti-inflamatório Antitumoral (anti angiogênese – TGF-β1 Reepitelizante |
ADMUC® | MFC extrato de Curcuma longa L.) E placebo |
Cicatrização |
| Schönknecht et al. | 2021 | RL 5 | NI | - | Anti-inflamatório | Dentosept® (Polônia e Lituânia) Stomatofit ®(Rússia e Ucrânia) Dentosept A®(Polônia) Stomatofit A ®(Rússia e Ucrânia) | Casca de carvalho (Quercus spp.) Sage leaf (Salvia officinalis L.) Arnica (Arnica spp.) Rizoma de calamus (Acorus calamus L.) Hortelã (Mentha piperita L.) thyme herb (Thymus spp.) |
Cicatrizante Redução da Intensidade |
| Sencer | 2012 | ECR 2 | NI | - | Anti-inflamatório | Traumeel S Matricaria Chamomilla D 3 (German Homeopathic Pharmacopoeia) | placebo | Ineficiente |
| Seyyedi et al. | 2014 | ECR 1 | NI | - | Reepitelizante | TM (tintura mãe) | - | Redução na intensidade Cicatrização |
| Silva et al. | 2021 | RS 1 | NI | - | - | Pomada tintura Infusão |
- | Redução na incidência Redução na intensidade e duração |
| Silva KO et al. | 2016 | RL 6 | NI | - | Antifúngico Anti-inflamatório |
Tintura | Chá de sálvia (Salvia officinalis L.) Chá de Mirra (Commiphora myrrha) |
Analgesia |
| Souza CB et al. | 2019 | EC 6 | NI | apigenina, apigenina-7-O-glicosídeo α-bisabolol camazuleno |
Anti-inflamatório Antioxidante Antitumoral Antifúngico Antimicrobiano Antisséptico |
Infusão | - | Redução na intensidade Analgesia |
| Steinmann et al. | 2021 | RS 1 | NI | - | - | OraLife -enxaguatório bucal (camomila e associações) (AgainLife), Kamistad (camomila e associações) (STADA) |
Própolis Crioterapia |
Resultados inferiores aos da própolis e da crioterapia |
| Tadbir et al. | 2015 | ECR 2 | NI | - | Reepitelizante | Gel orabase (concentração NI) | Triancinolona | Ineficaz na redução da intensidade em comparação ao corticóide Analgesia |
| Valenzuela et al. | 2015 | ECR 2 | NI | α-bisabolol azuleno matricina camazuleno |
Anti-inflamatória Antioxidante |
Gel 2% | Placebo | Não houve diferença significativa em analgesia e cicatrização |
| Worthington et al. | 2011 | RS 1 | NI | - | Anti-inflamatório | - | - | Redução na intensidade Redução na incidência |
| Yarom et al. | 2020 | RS 1 | NI | - | Anti-inflamatório Antifúngico Antibacteriano |
- | - | Analgesia Redução da intensidade/severidade |
| Zhang et al. | 2020 | RSm 1 | NI | - | - | Extrato de camomila (bochechos) | Aloe vera Benzydamine Mel clorexidina Curcumina Lactobacillus Bicarbonato de sódio Placebo Povidone-iodine Sucralfato |
Superior na redução da intensidade/severidade dentre as substâncias comparadas |
| Legenda: Tipo de Estudo (RSm, revisão sistemática com metanálise; RS, revisão sistemática; RL, revisão da literatura; RI, revisão integrativa; ECR, estudo clínico randomizado; EC, estudo clínico; EPC, estudo pré-clínico; EV, estudo in vitro; RC, relato de caso); Nível da Evidência (de acordo com ACTA, 2006); NI, dado não informado. | ||||||||
Produtos e Formulações à base de Matricaria chamomilla L. para manejo da mucosite oral
O uso tópico da camomila para a prevenção e tratamento da MO possui muitos resultados similares, porém distintos no que se refere a forma farmacêutica, concentração e protocolo de uso. A maioria dos estudos preconiza as soluções aquosas ou hidroalcóolicas, em enxaguatórios para bochechos, porém ainda sem consenso quanto à forma de preparação, concentração, veículo utilizado e posologia[32,75,83].
As formas de preparação da camomila, ou disponíveis comercialmente, podem variar entre extratos aquosos à óleos essenciais, assim como a espécie pode apresentar diferença nos quimiotipos alemão e romana[84,85].
As evidências de estudos clínicos indicam que o extrato aquoso da camomila inibe a produção de interleucina e da cicloxigenase (glicoproteína que apresenta duas isoformas: COX-1 que é responsável pela função fisiológica constitutiva; e, COX-2 que é estimulada e ativada em processos inflamatórios. Farmacologicamente quando inibidas, há redução da inflamação e da dor) responsáveis pelos processos inflamatórios causados pela toxicidade dos quimioterápicos[10]. Desta forma, comprovando a menor incidência, intensidade e duração da mucosite, bem como a reparação das úlceras tiveram melhores resultados quando comparados com uso tópico de corticóides[13,45,86].
Um estudo clínico randomizado com 40 pacientes sob tratamento quimioterápico e submetidos a transplante de células-tronco hematopoéticas (TCTH) alogênico, maioria composta de homens com diagnóstico de anemia aplásica grave, leucemia mieloide aguda e leucemia linfocítica aguda, utilizaram concentrações de extrato líquido de 0,5%, 1% e 2% com flores desidratadas da camomila, e indicação controlada de bochechos. O grupo controle que utilizou os bochechos com concentração de 1% (0,108 mg de apigenina-7-glicosídeo por mililitro de produto) teve resultados na redução de incidência e duração da MO quando comparados aos outros grupos estudados[10].
Estudo semelhante em 60 pacientes transplantados, sem diferenças significativas entre sexo, idade e tipo de transplante (autólogo e alogênico) e malignidade (linfoma, leucemia e mieloma múltiplo) receberam a indicação de bochechos de solução etanólica associando o óleo essencial de hortelã-pimenta à 1% e ao extrato seco da camomila à 1% preparados em etanol à 96º. Os resultados demonstraram redução na severidade, dor e solicitação de outras medicações no grupo tratamento[31].
O gel de camomila a 3% demonstrou em um estudo clínico recente, a capacidade de reduzir a gravidade da mucosite com escores de dor mais baixos em comparação com os outros dois grupos controles tratados com miconazol gel e com os protocolos convencionais. Este produto foi produzido com consistência muco-adesiva a partir do extrato de uma camomila identificada com depósito de espécime testemunho (Voucher) em laboratório de farmacognosia na Universidade de Alexandria, Egito. A camomila foi capaz de reduzir o dano tecidual sendo bem tolerada pelos pacientes sem sinais de toxicidade[87,88].
Tadbir e colaboradores[89] realizaram um estudo clínico randomizado em que foi utilizado a triancinolona (a triancinolona acetonida é um corticosteroide sintético de uso tópico) e a camomila em formulação de orabase, porém, sem citar o perfil fitoquímico e a concentração dos componentes secundários presentes na formulação. Os resultados do grupo que utilizou a camomila em orabase foram superiores quanto à resolutividade quando comparados com o que utilizou a triancinolona em orabase, bem como o do grupo controle. Em relação a analgesia, a camomila em gel teve resultado satisfatório na redução da dor e na satisfação do uso pelos pacientes.
Outro estudo comparou o uso do gel de camomila a 2% ao placebo, também em gel, concluindo que o produto o primeiro, apesar de bem tolerado, produziu resultados semelhantes ao produto placebo[90].
Dentre os estudos relacionados neste presente trabalho, alguns pesquisadores optaram pela utilização de fórmulas farmacêuticas industrializadas. Marucci e colaboradores[84] promoveram um estudo com uma solução aquosa comercializada como Faringel® (Cadigroup, Italy), um composto fitoterápico que incluía a camomila, calêndula, babosae própolis. O grupo placebo recebeu uma solução semelhante em cor, sabor e densidade produzida pelo mesmo laboratório. Os pacientes tinham diagnóstico de câncer de cabeça e pescoço, e ambos os grupos foram instruídos a bochechar a solução aquosa (7 mL do produto, quatro vezes ao dia) antes de cada refeição principal e sessão de radioterapia ou três vezes ao dia nos fins de semana em que não havia incidência de radiação ionizante. O resultado obtido foi de ineficácia na prevenção da MO, e todos os pacientes desenvolveram no mínimo mucosite grau 3. Corroborando com outro autor com trabalho similar, em que conclui que o gel à 3% utilizado em pacientes que receberam radioterapia na região de cabeça e pescoço, não foi eficaz em prevenir o surgimento de MO, porém promoveu redução da severidade na maioria dos pacientes[91].
O Ad-Muc® é um medicamento fitoterápico utilizado em alguns estudos pré-clínicos, o qual mostrou benefícios no aumento da proliferação e migração epitelial reduzindo a inflamação das lesões. Em um grama de pomada é encontrado 100 mg de extrato fluido de Chamomilla recutita que equivale a 0,30 mg de apigenina-7-O glicosídeo (Ad-Muc®)[92].
Ainda sobre os produtos industrializados com camomila, associados a outras plantas medicinais, um complexo homeopático de nome Traumeel S.®, foi utilizado num estudo multicêntrico americano, em que se avaliou o seu uso tradicional como anti-inflamatório há 50 anos, no tratamento da MO[93]. O Traumeel S.® é composto de 14 plantas e minerais em baixas concentrações, diluições homeopáticas, e entres estas, a M. chamomilla se faz presente. Não houve efeito benéfico do Traumeel S.® na mucosite induzida por quimioterapia em comparação ao placebo, sem vantagens estatísticas nos escores de MO[94].
Eubank e colaboradores[85] realizaram um estudo com um medicamento fitoterápico composto por sorbitol, magnésio estearato, babosa (Aloe vera sp.), centelha (Centella asiatica (L.) Urb., Apiaceae) e extrato de glicirrizina, chamado Mucotrol TM® (Belker Pharmaceuticals, Geo Pharma, USA), o qual promoveu redução do grau de MO apresentada em pacientes submetidos a quimioterapia. No entanto, não houve diferença significativa para os pacientes submetidos à radiação ionizante.
Outros medicamentos fitoterápicos disponíveis em outros países, como formulações para bochechos, o QRLYD (Puji Pharmacy, Shaanxi, China), o SAMITAL® (Indena SpA, Milão), o Mucosyte (BIOPHARM, Milão, Itália), Azunol® (Nippon Shinyaku Co., Ltd Kyoto, Japan), e Oncare® (Oncosmetic), promoveram uma redução no grau de mucosite e melhor controle da dor[40,85,94,95].
A tintura de camomila é uma das formas farmacêuticas de maior aplicabilidade, apresentando potencial anti-inflamatório, antiespasmódico, antibacteriano, antifúngico e efeitos analgésicos, podendo ser administrado para uso interno ou externo em preparações para bochechos e gargarejos orais, em afecções da mucosa oral e faringe[60].
Dentre as evidências analisadas, a infusão das flores da camomila, é a forma farmacêutica mais recomendadas para o acesso ao usuário do Sistema Único de Saúde (SUS), sendo de fácil acesso e preparo, geralmente para uso tópico e com poucos efeitos adversos. No entanto, faz-se necessária conhecer a origem da planta, forma de cultivo, e orientar sobre o correto preparo e posologia adequados. O ideal seria uma droga vegetal padronizada, com coleta adequada segundo as normas técnicas, bem armazenada e fornecida pelas Farmácias Vivas do SUS[69,96–98].
No que concerne as formas farmacêuticas, os extratos hidroalcóolicos à base de camomila foram os mais utilizados em bochechos, e comprovaram serem eficazes na reepitalização do tecido bucal, de fácil utilização e aceitação por parte do paciente. Seguido da forma farmacêutica em gel orabase, que também apresentou resultados promissores para o tratamento da MO. Estas formas farmacêuticas (GRÁFICO 2) podem ser preparadas através de manipulações extemporâneas, caseiras, ou ainda como medicamento fitoterápico[40,63,83,87].
Componentes especiais e potencial terapêutico da camomila
A camomila (M. recutita L.) contém flavonoides, cumarinas e óleos essenciais com propriedades antissépticas, efeito carminativo, sedativo e protetor contra úlceras mucosas[23,75,99].
Dentre as propriedades terapêuticas da M. chamomilla, a ação anti-inflamatória é uma das mais citadas e comprovadas em estudos clínicos e pré-clínicos apresentados neste trabalho, e se dá principalmente pela presença de flavonoides, especialmente apigenina-7-glicosídeo[10,70,100].
Esses dados podem ser confirmados com o estudo de Curra et al.[101], em que os níveis de pró-inflamatórios de citocinas IL-1β e TNF-α reduziram significativamente no grupo em que houve o uso tópico de 100 mg de extrato de camomila. Os constituintes bioativos mais conhecidos da camomila incluem a apigenina, luteolina, quercetina, α-bisabolol, óxidos de α-bisabolol A e B e matricina (geralmente convertida em camazuleno) apresentando propriedades antimicrobianas (FIGURAS 5 e 6)[25,58,102].
Estudos in vitro possuem resultados significativos no tratamento da MO comprovando redução anti-inflamatória nos tecidos estudados, tanto com a utilização de fórmulas padronizadas como industrializadas. A presença de α-bisabolol e camazuleno, em extratos padronizados, entre 2 e 4%, de acordo com as farmacopeias europeias, demonstraram redução de células apoptóticas em estudos histopatológicos, restaurando tecidos lesionados[103].
Outro estudo realizou experimentos com placas de espécimes bacterianos orais e testaram o extrato de camomila a 20 mg/ml comprovando ação antimicrobiana[58].
A camomila apresenta potencial terapêutico no combate ao câncer, pela presença de flavonoides cujas propriedades antioxidantes favorecem a atividade antimutagênica comprovada em outro estudo in vitro por Al-Dabbagh e colaboradores[70].
No que diz respeito às reações adversas, as lactonas presentes nas flores, podem ser responsáveis por reações alérgicas em preparações contendo camomila[60]. Um estudo detectou a presença de um composto químico denominado polyacetylene tonghaosu presente no óleo essencial de camomila. Este estudo sugere precauções nas aplicações tópicas indicadas para radiodermites, e estendidas as mucosites na cavidade oral[74].
O óleo essencial de camomila demonstrou efeitos antimicrobianos em bactérias gram-negativas, fungos e vírus, comprovado por um dos seus principais componentes, a cumarina, um dos flavonoides com ação na prevenção de mucosites[4,73-75].
A forma de aplicação, manuseio da planta, local de cultivo e coleta, pode interferir nas composições fitoquímicas tornando inseguro o direcionamento de um protocolo de uso embasado em eficácia e evidências[16,104,105].
Protocolos terapêuticos para o manejo da mucosite oral utilizando produtos à base de camomila
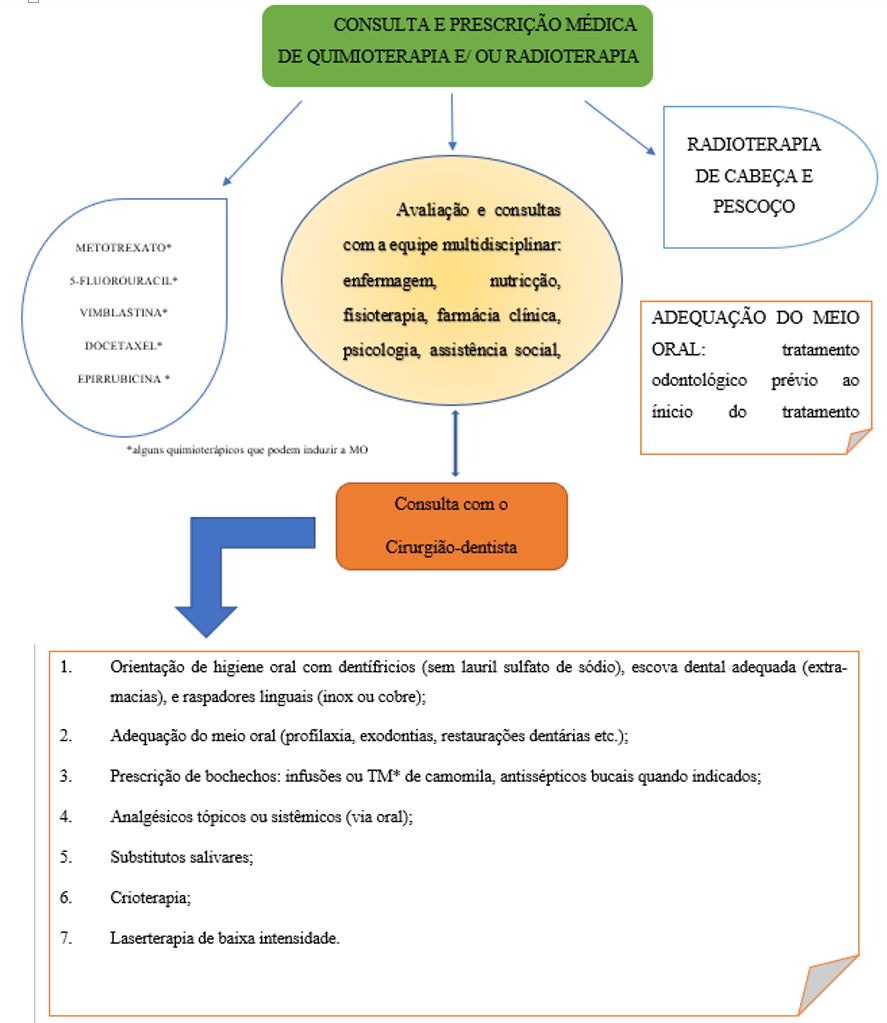
Têm sido demonstrados que a camomila pode reduzir o surgimento e a severidade da MO. As propriedades anti-inflamatórias e o potencial cicatrizante da camomila proporcionam analgesia, efeito calmante e redução da disgeusia na mucosa bucal. Além disso, a atividade antisséptica e antimicrobiana pode prevenir infecções secundárias que agravam a MO[106-108].
Consequentemente, o uso da camomila como planta medicinal, possibilita a redução do uso de outros medicamentos, como a nistatina suspensão oral (100.000 UI/ml), comumente utilizada para tratamento de lesões oportunistas fúngicas sob a forma de bochechos prescritos de 8 em 8 horas por 14 dias sendo mantida por três minutos na boca e, posteriormente, engolida ou não, de acordo com a orientação médica ou do cirurgião-dentista[14,24,31].
A camomila possui ação antioxidante reduzindo, ou até mesmo prevenindo, o surgimento de lesões ulceradas como protetora das células epiteliais, e consequentemente ação analgésica[75,99].
Barreto e colaboradores[109] realizaram um estudo, o qual foi prescrito aos pacientes do grupo-caso a utilização de bochechos com chá de camomila refrigerados, quatro vezes ao dia por um minuto, sem deglutição. Porém, não foi informada a marca ou origem da camomila, a forma de apresentação, se extrato seco ou sachês, seguindo apenas a orientação do fabricante do produto de escolha do paciente, com orientação para manter o chá refrigerado de 15 a 17ºC (Celsius). Mesmo associando a rigorosa higiene oral, não houve diferença significativa entre o grupo estudado e o grupo controle, resultando em dados insuficientes para a prevenção de MO.
Lopes e colaboradores[43] também ressaltaram que a falta de evidência clínica e uma diretriz para indicação de bochechos com algumas ervas medicinais no tratamento da MO, dentre elas a camomila, e portanto, não realizam a indicação das mesmas aos pacientes.
As propriedades anti-inflamatórias das inflorescências de camomila podem contribuir em conjunto aos efeitos da crioterapia sugeridas nos estudos clínicos[45]. Neste estudo particular, foi preconizado a associação de infusão com 10 gramas de inflorescências de camomila em 400 mililitro de água, armazenadas então para congelamento em forma de cubos, e os pacientes foram orientados a utilizarem sobre a mucosa oral, cinco minutos antes de iniciar a infusão com 5-FU, dando continuidade por mais vinte e cinco minutos, completando trinta minutos totais de aplicação.
Ardakani e colaboradores[31] realizaram um estudo clínico randomizado duplo cego, comparando dois grupos, um tratado e outro placebo. O grupo tratado utilizou um enxaguatório obtido das partes aéreas da camomilaà 1% de extrato seco, associada com 1% de óleo de hortelã-pimenta e 99% de etanol a 96o Celsius. O grupo placebo recebeu um enxaguatório bucal semelhante em sabor, cheiro e cor. Ambos os grupos foram indicados a usar 1 mL da solução diluída em 50 mL de água pré fervida (a partir de 97º Celsius) e realização de bochechos, três vezes ao dia, por 30 segundos. E similar ao estudo anteriormente citado, o resultado foi de redução no surgimento de lesões e sintomatologia dos pacientes estudados[31].
A tintura de camomila tem diversas indicações de uso, interno, via oral, como antiespasmódico, por exemplo, ou em aplicações tópicas, como enxaguatório bucal, diluído em água, para afecções orais, lesões aftosas e ardência bucal[17,109].
As concentrações para o preparo das infusões podem variar (de 6-9 g em 150 mL ou 30-100 g em 1000 mL) de 6 a 10 porcento gramas de inflorescências secas, e de 400 a 1000 ml de água. A infusão pode ser usada como enxaguatório bucal ou como crioterapia, congelado em formato de picolé ou cubos que possam ser aplicados na cavidade oral. Além das tinturas incorporadas em formulações extemporâneas como gel em orabase ou creme-gel para a pele[45,60,106,107].
Os experimentos podem divergir quanto à forma de uso da camomila. Alguns pesquisadores indicaram a diluição de 30 gotas da tintura (manipulada) em 100 mL de água, para bochecho três vezes ao dia por 14 dias com início no primeiro dia do ciclo de quimioterapia com 5-fu (fluorouracil). Outros, orientaram a aplicação da infusão preparada com 10 gramas das flores desidratadas em 400 mL de água e ofertada em cubos de gelo aplicados por 30 minutos no momento da infusão dos quimioterápicos, iniciando 5 minutos antes[45,110].
Sampaio e colaboradores[87] realizaram estudo clínico em que foi testado o gel à 1% e a 3% nos pacientes submetidos a radioterapia de cabeça e pescoço. O protocolo de uso indicava a aplicação tópica após as sessões de radioterapia. O resultado obtido foi de redução da severidade da MO, mas não de prevenção dela.
Em 2016, Valenzuela e colaboradores[89], realizaram estudo clínico randomizado duplo-cego em que o grupo estudo utilizou a aplicação tópica do gel orabase à 2% para redução da ardência bucal, e da dor que acompanha os pacientes que apresentam MO. A indicação de uso foi a aplicação duas vezes ao dia por 30 dias, com boa tolerabilidade pelos pacientes e redução da ardência e dor, mas não significativa para redução da MO.
Braga e colaboradores[10] usaram concentrações de 0,5%, 1% e 2% de extrato aquoso das flores desidratadas na forma de bochechos em pacientes adultos submetidos ao transplante de células-tronco hematopoiéticas sob diferentes regimes quimioterápicos. Os pacientes eram instruídos a bochechar 10 ml da solução aquosa por um minuto, duas vezes ao dia, como resultados positivos na redução da gravidade da MO na concentração à 1%.
Dantas e colaboradores[111] realizou uma revisão sistemática que incluiu apenas estudos pré-clínicos, em modelo animal, e demonstrou que um desses estudos foi realizada a aplicação com cotonete da pomada com 100 mg de extrato fluido de camomila na cavidade oral dos hamsters com MO induzida, concluindo que esta formulação teve melhor resultado na redução das lesões por permanecer maior tempo em contato com o tecido epitelial bucal, quando comparada a outras formas farmacêuticas.
Portanto, diante do exposto faz-se necessário definir um protocolo para o uso de uma formulação à base de camomila (ou uma manipulação extemporânea), inovadora, seguindo as normas técnicas, indicada na prevenção e tratamento da MO (FIGURA 7), de bom aceite e tolerabilidade pelos pacientes[18,26,37,62].
Os trabalhos apresentaram pouquíssimos registros de plantas medicinais estudadas, com protocolos de preparo variados. O registro, ou voucher, é importante para respaldar o uso e a eficácia da planta medicinal, tendo visto que dessa forma há o controle desde o plantio, até a forma farmacêutica ou medicamento que será utilizado pelo paciente ou usuário.
Perspectivas
As conclusões obtidas contribuem de forma a reduzir o impacto negativo que a MO possa gerar no paciente submetido a diversos quimioterápicos e radioterapia de cabeça e pescoço. Há perspectivas promissoras para a inovação de um medicamento composto com camomila possivelmente com concentrações mais altas do que se encontra no mercado (drogarias). Faltando apenas, que a comunidade científica proponha mais estudos clínicos randomizados com esta planta medicinal padronizada e registrada segundo os critérios exigidos. Dessa forma os guidelines para o manejo da MO e os prescritores possam indicar a camomila com conhecimento, solidez e segurança. Certamente, a falta de padronização entre os estudos aqui elencados, e a ausência de registro (voucher) foram as maiores limitações apresentadas neste trabalho.
Conclusão
Diante do que foi apresentado, este trabalho vem contribuir com a realização de um levantamento bibliográfico demonstrando que a Matricaria chamomilla L. é considerada uma planta medicinal segura, eficaz, indicada e amplamente estudada para o tratamento da MO, com importantes ações farmacológicas e terapêuticas. As boas evidências do potencial terapêutico da Matricaria chamomilla L. Asteraceae a torna promissora para a inovação de medicamentos potenciais no manejo da MO, podendo ser incluída e indicada nos guidelines para prevenção e tratamento desta manifestação oral, melhorando a qualidade de vida dos pacientes.
Agradecimentos
Eu agradeço a própria camomila, por me permitir desvendá-la e estudá-la. Agradeço a está bendita planta medicinal por ser tão gentil e potente no reestabelecimento das células da mucosa oral dos pacientes oncológicos.
Fontes de Financiamento
Nenhuma.
Conflito de Interesses
Não há conflito de interesses.
Colaboradores
Concepção do estudo: ESLC
Curadoria dos dados: ESLC
Coleta de dados: ESLC
Análise dos dados: ESLC
Redação do manuscrito original: ESLC
Redação da revisão e edição: ESLC.
Referências
1.Smith RA, Andrews KS, Brooks D, Fedewa SA, Manassaram‐Baptiste D, Saslow D et al. Cancer screening in the United States, 2019: a review of current American Cancer Society guidelines and current issues in cancer screening. CA Cancer J Clin. 2019 May; 69(3): 184–210. [https://doi.org/10.3322/caac.21557] [https://pubmed.ncbi.nlm.nih.gov/30875085/].
2. Soares RG. Treatment of mucositis with combined 660- and 808-nm-wavelength low-level laser therapy reduced mucositis grade, pain, and use of analgesics: a parallel, single-blind, two-arm controlled study. Lasers Med Sci. 2018 Nov; 33(8): 1813-1819. [https://doi.org/10.1007/s10103-018-2549-y]
3. Valduga F, Oltramari E, Lemes LTO, Mattos CE, Stefenon L, Mozzini CB. Prevenção da Mucosite Oral em Pacientes submetidos à Quimioterapia. Rev Bras Cancerol. 2018; 64(2): 189-194. Disponível em: [https://doi.org/10.32635/2176-9745.RBC.2018v64n2.77].
4. Almeida EM, Ferreira HJ, Alves DR, Silva WMB. Therapeutic potential of medicinal plants indicated by the Brazilian public health system in treating the collateral effects induced by chemotherapy, radiotherapy, and chemoradiotherapy: a systematic review. Complement Ther Med. 2020 Mar; 49: 102293. [https://doi.org/10.1016/j.ctim.2019.102293] [https://pubmed.ncbi.nlm.nih.gov/32147034/].
5. Organization WH. WHO traditional medicine strategy: 2014-2023. Who.int. World Health Organization; 2014. Available from: [https://apps.who.int/iris/handle/10665/92455].
6. Inca 2020. Estimativa-2020-Incidencia-de-cancer-no-brasil. Instituto nacional de câncer José Alencar Gomes da Silva. Disponível em: [https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2020-incidencia-de-cancer-no-brasil.pdf]. [acesso em: 16 jan. 2023].
7. Beech N, Robinson S, Porceddu S, Batstone M. Dental management of patients irradiated for head and neck cancer. Australian Dental J. 2014 Mar; 59(1): 20-8. [https://doi.org/10.1111/adj.12134] [https://pubmed.ncbi.nlm.nih.gov/24495127/].
8. Bezinelli LM, Eduardo FP, Lopes RMG, Biazevic MGH, Eduardo CP, Correa L et al. Cost-effectiveness of the introduction of specialized oral care with laser therapy in hematopoietic stem cell transplantation. Hematol Oncol. 2014; 32(1): 31–9. [https://doi.org/10.1002/hon.2050] [https://pubmed.ncbi.nlm.nih.gov/23625880/].
9. Peterson DE, Boers-Doets CB, Bensadoun RJ, Herrstedt J. Management of oral and gastrointestinal mucosal injury: ESMO Clinical Practice Guidelines for diagnosis, treatment, and follow-up. Annals Oncol. 2015 Sep 1; 26 (Suppl 5): 139–51. [https://doi.org/10.1093/annonc/mdv202] [https://pubmed.ncbi.nlm.nih.gov/26142468/].
10. Braga FTMM, Santos ACF, Bueno PCP, Silveira RCCP, Santos CB, Bastos JK et al. Use of Chamomilla recutita in the prevention and treatment of oral mucositis in patients undergoing hematopoietic stem cell transplantation: a randomized, controlled, phase II clinical trial. Cancer Nurs. 2015 Jul/ago 2; 38(4): 322–9. [https://doi.org/10.1097/NCC.0000000000000194].
11. Yarom N, Hovan A, Bossi P, Ariyawardana A, Jensen SB, Gobbo M et al. Systematic review of natural and miscellaneous agents, for the management of oral mucositis in cancer patients and clinical practice guidelines — part 2: honey, herbal compounds, saliva stimulants, probiotics, and miscellaneous agents. Support Care Cancer. 2020 May; 28(5): 2457–72. [https://doi.org/10.1007/s00520-019-05256-4] [https://pubmed.ncbi.nlm.nih.gov/32056010/].
12. Bonomo P, Elad S, Kataoka T, Bosso P. The impact of the COVID-19 outbreaks on supportive care for oral mucositis: current concepts and practice. Support Care Cancer. 2021May; 29(5): 2255-2258. [https://doi.org/10.1007/s00520-020-05966-0] [https://pubmed.ncbi.nlm.nih.gov/33392774/].
13. Paiva MDEB et al. Complicações orais decorrentes da terapia antineoplásica. Arq Odontol. 2010; 46(01): 48–55. ISSN 1516-0939. [http://revodonto.bvsalud.org/pdf/aodo/v46n1/a08v46n1.pdf].
14. Schirmer EM, Ferrari A, Trindade LCT. Evolução da mucosite oral após intervenção nutricional em pacientes oncológicos no serviço de cuidados paliativos. Rev Dor São Paulo. 2012; 13(2): 141-6.[https://doi.org/10.1590/S1806-00132012000200009].
15. Andishe Tadbir A, Pourshahidi S, Ebrahimi H, Hajipour Z, Memarzade MR, Shirazian S. The effect of Matricaria chamomilla (chamomile) extract in Orabase on minor aphthous stomatitis, a randomized clinical trial. J Herb Med. 2015 Jun 1; 5(2): 71-6. [https://doi.org/10.1016/j.hermed.2015.05.001].
16. Pacífico DM et al. Prospecção científica e tecnológica de Matricaria recutita L. (Camomila). Rev GEINTEC–Aracaju/SE. 2018; 8(2): 4339–56. [https://repositorio.ufc.br/handle/riufc/36056].
17. Batista ALA, Lins RDAU, Coelho RS, Barbosa DN, Belém NM, Celestino FJA. Clinical efficacy analysis of the mouth rinsing with pomegranate and chamomile plant extracts in the gingival bleeding reduction. Complement Ther Clin Pract. 2014 Feb; 20:93–8. [https://doi.org/10.1016/j.ctcp.2013.08.002] [https://pubmed.ncbi.nlm.nih.gov/24439653/].
18. Monteiro MHDA, Fraga SAPM. Fitoterapia na prática clínica odontológica: produtos de origem vegetal e fitoterápicos. Rev Fitos. Rio de Janeiro. 2021; 15(1): 58–77. [https://doi.org/10.32712/2446-4775.2021.1102].
19. Brasil. Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de Atenção Básica. Política nacional de práticas integrativas e complementares no SUS: atitude de ampliação de acesso. Diário da República, 2.a série – nº 102 (27-05-2015). 2015. 96 p. Available from: [http://bvsms.saude.gov.br/bvs/publicacoes/politica_nacional_praticas_integrativas_complementares_2ed.pdf].
20. Resolução CFO-82, de 25 de setembro de 2008. Available from: [https://sistemas.cfo.org.br/visualizar/atos/RESOLU/SEC/2008/82].
21. Porto PF, Bragança MLBM, Oliveira BR, Coelho CCNS, Serra HCOA, Muniz AKOA et al. The trends on plants in the prevention and treatment of the COVID-19. Rev Fitos. 2021 Mar 31; 15(1): 115–9. [https://doi.org/10.32712/2446-4775.2021.1026].
22. Caires JS, Andrade TA, Amaral JB, Calasans MTA, Rocha MD S. A Utilização das terapias complementares nos cuidados paliativos: benefícios e finalidades. Cogitare Enferm. 2014; 19(3): 514–20. ISSN 1414-8536. [http://www.revenf.bvs.br/scielo.php?script=sci_arttext&pid=S1414-85362014000300012].
23. Aleluia CM et al. Fitoterápicos na odontologia. Rev Odontol Univ Cid São Paulo. 2015; 27(2): 126–34. ISSN 1983-5183.
24. Bohneberger G, Machado MA, Debiasi MM, Dirschnabel AJ, Ramos GO. Fitoterápicos na odontologia, quando podemos utilizá-los? Braz J Health Rev. 2019; 2(4): 3504–17. [https://doi.org/10.34119/bjhrv2n4-114].
25. Santos ARFC, Cruz JHA, Guênes GMT, Filho AAO, Alves MASG. Matricaria chamomilla L.: propriedades farmacológicas. Arch Health Invest. 2019; 8(12): 846–52. [https://doi.org/10.21270/archi.v8i12.4654].
26. Bôas GKV. Inovação em medicamentos da biodiversidade: uma adaptação necessária (ou útil) nas políticas públicas. 2013. 174 f. Tese de Doutorado [Programa de Pós-Graduação em Saúde Pública] - Escola Nacional de Saúde Pública Sergio Arouca, Fundação Oswaldo Cruz, Rio de Janeiro, 2013. [https://www.arca.fiocruz.br/handle/icict/13796].
27. Brasil. Presidência da República. Lei No 10.973, de 2 de dezembro de 2004. Diário Oficial [República Federativa do Brasil] [Internet]. 2004;17. Available from: [www.planalto.gov.br/ccivil_03/_Ato2004-2006/2004/Lei/L10.973.htm#art16].
28. Brasil. Ministério da Saúde. Política e Programa nacional de Plantas Medicinais e Fitoterápicos. [Internet]. Available from: [http://editora.saude.gov.br].
29. Silva KO, Coutinho KF, Messias GC, Santos GS, Souza ÉP. Conduta de pacientes oncológicos com mucosites orais quanto ao tratamento farmacológico e não farmacológico. Rev Ciênc Méd Biol. 2016 Dec 15; 15(3): 375-381. [https://doi.org/10.9771/cmbio.v15i3.17354].
30. el Mobadder M, Farhat F, el Mobadder W, Nammour S. Photobiomodulation therapy in the treatment of oral mucositis, dysgeusia and oral dryness as side-effects of head and neck radiotherapy in a cancer patient: a case report. Dent J (Basel). 2018 Dec 1; 6(4): 64. [https://doi.org/10.3390/dj6040064] [https://pubmed.ncbi.nlm.nih.gov/30423851/].
31. Ardakani MT, Ghassemi S, Mehdizadeh M, Mojab F, Salamzadeh J, Ghassemi S et al. Evaluating the effect of Matricaria recutita and Mentha piperita herbal mouthwash on management of oral mucositis in patients undergoing hematopoietic stem cell transplantation: a randomized, double blind, placebo controlled clinical trial. Complement Ther Med. 2016 Dec 1; 29: 29–34. [https://doi.org/10.1016/j.ctim.2016.08.001].
32. Souza BCDE. Bochecho de camomila (Chamomilla recutita) como auxiliar no tratamento da mucosite oral. Braz J Surgery Clinic Res - BJSCR. 2019; 29(1): 68–74. [https://www.mastereditora.com.br/periodico/20191208_114225.pdf].
33. Zadik Y, Arany PR, Fregnani ER, Bossi P, Antunes HS, Bensadoun RJ et al. Systematic review of photobiomodulation for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2019 Oct 1; 27(10): 3969–83. [https://doi.org/10.1007/s00520-019-04890-2].
34. Watters AL, Epstein JB, Agulnik M. Oral complications of targeted cancer therapies: a narrative literature review. Oral Oncol. 2011; 47: 441–8. [https://doi.org/10.1016/j.oraloncology.2011.03.028].
35. WHO handbook for reporting results of cancer treatment. Vol. 48. WHO; 1979.
36. Magnani C, Mastroianni C, Giannarelli D, Stefanelli MC, di Cienzo V, Valerioti T et al. Oral hygiene care in patients with advanced disease: an essential measure to improve oral cavity conditions and symptom management. American J Hospice Palliat Med. 2019 Sep 1; 36(9): 815–9. [https://doi.org/10.1177/1049909119829411].
37. Hong CHL, Gueiros LA, Fulton JS, Cheng KKF, Kandwal A, Galiti D et al. Systematic review of basic oral care for the management of oral mucositis in cancer patients and clinical practice guidelines. Support Care Cancer. 2019 Oct 1; 27(10): 3949–67. [https://doi.org/10.1007/s00520-019-04848-4].
38. Jones JA et al. MASCC/ISOO expert opinion on the management of oral problems in patients with advanced cancer. Support Care Cancer. 2022. [https://doi.org/10.1007/s00520-022-07211-2].
39. Charalambous A, Lambrinou E, Katodritis N, Vomvas D, Raftopoulos V, Georgiou M et al. The effectiveness of thyme honey for the management of treatment-induced xerostomia in head and neck cancer patients: A feasibility randomized control trial. Europ J Oncol Nursing. 2017 Apr 1; 27: 1–8. [https://doi.org/10.1016/j.ejon.2017.01.001].
40. Giafferis RBL et al. Estratégias terapêuticas disponíveis para xerostomia e hipossalivação em pacientes irradiados de cabeça e pescoço: manual para profissionais da saúde. Rev UNINGÁ, Maringá. 2017; 54(1): 45–58. [https://doi.org/10.46311/2318-0579.54.eUJ6].
41. Gomes VTS, Gomes RNS, Gomes MS, Joaquim WM, Lago EC, Nicolau RA. Effects of Matricaria Recutita L. in the Treatment of Oral Mucositis. he Scient World J. 2018; 2018: 1–8. [https://doi.org/10.1155/2018/4392184].
42. Elad S, Cheng KKF, Lalla R v, Yarom N, Hong C, Logan RM et al. MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy. Cancer. 2020 Oct 1; 126(19): 4423–31. [https://doi.org/10.1002/cncr.33100].
43. Lopes LD, Rodrigues AB, Brasil DRM, Moreira MMC, Amaral JG, Oliveira PP. Prevenção e tratamento da mucosite em ambulatório de oncologia: uma construção coletiva. Texto Contexto Enferm. 2016; 25(1): e2060014. [https://doi.org/10.1590/0104-070720160002060014].
44. Jales SMCP. Avaliação da efetividade de um protocolo de cuidados odontológicos no alívio da dor, sintomas bucais, melhora da qualidade de vida em pacientes com câncer de cabeça e pescoço em cuidados paliativos: ensaio clínico não controlado. São Paulo. 2011. Tese de Doutorado [em Neurologia] - Faculdade de Medicina, Universidade de São Paulo, São Paulo. 2011. [https://doi.org/10.11606/T.5.2011.tde-08122011-161547].
45. Reis PED, Ciol MA, Melo NS, Figueiredo PTS, Leite AF, Manzi NM. Chamomile infusion cryotherapy to prevent oral mucositis induced by chemotherapy: a pilot study. Support Care Cancer. 2016 Oct 1; 24(10): 4393–8. [https://doi.org/10.1007/s00520-016-3279-y]
46. Riley P, Glenny AM, Worthington H v, Littlewood A, Clarkson JE, Mccabe MG. Interventions for preventing oral mucositis in patients with cancer receiving treatment: oral cryotherapy. Cochr Database System Rev. 2015; 2015(2): 1465-1858. [https://doi.org/10.1002/14651858.CD011552].
47. Eduardo FP, Bezinelli LM, Lopes RMG, Sobrinho JJN, Hamerschlak N, Correa L. Efficacy of cryotherapy associated with laser therapy for decreasing severity of melphalan-induced oral mucositis during hematological stem-cell transplantation: a prospective clinical study. Hematol Oncol. 2015 Sep; 33(3): 152-8. [https://doi.org/10.1002/hon.2133] [https://pubmed.ncbi.nlm.nih.gov/24519448/].
48. Soileau K, Elster N. The hospice patient's right to oral care: making time for the mouth. J Palliat Care. 2018; 3(2): 65-69. [https://doi.org/10.1177/0825859718763283].
49. Brito CA, Araujo DS, Granja JG, Souza SM, Lima MAG, Oliveira MC. Efeito da clorexidina e do laser de baixa potência na prevenção e no tratamento da mucosite oral. Rev Odontol UNESP. 2012 July-Aug; 41(4): 236. ISSN 1807-2577.
50. Lalla RV, Bowen J, Barasch A, Elting L, Epstein J, Keefe DM et al. MASCC/ISOO clinical practice guidelines for the management of mucositis secondary to cancer therapy. Cancer. 2014; 120: 1453–61. [https://doi.org/10.1002/cncr.28592].
51. Riley P, Glenny AM, Worthington HV, Littlewood A, Fernandez Mauleffinch LM, Clarkson JE et al. Interventions for preventing oral mucositis in patients with cancer receiving treatment: cytokines and growth factors. 2017; 2017(11): 1465-1858. Cochr Database System Rev. [https://doi.org/10.1002/14651858.CD011990.pub2].
52. Neto APA et al. Fitoterapia como opção de tratamento para a mucosite oral: uma revisão da literatura. Anais III CIOPB - III Congresso Interdisciplinar de Odontologia da Paraíba / Arch Health Invest. 2018; (7):. [https://www.archhealthinvestigation.com.br/ArcHI/article/view/3972].
53. Neves L de J, Boldrini É, Tanimoto HM, Trevisani DM, Lopes LF, Macari KSM. Avaliação do efeito do laser preventivo na mucosite oral quimioinduzida em pacientes submetidos a altas doses de Metotrexato. Rev Bras Cancerol. 2020 Dec 28; 67(1). [https://doi.org/10.32635/2176-9745.RBC.2021v67n1.1128].
54. Lin YS, Lin LC, Lin SW, Chang CP. Discrepancy of the effects of zinc supplementation on the prevention of radiotherapy-induced mucositis between patients with nasopharyngeal carcinoma and those with oral cancers: subgroup analysis of a double-blind, randomized study. Nutr Cancer. 2010; 62(5): 682–91. [https://doi.org/10.1080/01635581003605532].
55. Machado A, Freitas A, Sales-Peres SH. Atividade anti-inflamatória de produtos naturais em odontologia: uma revisão sistemática. Rev Fitos. Rio de Janeiro. 2016; 10(1): 1–93. [https://doi.org/10.5935/2446-4775.20160005].
56. Yang C, Gong G, Jin E, Han X, Zhuo Y, Yang S et al. Topical application of honey in the management of chemo/radiotherapy-induced oral mucositis: a systematic review and network meta-analysis. Int J Nurs Stud. 2019 Jan; 89: 80-87. [https://doi.org/10.1016/j.ijnurstu.2018.08.007].
57. Pequeno MA et al. Matricaria Recutita Extract (Chamomile) to reduce Candida albicans and entrobacter cloacae biofilms: in vitro study. RGO - Rev Gaúch Odontol. Porto Alegre. 2018; 66(2): 122–8. [https://doi.org/10.1590/1981-863720180002000033328].
58. Braga AS, Simas LLM, Pires JG, Souza BM, Melo FPSR, Saldanha LL et al. Antibiofilm and anti-caries effects of an experimental mouth rinse containing Matricaria chamomilla L. extract under microcosm biofilm on enamel. J Dent. 2020 Aug 1; 99. [https://doi.org/10.1016/j.jdent.2020.103415].
59. Schmidt TR, Curra M, Wagner VP, Martins MAT, de Oliveira AC, Batista AC et al. Mucoadhesive formulation containing Curcuma longa L. reduces oral mucositis induced by 5-fluorouracil in hamsters. Phytother Res. 2019 Apr 1; 33(4): 881–90. [https://doi.org/10.1002/ptr.6279].
60. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária-Anvisa. Farmacopeia Brasileira. Memento Fitoterápico da Farmacopeia Brasileira. 1ª Ed. Brasília. 2016. [https://www.gov.br/saude/pt-br/composicao/sectics/daf/pnpmf/publicacoes/memento-fitoterapico-da-farmacopeia-brasileira/view].
61. Monteiro MHDA. Fitoterapia na odontologia: levantamento dos principais produtos de origem vegetal para saúde bucal. 2014. 218 f. Trabalho de Conclusão de Curso (Especialização) [Programa Pós-Graduação em Gestão da Inovação em Fitomedicamentos] - Instituto de Tecnologia em Fármacos/Farmanguinhos, Fundação Oswaldo Cruz, Rio de Janeiro, 2014. [https://doi.org/10.5935/2446-4775.20150021].
62. Dantas IC de M, Lucena EES, Lima ÁMP. Avaliação do conhecimento e uso de plantas medicinais e fitoterápicos por dentistas do Seridó Potiguar/RN. Rev Fitos. 2020; 14(3): 372–81. [https://doi.org/10.32712/2446-4775.2019.1097].
63. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária-Anvisa. Brasileira F. Formulário de Fitoterápicos. 2a Ed. 2021. Disponível em: [https://www.gov.br/anvisa/pt-br].
64. Shetty SB, Mahin-Syed-Ismail P, Varghese S, Thomas-George B, Kandathil-Thajuraj P, Baby D et al. Antimicrobial effects of Citrus sinensis peel extracts against dental caries bacteria: an in vitro study. J Clin Exp Dent. 2016; 8(1): e71–7. [https://doi.org/10.4317/jced.52493].
65. Domingues SA, Paiva LF. Atividade antifúngica de Cymbopogon citratus (DC) Stapf frente à leveduras do gênero Candida sp. Rev Fitos. Rio de Janeiro. 2021; 15(1): 22–31. [https://doi.org/10.32712/2446-4775.2021.958].
66. Marmitt DJ, Rempel C, Goettert MI, Silva AC. Plantas Medicinais da RENISUS Com potencial anti-inflamatório: revisão sistemática em três bases de dados científicas. Rev Fitos, Rio de Janeiro. 2015; 9(2): 73–159. [https://doi.org/10.5935/2446-4775.20150011].
67. Brasil. Ministério da Saúde. B. Monografia da Espécie Matricaria chamomilla L. (= Chamomilla recutita (L.) Rauschert, CAMOMILA). Brasília. 2015. [https://www.gov.br/saude/pt-br/acesso-a-informacao/participacao-social/consultas-publicas/2017/arquivos/MonografiaCamomila.pdf].
68. Organization WH, Plants WHOC on SM, WHO Consultation on Selected Medicinal Plants (2nd 1999: Ravello-Salerno I, WHO Consultation on Selected Medicinal Plants (3rd: 2001: Ottawa Ont), WHO Consultation on Selected Medicinal Plants (4th: 2005: Salerno-Paestum I. WHO monographs on selected medicinal plants [Internet]. Geneva PP - Geneva: World Health Organization; Available from: [https://apps.who.int/iris/handle/10665/42052].
69. Pereira SV et al. Dynamic maceration of Matricaria chamomilla inflorescences: optimal conditions for flavonoids and antioxidant activity. Rev Bras Farmacog. 2018; 28: 111–7. [https://doi.org/10.1016/j.bjp.2017.11.006].
70. Al-Dabbagh B, Elhaty IA, Elhaw M, Murali C, al Mansoori A, Awad B et al. Antioxidant and anticancer activities of chamomile (Matricaria recutita L.). BMC Res Notes. 2019 Jan 3; 12(1). [https://doi.org/10.1186/s13104-018-3960-y].
71. Balbinot S, Velasquez PG, Düsman E. Reconhecimento e uso de plantas medicinais pelos idosos do Município de Marmeleiro – Paraná. Rev Bras Pl Med. Campinas. 2013; 15(4 supl. I): 632–8. [https://doi.org/10.1590/S1516-05722013000500002].
72. Lins R, Vasconcelos, Leite, Coelho-Soares, Barbosa. Avaliação clínica de bochechos com extratos de aroeira (Schinus terebinthifolius) e Camomila (Matricaria recutita L.) sobre a placa bacteriana e a gengivite. Rev Bras Pl Med. 2013. [https://doi.org/10.1590/S1516-05722013000100016].
73. Amaral W, Deschamps C, Machado MP, Côcco LC, Koeler HS, Scheer AP. Desenvolvimento da camomila, rendimento e qualidade do óleo essencial em diferentes idades de colheita. Rev Bras Pl Med. Campinas. 2014; 16(2): 237–42. [https://doi.org/10.1590/S1516-05722014000200011].
74. Avonto C, Rua D, Lasonkar PB, Chittiboyina AG, Khan IA. Identification of a compound isolated from German chamomile (Matricaria chamomilla) with dermal sensitization potential. Toxicol Appl Pharmacol. 2017; 318: 16–22. [https://doi.org/10.3390/biom9030106].
75. Salehi B et al. Plant-Derived bioactives in oral mucosal lesions: a key emphasis to Curcumin, Lycopene, Chamomile, Aloe vera, Green Tea and Coffee Properties. Biomolecules. 2019; 9(106): 2-23. [https://doi.org/10.3390/biom9030106].
76. Flemming M, Kraus B, Rascle A, Jürgenliemk G, Fuchs S, Fürst R et al. Revisited anti-inflammatory activity of matricine in vitro: comparison with chamazulene. Fitoterapia. 2015; 106: 122–8. Available from: [https://doi.org/10.1016/j.fitote.2015.08.010].
77. Monteiro MHDA, Fraga SAPM. Fitoterapia na odontologia: levantamento dos principais produtos de origem vegetal para saúde bucal. Rev Fitos. Rio de Janeiro. 2015; 9(4): 253–303. [https://doi.org/10.5935/2446-4775.20150021].
78. Morales-Bozo I, Ortega-Pinto A, Rojas Alcayaga G, Aitken Saavedra JP, Salinas Flores O, Lefimil Puente C et al. Evaluation of the effectiveness of a chamomile (Matricaria chamomilla) and linseed (Linum usitatissimum) saliva substitute in the relief of xerostomia in elders. Gerodontology. 2017 Mar 1; 34(1): 42–8. [https://doi.org/10.1111/ger.12220].
79. Goes P, Dutra CS, Lisboa MRP, Gondim D V, Leitão R, Brito GAC et al. Clinical efficacy of a 1% Matricaria chamomile L. Mouthwash and 0.12% chlorhexidine for gingivitis control in patients undergoing orthodontic treatment with fixed appliances. J Oral Sci. 2016 Dec 1; 58(4): 569–74. [https://doi.org/10.2334/josnusd.16-0280].
80. Whittemore R, Knafl K. Methodological issues in nursing research. The integrative review: updated methodology. J Adv Nurs. 52(5): 546– 553. [https://doi.org/10.1111/j.1365-2648.2005.03621.x].
81. Galvão CM. Níveis de evidência. ACTA Paulista Enferm. 2006; 19(2): 2006. [https://doi.org/10.1590/S0103-21002006000200001].
82. Howick J, Chalmers I, Lind J, Glasziou P, Greenhalgh T, Heneghan C et al. Oxford Centre for Evidence-Based Medicine 2011. Levels Evid. Available from: http://www.cebm.net/index.aspx?o=5653
83. Zhang X, Sun D, Qin N, Liu M, Zhang J, Li X. Comparative prevention potential of 10 mouthwashes on intolerable oral mucositis in cancer patients: A Bayesian network analysis. Oral Oncol. 2020; 107:104751. [https://doi.org/10.1016/j.oraloncology.2020.104751].
84. Marucci L, Farneti A, di Ridolfi P, Pinnaro P, Pellini R, Giannarelli D et al. Double-blind randomized phase III study comparing a mixture of natural agents versus placebo in the prevention of acute mucositis during chemoradiotherapy for head and neck cancer. Head Neck. 2017 Sep 1; 39(9): 1761-9. [https://doi.org/10.1002/hed.24832].
85. Eubank PLC, Abreu LG, Violante IP, Volpato LER. Medicinal plants used for the treatment of mucositis induced by oncotherapy: a systematic review. Support Care Cancer. 2021; 29: 6981-6993. [https://doi.org/10.1007/s00520-021-06247-0].
86. Oliveira BV, de Barros Silva PG, Nojosa JDS, Brizeno LAC, Ferreira JM, Sousa FB et al. Tnf-alpha expression, evaluation of collagen, and TUNEL of Matricaria recutita L. extract and triamcinolone on oral ulcer in diabetic rats. J Applied Oral Sci. 2016 May 1; 24(3): 278–90. [https://doi.org/10.1590/1678-775720150481].
87. Elhadad MA, El-Negoumy E, Taalab MR, Ibrahim RS, Elsaka RO. The effect of topical Chamomile in the prevention of chemotherapy induced oral mucositis: a randomized clinical t. Oral Dis. 2022; 28: 164-72. Available from: [https://doi.org/10.1016/j.oooo.2013.12.338].
88. Sampaio TPD. Matricaria recutita Linn. In the prevention and control of radio-induced oral mucositis. Oral Surg Oral Med Oral Pathol Oral Radiol. 2014; 117(2): E215. [https://doi.org/10.1016/j.oooo.2013.12.338].
89. Tadbir AA et al. The effect of Matricaria chamomilla (chamomile) extract in Orabase on minor aphthous stomatitis, a randomized clinical trial. HERMED/ J Herb Med. June 2015; 5(2): 71-76. [https://doi.org/10.1016/j.hermed.2015.05.001].
90. Valenzuela S, Pons-Fuster A, López-Jornet P. Effect of a 2% topical Chamomile application for treating burning mouth syndrome: a controlled clinical trial. J Oral Pathol Med. 2016; 45(7): 528–33. [https://doi.org/10.1111/jop.12412].
91. Holmes TSV, Pereira JV, Gomes DQC, Pereira MSV, Nóbrega DRM, Santos MGC. Evaluation of the effectiveness of Matricaria recutita Linn. in the prevention and control of radiation-induced oral mucositis. Rev Odonto Cienc. 2013; 28(4): 89–93. Available from: [https://revistaseletronicas.pucrs.br/index.php/fo/article/view/12488].
92. Biolab Sanus Farmacêutica Ltda. AD-MUC: Bula original, obtida diretamente da ANVISA. Disponível em: [https://buladeremedio.net/biolab_sanus_farmaceutica_ltda/1/ad_muc/profissional].
93.Ltda HDBB. Traumeel S | Bulas Med. Disponível em: [https://www.bulas.med.br/p/bulas-de-medicamentos/bula/1365168/traumeel+s.htm]. [acesso em: 16 jan. 2023].
94. Sencer SF, Zhou T, Freedman LS, Ives JA, Chen Z, Wall D et al. Traumeel S.® in preventing and treating mucositis in young patients undergoing SCT: a report of the Children's Oncology Group. Bone Marrow Transplant. 2012 Nov; 47(11): 1409–14. [https://doi.org/10.1038/bmt.2012.30].
95. Kato S, Saito A, Matsuda N, Suzuki H, Ujiie M, Sato S et al. Management of afatinib-induced stomatitis. Mol Clin Oncol. 2017 Apr; 6(4): 603–5. [https://doi.org/10.3892/mco.2017.1184].
96. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária, ANVISA. Resolução da Diretoria Colegiada-RDC N° 26, de 13 de maio de 2014. [https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2014/rdc0026_13_05_2014.pdf].
97. Silva ACA et al. Effect of Chamomilla Recutita in the oncology patient with oral mucositis: a systematic review. Enferm Global. 2021; 20(2): 614-652. [https://doi.org/10.6018/eglobal.426451].
98. Brasil. Ministério da Saúde. ANVISA. Farmacopeia Brasileira. 6ª ed. Vol. 1. Anvisa. 2019; 1: 874. [https://fitoterapiabrasil.com.br/biblioteca-virtual/farmacopeia-brasileira-6a-edicao2019-volume-i].
99. Bigagli E, Cinci L, D'Ambrosio M, Luceri C. Pharmacological activities of an eye drop containing Matricaria chamomilla and Euphrasia officinalis extracts in UVB-induced oxidative stress and inflammation of human corneal cells. J Photochem Photobiol B. 2017 Aug 1; 173: 618–25. [https://doi.org/10.1016/j.jphotobiol.2017.06.031].
100. Aghamohammadi A, Hosseinimehr SJ. Natural products for management of oral mucositis induced by radiotherapy and chemotherapy. Integr Cancer Ther. 2016; 15(1): 60–8. [https://doi.org/10.1177/1534735415596570].
101. Curra M, Junior LAVS, Martins MD, Santos PSS. Protocolos quimioterápicos e incidência de mucosite bucal. Revisão integr. einstein (São Paulo). 2018; 16(1): 1–9. [https://doi.org/10.1590/s1679-45082018rw4007].
102. Sharifi-Rad M et al. Matricaria genus as a source of antimicrobial agents: from farm to pharmacy and food applications. Microbiol Res. 2018; 215: 76–88. [https://doi.org/10.1016/j.micres.2018.06.010].
103. Khayyal MT, Kreuter MH, Kemmler M, Altmann P, Abdel-Naby DH, El-Ghazaly MA. Effect of a chamomila extract in protecting against radiation-induced intestinal mucositis. Phytother Res. 2019 Mar 1; 33(3): 728–36. [https://doi.org/10.1002/ptr.6263].
104. Singh O, Khanam Z, Misra N, Srivastava M. Chamomile (Matricaria chamomilla L.): An overview. Pharmacogn Rev. 2011; 5(9). [https://doi.org/10.4103/0973-7847.79103].
105. Worthington H v., Clarkson JE, Bryan G, Furness S, Glenny AM, Littlewood A et al. Interventions for preventing oral mucositis for patients with cancer receiving treatment. Cochr Database System Rev. 2011 Apr 13; 2021(3): [https://doi.org/10.1002/14651858.CD000978.pub5].
106. Schönknecht K, Surdacka A, Rudenko L. Effectiveness of composed herbal extract in the treatment of gingivitis and oral and pharyngeal mucosa – review of studies. Wiad Lek Wiadomości Lekarskie. 2021; 74(7): 1737–49. [https://doi.org/10.36740/WLek202107131].
107. Steinmann D, Babadağ Savaş B, Felber S, Joy S, Mertens I, Cramer H et al. Nursing procedures for the prevention and treatment of mucositis induced by cancer therapies: clinical practice guideline based on an interdisciplinary consensus process and a systematic literature search. Integr Cancer Ther. 2021; 20: [https://doi.org/10.1177/1534735420940412].
108. López-González Á, García-Quintanilla M, Guerrero-Agenjo CM, Tendero JL, Guisado-Requena IM, Rabanales-Sotos J. Eficacy of cryotherapy in the prevention of oral mucosistis in adult patients with chemotherapy. Int J Environ Res Public Health. 2021; 18(3): 1–15. [https://doi.org/10.3390/ijerph18030994].
109. Barreto RAB, Dantas JBL, Lima JB, Martins GB, Sanches ACB, Carrera M et al. Evaluation of the impact of oral hygiene and chamomila tea in the development of oral mucositis: pilot study. Rev Bras Cancerol. 2020; 66(1): e-10777. [https://doi.org/10.32635/2176-9745.RBC.2020v66n1.777].
110. Seyyedi SA, Sanatkhani M, Pakfetrat A, Olyaee P. The therapeutic effects of chamomilla tincture mouthwash on oral aphthae: a randomized clinical trial. J Clin Exp Dent. 2014; 6(5): e535–8. [https://doi.org/10.4317/jced.51472].
111. Morais EF, Severo MLB, Martins HDD, Martins MAT, Martins MD, Freitas RA et al. Effectiveness of phytotherapeutics in the prevention and treatment of 5-fluorouracil-induced oral mucositis in animal models: a systematic review. Arch Oral Biol. 2021; 123:104998. [https://doi.org/10.1016/j.archoralbio.2020.104998].
112. Dantas JBL, Freire TFC, Sanches ACB, Julião ELD, Medrado ARAP, Martins GB. Action of Matricaria recutita (chamomile) in the management of radiochemotherapy oral mucositis: a systematic review. Phytother Res. 2022; 36(3): 1115–25. [https://doi.org/10.1002/ptr.7378].