REVISÃO
Evidências farmacológicas sobre plantas medicinais usadas para o tratamento de artrite reumatoide e osteoartrite (artrose)
Pharmacological evidence regarding medicinal plants used for the treatment of rheumatoid arthritis and osteoarthritis (osteoarthrosis)
Resumo
A artrite reumatoide (AR) e a osteoartrite (OA) são enfermidades de grande impacto social que acarretam fortes dores, deformidades e incapacidade para atividades rotineiras e laborais. No Brasil, mesmo com as Políticas Nacionais de Práticas Integrativas e Complementares (PNPIC) e de Plantas Medicinais e Fitoterápicos (PNPMF) que permitiram ampliar o acesso à Fitoterapia, continua muito comum a difusão sobre o uso de plantas medicinais de maneira equivocada, muitas vezes sem nenhuma evidência científica de eficácia. O objetivo deste trabalho foi selecionar algumas plantas popularmente indicadas na internet para uso em tratamento de AR e OA e buscar dados de eficácia e segurança, sendo elas Harpagophytum procumbens, Hypericum perforatum, Miconia albicans, Uncaria tomentosa e Varronia curassavica. A partir de uma revisão da literatura englobando ensaios in vitro, pré-clínicos e clínicos foram encontrados resultados promissores sobre a ação dessas plantas sobre AR e OA. A maioria dos trabalhos reforça os efeitos anti-inflamatório, antiartrítico e analgésico dessas espécies, porém, como os mecanismos ainda não são elucidados, mais estudos são necessários, principalmente clínicos, para se chegar a uma melhor conclusão. Essa revisão bibliográfica poderá contribuir e alertar profissionais da saúde e pacientes que buscam esses produtos para tratamento de doenças reumáticas.
- Palavras-chave:
- Harpagophytum procumbens.
- Hypericum perforatum.
- Miconia albicans.
- Uncaria tomentosa.
- Varronia curassavica.
Abstract
Rheumatoid arthritis (RA) and osteoarthritis (OA) are social impact disorders that lead to intense pain, deformities, and inability to perform daily and work-related activities. In Brazil, despite the National Policies for Integrative and Complementary Practices (PNPIC) and Medicinal Plants and Phytotherapies (PNPMF) that have expanded access to Phytotherapy, the incorrect dissemination of the use of medicinal plants remains common, often without any scientific evidence of efficacy. The aim of this study was to select some plants popularly recommended on the internet for treating RA and OA and to gather data on their efficacy and safety. These plants include Harpagophytum procumbens, Hypericum perforatum, Miconia albicans, Uncaria tomentosa, and Varronia curassavica. A literature review covering in vitro, preclinical, and clinical trials revealed promising results regarding the action of these plants on RA and OA. Most studies emphasize the anti-inflammatory, anti-arthritic, and analgesic effects of these species. However, as the mechanisms are not yet fully understood, further studies, particularly clinical trials, are necessary to reach a more definitive conclusion. This literature review can contribute to and alert healthcare professionals and patients seeking these products for the treatment of rheumatic diseases.
- Keywords:
- Harpagophytum procumbens.
- Hypericum perforatum.
- Miconia albicans.
- Uncaria tomentosa.
- Varronia curassavica.
Introdução
Osteoartrite
A osteoartrite (OA) é hoje uma das doenças crônicas mais frequentes na população brasileira e, com o aumento da expectativa de vida, é esperado que a sua prevalência e incidência sejam cada vez maiores. É ainda uma condição progressiva que leva à perda de qualidade de vida e declínio funcional, com relevantes perdas para a saúde e sociedade[1], sendo a segunda maior causa de incapacidade laborativa. A OA fica atrás somente de doenças cardíacas isquêmicas em homens com mais de 50 anos[2], sendo também a doença reumática mais prevalente entre indivíduos com mais de 65 anos de idade[3]. Em 2017, mais de 300 milhões de casos de OA de joelho e quadril foram relatados em todo o mundo e a estimativa é que a prevalência seja cada vez maior no futuro, principalmente entre as mulheres[4].
Diversos fatores estão associados a um maior risco de progressão da OA: envelhecimento populacional, sobrepeso, fatores genéticos e biomecânicos, lesão prévia, fraqueza muscular, trabalhos insalubres e que demandem esforço da articulação[5]. Sabe-se que o processo não é apenas mecânico, mas também está relacionado às vias inflamatórias[6].
A FIGURA 1 ilustra o avanço da OA em pacientes em estágio inicial e avançado comparado a um paciente normal. O mesmo acontece para músculos, tendões e ligamentos que envolvem as articulações. A deterioração progressiva da cartilagem resulta na dificuldade da realização de atividades diárias do paciente. As dores são originadas no osso abaixo da cartilagem, que é rico em nervos, ou nos músculos, tendões e ligamentos, que possuem diversas terminações nervosas[7].
Estudos recentes apontam a obesidade como fator de predisposição para OA de joelho[8]. A associação entre Índice de Massa Corporal (IMC) e OA de joelho é relacionada pela sobrecarga articular e pela relação com o ambiente metabólico inflamatório encontrado na obesidade. As citocinas associadas ao tecido adiposo podem influenciar a OA de joelho pela degradação direta da articulação por processos inflamatórios locais[9].
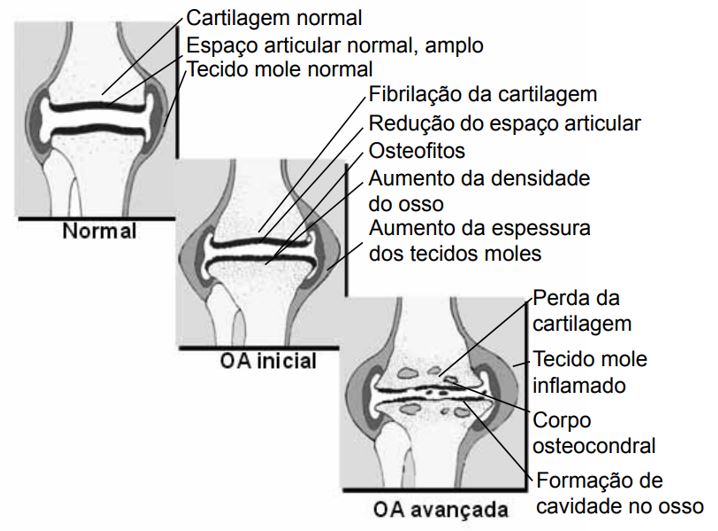
Clinicamente, a OA se caracteriza por dores, crepitações, sensibilidade e rigidez nas articulações bem como restrições de movimentos, podendo ainda causar derrame articular e variáveis graus de inflamação[1]. Doenças inflamatórias são caracterizadas pela produção excessiva de radicais livres, espécies reativas de nitrogênio e citocinas TNF-α, IL-1 e IL-6[10].
Não existe uma cura para a doença, mas sim manejos para o alívio da dor[2], que podem proporcionar uma melhor qualidade de vida para o paciente. Como a OA se faz presente em um longo período da vida de um paciente, é provável que seu tratamento englobe diversas intervenções farmacêuticas e não farmacêuticas, muitas vezes em combinação[11]. Sociedades científicas recomendam a prática de exercícios físicos, de preferência dentro da água, e mudança nos hábitos diários, bem como de exercícios aeróbicos de baixo impacto visando fortalecer os músculos em volta das articulações, alongamento e perda de peso[3]. Uma redução de 10% do peso já proporciona melhora funcional de 28%[12].
Órteses, como muletas e bengalas, também são comumente utilizadas, por descarregar a articulação, reduzir a dor, melhorar a estabilidade e facilitar a rotina do paciente. É recomendado também o uso de calçados específicos para diminuição do impacto e bandagens para realinhamento e redução do estresse nas articulações[13].
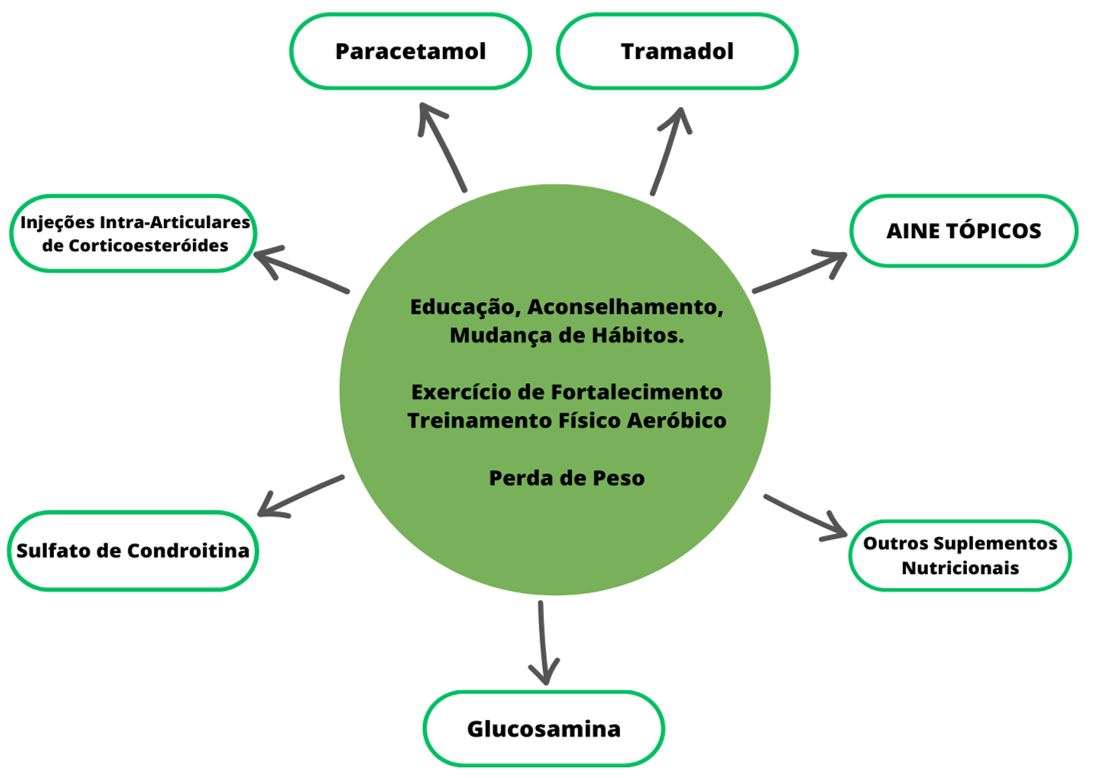
Como demonstrado na FIGURA 2, o tratamento farmacológico recomendado para o manejo inicial de pacientes com OA é feito a base de paracetamol e anti-inflamatórios não esteroidais (AINES)tópicos, tramadol, injeções intra-articulares de corticosteroides, glucosamina, sulfato de condroitina e outros suplementos nutricionais. Injeções intra-articulares de hialuronato, duloxetina e uso de opioides são recomendados em pacientes com resposta inadequada à terapia inicial. Procedimentos cirúrgicos são aconselhados em pacientes com um longo curso da doença e/ou dor intratável ou incapacidade com métodos não cirúrgicos. Opções cirúrgicas incluem lavagem/desbridamento, osteotomia e artroplastia[14].
Artrite Reumatoide
A artrite reumatoide (AR) é uma doença autoimune inflamatória crônica de origem ainda desconhecida, cujas características são definidas por inflamação do tecido articular e hiperplasia sinovial com proliferação de sinoviócitos análogos a fibroblastos (FBS), ocasionalmente levando à destruição cartilaginosa e óssea, e acomete duas vezes mais as mulheres que os homens. Apesar de ter sua origem desconhecida, predisposição genética, exposição a fatores ambientais, tabagismo e infecções (ex. infecções periodontais) estão entre alguns fatores envolvidos no desenvolvimento da doença. Exposição à sílica e fatores hormonais também estão correlacionados, o que explica o maior acometimento nas mulheres[7].
Seu início geralmente se dá entre os 30 e 40 anos e a incidência é maior com o passar dos anos. Os sintomas mais recorrentes são dor, edema, rigidez, rubor e calor nas articulações do corpo, principalmente nas mãos e punhos, evoluindo progressivamente para articulações mais centrais e maiores, como ombro, tornozelo, joelho, cotovelo e quadril. Sua evolução é progressiva e causa a ruptura/afrouxamento de tendões e erosões articulares. Exames complementares de sangue e de imagem podem ser usados para o diagnóstico da AR junto à exames que meçam atividade inflamatória, fator reumatoide, anticorpos antipeptídeos citrulinados cíclicos, radiografias das articulações acometidas e, eventualmente, ultrassonografia ou ressonância das articulações[15].
Os mecanismos patogênicos da AR não são totalmente esclarecidos, mas os FBS ativados são levados em consideração como papel fundamental no início e perpetuação da inflamação articular destrutiva[16]. Os FBS são importantes no aumento da inflamação e dano articular, podem produzir grande quantidade de mediadores pró-inflamatórios, como IL-1, IL-6, TNF-α, metaloproteinases da matriz (MMPs) e prostaglandina E2 (PGE2). Esses mediadores se ligam a receptores específicos, transcrevem os genes e interagem de forma a contribuir para a progressão da artrite, infiltração de leucócitos, formação de rede de citocinas, elevação do catabolismo da cartilagem e supressão do anabolismo[17].
As intervenções farmacológicas podem variar de acordo com a evolução, estágio e gravidade da doença, devendo ser mais incisivas de acordo com a gravidade. Para o controle da AR, deve-se considerar a autoimunidade exacerbada e redução da inflamação e consequências para as articulações. Antes do uso de medicamentos antirreumáticos específicos, os anti-inflamatórios são a base do tratamento, seguidos por corticoides nas fases agudas. Para o paciente seguir com suas rotinas e atividades do dia a dia, ainda é recomendado que faça fisioterapia e terapia ocupacional. Terapias alternativas incluem meditação, acupuntura, massagem, quiropraxia, homeopatia, dieta etc. Muitas destas práticas não possuem ainda comprovação de eficácia e segurança, não sendo possível afirmar seus benefícios para esses pacientes[15].
Tratamento da OA e AR com plantas medicinais
Nas últimas décadas, pesquisas a respeito de plantas medicinais e produtos naturais, muitas vezes a partir de informações etnofarmacológicas, têm oferecido contribuições significativas na descoberta de novas possibilidades farmacológicas. No entanto, a maioria dos estudos utilizando modelos de inflamação são in vitro e in vivo pré-clínicos. Além do mais, a composição química e os mecanismos de ação pelos quais atuam estas plantas, em sua maioria, não foram ainda determinados[18-20].
Além do mais, o uso tradicional de diversas plantas medicinais baseado em conhecimentos populares aliado à crença de que, por serem naturais, não causam reações adversas, fazem das plantas recursos acessíveis à população que busca tratamentos mais baratos ou "alternativos". Porém, como carecem de estudos de eficácia e segurança, estas plantas podem causar uma série de efeitos adversos e interações medicamentosas, ou até mesmo riscos de toxicidade[21-23].
Neste contexto, o objetivo deste trabalho foi realizar uma revisão da literatura a respeito das cinco plantas medicinais (erva-baleeira, garra-do-diabo, erva-de-são-joão, canela-de-velho e unha-de-gato) que são mais utilizadas na medicina popular, segundo sites de busca da internet, para o tratamento e alívio de sintomas de AR e OA, a fim de averiguar se estes recursos naturais possuem evidências científicas, a partir de estudos pré-clínicos e clínicos, que sustentem a sua eficácia e segurança.
Metodologia
Inicialmente foi realizada uma pesquisa preliminar na internet em sites de busca (ex. Google) a respeito das plantas medicinais mais usadas para o tratamento da OA e AR. Cinco espécies foram encontradas com maior frequência: erva-baleeira (Varronia curassavica Jacq.), garra-do-diabo (Harpagophytum procumbens (Burch.) DC. ex Meisn.), erva-de-são-joão (Hypericum perforatum L.), canela-de-velho (Miconia albicans (Sw.) Steud.) e unha-de-gato (Uncaria tomentosa Willd. ex Schult. DC.). Posteriormente foi realizada uma pesquisa nas bases de dados PubMed, Science Direct e Scielo usando como descritores as seguintes combinações de palavras-chaves: [nome científico da planta] + [osteoarthritis OU arthritis]. Para a erva-baleeira, foram utilizados na busca o nome científico atualizado e a sinonímia, ou seja, Varronia curassavica e Cordia verbenacea. Foram selecionados artigos de pesquisa sobre OA e AR que realizaram experimentos in vitro, pré-clínicos e clínicos usando como tratamento os extratos, frações e/ou substâncias ativas isoladas das plantas selecionadas. O período determinado no levantamento dos artigos foi de 2002 a 2022. Os artigos, inicialmente selecionados a partir da leitura dos resumos, foram lidos na íntegra e os dados referentes a resultados dos tratamentos com as plantas medicinais foram sistematizados e organizados em tabelas. Foram excluídos aqueles artigos que não apresentavam dados experimentais sobre as plantas ou aqueles que traziam apenas citação de uso popular.
Resultados e Discussão
A partir do levantamento nas bases de dados e análise dos critérios de inclusão e exclusão, foram selecionados para a revisão bibliográfica deste trabalho um total de 35 artigos: 4 artigos para erva-baleeira, 16 para garra-do-diabo, 4 para erva-de-são-joão, 4 para canela-de-velho e 9 para unha-de-gato.
Erva-baleeira (Varronia curassavica Jacq., Boraginaceae)
Dentre as diversas espécies usadas no tratamento da OA e AR, a erva-baleeira (Varronia curassavica; sinonímia= Cordia verbenacea DC.) é conhecida por suas propriedades analgésicas e anti-inflamatórias[24]. A espécie também é conhecida popularmente por maria-milagrosa, salicina, maria-preta, catinga-preta e catinga-de-barrão. É um arbusto ereto, ramificado, aromático, medindo de 1,5 a 2,5 m de altura. Suas folhas são simples e de coloração esverdeadas e margens dentadas, aromáticas, de 5 a 9 cm de comprimento. Possui flores brancas, pequenas e que dão origem a pequenos frutos de cor vermelho-escuro. Suas folhas são usadas em forma de tintura, maceradas em álcool – esse processo libera um forte odor do seu óleo essencial, que é o responsável pela ação medicinal. Seus constituintes químicos são o óleo essencial (contendo como substância ativa o sesquiterpeno α-humuleno) e os flavonoides[25].
A erva-baleeira é usada popularmente como anti-inflamatório, analgésico e antiulcerogênico[26]. Sua administração pode ser interna, na forma de chás para a AR, reumatismo e problemas de coluna[27]. O Formulário Nacional de Fitoterápicos da Farmacopeia Brasileira, 2ª edição[28], descreve o uso tópico das folhas da V. curassavica, na forma de infusão ou gel, como auxiliar no alívio de sintomas decorrentes de processos inflamatórios localizados. Deve-se utilizar apenas na pele íntegra, sem lesões ou feridas abertas.
Em 2004, foi registrado o primeiro medicamento fitoterápico do Brasil, o Acheflan®, utilizando óleo essencial de folhas de V. curassavica na formulação de creme dermatológico para uso tópico. Este medicamento é indicado para tratamento de tendinites, afecções musculoesqueléticas associadas a dor e inflamação, como dor miofascial, dorsalgia, lombalgia, em quadros inflamatórios dolorosos associados a traumas de membros, entorses e contusões. Foi realizado estudo clínico fase III, duplo-cego, randomizado, comparativo, que concluiu que o medicamento obteve melhor eficácia no tratamento de contusões, entorses, trauma e lesões musculares comparado ao diclofenaco dietilamônio emulgel 1%[29]. Este produto foi lançado no mercado em 2005 e tem sido um dos medicamentos fitoterápicos mais comercializados desde então[30].
Estudos pré-clínicos preliminares realizados com o extrato foliar liofilizado hidroalcoólico de V. curassavica mostraram potencial ação anti-inflamatória oral e tópica, com baixa toxicidade em roedores e ainda efeito protetor para a mucosa gástrica[31-33]. Em 1990, os mesmos pesquisadores isolaram e caracterizaram quimicamente a artemetina, que também apresenta efeito anti-inflamatório sistêmico e baixa toxicidade. Refsio et al.[34] observaram que o tratamento com erva-baleeira em forma de creme contendo 0,5% de óleo essencial e 2,3-2,9% de α-humuleno, mostrou melhora acentuada após 10 dias de tratamento em 72,7% dos pacientes, 18,2% dos pacientes com melhora moderada, 7,3% tiveram melhora discreta e 1,8% dos pacientes permaneceram com o quadro inalterado.
A ação anti-inflamatória do óleo essencial de V. curassavica vem sendo avaliada há décadas frente ao modelo de edema de pata induzido por carragenina em ratos. O tratamento com óleo essencial por via tópica atenuou o edema de pata induzido e diminuiu a liberação de vários mediadores inflamatórios[35-38]. Passos et al.[39] avaliaram ainda o efeito do óleo essencial por administração oral, e perceberam resultados interessantes de acordo com a avaliação em modelos de inflamação em ratos e camundongos. Os resultados apresentados pelos sesquiterpenos α-humuleno e trans-cariofileno parecem representar os principais componentes ativos de ação anti-inflamatória, sendo eficazes na redução do edema de pata induzido por carragenina em todos os intervalos de tempo avaliados. Os resultados indicaram que o óleo essencial é eficaz em interferir no TNF-α, mas não interfere na produção de IL-1. Há várias estratégias terapêuticas baseadas na inibição da produção de TNF-α bem-sucedidas no tratamento clínico de doenças inflamatórias crônicas[40-41].
Fernandes et al.[42] demonstraram que o α-humuleno inibe a produção de TNF-α e IL-1β, enquanto o trans-cariofileno inibe apenas o TNF-α. Ambos os sesquiterpenos isolados do óleo essencial de V. curassavica demonstraram capacidade de inibir PGE2, por via oral, a 50 mg/kg, após 1 hora de tratamento. Bodini et al.[43] mostraram que o extrato de V. curassavica inibe a enzima ciclo-oxigenase 2 (COX-2) em 90,5% em todas as concentrações testadas (0,25, 0,50 e 0,75 mg/filme de dissolução oral (FDO)). Em contrapartida, Passos et al.[39] demonstraram que o óleo essencial não apresentou efeito significativo na ciclo-oxigenase 1 (COX-1) ou COX-2; apenas os compostos isolados inibiram a atividade da COX-2[42]. O mecanismo de ação com relação à COX-2 e a iNOS ainda é incerto.
Os estudos farmacológicos investigando as propriedades antiartríticas e anti-inflamatórias dos extratos ou óleos essenciais de Varronia curassavica estão compilados na TABELA 1.
| Amostra | Objetivo experimental | Principais resultados | Autores |
|---|---|---|---|
| Óleo essencial | Avaliar as propriedades anti-inflamatórias e antialérgicas do óleo essencial de V. curassavica (300-600 mg/kg, v.o.) e seus componentes ativos em ratos e camundongos | – Redução significativa no edema de pata de camundongo induzido por vários mediadores da inflamação, como bradicinina, substância P, histamina e fator de ativação plaquetária com 300 mg/kg (v.o.); – Redução significativa dos níveis de TNF-α (62%) com 600 mg/kg (v.o.); – Após a injeção de carragenina, nos tempos 0,5, 1, 2 e 4h, na dose de 50 mg/kg (v.o.), houve inibição do edema de pata de 58, 53, 69 e 40% (α-humuleno), e de 47, 55, 79 e 28% (trans-cariofileno). |
[39] |
| Óleo essencial | Avaliar as propriedades anti-inflamatórias dos sesquiterpenos isolados do óleo essencial de V. curassavica, α-humuleno e (−)-trans-cariofileno, em ratos e camundongos | – Redução da formação de edema induzido por carragenina (300 μg/pata) com α-humuleno e (−)-trans-cariofileno após, respectivamente, 30 min (54% e 47%), 60 min (53% e 56%), 120 min (72% e 79%) e 240 min (41% e 38%) da administração; - Redução do edema induzido por PAF ou bradicinina (ambos 3 nmol/pata), e apenas α-humuleno reduziu o edema de pata induzido por histamina (100 nmol/pata) em camundongos; – Apenas (−)-trans-cariofileno (100 mg/kg) reduziu significativamente a atividade da mieloperoxidase (MPO) (52%); – O tratamento oral de α-humuleno causou redução significativa de IL-1β (35%) e TNF-α (54%) em carragenina (300 μg/pata), enquanto (-)-trans-cariofileno não alterou a produção de IL-1β, ao passo que apresentou um efeito inibitório significativo no aumento de TNF-α (79%); – Tratamento oral com α-humuleno e (−)-trans-cariofileno (50 mg/kg, 1 h) apresentou significativa inibição da produção de PGE2 após injeção de carragenina (55 e 78%, respectivamente) e inibição da expressão de COX-2; - O aumento da expressão de iNOS induzido por carragenina também foi fortemente inibida pelos sesquiterpenos isolados. |
[42] |
| Extrato etanólico de folhas e caule | Avaliar a capacidade antioxidante e anti-inflamatória de filme de dissolução oral (FDO) com diferentes concentrações de extrato etanólico de V. curassavica | – 90,5% de inibição da enzima COX-2 com extrato de V. curassavica; – Filmes com diferentes concentrações (0,25; 0,50 e 0,75 mg de flavonoides/FDO) também apresentaram alta capacidade inibitória de COX-2: 71%; 80,8% e 87,5%, respectivamente. |
[43] |
| Extrato Pterodon pubescens (Pp), óleo essencial V. curassavica (Vc) e combinações A25 = 25% Vc (41,25 mg/kg) + 75% Pp (48,75 mg/kg); A50 = 50% Vc (82,5 mg/kg) + 50% Pp (32,5 mg/kg); A75 = 75% Vc (123,75 mg/kg) + 25% Pp (16,25 mg/kg); A100 = 100% Vc (165 mg/kg) + 100% Pp (65 mg/kg); A200 = 200% Vc (330 mg/kg) + 200% Pp (130 mg/kg) |
Avaliar o efeito farmacológico da associação de extrato bruto dos frutos de Pterodon pubescens com o óleo essencial de V. curassavica em modelos experimentais de antinocicepção e anti-inflamatórios | – Em grupos tratados com os extratos separadamente, as doses de 32,5 e 65 mg/kg de Pp apresentaram inibição das contorções abdominais induzidas por ácido acético de 29% e 48%, respectivamente, enquanto 82,5 e 165 mg/kg de Vc mostraram inibição de 31% e 47%, respectivamente; - A25, A50, A75, A100 e A200 apresentaram inibição das contorções abdominais induzidas por ácido acético de 66%, 70%, 65%, 73% e 74%, respectivamente; – Todas as associações mostraram eficácia significativa contra a nocicepção causada pela injeção de formalina na fase inflamatória. As inibições foram de 51%; 70%; 56%; 66% e 62% para A25, A50, A75, A100 e A200, respectivamente. – A50, A100 e A200 não demonstraram eficácia significativa contra a nocicepção nos modelos de placa quente e movimento de cauda; – Inibição de 19%, 23% e 39% do edema de pata induzido por carragenina após 6h de indução para A50, A100 e A200; associações nas três doses testadas também mostraram redução significativa do edema de pata induzido por PGE2 em diferentes momentos de avaliação após administração de PGE2. |
[44] |
Garra-do-diabo (Harpagophytum procumbens (Burch.) DC. ex Meisn., Pedaliaceae)
Popularmente conhecida como garra-do-diabo, é uma planta nativa de países do sul da África, rasteira, perene, com raiz medindo de 20 a 50 cm de comprimento. Suas folhas são verde-acinzentadas e podem ser divididas irregularmente em diversos lobos. As flores tubulares são violetas, amarelas ou amarelas violáceas.
O nome garra-do-diabo é oriundo de seus frutos, que são cobertos por pequenos relevos semelhantes a garras. O nome "Harpagophytum" vem do grego 'harpago', que significa 'um gancho'. O epíteto específico procumbens significa prostrado, referindo-se aos caules rastejantes da planta[45].
A parte usada medicinalmente são as raízes tuberosas secundárias, que armazenam água para sobreviver às estações secas da região. As raízes são colhidas e, posteriormente, cortadas para uso terapêutico[46]. Harpagophytum procubens tem sido utilizada há séculos por povos tradicionais para o tratamento de diversas condições, principalmente como analgésico, tratamento para complicações de gravidez, pomada para alívio de doenças dermatológicas, tratamento de doenças do sangue, nas dores pós-parto, dores associadas à dismenorreia e dores reumáticas e musculoesqueléticas de maneira geral[47]. Preparações na forma de unguentos são ainda usadas para feridas, furúnculos e entorses[45].
As substâncias ativas da raiz tuberosa da garra-do-diabo são os iridoides glicosilados, compreendendo aproximadamente 3% da droga vegetal[48]. Entre os principais iridoides glicosilados estão o harpagosídeo (éster do ácido cinâmico) - considerado o marcador químico, procumbídeo, harpagida e 8-p-cumaril-harpagida[49].
No Brasil, atualmente existem dois medicamentos fitoterápicos à base de garra-do-diabo registrados na ANVISA. O primeiro é na forma de comprimidos revestidos de 400 mg, cujo insumo ativo utilizado para a sua fabricação é o extrato seco de H. procumbens contendo 5% de harpagosídeo. Este medicamento é indicado no tratamento de quadros reumatológicos, tais como AR e OA, assim como no tratamento de dores lombares, dores musculares e demais dores que acometem os ossos e as articulações[50]. Já o segundo utiliza 450 mg de extrato seco de raiz de H. procumbens, com 4% de harpagosídeo por comprimido revestido. É um medicamento fitoterápico anti-inflamatório recomendado para os quadros reumáticos acompanhados de dor (AR, OA e lombalgia)[51].
A garra-do-diabo faz parte da Relação Nacional de Medicamentos Essenciais[52], integrando o rol de 12 fitoterápicos disponíveis no Sistema Único de Saúde (SUS). No Formulário de Fitoterápicos da Farmacopeia Brasileira, 2ª edição, é indicado como auxiliar no alívio da dor articular leve[28].
Os produtos à base de H. procumbens parecem ser bem tolerados em ensaios clínicos no tratamento de condições osteomusculares. Ensaios clínicos não relatam eventos adversos graves e a maior parte dos eventos adversos foi de distúrbios gastrointestinais leves: inchaço ou dispepsia[53-54]. O efeito analgésico é considerado leve a moderado e sua utilização continua sendo alvo de discussão[55], sendo necessários mais estudos farmacológicos e toxicológicos visando elucidação do mecanismo de ação para atestar a segurança dos produtos[56]. Considera-se o harpagosídeo como principal ativo em relação à ação anti-inflamatória e seu teor usado para padronizar produtos, segundo a farmacopeia europeia, é de pelo menos 1,2%[57].
O uso a longo prazo parece ser bem tolerado e não foram relatadas interações medicamentosas para condições reumáticas, apoiando o uso de H. procumbens como terapia adjunta. Apesar disso, Unger e Frank[58] demonstraram através de estudo de triagem in vitro que H. procumbens, juntamente com raiz forte, óleo de hortelã-pimenta, óleo de eucalipto, flor de trevo vermelho e suco de toranja, é um inibidor do citocromo P450. Essas enzimas são encontradas predominantemente no fígado e trabalham na metabolização de drogas através da oxidação de grupos funcionais. Isso faria com que os produtos à base de H. procumbens competissem com outras drogas pelo sítio ativo de ligação, podendo ocasionar interações. Já é citado na literatura que H. procumbens é contraindicado para pacientes que fazem uso de anti-hipertensivos, anticoagulantes e medicamentos antidiabéticos[59]. Não há relatos de hepatotoxicidade associada à H. procumbens, apesar disso, os estudos precisam investigar a eficácia e segurança da garra-do-diabo nas funções hepáticas[60].
Chantre et al.[61] realizaram um estudo comparando a eficácia e tolerabilidade de um medicamento fitoterápico à base de H. procumbens à diacereína, um AINE usado para o tratamento da artrite, e foi constatado que o fitoterápico se comparava em eficácia e apresentou segurança maior quando comparado a aquele fármaco.
Lanhers et al.[62] encontraram resultados que entravam em contradição com o que já havia descrito na literatura, onde outros autores não encontraram efeitos anti-inflamatórios significativos no teste de edema induzido por carragenina. Parece que estes extratos são inativos por administração oral, mas quando administrados via intraperitoneal apresentam efeitos dose-dependentes. Entretanto, o harpagosídeo provavelmente não é o ativo responsável pela ação anti-inflamatória, já que não exerceu efeitos no edema de pata induzido por carragenina quando testado sozinho. O harpagosídeo, sozinho, pode não explicar as propriedades analgésicas da garra-do-diabo, fazendo com que a sinergia com os outros componentes seja responsável pela ação. Os iridoides precisam ser mais investigados nesse caso, para elucidar o mecanismo de ação da planta.
Mahomed e Ojewole[63] avaliaram o efeito analgésico de extrato aquoso de raiz secundária de H. procumbens em camundongos, usando testes de placa quente e de ácido acético, além dos efeitos anti-inflamatórios. O extrato aquoso da raiz (50-800 mg) produziu efeitos analgésicos significativos na dor nociceptiva induzida térmica e quimicamente nos camundongos. O extrato da raiz indicou propriedades analgésicas e anti-inflamatórias de forma dose-dependente, dando suporte ao uso popular para o manejo e controle da dor.
Anauate et al.[64] estudaram a eficácia de H. procumbens e U. tomentosa em 40 pacientes do sexo feminino com OA de coluna lombar e a ação dos metabólitos sobre COX-1 e COX-2 por ensaio ex vivo. O tratamento apresentou diminuição de COX-2 estimulado com LPS e aumento de atividade da COX-1. Como o estudo usou 2 g de extrato hidroalcóolico de garra-do-diabo/dia manipulado em farmácia magistral, não é possível avaliar qual ativo responsável pela ação anti-inflamatória.
Já foram realizados diversos estudos para elucidação do mecanismo de ação da atividade anti-inflamatória do harpagosídeo. Estudos in vitro se concentram na ciclo-oxigenase (COX), iNOS e o fator nuclear k-β (NF-kβ). Alguns estudos demonstram a atividade por inibição da expressão de COX-1 e COX-2, da atividade de iNOS e/ou translocação nuclear de NF-kβ e redução da produção de mediadores inflamatórios como TNF-α, PGE2, IFN-γ, IL-16 e IL-6[57, 65-68].
Chung et al.[69] estudaram o efeito antiosteoporótico em células in vitro e in vivo, vendo também que o harpagosídeo e a harpagida tem ação no tratamento da perda óssea e osteoporose pós-menopausa. A harpagida é um inibidor enzimático adequado e um ligante moderado de receptor acoplado à proteína G, modulador de canal iônico, ligante de receptor nuclear e inibidor de protease, enquanto harpagosídeo é ligante moderado de receptor acoplado à proteína G, ligante de receptor nuclear e inibidor de protease[70].
Mariano et al.[71] verificaram que a atividade anti-inflamatória do harpagosídeo é mediada pela inibição das enzimas COX-1 e COX-2, diminuindo também a liberação de citocinas e NO. Zhang et al.[72] demonstraram que o harpagosídeo precisa ser hidrolisado a um metabólito bioativo para ação anti-inflamatória. Apesar disso, a ação do harpagosídeo não explica a de todos os componentes de H. procumbens, o que sugere que outros compostos também estejam envolvidos na ação.
Um recente ensaio clínico randomizado controlado foi publicado por Farpour et al.[73], com 38 pacientes entre 40 e 60 anos com artrite de joelho. Esses pacientes foram divididos em dois grupos: A (20 pacientes) e B (18 pacientes). O grupo A seguiu com o tratamento a base de 2 comprimidos de 480 mg de H. procumbens por um mês e o grupo B seguiu, por 15 dias, com o tratamento a base de 15 mg de meloxicam. 8 pacientes foram excluídos durante o período de acompanhamento, seguindo-se com 15 pacientes em cada grupo. Ao final do estudo foi concluído que H. procumbens é um tratamento eficaz e adequado no manejo da dor e melhora da função em pacientes com artrite de joelho a curto prazo, podendo ser um bom substituto para AINES, sem efeitos colaterais graves.
Os estudos farmacológicos investigando as propriedades antiartríticas e anti-inflamatórias dos extratos ou substâncias isoladas de H. procumbens estão compilados na TABELA 2.
| Amostra | Objetivo experimental | Principais resultados | Autores |
|---|---|---|---|
| Harpagosídeo (HARP) | Avaliar o mecanismo de ação do HARP, usando células de hepatocarcinoma humano HepG2 e macrófagos RAW 264.7 | – Redução da liberação de NO em células tratadas com LPS de maneira dose-dependente com IC50 de 39,8 µM; – Inibição significativa da indução de COX-2 e iNOS mRNA bem como da expressão proteica correspondente em células tratadas com LPS com 200 µM de HARP; – Inibição de forma dose-dependente da atividade transcricional de NF-κB induzida por LPS em células RAW 264.7 transfectadas, com um IC50 de 96,4 µM de HARP. |
[74] |
| Extrato etanólico de raiz | Avaliar o potencial anti-inflamatório e analgésico de H. procumbens em modelo de rato (n=10/grupo) com artrite induzida por adjuvante de Freund | – Redução significativa do edema de pata direita em todos os animais do grupo experimental de forma dose-dependente; – Redução da altura da pata com a dose de 100 mg/kg; – Todas as doses diminuíram a medida da articulação em relação ao grupo controle; – No tratamento crônico, a partir do 24º dia após a indução da artrite, os grupos controle e 100 mg/kg de extrato diferiram entre si; - O grupo 100 mg/kg apresentou redução do edema da pata nos 7º, 29º, 34º e 40º dias com artrite. |
[75] |
| Doloteffin® | Estudo clínico para avaliar medidas de resultados durante o tratamento com Doloteffin® (extrato aquoso de Harpagophytum) em pacientes com dor na região lombar (n= 104), joelho (n= 85) ou quadril (n = 61) por 8 semanas em doses que forneciam 60 mg de HARP/dia | – Maior percentual de dor no grupo lombar e 53% dos pacientes tinham dor irradiando para uma ou ambas as pernas; – Sintomas bilaterais em 75% dos pacientes do joelho e 59% dos pacientes do quadril; – Melhora das medidas na semana 4 e depois na semana 8 em todos os grupos; após 8 semanas, o grupo lombar melhorou em 23% e seu componente de dor e a pontuação de três itens em cerca de 30% bem como o índice total de dor em 35%; – Melhora de 37% e 35% das pontuações mediana de WOMAC¹ para grupos joelho e quadril, respectivamente, e seus componentes de dor em 40% e 45%, a pontuação de três itens em 30% e 44%, e os índices totais de dor em 38% e 54%; – Melhora das pontuações médias semanais de dor em todos os grupos ao longo do tratamento; – Para as medidas genéricas, após 8 semanas com Doloteffin®, houve melhora de 37% nos pacientes do grupo lombar e cerca de 30% nos pacientes dos grupos joelho e quadril. |
[76] |
| Doloteffin® | Estudo clínico para acompanhar o tratamento duplo-cego com os pacientes previamente estudados pelos mesmos pequisadores com Doloteffin® (ex-D) (extrato aquoso de Harpagophytum) (n=38) e rofecoxibe (ex-R) (n=35) para a dor lombar crônica | – Ligeira melhora adicional durante o acompanhamento, mas nenhuma diferença significativa entre ex-D e ex-R; – Dos 21.761 pacientes-dia, os respectivos percentuais sem, leve, moderada, intensa e dor excruciante foram 28%, 39%, 22%, 8,5% e 1,5%. |
[54] |
| Doloteffin® | Estudo clínico para avaliar o benefício do tratamento com Doloteffin® em pacientes (n= 114) - dor lombar crônica inespecífica (n = 56), osteoartrite do joelho (n= 37) e dor osteoartrítica do quadril (n= 21) por até 54 semanas | – Redução significativa das pontuações de resultados em análises de variâncias separadas; – Resposta durante o tratamento alcançada em 75% dos pacientes, e estes avaliaram o tratamento como ''bom'' ou ''muito bom''. |
[77] |
| Culturas de células de garra-do-diabo (glicosídeos feniletanoides verbascosídeo, leucosceptosídeo A, β-OH-verbascosídeo e martinosídeo) | Avaliar, através de suspensão de células e culturas de raízes pilosas transformadas por Agrobacterium rhizogenes, a atividade anti-inflamatória das culturas de células da garra-do-diabo e glicosídeos testados em macrófagos murinos isolados para estudar seus efeitos na liberação de óxido nítrico (NO) e citocinas (TNF-α, IL-6) e na expressão de COX- 1 e COX-2 *CME-CB= biomassa celular, extrato metanólico bruto de cultura em suspensão celular; PF-CB= fração feniletanoide de cultura em suspensão celular; CME-HR= extrato metanólico bruto de cultura de raízes pilosas; PF-HR= fração feniletanoide da cultura |
– Redução do acúmulo de NO nos sobrenadantes de macrófagos estimulados por LPS em todas as frações e compostos puros, exceto o CME-HR; – Inibição significativa de LPS e redução da produção de TNF-α por macrófagos com CME-CB, PF-CB, CME-HR; – CME-CB e PF-CB suprimiram a liberação de IL-6 por células estimuladas, mais substancialmente por PF-HR e martinosídeo puro; – Todas as frações testadas e substâncias purificadas inibiram fortemente a expressão de COX-1 e COX-2 por macrófagos estimulados com PMA/ionomicina e os extratos e frações de ambos os sistemas in vitro tiveram atividade de inibição de COX-2 para HARP puro e verbascosídeo; – Verbascosídeo apresentou os efeitos inibitórios mais fortes; β-OH-verbascosídeo, harpagida e HARP apresentaram supressão moderada, na concentração de 1 mg/ml; leucosceptosídeo A mostrou efeitos fracos e nenhum efeito foi observado para martinosídeo. |
[78] |
| Extrato aquoso de raiz | Investigar os efeitos de H. procumbens contra expressões de COX-2 e iNOS estimuladas por LPS em células da linhagem celular de fibroblastos de camundongo L929 por ensaio de brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio, transcrição reversa seguida de reação em cadeia da polimerase, imunoensaio de PGE2 e detecção de NO | – Supressão da expressão de COX-1 com 1 mg/ml de H. procumbens, sem efeito significativo com 0,1 mg/ml; – Aumento significativo do nível de mRNA de COX-2 após o tratamento com 5 µg/ml de LPS por 24 h para 11,96, e diminuição para 4,59 e 0,95 com H. procumbens a 0,1 e 1 mg/ml, respectivamente; – Aumento acentuado nos níveis de mRNA de iNOS para 9,47 após o tratamento com 5 µg/ml de LPS por 24 h, enquanto diminuiu para 8,01 e 6,39 com H. procumbens a 0,1 e 1 mg/ml; – Aumento da quantidade de PGE2 pelo imunoensaio de PGE2, após 24h de exposição ao LPS, de 5,00 para 71,00 pg/poço, enquanto diminuiu para 38,00 e 22,00 pg/poço com H. procumbens a 0,1 e 1 mg/ml; – Aumento da quantidade de nitrito no ensaio de detecção de NO, após 24 h de exposição ao LPS, de 0,11 para 16,02 µM, e diminuição para 10,54 e 7,41 µM com H. procumbens a 0,1 e 1 mg/ml |
[79] |
| Extrato aquoso da raiz | Avaliar a regulação negativa da expressão de iNOS em células mesangiais de ratos por extratos de H. procumbens usando dois extratos diferentes, contendo 8,9% (extrato 1) e 27% (extrato 2) de HARP | – Inibição dose-dependente significativa em concentrações superiores a 0,1 mg/ml da formação de nitrito estimulado por IL-1β; a expressão de iNOS e nível de proteína também foram afetados pelos extratos de forma dose-dependente; – Potente inibição do promotor iNOS estimulado por IL-1β no ensaio de luciferase dupla; – Redução significativa da formação de nitrito estimulado por IL-1β e nível de estado estacionário de mRNA de iNOS de 20% com 0,3 mg/ml e 80-100% com 1 mg/ml de HARP; extrato 1 apresentou redução de cerca de 20-30% quando usado 0,6 mg/ml e uma inibição de 70-80% com 1 mg/ml; 90 mg/ml de HARP puro não inibiu expressão de iNOS; – Efeito inibitório na formação de nitrito e na expressão da proteína iNOS em cerca de 50% pelo extrato sem HARP; – Extrato 1 e 2, bem como extrato sem HARP, impediram parcialmente a translocação de p65 estimulada por IL-1β para o núcleo e HARP não teve efeito. |
[80] |
| HARP | Investigar os efeitos do HARP na expressão de adipocinas inflamatórias induzidas pelo TNF-α | – Inibição do aumento induzido por TNF-α na secreção de IL-6, PAI-1 e MCP-1 de maneira dose-dependente com IC50 de 14,04, 18,68 e 12,18 µM, respectivamente; – Com 20 µM de HARP, a produção de mRNA de IL-6, PAI-1 e MCP-1 foi suprimida em 75,5%, 59,4% e 69,5%, respectivamente. |
[81] |
| Harpagida (1), HARP (2) e produto hidrolisado de harpagida (H-harpagida, 3) | Avaliar os efeitos de produtos hidrolisados de β-glucosidase de (1), (2) e (3) na COX-2 in vitro | – Sem inibição das isoenzimas de COX com 1 e 2 nas concentrações 2,5-100 µM, enquanto 3 inibiu significativamente a atividade de COX-2 de maneira dose-dependente com o valor de IC50 de 43,3 µM; – Inibição da expressão de mRNA de COX-2 intensificada por LPS em 3, com taxa máxima de inibição de 47,6% a 100 µM, sem inibição para 1 e 2; – Sem efeito inibitório sobre a produção de TNF-α e NO a 2,5-100 µM para 1, 2 e 3; – 3 pode ainda se ligar bem ao domínio ativo COX-2 através de interações hidrofóbicas e de ligação de hidrogênio. |
[72] |
| Extrato etanólico – HARP (1), harpagida (2), 8-O-p-cumaroil- harpagida (3) e verbascosídeo (4) | Avaliar, em modelo de pele ex vivo, o efeito anti-inflamatório transcutâneo do extrato de H. procumbens aplicado topicamente | – Permeação da pele em todos os glicosídeos, com níveis de harpagida mais altos que os glicosídeos 1, 3 e 4; – Redução significativa dos níveis de PGE2 por solução saturada de H. procumbens, sem efeito significativo pelos constituintes; – A solução saturada de H. procumbens levou a um declínio considerável nas enzimas nos tecidos epiteliais em pele de suínos em comparação com o controle em 6 h. |
[82] |
| HARP (1) e harpagida (2) | Avaliar o mecanismo de inibição molecular de (1) e (2) sobre COX-2 | – Interação de 1 e 2 com COX-2 (energias de ligação: –9,13 e –5,53 kcal/mol, respectivamente); - Interações estabilizadas para 1 e 2 dentro do sítio ativo da COX-2 por 7 e 10 ligações de hidrogênio. |
[70] |
| HARP (1) e harpagida (2) | Investigar a influência de 1 e 2 na secreção de TNF-α em células THP-1 indiferenciadas e diferenciadas sob condições inflamatórias | – Diminuição na secreção de TNF-α até 60% de maneira dose-dependente pela estimulação com 1; – Redução da concentração sérica de TNF-α para 50% no contexto de inflamação induzida por IFN-γ/LPS com 2; – Indução de aumento de duas vezes de TNF-α após 3 h e aumento de quatro vezes após 48 h pela estimulação de células THP-1 indiferenciadas com 1; – IFN-γ e LPS + 1 aumentou ainda mais a expressão de mRNA de TNF-α em até 13 vezes após 3 h e essa presença de 1 manteve os níveis de expressão de TNF-α altos por um período de 48 h; – Diminuição de quatro vezes para IFN-γ/LPS sozinho e expressão restante de 18 vezes combinado com 1 após 48 h na expressão de ICAM-1; - Após 48 h, 1 induziu níveis de expressão de mRNA de cerca de 12 vezes para L-selectina e 17 vezes para PSGL-1; - 2 prejudicou a expressão de ICAM-1 induzida por IFN-γ/LPS após 3 h, mas também manteve a expressão em um nível mais alto após 48h. |
[68] |
| Comprimidos de Harpagophytum (comprimidos de tintura de garra-do-diabo - 480 mg extrato seco), 2 comprimidos/dia | Estudo clínico de 8 semanas de duração (n= 259) para avaliar a eficácia, segurança e tolerabilidade do Harpagophytum no tratamento de outras condições reumáticas (OCR) | – Redução significativa desde a linha de base até a semana 4 e semana 8 dos escores médios globais para dor, rigidez e função, enquanto escores médios para dor na mão, punho, cotovelo, ombro, quadril, joelho e costas foram significativamente reduzidos desde o início até a semana 8 e os escores médios para dor em tecidos moles foram reduzidos desde o início (6,0) até a semana 8 (3,7); – Redução significativa das pontuações médias da subescala WOMAC desde o início até a semana 4 e semana 8 e escores médios para o Algofunctional Hand Osteoarthritis Index² foram significativamente reduzidos desde o início (6,5) até a semana 8 (4,5); – As distâncias médias dos dedos (da mão) para o solo foram significativamente reduzidas desde a linha de base (18,3) até a semana 8 (12,9); – Redução significativa de todos os escores médios da semana 1 para a semana 2 e semana 8 e pontuações médias para ambas as subescalas aumentaram significativamente desde a linha de base até a semana 4 e semana 8. |
[83] |
| Comprimido contendo 400 mg de extrato aquoso dos tubérculos secundários de garra-do-diabo (Doloteffin®), 3 vezes ao dia, 2 comprimidos | Avaliar a eficácia e segurança de um extrato aquoso dos tubérculos secundários de H. procumbens (Doloteffin® – 50 mg HARP) em pacientes (n= 75) com doenças reumáticas por 12 semanas | – Melhora contínua dos achados clínicos (dor à palpação, limitação da mobilidade, crepitação articular, edema e vermelhidão e estado geral); – Melhora relevante de cada subescala do WOMAC, bem como do índice total do WOMAC: 23,8% para dor, 22,2% para rigidez e 23,1% para função física. - A pontuação total do WOMAC foi reduzida em 22,9%. - Os escores da escala analógica visual foram reduzidos em 25,8% para dor real, 25,2% para dor média, 22,6% para pior dor e 24,5% para o escore total de dor e os médicos relataram melhora contínua dos achados clínicos típicos, como 45,5% para dor à palpação, 35% para limitação de mobilidade e 25,4% para crepitação articular. |
[84] |
| Comprimidos de H. procumbens (Teltonal®), 480 mg, 2 vezes ao dia | Estudo clínico para comparar a eficácia de H. procumbens (Teltonal®) 2x 480 mg (grupo A) com meloxicam 15 mg (grupo B) na redução da dor e melhora da função de pacientes com OA de joelho (n= 38) | – Sem diferença entre os grupos na escala analógica visual antes e 2, 4 e 8 semanas depois do tratamento. Em contrapartida, a taxa de redução da dor ao longo do tempo foi significativa; – Sem diferença estatisticamente significativa entre os grupos na semana 2, 4 e 8 após o tratamento do joelho, mas a taxa de melhora do desempenho ao longo do tempo em ambos os grupos foi significativa; – Sem diferença estatisticamente significativa na redução da pontuação total média de WOMAC nos grupos na semana 2, 4 e 8 de tratamento, enquanto a melhora na escala WOMAC geral do desempenho foi significativamente diferente nos grupos ao longo do tempo e após 8 semanas de tratamento ambos os grupos estavam satisfeitos com os tratamentos recebidos, novamente sem diferença estatisticamente significativa. |
[73] |
| ¹Subescala WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) é usada para avaliação de qualidade de vida em indivíduos com osteoartrite. ²Algofunctional Hand Osteoarthritis avalia dor, força muscular da mão, qualidade de vida relacionada à saúde e gravidade radiográfica na osteoartrite da mão. |
|||
Erva-de-são-joão (Hypericum perforatum L., Hypericaceae)
A erva-de-são-joão é uma erva/arbusto perene que cresce 40 a 80 m de altura com numerosos pares de ramos e flores amarelas, nativa da Europa e Ásia. Utilizada na medicina tradicional, é incluída no tratamento de icterícia, depressão, doenças hepáticas, cálculos na vesícula biliar, artrite reumatoide e outras condições inflamatórias[85]. Também é usada como aromatizante em alimentos e bebidas alcoólicas para preparar licores, principalmente digestivos e bitters tônicos[86-87].
H. perforatum é validada como agente antidepressivo para casos de depressão leve a moderada, principalmente através da inibição da recaptação de serotonina[88]. Existem diversos estudos sobre espécies de Hypericum, graças às atividades farmacológicas demonstradas dos seus componentes ativos isolados. Seus principais constituintes são: naftodiantronas, representadas principalmente por hipericina e pseudohipericina, derivados de floroglucinol, especialmente hiperforina, e flavonoides como quercetina, quercitrina, hiperosídeo e rutina. A hiperforina pode ter contribuição para a atividade antidepressiva, enquanto os flavonoides podem ter atividades antidepressiva e antioxidante[89]. A hiperforina demonstrou ser um componente antidepressivo importante no extrato de H. perforatum, cujo mecanismo de ação envolve também a inibição da captação neuronal de serotonina, norepinefrina e dopamina. Entretanto, ela também inibe a captação de ácido gama-aminobutírico (GABA) e L-glutamato[90].
Apesar do seu uso popular, a erva-de-são-joão pode levar a uma síndrome serotoninérgica com disfunção autonômica, rigidez muscular e alteração de estado mental quando combinada com drogas que também aumentam as concentrações plasmáticas de serotonina[91]. Uma vez que foram identificadas interações medicamentosas com erva-de-são-joão, é necessário investigar a segurança do uso da planta[89]. Várias interações clínicas significativas são descritas na literatura, incluindo varfarina, fenprocumona, ciclosporina, inibidores de protease do HIV, teofilina, digoxina e contraceptivos orais, resultando em diminuição da concentração ou do efeito dos fármacos. Essas interações são, provavelmente, graças à indução de isoenzimas do citocromo P450 CYP3A4, CYP2C9, CYP1A2 e da proteína de transporte P-glicoproteína por constituintes da erva-de-são-joão[92].
Savikin et al.[93] estudaram a ação anti-inflamatória de extratos etanólicos de H. perforatum e outras espécies por meio do teste de edema de pata induzido por carragenina. Os resultados indicaram que os extratos secos examinados de H. perforatum possuem atividade anti-inflamatória. Entretanto, não houve relação entre a quantidade de hipericina nos extratos com a atividade anti-inflamatória.
A hipericina é um dos principais ativos das espécies de Hypericum e seu papel na atividade anti-inflamatória de H. perforatum e outras espécies de Hypericum ainda não é completamente elucidado. Foi demonstrado que a hipericina in vitro inibe a ativação induzida pelo TNF-α do fator de transcrição NF-κB, que está envolvido na resposta imunológica e de inflamação. O NF-κB é ativado pelo estresse físico e oxidativo, por produtos químicos, vírus, radicais livres, bactérias, e citocinas inflamatórias, incluindo interleucinas (IL-1, IL-2, LTB4, TNF-α) e outros[94].
Também temos na literatura que o H. perforatum tem ação antioxidante de inibição da produção de radicais livres[95-96]. Por outro lado, sabe-se que em macrófagos e outros tipos celulares, citocinas como interferon gama e lipopolissacarídeo induzem a co-expressão de óxido nítrico sintase induzível (iNOS) e COX-2. Tanto iNOS quanto COX-2 são responsáveis pela produção de mediadores pró-inflamatórios, óxido nítrico e prostaglandinas[97-98]. Raso et al.[99] e Abdel-Salam[100], usando modelo de edema de pata induzido por carragenina em pequenos roedores, mostraram atividade anti-inflamatória significativa de H. perforatum, provavelmente causada pela inibição de iNOS[99,101] e expressão de COX-2 em macrófagos estimulados[99], efeito causado pela ação da quercetina[102]. Estes resultados sugerem que, em conjunto, os ativos das espécies de Hypericum são responsáveis por sua atividade anti-inflamatória.
Kumar et al.[103] averiguaram a atividade anti-inflamatória e analgésica nas doses de 100 e 200 mg/kg via oral do extrato etanólico aquoso padronizado a 50% com a variante indiana de H. perforatum. Foram usados edema de pata induzido por carragenina e granuloma induzido por bolinha de algodão como modelos para a atividade anti-inflamatória, enquanto movimento de cauda, placa quente e contorção induzida por ácido acético para avaliação da atividade analgésica, distinguindo a ação analgésica central e periférica. Foi visto que H. perforatum inibiu significativamente a resposta de contorção induzida pelo ácido acético e, também, potencializou a atividade da aspirina. Indometacina (20 mg/kg, i.p) foi usada como padrão anti-inflamatório e pentazocina (10 mg/kg, i.p) e aspirina (25 mg/kg, i.p) foram usados como analgésicos padrão. Foi visto que o extrato de H. perforatum apresentou atividade anti-inflamatória e analgésica significativa em ambas as doses, em todos os métodos utilizados. Estes achados sugerem que a erva-de-são-joão exerce efeito analgésico pela inibição da síntese ou ação das prostaglandinas.
Sun et al.[104] descreveram a astilbina como o principal ativo de H. perforatum e desenvolveram o trabalho com investigação do efeito da astilbina em condrócitos humanos e em camundongos. In vitro, foi visto que o pré-tratamento com astilbina inibe a superprodução induzida por LPS de citocinas ligadas à inflamação, como NO, PGE2, TNF-α e IL-6 e suprimiu, ainda, a superexpressão de enzimas inflamatórias como iNOS e COX-2. Por outro lado, a astilbina preveniu a degradação induzida por LPS da matriz extracelular pela regulação negativa de MMP13 – metaloproteinases de matriz 13 e ADAMTS5 – uma desintegrina e metaloproteinase com trombospondina 5. Inibe também a formação do complexo TLR4/MD-2/LPS, bloqueando a ativação induzida por LPS da cascata de sinalização TLR4/NF-κB. Nos estudos in vivo, astilbina demonstrou efeito condroprotetor nos modelos de camundongos com OA.
Jin et al.[16] investigaram o efeito do hiperosídeo em sinoviócitos semelhantes à FBS e o efeito na artrite induzida in vitro nas doses de 10, 50 e 100 μmol/L via i.p. por três semanas. Foi visto que o hiperosídeo inibiu a proliferação e migração induzida por LPS de forma dose-dependente. Além disso, o hiperosídeo também diminuiu a produção de TNF-α, IL-6, IL-1 e MMP-9 estimulada por LPS nas células e a fosforilação induzida por LPS de p65 e IκBα e suprimiu a translocação nuclear induzida por LPS de p65 e ligação de DNA de NF-κB nas células.
São demonstradas na TABELA 3 as evidências farmacológicas investigando as propriedades antiartríticas e anti-inflamatórias de H. perforatum.
| Amostra | Objetivo experimental | Principais resultados | Autores |
|---|---|---|---|
| Extrato etanólico de folhas de H. perforatum (SJW) + inclusão de ciclodextrina (SJW-CD), dispersão sólida (SJW-SD), emulsão seca (SJW-DE) e nanoemulsão (SJW-NE) | Desenvolver uma nova formulação de extrato de H. perforatum com o objetivo de melhora farmacocinética e efeito antinociceptivo | – SJW-NE foi considerada a forma mais estável e após sua administração oral (5,2 mg hiperforina/kg) em camundongos, foi observada maior exposição à hiperforina no plasma (1188 nM·h) e no cérebro (52,9 pmol/g tecido·h) com aumentos de 2,8 e 1,3 vezes da área sob a curva de concentração de 0 a 6 h em comparação com os do extrato SJW no plasma (417 nM·h) e no cérebro (41,6 pmol/g tecido·h) no cérebro; – Redução significativa do tempo de lambida/mordida no teste de formalina, com redução de 14% em 3h na administração de SJW, e a administração de SJW-NE também reduziu 14% em 0,5 h; 21% em 1h e 30% em 3h. O grupo SJW-NE exibiu uma resposta menor (18% menor) do que o grupo SJW 3h após a administração; – Na segunda fase, redução significativa (-37%) após 1h de administração do extrato de SJW e 39% em 3 h; a administração de SJW-NE também reduziu significativamente (17%) em 0,5 h, 39% em 1 h e 38% em 3 h. SJW-NE ainda reduziu significativamente o tempo em 20% em 0,5 h, além de obter uma redução significativa em 0,5 h na primeira fase. |
[105] |
| Extrato de H. perforatum e substâncias isoladas (pseudo-hipericina (1), quercetina (2), amentoflavona (3), ácido clorogênico (4) | Investigar o impacto do extrato de H. perforatum e os quatro compostos em mediadores inflamatórios e citocinas | – Comprometimento significativo da inibição de PEG2 e NO, bem como diminuição de IL-6 e TNF-α pela supressão do gene SOCS3 pelos 4 compostos; – Diminuição de IL-6 e TNF-α pelos quatro compostos, enquanto o extrato e extrato + compostos diminuíram a IL-1β; – Sem alteração na expressão de COX-2 e NO sintase induzível pelos tratamentos, enquanto a atividade da COX-2 foi diminuída pelo extrato e pelos quatro compostos e aumentada pela supressão de SOCS3. |
[106] |
| Hiperosídeo | Investigar o efeito do hiperosídeo na regulação positiva mediada por TNF-α de VCAM-1 em células MOVAS-1 | – Aumento significativo da expressão de mRNA de VCAM-1 após exposição a TNF-α e supressão quando hiperosídeo (1-10 μg/mL) foi adicionado; – Reversão significativa das alterações mediadas por TNF-α em p65 e IκB com hiperosídeo (1 e 10 μg/mL); – Supressão significativa da ativação mediada por TNF-α de 3 MAPKs e NF-κB, bem como a expressão de VCAM-1 induzida por TNF-α e a taxa de adesão de monócitos no grupo tratado com TNF-α e hiperosídeo foi significativamente reduzida (50,8%, 34,2% e 16,6 %). |
[107] |
| Hiperosídeo (20 mg/kg) | Avaliar os efeitos antiartríticos do hiperosídeo com o objetivo de delinear o potencial mecanismo a nível celular por condrócitos murinos estimulados por IL-1β | – Inibição da expressão induzida por IL-1β de iNOS e COX-2; – Atenuação da destruição da matriz extracelular induzida por IL-1β, regulando negativamente a expressão de MMPs e ADAMTS5 e, ao mesmo tempo, regulando positivamente a expressão de colágeno II, agrecano e SOX9; – Redução da superprodução de EROs induzida por IL-1β e a apoptose de condrócitos com pré-tratamento com hiperosídeo, assim como efeitos anti-inflamatórios, suprimindo parcialmente as vias de sinalização PI3K/AKT/NF-κB e MAPK, aumentando o Nrf2/HO-1 para limitar a ativação do NF-κB. |
[104] |
Canela-de-velho (Miconia albicans (Sw.) Steud., Melastomataceae)
Miconia albicans, popularmente conhecida como canela-de-velho, folha-branca ou pau-de-tucano, está presente em diversos países[108]. Encontrada em florestas tropicais e savanas, é um arbusto que pode atingir de 1 a 4 m, com sementes que possuem cotilédones foliáceos. Apresenta folhas simples, discolores, opostas, com nervuras secundárias e margem dentada. Apresenta frutos rosados, em forma de baga [109].
O chá das folhas e pomadas de M. albicans são amplamente usados pela população para o tratamento de dores articulares. É popularmente usada para o tratamento de OA, AR, dores nas articulações e anti-inflamatório para distúrbios intestinais[109,110]. É também usada para purificação do sangue, tanto interna quanto externamente[109]. Entretanto, ainda existem dúvidas sobre a segurança e eficácia de seu uso.
A ANVISA proibiu, através da resolução RE nº 400, de 16 de fevereiro de 2017[111], a fabricação, distribuição e comercialização de um produto à base de M. albicans, por não possuir registro, cadastro ou notificação na agência. O produto tinha M. albicans em sua formulação, mas não fornecia informações sobre qual parte da planta era usada.
Cremes massageadores com o nome canela-de-velho são amplamente vendidos com a promessa de resultado imediato e apelo para o público mais velho. Greenhalgh[112] realizou um levantamento observando que apenas dois produtos de uso externo (pomada, creme) continham extrato de M. albicans e que apenas cosméticos de uso externo são registrados na Anvisa. Popularmente vemos cápsulas, pós, folhas e garrafadas sendo vendidos em feiras e lojas de produtos naturais, que fazem a venda desses produtos como suplementos alimentares, os quais são isentos dos rigores sanitários. É necessário que os órgãos reguladores façam inspeções para controle e recolhimento da venda desses produtos já que não garantem segurança e eficácia ao consumidor.
Existem poucos estudos sobre M. albicans associados ao seu uso e atividade anti-inflamatória e analgésica. Estudos anteriores demonstram os compostos isolados com possível mecanismos analgésicos e anti-inflamatórios, entre eles esteroides, triterpenos (ácido ursólico e oleanólico) e flavonoides[113-115].
Os triterpenos vêm sendo relacionados à inibição de liberação da histamina por mastócitos e inibição de atividade de lipoxigenase e ciclo-oxigenase (COX), reduzindo fatores inflamatórios que são produzidos na cascata de ácido araquidônico, como a síntese e liberação de prostaglandinas E2 (PGE2) e supressão de leucotrienos B[116]. O ácido oleanólico parece regular a atividade, secreção e expressão gênica de MMP-3, atuando diretamente nos condrócitos articulares; seu efeito condroprotetor é sustentado pela regulação da expressão gênica de proteases envolvidas na destruição da cartilagem articular na osteoartrite[116]. Ainda conta com compostos fenólicos como quercetina, quercetina-3-O-glicosídeo, rutina, 3-(E)-p-cumaroil-α-amirina e α-amirina, ácido epi-betulínico, o ácido ursólico e ácido epi-ursólico. Foi observada atividade antioxidante do extrato das folhas de M. albicans usando a quercetina como substância padrão [113].
Vasconcelos et al.[114] averiguaram in vitro as atividades analgésicas e anti-inflamatórias do ácido ursólico (AU) e ácido oleanólico (OA), os principais ativos em mistura no extrato diclorometânico das partes aéreas de M. albicans,como forma de investigar se esses compostos eram responsáveis pela ação anti-inflamatória e analgésica da canela-de-velho. O AU inibiu a constrição abdominal de forma dose-dependente, com resultado semelhante à administração de ácido acetilsalicílico 100 mg. AU e OA ainda apresentaram efeito anti-inflamatório significativo na dose de 40 mg. A mistura isolada 65% AU + 35% OA não apresentou atividade analgésica e anti-inflamatória significativa. Pode-se considerar que AU e OA foram efetivos com baixa ação, sugerindo que outros compostos sejam responsáveis pela atividade de M. albicans, já que o extrato bruto apresentou boa atividade.
Serpeloni et al.[117] avaliaram a anti-clastogenicidade de extratos de espécies do gênero Miconia (M. albicans, M. cabucu, M. rubiginosa e M. stenostachya) através de micronúcleo. Somente M. rubiginosa e M. stenostachya apresentaram efeitos protetores.
Quintans-Júnior et al.[118] avaliaram in vivo o perfil antiartrítico e anti-inflamatório de extrato etanólico de folhas de M. albicans em doses de 50 e 100 mg/kg via oral em camundongos. Foram identificados 23 compostos por HPLC-DAD-ESI-MS/MS, incluindo rutina, que foi escolhida como marcador analítico. Ambas as doses do extrato reduziram significativamente a migração de leucócitos no modelo de pleurisia e reduziram os níveis de TNF-α e IL-1β no lavado pleural. No modelo animal houve redução significativa dos comportamentos nociceptivos e hiperalgésicos. Verificou-se melhora significativa na mobilidade no teste de campo aberto (dose de 100 mg), aumento significativo da força de preensão da pata traseira, e, ainda, redução do diâmetro do edema de joelho ipsilateral induzido, o qual foi relacionado a níveis reduzidos de IL-6 e TNF-α na articulação do joelho. Não foi encontrada lesão hepática no tratamento crônico, demonstrando ainda segurança no tratamento. Esses resultados colaboram para o uso da canela-de-velho nos sintomas da AR.
Gomes et al. [119] realizaram o primeiro estudo clínico com 24 pacientes com OA, de 40 anos de idade ou mais. Observaram que M. albicans apresenta efeitos analgésicos e anti-inflamatórios no tratamento de pacientes com OA de joelho em virtude da diminuição dos escores de dor, melhora da função e diminuição da efusão articular na maioria dos pacientes estudados. Entretanto, o estudo foi realizado em apenas 9 pacientes. Mais estudos clínicos são necessários para desenvolvimento de terapia eficaz e segura.
Devido ao uso difundido de canela-de-velho e poucos dados da literatura, reforça-se a importância de novos estudos para comprovação da eficácia e segurança da planta.
Na TABELA 4 é possível encontrar os poucos estudos farmacológicos investigando as propriedades antiartríticas e anti-inflamatórias de M. albicans.
| Amostra | Objetivo experimental | Principais resultados | Autores |
|---|---|---|---|
| Extrato de frutos de M. albicans (EFMA) | Avaliar o perfil químico do extrato dos frutos (EFMA) e suas atividades antioxidante, anti-inflamatória e antitumoral, bem como sua toxicidade | – Redução significativa da intensidade do edema de orelha em 58,48% na dose de 2,5 mg/orelha com o tratamento tópico com EFMA, sem diferença significativa em comparação a medicamentos comerciais; – Tratamento com EFMA reduziu significativamente a atividade de MPO em 84,48%, em comparação com o grupo não tratado. |
[120] |
| Extrato etanólico das folhas de M. albicans (EEMA) | Averiguar in vivo em modelo de artrite de camundongos o perfil antiartrítico e anti-inflamatório do extrato etanólico das folhas de M. albicans (EEMA) | – Redução significativa da infiltração leucocitária com o pré-tratamento com EEMA (50 e 100 mg/kg, v.o.); – Redução significativa dos níveis de TNF-α e IL-1β nos exsudatos pleurais em comparação com o grupo veículo com o pré-tratamento com EEMA (50 e 100 mg/kg, v.o.); – Menor número de cruzamentos de linha no teste de campo aberto e fatores no índice de incapacidade funcional relacionada à dor em comparação com controle; – Pré-tratamento com EEMA (50 e 100 mg/kg, v.o.) recuperou significativamente os níveis dos comportamentos, no caso de criação vertical, a diferença com o grupo veículo foi significativa para doses de 50 e 100 mg/kg, respectivamente) produzindo parâmetros semelhantes ao grupo controle durante o dia 18, enquanto o teste de campo aberto apresentou diferença para o grupo veículo apenas na dose mais alta; – Perfil anti-hiperalgésico demonstrado com o pré-tratamento com EEMA (50 e 100 mg/kg, p.o.) pela reversão significativa do comportamento hiperalgésico em todos os dias avaliados quando comparado com o grupo veículo; – Força da preensão da pata traseira aumentada significativamente em camundongos tratados com EEMA comparados com os animais tratados com veículo em 11, 18 e 25 dias; – Diâmetro do edema de joelho ipsilateral induzido por CFA significativamente reduzido pelas doses de 50 e 100 mg/kg (via oral) nos dias 4, 11, 18 e 25 após o início da provocação de CFA, de maneira dose-dependente e bloqueio significativo do aumento do nível de IL-6 e TNF-α no fluido da articulação do joelho de camundongos quando comparado com o grupo veículo pelo pré-tratamento com EEMA, em ambas as doses. |
[118] |
| Extrato seco das folhas de M. albicans (ESMA) | Avaliar a caracterização físico-química da planta e ESMA, bem como investigar o efeito anti-inflamatório e perfil antioxidante do extrato seco padronizado desta espécie empregando diferentes sistemas | – Redução significativa da hipersensibilidade mecânica induzida pela injeção de carragenina em todos os tempos estudados (60, 120 e 240 min) com o tratamento oral de ESMA na concentração de 100 mg/kg e efeito anti-inflamatório com indometacina (10 mg/kg); – Diminuição significativa do edema de pata com ESMA em todas as concentrações testadas (25, 50 e 100 mg/kg; v.o.), e efeito antiedematogênico semelhante ao controle positivo; – Redução significativa dos níveis de TNF-α e IL-1β no tratamento oral com ESMA nas concentrações de 25, 50 e 100 mg/kg quando comparado ao controle e consequente redução da nocicepção inflamatória e do edema causado pela injeção de carragenina. |
[121] |
| Cápsula de produto a base de M. albicans (500 mg) | Avaliar o efeito analgésico e modulador dos fitoterápicos Curcuma longa e Miconia albicans no tratamento da osteoartrite (OA) do joelho (n= 24) | – Redução média no WOMAC Total observada para os três tratamentos após 30 dias. Na variação do WOMAC Total para M. albicans (n = 9), 7 dos 9 pacientes tiveram redução no indicador; – Para a VASP1, com M. albicans (n = 9), 8 em 9 pacientes apresentaram redução do indicador com diferença estatisticamente significativa (média dia 0= 8,22; média dia 30= 3,00); – Para a variação da rigidez WOMAC, com M. albicans (n= 9), 8 em 9 pacientes apresentaram redução no indicador, enquanto 1 paciente permaneceu o mesmo e a comparação da média de rigidez do WOMAC antes e após o tratamento mostrou uma diferença significativa (média do dia 0= 59,17; média do dia 30= 23,41) – Para a variação da atividade física WOMAC, com M. albicans (n= 9), 6 dos 9 pacientes tiveram redução do indicador. As médias de atividade física do WOMAC antes e após o tratamento não mostraram diferença estatisticamente significativa (média dia 0= 58,46; média dia 30= 34,82); |
[119] |
| Legenda: ¹Visual Analogue Scale of Pain (Escala Visual Analógica da Dor). | |||
Unha-de-gato (Uncaria tomentosa Willd. ex Schult. DC, Rubiaceae)
Uncaria tomentosa é popularmente conhecida por "unha-de-gato" e é uma trepadeira típica da Amazônia amplamente utilizada no tratamento de doenças inflamatórias. As espécies do gênero Uncaria se apresentam como arbustos trepadores com folhas simples e opostas, com par de estípulas interpeciolares com flores em capítulos densos e globosos [122-126].
As plantas do gênero Uncaria são usadas há pelo menos dois mil anos na medicina tradicional ameríndia da América do Sul por suas propriedades anti-inflamatórias, e mais recentemente no tratamento de doenças como câncer, gastrite, reumatismo, OA, AR e afecções epidérmicas. Tradicionalmente, são usadas as folhas, cascas e raízes dessas espécies, variando de acordo com a patologia em questão. Em processos inflamatórios, extratos alcoólicos das cascas dos caules são mais utilizados[127].
Suas propriedades terapêuticas, a complexidade e a diversidade estrutural de seus componentes e seus mecanismos de ação, assim como seus aspectos ecológicos e econômicos têm despertado nos últimos trinta anos o interesse de médicos, farmacêuticos, químicos, botânicos, agrônomos e economistas[128].
U. tomentosa é composta principalmente por três frações bioativas: polifenóis, derivados triterpênicos e alcaloides[129-131]. As espécies do gênero Uncaria acumulam alcaloides indólicos, conhecidos como os principais marcadores químicos de Rubiaceae. A casca da unha-de-gato contempla seus principais compostos bioativos conhecidos: alcaloides oxindólicos, principalmente tetracíclicos e, também, pentacíclicos; glicosídeos de ácido quinóvico e polifenóis, como ácidos fenólicos, flavonoides e proantocianidinas[132]. Um de seus principais ativos é a mitrafilina, alcaloide isolado e avaliado por Rojas-Duran et al.[133], resultando em modulação de citocinas, fornecendo menos sinais inflamatórios.
O efeito citoprotetor dos extratos de unha-de-gato foi relatado por Sandoval-Chacon et al.[134] quando estes pesquisadores relataram que o extrato aquoso da casca foi capaz de inibir a expressão de NO sintase induzida por lipopolissacarídeo, inibir a síntese de TNF-α e ativar o NF-kB. Os autores sugerem que o mecanismo de ação anti-inflamatório primário deve ser graças à imunomodulação da via de supressão de TNF-α.
Aguilar et al.[135] avaliaram in vitro as atividades anti-inflamatórias de dois extratos de U. tomentosa e perceberam que esse efeito ocorreu após 4 h da administração. O extrato hidroalcoólico (50 mg/kg) produziu efeito anti-inflamatório semelhante ao da indometacina (7 mg/kg), enquanto o extrato liofilizado exibiu o mesmo efeito na dose de 200 mg/kg. Esses resultados demonstram que ambos os extratos apresentam importantes resultados anti-inflamatórios, apresentando resultados mais robustos para o extrato hidroalcoólico, o que pode ser explicado pela maior concentração de ativos obtidos através da extração de mistura aquosa alcoólica.
Sandoval et al.[127] trouxeram a comparação entre espécies U. tomentosa e U. guianensis, já que são usadas de forma intercambiável na medicina tradicional. As duas espécies apresentaram ótimos resultados antioxidantes e potente supressão de TNF-α, a citocina associada à ativação imunológica e inflamação. Elas têm ações semelhantes, mas a U. guianensis foi mais potente nas determinações dos autores. Os autores sugerem ainda que a supressão da regulação da expressão gênica pode ser a chave para entender o mecanismo de ação.
Rojas-Duran et al.[133] e La Paz et al.[136] demonstraram correlação entre atividade anti-inflamatória de U. tomentosa e seus ativos purificados com o teor de alcaloides pentacíclicos oxindólicos, particularmente a mitrafilina. Snow et al.[137] demonstraram que a mitrafilina inibe NF-κB e reduz a circulação de TNF-α e IL-6 em modelo de estimulação por LPS em macrófagos de camundongos.
Um estudo envolvendo novamente a mitrafilina, considerado como o principal composto presente na casca de U. tomentosa, inibiu aproximadamente 50% da produção de citocinas pró-inflamatórias IL-1, IL-17 e TNF- α após três dias de tratamento (30 mg/kg/ dia, v.o.). U. tomentosa inibe o TNF-α de maneira dose-dependente[133,138-139]. Castilhos et al.[140] sustentam a utilização do extrato de U. tomentosa como adjuvante no tratamento da artrite.
A TABELA 5 elenca os estudos farmacológicos investigando as propriedades antiartríticas e anti-inflamatórias de U. tomentosa.
| Amostra | Objetivo experimental | Principais resultados | Autores |
|---|---|---|---|
| Extrato do quimiotipo pentacíclico de Uncaria tomentosa (UT) | Avaliar a segurança e eficácia clínica de um extrato do quimiotipo pentacíclico de UT em pacientes com artrite reumatoide (n= 40) submetidos a tratamento com sulfassalazina ou hidroxicloroquina. Durante a primeira fase (24 semanas, duplo-cego, controlado por placebo), os pacientes foram tratados com extrato de UT ou placebo. Na segunda fase (28 semanas) todos os pacientes receberam o extrato de UT | – Os pacientes que usaram extrato de UT tiveram menos dores nas articulações que os do grupo placebo (redução de 53,2 vs 24,1%;) na fase 1, mas não foram observadas diferenças entre os dois grupos para as demais variáveis; – Redução no número de articulações sensíveis, índice de Ritchie e duração da rigidez matinal após 24 semanas em comparação com os valores basais nos pacientes que receberam UT; – Número reduzido de articulações sensíveis, Índice de Ritchie e duração da rigidez matinal pela ingestão adicional do extrato de UT, na fase 2 em comparação com os valores basais na semana 0; – Redução no número de articulações, número de articulações inchadas e índice de Ritchie em relação aos valores observados ao final do tratamento com placebo nos pacientes que receberam o extrato apenas na segunda fase. |
[141] |
| Extrato aquoso da casca (EAC) e das folhas (EAF) de U. tomentosa (UT) | Caracterizar EAC e EAF de UT e comparar seus efeitos anti-inflamatórios | – Sem influência significativa na produção de TNF-α com o tratamento de macrófagos estimulados por LPS com EAC e EAF nas concentrações testadas; – Redução significativa na produção de IL-6 com o tratamento de macrófagos estimulados por LPS com EAF a 5 µg mL−1, enquanto o tratamento com EAC a 300 µg mL−1 aumentou significativamente; – Inibição da transcrição de NF-kB por EAC em todas as concentrações testadas (3-300 µg mL−1) e por EAF em 1,5, 5, 15 e 150 µg mL−1. |
[142] |
| Extrato aquoso da casca de U. tomentosa (UT) | Caracterizar as propriedades antioxidantes e anti-inflamatórias de U. tomentosa (UT)e U. guianensis (UG) | – Os valores de IC50 para a atividade anti-TNFα de UT e UG foram 14,1 e 9,5 ng/ml, respectivamente - UG foi mais potente na diminuição da produção de TNF-α em macrófagos (RAW 264,7) em comparação com UT; – Diminuição da produção de TNF-α e nitrito induzida por LPS em células RAW 264,7 nas frações não alcaloídicas de UT; – Pré-tratamento oral por 3 dias com UT provocou um efeito protetor, e o grau de lesão da mucosa gástrica foi acentuadamente atenuado e preveniu a expressão de mRNA de TNF-α. |
[127] |
| Mitrafilina (MTP) | Avaliar a atividade anti-inflamatória da mitrafilina isolada da casca de U. tomentosa em modelo murino in vivo | – Redução da liberação de TNF-α em 50% quando administrada a camundongos por via oral na dose de 30 mg/kg por três dias, bem como inibição de quase 70% da liberação de IL-1α e -1β com MTP; – Redução da produção de IL-4 em cerca de 40%, enquanto a dexametasona foi inativa e redução da produção de IL-17 em 50% com MTP. |
[133] |
| Extrato de U. tomentosa (UT), contendo 95% de alcaloides oxindólicos | Avaliar o envolvimento dos receptores 5-HT2 no efeito antinociceptivo de U. tomentosa | – Redução significativa no número de respostas de contorções abdominais de aproximadamente 54, 72 e 97%, nas doses de 10, 30 e 100 mg/kg i.p., respectivamente, quando comparado ao controle tratado pelo pré-tratamento com UT; – Redução significativa na resposta ao estímulo nocivo de aproximadamente 11, 66 e 94%, respectivamente, quando comparado ao controle no teste de capsaicina, pré-tratados i.p. com fração UT nas doses de 30, 100 e 300 mg/kg; – Redução significativa do tempo gasto lambendo ou mordendo a pata injetada no teste da formalina pelo pré-tratamento com doses variadas da fração UT. As porcentagens de inibição para as doses de 10, 30, 100, 150 e 300 mg/kg na fase inicial foram de 8, 30, 33, 65 e 94%, enquanto os valores correspondentes para a segunda fase foram 28, 36, 41, 94 e 100%; – Aumento significativo de 192% na latência, 120 min depois no teste de movimento de cauda nos animais com a fração UT na dose de 300 mg/kg e esse mesmo tratamento também aumentou a latência no teste de placa quente em cerca de 311%; – Fração UT nas doses de 100 e 300 mg/kg, administradas por via i.p., não afetou significativamente a resposta motora dos animais. |
[143] |
| Extrato etanólico de cascas de U. tomentosa (UT) | Demonstrar que o tratamento de células THP-1 com extratos de U. tomentosa regula diferencialmente a expressão de IL-1 e TNF-α | – Aumento da expressão de IL-1 em 2,4 vezes e inibição da expressão de TNF-α em 5,5 vezes pelo pré-tratamento de células semelhantes a monócitos THP-1 estimuladas por LPS com extratos de UT; – Aumento da expressão de IL-1 em mais de 20 vezes, sem afetar a expressão de TNF-α com o tratamento de monócitos THP-1 com extratos de UT; – Bloqueio da fosforilação de ERK de maneira dose-dependente com o tratamento de células THP-1 estimuladas por LPS com extratos de UT. Em altas doses, há promoção de bloqueio completo da fosforilação de ERK, e bloqueio parcial nos tratamentos com doses mais baixas |
[138] |
| Extrato hidroalcoólico seco por pulverização (EHSP) e extrato aquoso liofilizado (EAL) de cascas de U. tomentosa (UT) | Avaliar comparativamente in vivo a atividade anti-inflamatória de EHSP e EAL de UT | – Diminuição significativa do aumento induzido por carragenina no volume da pata em comparação com ratos controle pelos extratos, de forma dose-dependente. EHSP (50 mg/kg), com 5,61% de alcaloides oxindólicos totais, produziu efeito anti-inflamatório semelhante a 7 mg/kg do fármaco controle indometacina. EAL exibiu o mesmo efeito na dose mais alta de 200 mg/kg; – Redução da ativação de NF-kB pelo pré-tratamento de células Jurkat com 500 mg/ml de EHSP, enquanto EAL impediu apenas ligeiramente a ligação ao DNA de NF-kB nesta concentração; – EHSP na concentração de 50 mg/ml exibiu uma inibição das COX-1 e -2 de 7,8% e de 21,7%, respectivamente. Em contraste, uma atividade inibitória de 32,7% foi medida para COX-1 e de 12,2% para COX-2 para o EAL. |
[135] |
| Extrato etanólico das cascas de U. tomentosa (UT) | Avaliar a capacidade de UT de regular diferencialmente citocinas inflamatórias como TNF-α e IL-1β | – Inibição da secreção de TNF-α em células tratadas com LPS de forma dose-dependente: 10 µg/ml de UT inibiu a secreção de TNF-α em 33%; 40 µg/ml em 45%; 160 µg/ml em 80%; e 320 µg/ml em 95%. Em contraste, o tratamento com UT aumentou a expressão dependente de LPS de IL-1β: 40 µg/ml aumentou IL-1β em 1,2 vezes e 160 g/ml em 1,4 vezes, embora 320 µg/ml tenha bloqueado completamente a secreção de IL-1β dependente de LPS; – Inibição da ativação de todas as subunidades AP-1 tanto na presença quanto na ausência de tratamento com LPS; – Inibição da secreção de TNF-dependente de LPS em 85% (p < 0,01) pelo tratamento com 160 µg/ml de UT. No entanto, nas células tratadas com LPS e UT, SN50 resultou em um pequeno aumento na secreção de TNF-α em comparação com as células controle; – Aumento da secreção de IL-1β nas células THP-1 tratadas apenas com UT e esta foi inibida na presença de SN50 e do peptídeo controle MSN50. – Forte aumento da secreção de TNF-α com LPS e esta foi quase completamente bloqueada pela adição de 160 µg/ml de UT. |
[139] |
| Mitrafilina (MTP) | Determinar a capacidade da MTP de modular a ativação de neutrófilos e regular diferencialmente as citocinas relacionadas à inflamação | – Diminuição significativa da produção de NO2 pela incubação com MTP (25 μM) nas células ativadas por LPS (– 54%); – Neutrófilos ativados por LPS mostraram altos níveis de expressão de mRNA iNOS em comparação com amostras não ativadas por LPS (+56%), sendo observada regulação negativa acentuada da expressão de mRNA de iNOS em neutrófilos ativados por LPS na presença de MTP (25 μM) (-67%); – Regulação negativa de citocinas pró-inflamatórias como IL-6 e IL-8 e TNF-α por MTP em neutrófilos tratados com LPS (-83%, -37%, -53% respectivamente) após neutrófilos serem expostos a 0,1 μg/ml LPS na ausência ou presença de 25 μM de MTP por 6 h. O mesmo padrão foi observado com o nível de citocinas secretadas, que foram fortemente diminuídas na presença de MTP (–62%, –79%, –65%, respectivamente). |
[136] |
Conclusão
A OA e a AR limitam a qualidade de vida dos pacientes e diversas plantas medicinais são utilizadas na medicina popular para reduzir e tratar os sintomas destas condições, já que não possuem cura, e o tratamento farmacológico considera AINEs, que devem ser administrados por um período curto.
As plantas medicinais têm sido um importante recurso terapêutico desde os primórdios da humanidade. Entretanto, seu uso muitas vezes é feito através de conhecimento empírico, o que não necessariamente significa que as plantas apresentarão resultado na prática e terão comprovação científica na literatura.
A erva-baleeira e a garra-do-diabo têm medicamentos fitoterápicos comercializados atualmente no Brasil e podem ser consideradas as duas plantas mais promissoras no tratamento da OA e AR. Para a erva-baleeira, o α-humuleno é considerado o principal ativo e inibe a produção de TNF-α e IL-1, citocinas relacionadas à inflamação, fornecendo menos sinais inflamatórios. Os resultados para a erva-baleeira foram satisfatórios, com diminuição do edema da pata de camundongos, além dos estudos demonstrarem sua influência sobre TNF-α, IL-1 e COX-2.
A garra-do-diabo apresentou resultados contraditórios na literatura, divididos em: ineficaz, eficaz e nulo. Ainda não se tem o mecanismo bem elucidado para esta espécie, mas o harpagosídeo parece ser o marcador, embora o verbascosídeo tenha apresentado efeitos inibitórios mais potentes. Os estudos comprovam sua ação anti-inflamatória e não há relatos de eventos adversos graves. É importante que novos estudos sejam feitos apenas com a garra-do-diabo para confirmação de sua segurança e eficácia.
Sobre a erva-de-são-joão, a planta apresentou excelentes resultados de potencial ação anti-inflamatória e a hipericina parece ser a responsável pelos efeitos observados da planta, embora o hiperosídeo também apresentou efeitos relevantes.
A canela-de-velho tem poucos estudos disponíveis na literatura, com destaque para a melhora da inflamação.
Para a unha-de-gato também foram encontrados poucos artigos sobre a sua ação anti-inflamatória e analgésica, mas estes corroboram com o uso popular.
Com o levantamento bibliográfico, pode-se concluir que todas as plantas envolvidas no presente trabalho, têm atuação na melhora das dores e sintomas de OA e AR, sendo promissoras e caso aliadas à mudança no estilo de vida do paciente, podem funcionar como boa alternativa às terapias convencionais. Porém, novas pesquisas devem ser realizadas, pois os mecanismos de ação não estão bem elucidados e é preciso investigar ainda a segurança e a toxicidade do uso destas espécies.
Fontes de Financiamento
Não houve fontes de financiamento.
Conflito de Interesses
Os autores declaram não haver qualquer conflito de interesses.
Agradecimentos
Os autores agradecem aos Professores Maria Isabel Sampaio dos Santos e Hélio de Mattos Alves (Faculdade de Farmácia, UFRJ) pela revisão do texto.
Colaboradores
Concepção do estudo: KASM; LCB.
Curadoria dos dados: KASM; LCB.
Coleta de dados: KASM; BPP.
Análise dos dados: KASM; BPP.
Redação do manuscrito original: KASM; LCB
Referências
1. Pereira D, Ramos E, Branco J. Osteoarthritis. Acta Méd Portug. 2015; 28(1): 99-106. [https://doi.org/10.20344/amp.5477].
2. Myers SP, O'Connor J, Fitton JH, Brooks L, Rolfe M, Connellan P. A combined phase I and II open label study on the effects of a seaweed extract nutrient complex on osteoarthritis. Biol Targets Ther. 2010; 4: 33-44. [https://doi.org/10.2147/btt.s8354].
3. Coimbra IB, Pastor EH, Greve JMD, Puccinelli MLC, Fuller R, Cavalcanti FS. Osteoartrite (artrose): tratamento. Rev Bras Reumatol. 2004; 44(6): 450-3. Disponível em: [https://www.scielo.br/j/rbr/a/F39LTRWZ985dPVQTpYPcvfJ].
4. Farpour HR, Rajabi N, Ebrahimi B. The Efficacy of Harpagophytum procumbens (Teltonal) in Patients with Knee Osteoarthritis: a randomized active-controlled clinical trial. Evidence-Based Compl Alter Medic. 2021; 2021: 5596892. [https://doi.org/10.1155/2021/5596892].
5. Rosis RG, Massabki OS, Kairalla M. Osteoartrite: avaliação clínica e epidemiológica de pacientes idosos em instituição de longa permanência. Rev Soc Bras Clín Méd. 2010; 8(2): 101-108. Disponível em:[http://files.bvs.br/upload/S/1679-1010/2010/v8n2/a003.pdf].
6. Rezende MU, Campos GC, Pailo AF. Conceitos atuais em osteoartrite. Acta Ortop Bras. 2013; 21(2): 120-2. [https://doi.org/10.1590/S1413-78522013000200010].
7. Brasil. Comissão de Osteoartrite da Sociedade Brasileira de Reumatologia. Osteoartrite (Artrose) – Cartilha para pacientes. Sociedade Brasileira de Reumatologia. 2011. Disponível em: [http://www.dol.inf.br/Html/CartilhaOsteoartrite/CartilhaOsteoartrite.pdf].
8. Sartori-Cintra AR, Aikawa P, Cintra DEC. Obesidade versus osteoartrite: muito além da sobrecarga mecânica. Einstein (São Paulo). 2014; 12(3): 374-9. [https://doi.org/10.1590/S1679-45082014RB2912].
9. Rezende MU, Campos GC, Pailo AF. Conceitos atuais em osteoartrite. Acta Ortop Bras. 2013; 21(2): 120-2. [https://doi.org/10.1590/S1413-78522013000200010].
10. Holtmann H, Resch K. Cytokines. Naturwissenschaften. 1995; 82(4): 178-87. [https://doi.org/10.1007/BF01143192].
11. Kolasinski SL, Neogi T, Hochberg MC, Oatis C, Guyatt G, Block J et al. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arth Care Res. 2020; 72(2): 149-62. [https://doi.org/10.1002/acr.24131].
12. Christensen R, Astrup A, Bliddal H. Weight loss: the treatment of choice for knee osteoarthritis? a randomized trial. Osteoarth Cartilage. 2005; 13(1): 20-7. [https://doi.org/10.1016/j.joca.2004.10.008].
13. Negrini S, Donzelli S, Lusini M, Minnella S, Zaina F. The effectiveness of combined bracing and exercise in adolescent idiopathic scoliosis based on SRS and SOSORT criteria: a prospective study. BMC Musculoskel Disorders. 2014; 15: 263. [https://doi.org/10.1186/1471-2474-15-263].
14. Zhang W, Doherty M, Arden N, Bannwarth B, Bijlsma J, Gunther KP et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the eular standing committee for international clinical studies including therapeutics (ESCISIT). Annals Rheumatic Dis. 2005; 64(5): 669-81. [https://doi.org/10.1136/ard.2004.028886].
15. Brasil. Sociedade Brasileira de Reumatologia-SBR. 2022. Osteoartrite (Artrose). Disponível em: [https://www.reumatologia.org.br/doencas/principais-doencas/osteoartrite-artrose/].
16. Jin X, Yan E, Wang H, Sui H, Liu Z, Gao W et al. Hyperoside exerts anti-inflammatory and anti-arthritic effects in LPS-stimulated human fibroblast-like synoviocytes in vitro and in mice with collagen-induced arthritis. Acta Pharmacol Sinica. 2016; 37(5): 674-86. [https://doi.org/10.1038/aps.2016.7].
17. Kapoor M, Pelletier JM, Lajeunesse D, Pelletier JP, Fahmi H. Role of proinflammatory cytokines in the pathophysiology of osteoarthritis. Nat Rev Rheumatol. 2010; 7(1): 33-42. [https://doi.org/10.1038/nrrheum.2010.196].
18. Maione F, Russo R, Khan H, Mascolo N. Plantas Medicinais com atividades anti-inflamatórias. Nat Prod Res. 2015; 30(12): 1343-1352. [https://doi.org/10.1080/14786419.2015.1062761].
19. Yatoo MI, Gopalakrishnan A, Saxena A, Parray OR, Tufani NA, Chakraborty S et al. Anti-Inflammatory Drugs and Herbs with Special Emphasis on Herbal Medicines for Countering Inflammatory Diseases and Disorders - A Review. Recent Pat Inflamm Allergy Drug Discov. 2018; 12(1): 39-58. [https://doi.org/10.2174/1872213X12666180115153635].
20. Nunes CDR, Arantes MB, Pereira SMF, Cruz LL, Passos MS, Moraes LP, Vieira IJC, Oliveira DB. Plants as Sources of Anti-Inflammatory Agents. Molecules. 2020; 25(16): 3726. [https://doi.org/10.3390/molecules25163726].
21. De Smet PAGM. Health risks of herbal remedies: an update. Clin Pharmacol Therap. 2004; 76(1): 1-17. [https://doi.org/10.1016/j.clpt.2004.03.005].
22. Van-Rooyen RM, Pretorius B, Tembani NM, Ham-Baloyi W. Evidence-based recommendations to facilitate professional collaboration between allopathic and traditional health practitioners. Health SA Gesondheid. 2017; 22(1): 291-299. [https://doi.org/10.1016/j.hsag.2017.05.001].
23. Medeiros RD, Bezerra AS, De Oliveira RB, De Lima JBF, Da Silva LV, Oliveira G et al. Uso seguro e racional de produtos naturais e fitoterápicos: a utilização das redes sociais digitais para interação entre profissionais da área da saúde e a sociedade. Rev Ext Soc. 2020; 11(2). [https://doi.org/10.21680/2178-6054].
24. Gilbert B, Favoreto R. Cordia verbenacea DC. Boraginaceae. Monografia. Rev Fitos. jan-mar. 2012; 7(1): 17-25. [https://pesquisa.bvsalud.org/portal/resource/pt/far-2012].
25. Sertié JAA, Basile AC, Panizza S, Matida AK, Zelnik R. Anti-inflammatory activity and Sub-Acute Toxicity of Artemetin. Pl Méd. 1990; 56(1): 36-40. [https://doi.org/10.1055/s-2006-960879].
26. Ventrella MC, Marinho CR. Morphology and histochemistry of glandular trichomes of Cordia verbenacea DC. (Boraginaceae) leaves. Rev Bras Bot. 2008; 31(3): 457-467. [https://doi.org/10.1590/S0100-84042008000300010].
27. Silva Junior AA, Vizzotto VJ, Giorgi E; Macedo SG, Marques LF. Plantas medicinais, caracterização e cultivo. EPAGRI-Itajaí, 71p. Boletim Técnico, 68. 1995. [ISSN:7416].
28. Brasil. Agência Nacional de Vigilância Sanitária-ANVISA. Formulário de Fitoterápicos da Farmacopeia Brasileira, 2ª edição. Brasília: ANVISA 2021. Disponível em: [https://www.gov.br/anvisa/pt-br/assuntos/farmacopeia/formulario-fitoterapico/2023-fffb2-1-er-2-atual-final-versao-com-capa-em-word-25-abr-2023.pdf].
29. ACHE. Bula Acheflan Cordia verbenacea DC. Creme – 5mg. Disponível em: [https://www.ache.com.br/arquivos/BU_ACHEFLAN-CREME_ACHE_JUL2012.pdf].
30. Dutra RC, Campos MM, Santos ARS, Calixto JB. Medicinal plants in Brazil: pharmacological studies, drug discovery, challenges and perspectives. Pharmacological Research. 2016; 112: 4-29. [https://doi.org/10.1016/j.phrs.2016.01.021].
31. Sertié JA, Basile AC, Panizza S, Matida AK, Zelnik R. Pharmacological Assay of Cordia verbenacea; Part 1. Anti-Inflammatory Activity and Toxicity of the Crude Extract of the Leaves. Planta Medica. 1988; 54(1): 7-10. [https://doi.org/10.1055/s-2006-962318].
32. Sertié JA, Basile AC, Panizza S, Oshiro TT, Azzolini CP, Penna SC. Pharmacological assay of Cordia verbenacea III: Oral and topical anti-inflammatory activity and gastrotoxicity of a crude leaf extract. J Ethnopharmacol. 1991; 31(2): 239-47. [https://doi.org/10.1016/0378-8741(91)90008-2].
33. Sertié JAA, Woisky RG, Wiezel G, Rodrigues M. Pharmacological assay of Cordia verbenacea V: oral and topical anti-inflammatory activity, analgesic effect and fetus toxicity of a crude leaf extract. Phytomedicine. 2005; 12(5): 338-44. [https://doi.org/10.1016/j.phymed.2003.09.013]
34. Refsio C, Brandão DC, Brandão GC, Korukian M, Garcia RJ, Bonfiglioli R et al. Clinical assessment of efficacy and safety from Cordia verbenacea standardized extract in tendinits and chronical miofacial pain patients. Rev Bras Medic. 2005; 62(1-2): 40-46.
35. Stochla K, Maśliński S. Carrageenan-induced oedema in the rat paw-histamine participation. Agents Actions. 1982; 12(1-2): 201-2. [https://doi.org/10.1007/BF01965145].
36. Hwang SB, Lam MH, Li CL, Shen TY. Release of platelet activation factor and its involvement in the first phase of carrageenin-induced rat foot edema. Europ J Pharmacol. 1986; 120(1): 33-41. [https://doi.org/10.1016/0014-2999(86)90636-9].
37. Gilligan JP, Lovato SJ, Erion MD, Jeng AY. Modulation of carrageenan-induced hind paw edema by substance P. Inflammation. 1994; 18(3): 285-92. [https://doi.org/10.1007/BF01534269].
38. De Campos RO, Alves RV, Kyle DJ, Chakravarty S, Mavunkel BJ, Calixto JB. Antioedematogenic and antinociceptive actions of NPC 18521, a novel bradykinin B2 receptor antagonist. Europ J Pharmacol. 1996; 316(2-3): 277-86. [https://doi.org/10.1016/s0014-2999(96)00661-9].
39. Passos GF, Fernandes ES, Cunha FM, Ferreira J, Pianowski LF, Campos MM et al. Anti-inflammatory and anti-allergic properties of the essential oil and active compounds from Cordia verbenacea. J Ethnopharmacol. 2007; 110 (2): 323-33. [https://doi.org/10.1016/j.jep.2006.09.032].
40. Van-Assche G, Rutgeerts P. Anti-TNF agents in Crohn's disease. Exp Opinion Investig Drugs. 2000; 9: 103–111. [https://doi.org/10.1517/13543784.9.1.103].
41. Feldmann M. Development of anti-TNF therapy for rheumatoid arthritis. Nat Rev Immunol. 2002; 2(5): 364-71. [https://doi.org/10.1038/nri802].
42. Fernandes ES, Passos GF, Medeiros R, Cunha FM, Ferreira J, Campos MM et al. Anti-inflammatory effects of compounds alpha-humulene and (−)-trans-caryophyllene isolated from the essential oil of Cordia verbenacea. Europ J Pharmacol. 2007; 569(3): 228-36. [https://doi.org/10.1016/j.ejphar.2007.04.059].
43. Bodini RB, Pugine SMP, Melo MP, Carvalho RA. Antioxidant and anti-inflammatory properties of orally disintegrating films based on starch and hydroxypropyl methylcellulose incorporated with Cordia verbenacea (erva baleeira) extract. Inter J Biol Macromolec. 2020; 159:714-24. [https://doi.org/10.1016/j.ijbiomac.2020.05.075].
44. Basting RT, Spindola HM, Sousa IMO, Queiroz NCA, Trigo JR, JE Carvalho et al. Pterodon pubescens and Cordia verbenacea association promotes a synergistic response in antinociceptive model and improves the anti-inflammatory results in animal models. Biomed Pharmacother. 2019; 112: 108693. [https://doi.org/10.1016/j.biopha.2019.108693].
45. Mills S, Bone K. Principles and Practice of Phytotherapy: Modern Herbal Medicine. Churchill Livingdtone, Edinburg, 439-447. Harcourt Publishers Ltd.: Londres. 2000.
46. Wegener T. Devil's Claw: from African traditional remedy to modern analgesic and anti-inflammatory. Herbal Gram. 2000;(50): 47-54. Disponivel em: [https://www.herbalgram.org/resources/herbalgram/issues/50/table-of-contents/article2285/].
47. Tyler VE. The Honest Herb.: A sensible guide to the use of herbs and related remedies. 3a ed. New York: Pharmaceutical Products, 1993.
48. Baghdikian B, Lanhers MC, Fleurentin J, Ollivier E, Maillard C, Balansard G, Mortier F et al. An Analytical Study and Anti-Inflammatory and Analgesic Effects of Harpagophytum procumbens and Harpagophytum zeyheri. Pl Med. 1997; 63(2): 171-6. [https://doi.org/10.1055/s-2006-957638].
49. Mncwangi N, Chen W, Vermaak I, Viljoen AM, Gericke N. Devil's Claw - a review of the ethnobotany, phytochemistry and biological activity of Harpagophytum procumbens. J Ethnopharmacol. 2012; 143(3): 755-71. [https://doi.org/10.1016/j.jep.2012.08.013].
50. Apsen Farmacêutica S/A. Bula Apardol - Harpagophytum procumbens DC. Cápsulas – 20 mg harpagosídeo. Disponível em: [https://www.apsen.com.br/bula/Arpadol/Bula-Arpadol-Profissional.pdf].
51. Natulab Laboratório S.A. Bula Arpynflan Harpagophytum procumbens. Comprimidos revestidos – 18 mg harpagosídeo. Disponível em: [https://natulab.com.br/wp-content/uploads/2019/10/Arpynflan-Bula_Paciente-1.pdf].
52. Brasil. Ministério da Saúde. Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. Relação Nacional de Medicamentos Essenciais - RENAME. Departamento de Assistência Farmacêutica e Insumos Estratégicos. Brasília - DF, 2022. 1ª edição. Disponível em: [https://www.gov.br/saude/pt-br/composicao/sectics/daf/rename/20210367-rename-2022_final.pdf].
53. Belaiche P. Etude clinique de 360 cas d'arthrose traités par le nébulisat aqueux d'Harpagophytum procumbens. Phytotherapie. 1982; 1:22–28.
54. Chrubasik S, Künzel O, Thanner J, Conradt C, Black A. A 1-year follow-up after a pilot study with Doloteffin® for low back pain. Phytomedicine. 2005; 12(1-2): 1-9. [https://doi.org/10.1016/j.phymed.2004.01.005].
55. Conrozier T, Mathieu P, Bonjean M, Marc JF, Renevier JL, Balblanc JC. A complex of three natural anti-inflammatory agents provides relief of osteoarthritis pain. Alter Ther Health Medic. 2014; 20(1): 32-7. [PMID: 24473984].
56. Lim DW, Kim JG, Han D, Kim YT. Analgesic Effect of Harpagophytum procumbens on Postoperative and Neuropathic Pain in Rats. Molecules. 2014; 19(1): 1060-8. [https://doi.org/10.3390/molecules19011060].
57. Park KS. A Systematic Review on Anti-Inflammatory Activity of Harpagoside. J Biochem Molec Biol Res. 2016; 2(3): 166-9. Disponível em: [http://www.ghrnet.org/index.php/jbmbr/article/view/1715].
58. Unger M, Frank A. Simultaneous determination of the inhibitory potency of herbal extracts on the activity of six major cytochrome P450 enzymes using liquid chromatography/mass spectrometry and automated online extraction. Rapid Commun Mass Spectrom. 2004; 18(19): 2273-81. [https://doi.org/10.1002/rcm.1621].
59. Ernst E. Herbal medicines: where is the evidence? British Med J. 2000; 321(7258): 395-6. [https://doi.org/10.1136/bmj.321.7258.395].
60. Rang HP, Dale MM, Ritter JM, Moore PK. Pharmacology. 5th ed. Churchill Livingstone, Edinburgh, pp. 234. 816p. 2003. ISBN-13: 978-0443071454.
61. Chantre P, Cappelaere A, Leblan D, Guedon D, Vandermander J, Fournie B. Efficacy and tolerance of Harpagophytum procumbens versus diacerhein in treatment of osteoarthritis. Phytomedicine. 2000; 7(3): 177-83. [https://doi.org/10.1016/S0944-7113(00)80001-X].
62. Lanhers MC, Fleurentin J, Mortier F, Vinche A, Younos C. Anti-inflammatory and analgesic effects of an aqueous extract of Harpagophytum procumbens. Planta Medica; 1992; 58(2): 117-23. [https://doi.org/10.1055/s-2006-961411]
63. Mahomed IM, Ojewole JAO. Analgesic, anti-inflammatory and antidiabetic properties of Harpagophytum procumbens DC (Pedaliaceae) secondary root aqueous extract. Phytother Res. 2005; 18(12): 982-9. [https://doi.org/10.1002/ptr.1593]
64. Anauate MCC, Torres LMB, Mello SBV. Uso dos fitoterápicos, Harpagophytum procumbens (garra-do-diabo) e Uncaria tomentosa (unha-de-gato) no tratamento da osteoartrite de coluna lombar. 2009. Art Hypertexto. Disponível em: [http://www.infobibos.com/Artigos/2009_4/fitoterapicos/index.htm]
65. Haseeb A, Ansari MY, Haqqi TM. Harpagoside suppresses IL-6 expression in primary human osteoarthritis chondrocytes. J Orthop Res. 2017; 35(2): 311-320. [https://doi.org/10.1002/jor.23262]
66. Ghasemian M, Owlia S, Owlia MB. Review of Anti-Inflammatory Herbal Medicines. Adv Pharmacol Sci. 2016; 2016: 9130979. [https://doi.org/10.1155/2016/9130979].
67. Inaba K, Murata K, Naruto S, Matsuda H. Inhibitory effects of devil's claw (secondary root of Harpagophytum procumbens) extract and harpagoside on cytokine production in mouse macrophages. J Nat Medic. 2010; 64(2): 219-22. [https://doi.org/10.1007/s11418-010-0395-8].
68. Schopohl P, Grüneberg P, Melzig MF. The influence of harpagoside and harpagide on TNFα-secretion and cell adhesion molecule mRNA-expression in IFNγ/LPS-stimulated THP-1 cells. Fitoterapia. 2016; 110: 157-65. [https://doi.org/10.1016/j.fitote.2016.03.005].
69. Chung HJ, Kim WK, Park HJ, Cho L, Kim MR, Kim MJ et al. Anti-osteoporotic activity of harpagide by regulation of bone formation in osteoblast cell culture and ovariectomy-induced bone loss mouse models. J Ethnopharmacol. 2016; 179: 66-75. [https://doi.org/10.1016/j.jep.2015.12.025].
70. Rahimi A, Razmkhah K, Mehrnia M, Mohamadnia A, Sahebjamee H, Salehi S et al. Molecular docking and binding study of harpagoside and harpagide as novel anti-inflammatory and anti-analgesic compound from Harpagophytum procumbens based on their interactions with COX-2 enzyme. Asian Pacif J Trop Dis. 2016; 6(3): 227-31. [https://doi.org/10.1016/S2222-1808(15)61019-2].
71. Mariano A, Sotto AD, Leopizzi M, Garzoli S, Maio VD, Gullì M et al. Antiarthritic effects of a root extract from Harpagophytum procumbens DC: novel insights into the molecular mechanisms and possible bioactive phytochemicals. Nutrients. 2020; 12(9): 2545. [https://doi.org/10.3390/nu12092545].
72. Zhang L, Feng L, Jia Q, Xu J, Wang R, Wang Z et al. Effects of β-glucosidase hydrolyzed products of harpagide and harpagoside on cyclooxygenase-2 (COX-2) in vitro. Bioorg Medic Chem. 2011; 19(16): 4882-6. [https://doi.org/10.1016/j.bmc.2011.06.069].
73. Farpour HR, Rajabi N, Ebrahimi B. The Efficacy of Harpagophytum procumbens (Teltonal) in Patients with Knee Osteoarthritis: a randomized active-controlled clinical trial. Evidence-Based Compl Alter Medic. 2021; 2021: 5596892. [https://doi.org/10.1155/2021/5596892].
74. Huang THW, Tran VH, Duke RK, Tan S, Chrubasik S, Roufogalis BD et al. Harpagoside suppresses lipopolysaccharide-induced iNOS and COX-2 expression through inhibition of NF-κB activation. J Ethnopharmacol. 2006; 104(1-2): 149-55. [https://doi.org/10.1016/j.j].
75. Andersen ML, Santos EHR, Seabra MLV, Silva AAB, Tufik S. Evaluation of acute and chronic treatments with Harpagophytum procumbens on Freund's adjuvant-induced arthritis in rats. J Ethnopharmacol. 2004; 91(2-3): 325-30. [https://doi.org/10.1016/j.jep.2004.01.003]
76. Chrubasik S, Thanner J, Künzel O, Conradt C, Black A, Pollak S. Comparison of out come measures during treatment with the proprietary Harpagophytum extract Doloteffin® in patients with pain in the lower back, knee or hip. Phytomedicine. 2002; 9(3): 181-94. [https://doi.org/10.1078/0944-7113-00140]
77. Chrubasik S, Chrubasik C, Künzel O, Black A. Patient-perceived benefit during one year of treatment with Doloteffin®. Phytomedicine. 2007; 14(6): 371-6. [https://doi.org/10.1016/j.phymed.2007.04.011].
78. Gyurkovska V, Alipieva K, Maciuk A, Dimitrova P, Ivanovska N, Haas C et al. Anti-inflammatory activity of Devil's claw in vitro systems and their active constituents. Food Chem. [S.L.]. 2011; 125(1): 171-178. [https://doi.org/10.1016/j.foodchem.2010.08.056].
79. Jang MH, Lim S, Han SM, Park HJ, Shin I, Kim JW et al. Harpagophytum procumbens Suppresses Lipopolysaccharide-Stimulated Expressions of Cyclooxygenase-2 and Inducible Nitric Oxide Synthase in Fibroblast Cell Line L929. J Pharmacol Sci. 2003; 93(3): 367-71. [https://doi.org/10.1254/jphs.93.367].
80. Kaszkin M, Beck KF, Koch E, Erdelmeier C, Kusch S, Pfeilschifter J, Loew D. Downregulation of iNOS expression in rat mesangial cells by special extracts of Harpagophytum procumbens derives from harpagoside-dependent and independent effects. Phytomedicine. 2004; 11(7-8): 585-95. [https://doi.org/10.1016/j.phymed.2004.02.003].
81. Kim TK, Park KS. Inhibitory effects of harpagoside on TNF-α-induced pro-inflammatory adipokine expression through PPAR-γ activation in 3T3-L1 adipocytes. Cytokine. 2015; 76(2): 368-374. [https://doi.org/10.1016/j.cyto.2015.05.015].
82. Ouitas NA, Heard CM. A novel ex vivo skin model for the assessment of the potential transcutaneous anti-inflammatory effect of topically applied Harpagophytum procumbens extract. Inter J Pharmac. 2009; 376 (1-2): 63-8. [https://doi.org/10.1016/j.ijpharm.2009.04.017].
83. Warnock M, McBean D, Suter A, Tan J, Whittaker P. Effectiveness and safety of Devil's Claw tablets in patients with general rheumatic disorders. Phytother Res. 2007; 21(12): 1228-33. [https://doi.org/10.1002/ptr.2288].
84. Wegener T, Lüpke NP. Treatment of patients with arthrosis of hip or knee with an aqueous extract of Devil's Claw (Harpagophytum procumbens DC.). Phytother Res. 2003; 17(10): 1165-72. [https://doi.org/10.1002/ptr.1322].
85. Al-Asmari KA, Al-Elaiwi MA, Athar MT, Tariq M, Al Eid A, Al-Asmary SM. A review of hepatoprotective plants used in Saudi Traditional Medicine. Evidence-Based Compl Alter Medic. 2014; 2014: 890842. [https://doi.org/10.1155/2014/890842].
86. Meral GE, Karabay NU. In vitro antibacterial activities of three Hypericum species from West Anatolia. Turkish Electr J Biotechnol. 2002: 6–10. [Disponível em: [https://www.maltawildplants.com/CLUS/Docs/HYPTQ/Antimicrobialproperties.pdf].
87. Mašković PZ, Mladenović JD, Cvijović MS, Đoković GA, Solujić SR, Radojković MM. Phenolic content, antioxidant and antifungal activities of acetonic, ethanolic and petroleum ether extracts of Hypericum perforatum L. Hemijska industrija, 2011; 65(2): 159-164. [https://doi.org/10.2298/HEMIND100819004M].
88. Linde K, Berner MM, Kriston L. St John's wort for major depression. Cochr Database System Rev. 2008; 2008(4): CD000448. [https://doi.org/10.1002/14651858.CD000448.pub3].
89. Stojanović G, Ðorđević A, Šmelcerović A. Do Other Hypericum Species Have Medical Potential As St. John's Wort (Hypericum perforatum)?. Current Medic Chem. 2013; 20(18): 2273-95. [https://doi.org/10.2174/0929867311320180001].
90. Kubin A, Wierrani F, Burner U, Alth G, Grünberger W. Hypericin-the facts about a controversial agent. Current Pharmac Design. 2005; 11(2): 233-53. [https://doi.org/10.2174/1381612053382287].
91. Wong A, Townley SA. Herbal medicines and anaesthesia. Contin Educ Anaesthesia Critic Care Pain. 2011; 11(1): 14-17. [https://doi.org/10.1093/bjaceaccp/mkq046].
92. Henderson L, Yue QY, Bergquist C, Gerden B, Arlett P. St John's wort (Hypericum perforatum): drug interactions and clinical outcomes. British J Clin Pharmacol. 2002; 54(4): 349-56. [https://doi.org/10.1046/j.1365-2125.2002.01683.x].
93. Šavikin K, Dobrić S, Tadić V, Zdunić G. Anti-inflammatory activity of ethanol extracts of Hypericum perforatum L., H. barbatum Jacq., H. hirsutum L., H. richeri Vill. and H. androsaemum L. in rats. Phytother Res. 2007; 21(2): 176-180. [https://doi.org/https://doi.org/10.1002/ptr.2041].
94. Baeuerle PA, Henkel T. Function and Activation of NF-kappaB in the Immune System. Annual Rev Immunol. 1994; 12: 141-79. [https://doi.org/10.1146/annurev.iy.12.040194.001041].
95. Hunt EJ, Lester CE, Lester EA, Tackett RL. Effect of St. John's wort on free radical production. Life Sci. 2001; 69(2): 181-90. [https://doi.org/10.1016/s0024-3205(01)01102-x].
96. Silva BA, Ferreres F, Malva JO, Dias ACP. Phytochemical and antioxidant characterization of Hypericum perforatum alcoholic extracts. Food Chemistry. 2005; 90(1-2): 157-67. [https://doi.org/10.1016/j.foodchem.2004.03.049].
97. Lee SH, Soyoola E, Chanmugam P, Hart S, Sun W, Zhong H et al. Selective expression of mitogen-inducible cyclooxygenase in macrophages stimulated with lipopolysaccharide. J Biol Chem. 1992; 267(36): 25934-8. [https://doi.org/10.1016/S0021-9258(18)35698-9].
98. Nussler AK, Billiar TR. Inflammation, immunoregulation, and inducible nitric oxide synthase. J Leukocyte Biol. 1993; 54(2): 171-8. [PMID: 7689630].
99. Raso GM, Meli R, Di Carlo G, Pacilio M, Di Carlo R. Inhibition of inducible nitric oxide synthase and cyclooxygenase-2 expression by flavonoids in macrophage J774A.1. Life Sci. 2001; 68(8): 921-31. [https://doi.org/10.1016/s0024-3205(00)00999-1].
100. Abdel-Salam OME. Anti-inflammatory, antinociceptive, and gastric effects of Hypericum perforatum in rats. Scient World J. 2005; 5: 586-95. [https://doi.org/10.1100/tsw.2005.78].
101. Tedeschi E, Menegazzi M, Margotto D, Suzuki H, Förstermann U, Kleinert H. Anti-inflammatory actions of St. John's wort: inhibition of human inducible nitric-oxide syntahse expression by down-regulating signal transducer and activator of transcription-1α (STAT-1α) activation. J Pharmacol Experim Ther. 307: 2003; 307(1): 254-61. [https://doi.org/10.1124/jpet.103.054460].
102. Raso GM, Pacilio M, Di Carlo G, Esposito E, Pinto L, Meli R. In-vivo and in-vitro anti-inflammatory effect of Echinacea purpurea and Hypericum perforatum. J Pharm Pharmacol. 2002; 54(10): 1379-83. [https://doi.org/10.1211/002235702760345464].
103. Kumar V, Singh PN, Bhattacharya SK. Anti-stress activity of Indian Hypericum perforatum L. Indian J Exper Biol. 2001; 39(4): 344-9. [PMID: 11491579].
104. Sun K, Luo J, Jing X, Xiang W, Guo J, Yao X et al. Hyperoside ameliorates the progression of osteoarthritis: an in vitro and in vivo study. Phytomedicine. 2021; 80:153387. [https://doi.org/10.1016/j.phymed.2020.153387].
105. Hatanaka J, Shinme Y, Kuriyama K, Uchida A, Kou K, Uchida S et al. In vitro and in vivo Characterization of New Formulations of (St. John's Wort) Extract with Improved Pharmacokinetics and Anti-nociceptive Effect. Drug Metab Pharmacok. Sep. 2011; 26(6): 551-8. [https://doi.org/10.2133/dmpk.DMPK-11-RG-041].
106. Huang N, Rizshsky L, Hauck CC, Nikolau BJ, Murphy PA, Birt DF. The inhibition of lipopolysaccharide-induced macrophage inflammation by 4 compounds in Hypericum perforatum extract is partially dependent on the activation of SOCS3. Phytochemistry. 2012; 76:106-16. [https://doi.org/10.1016/j.phytochem.2011.12.001].
107. Jang SA, Park DW, Sohn EH, Lee SR, Kang SC. Hyperoside suppresses tumor necrosis factor α-mediated vascular inflammatory responses by downregulating mitogen-activated protein kinases and nuclear factor-κB signaling. Chem Biol Interact. 2018; 294: 48-55. [https://doi.org/10.1016/j.cbi.2018.08.013].
108. Arjona FBS, Montezuma RCM, Silva IM. Aspectos etnobotânicos e biogeografia de espécies medicinais e / ou rituais comercializados no mercado de Madureira, RJ. Caminhos Geogr. 2007; 8(23): 41–50. Disponível em: [https://seer.ufu.br/index.php/caminhosdegeografia/article/view/15661].
109. Allenspach N, Dias MM. Frugivory by birds on Miconia albicans (Melastomataceae), in a fragment of cerrado. in São Carlos, southeastern Brazil. Braz J Biol. 2012; 72(2): 407-13. [https://doi.org/10.1590/s1519-69842012000200024].
110. Reis C, Bieras AC, Sajo MG. Anatomia foliar de Melastomataceae do cerrado do Estado de São Paulo. Rev Bras Botân. 2005; 28(3): 451-466. [https://doi.org/10.1590/S0100-84042005000300004].
111. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária-ANVISA. RDC Nº 400, de 16 de fevereiro de 2017. Disponível em: [https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2017/cha-canela-de-velho-interditado-por-nao-ter-registro].
112. Greenhalgh L. Canela-de-velho: uma perspectiva sobre a venda irregular de plantas medicinais. 2020. Disponível em: [https://www.plantaciencia.com/colunas/canela-de-velho%3A-uma-perspectiva-sobre-a-venda-irregular-de-plantas-medicinais].
113. Pieroni LG, Rezende FM, Ximenes VF, Dokkedal AL. Antioxidant activity and total phenols from the methanolic extract of Miconia albicans (Sw.) Trianaleaves. Molecules. 2011; 16(11): 9439–9450. [https://doi.org/10.3390/molecules16119439].
114. Vasconcelos MAL, Royo VA, Ferreira DS, Crotti AEM, Silva MLA, Carvalho JCT et al. In vivo analgesic and anti-Inflammatory activities of ursolic acid and oleanoic acid from Miconia albicans (Melastomataceae). Zeitschrift für Naturforschung C A. J Biosci. 2006; 61(7-8): 477-82. [https://doi.org/10.1515/znc-2006-7-803].
115. Moreira L. Avaliação da atividade tóxica em Artemia salina leach. de extratos de duas espécies da família melastomataceae. Anápolis, 2013. 43f. Trabalho de Conclusão de curso. [Graduação em Química] - Secretaria de Educação Profissional e Tecnológica, Instituto Federal de Educação, Ciência e Tecnologia de Goiás. Anápolis, GO. 2013.
116. Shen XX, Hittinger CT, Rokas A. Contentious relationships in phylogenomic studies can be driven by a handful of genes. Nat Ecol Evol. 2017; 1(5): 0126. [https://doi.org/10.1038/s41559-017-0126].
117. Serpeloni JM, Vilegas W, Varanda EA, Cólus IMS. Avaliação in vivo da anticlastogenicidade de extratos de plantas medicinais do gênero Miconia através do teste do micronúcleo. Semina: Ciênc Biol Saúde. 2008; 29(1): 47-56. [https://doi.org/10.5433/1679-0367.2008v29n1p47].
118. Quintans-Júnior LJ, Gandhi SR, Passos FRS, Heimfarth L, Pereira EWM, Monteiro BS, et al. Dereplication and quantification of the ethanol extract of Miconia albicans (Melastomaceae) by HPLC-DAD-ESI-/MS/MS, and assessment of its anti-hyperalgesic and anti-inflammatory profiles in a mice arthritis-like model: evidence for involvement of tnf-α, il-1β and il-6. J Ethnopharmacol. 2020; 258: 112938. [https://doi.org/10.1016/j.jep.2020.112938].
119. Gomes TPO, Souza JIN, Somerlate LC, Mendonça VA, Lima NM, Carli GP et al. Miconia albicans and Curcuma longa herbal medicines positively modulate joint pain, function and inflammation in patients with osteoarthritis: a clinical study. Inflammopharmacol. 2021; 29(2): 377-391. [https://doi.org/10.1007/s10787-020-00781-9].
120. Corrêa JGS, Bianchina M, Lopes AP, Silva E, Ames FQ, Pomini AM et al. Chemical profile, antioxidant and anti-inflammatory properties of Miconia albicans (Sw.) Triana (Melastomataceae) fruits extract. J Ethnopharmacol. 2021; 273: 113979. [https://doi.org/10.1016/j.jep.2021.113979].
121. Lima TC, Matos SS, Carvalho TF, Silveira-Filho AJ, Couto LPSM, Quintans-Júnior LJ et al. Evidence for the involvement of IL-1β and TNF-α in anti-inflammatory effect and antioxidative stress profile of the standardized dried extract from Miconia albicans Sw. (Triana) Leaves (Melastomataceae). J Ethnopharmacol. 2020; 259: 112908. [https://doi.org/10.1016/j.jep.2020.112908].
122. Steyemark JA. Rubiaceae. In: Laser T. Flora de Venezuela. Caracas, Ve: Instituto Botánico, Dirección de Recursos Naturales Renovables, Ministerio de Agricultura y Cria, Caracas, v.9. p.1-2070. 1974.
123. Gentry A. A field guide to the families and genera of woody plants of northwest South America. Conservation Internacional. Washington, DC. 1993.411p.
124. Boom B, Delprete P. Uncaria: Plants central French Guiana. Brittonia, 1994; 46(2): 105-125.
125. Rea RL. Cinchona y la tribu Cinchonaeae (Rubiaceae) en Bolivia, actualización sistemática, fitoquímica y actividad antimalárica, 183p. Bolivia, 1995. Tese (Graduação). Universidade Mayor de San Andrés de La Paz.
126. Zevallos PP, Lombardi I, Bernal Y. Agrotecnología para el cultivo de la uña de gato o bejuco de agua". In: Martínez JV, Bernal HJ, Cáceres A. In: Fundamentos de agrotecnología para el cultivo de plantas medicinais Iberoamericanas. Santafé de Bogotá, Colombia. Convenio Andrés Bello/Ciencia y Tecnología para el Desarrollo. p463- 492. 2000.
127. Sandoval M, Okuhama NN, Zhang XJ, Condezo LA, Lao J, Angeles FM, et al. Anti-inflammatory and antioxidant activities of cat's claw (Uncaria tomentosa and Uncaria guianensis) are independent of their alkaloid content. Phytomedicine. 2002; 9(4): 325-337. [ https://doi.org/10.1078/0944-7113-00117 ]
128. Pereira RCA, Lopes JVM. Aspectos Botânicos, Etnobotânicos, Agronômicos e Fitoquímicos de Unha-de-Gato. Fortaleza: Embrapa Agroindústria Tropical, 2006. [Disponível em: [https://www.embrapa.br/busca-de-publicacoes/-/publicacao/1092500/aspectos-botanicos-etnobotanicos-agronomicos-e-fitoquimicos-de-unha-de-gato].
129. Laus G. Advances in chemistry and bioactivity of the genus Uncaria. Phytother Res. 2004; 18(4): 259-74. [https://doi.org/10.1002/ptr.1469].
130. Heitzman ME, Neto CC, Winiarz E, Vaisberg AJ, Hammond GB. Ethnobotany, phytochemistry and pharmacology of Uncaria (Rubiaceae). Phytochemistry. 2005; 66(1): 5-29. [https://doi.org/10.1016/j.phytochem.2004.10.022].
131. Zhang Q, Zhao JJ, Xu J, Feng F, Qu W. Medicinal uses, phytochemistry and pharmacology of the genus Uncaria. J Ethnopharmacol. 2015; 173:48-80. [https://doi.org/10.1016/j.jep.2015.06.011].
132. Peñaloza EMC, Kaiser S, Resende PE, Pittol V, Carvalho AR, Ortega GG. Chemical composition variability in the Uncaria tomentosa (cat's claw) wild population. Quím Nova. 2015; 38(3). [https://doi.org/https://doi.org/10.5935/0100-4042.20150007].
133. Rojas-Duran R, González-Aspajo G, Ruiz-Martel C, Bourdy G, Doroteo-Ortega VH, Alban-Castillo J et al. Anti-inflammatory activity of Mitraphylline isolated from Uncaria tomentosa bark. J Ethnopharmacol. 2012; 143(3): 801-4. [https://doi.org/10.1016/j.jep.2012.07.015].
134. Sandoval-Chacón M, Thompson JH, Zhang XJ, Liu X, Mannick EE, Sadowska-Krowicka H et al. Anti-inflammatory actions of cat's claw: the role of NF-κb. Aliment Pharmacol Therap. 1998; 12(12): 1279-89. [https://doi.org/10.1046/j.1365-2036.1998.00424.x].
135. Aguilar JL, Rojas P, Marcelo A, Plaza A, Bauer R, Reininger E et al. Anti-inflammatory activity of two different extracts of Uncaria tomentosa (Rubiaceae). J Ethnopharmacol. 2002; 81 (2): 271-6. [https://doi.org/10.1016/s0378-8741(02)00093-4].
136. La Paz SM, Arche AF, Puerta R, Quilez AM, Muriana FJG, Gimenez MDG et al. Mitraphylline inhibits lipopolysaccharide-mediated activation of primary human neutrophils. Phytomedicine. 2016; 23(2): 141-8. [https://doi.org/10.1016/j.phymed.2015.12.015]
137. Snow AD, Castillo GM, Nguyen BP, Choi PY, Cummings JA, Cam J et al. The Amazon rain forest plant Uncaria tomentosa (cat's claw) and its specific proanthocyanidin constituents are potent inhibitors and reducers of both brain plaques and tangles. Scient Rep. 2019; 9: 561. [https://doi.org/10.1038/s41598-019-38645-0].
138. Allen-Hall L, Cano P, Arnason JT, Rojas R, Lock O, Lafrenie RM. Treatment of THP-1 cells with Uncaria tomentosa extracts differentially regulates the expression if IL-1β and TNF-α. J Ethnopharmacol. 2007; 109(2):312-7. [https://doi.org/10.1016/j.jep.2006.07.039].
139. Allen-Hall L, Arnason JT, Cano P, Lafrenie RM. Uncaria tomentosa acts as a potent TNF-α inhibitor through NF-κB. J Ethnopharmacol. 2010; 127(3): 685-93. [https://doi.org/10.1016/j.jep.2009.12.004].
140. Castilhos LG, Rezer JFP, Ruchel JB, Thorstenberg ML, Jaques JAS, Schlemmer JB et al. Effect of Uncaria tomentosa extract on purinergic enzyme activities in lymphocytes of rats submitted to experimental adjuvant arthritis model. BMC Compl Alter Medic. 2015; 15(1): 189. [https://doi.org/10.1186/s12906-015-0694-4]. ISSN: 2662-7671
141. Mur E, Hartig F, Eibl G, Schirmer M. Randomized double-blind trial of an extract from the pentacyclic alkaloid-chemotype of Uncaria tomentosa for the treatment of rheumatoid arthritis. J Rheumatol. 2002; 29(4): 678-81. [PMID: 11950006].
142. Azevedo BC, Morel LJF, Carmona F, Cunha TM, Contini SHT, Delprete PG et al. Aqueous extracts from Uncaria tomentosa (Willd. ex Schult.) DC. reduce bronchial hyperresponsiveness and inflammation in a murine model of asthma. J Ethnopharmacol. 2018; 218: 76-89. [https://doi.org/10.1016/j.jep.2018.02.013].
143. Jürgensen S, DalBó S, Angers P, Santos ARS, Valle RMR. Involvement of 5-HT receptors in the antinociceptive effect of Uncaria tomentosa. Pharmacol Biochem Behav. 2005; 81(3): 466-77. [https://doi.org/10.1016/j.pbb.2005.04.004].