Resumo
As plantas têm sido utilizadas mundialmente como fonte de moléculas bioativas com potencial de tratar diversas doenças, porém muitas dessas espécies não foram suficientemente estudadas. Essas plantas podem conter substâncias tóxicas capazes de causar danos à saúde da população. Nesse contexto, objetivou-se determinar a concentração letal 50% (CL50) de extratos de Erythroxylum caatingae e Erythroxylum revolutum, como parâmetro de toxicidade/bioatividade. Foram testados o extrato metanólico e a fase aquosa básica de E. caatingae e o extrato metanólico de E. revolutum. Foi adotado o bioensaio com Artemia salina, sendo cada concentração dos extratos testada em triplicata e repetida em pelo menos três experimentos. As CL50 foram analisadas por regressão não-linear. Os valores de CL50 para os extratos metanólico e da fase aquosa de E. caatingae e para o extrato bruto de E. revolutum foram de 203,7 (190,1-218,2) µg/mL, 1.074,0 (949,6-1.214,0) µg/mL e 308,1 (241,1-393,6) µg/mL, respectivamente. Dessa forma, conclui-se que existe uma concentração tóxica dos extratos testados, bem como, uma relação diretamente proporcional entre a concentração do extrato e a mortalidade para A. salina. O extrato metanólico de E. caatingae apresentou-se mais tóxico, enquanto a fase aquosa teve a menor letalidade.
Dose letal mediana; Erythroxylaceae; Mortalidade; Plantas medicinais; Toxicidade
Abstract
Plants have been used worldwide as a source of bioactive molecules with the potential to treat various diseases, but many of these species have not been sufficiently studied. These plants may contain toxic substances capable of causing harm to the health of the population. In this context, the objective was to determine the 50% lethal concentration (LC50) of extracts of Erythroxylum caatingae and Erythroxylum revolutum, as a toxicity/bioactivity parameter. The methanolic extract and basic aqueous phase of E. caatingae and the methanolic extract of E. revolutum were tested. The bioassay with Artemia salina was adopted, with each concentration of extracts tested in triplicate and repeated in at least three experiments. LC50 were analyzed by non-linear regression. The LC50 values for the methanolic and aqueous phase extracts of E. caatingae and for the crude extract of E. revolutum were 203.7 (190.1-218.2) µg/mL, 1,074.0 (949.6-1,214.0) µg/mL and 308.1 (241.1-393.6) µg/mL, respectively. Therefore, it is concluded that there is a toxic concentration of the tested extracts, as well as a directly proportional relationship between the concentration of the extract and mortality for A. salina. The methanolic extract of E. caatingae was more toxic, while the aqueous phase had the lowest lethality.
Erythroxylaceae; Lethal dose 50; Medicinal plants; Mortality; Toxicity
Introdução
A utilização de plantas para o tratamento, cura e prevenção de doenças é uma das mais antigas formas de prática medicinal da humanidade. Desde os tempos mais remotos, em diversas partes do mundo, há registros de enfermidades corporais ou queixas psíquicas tratadas por meio da ação curativa de plantas. Esse fenômeno é também observado no Brasil, devido, entre outros fatores, à miscigenação de vários povos, principalmente os indígenas, africanos e europeus[1].
As plantas medicinais têm sido comumente utilizadas como alternativa à medicina tradicional. Nos países em desenvolvimento, como o Brasil, a maioria das pessoas depende de plantas para suas necessidades primárias de saúde. Adicionalmente, muitos extratos isolados de plantas têm demonstrado atividade biológica, justificando a investigação de suas atividades terapêutica e tóxica[2].
As ervas com propriedades medicinais são de fácil obtenção e são vistas como seguras e benéficas. Entretanto, no meio científico, ainda não existe muito conhecimento acerca da segurança e confiabilidade do uso da maioria das plantas medicinais. Ademais, o território brasileiro é detentor da maior biodiversidade vegetal do mundo, por isso desperta interesse mundial sobre as plantas que possui propriedades farmacológicas, ricas em compostos bioativos de interesse farmacêutico[3,4].
No tocante ao uso de plantas com poucos estudos, deve-se levar em consideração a potencial toxicidade. Essa é uma particularidade representada pela capacidade de produzir danos aos organismos vivos, podendo estar relacionada, principalmente, ao tempo de exposição e concentração da substância ativa. Os efeitos da toxicidade de uma substância, incluindo as de origem vegetal, sobre organismos podem ser de natureza aguda ou crônica. Os efeitos agudos apresentam resultados súbitos e rápidos em indivíduos submetidos ao agente tóxico, um dos mais frequentemente encontrados é a letalidade[5].
Sendo assim, as plantas medicinais podem ser tóxicas devido à produção de metabólitos secundários, e o consumo ou contato com esses vegetais podem ocasionar alterações patológicas em homens e animais. Desse modo, o uso popular das plantas não as certifica como eficazes e seguras, pois dependendo da quantidade, modo de preparo e a parte da planta utilizada, podem apresentar toxicidade. Em vista disso, é fundamental que sejam realizados estudos e ensaios toxicológicos clínicos e não-clínicos para avaliação de critérios de segurança. Os ensaios toxicológicos não clínicos são de extrema importância na triagem do estudo de uma planta, podendo ser realizados testes in vivo e in vitro[6].
A maior parte dos fitoterápicos utilizados atualmente, por automedicação ou por prescrição, não possui seu perfil tóxico bem conhecido, e a utilização inadequada de um produto, mesmo com baixa toxicidade, pode induzir problemas graves se existirem outros fatores de risco, como contraindicações ou uso concomitante de medicamentos sintéticos. As evidências científicas, relacionadas à ocorrência de intoxicações e efeitos colaterais relacionados ao uso de plantas medicinais, dificilmente chegam ao alcance dos usuários atendidos nos serviços de saúde pública. Além disso, dados de segurança de muitos fitoterápicos ainda são insuficientes, especialmente para gestantes, lactantes e crianças, sendo o uso contraindicado, exceto sob supervisão de um profissional habilitado[7].
Levando-se em consideração o potencial tóxico das plantas, a comunidade científica utiliza testes que têm a capacidade de avaliar parâmetros de toxicidade. Um dos testes frequentemente utilizados, é o da toxicidade aguda em Artemia salina Leach. Este teste utiliza um microcrustáceo sensível às variações ambientais, de fácil aquisição e com cistos que permanecem viáveis no estado seco por um considerável período, apresentam baixo custo e fornece uma grande quantidade de náuplios, sendo uma alternativa a outros ensaios que utilizam outros animais. Além disto, o uso de A. salina em testes de toxicidade se deve a sua semelhança genética com o organismo humano. Já foi observada a presença de família de proteínas altamente conservadas que respondem ao estresse ambiental, em espécies de A. salina, bem como, em humanos[8]. Por meio desse bioensaio é obtida a concentração letal média (CL50), que é à concentração de um produto que causa a letalidade de 50% de uma população em teste, em um tempo pré-estabelecido[9].
Neste contexto, insere-se o estudo da família Erythroxylaceae Kunth que abrange quatro gêneros (Aneulophus Benth., Erythroxylum P. Br., Nectaropetalum Engl. e Pinacopodium Exell & Mendonça) e, aproximadamente, 240 espécies com distribuição pantropical. O gênero Erythroxylum é o mais representativo e único distribuído nas Américas, com 187 espécies registradas, incluindo a Erythroxylum coca Lam. conhecida popularmente como “coca” e a Erythroxylum vacciniifolium Mart., conhecida por “catuaba”, ambas com atividade estimulante no sistema nervoso central. O Brasil é considerado um dos centros de diversidade do gênero, onde foram listados 128 táxons com 83 endêmicos nos diversos domínios fitogeográficos, ocorrendo preferencialmente em ambientes mais úmidos como Mata Atlântica e Floresta Amazônica. No Nordeste brasileiro, Erythroxylum está representado por 78 espécies, sendo 34 endêmicas. Algumas espécies apresentam potencial farmacológico, uma vez que podem fornecer alcaloides, terpenoides e flavonoides, e serem utilizadas na área da saúde[10].
Apesar de haver registros recentes sobre o potencial terapêutico de plantas pertencentes ao gênero Erythroxylum, não existem, na literatura, estudos utilizando bioensaios com Artemia salina empregando extratos de E. caatingae e E. revolutum para determinação da CL50, como parâmetro de bioatividade e/ou toxicidade[11,12]. A E. caatingae é uma espécie com estudos sobre seu potencial antimicrobiano e citotóxico[13], enquanto E. revolutum é utilizada popularmente como uma erva afrodisíaca e tônica[14].
As informações anteriormente citadas foram relevantes para a elaboração dessa pesquisa, aliadas ao fato da necessidade constante de estudos que permitam a utilização segura de extratos e substâncias vegetais, mais precisamente de espécies do gênero Erythroxylum como E. caatingae and E. revolutum. Dessa forma, o presente trabalho objetivou determinar a CL50 de extratos de Erythroxylum caatingae e Erythroxylum revolutum, visando sua utilização em estudos farmacológicos posteriores.
Material e Métodos
Tipo de estudo e obtenção dos extratos e fase
Corresponde a um estudo experimental, quantitativo, realizado em condições laboratoriais específicas e padronizadas. Os extratos e fase de Erythroxylum caatingae Plowman e Erythroxylum revolutum Mart. foram obtidos em Laboratórios de Fitoquímica. As espécies vegetais foram coletadas e devidamente identificadas botanicamente com as exsicatas depositadas no Herbário Prof. Lauro Pires Xavier (JPB) na Universidade Federal da Paraíba, sob o número 5666 para E. caatingae e 5695 para E. revolutum.
Incubadora e solução salina
A incubadora para eclosão dos cistos de A. salina Leach consistiu em um recipiente retangular de vidro com uma divisória com orifícios de aproximadamente 0,02 cm de espessura e distribuídos uniformemente, como demonstrado na FIGURA 1. O meio para eclosão do cisto foi uma solução salina preparada com 39 g de sal marinho (Marinex®) e 1 L de água destilada, com um pH dentro da faixa limite ideal para eclosão dos cistos, compreendido entre 8,0 e 8,5.
Obtenção dos náuplios de A. salina Leach
As larvas de A. salina Leach foram utilizadas na forma de náuplios. Os cistos foram colocados na incubadora, junto com a solução salina, em um dos lados do recipiente. A parte do sistema contendo os cistos foi recoberta com papel alumínio, para que as larvas, após a eclosão dos cistos, fossem atraídas pela luz do outro lado do sistema, forçando-as a atravessar à divisória. O conjunto permaneceu em incubação sob luz artificial amarela por 24 horas com auxílio de uma lâmpada comum de 40 W (Philips®), conforme a FIGURA 2. Com isso, os cistos que eclodiram foram coletados com auxílio de pipetas de Pasteur (Brand®).
Preparação da solução inicial
Inicialmente, foi pesado 0,02 g do extrato metanólico de E. caatingae (EMEc). Em seguida, solubilizou-se com o auxílio de 20 µL decremofor (SIGMA®) em 5 mL da solução salina, obtendo-se a solução inicial. Nos tubos de ensaio, foram adicionados 10, 20, 60, 120, 240, 480, 960 e 1920 µL da solução inicial, acrescentando-se 5 mL da solução salina, totalizando 10 mL em cada tudo. Sendo assim, resultou em concentrações de 8, 16, 48, 96, 192, 384, 768 e 1536 µg/mL do EMEc.
O segundo extrato utilizado foi a fase aquosa básica da espécie E. caatingae (FAEc). Seu emprego seguiu as mesmas etapas listadas para o primeiro extrato. Entretanto, não houve necessidade de dissolvê-lo em cremofor, devido a sua fácil solubilização na solução salina. Além disso, as concentrações da solução inicial adicionadas aos tubos de ensaio foram 60, 120, 240, 480, 960, 1920 e 3840 µL, resultando em 48, 96, 192, 384, 768, 1536, 3072 µg/mL.
O terceiro utilizado foi o extrato metanólico de E. revolutum (EMEr), que também seguiu as mesmas etapas anteriormente citadas com auxílio do cremofor. As concentrações da solução inicial adicionadas aos tubos de ensaio foram 30, 60, 120, 240, 480, 960, 1920 e 3840 µL, com concentrações finais de 24, 48, 96, 192, 384, 768, 1536, 3072 µg/mL.
Bioensaio com A. salina Leach
Para a realização dos ensaios foi adotada a metodologia descrita por Meyer et al.[15]. Após a obtenção dos náuplios pela eclosão dos cistos, foram adicionados 10 em cada tubo de ensaio, totalizando 10 náuplios em 10 mL de solução de cada concentração a ser analisada. Em seguida, aguardou-se 24 horas, sendo, então, procedida a contagem de náuplios vivos e mortos para posterior análise em programas estatísticos. Cada concentração foi testada em triplicata e em três testes posteriores, resultando em nove tubos de ensaio para cada concentração.
Grupo controle
Os grupos controles para os EMEc e EMEr consistiram na solução salina e a mesma quantidade de cremofor utilizados para a preparação das soluções iniciais. Para a FAEc utilizou-se a solução salina. Dessa forma, cada controle constituiu do solvente e agente solubilizador de cada extrato.
Análise estatística
Os valores de CL50 foram calculados por meio da expressão dos resultados como uma percentagem dos controles, e determinados graficamente a partir das curvas concentração-resposta por regressão não-linear, com intervalo de confiança de 95%, utilizando-se o programa GraphPad Prism versão 10, sistema operacional Windows.
Resultados e Discussão
Na análise dos resultados obtidos no bioensaio com A. salina, para o EMEc e a FAEc, observou-se que, com o aumento das concentrações testadas, houve aumento da letalidade nos náuplios, bem como, não houve morte nos grupos controles, conforme demonstrado na TABELA 1.
Os dados para EMEc foram plotados em um gráfico, obtendo-se a GRÁFICO 1. Com isso, foi possível calcular uma CL50 de 203,7 µg/mL com intervalo de confiança de 190,1-218,2 µg/mL.
: Curva concentração-resposta de diferentes concentrações do EMEc no bioensaio com A. salina Leach.
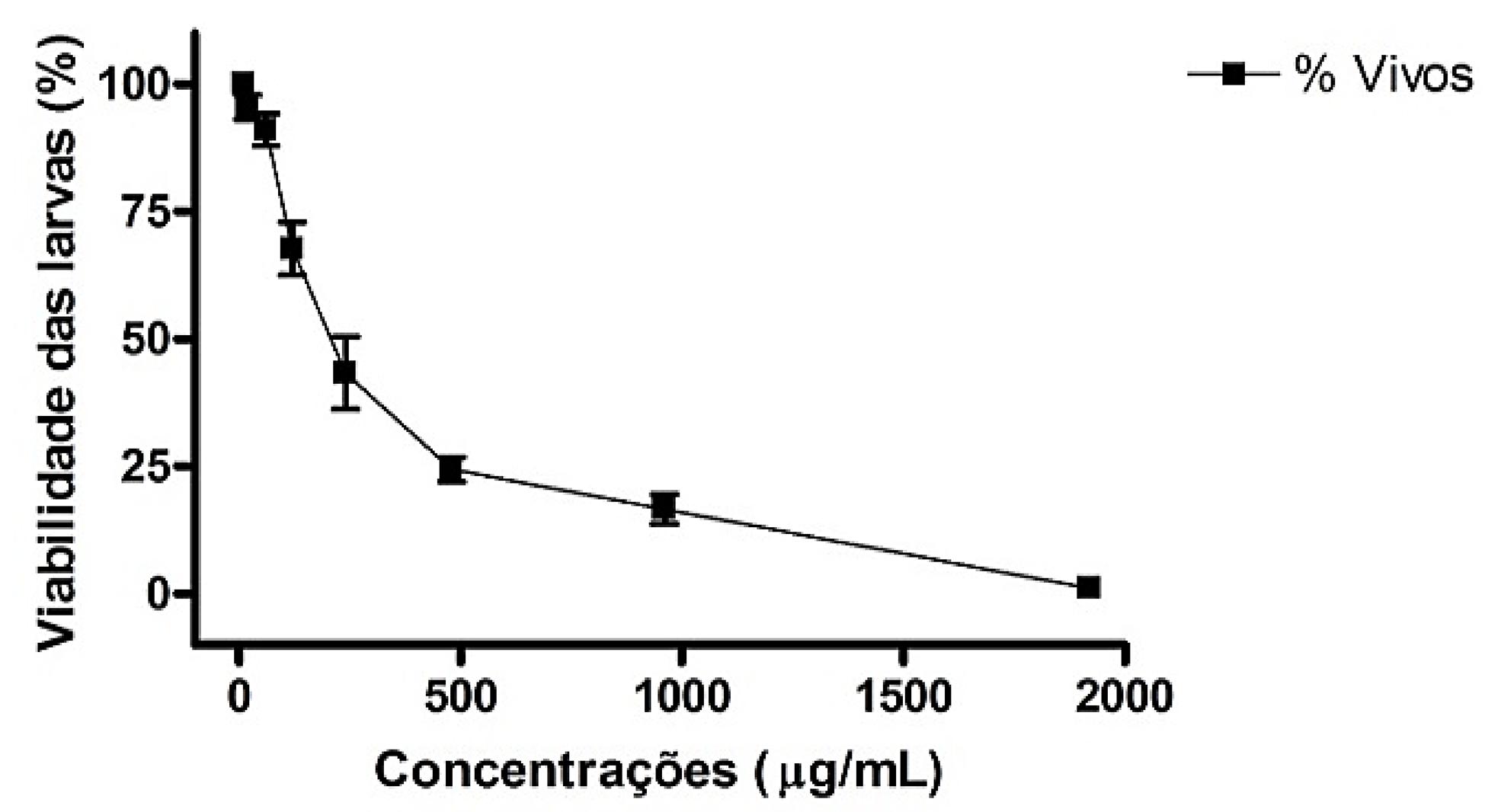
Com dados da FAEc, obteve-se o GRÁFICO 2 e uma CL50 de 1.074,0 (949,6-1.214,0) µg/mL.
: Curva concentração-resposta de diferentes concentrações da FAEc no bioensaio com A. salina Leach.
O EMEr causou, da mesma forma, aumento de letalidade para A. salina a partir de aumento das concentrações. Esses resultados estão descritos na TABELA 2.
Com esses dados obteve-se um valor de CL50 para o EMEr de 308,1 (241,1-393,6) µg/mL. A curva concentração-resposta está demonstrada no GRÁFICO 3.
: Curva concentração-resposta de diferentes concentrações do EMEr no bioensaio com A. salina Leach.
O uso indiscriminado de plantas sem qualquer conhecimento fitoquímico, farmacológico e, principalmente, toxicológico é de grande preocupação para a saúde. Assim, encontrar uma concentração segura e não letal para o uso terapêutico constitui-se em uma etapa de grande importância na pesquisa científica[5].
Os compostos, incluindo os de origem vegetal, para serem estudados sobre suas potencialidades terapêuticas, necessitam ser avaliados por ensaios de segurança. Como exemplo para avaliação da toxicidade, tem-se o teste da A. salina, que consiste em uma triagem inicial para a avaliação da toxicidade de inúmeras substâncias[6]. No presente estudo, utilizou-se esse bioensaio para determinar a toxicidade por meio da CL50 de EMEc, FAEc e EMEr.
A análise dos resultados obtidos no bioensaio com A. salina demonstrou a eficiência desse teste, uma vez que, pode-se determinar a toxicidade aguda dos extratos testados, semelhante a determinação da toxicidade de outras espécies vegetais e até substâncias sintéticas[16,17].
A relação entre o grau de toxicidade e a CL50 apresentada por extratos de plantas sobre larvas de A. salina, tanto extratos orgânicos, quanto extratos aquosos são bastante aceitos por pesquisadores. Os extratos com valores de CL50 acima de 1000 μg/mL, são considerados atóxicos, de baixa toxicidade quando a CL50 for superior a 500 μg/mL e inferior a 1000 μg/mL, toxicidade moderada para CL50 entre 100 a 500 μg/mL e muito tóxico para valores inferiores a 100 μg/mL[5].
Os resultados encontrados nesta pesquisa revelam que o EMEc foi considerado o mais tóxico, com uma CL50 classificada como moderada, assim como, o EMEr também apresentou uma CL50 entre 100 a 500 μg/mL. A A. salina tem a característica de apresenta reduzida tolerância a alterações ambientais e alta especificidade a interferências externas, garantindo a expressão de resultados nítidos em face de pequenas variações de qualidade do ambiente. Desta forma, foi possível determinar a CL50, observando a sensibilidade do microcrustáceo aos extratos metanólicos, utilizando um teste de letalidade que é considerado essencial como bioensaio preliminar no estudo de compostos com potencial atividade biológica[18].
Esses dados demonstram que, apesar de serem produtos naturais, os extratos vegetais e suas fases apresentam toxicidade e, por esse motivo, necessitam ser testados, para que sejam utilizados com segurança[9].
Os EMEc e EMEr, mesmo com toxicidade moderada, podem ser considerados com uma interessante bioatividade, pois a toxicidade para A. salina tem demonstrado uma boa correlação com outras atividades biológicas, como a citotóxica contra tumores humanos, leishmanicida e larvicida[5]. Além disso, permite ainda um direcionamento para outros estudos, de maneira que, substâncias tóxicas de extratos vegetais para o microcrustáceo podem ser testadas para outros fins como: herbicidas e inseticidas[19].
Para a FAEc, uma fase obtida a partir do EMEc, obteve-se uma CL50 acima de 1000 μg/mL, sendo assim considerada sem toxicidade significativa para A. salina, de acordo com a literatura. Os compostos que demonstram ausência de toxicidade devem prosseguir para estudos farmacológicos e toxicológicos in vivo para comprovação da sua eficácia e segurança[19].
Essa informação permite inferir que a FAEc é a mais indicada para estudos posteriores com finalidade farmacológica in vivo, por ter demonstrado o menor potencial tóxico. É importante salientar que mesmo não apresentando toxicidade, isso não implica ausência de metabólitos secundários com atividades bioativas, mas sim indica que esses metabólitos não causaram letalidade para A. salina. É provável que na obtenção de FAEc, os componentes mais tóxicos do EMEc não foram extraídos, sendo assim essa fase causou menos letalidade[20].
Nos grupos controles, em todos os bioensaios realizados, não foi observada letalidade, incluindo os grupos que continham cremofor®, demonstrando que a solução salina e esse agente solubilizante não interferiram nos resultados, sendo as mortes decorrentes unicamente da ação dos extratos e fase testados[20].
Os resultados quando convertidos em gráficos em forma de curva, demonstraram melhor que, conforme se aumentava a concentração dos extratos, observava-se crescimento da letalidade em A. salina de forma concentração-resposta, indicando toxicidade dependente da concentração[21]. Essa mortalidade de A. salina pelos extratos de plantas pode estar diretamente ligada a dois fatores: a presença de metabólitos prejudiciais à A. salina, como também as concentrações testadas[22].
A atividade toxicológica de uma planta depende diretamente dos seus metabólicos contidos em sua composição química, entretanto, a toxicidade dos compostos sofre influência de outros fatores, como: quantidade a ser ingerida, tolerância, condições de caráter ambiental e a própria intolerância do organismo intoxicado[23]. Por conseguinte, o gênero Erythroxylum é muito estudado por possuir constituintes químicos com amplo espectro de atividade, entre esses merecem destaque os alcaloides com esqueleto tropânico[24]. Porém, relacionar a toxicidade diretamente a constituintes específicos ainda é temerário, pois requer estudos mais detalhados.
Adicionalmente, o bioensaio também contribui para o monitoramento dos fracionamentos cromatográficos fitoquímicos, ou seja, determinar o extrato ou fase dos obtidos das espécies de Erythroxylum é o mais viável para dar continuidade a determinados estudos[25].
Esse trabalho permitiu avaliar a bioatividade e/ou toxicidade de extratos de Erythroxylum, contribuindo para o estudo do gênero vegetal, por meio de uma metodologia simples e confiável, sem a prática de utilizar animais vertebrados e maiores, proporcionando mais segurança para estudos farmacológicos posteriores.
Conclusão
O bioensaio utilizado para o monitoramento dos extratos se apresentou como um bom parâmetro de toxicidade. Com a determinação das CL50 dos três extratos testados, evidenciou-se que o EMEc e o EMEr apresentaram resultados semelhantes e toxicidade moderada, enquanto a FAEc demonstrou a maior CL50 e, consequentemente, a menor letalidade para A. salina. Todos os extratos demonstraram aumento de toxicidade em concentrações crescentes.
Contudo, é importante evidenciar a necessidade de estudos mais aprofundados utilizando testes farmacológicos e toxicológicos específicos, de forma a contribuir na propagação de conhecimento acerca das espécies de Erythroxylum, tendo como resultado a prevenção da segurança em saúde.
Agradecimentos
Os autores agradecem ao PIVIC/UFCG - Programa Institucional de Voluntários de Iniciação Científica da Universidade Federal de Campina Grande.
Referências
- 1 Sganzerla CM, Predebom AJ, Veloso J, Corralo VS, Roman Júnior WA. Revisão integrativa aplicada a levantamentos etnobotânicos de plantas medicinais no Brasil. Acta Amb Catarinense. 2022; 19(1): 1-16. ISSN: 2175-1552. [ https://doi.org/10.24021/raac.v19i1.6365 ].
» https://doi.org/10.24021/raac.v19i1.6365 - 2 Cruz JER, Guimarães IISM, Almeida KC, Amâncio NFG. Antifungal and antibacterial activities of the medicinal plant jatobá ( Hymenea courbaril Linneaus) occurring in the brazilian cerrado: a review. Res Soc Dev. 2023; 12(1): e22612139812. ISSN: 2525-3409. [ https://doi.org/10.33448/rsd-v12i1.39812 ].
» https://doi.org/10.33448/rsd-v12i1.39812 - 3 Lopes RS, Teixeira RS, Silva LS. Uso de plantas medicinais por moradores em uma comunidade rural no sul do Piauí. Diversitas J. 2023; 8(1): 62-70. ISSN: 2525-5215. [ https://doi.org/10.48017/dj.v8i1.2313 ].
» https://doi.org/10.48017/dj.v8i1.2313 - 4 Pereira Júnior GF, Azevedo MGB, Souza JBP. Cultivo e uso de plantas medicinais na comunidade rural Sítio Bujari, Cuité, Paraíba, Brasil. Saúde Meio Amb.: Rev Interdisciplin. 2024; 13(1): 61-80. ISSN: 2316-347X. [ https://doi.org/10.24302/sma.v13.4875 ].
» https://doi.org/10.24302/sma.v13.4875 - 5 Martins ACR, Costa JKN, Herbert A, Farias FRS, Rezende M, Kozlowski Júnior VA, et al. Toxicity assessment of mastic and pomegranate tinctures using the Artemia salina bioassay. Res Soc Dev. 2021; 10(3): e52010313751. ISSN: 2525-3409. [ https://doi.org/10.33448/rsd-v10i3.13751 ].
» https://doi.org/10.33448/rsd-v10i3.13751 - 6 Oliveira MCB, Cruz CKS, Rocha GMM, Brito MGA, Oliveira GAL. Toxicity and antibacterial activity of medicinal plants used in the treatment of respiratory diseases: an integrative review. Res Soc Dev. 2020; 9(9): e244997169. ISSN: 2525-3409. [ https://doi.org/10.33448/rsd-v9i9.7169 ].
» https://doi.org/10.33448/rsd-v9i9.7169 - 7 Gonçalves RN, Gonçalves JRSN, Buffon MCM, Negrelle RRB, Rattmann YD. Plantas medicinais na atenção primária à saúde: riscos, toxicidade e potencial para interação medicamentosa. Rev APS. 2022; 25(1): 120-153. ISSN: 1809-8363. [ https://doi.org/10.34019/1809-8363.2022.v25.16611 ].
» https://doi.org/10.34019/1809-8363.2022.v25.16611 - 8 Ntungwe NE , Domínguez-Martín EM , Roberto A , Tavares J , Isca VMS , Pereira P , et al . Artemia species: an important tool to screen general toxicity samples. Curr Pharm Des. 2020; 26(24): 2892-2908. ISSN: 1873-4286. [ https://doi.org/10.2174/1381612826666200406083035 ].
» https://doi.org/10.2174/1381612826666200406083035 - 9 Tchemra FGC, Pontes MM, Melo AR, Geus JL, Kozlowski Júnior VA, Rezende M. Evaluation of the toxicity of different concentrations of mallow and marigold tinctures through the bioassay with Artemia salina. Res Soc Dev. 2022; 11(3): e20511326255. ISSN: 2525-3409. [ https://doi.org/10.33448/rsd-v11i3.26255 ].
» https://doi.org/10.33448/rsd-v11i3.26255 - 10 Cordeiro LS, Loiola MIB. Flora do Ceará, Brasil: Erythroxylaceae. Rodriguésia. 2018; 69(2): 881-903. ISSN: 2175-7860. [ https://doi.org/10.1590/2175-7860201869242 ]
» https://doi.org/10.1590/2175-7860201869242 - 11 Lv Y, Tian T, Wang YJ, Huang J, Huang SX. Advances in chemistry and bioactivity of the genus Erythroxylum. Nat Prod Bioprospect. 2022; 12(15): 1-20. ISSN: 2192-2209. [ https://doi.org/10.1007/s13659-022-00338-z ].
» https://doi.org/10.1007/s13659-022-00338-z - 12 Macêdo LM, Souza Neta LC, Ribeiro EMO, Teles ALB. Atividades biológicas avaliadas in vitro de espécies do gênero Erythroxylum: uma revisão de literatura. Rev Colomb Cienc Quim Farm. 2022; 51(1): 316-347. ISSN: 1909-6356. [ https://doi.org/10.15446/rcciquifa.v51n1.96629 ].
» https://doi.org/10.15446/rcciquifa.v51n1.96629 - 13 Aguiar JS, Araújo RO, Rodrigues MD, Sena KXFR, Batista AM, Guerra MMP, et al. Antimicrobial, antiproliferative and proapoptotic activities of extract, fractions and isolated compounds from the stem of Erythroxylum caatingae Plowman. Int J Mol Sci. 2012; 13(4): 4124-4140. ISSN: 1422-0067. [ https://doi.org/10.3390/ijms13044124 ].
» https://doi.org/10.3390/ijms13044124 - 14 Agra MF, Silva KN, Basílio IJLD, Freitas PF, Barbosa-Filho JM. Survey of medicinal plants used in the region Northeast of Brazil. Rev Bras Farmacogn. 2008; 18(3): 472-508. ISSN: 1981-528X. [ https://doi.org/10.1590/S0102-695X2008000300023 ].
» https://doi.org/10.1590/S0102-695X2008000300023 - 15 Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, et al. Brine shrimp: a convenient general bioassay for active plant constituents. Pl Med. 1982; 45(5): 31-34. ISSN: 1439-0221. [ https://doi.org/10.1055/s-2007-971236 ].
» https://doi.org/10.1055/s-2007-971236 - 16 Santos ARS, Medeiros HIR, Santos JAM, Oliveira FS, Rufino JC. Avaliação toxicológica frente às larvas da Artemia salina Leach do 1,2:3,4-di-o-isopropilideno-alfa-D-galactopiranose. Educ Ciên Saúde. 2018; 5(1): 1-14. ISSN: 2358-7504. [ http://dx.doi.org/10.20438/ecs.v5i1.141 ].
» http://dx.doi.org/10.20438/ecs.v5i1.141 - 17 Marques GF, Brito TAM, Sobreira ALC, Costa DA, Oliveira FS. Avaliação de extratos de Sida planicaulis Cav. por meio do bioensaio com Artemia salina Leach. Educ Ciên Saúde. 2020; 7(1): 132-144. ISSN: 2358-7504. [ http://dx.doi.org/10.20438/ecs.v7i1.256 ].
» http://dx.doi.org/10.20438/ecs.v7i1.256 - 18 Lima MFF, Silva JWSA, Silva JK, Moura AHN, Lopes RLF, Cordeiro BA, et al. Toxicological evaluation by Artemia salina Leach bioassay of caatinga plant specimens. Braz J Health Rev. 2019; 2(6): 5950-5963. ISSN: 2595-6825. [ https://doi.org/10.34119/bjhrv2n6-088 ].
» https://doi.org/10.34119/bjhrv2n6-088 - 19 Dalarmi L, Sartor EB, Anjos CA, Fladzinski KA, Fernandes IC, Montrucchio DP, et al. Toxicidade preliminar dos extratos e frações obtidas das folhas e das cascas do caule da Dalbergia brasiliensis. Rev JRG. 2024; 7(14): e14896. ISSN: 2595-1661. [ https://doi.org/10.55892/jrg.v7i14.896 ].
» https://doi.org/10.55892/jrg.v7i14.896 - 20 Dantas DL , Sousa APM , Costa JD , Oliveira JAM , Almeida AF , Apolinário MO , et al . Toxicological study of seeds Moringa oleifera Lam. using the Artemia salina Leach test. Res Soc Dev. 2020; 9(9): e457997332. ISSN: 2525-3409. [ https://doi.org/10.33448/rsd-v9i9.7332 ].
» https://doi.org/10.33448/rsd-v9i9.7332 - 21 Siqueira JS, Ferreira LRD, Lima VS, Santos RC, Oliveira AM, Soares LAL, et al. Phytochemical prospection and evaluation of the cytoxic potentials and antioxidants of the Microgramma vaccinnifolia leaves extract. Braz J Develop. 2020; 6(4): 20318-20331. ISSN: 2525- 8761.[ https://doi.org/10.34117/bjdv6n4-271 ].
» https://doi.org/10.34117/bjdv6n4-271 - 22 Rolim CEL, Quaresma ACSQ, Chagas CKS, Silva Júnior JOC, Melo PRS, Dolabela MF. Pharmacognostic study, phytochemical and toxicity assessment of Justicia secunda Vahl. Res Soc Dev. 2022; 11(12): e240111234344. ISSN: 2525-3409. [ https://doi.org/10.33448/rsd-v11i12.34344 ].
» https://doi.org/10.33448/rsd-v11i12.34344 - 23 Pinho BLS, Sousa BM, Tavares JVM, Souza WFS, Almeida SVS, Silveira SS, et al. Atividade citotóxica do extrato etanólico das folhas secas de Turnera subulata (charles plumier) em hemácias e Artemia salina. Conexões Interdiscip. 2024; 1(3): 144-152. ISSN: 2965-8829. [ https://www.conexoesinterdisciplinares.com/rci/index.php/ojs/article/view/29 ].
» https://www.conexoesinterdisciplinares.com/rci/index.php/ojs/article/view/29 - 24 Pereira GJV, Freitas IC, Ramos JM, Souza LS. Tradicionalidade das espécies de Erythroxylum conhecidas como "coca" na região Sul-Americana: história, propriedades químicas e aspectos farmacológicos. Braz J Health Rev. 2023; 6(6): 33107-33119. ISSN: 2595-6825. [ https://doi.org/10.34119/bjhrv6n6-504 ].
» https://doi.org/10.34119/bjhrv6n6-504 - 25 Senigalia RLC, Ferreira ALS, Kratz D, Coelho MFB, Santos ASRM, Castro DA. Toxicity of vegetable extracts from plants in the cerrado for medicine use. Braz J Develop. 2020; 6(8): 55308-55317. ISSN: 2525-8761. [ https://doi.org/10.34117/bjdv6n8-088 ].
» https://doi.org/10.34117/bjdv6n8-088
-
Fonte de financiamento
Financiamento próprio.
Datas de Publicação
- Publicação nesta coleção
15 Maio 2025 - Data do Fascículo
Abr 2025
Histórico
- Recebido
07 Nov 2024 - Aceito
02 Abr 2025
 Investigação de Erythroxylum caatingae e Erythroxylum revolutum frente à Artemia salina
Investigação de Erythroxylum caatingae e Erythroxylum revolutum frente à Artemia salina