BOTÂNICA
Um novo ecótipo de Mikania glomerata Spreng. (Asteraceae) rico em óleo essencial no Sul do Brasil
A new ecotype of Mikania glomerata Spreng. (Asteraceae) rich in essential oil in southern Brazil
Resumo
O guaco (Mikania glomerata) é uma das principais plantas bioativas industrializadas no Brasil. A fitoprospecção de acessos de Mikania com objetivo de formação de um Banco Ativo de Germoplasma (BAG) culminou com a descoberta de um ecótipo de Mikania glomerata distinto dos acessos convencionais. O material foi encontrado na localidade de Cobrinha de Ouro, município de Palhoça, Santa Catarina. Propágulos deste ecótipo foram coletados e cultivados visando obter plantas adultas para posterior avaliação. O mesmo procedimento foi realizado para uma matriz representativa de Mikania glomerata típica, obtida na Vila Nova do Moura, município de Canelinha, Santa Catarina. Após um ano de cultivo a campo constatou-se existir fortes contrastes morfológicos e produtivos em biomassa entre os ecótipos, bem como diferenças significativas no rendimento de óleo essencial e na composição de terpenos. O acesso convencional apresenta baixo rendimento de óleo essencial, cuja composição é predominantemente composta de pinenos (quimiótipo pineno - Q-P). Além disso, este acesso apresenta elevado teor de cumarina e foi caracterizado como quimiótipo pineno. Já o acesso descoberto foi caracterizado como quimiótipomirceno/limoneno/felandreno (Q-MLF), e com baixos teores de cumarina.
- Palavras-chave:
- guaco.
- botânica.
- quimiótipos, mirceno.
- limoneno.
- felandreno.
Abstract
The guaco (Mikania glomerata) is one of the major bioactive plants industrialized in Brazil. Phytoprospection of Mikania access culminated in the discovery of one distinct ecotype of Mikania glomerata. The material was found in the locality Cobrinha de Ouro, in Palhoça, SC, Brazil. Seedlings this ecotype was collected and propagated in order to obtain adult plants for later evaluation. The same procedure was done to a representative array of Mikania glomerata, retrieved in Vila Nova do Moura, in Canelinha, SC, Brazil. After a year of cultivation under controlled conditions and field it was founded strong morphological and productive contrasts among the ecotypes, as well as significant differences in the essential oil yield and terpenes composition in the essential oil. Conventional access was characterized as pinene chemotype (Q-P), with high coumarin content, while access recently discovered was characterized as myrcen/limonene/felandrenechemotype (Q-MLF), with low coumarin content.
- Key-words:
- guaco.
- botany.
- chemotypes.
- mircene.
- limonene.
- felandrene.
Introdução
O gênero Mikania compreende cerca de 450 espécies distribuídas principalmente nas regiões tropicais e temperadas da América, com um elemento Pantropical (Robinson, Schilling e Panero 2009). Para o Brasil são aceitas 203 espécies (Ritter et al., 2015), sendo queas mais utilizadas na medicina popular para tratamento das afecções respiratórias são Mikania glomerata Spreng. e M. laevigata Sch. Bip. ex Baker, conhecidas peh nome de guaco (Panizza, 1997).
A identificação das espécies de Mikania permanece um dilema, tendo em vista a grande diversidade fenotípica encontrada entre algum espécies, principalmente em Mikania glomerata. Isso pode resultar em uso incorreto de espécies diversas de guaco como sendo aquela indicada na Farmacopeia Brasileira e aprovada atualmente pelos órgãos oficiais de saúde no Brasil (ANVISA, 2011).
Mikania glomerata apresenta ação anti-inflamatória (Oliveira, Oga e Akisue, 1985), antialérgica (Fierro et al., 1999), espasmódica e broncodilatadora (Leite et al., 1993), sendo esta última propriedade atribuída às cumarinas (Celeghini, Vilegas e Lanças, 2001), além de ações antifúngica e antibacteriana (Misrae Dixit, 1979, Rossi-Bergmann, Costa e Moraes, 1997).
As folhas contêm cumarinas, saponinas, taninos, alcaloides, esteróides (Oliveira, Oga e Akisue, 1985), cineol, borneol e eugenol (Franco, 1996). Apresenta normalmente baixos níveis de óleo essencial nas folhas (0,07%) e ramos, sendo que o componente principal do óleo é o espatulenol (23,7%) (Farias et al., 1998).
As populações existentes de guaco na Floresta Atlântica e nos cultivos domésticos apresentam ampla variabilidade fenotípica, principalmente nos aspectos morfológicos foliares (FIGURA 1), e também no rendimento de biomassa e conteúdo de cumarina (Silva Júnior, 2010).

O objetivo deste trabalho é apresentar as característica diferenciadoras de um novo acesso de Mikania glomerata em seus aspectos morfológicos, fenológicos, genéticos e químicos, comparando-o com um acesso típico da espécie.
Material e métodos
Foram avaliados dois ecótipos (depois caracterizados como quimiótipos) de Mikania glomerata, designados Q-P (quimiótipo pineno) - Mikania glomerata típico, coletado na localidade da Vila Nova do Moura, em Canelinha - SC e Q-MLF (quimiótipomirceno/limoneno/felandreno) Mikania glomerata atípico, coletado na localidade Cobrinha de Ouro, Palhoça - SC. O Q-P foi georreferenciado segundo as coordenadas 27° 12' 26" sul e 48° 53" 10" oeste, na altitude de 125 m, enquanto que o Q-MLF localizou-se nas coordenadas 27° 43' 21''sul e 48° 43' 06''oeste, na altitude 27 m, ambos nativos do bioma Floresta Ombrófila Densa.
Exsicatas dos quimiótipos foram encaminhadas para identificação ao Departamento de Botânica - UFRGS, onde foram confirmadas como sendo Mikania glomerata. O material testemunho foi depositado no Herbário Barbosa Rodrigues (HBR), em Itajaí, SC, sob os números de Voucher 54.403 e 54.404.
Das plantas matrizes foram obtidas estacas caulinares medianas com dois nós e duas folhas remanescentes, sendo que os limbos foram seccionados transversalmente, para redução da área foliar evapo-transpirante. A rizogênese das estacas ocorreu em substrato composto de casca de arroz carbonizada, em abrigo protegido por telado plástico com 70% de sombra e com irrigação intermitente por nebulização, em turnos de dois minutos, cinco vezes ao dia. As mudas obtidas foram transferidas para vasos plásticos com capacidade de 7 litros, contendo substrato composto por solo + húmus + casca de arroz carbonizada (4:2:1) e aclimatadas em abrigo de telado com 50% de sombra e irrigação por nebulização.
Adotou-se o delineamento experimental de blocos ao acaso, com quatro repetições constituídas por uma planta (parcela útil) como unidade amostral de cada quimiótipo. As mudas foram para o campo utilizando-se como adubação de plantio cama de aviário (1,0 L/cova) e fosfato natural (200 g/cova). O tutoramento das plantas foi feito com arame n.12, disposto horizontalmente entre palanques de concreto. As plantas foram avaliadas após 10 meses de cultivo, no mês de outubro de 2010. Foram avaliadas as dimensões foliares (limbo e pecíolo) utilizando-se um paquímetro digital e amostra de dez folhas coletadas no terço médio das plantas, além do comprimento do entrenó e a produção de matéria seca.
Para a determinação do rendimento de óleo essencial dos dois quimiótipos utilizou-se, para cada um dos acessos, amostras compostas constituídas por folhas coletadas das quatro plantas. Foram separadas sub-amostras para determinação da matéria seca e para as análises laboratoriais que determinaram os teores de óleo essencial. A massa seca foi determinada após a secagem das amostras de folhas frescas em estufa de ventilação forçada, com temperatura de 60oC, por 72 horas.
A extração do óleo essencial foi realizada através de hidrodestilação durante quatro horas em aparelho tipo Clevenger. Para a determinação dos seus principais componentes, o óleo foi diluído 400x em hexa no e injetado em um equipamento de Cromatografia Gasosa Acoplada a Espectrometria de Massas (GC/ MS), utilizando coluna ZB-5MS, 30m x 0,25mm x filme 0,25um. A programação do forno de colunas iniciou com temperatura de 60oC (4 minutos), rampa de 6oC/minuto até 210oC, permanecendo por 6 minutos, com tempo total da corrida de 35 minutos. A temperatura do injetor foi de 250oC e o fluxo de hélio na coluna foi de 1,0 ml/minuto.
Para quantificar o teor de cumarina foi preparado o extrato fluido das folhas seguindo a metodologia recomendada pela Farmacopeia Brasileira (Silva, 1929), que é aceita até hoje. A determinação de cumarina foi realizada por Cromatografia Liquida de Alta Eficiência, com modificações do método inicial mente proposto por Deschamps e Ramos (2002).
A caracterização genética foi feita através dos marcadores microssatélites nucleares Mm19EF614133 e Mm27EF614136 (Hong, Shen e Cao, 2008), microssatélites cloroplastidiais ccmp2, ccmp3 e ccmp5 (Weising e Gardner, 1999), e microssatélites nucleares Guaco_1 e Guaco_2 (Pavanelli et al., 2010). As condições de amplificação do DNA foram às indicadas nas publicações originais, modificando-se a extensão final, que passou a ser de 60 minutos. A visualização dos alelos foi feita em analisador genético automático AB 3130 (Applied Biosystems) com capilar de 36 cm e polímero POP7. Os dados de amplificação de bandas foram anotados em número de pares de bases (pb), conforme a genotipagem fornecida pelo programa Gene Mapper (Applied Biosystems), sendo transformados em uma matriz de presença e ausência de alelos, que foi submeti da à análise de conglomerados utilizando o Simple Matching Coefficient como medida de similaridade e o método aglomerativo UPGMA para a geração do dendrograma de relações entre os acessos.
A caracterização microfotográfica dos ecótipos foi feita utilizando-se amostras do limbo foliar e pecíolo. Utilizou-se microscópio estereoscópico Lambda Let2, com aumento de 10 x 30. Os pecíolos dos dois ecótipos foram cortados transversalmente utilizando-se lâmina de barbear e corte a mão livre. Os cortes foram montados entre lâmina e lamínula e fotografados. Para a visualização da face dorsal e ventral do limbo, utilizaram-se pequenos fragmentos quadrangulares da parte central do limbo (0,5 cm x 0,5 cm), junto à nervura central. Foram coletados dez cipselas de cada ecótipo para a verificação da morfologia.
Resultados e discussão
Os dois ecótipos avaliados (FIGURA 2) apresentaram variações morfológicas já observadas por Ritter e Miotto (2005), fenológicas, produtivas, genéticas e químicas. Ambos ecótipos apresentaram ramos lenhosos, cilíndricos, estriados com folhas opostas, pecioladas, sem estípulas, ovaladas a lanceolado-hastadas, 3-5 lóbulos, 6-24 x 4-11 cm, margem inteira, base cordada a atenuada, ápice acuminado, glabras em ambas as faces, trinérveas a qüinqüenérveas, conforme descrição prévia de Ritter e Miotto (2005).

Comparando-se os dois ecótipos, Mikania glomerata Q-P apresentou folhas com limbo proporcionalmente menos largo que o Q-MLF (TABELA 1 e FIGURA 3). Verificaram-se também variações na largura e peso das folhas, bem como na densidade foliar e comprimento de entrenó. Observou-se que o Q-P apresenta maior produção de biomassa aérea, maior teor de ma téria seca e maior número de folhas que o Q-MLF, que por sua vez apresenta um maior índice de enfolhamento, pecíolos mais robustos, entrenós maiores e folhas mais largas. O alto índice foliar do Q-MLF sugere maior rendimento de folhas por planta, o que pode contribuir para obtenção de quantidades mais elevadas dos constituintes de interesse presentes na planta.
| Quimiótipo | Índice Foliar*1 (%) |
MFPA*2 (g) |
MFC*3 (g) |
Rendimento folhas/planta | |
| Base fresca (g) |
Base seca (g) |
||||
| Q-P | 37,72 | 7047,67 | 4389,24 | 2658,29 | 495,41 |
| Q-MLF | 50,21 | 912,00 | 438,00 | 458,00 | 52,72 |
| P | 0,00048 | 0,00000 | 0,00001 | 0,00003 | 0,00002 |
| CV(%) | 2,43 | 0,93 | 3,98 | 4,90 | 4,43 |
| Quimiótipo | Pecíolo | Entrenó | |||
| Comprimento (cm) |
Diâmetro (mm) |
Comprimento (cm) |
Diâmetro (mm) |
||
| Q-P | 4,01 | 2,71 | 13,31 | 6,60 | |
| Q-MLF | 5,54 | 3,36 | 17,54 | 5,49 | |
| p | 0,00000 | 0,00000 | 0,00000 | 0,00000 | |
| CV(%) | 11,37 | 14,36 | 11,88 | 11,73 | |
| Quimiótipo | Folhas | ||||
| Comprimento (cm) |
Largura (cm) |
Espessura (mm) |
Matéria Seca (%) |
Número Total/ Planta |
|
| Q-P | 13,60 | 4,83 | 0,67 | 18,68 | 3307,00 |
| Q-MLF | 14,34 | 11,93 | 0,68 | 11,51 | 394,75 |
| p | 0,00286 | 0,00000 | NS | 0,00000 | 0,00000 |
| CV(%) | 7,66 | 9,67 | 9,11 | 8,32 | 1,44 |
| p: probabilidade pelo teste F CV: coeficiente de variação. NS: não significativo. *1Relação entre o peso de folhas secas e o peso total da parte aérea; *2Massa fresca da parte aérea; *3 Massa fresca do caule e ramos, sem as folhas. | |||||

A face abaxial das folhas jovens do Q-MLF apre senta suave tom violáceo, provavelmente devido à presença de antocianinas (FIGURA 4). As folhas deste quimiótipo apresentam aroma resinoso-balsâmico e o sabor é amargo, enquanto o Q-P apresenta folhas com aroma baunilha e sabor acridoce. Nas condições edafoclimáticas do local do estudo, o quimiótico Q-P tende a ser mais tardio no florescimento, normalmente, em meados da primavera, enquanto o Q-MLF floresce ao final do inverno (FIGURA 5).


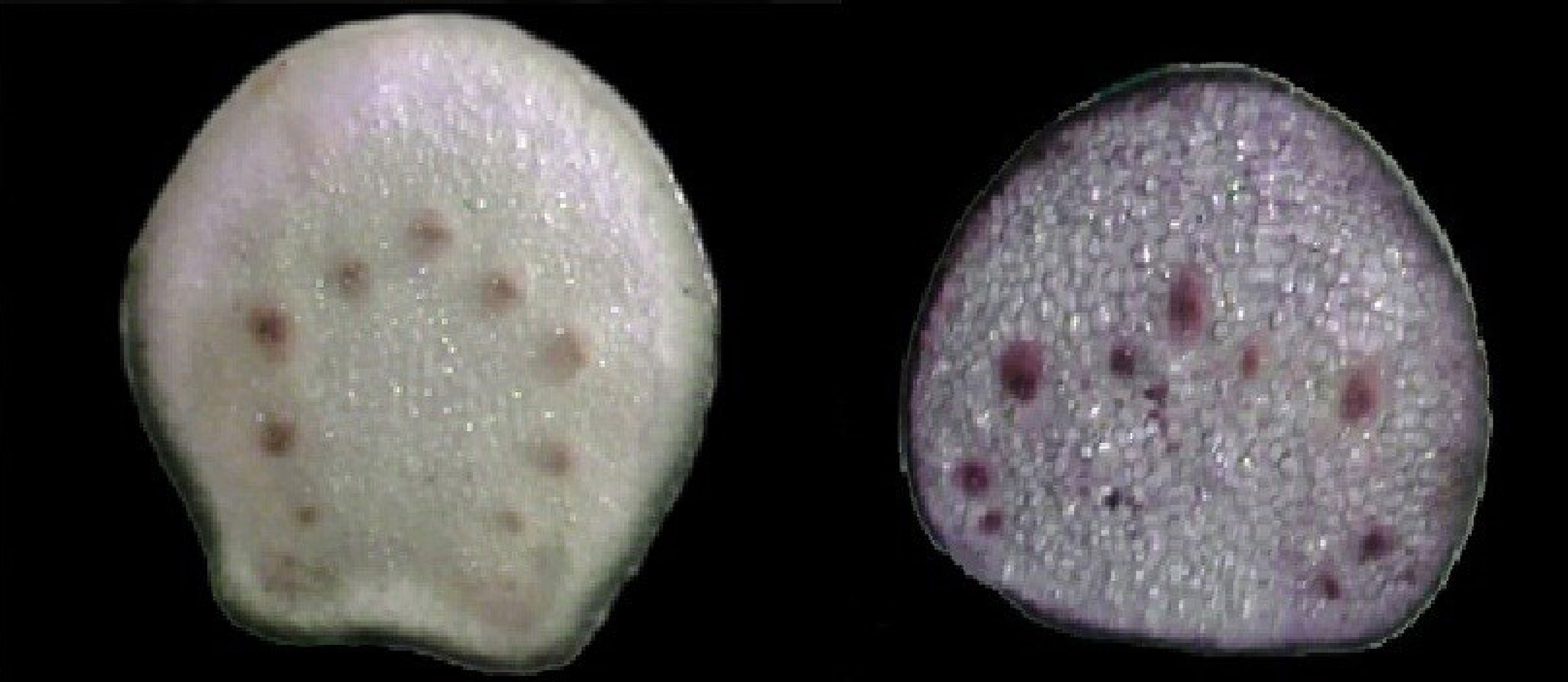
A visualização das folhas através de microscopia estereoscópica revelou diferenças sutis nas venações quaternárias. No Q-P as nervuras quaternárias da face dorsal das folhas são mais lineares e menos ramificadas que o Q-MLF (FIGURA 6). O corte transversal da base do pecíolo revelou que o Q-MLF apresenta o floema disposto de forma desordenada, enquanto que no Q-P os vasos apresentam uma equidistância regular no parênquima. Nota-se que as células do parênquima cortical do Q-P são menores que as do Q-MLF (FIGURA 7). A cipsela do Q-MLF distingue-se pelo seu maior porte e pelas estrias mais evidentes na superfície do fruto (FIGURA 8). O padrão estriado na superfície do fruto de Mikania glomerata foi anteriormente observado por Ritter e Miotto (2006).


Constatou-se também que o Q-MLF produziu cerca de seis vezes mais óleo essencial que o Q-P, algo excepcional à espécie Mikania glomerata (TABELA 2). Este alto rendimento abre possibilidades para o aproveitamento industrial deste ecótipo para a utilização do óleo essencial. O rendimento de óleo essencial para espécies de Mikania normalmente é baixo, entre eles, os descritos Mikania burchelli Baker (0,07%), Mikania glomerata (0,07%), Mikania hirsutissima DC. (0,9%), Mikania micranta Kunth (0,09%) e Mikania paranensis Dusén (0,35%) (Farias et al., 1998).
| Componentes | Quimiótipo Q-P |
Quimiótipo Q-MLF |
| Óleo essencial (%) | 0,12 | 0,73 |
| Cumarina (%) | 0,96 | 0,09 |
| * Extração do óleo essencial através de hidrodestilação durante quatro horas em Clevenger. | ||
A análise química dos óleos essenciais entre os quimiótipos apresentou majoritariamente mirceno, limoneno e felandreno no quimiótipo Q-MLF e pinenos no quimiótipo Q-P (TABELA 3). A ocorrência de metabólitos secundários majoritários nas espécies vegetais remete a uma área da botânica conhecida como quimiossistemática, a qual pode ajudar a deslindar impasses na área de taxonomia vegetal (Gottlieb, 1982).
| Terpenos | Quimiótipos (teor de terpenos em %) | |
| Q-MLF | Q-P | |
| β-mirceno | 19,59 | 12,97 |
| D-limoneno | 19,59 | 3,43 |
| α-felandreno | 13,63 | - |
| γ-terpineno | 10,16 | - |
| Terpinoleno | 9,00 | - |
| α-pineno | 8,47 | 46,66 |
| O-cimeno | 6,58 | - |
| α-terpineno | 5,25 | - |
| β-felandreno | 3,09 | - |
| β-pineno | 2,89 | 28,17 |
| Cis-ocimeno | 1,75 | - |
| Sabineno | - | 4,32 |
| * Método de Cromatografia Gasosa acoplada a Espectrometria de Massas (GC/MS) | ||
Monoterpenos parecem ocorrer em apenas 1/3 das espécies do gênero Mikania, sendo que a maior parte dos compostos químicos encontrados nas espécies deste gênero corresponde a componentes não voláteis (Alves, 2009).
Quanto aos teores de cumarina, o quimiótipo Q-MLF apresentou baixo teor deste ativo marcador da espécie, ao passo que amostras de Mikania glomerata Q-P obtidas no Banco de Germoplasma de Bioativas da Epagri - Estação Experimental de Itajaí revelaram a presença de altos níveis de cumarina nas folhas. Vale lembrar que a cumarina ocorre em apenas 20% das espécies de Mikania (Celeghini, Vilegas e Lanças, 2001), notadamente em M. micranta Kunth; M. laevigata Sch. Bip. ex Baker e M. glomerata.
Trabalhos anteriormente realizados com Mikania glomerata descreveram a presença da cumarina como substância majoritária em extratos alcoólicos da planta (Kuster e Rocha, 2001). Já para a caracterização química do óleo essencial desta espécie foram identificados: α-pineno (Dos Santos, Cabral e Tomassini, 1996) e germacreno-D (41,45%); espatulenol como principal terpeno (Farias et al., 1998); espatulenol (23,72%) e óxido de cariofileno (24,84%) além de cariofileno, germacreno, cadineno e bisaboleno (Limberger, 1999; Limberger et al., 2001). Apesar de poucos estudos realizados com caracterização química de óleo essencial de Mikania glomerata, os valores encontrados neste trabalho mostram poucas diferenças em relação aos componentes descritos na literatura. Segundo Simões e Spitzer (2003), estas variações ocorrem na composição química de um óleo essencial, devido a fatores como época da colheita, estágio de desenvolvimento da planta, clima e constituição do solo.
As análises genéticas revelaram um total de 11alelos em cinco dos sete microssatélites avaliados. Para os microssatélites nucleares Mm19EF614133 e Mm27EF614136 não houve amplificação, o que provavelmente se deve ao fato de os mesmos terem sido desenvolvidos especificamente para a espécie M. micrantha, na qual os autores encontraram alelos variando entre 229 e 241 pb (Mm19EF614133) e entre 208 e 222pb (Mm27EF614136) (Hong, Shen e Cao, 2008). Os restantes cinco microssatélites apre sentaram produtos de amplificação, sendo que dois deles foram polimórficos, ou seja, houve diferenças entre os dois quimiótipos na ocorrência de bandas.
No caso dos microssatélites ccmp2, ccmp3 e ccmp5, desenvolvidos para amplificar DNA cloroplastidial de plantas dicotiledôneas, poderiam ser esperados alelos variando de 180 a 234 pb (ccmp2), 107 a 130 pb (ccmp3) e 77 a 125 pb (ccmp5) (Weising e Gardner, 1999). No presente trabalho, o microssatélite ccmp2 apresentou um alelo de tamanho 207 pb para o quimiótipo Q-P, enquanto que o quimiótipo Q-MLF apresentou um alelo de tamanho 209 pb. Para os microssatélites ccmp3 e ccmp5, que foram monomórficos, foram encontrados alelos de 129 e de 100 pb, respectivamente, não havendo portanto diferenças entre os quimiótipos. A presença de um único alelo por planta nesses três microssatélites cloroplastidiais concorda com o esperado para a expressão haploide desse tipo de organela (Provan et al., 2001), e a ocorrência de polimorfismo, como aqui encontrada para o microssatélite ccmp2, demonstra a utilidade desse marcador cloroplastidial para estudos de genética de populações e de filogenia, para o entendimento da evolução e domesticação das culturas e para estudos da relativa contribuição do movimento de sementes e pólen no fluxo gênico entre populações (Weising e Gardner, 1999; Provan et al., 2001).
Para o microssatélite nuclear Guaco_1, o quimiótipo Q-P apresentou três alelos, de tamanhos 238, 242 e 244 pb, enquanto que o quimiótipo Q-MLF apresentou dois alelos, de tamanhos 228 e 243 pb. Resultados semelhantes haviam sido obtidos anteriormente, quando outro acesso de M. glomerata analisado também apresentou três alelos, postulando-se a ocorrência de poliploidia ou de duplicação cromossomal localizada (Tack et al., 2012). O mesmo fenômeno poderia estar ocorrendo com o acesso Q-MLF no presente estudo, corroborando dados já relatados para o polimorfismo cromossomal em outras espécies de Mikania, onde há ocorrência de aneuploidia, poliploidia, cromossomos B e outras inversões, adições e deleções de DNA (Ruas e Ruas, 1987; Ruas e Aguiar-Perecin, 1997; Maffei et al., 1999).
Para o microssatélite nuclear Guaco_2, foram encontrados dois alelos, de tamanhos 102 e 172 pb, não havendo diferença entre os dois quimiótipos. Tamanhos semelhantes de alelos haviam sido obtidos por Pavanelli e colaboradores (2010), exceto pelo alelo 102 pb encontrado no presente trabalho, que poderia ser um artefato da técnica.
Através da análise multivariada foi possível determi nar apenas 47% de similaridade entre os quimiótipos Q-P e Q-MLF, já que em somente seis dos 11 alelos encontrados houve coincidência entre os dois.
Este e os demais resultados genéticos aqui relatados são bastante sugestivos quanto à utilidade da técnica de marcadores moleculares do tipo microssatélite para estudos da diversidade genética intraespecifica de acessos de Mikania. Destaca-se também a alta transferibilidade de marcadores desenhados para outras espécies, como no caso dos marcadores ccmp utilizados no presente trabalho, que foram desenvolvidos a partir do sequenciamento do genoma de cloroplastos de Nicotiana e de outros taxa de angiospermas (Weising e Gardner, 1999), e que tiveram 100% de transferibilidade para estudos da variabilidade do gênero Mikania.
As variações fitométricas observadas entre os dois quimiótipos Q-P e Q-MLF ressaltam a ampla plasticidade fenotípica característica da espécie Mikania glomerata. Silva Júnior, Deschamps e Osaida (2010) verificaram haver grande variabilidade fenotípica em Mikania glomerata, evidenciada principalmente pelo polimorfismo foliar (folhas hastadas, triangulares e ovaladas). Segundo Ritter e Miotto (2005), Mikania glomerata é muitas vezes confundida com M. laevigata, espécie próxima, principalmente porque pode apresentar uma variação na forma das folhas, geralmente as que estão localizadas próximo à inflorescência. Estas folhas apresentam-se ovalado-lanceoladas, muito semelhantes às de M. laevigata. A confusão na identificação ocorre em exemplares mal coletados que apresentam apenas folhas junto à inflorescência. Estas duas espécies diferenciam-se, principalmente, pelo formato das folhas e pelo odor característico de M. laevigata que normalmente permanece no material seco.
Ficou comprovada no presente trabalho a ampla diversidade existente entre os quimiótipos estudados, em especial quanto aos aspectos fitométricos, produção de biomassa foliar, fitoquímicos (em especial o alto teor de óleo essencial e ausência de cumarina no quimiótipo Q-MLF) e genéticos. O conjunto destas diferenças comprova que a plasticidade fenotípica - característica das espécies do gênero Mikania vai além do polimorfismo foliar. A identificação dos quimiótipos de Mikania glomerata a partir da estrutura floral, também não é eficiente, pois a morfologia é semelhante entre eles e entre M. glomerata e M. laevigata. Este procedimento de identificação botânica da espécie - fortemente ancorado nas estruturas foliares e florais pode propiciar o uso inadequado de M. glomerata pela sociedade, uma vez que ocorrem ecótipos/quimiótipos significativamente diferentes quanto a sua constituição química e carga genética.
Considerando a importância do guaco para a saúde pública e as características evidenciadas por este trabalho acerca do M. glomerata quimiótipo Q-MLF, recomenda-se a busca de novos descritores morfológicos, químicos e genéticos que garantam a correta identificação desta consagrada espécie da Farmacopeia Brasileira.
Agradecimentos
Os autores agradecem a Fapesc pelo financiamento do Projeto Desenvolvimento Agrotecnológico e Testes Laboratoriais de Espécies Bioativas de Interesse Industrial no Estado de Santa Catarina, que viabilizou este estudo.
Referências
ANVISA. AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. 2011. Formulário de fitoterápicos da farmacopeia brasileira: Brasília. 126p.
ALVES, T.L.S.2009. Perfil químico micromolecular e análise quimiotaxonômica dos gêneros Stevia Cav. e Mikania Willd. (Asteraceae, Eupatorieae). Porto Alegre: UFRGS.87p. (Dissertação de Mestrado).
CELEGHINI, R.M.S.; VILEGAS, J.H.Y; LANÇAS, F.M. 2001 . Extraction and quantitative HPLC analysis of coumarin in hydroalcoholic extracts of Mikania glomerata Spreng. (“guaco”) leaves. Journal of the Brazilian Chemical Society, v.12, p.706-709.
DESCHAMPS, F.C.; RAMOS, L.P. 2002. Método para a determinação de ácidos fenólicos na parede celular das forragens. Revista Brasileira de Zootecnia, v.31, n.4, p.1634-39.
DOS SANTOS, T.C.; CABRAL, L.M.; TOMASSIN I, T.C.B. 1996. Contribuição para o estudo fitoquímico de Mikania glomerata Sprengel. In: Simpósio de Plantas Medicinais do Brasil, 14, Florianópolis. Resumos. Florianópolis: UFSC/CEME/FINEP/ CNPQ, p.177. Q-034.
FARIAS, A. T; LIMBERGER, R. P; SIMÕES PIRES, C. A; HENRIQUES, A. T 1998. Análise da composição química do óleo volátil de cinco espécies do gênero Mikania. In: Simpósio De Plantas Medicinais do Brasil, XV. Águas de Lindóia - SP. Anais... São Paulo: UNIFESP, 1998, p. 03.195.
FIERRO, I.M.; SILVA, A.C.; LOPES, C.D.; MOURA, R.S.; BARJA-FIDALGO, C. 1999. Studies on the anti-allergic activity of Mikania glomerata. Journal of Ethnopharmacology, v.66, p.19-24. FRANCO, L.L. 1996. As sensacionais plantas medicinais, campeãs de poder curativo. Curitiba: Santa Mônica, 241p.
GOTTLIEB, O.R. 1982. Micromolecular evolution, systematics and ecology an essay into a novel botanical discipline. Berlin/New York: Spring Berlag, 170p.
HONG, L.; SHEN, H.; CAO, H. 2008. Development and characterization of microsatellite markers for the invasive weed Mikania micrantha (Asteraceae). Molecular Ecology Resources, n.8, p.193-195.
KUSTER, R.M.; ROCHA, L.M. 2001. Cumarina, cromonas e xantonas. In: SIMÕES, C.M.O., SCHENKEL, E.P.; GOSMANN, G.; MELLO, J.C.P. MENTZ, L.A.; PETROVICK, P.R. ed. Farmacognosia, da planta ao medicamento. 3th Ed. Porto Alegre/Florianópolis: UFRGS/UFSC, p.461-77.
LEITE, M.G.R. SOUZA, C.L.; SILVA, M.A.M.; MOREIRA, L.K.A.; MATOS, F.J.A.; VIANA, G.S.B. 1993. Estudo farmacológico comparativo de Mikania glomerata Spreng. (guaco), Justicia pectoralis Jacq (anador) e Torresea cearensis (cumaru). Revista Brasileira de Farmácia, v.74, n.1, p.12-15.
LIMBERGER, R.P. 1999. Volatile oil from Mikania species (Asteraceae) and Myrtinae (Myrtaceae) of southern Brazil. Caderno de Farmácia, v.15, n.1, p.29-30.
LIMBERGER, R.P.; ABOY, A.L.; BASSANI, V.L.; MORENO, P.R.H.; RITTER, M.R.; HENRIQUES, A.T. 2001. Essential oils from four Mikania species (Asteraceae). Journal of Essential Oil Research, v.13, n.4, p.225-28.
MAFFEI, E.M.D. MARIN-MORALES, M.A., RUAS, P.M.; RUAS, C.F. 1999. Chromosomal polymorphism in 12 populations of Mikania micrantha (Compositae).Genetics and Molecular Biology, vol.22, n.3, p.433-444.
MISRA, S.B.; DIXIT, S.N. 1979. Antifungal activity of the leaf extracts of some higher plants. Acta Indica, v.7, p.147-150.
OLIVEIRA,F.; OGA, S.; AKISUE, M.K. 1985. Parâmetros físicos e químicos e efeito antiedema dos extratos fluidos de guaco (Mikania glomerata Spreng.) e de guaco de mato (Mikania laevigata Schutz Bip. ex Baker). Anais de Farmácia e Química, v.25, n.1/2, p.50-54.
PAVANELLI, J.C.; MONTEIRO, M.; CAVALLARI, M.M.; PINHEIRO, J.B.; ZUCHI, M.I. 2010. Desenvolvimento e otimização de pares de primers para amplificação de locos microssatélites nucleares e cloroplastidiais em Mikania glomerata. In: Congresso Brasileiro de Genética, 56, Guarujá. Resumos... São Paulo: SBG. Disponível em: <http://web2.sbg.org.br/congress/sbg2008/pdfs2010/GP.pdf>. Acesso em: 10 jun. 2011.
PANIZZA, S. 1997. Plantas de curam. Cheiro de mato. 3.ed. São Paulo: IBRASA. 280p.
PROVAN, J.; POWELL, W.; HOLLINGSWORTH, P.M. 2001. Chloroplast microsatellites: new tools for studies in plant ecology and evolution. Trends in Ecology and Evolution, v.16, n.3, p.142-147.
RITTER, M.R.; MIOTTO, S.T.S. 2005. Taxonomia de Mikania Willd. (Asteraceae) no Rio Grande do Sul, Brasil. Hoehnea, v.32, p.309-59.
RITTER M.R.; MIOTTO, S.T.S. 2006. Micromorfologia da superfície do fruto de espécies de Mikania Willd. (Asteraceae) ocorrentes no Estado do Rio Grande do Sul, Brasil. Acta Botanica Brasilica, v.20, n.1, p. 241-247.
RITTER, M.R. LIRO, R.M.; ROQUE, N.; NAKAJIMA, J.; SOUZA-BUTURI, F.O.; OLIVEIRA, C.T 2015. Mikania in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: <http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/FB5344>. Acesso e m: 30 Mar. 2015.
ROBINSON, H.; SCHILLING, E.; PANERO, J.L. 2009. Eupatorieae. In: FUNK, V.A., SUSANNA, A.; STUESSY; BAYER, R.J. (eds.). Systematics, Evolution and Biogeographics of Compositae. IAPT: Vienna.
ROSSI-BERGMANN, B.; COSTA, S.S.; MORAES, V.L.G. de. 1997. Brazilian medicinal plants: a rich source of immunomodulatory substances. Ciência e Cultura, v.49, n.5/6, 395-401.
RUAS, C.F.; AGUIAR-PERECIN, M.L.R. 1997. Chromosome evolution in the genus Mikania (Compositae). American Journal of Botany, v.84, n.8, p.1156-63.
RUAS, P.M.; RUAS, C.F. 1987. Karyotypes and chromosome morphology in the genus Mikania (Compositae). Cytologia, v.52, p.551-558.
SILVA, R.A. 1929. Pharmacopeia dos Estados Unidos do Brasil. Ed. Nacional: São Paulo.
SILVA JÚNIOR, A.A. 2010. Fitoprospecção e avaliação de acessos de Mikania glomerata Sprengel (guaco) no Litoral de Santa Catarina. In: Jornada Catarinense de Plantas Medicinais, 6, , Florianópolis, SC. Resumos... Florianópolis, SC: UFSC, 2010. p.58-61.
SILVA JUNIOR, A.A.; DESCHAMPS, F.C.; OSAIDA, C.C. 2010. Fitoprospecção de plantas aromáticas nativas de Santa Catarina. In: Jornada Catarinense de Plantas Medicinais, 6, Florianópolis. Anais... Florianópolis: UFSC, 2010. p.55-57.
SIMÕES, C. M. O.; SPITZER, V. 2003. Óleos voláteis. In: SIMÕES, C.M.O et al. Farmacognosia: da planta ao medicamento. 5. ed. Porto Alegre/Florianópolis: Editora UFRGS/ Editora UFSC, p.467-495.
TACK, H.H.; PEREIRA, A.; SILVA JUNIOR, A.A; TCACENCO, FA. 2012. Validação de marcador microssatélite para a identificação de acessos de Mikania Willd. (Asteraceae).In: Congresso Brasileiro de Botânica, 63, Joinville, SC. Anais... Joinville: Univille, 2012. n.p.
WEISING.K.; GARDNER, R.C. 1999. A set of conserved PCR primers for the analysis of simple sequence repeat polymorphisms in chloroplast genomes of dicot- yledoneous angiosperms. Genome, v.42, p.9-19.