Estado da Arte
Produtos Naturais para o tratamento da doença de Alzheimer: Promessa e Desafio
Herbal Natural Products for the treatment of Alzheimer’s disease: Promise and Challenge
Resumo
A Doença de Alzheimer (DA) é uma patologia neurodegenerativa caracterizada por prejuízo das funções cognitivas e mudanças na personalidade, responsável por cerca de 50-60% dos casos de demência diagnosticados em pessoas com mais de 60 anos. O depósito cerebral de um peptídeo insolúvel, chamado peptídeo β-amilóide, e a presença de emaranhados neurofibrilares são considerados os marcadores neuropatológicos da doença. Somente cinco fármacos estão aprovados pelo FDA para o tratamento da DA, sendo que nenhum pode reverter o processo de neurodegeneração provocado pela doença. Atualmente o tratamento consiste apenas em aliviar temporariamente os sintomas, ou seja, não há cura para a DA. Portanto, em busca de substâncias potencialmente úteis para o tratamento da DA, os produtos naturais têm se destacado por apresentarem um papel importante na patologia da doença, não agindo somente na causa, mas também em seus mecanismos específicos.
- Unitermos:
- Doença de Alzheimer.
- Produtos Naturais.
- Plantas.
- Acetilcolinesterase.
- -Amilóide.
- Proteína TAU.
Abstract
Alzheimer’s Disease (AD) is a neurodegenerative pathology characterized by impairment of cognitive functions and personality changes, accounting for around 50%-60% of the overall cases of dementia among persons over 60 years of age. The cerebral deposit of an insoluble peptide, called amyloid β-peptide, and the presence of neurofibrillary tangles are considered the neuropathological hallmarkers for the disease. Only five drugs are approved by the Food and Drug Administration (FDA) for the treatment of AD, although no treatment can reverse the neurodegeneration process caused by the disease. Actually the treatment provides a temporary relief of symptoms; it means that there is no cure for AD. Hence, in search for potentially useful substances for treatment of AD, the herbal natural products have played an important role in the pathology of the disease, not only acting on the cause, but also on its specific mechanisms.
- Key Words:
- Alzheimer’s disease.
- Natural Products.
- Plants.
- Acetylcholinesterase.
- -Amyloid.
- Protein TAU.
Introdução
A Doença de Alzheimer (DA) pode ser caracterizada como uma desordem neurodegenerativa progressiva, com média de duração de 8,5 anos entre o início dos sintomas clínicos e a morte, que resulta em uma perda neuronal irreversível das regiões cerebrais associadas às funções superiores como o hipocampo, a amídala e o córtex frontal (FRANCIS et al., 1999). Estima-se que aproximadamente 12 milhões de pessoas no mundo são afetadas pela doença (CITRON, 2004). É a causa mais comum de demência, um termo geral para prejuízo progressivo da função mental, e a terceira causa de morte nos países desenvolvidos, perdendo apenas para as doenças cardiovasculares e para o câncer (FRIDMAN et al., 2004).
Patologia da Doença De Alzheimer
Na DA, as regiões cerebrais mais afetadas apresentam uma patologia característica. Isto inclui o depósito extracelular de um peptídeo insolúvel, chamado peptídeo β-amilóide (Aβ), e a formação de fusos neurofibrilares. O peptídeo Aβ é produzido através do processamento proteolítico da proteína precursora amilóide (APP), uma proteína transmembrana normalmente expressa por muitas células, incluindo neurônios do sistema nervoso central, por enzimas conhecidas como βe γsecretases (CITRON, 2004). A βsecretase cliva a APP gerando um fragmento solúvel e outro que será clivado em várias posições pela γ-secretase, gerando fragmentos Aβ de 40 (Aβ40) e 42 (Aβ42) aminoácidos. O fragmento Aβ42 é neurotóxico, e seu acúmulo resulta na formação de fibras amilóides e posterior acúmulo, formando as placas senis (FRIDMAN et al., 2004). Os fusos neurofibrilares são depósitos intracelulares de filamentos helicoidais pareados que concentram a proteína tau em estado hiperfosforilado. O grau de fosforilação da tau determina a sua capacidade de estabilizar os microtúbulos, integrantes fundamentais do citoesqueleto, essenciais para a manutenção da estrutura neuronal e o transporte axonal de diversas substâncias, incluindo os neurotransmissores. A tau hiperfosforilada é menos capaz de polimerizar tubulina, e, ao invés, agrega-se nos filamentos helicoidais pareados. Como conseqüência, ocorre uma ruptura do citoesqueleto celular que leva, inicialmente, a uma disfunção e, posteriormente, à morte neuronal (ALMEIDA, 1997). A fisiopatologia da DA é complexa e envolve diferentes caminhos bioquímicos. Além do metabolismo errado de Aβ e da formação dos emaranhados neurofibrilares, a DA também está associada, principalmente, à redução das taxas de acetilcolina no processo sináptico, diminuindo a neurotransmissão colinérgica cortical. Há também redução de outros neurotransmissores como noradrenalina, dopamina, serotonina e glutamato, além do envolvimento de processos oxidativos, inflamatórios e hormonais. Estudos mais recentes demonstraram ocorrência da redução do número de receptores nicotínicos e muscarínicos (M2) de acetilcolina localizados nas terminações colinérgicas pré-sinápticas. Conseqüentemente, estes caminhos são potenciais marcadores para o tratamento da DA e estratégias para prevenção (VIEGAS JR. et al., 2004).
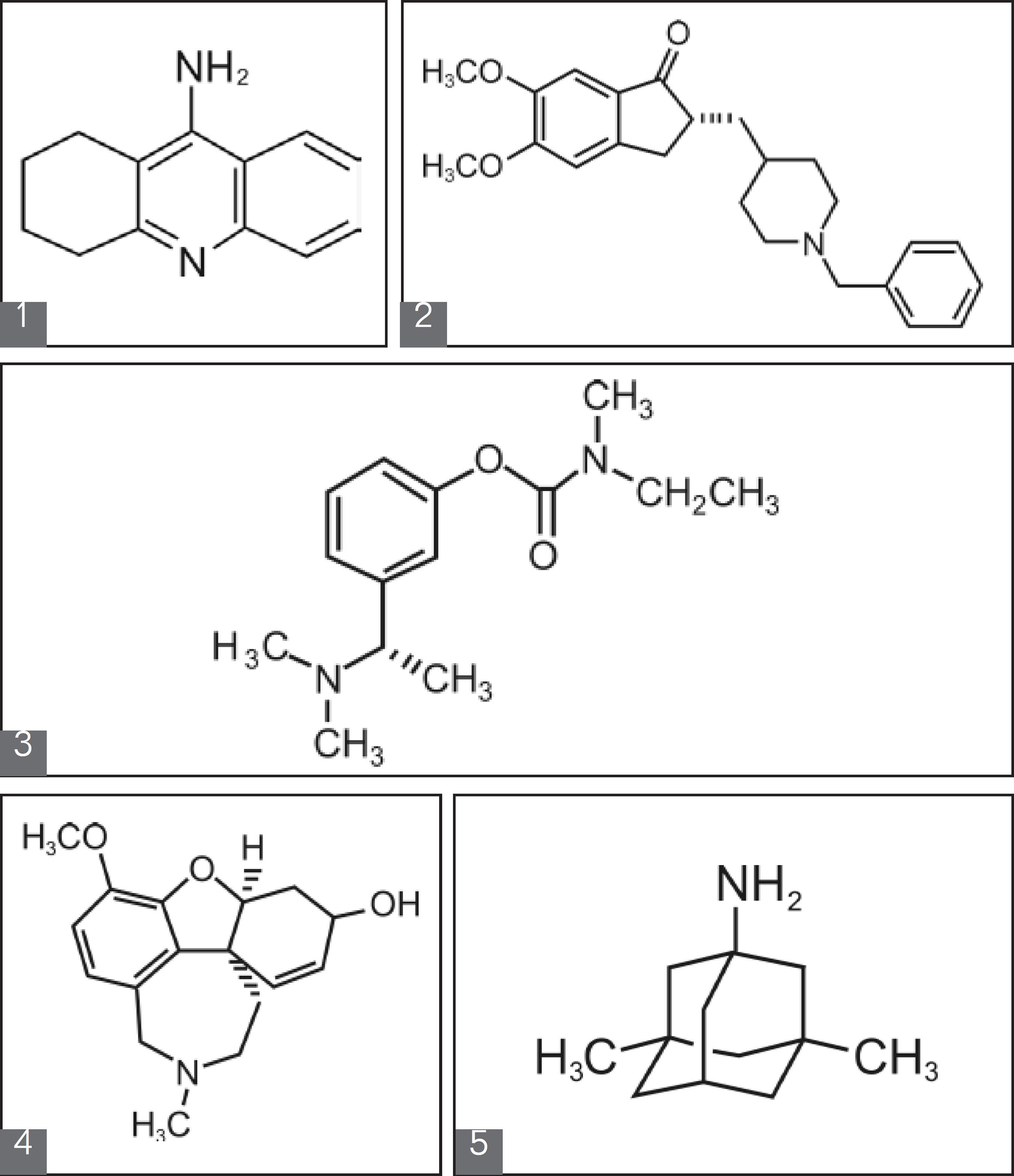
Dos cinco fármacos aprovados pelo FDA (Food and Drug Administration) para o tratamento da DA, quatro são inibidores da acetilcolinetserase: tacrina (1, Cognex®), donezepil (2, Aricept®), rivastigmina (3, Exelon®) e galantamina (4, Reminyl®) (FRANCIS; NORDBERG; ARNOLD, 2005). O quinto fármaco, aprovado em 2003, é a memantina (5, Namenda®), um antagonista de baixa afinidade do receptor NMDA (N-metil-D-aspartato), que tem como objetivo prevenir a neurotoxidade de aminoácidos excitatórios (como o glutamato) sem interferir com suas ações no aumento do aprendizado e da memória (YOUDIM; BUCCAFUSCO, 2005). Dentre eles, a galantamina se destaca por ser o único fármaco de origem natural e está sendo utilizado como protótipo para desenvolvimento de novos fármacos.
Os custos com o tratamento da Doença de Alzheimer são altíssimos, podendo variar de US$160 a US$220 por mês, dependendo da farmácia ou da dose prescrita (www.alzheimers.org.au). A diversidade estrutural de moléculas presentes nas espécies vegetais as tornam fontes valiosas de novas substâncias que poderão desempenhar um papel fundamental na terapia da Doença de Alzheimer.
Produtos Naturais com atividade contra a doença de Alzheimer
O reino vegetal tem se destacado como um grande fornecedor de substâncias com as mais variadas atividades biológicas. Dos 868 novos fármacos aprovados entre 1981 e 2002, 40% eram produtos naturais ou derivados de produtos naturais; e 60-80% de fármacos antibacterianos e anticancerígenos eram derivados de produtos naturais (NEWMAN; CRAGG; SNADER, 2003). A busca por novos agentes naturais para o tratamento da DA vai além dos inibidores da acetilcolinesterase, os quais têm como objetivo estabilizar os níveis de acetilcolina nas fendas sinápticas para manter a neurotransmissão, uma vez que os baixos índices de acetilcolina na DA são uma conseqüência da doença. Muitas pesquisas procuram diferentes abordagens terapêuticas que atuem em outros marcadores neuropatológicos da Doença de Alzheimer como as placas amilóides extracelulares ou então os emaranhados neurofibrilares intracelulares.
Alcalóides
A galantamina (4) é um alcalóide isolado de várias espécies vegetais da família Amaryllidaceae. É um inibidor da acetilcolinesterase de longa ação, seletivo, reversível e competitivo, o qual produz efeitos benéficos inclusive após o término do tratamento (LÓPEZ et al., 2002). Pesquisas indicam que a galantamina também modula alostericamente os receptores nicotínicos da acetilcolina (prée póssinápticos). A estimulação de ambos os receptores protege os neurônios da citotoxicidade provocada por Aβ e aumenta a função cognitiva por aumentar a liberação de acetilcolina e glutamato (KIHARA et al., 2004; VIEGAS JR. et al., 2004). Outros alcalóides análogos à galantamina também se destacam por apresentar uma boa atividade inibitória sobre a AChE (acetilcolinesterase). O derivado mais promissor é a sanguinina (6), um alcalóide presente em Eucharis grandiflora (Amaryllidaceae), que se mostrou dez vezes mais ativo do que a própria galantamina em ensaios in vitro. Além deste, outros dois derivados ativos da galantamina foram isolados: a 11-hidroxigalantamina (7), que mostrou atividade similar ao apresentado pela galantamina in vitro, e a epinorgalantamina (8) (LÓPEZ et al., 2002). O interesse pela busca de novos inibidores da acetilcolinesterase de origem vegetal levou ao isolamento de outro padrão estrutural de alcalóides, tipo-licorina. Foram isolados três alcalóides ativos, a oxoassoanina (9), a assoanina (10) e a pseudolicorina (11), sendo que a assoanina foi a mais ativa com IC50 quatro vezes menor que o controle galantamina (LÓPEZ et al., 2002). A huperzina A (HupA, 12), isolado de Huperzia serrata (Lycopodium serratum), uma planta da família Lycopodiaceae, é um alcalóide sesquiterpênico e atua como um poderoso, altamente específico e reversível inibidor da acetilcolinesterase. HupA satisfaz os critérios de um novo fármaco potencial para o tratamento da DA: é específico para AChE sobre outras enzimas, seletivo para a AChE cerebral (não atua sobre a AChE periférica reduzindo, portanto, os efeitos colaterais colinérgicos periféricos), tem uma ação de longa duração, atravessa com facilidade a barreira hemato-encefálica, alta biodisponibilidade após administração oral, e possui inibição maior ou equivalente sobre a AChE quando comparada com os inibidores prescritos normalmente. Encontra-se em estudo clínico (fase II), fazendo dele um fármaco promissor para o tratamento da Doença de Alzheimer. Além de sua ação sobre a acetilcolinesterase, a HupA apresenta outras ações que lhe conferem como um potente agente terapêutico para a DA: é um poderoso agente neuroprotetor, antioxidante e um protetor contra a morte celular neuronal induzida pelo peptídeo Aβ (ZANGARA, 2003); e atua sobre o processamento da APP favorecendo a via não-amiloidogênica (ZHANG; YAN; TANG, 2004).

Terpenos
Um triterpeno isolado de uma espécie do gênero Lycopodium (Lycopodiaceae) também apresentou uma boa atividade anticolinesterásica. O fracionamento bioguiado do extrato obtido a partir das partes aéreas de L. clavatum resultou no isolamento da α-onocerina (13), cuja atividade anticolinesterási- ca (IC50 = 5,2 μM) foi melhor que a do donezepil (VIEGAS JR. et al., 2004). Os ginkgolidos A (14) e B (15), dois diterpenos isolados de Ginkgo biloba (Ginkgoaceae), mostraram a capacidade de prevenir a morte neuronal em resposta ao dano provocado pelo peptídeo β-amilóide. Este efeito dos ginkgolidos é dose-dependente, protegendo os neurônios a concentrações nanomolares (BATE; SALMONA; WILLIAMS, 2004). O estudo de 17 monoterpenos com esqueleto do p-mentano, presentes em vários tipos de óleo de menta, sobre a inibição da acetilcolinesterase mostrou que os monoterpenos cetona (por exemplo, a (-)-carvona, 16) apresentaram maior atividade inibitória que os álcoois (por exemplo, o (+)-mentol, 17). Além disso, a presença de um grupamento isopropenila diminui a inibição sobre a acetilcolinesterase. A (+)-pulegona (18) foi o monoterpeno mais ativo (MIYAZAWA; WATANABE; KAMEOKA, 1997).

Cumarinas
O fracionamento do extrato metanólico de Angelica gigas (Umbelliferae), guiado pela atividade inibitória da acetilcolinesterase, levou ao isolamento de 12 cumarinas. Destas, cinco apresentaram atividade na inibição da enzima acetilcolinesterase: o decursinol (19), a marmesina (20), a xanthotoxina (21), a isoimperatorina (22) e a nodakenina (23). O decursinol foi o mais potente inibidor da acetilcolinesterase (KANG et al., 2001). O estudo com o decursinol mostrou sua atividade protetora contra o prejuízo de memória em camundongos induzido pelo peptídeo Aβ 42 (peptídeo neurotóxico) (YAN et al., 2004).

Flavonóides
A quercetina (24) e a miricetina (25), flavonóides presentes em diversas fontes vegetais e com reconhecida atividade antioxidante, impediram a inativação de receptores de acetilcolina muscarínicos pelo dano oxidativo catalizado pelo inibidor endógeno de baixo peso molecular presente 3 vezes mais em cérebros de pacientes com Alzheimer. O dano a estes receptores causa uma diminuição da transmissão colinérgica, envolvida na memória e na aprendizagem, sendo um elemento-chave da patologia da DA. A inativação dos receptores pelo inibidor é um fator de declínio contínuo para os pacientes com DA e o uso desses flavonóides pode aumentar a eficácia dos inibidores da acetilcolinesterase (FAWCETT et al., 2002). O estudo com os constituintes fenólicos relacionados ao vinho, miricetina, morina (26), quercetina, kaempferol (27), (+)-catequina (28) e (-)- epicatequina (29), permitiu avaliar suas atividades sobre a formação, extensão e desestabilização das fibrilas β-amilóide. Todos os polifenóis inibiram, de forma dose-dependente, a formação das fibrilas de Aβ assim como sua extensão. Além disso, desestabilizaram as fibrilas pré-formadas. A miricetina, a morina e a quercetina apresentaram as melhores atividades, seguidas do kaempferol e, por último, a (+)-catequina e a (-)-epicatequina, com baixa atividade (ONO et al., 2003). Um outro alvo terapêutico para o tratamento da DA é a inibição da β-secretase (BACE1), a enzima que cliva a APP gerando Aβ. Neste modelo foram testados os constituintes do chá verde, a (-)-galocatequina galato (30), a (-)-epigalocatequina galato (31) e a (-)-epicatequina galato (32), que apresentaram uma potente atividade inibitória. De acordo com os resultados obtidos, a grande atividade inibitória da BACE1 está relacionada com o padrão pirogaloil do C-2 e/ou C-3 do esqueleto da catequina, enquanto que a estereoquímica de C-2 e C-3 não tem efeito na atividade inibitória (JEON et al., 2003). Além da inibição da BACE1, a (-)-epigalocatequina galato também possui uma potente propriedade antioxidante e previne o dano neuronal induzido por radicais livres. Além deste efeito protetor, a (-)-epigalocatequina galato protege as células neuronais expostas ao peptídeo Aβ e impede a formação de Aβ por promover o processamento da APP pelo caminho não-amiloidogênico, via αsecretase, aumentando em seis vezes a liberação da forma solúvel da APP ( αAPPs) (CHOI et al., 2001; LEVITES et al., 2003). Um estudo com a (+)- catequina e a (-)-epicatequina mostrou que ambas protegem as células neuronais da neurotoxicidade provocada por Aβ. Os resultados mostraram que a epicatequina, a catequina e a mistura de ambas impediram a morte de células neuronais e protegeram a membrana celular da toxicidade induzida por Aβ. Em todos os casos, a mistura das duas substâncias mostrou um maior efeito protetor, concluindo que a atividade depende do sinergismo (HEO; LEE, 2005). Os flavonóides gossipina (33), presente em Hibiscus vitifolius (Malvaceae), baicaleína (34) e baicalina (35), isolados de Scutellaria baicalensis (Labiatae), foram avaliados em modelos de neurotoxicidade induzido pelo peptídeo Aβ e por estresse oxidativo. Em ambos os testes, os flavonóides mostraram-se ativos ao proteger as células corticais (HEO et al., 2004; YOON; LEE; CHO, 2004). Alguns flavonóides foram avaliados quanto ao seu efeito sobre a atividade cinase de ciclina-dependente cinase 5 (CDK5), onde sua desregulação leva a hiperfosforilação da tau, um evento inicial da formação dos emaranhados fibrilares que são um dos marcadores da Doença de Alzheimer. Os mais ativos inibidores do complexo CDK5 foram a 6-metoxi apigenina (36) e a 6-metoxi luteolina (37) (ZAPATA-TORRES et al., 2004).

Produto natural marinho
A himenialdisina (HD, 38), isolada de esponjas marinhas pertencentes às famílias Agelasidae, Axinellidae e Halichondriidae, apresentou uma potente atividade inibitória da CDK5 e glicogênio sintase cinase (GSK-3β), as enzimas que parecem apresentar um papel essencial na hiperfosforilação da tau. HD atua por competir com o ATP na ligação do sítio catalítico da cinase (MEIJER et al., 2000).

| Substâncias | Propriedades farmacológicas | |
| Alcalóides | ||
| galantamina | Inibição da AChE, ligante potencializador alostérico dos receptores nicotínicos de ACh | |
| sanguinina, 11-hidroxigalantamina, epinorgalantamina, oxoassoanina, assoanina, pseudolicorina | Inibição da AChE | |
| huperzina A | Inibição da AChE, impedimento da morte neuronal provocada por Aβ e atuação sobre o processamento da APP | |
| Terpenos | ||
| a-onocerina | Inibição da AChE | |
| ginkgolido A e B | Inibição da morte neuronal provocada por Aβ | |
| (+)-pulegona | Inibição da AChE | |
| Cumarinas | ||
| decursinol | Inibição da AChE, proteção do prejuízo de memória provocado por Ab em camundongos | |
| marmesina, xanthotoxina, nodakenina, isoimperatorina | Inibição da AChE | |
| Flavonóides | ||
| quercetina | Impedimento da inativação de receptores de acetilcolina muscarínicos, inibição da agregação de Aβ, inibição da CDK5 | |
| miricetina | Impedimento da inativação de receptores de acetilcolina muscarínicos, inibição da agregação de Aβ | |
| morina | Inibição da agregação de Aβ | |
| kaempferol | Inibição moderada da agregação de Aβ, inibição da CDK5 | |
| (+)-catequina, (-)-epicatequina | Inibição da β-secretase, proteção da célula neuronal do dano provocado por Aβ | |
| (-)-galocatequina galato e
(-)-epicatequina galato |
Inibição da β-secretase | |
| (-)-epigalocatequina galato | Inibição da β-secretase, prevenção do dano neuronal
provocado por radicais livres, impedimento da morte neuronal provocada por Aβ e a formação de Aβ |
2001; |
| gossipina, baicaleína e baicalina | Impedimento do estresse oxidativo e da neurotoxicidade induzida por Aβ | |
| 6-metoxi apigenina e
6-metoxi luteolina |
Inibição da CDK5 | |
| Produtos naturais marinhos | ||
| himenialdisina | Inibição da CDK5 e da GSK-3β | |
| ACh: acetilcolina; AChE: acetilcolinesterase; Aβ : peptídeo β-amilóide; APP: proteína precursora amilóide; CDK5: cinase ciclina-dependente 5; GSK-3β : glicogênio sintase cinase | ||
Conclusões
A busca por substâncias potencialmente úteis no tratamento do mal de Alzheimer a partir das plantas mostrou a diversidade de produtos naturais encontrados. Estes produtos não apresentaram ação somente sobre os sintomas, ou seja, melhorando a função cognitiva, mas sim em mecanismos específicos da doença como a inibição da β-secretase, uma enzima chave para a formação de Aβ, e inibindo a formação dos emaranhados neurofibrilares, por impedir a hiperfosforilação da tau pela CDK5 e pela GSK-3β. Portanto, o reino vegetal, por ainda ser pouco conhecido, pode ser a fonte capaz de fornecer moléculas diversas com alvos de ação definidos e que poderão servir de protótipos para o planejamento de novos candidatos a fármacos permitindo, assim, o controle da evolução da doença.
Agradecimentos
Os autores agradecem à CAPES pelo apoio financeiro concedido.
Referências
ALMEIDA, O.P. Biologia molecular da doença de Alzheimer: uma luz no fim do túnel? Revista da Associação Médica Brasileira, v.43, n.1, p.77-81, 1997.
BATE, C.; SALMONA, M.; WILLIAMS, A. Ginkgolide B inhibits the neurotoxicity of prions or amyloid-β1-42. Journal of Neuroinflammation, v.1, n.1, p.4-11, 2004.
CHOI, Y-T; JUNG, C-H; LEE, S-R; BAE, J-H; BAEK, W-K; SUH, M-H; PARK, J.; PARK, C-W; SUH, S-I. The green tea polyphenol (-)-epigallocatechin gallate attenuates -amyloid-induced neurotoxicity in cultured hippocampal neurons. Life Sciences, v.70, p.603-614, 2001.
CITRON, M. β-Secretase inhibition for the treatment of Alzheimer's disease - promise and challenge. TRENDS in Pharmacological Sciences, v.25, n.2, p.92-97, 2004.
FAWCETT, J.R.; BORDAYO, E.Z.; JACKSON, K.; LIU, H.; PETERSON, J.; SVITAK, A.; FREY, W.H. Inactivation of the human brain muscarinic acetylcholine receptor by oxidative damage catalyzed by a low molecular weight endogenous inhibitor from Alzheimer’s brain is prevented by pyrophosphate analogs, bioflavonoids and other antioxidants. Brain Research, v.950, p.10-20, 2002.
FRANCIS, P.T.; NORDBERG, A.; ARNOLD, S.E. A preclinical view of cholinesterase inhibitors in neuroprotection: do they provide more than symptomatic benefits in Alzheimer’s disease? TRENDS in Pharmacological Sciences, v.26, n.2, p.104-111, 2005.
FRANCIS, P.T.; PALMER, A.M.; SNAPE, M.; WILCOCK, G.K. The cholinergic hypothesis of Alzheimer’s disease: a review of progress. Journal of Neurology, Neurosurgery & Psychiatry, v.66, p.137-147, 1999.
FRIDMAN, C.; GREGÓRIO, S.P.; OJOPI, É.P.B.; DIAS NETO, E. Alterações genéticas na doença de Alzheimer. Revista de Psiquiatria Clínica, v.31, n.1, p.19-25, 2004.
HEO, H.J.; KIM, D.O.; CHOI, S.J.; SHIN, D.H.; LEE, C.Y. Potent inhibitory effect of flavonoids in Scutellaria baicalensis on amyloid proteininduced neurotoxicity. Journal of Agricultural and Food Chemistry, v.52, p.4128-4132, 2004.
HEO, H.J.; LEE, C.Y. Epicatechin and catechin in cocoa inhibit amyloid protein induced apoptosis. Journal of Agricultural and Food Chemistry, v.53, p.1445-1448, 2005.
JEON, S-Y; BAE, K.; SEONG, Y-H; SONG, K-S. Green tea catechins as a BACE1 ( -Secretase) inhibitor. Bioorganic & Medicinal Chemistry Letters, v.13, p.3905-3908, 2003.
VIEGAS JR., C.; BOLZANI, V.S.; FURLAN, M.; FRAGA, C.A.M.; BARREIRO, E.J. Produtos naturais como candidatos a fármacos no tratamento do mal de Alzheimer. Química Nova, v.27, n.4, p.655-660, 2004.
KANG, S.Y.; LEE, K.Y.; SUNG, S.H.; PARK, M.J.; KIM, Y.C. Coumarins isolated from Angelica gigas inhibit acetylcholinesterase: structure-activity relationships. Journal of Natural Products, v.64, p.683-685, 2001.
KIHARA, T.; SAWADA, H.; NAKAMIZO, T.; KANKI, R.; YAMASHITA, H.; MAELICKE, A.; SHIMOHAMA, S. Galantamine modulates nicotinic receptor and blocks Aβ-enhanced glutamate toxicity. Biochemical and Biophysical Research Communications, v.325, p.976-982, 2004.
LEVITES, Y.; AMIT, T.; MANDEL, S.; YOUDIM, M.B.H. Neuroprotection and neurorescue against Aβ toxicity and PKC-dependent release of non-amyloidogenic soluble precursor protein by green tea polyphenol (-)-epigallocatechin-3-gallate. The FASEB Journal, v.17, n.8, p.952-954, 2003.
LÓPEZ, S.; BASTIDA, J.; VILADOMAT, F.; CODINA, C. Acetylcholinesterase inhibitory activity of some Amaryllidaceae alkaloids and Narcissus extracts. Life Sciences, v.71, p.2521-2529, 2002.
MEIJER, L.; THUNNISSEN, A.-M.W.H., WHITE, A.W., GARNIER, M.; NIKOLIC, M.; TSAI, L.-H. ET AL. Inhibition of cyclin-dependent kinases, GSK-3β and CK1 by hymenialdisine, a marine sponge constituent. Chemistry & Biology, v.7, n.1, 51-63, 2000.
MIYAZAWA, M.; WATANABE, H.; KAMEOKA, H. Inhibition of acetylcholinesterase activity by monoterpenoids with a p-menthane skeleton. Journal of Agricultural and Food Chemistry, v.45, p.677-679, 1997.
NEWMAN, D.J.; CRAGG, G.M.; SNADER, K.M.. Natural products as sources of a new drugs over the period 1981-2002. Journal of Natural Products, v.66, p.1022-1037, 2003.
ONO, K.; YOSHIIKE, Y.; TAKASHIMA, A.; HASEGAWA, K.; NAIKI, H.; YAMADA, M. Potent anti-amyloidogenic and fibril-destabilizing effects of polyphenols in vitro: implications for the prevention and therapeutics of Alzheimer’s disease. Journal of Neurochemistry, v.87, p.172-181, 2003.
www.alzheimers.org.au, acessado em 31 de julho de 2005.
YAN, J.J.; KIM, D.H.; MOON, Y.S.; JUNG, J.S.; AHN, E.M.; BAEK, N.I.; SONG, D.K. Protection against β-amyloid peptide-induced memory impairment with long-term administration of extract of Angelica gigas or decursinol in mice. Progress in Neuro-Psychopharmacology & Biological Psychiatry, v.28, p.25-30, 2004.
YOON, I.; LEE, K.H.; CHO, J. Gossypin protects primary cultured rat cortical cells from oxidative stressand β-amyloid-induced toxicity. Archives of Pharmacal Research, v.27, n.4, p.454-459, 2004.
YOUDIM, M.B.H.; BUCCAFUSCO, J.J. CNS Targets for multi-functional drugs in the treatment of Alzheimer’s and Parkinson’s diseases. Journal of Neural Transmission, v.112, p.519-537, 2005.
ZANGARA, A. The psychopharmacology of huperzine A: an alkaloid with cognitive enhancing and neuroprotective properties of interest in the treatment of Alzheimer’s disease. Pharmacology, Biochemistry and Behavior, v.75, p.675-686, 2003.
ZAPATA-TORRES, G.; OPAZO, F.; SALGADO, C.; MUNÕZ, J.P.; KRAUTWURST, H.; MASCAYANO, C.; SEPÚLVEDA-BOZA, S.; MACCIONI, R.B.; CASSELS, B.K. Effects of natural flavones and flavonols on the kinase activity of Cdk5. Journal of Natural Products, v.67, p.416-420, 2004.
ZHANG, H.Y.; YAN, H.; TANG, X.C. Huperzine A enhances the level of secretory amyloid precursor protein and protein kinase C-a in intracerebroventricular -amyloid-(1-40) infused rats and human embryonic kidney 293 Swedish mutant cells. Neuroscience Letters, v.360, p.21-24, 2004.