Estado da Arte
Picrolemma sprucei Hook. f.: Uso Tradicional, Princípios Ativos e seus Derivados Semi-sintéticos, Exploração Comercial e Econômica
Picrolemma sprucei Hook. f.: Traditional Use, Active Principles and their Semisynthetic Derivatives, Commercial and Economic Uses
Resumo
Nessa revisão da literatura botânica, etnobotânica, etnofarmacológica, química e farmacológica, são enfatizadas as diversas atividades biológicas atribuídas pela medicina popular e por estudos científicos à planta Amazônica Picrolemma sprucei Hook. f. (Simaroubaceae). Ênfase especial é dada aos conhecimentos atuais sobre os principais componentes químicos encontrados nessa espécie, da classe dos quassinóides: sergeolida (1), neosergeolida (5), isobruceína B (2) e 15-desacetilsergeolida (4), que incluem atividade antimalárica, tóxica aguda, antitumoral, citotóxica, antifágica, larvicida/inseticida e fitotóxica. Também é incluída discussão das atividades biológicas de derivados (naturais e semi-sintéticos) desses quassinóides com o intuito de revelar, além do potencial de P. sprucei como fonte de extratos para o aproveitamento fitoterapêutico, o potencial dessa planta como fonte de quassinóides bioativos para estudos de química medicinal e modificação estrutural.
- Unitermos
- Picrolemma sprucei.
- Picrolemma pseudocoffea.
- quassinóide.
- isobruceína B.
- neosergeolida.
- sergeolida.
- 15-desacetilsergeolida..
Abstract
In this review of the botanical, ethnobotanical, ethnopharmacological, chemical and pharmacological literature available concernig the Amazonian plant Picrolemma sprucei Hook. f. (Simaroubaceae), the different biological activities attributed by traditional medicine and scientific studies are emphasized. Special emphasis is given to the status emphasis is given to the status of knowledge of the principal chemical components (quassinoids) found in this plant species: sergeolide (1), neosergeolide (5), isobrucein B (2) and 15-deacetylsergeolide which include antimalarial, acute toxic, antitumor, cytotoxic, antifeedant, larvicidal/insecticidal and phytotoxic properties. A discussion of the important derivatives (natural and semi-synthetic) and their biological activities intends to reveal the potential of this plant as a source of highly bioactive quassinoids for structural and activity medicinal chemistry studies, as well as the potential of P. sprucei as a source of extracts for phytotherapeutic use.
- Key words
- Picrolemma sprucei.
- Picrolemma pseudocoffea.
- quassinoid.
- isobrucein B.
- neosergeolide.
- sergeolide.
- 15-deacetylsergeolide..
Introdução
A presente revisão tem como objetivo principal fazer uma síntese e análise crítica de informações bibliográficas das áreas de botânica, etnobotânica, química e farmacologia sobre a espécie Picrolemma sprucei Hook. f., os seus princípios ativos, bem como alguns derivados semi-sintéticos desses últimos. Onde pertinente, também estão incluídos informações e resultados inéditos das experiências e provenientes das pesquisas dos autores com essa planta. A importância dessa espécie como planta medicinal e o potencial medicinal dos seus princípios ativos são grandes fora do Brasil, através de estudos efetuados por pesquisadores trabalhando em outros países da Amazônia, como a França (Guiana Francesa), mas que certamente o Brasil é o país com a maior população nativa dessa espécie do planeta. Entre outros motivos que temos para a publicação do presente foi a exclusão ou não menção dessa espécie em uma das obras bibliográficas mais usadas e citadas no Brasil, o Dicionário das Plantas Úteis do Brasil e das Exóticas Cultivadas, de Pio Corrêa (1984), fato que deixou essa planta medicinal valiosa numa relativa obscuridade para pesquisadores e usuários brasileiros de plantas medicinais, não-familiarizados com plantas medicinais da região Amazônica. Outro fato importante é que na Amazônia brasileira se conhecem até 4 espécies, de famílias botânicas distintas, pelo nome “caferana”, entre elas, a P. sprucei. Pio Corrêa (1984) descreveu apenas uma dessas, a Tachia guianensis Aubl., da família Gentianaceae, uma planta, aliás, bastante rara ou “esporádica” na Amazônia brasileira e sem a ocorrência ubíqua da P. sprucei.
O nome caferana (café-rana ou café falso, na linguagem regional) se deve à semelhança desta e algumas outras plantas na região com o cafeeiro (Coffea arabica L., Rubiaceae), em especial, isso é verdade no período de frutificação, quando a caferana (P. sprucei) produz frutos verdes que se tornam alaranjados e posteriormente avermelhados ao amadurecerem em cacho localizado na ponta do caule. A planta é identificada pela sinonímia botânica P. pseudocoffea Ducke, nome que reconhece essa semelhança morfológica com o cafeeiro, em alguns textos (BERTANI et al., 2005; DUKE; VASQUEZ, 1994; LE COINTE, 1947; FANDEUR; MORETTI; POLONSKY, 1985; GRENAND; MORETTI et al., 1982; MILLIKEN, 1997; MORETTI; JACQUEMIN, 1987; MORS et al., 2000; POLONSKY; BHATNAGAR; MORETTI, 1984; SILVA; LISBOA; LISBOA, 1977; VIGNERON et al., 2005). O correto nome botânico de P. sprucei Hook. f., refletindo a precedência histórica na descrição dessa espécie, foi garantido por um perito nessa família botânica (THOMAS, W.; comunicação pessoal). A espécie P. sprucei pertence à família Simaroubaceae. Essa família se distingue de todas as demais pela presença nos seus tecidos de substâncias terpênicas altamente oxigenadas, conhecidas como quassinóides (THOMAS, 1990).
Morfologia Macroscópica
A P. sprucei é um arbusto que atinge até 2,5 m de altura, muito amargo em todas as suas partes. Apresenta folíolos cartáceos simétricos, verde-escuros e brilhantes. Quando em inflorescência apresenta flores de pétalas alaranjadas e estames amarelos. Os frutos são apocárpicos. A raiz central é espessa e penetrante, frequentemente alcançando 2 m ou mais de comprimento. A planta pode ser encontrada principalmente em regiões de platô, na capoeira e na mata de terra firme, no norte da América do Sul (LE COINTE, 1947; GRENAND; MORETTI; JACQUEMIN, 1987; RIBEIRO et al., 1999; SARAIVA et al., 2003; SILVA; LISBOA; LISBOA, 1977), já tendo sido registrada sua presença no Equador, Guiana Francesa, Peru, Colômbia e Venezuela (NYBG, 2005; MOBOT, 2005). No Brasil, acessos de P. sprucei foram detectados nos Estados do Pará, Rondônia e Amazonas, sendo neste último, distribuídos em todo o Estado, conforme dados obtidos do herbário do INPA - Instituto Nacional de Pesquisa da Amazônia. Em geral, a espécie apresenta interações com insetos, principalmente formigas, que habitam seu caule oco. Esta parte da planta é freqüentemente frágil, e é a parte mais utilizada medicinalmente na Amazônia brasileira, sendo disponível em feiras populares e por intermédio de raizeiros no interior do Estado (RIBEIRO et al., 1999).
Morfologia Microscópica
A anatomia foliar e caulinar de P. sprucei já foi estudada por Saraiva et al. (2003). As epidermes das folhas são glabras, apresentam células de paredes onduladas e estômatos anomocíticos. O mesofilo é dorsiventral com uma camada de células em paliçada e um parênquima lacunoso. Os feixes vasculares são bicolaterais e apresentam idioblastos escuros de conteúdo tânico. No caule evidencia-se um parênquima cortical desenvolvido, com células de natureza esclerenquimática, isoladas ou reunidas em pequenos grupos, de paredes espessas. Internamente observa-se a região vascular com vasos xilemáticos isolados ou em grupos imersos em tecido fibroso, sendo o parênquima do tipo paratraqueal, vasicêntrico. Na região central encontra-se uma medula desenvolvida. A nervura mediana do terço médio do limbo foliar e o pecíolo possuem um conteúdo tânico e óleo-resinoso em algumas de suas células.
Estudos etnobotânicos e etnofarmacológicos
Bem conhecida por populações indígenas, P. sprucei tem sido utilizada há bastante tempo na medicina tradicional para o tratamento da malária (GRENAND; MORETTI; JACQUEMIN, 1987). No Brasil, o chá das folhas e das raízes é usado no tratamento de gastrite, como febrífugo e antelmíntico (LE COINTE, 1947), sendo empregado no Peru para as mesmas finalidades (DUKE; VASQUEZ, 1994; MORS; RIZZINI; PEREIRA, 2000). No Estado do Amazonas, o uso popular da P. sprucei é bastante difundido, especialmente na região de Manaus (FERREIRA, 2000) onde é comum encontrar pedaços do caule de P. sprucei sendo comercializados no Mercado Municipal Adolpho Lisboa (Centro de Manaus), como antimalárico e febrífugo. Na Guiana Francesa, o chá do caule é utilizado pelos Créoles e Palikur uma vez ao dia, preferencialmente pela manhã, em combinação com Fagara rhoifolia Engl. para tratar a malária (GRENAND; MORETTI; JACQUEMIN, 1987; MILLIKEN, 1997).
Um estudo etnofarmacológico realizado na Guiana Francesa com cento e dezessete pessoas de cinco diferentes grupos e nacionalidades (Créoles, Palikur, Galibi, brasileira e européia) demonstrou que extratos alcoólicos preparados a partir de caules, folhas e raízes de P. sprucei são utilizados para o tratamento curativo da malária, sempre em combinação com outras espécies vegetais, preferencialmente Quassia amara L. (Simaroubaceae) e, em muitos casos, em combinação com drogas modernas. O extrato é obtido por maceração da planta em rum ou outra bebida alcoólica, por vários dias ou semanas. Um pequeno copo é tomado diversas vezes por semana. Foi constatado que, em muitos casos, as plantas medicinais são utilizadas por mais tempo do que as drogas modernas, podendo chegar até 15 dias de administração. Segundo a maioria dos entrevistados, as drogas modernas são capazes de curar a malária, entretanto, “as plantas saram”. Dessa forma, o papel das drogas modernas é considerado essencial, porém complementar ao uso das plantas medicinais, as quais garantem a “cura verdadeira”. Demonstrou-se ainda que os extratos de caferana, bem como de outras plantas, são utilizados para banhar o corpo, como uma forma de eliminar a febre, a malária e todas as impurezas. Já em relação ao tratamento preventivo, o extrato alcoólico de P. sprucei também foi utilizado sempre em combinação e preferencialmente com Geissospermum spp. (Apocynaceae) e Q. amara. Também foi constatado o uso do extrato etanólico de P. sprucei em banhos, como tratamento preventivo da malária (VIGNERON et al., 2005).
Em um estudo subseqüente, Bertani e colaboradores (2005) demonstraram a capacidade do extrato aquoso de P. sprucei de inibir a formação da hemozoína, proteína derivada da digestão da hemoglobina, inibição esta que acarreta no acúmulo dos grupos heme, altamente tóxicos para o parasita. Ensaios in vitro demonstraram que o extrato de P. sprucei foi capaz de inibir o crescimento da cepa W2 (resistente à cloroquina) do parasita da malária humana Plasmodium falciparum (concentração inibitória mediana, CI50 1,43 ì g/mL) e uma dose de extrato de 95 mg/kg de peso corporal inibiu em 77,5 % o crescimento de P. falciparum in vivo (cinco vezes menor do que a requerida pelo extrato de Cinchona officinalis L.). O extrato combinado de P. sprucei, Q. amara e Geissospermum laevis Miers (20 g de folhas frescas de P. sprucei, com 8 folhas frescas de Q. amara e 40 g de casca de G. laevis em 1,5 L de água fervente por 15 min) apresentou CI50 de 1,83 ì g/mL in vitro frente a P. falciparum e com inibição de 95,5% do crescimento da cepa 17X do parasita Plasmodium yoelii yoelii em ratos a uma concentração de 125 mg/ kg, em apoio ao uso tradicional de P. sprucei no tratamento de infecções da malária. No ensaio de inibição da biomineralisação da ferriprotoporfirina IX (FBIT) os extratos de P. sprucei e de Q. amara foram os únicos mais ativos do que a Cinchona calisaya (controle positivo, CI50 37 μg/ mL), com CI50 de 30 e 5 ì g/mL, respectivamente. Por outro lado, o extrato aquoso preparado a partir das folhas de P. sprucei (como descrito acima) não apresentou nenhuma atividade no estágio intra-hepático do clone 1.1 da cepa 17X do parasita P. yoelii yoelii. Ao contrário do que havia sido levantado pela pesquisa etnofarmacológica, os testes não confirmaram a informação de que o extrato, na sua forma bruta, poderia ser utilizado em um tratamento preventivo contra malária.
Estudos químicos
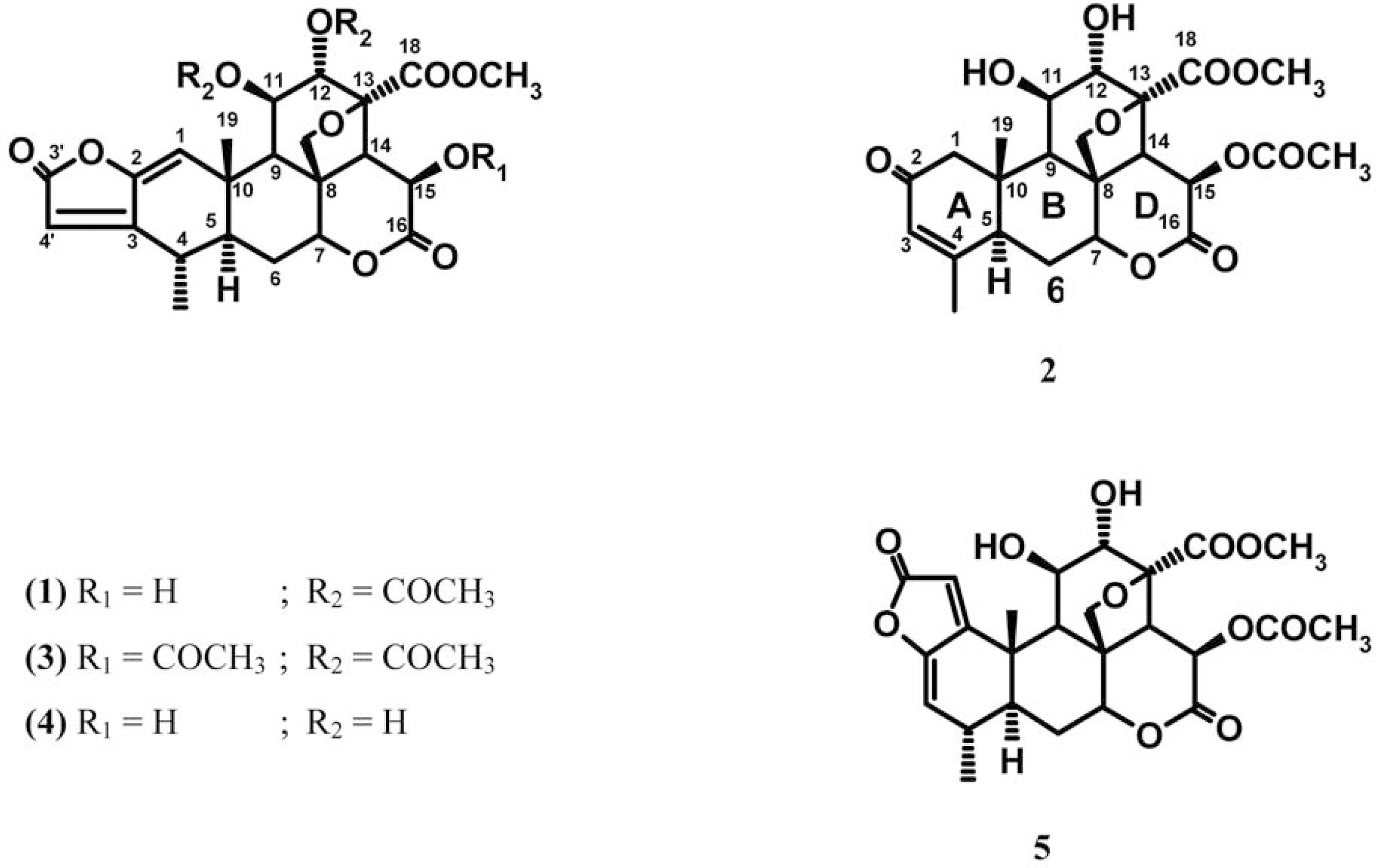
Moretti et al. (1982) submeteram caules e raízes de P. sprucei encontrada na Guiana Francesa à eliminação de graxas e gorduras com hexano, seguida de extração aquosa exaustiva por infusão em água fervente. O extrato aquoso concentrado foi extraído continuamente com clorofórmio em sistema liquido-liquido e a partir da fração clorofórmica obtiveram-se os quassinóides sergeolida (1) e isobruceína B (2) por cromatografia em fase normal (MORETTI et al., 1982). A acetilação da sergeolida (1) produziu a diacetilsergeolida (3). As folhas de P. sprucei, também da Guiana Francesa, foram submetidas ao processo de extração descrito acima foram isoladas a 15-desacetilsergeolida (4), além da sergeolida (1) e da isobruceína B (2) (POLONSKY; BHATNAGAR; MORETTI, 1984). Dos caules e raízes de espécimes nativos da Amazônia brasileira, quando submetidos ao mesmo processo de extração, porém com pequenas modificações, foram isolados os quassinóides neosergeolida (5) e isobruceína B (2) (SCHPECTOR et al., 1994; VIEIRA et al., 2000; SARAIVA, 2001).
Existem algumas outras espécies que apresentam a sergeolida (1) e a isobruceína B (2) na sua composição, nenhuma daquelas sendo encontrada no Brasil. Por exemplo, a isobruceína B (2) foi primeiramente isolada da espécie Brucea antidysenterica Mill. (KUPCHAN et al., 1975). Tischler e colaboradores (1992) também isolaram a sergeolida (1) e a isobruceína B (2) de Picrolemma huberi Ducke (sin. Cedronia granatensis Cautrec.), e Bhatnagar et al. (1985) isolaram a isobruceína B (2) de Soulamea amara Lam.
Atividade antimalárica dos quassinóides de P. sprucei
A sergeolida (1) apresenta elevada atividade antiplasmódio tanto in vitro quanto in vivo. Uma concentração de 50 ng/mL foi capaz de inibir em 94% o crescimento in vitro da cepa FUP de P. falciparum (sensível à cloroquina) em culturas com até 48 h com CI50 de 6 ng/mL (cerca de 3 vezes menor do que a da cloroquina). A isobruceína B (2) apresentou atividade antimalárica in vitro cinco vezes menor do que a sergeolida (1). Nos testes in vitro realizados com as cepas resistentes à cloroquina 98/83, 96/83 e 97/83, sendo que esta última também se mostrou resistente à associação quinina/fansidar in vivo, a sergeolida (1) foi capaz de inibir significativamente o crescimento do parasita, a uma concentração de 6 ng/mL, enquanto que para a cloroquina um efeito inibitório idêntico somente foi possível com uma concentração cem vezes maior. Contagens de parasitas mostraram que a sergeolida (1), de forma semelhante à cloroquina, foi efetiva contra todos os estágios assexuados do parasita no sangue. Ensaios in vivo mostraram que a sergeolida (1) foi capaz de inibir a cepa NK65 de Plasmodium berghei em ratos, com DE50 (dose efetiva mediana) de 0,2 mg/kg/dia, ou seja, cinco vezes menor do que a da cloroquina (FANDEUR; MORETTI; POLONSKY, 1985). Esses resultados mostram a superioridade ou equivalência entre a atividade antimalárica in vitro e in vivo dos quassinóides e a cloroquina, agindo sobre cepas sensíveis.
Toxicidade e efeitos co-laterais de P. sprucei e seus componentes químicos
Como constatado por Vigneron e colaboradores (2005), muitas das drogas modernas, apesar de sua elevada eficiência, são tidas pela maioria da população como potencialmente tóxicas e apresentam forte incidência de danos nas funções hepáticas, aumentando os efeitos tóxicos da malária sobre o fígado. Para preparações contendo P. sprucei, reconhecida por todos os informantes como extremamente tóxica, a dose utilizada é de apenas uma pequena xícara de café (50 mL) três vezes por dia (20 g de folhas frescas em 1 L de água fervente por 10 min), por alguns dias e que esta não é recomendada para crianças. Além disso, na Amazônia brasileira, as preparações de P. sprucei não são recomendadas para grávidas, devido ao efeito fortemente abortivo. Por outro lado, chás fortes (ca. 10 g de caule triturado em infusão de 1 L) de água são usados para provocar o aborto. Devido à sua elevada toxicidade por injeção subcutânea a camundongos (dose letal mediana, DL50 1,8 mg/kg), a sergeolida (1) não é indicada ao tratamento da malária de roedores (DE90 1,7 mg/ kg/dia). A isobruceína B (2) apresentou DL50 de 5 mg/kg e, portanto, possui menor toxicidade a camundongos do que a da sergeolida (1) (FANDEUR; MORETTI; POLONSKY, 1985).
Atividade antitumoral da sergeolida, isobruceína B e derivados
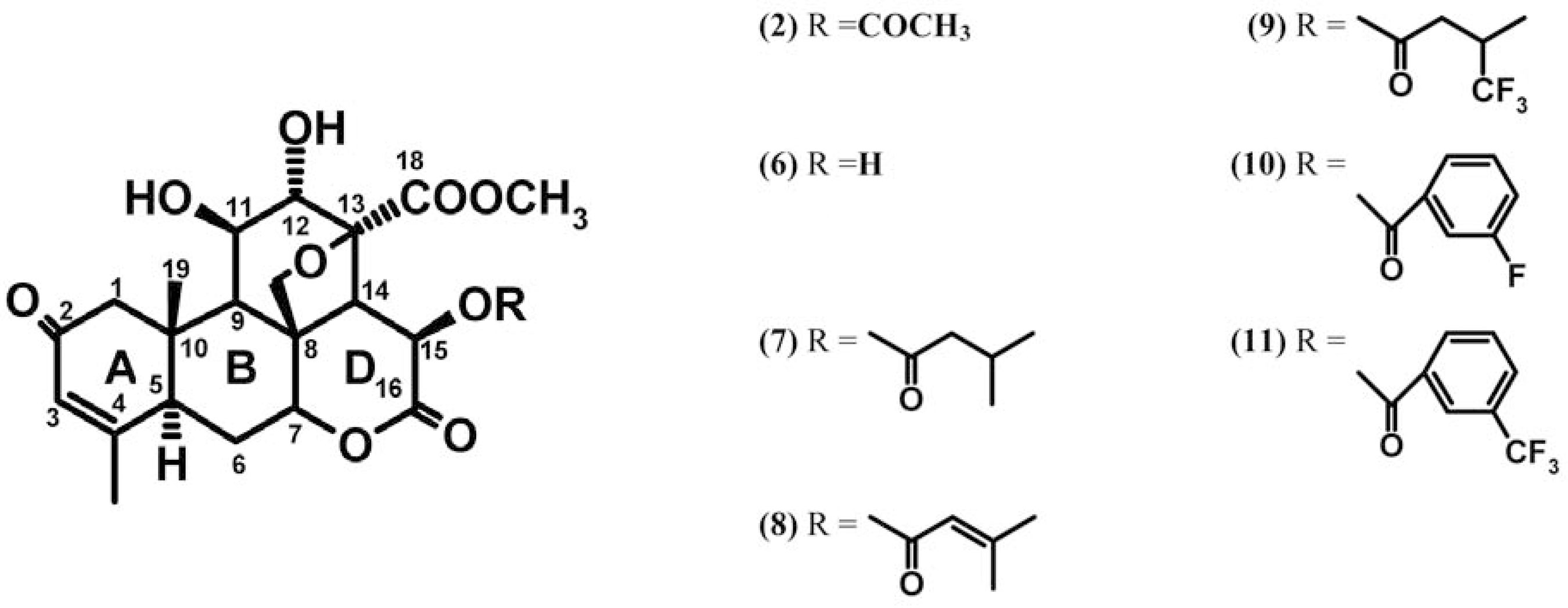
A sergeolida (1) apresentou elevada ação inibitória contra linhagens de células leucêmicas de camundongos (P388) (FANDEUR; MORET TI; POLONSKY, 1985). Por sua vez, a 15-desacetilsergeolida (2) apresentou apenas moderada atividade antileucêmica neste mesmo ensaio in vitro, apesar de demonstrar elevada atividade em testes in vivo (POLONSKY; BHATNAGAR; MORETTI, 1984). A sergeolida (1) e a isobruceína B (2) foram utilizados em um “screening” de atividade antitumoral in vitro seguindo as orientações do NCI. Ambos produziram concentrações letais medianas (CL50) na ordem de 10-5 a 10-8 M para a maioria das linhagens de melanoma e diversas linhagens de câncer de cólon, pulmão e outras linhagens de tumores sólidos (TISCHLER et al., 1992). Okano e colaboradores (1995) testaram a atividade antitumoral da isobruceína B (2) e de mais 44 quassinóides. Dentre os dez mais potentes, destacaram-se aqueles contendo grupos carbonila e hidroxilas no anel A, uma ponte epoximetileno entre o C-8 e o C-13 e uma cadeia lateral contendo um grupamento éster em C-15 como são encontrados na isobruceína B (2).
Fukamiya e colaboradores (2005), estudaram o efeito de 63 quassinóides, dentre os quais a sergeolida (1), a isobruceína B (2) e a 15-desacetilisobruceína B (9), sobre a síntese de proteínas em células eucarióticas. Eles constataram que a isobruceína B (2) e a 15-desacetilisobruceína B (9) não apresentam qualquer efeito sobre a tradução de RNAm em células procarióticas (E. coli) até uma concentração final de 10 μM, ao passo que a isobruceína B (2), a 15-desacetilisobruceína (6) e a sergeolida (1) apresentam forte inibição da tradução de RNAm em células eucarióticas com CI50 de 0,16, 0,32 e 0,07 μM, respectivamente. Estes quassinóides apresentaram, ainda, elevada inibição da síntese protéica em células de carcinoma uterino HeLa com 97, 95 e 97% de inibição, respectivamente. Rahman e colaboradores (1997) realizaram um estudo de atividade antitumoral de derivados semisintéticos da isobruceína B 5-10. Todos os derivados ésteres demonstraram maior atividade antitumoral do que a apresentada pelo derivado desacetilado 5. O composto 8, contendo um éster alifático fluorado, foi o que apresentou a maior atividade, seguido pelos quassinóides contendo cadeias laterais aromáticas fluoradas 9 e 10. A introdução de grupamentos fluorados na estrutura dos quassinóides aumenta tanto a lipofilicidade quanto a força das ligações, favorecendo, portanto, seus transportes até a célula, e protegendo-os de decomposição por oxidação enzimática. Muitos requerimentos estruturais necessários à atividade antineoplásica, exibida por diversos quassinóides, estão estabelecidas: A presença de um grupamento cetona á,âinsaturado no anel A; uma função éster no C-6 ou C-15 e uma ponte oximetileno entre o C-8 e o C-11 ou C-13 e um grupamento hidroxila no C-6 e/ou C-11 são características estruturais essenciais para uma forte atividade antineoplásica (BHATNAGAR; CARUSO; POLONSKY, 1987, KUBOTA et al., 1997, SPOHN; GRIECO; NARGUND, 1987). Ao contrário, um grupo hidroxila no C-13 e/ou C-15 e uma esterificação no grupo hidroxila no C-15 diminuem ligeiramente a atividade (KUBOTA et al., 1997). Os quassinóides encontrados em P. sprucei apresentam muitas dessas características estruturais associadas à atividade antitumoral.
Atividades antifágica, fitotóxica e inseticida
Os quassinóides sergeolida (1), isobruceína B (2) e 15-desacetilsergeolida (3) apresentaram potente atividade antifágica (inibição à vontade de se alimentar) e inibição do crescimento do verme Heliothis virescens f. (lagarta do broto do tabaco ou lagarta-da-maçã) e da praga do milho Agrotis ipsilon Hfn. (lagarta-rosca negra), sem provocar a morte dos insetos (LIDERT et al., 1987). Polonsky e colaboradores (1989) demonstraram que a isobruceína B (2) apresenta forte atividade antifágica frente à espécie de pulgão Myzus persicaes s.s. (Sulzer) (Hemíptera, Aphididae), a uma concentração de 0,05%, com uma baixa fitotoxicidade a Brassia campestris var. Chinensis (L.) Makino (repolho branco chinês - pak choi), enquanto que a sergeolida (1) não se mostrou eficaz até uma concentração de 0,1%, porém causou danos consideráveis às folhas de repolho. Daido e colaboradores (1995) demonstraram que, dentre 14 quassinóides naturais e 4 semi-sintéticos, a isobruceína B (2) apresentou a maior atividade antifágica e inseticida frente a larvas no terceiro estágio da traçadas-crucíferas (Plutella xylostella L.). Os extratos metanólicos de cascas e raízes, bem como o extrato aquoso de raízes de P. sprucei, a uma concentração de 500 μg/mL, provocaram mortalidades de 57%, 74% e 44%, respectivamente, frente a larvas do mosquito Aedes aegypti. Entretanto, o extrato metanólico de folhas e os extratos aquosos de folhas e raízes de P. sprucei, na mesma concentração, não demonstraram capacidade larvicida contra A. aegypti (POHLIT et al., 2004).
Não existe cultivo da P. sprucei, até onde temos conhecimento. Tentativas de coletar frutos e efetuar germinação e produção de mudas em situações controladas tem tido sucesso limitado, levando à produção de algumas mudas, mas foi percebida a existência de dormência na germinação das sementes, que levam meses para germinar. Além disso, a produção esporádica, nem sempre anual, dos frutos e sementes é outro impedimento à produção sustentável. Tentativas de reproduzir a planta utilizando estaquia tiveram sucesso extremamente limitado, sendo que as estacas se mantiveram vivas nas condições de viveiro, mas não desenvolveram folhas e/ou raízes; ou seja, não geraram mudas de caferana, nas condições testadas até o presente momento (POHLIT, BARROS, LIMA JÚNIOR, resultados não publicados). O extrativismo é a atividade estabelecida para a P. sprucei, sendo um processo sustentável para atender a população local, a qual usa principalmente o caule. Experimentos preliminares com o transplante de mudas silvestres na região de
Manaus demonstraram que a planta se desenvolve rapidamente em áreas ensolaradas, apesar de ser freqüentemente encontrada em áreas de campinarana ou matas com pouca luz (POHLIT, BARROS, resultados não publicados) Essa observação é reforçada em áreas de queimadas e desmatamentos, em que a planta, inicialmente eliminada da superfície, desenvolve-se em áreas de pasto, em céu aberto, devido à resistência da sua raiz. No momento, em Manaus, entre outras instituições, estão sendo conduzidos experimentos na Universidade Federal do Amazonas (UFAM) e no Instituto Nacional de Pesquisas da Amazônia (INPA). A finalidade é o desenvolvimento de métodos biotecnológicos baseados em cultura de células de P. sprucei, visando reproduzir a planta através de plântulas ou outros meios. Também estão em andamento estudos sobre a velocidade de recrescimento de caules/planta X área, com o fim de avaliar a sustentabilidade e os parâmetros de produção associados ao extrativismo, o único método de fornecimento existente para essa valiosa espécie Amazônica.
Agradecimentos
CNPq, FAPEAM, INPA e ao Herbário do INPA pelos dados de distribuição geográfica de P. sprucei.
Referências
BERTANI, S.; BOURDY, G.; LANDAU, I.; ROBINSON, J.C.; ESTERRE, PH.; DEHARO, E. Evaluation of French Guiana traditional antimalarial remedies. Journal of Ethnopharmacology, v.98, p.45-54, 2005.
BHATNAGAR, S.C.; CARUSO, A.J.; POLONSKY, J. Biologically active quassinoids: synthetic methodology for the conversion of chaparranin into glaucarubolone esters and quassinoid analogs. Tetrahedron, v.43 n.15, p.3471-3480, 1987.
BHATNAGAR, S.C.; POLONSKY, J.; SEVENT, T.; PRANCÉ, T. Isolation and structure of 15-O-benzoyl-brucein D, a new quassinoid from Soulamea amara (X-ray analysis). Tetrahedron Letters, v.26, n.9, p.1225-1228, 1985.
DAIDO, M.; OHNO, N.; IMAMURA, K.; FUKAMIYA, N.; HATAKOSHI, M.; YAMAZAKI, H.; TAGAHARA, K.; LEE, K.; OKANO, M. Antifeedant and inseticidal activity of quassinoids against the Diamondblack moth (Plutella xylostella) and structure-Activity Relationships. Bioscience, Biotechnology, and Biochemistry, v.59 n.6, p.974-979, 1995.
DUKE, J.A.; VASQUEZ, R. Amazonian Ethnobotanical Dictionary. USA, CRC Press, p. 137, 1994.
FANDEUR, T.; MORETTI, C.; POLONSKY, J. In vitro and in vivo assessement of the antimalarial activity of Sergeolide. Planta Medica, v.51, p.20-23, 1985.
FERREIRA, M.C. O Mercado de plantas medicinais em Manaus. In: A floresta em jogo. O extrativismo na Amazônia Central. São Paulo, Laure Emperaire, tradução brasileira: Editora da UNESP, p.177-181, 2000.
FUKAMIYA, N.; LEE, K.; MUHAMMAD, I.; MURAKAMI, C.; OKANO, M.; HARVEY, I.; PELLETIER, J. Structure-activity relationships of quassinoids for eukaryotic protein synthesis. Cancer Letters, v.220, p.37-48, 2005.
GRENAND, P.; MORETTI, C.; JACQUEMIN, H. Pharmacopées Traditionnelles de Guyane. Edições de l’Orstom, Institut Français de recherce scientifique pour le développment en coopération, Paris, França, p.397-399, 1987.
KUBOTA, K.; FUKAMIYA, N.; TOKUDA, H.; NISHINO, H.; TAGAHARA, K.; LEE, K.; OKANO, M. Quassinoids as inhibitors of Epstein-Barr virus early antigen activation. Cancer Letters, v.113, p.165-168, 1997.
KUPCHAN, S.M.; BRITTON, R.W.; LACADIE, J.A.; ZIEGLER, M.F.; SIGEL, C.W. The isolation and structural elucidation of Bruceantin and Bruceantinol, new potent antileukemic quassinoids from Brucea antidysenterica. Journal of Organic Chemistry, v.40, n.5, p.648-654, 1975
LE COINTE, P. Árvores e plantas úteis (Amazônia brasileira III). Companhia Editora Nacional, São Paulo, SP, p.92, 1947.
LIDERT, Z.; WING, K.; POLONSKY, J.; IMAKURA, Y.; OKANO, M.; TANI, S.; LIN, Y.; KIYOKAWA, H.; LEE, K. Insect antifeedant and growth inhibitory activity of forty-six quassinoids on two species of agricultural pests. Journal of Natural Products, v.50, n.3, p.442-448, 1987.
MILLIKEN, W. Plants for Malaria, Plants for Fever. Medicinal species in Latin America - a bibliographic survey. Editora Royal Botanic Garden, Kew, p.99, 1997.
MOBOT - Missouri Botanical Garden: http://mobot.mobot.org/cgi-bin/search_vast. Current specimen List for Picrolemma sprucei. Acesso em 07 de dezembro de 2005.
MORETTI, C.; POLONSKY, J.; VUILHORGNE, M.; PRANGE, T. Isolation and structure of sergeolide, a potent cytotoxic quassinoid from Piclolemma pseudocoffea. Tetrahedron Letters, v.23 n.6, p.647-650, 1982.
MORS, W.B.; RIZZINI, C.T.; PEREIRA, N.A.; DEFILIPPS, R.A. Medicinal plants of Brazil. Editora Reference Publications, p.314, 2000.
NYBG - New York Botanical Garden: http://www.nybg.org/. Acesso em 21 de novembro de 2005.
OKANO, M.; FUKAMIYA, N.; TAGAHARA, K.; TOKUDA, H.; IWASHIMA, A.; NISHINO, H.; LEE, H. Inhiitory effects of quassinoids on Epstein-Barr virus activation. Cancer Letters, v.94, p.139-146, 1995.
PIO CORRÊA, M. Dicionário das Plantas Úteis do Brasil e das Exóticas Cultivadas. Rio de Janeiro, Ministério da Agricultura-IBDF, v.1-6, il., 1984.
POHLIT, A.M.; QUIGNARD, E.L.J.; NUNOMURA, S.M.; TADEI, W.P.; HIDALGO, A.F.; PINTO, A.C.S.; SANTOS, E.V.M.; ALECRIM, A.M.; FERRAZ, A.B.; PEDROSO, A.C.S.; DINIZ, E.V.; FINNEY, E.K.; GOMES, E.O.; DON, L.C.; QUEIROZ, M.M.A.; HENRIQUE, M.C.; SANTOS, M.; LACERDA JUNIOR, O.S.; PINTO, P.S.; SILVA, S.G.; GRAÇA, Y.R. Screening of plants found in Amazonas State, Brazil for activity against Aedes aegypti larvae. Acta Amazonica, v.34, n.1, p.97-105, 2004.
POLONSKY, J.; BHATNAGAR, S.; MORETTI, C. 15-deacetylsergeolide, a potent antileukemic quassinoid from Picrolemma pseudocoffea. Journal of Natural Products, v.47, n.6, p.994-996, 1984.
POLONSKY, J.; BHATNAGAR, S.C.; GRIFFITHS, D.C.; PICKETT, J.A.; WOODCOCK, C.M. Activity of quassinoids as antifeedants against aphids. Journal of Chemical Ecology, v.15, n.3, p.993-999, 1989.
RAHMAN, S.; FUKAMIYA, N.; OHNO, N.; TOKUDA, H.; NISHINO, H.; TAGAHARA, K.; LEE, K.; OKANO, M. Inhibitory effects of quassinoid derivates on Epstein-Barr virus early antigen activation. Chemical & Pharmaceutical Bulletin, v.45, n.4, p.675-677, 1997.
RIBEIRO, J.E.L.; HOPKINS, M.J.G.; VICENTINI, A.; SOTHERS, C.A.; COSTA, M.A.S.; BRITO, J.M.; SOUZA, M.A.D.; MARTINS, L.H.P.; LOHMANN, L.G.; ASSUNÇÃO, P.A.C.L.; PEREIRA, E.C.; SILVA, C.F.; MESQUITA, M.R.; PROCÓPIO, L.C. Flora da Reserva Ducke - Guia de identificação das plantas vasculares de uma floresta de terrafirme na Amazônia Central. Manaus-AM, INPA, p.547-549, 1999.
SARAIVA, R. C. G. Estudo fitoquímico de Picrolemma sprucei Hook. (Simaroubaceae) e dosagem dos princípios antimaláricos nos chás do caule e raiz. Manaus. Dissertação de Mestrado, Universidade Federal do Amazonas, 2001.
SARAIVA, R. C. G.; BARRETO, A.S.; SIANI, A.C.; FERREIRA, J.L.P.; ARAÚJO, R.B.; NUNOMURA, S.M.; POHLIT, A.M. Anatomia Foliar e Caulinar de Picrolemma sprucei Hook (Simaroubaceae). Acta Amazônica, v.33, n.2, p.213-220, 2003.
SCHPECTOR, J.Z.; CASTELLANO, E.E.; FHO, E.R.; VIEIRA, I.J.C. A new quassinoid isolated from Piclolemma pseudocoffea. Acta Crystallographica C, v.50, p.794-797, 1994.
SILVA, M.F.; LISBÔA, P.L.B.; LISBOA, R.C.L. Nomes vulgares de plantas amazônicas. Brasil, Instituto Nacional de Pesquisas da Amazônia - INPA, p.46, 1977
SPOHN, R.F.; GRIECO, P.A.; NARGUND, R.P.; Chemical transformations in the quassinoid series: Construction of the sensitive hidroxy enone functionality present in ring A of quassimarin and related quassinoids. Tetrahedron Letters, v.28 n.22, p.2491-2494, 1987.
TISCHLER, M.; CARDELLINA II, J.H.; BOYD, M.R.; CRAGG, G.M. Cytotoxic quassinoids from Cedronia granatensis. Journal of Natural Products, v.55 n.5, p.667-671, 1992.
THOMAS, W.W. the American genera of Simaroubaceae and their distribution. Acta Botanica Brasilica, v.4 n.1, p.11-18, 1990.
VIEIRA, I.J.C.; RODRIGUES-FILHO, E.; FERNANDES, J.B.; DA SILVA, M.F.G.F.; VIEIRA, P.C. Complete 1H and 13C chemical shift assignments of a new C22-quassinoid isolated from Picrolemma sprucei Hook by NMR spectroscopy. Magnetic Resonance in Chemistry, v.38, p.805-808, 2000.
VIGNERON, M.; DEPARIS, X.; DEHARO, E.; BOURDY, G. Antimalarial remedies in French Guiana: A knowledge attitudes and practices study. Journal of Ethnopharmacology, v.98, p.351-360, 2005.