Estado da Arte
Constituintes Químicos das Cascas de Copaifera langsdorfii Desf.
Constituents from Bark Extracts of Copaifera langsdorfii Desf.
Resumo
Cada vez com mais freqüência, os extratos das cascas do tronco das árvores do gênero Copaifera L. (Fabaceae-Caesalpinoideae) são utilizados pela população no tratamento de inflamações e tumores especialmente Norte do Brasil. Apesar do gênero Copaifera L. ter sido amplamente estudado, não há estudos relatando a composição das cascas da árvore. Estudos fitoquímicos com extratos das cascas do tronco de Copaifera langsdorfii Desf. permitiram o isolamento e a identificação dos ácidos ent-caurenóico e betulínico como constituintes majoritários dos extratos obtidos em hexano e em acetato de etila, respectivamente, além de sesquiterpenos, ácidos graxos, esteróis e outros diterpenos e triterpenos. As atividades antiinflamatórias e antitumorais destes dois ácidos já foram relatadas na literatura.
- Unitermos
- Copaifera langsdorfii Desf..
- Ácido Betulínico.
- Ácido ent-Caurenóico..
Abstract
Bark extracts from the trunk of the trees of the Copaifera L. (Fabaceae-Caesalpinoideae) genus have been used by the population against inflammations and tumors, especially in the North of Brazil. The Copaifera species has been well studied; however, there are no reports on the bark chemical composition. Phytochemical studies with bark extracts from Copaifera langsdorfii Desf. led to the isolation and identification of ent-kaurenoic and betulinic acids as major components from extracts obtained with hexane and ethyl acetate, respectively, together with sesquiterpenes, fatty acids, sterols and other diterpenes e triterpenes. The anti-inflammatory and antitumoral activities of these two acids have been reported in the literature.
- Key words
- Copaifera langsdorfii Desf..
- Betulinic Acid.
- ent- Kaurenoic Acid..
Introdução
O gênero Copaifera L. (Fabaceae-Caesalpinioideae) é encontrado em todo o Brasil e em outros países da América Latina, principalmente (VEIGA JR.; PINTO, 2002). Suas árvores são conhecidas por exsudarem um óleo de seu tronco através de incisões realizadas com trado, o chamado óleo de copaíba (VEIGA JR. et al., 1997). Este óleo apresenta propriedades medicinais comprovadas por vários estudos (LIMA et al., 2003; PAIVA et al., 1998; VEIGA JR. et al., 2001). Entre as diversas espécies do gênero, a C. langsdorfii Desf. destaca-se por exsudar um óleo de coloração vermelha, pouco comum, e por ser a única encontrada em todas as regiões brasileiras (VEIGA JR.; PINTO, 2002). Além dos óleos de copaíba, os extratos obtidos das cascas do tronco das copaíbas também apresentam indicações de propriedades medicinais na literatura, como antiinflamatório e anti-tumoral (CARVALHO, 1994; MATOS, 1997; XAVIER FILHO et al., 1995).
Estas propriedades medicinais não são encontradas nos relatos mais antigos, sendo citadas apenas nos estudos realizados no final do século passado, e de forma cada vez mais freqüente entre os mateiros e nos mercados populares da Região Norte do Brasil. Sua utilização recente pode estar relacionada com a relativa dificuldade de se extrair o óleo das copaibeiras, o que não ocorre de qualquer árvore ou em qualquer época do ano. Apesar do crescente uso, não há estudos fitoquímicos relatando a constituição química das cascas do tronco de copaíferas. O objetivo deste estudo foi descrever a constituição química dos extratos de baixa e média polaridade das cascas de Copaifera langsdorfii Desf.
Materiais e Métodos
As cascas do tronco foram coletadas em 12 de dezembro de 1999 de um espécime localizado no bairro de Barão Geraldo, na região urbana do município de Campinas, Estado de São Paulo. Uma exsicata foi depositada no herbário do Jardim Botânico do Rio de Janeiro, sob número RB 344.931, e identificada pelo botânico Dr. Haroldo C. Lima como Copaifera langsdorfii Desf. Os extratos foram obtidos por maceração durante 3 dias, com subseqüente remoção do solvente, por concentração em evaporador rotatório e re-inserção de solvente puro; procedimento repetido 3 vezes para cada solvente utilizado. Os fracionamentos cromatográficos foram realizados em colunas de gel de sílica. Para cromatografia em camada fina foram utilizadas placas de alumínio revestidas com gel de sílica 60 F254. Como reveladores foram utilizados a luz ultravioleta e solução de sulfato cérico a 2% em ácido sulfúrico, seguido de aquecimento.
Para as análises por cromatografia em fase gasosa, os extratos foram previamente tratados com diazometano. As análises cromatográficas foram realizadas em cromatógrafo a gás (Hewlett Packard - modelo 5890), coluna capilar com 20 m de comprimento, 0,25 mm de diâmetro interno e 0,25 μm de espessura de fase de 5% de fenil em metil silicone (SE-54); nas seguintes condições: gás de arraste Hidrogênio, com vazão de 2 mL/min e divisão de fluxo (split) de 1:20. A temperatura inicial foi ajustada em 120 oC, com de taxa de aquecimento de 2 oC/min até 160 oC, a partir da qual a taxa de aquecimento foi selecionada em 8 oC / min até 290 oC. A temperatura final foi mantida constante durante 25 minutos. As análises por CG-EM (equipamento Hewlett Packard - modelo 6890 MSD) foram realizadas por impacto de elétrons (70 eV), utilizando a mesma programação de temperatura do forno da análise por cromatografia gasosa, com coluna semelhante à primeira, DB5 com 20 m de comprimento, 0,25 mm de diâmetro, 0,25 μm de espessura de fase; e gás de arraste Hélio, com vazão de 1,6 mL/min, sem divisão de fluxo (splitless). Os espectros de ressonância magnética nuclear (RMN) de 1H e 13C foram obtidos em espectrômetro Brüker modelo AC-300, com freqüências de 300 e 75 MHz, respectivamente, utilizando-se TMS como padrão interno e clorofórmio deuterado como solvente para as análises.
Resultados e discussão
Os extratos obtidos por maceração foram diretamente analisados por cromatografia em fase gasosa após esterificação dos componentes ácidos com diazometano. No extrato obtido em hexano foram identificados sesquiterpenos, diterpenos, triterpenos, esteróis e uma série de ácidos graxos lineares. A maior parte destas substâncias foi caracterizada sem a necessidade de isolamento, utilizando técnicas cromatográficas em conjunto com a espectrometria de massas e em concentrações extremamente baixas, como ilustra a Figura 1.
** A Região B: eluição de esteróis e triterpenos. Tempos de retenções entre 40 e 50 minutos
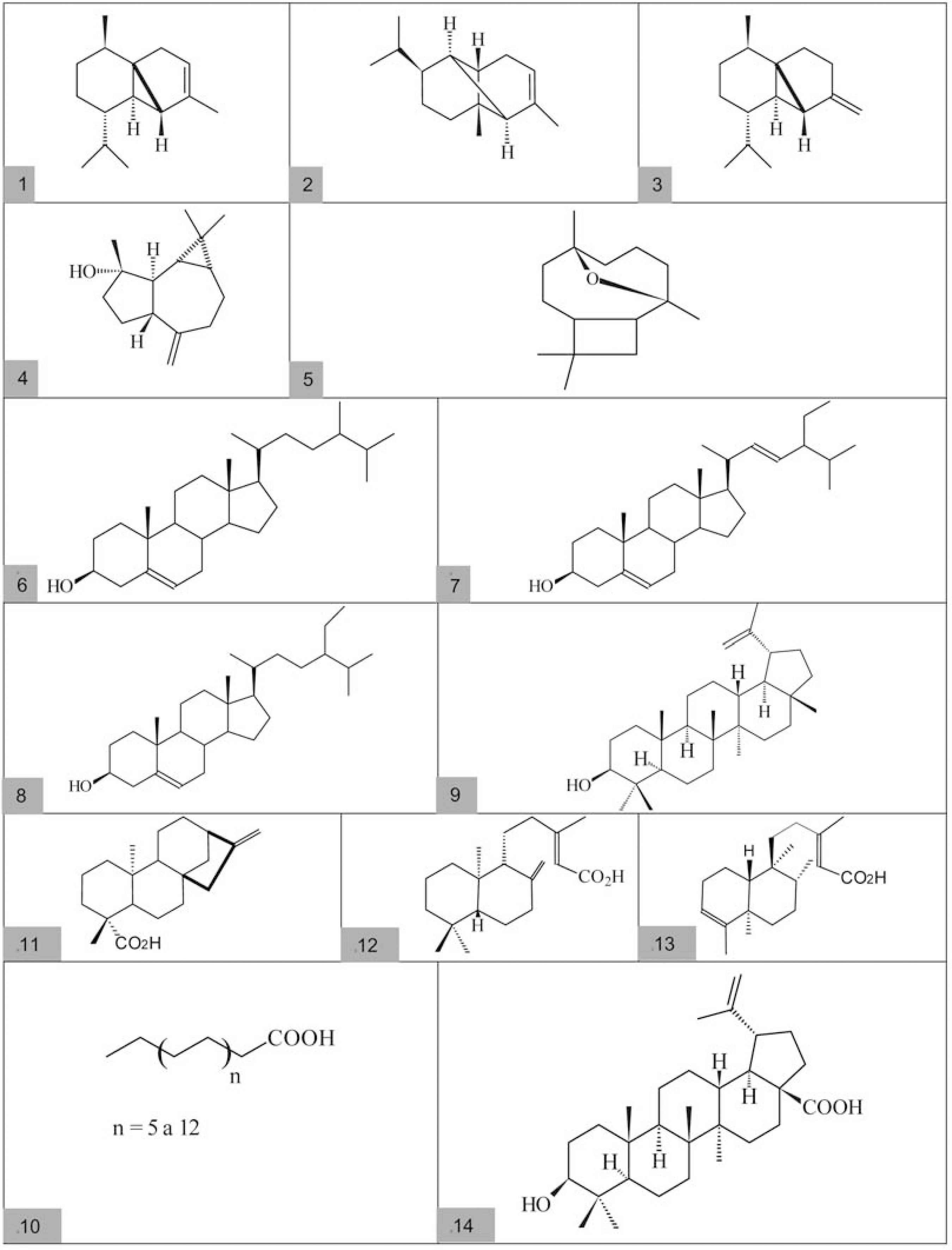
Utilizando esta metodologia, os custos de caracterização de substâncias já conhecidas são diminuídos enormemente, dispensando os longos processos de isolamento e as análises em equipamentos com custo de operação mais elevado, como a ressonância magnética nuclear. Séries de álcoois, ésteres metílicos, etílicos ou ácidos graxos lineares podem ser identificados por meio da detecção de série homóloga, utilizando a técnica de monitoramento seletivo de íons (VEIGA JR., PINTO, 2005). Sesquiterpenos, assim como monoterpenos, podem ser identificados através do conjunto de dados de espectrometria de massas, comparação destes dados com os de espectrotecas e através de seus índices de retenção obtidos em relação a uma série de hidrocarbonetos lineares (VAN DER DOOL, KRATZ, 1963). Já os esteróis comuns em extratos de plantas, como o campesterol, o estigmasterol e o β-sitosterol, podem ser identificados através de seus dados de espectrometria de massas, confirmados pela co-injeção e co-eluição utilizando misturas padrões, que podem ser obtidas, por exemplo, da fração insaponificável do óleo de soja (ALVES et al., 2002; PINTO et al., 1994). Utilizando esta metodologia, foram identificados em baixas concentrações os sesquiterpenos, α-cubebeno (1), α-copaeno (2), β-cubebeno (3), espatulenol (4) e óxido de cariofileno (5) (Região A, do cromatograma da Figura 1) e os esteróis campesterol (6), estigmasterol (7) e β-sitosterol (8) (Região B, do cromatograma da Figura 1). Utilizando o mesmo princípio foi identificado tentativamente o triterpeno lupeol (9), através da co-eluição com padrão previamente disponível em nosso laboratório. É pertinente mencionar-se que o lupeol normalmente coelui com um outro triterpeno, a α-amirina, em muitas condições diferentes de análise; fato este que permanece por ser mais bem elucidado (GUIMARÃES, 1997). A série homóloga de ácidos graxos identificados é composta de 14 a 28 átomos de carbono (C14 a C28 (10)) e pode ser observada na região que se estende de 18 a 40 minutos no cromatograma da Figura 1. Na Figura 2, a seguir, são apresentadas as estruturas das substâncias identificadas.
Os constituintes majoritários do extrato obtido em hexano, assinalados na Figura 1, são os ácidos diterpênicos ent-caurenóico (11), copálico (12) e colavênico (13), pertencentes a três esqueletos distintos: caurano, labdano e clerodano, respectivamente. A identificação foi realizada, após isolamento em coluna cromatográfica de sílica gel e recristalização, através de técnicas espectroscópicas, como a espectrometria de massas e a ressonância magnética nuclear, utilizando comparação com dados previamente publicados. Estes três ácidos já haviam sido anteriormente descritos em óleos de copaíba, mas nunca em um mesmo óleo. O ácido ent-caurenóico foi descrito inicialmente em 1971, por Ferrari (FERRARI et al., 1971) e re-isolado por Paiva e colaboradores (1998). Os demais ácidos foram detectados por Ohsaki, em 1994 (OHSAKI et al., 1994).
Os labdanos são diterpenos com variadas atividades farmacológicas já descritas na literatura (SINGH et al., 1999). Estudos de atividade antiinflamatória foram realizados com o ácido copálico (BASILE et al., 1988), assim como estudos de atividade antibacteriana (TINCUSI et al., 2002). Diversas atividades farmacológicas são relatadas para o ácido ent-caurenóico, como atividade relaxante uterina (CUNHA et al., 2003), antiinflamatória (PAIVA et al., 2003), embriotóxica (VALENCIA et al., 1986), bactericida (WILKENS et al., 2002; TINCUSI et al., 2002; VELIKOVAA et al., 2000), hemolítica em eritrócitos humanos e murinos, antileucêmica e citostática (COSTA-LOTUFO et al., 2002). Análise por cromatografia gasosa acoplada à espectrometria de massas do extrato obtido em acetato de etila indicou a presença de um triterpeno majoritário. Esse triterpeno foi isolado e identificado através de técnicas de ressonância magnética nuclear de 1H e 13C, além de DEPT, COSY e HETCOR, como o ácido betulínico (14), formalmente o ácido 3β-hidroxi-lupa-20(29)-en-28-óico. Os dados espectroscópicos do ácido betulínico foram comparados com os descritos na literatura para este triterpeno (JAGADEESH et al., 1998; TAKEOKA et al., 2000).
O ácido betulínico foi inicialmente isolado em espécies de Betula ssp. (BRUCHNER et al., 1948). Diversos estudos demonstraram suas atividades farmacológicas como antimalárica (BRINGMANN et al., 1997) e antitumoral, além da ação contra o vírus HIV (BAGLIN et al. 2003; FUJIOKA et al., 1994; MAYAUX et al., 1994). Seu mecanismo de ação diferenciado na ação contra o vírus HIV e sua potente ação no tratamento de melanomas (EVERS et al., 1996) têm motivado o depósito de diversas patentes, apresentando-se como uma importante alternativa de potencial de tratamento. Em Plantanus acerifolia, o ácido betulínico foi isolado numa concentração de 3,4% do extrato obtido em hexano (GALGON et al., 1999). No atual estudo não foram realizados estudos quantitativos. Os cálculos preliminares, para a quantidade de ácido betulínico contido no extrato apolar bruto de C. langsdorfii, revelam o alto potencial desta espécie como fonte desta substância, desde que as primeiras análises cromatográficas qualitativas apontam para uma concentração que rivaliza com a fonte comercial tradicional desta substância (estimados: cerca de 15%).
Este é o primeiro relato da constituição química de extratos de baixa polaridade das cascas de espécies do gênero Copaifera. Sesquiterpenos e diterpenos já haviam sido relatados no gênero Copaifera nos óleos de copaíba, mas nunca triterpenos. Esteróis e ácidos graxos, apesar de comuns em extratos de plantas, também não haviam sido anteriormente descritos no gênero. Entre os diterpenos, os três ácidos já haviam sido descritos nos óleos de copaíba obtidos de C. langsdorfii Desf. Os ácidos betulínico e ent-caurenóico possuem diversos estudos de atividade farmacológica comprovada, como antiinflamatórios e antitumorais. Mais estudos são necessários para que se estabeleça de forma inequívoca a relação destes terpenos com as atividades medicinais. Sua alta concentração nos extratos é sugerida como justificativa para o uso popular destas cascas em formulações medicinais.
Agradecimentos
Os autores agradecem ao CNPq, FAPERJ, FUJB, CAPES e à FAPEAM.
Referências
ALVES, A.B.; VEIGA JR., V.F.; PINTO, A.C. Constituintes químicos de Burlemarxia rodriguesii Menezes & Semir (Velloziaceae). Revista Brasileira de Farmacognosia, v.12, p.78-79, 2002.
BAGLIN, I.; MITAINE-OFFER, A.C.; NOUR, M.; TAN, K.; CAVÉ, C.; LACAILLE-DUBOIS, M.A. A review of natural and modified betulinic, ursolic, and echinocystic acid derivatives as potential antitumor and anti-HIV agents, Medicinal Chemistry, v.3, p.525-539, 2003.
BASILE, A.C.; SERTIE, J.A.; FREITAS, P.C.; ZANINI, A.C. Anti-inflammatory activity of oleoresin from Brazilian Copaifera. Journal of Ethnopharmacology, v. 22, p.101-109, 1988.
BRINGMANN, G., SAEB, W., ASSI, L.A., FRANCOIS, G., NARAYANAN, A.S.S., PETERS, K., PETERS, E.M. Betulinic acid: isolation from Triphyophyllum peltatum and Ancistrocladus heyneanus, antimalarial activity, and crystal structure of the benzyl ester. Planta Medica, v.64, p.54-57, 1997.
BRUCHNER, V.; KOVACS, J.; KOCSKA, I. Occurrence of betulinic acid in the bark of plane tree. Journal of Chemical Society, p.948-951, 1948.
CARVALHO, P.E.R., Espécies Florestais Brasileiras, EMBRAPA, Brasília, 1994.
COSTA-LOTUFO, L.V.; CUNHA, G.M.A.; FARIAS, P.A.M.; VIANA, G.S.B.; CUNHA, K.M.A.; PESSOA, C.; MORAES, M.O.; SILVEIRA, E.R.; GRAMOSA, N.V.; RAO, V.S.N. The cytotoxic and embriotoxic effects of kaurenoic acid, a diterpene isolated from Copaifera langsdorfii oleo-resin. Toxicon, v.40, p.1231-1234, 2002.
CUNHA, K.M.A.; PAIVA, L.A.; SANTOS, F.A.; GRAMOSA, N.V.; SILVEIRA, E.R.; RAO, V.S. Smooth muscle relaxant effect of kaurenoic acid, a diterpene from Copaifera langsdorfii on rat uterus in vitro. Phytotherapy Research, v.17, p.320-324, 2003.
EVERS, M.; POUJADE, C.; SOLER, F.; RIBEIL, Y.; JAMES, C.; LELIAVRE, Y.; GUEGUEN, J.C.; REISDORF, D.; MORIZE, I.; PAUWELS, R.; DE CLERCQ, E.; HENIN, Y.; BOUSSEAU, A.; MAYAUX, J.F.; LE PECQ, J.B.; DEREU, N. Betulinic acid derivatives: A new class of HIV type I specifc inhibitors with a new mode of action. Journal of Medicinal Chemistry, v.39, p.1056-1068, 1996.
FERRARI, M.; PAGNONI, U.M.; PELIZZONI, F.; LUKES, V.; FERRARI, G. Terpenoids from Copaifera langsdorfii. Phytochemistry, v.10, p.905-907, 1971.
FUJIOKA, T.; KASHIWADA, Y.; KILKUSKIE, R.E.; COSENTINO, LM.; BALLAS, L.M.; JIANG, J.B. Anti-AIDS Agents, 11. Betulinic acid and platanic acid as anti-HIV principles from Syzigium claviflorum, and the anti-HIV activity of structurally related triterpenoids. Journal of Natural Products, v.57, p.243-247, 1994.
GALGON, T.; HÖKE, D.; DRÄGER, B. Identification and quantification of betulinic acid. Phytochemical Analysis, v.10, p.187-190, 1999.
GUIMARÃES, A. C. Estudo Químico e Avaliação Biológica das Folhas de Protium strumosum, P. grandifolium, P. llewelynii e P. altsonii, These de Mestrado, Universidade do Amazonas, Manaus, Brazil, 98 p., 1997.
JAGADEESH, S.G.; KRUPADANAM, G.L.D.; SRIMANNARAYANA, G. Tobacco caterpillar antifeedent from the gotti stem wood triterpene betulinic acid. Journal of Agricultural and Food Chemistry, v.46, p.2797-2799, 1998.
LIMA, S.R.M.; VEIGA JR., V.F., CHRISTO, H.B., PINTO, A.C., FERNANDES, P.D. In vivo and in vitro studies on the anticancer activity of Copaifera multijuga Hayne. Phytotherapy Research, v.17, p.1048-1053, 2003.
MATOS, F.J.A., O Formulário Fitoterápico do Professor Dias da Rocha, 2ª. Edição, UFC, Fortaleza, 1997.
MAYAUX, J.-F.; BOUSSEAU, A.; PAUWELS, R.; HUET, T.; HENIN, Y.; DEREU, N. Triterpene derivatives that block entry of human immunodeficiency virus type 1 into cells. Proceedings of the National Academy of Sciences USA, v.91, p.3564-3568, 1994.
OHSAKI, A.; YAN, L.T.; ITO, S.; EDATSUGI, H.; IWATA, D.; KOMODA, Y. The isolation and in vivo potent antitumor activity of clerodane diterpenoid from the oleoresin of the brazilian medicinal plant, Copaifera langsdorfii Desfon. Bioorganic &. Medicinal Chemistry Letters v.4, n.24, p.2889-2892, 1994.
PAIVA, L.A. F.; RAO, V.S.N.; GRAMOSA, N.V.; SILVEIRA, E.R. Gastroprotective effect of Copaifera langsdorfii oleo-resin on experimental gastric ulcer models in rats. Journal of Ethnopharmacology, v.62, p.73-78, 1998.
PAIVA, L.A.F.; GURGEL, L.A.; SILVA, R.M.; TOMÉ, A.R.; GRAMOSA, N.V.; SILVEIRA, E.R.; SANTOS, F.A.; RAO, V.S.N. Anti-inflammatory effect of kaurenoic acid, a diterpene from Copaifera langsdorfii on acetic acid-induced colitis in rats. Vascular Pharmacology, v.39, p.303-307, 2003.
PINTO, A.C.; SIMONI, M.S.C.; CUNHA, M.P.C.C.; COELHO, R.B.; PATITUCCI, M.L. Mistura natural de esteróides, uma alternativa para aplicação de padrões em análises por cromatografia gasosa de alta resolução. Química Nova, v.17, p.333-335, 1994.
SINGH, M.; PAL, M.; SHARMA, R.P. Biological activities of labdane diterpenes. Planta Medica, v.65, p.2-8, 1999.
TAKEOKA, G.; DAO, L.; TERANISHI, R.; WONG, R.; FLESSA, S.; HARDEN, L.; EDWARDS, R. Identification of three triterpenoids in almond hulls. Journal of Agricultural and Food Chemistry, v.48, p.3437-3439, 2000.
TINCUSI, B.; JIMENEZ, I.; BAZZOCCHI, I.; MOUJIR, L.; MAMANI, Z.; BARROSO, J.; RAVELO, A.; HERNANDEZ, B. Antimicrobial terpenoids from the oleoresin of the peruvian medicinal plant Copaifera paupera. Planta Medica, v.68, p.808-812, 2002.
VALENCIA, A.; WENS, A.; PONCE-MONTER, H.; PEDRON, N.; GALLEGOS, A.J.; GUIJANE, A.F.; CALDERON, J.; GOMEZ, F.; RIOS, T. In vitro effect of kaurenoic acid isolated from Montana frutescens and two derivatives upon human spermazoa. Journal of Ethnopharmacology, v.18, p.89-94, 1986.
VAN DER DOOL, H.; KRATZ, P.D. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography. Journal of Chromatography, v.11, p.463-471, 1963.
VEIGA JR., V.F.; PATITUCCI, M.L.; PINTO, A.C. Controle de adulteração de óleos de copaíba por cromatografia gasosa de alta resolução. Química Nova, v. 20, p.612-615, 1997.
VEIGA JR, V.F.; ZUNINO, L.; CALIXTO, J.B.; PATITUCCI, M.L.; PINTO, A.C. Phytochemical and anti-oedematogenic studies of commercial copaiba oils available in Brazil. Phytotherapy Research. v.15, p.476-480, 2001.
VEIGA JR., V.F.; PINTO, A.C. O gênero Copaifera L. Química Nova, v.25, p.273-286, 2002.
VEIGA JR., V.F.; PINTO, A.C. Utilização do monitoramento seletivo de íons como ferramenta para detecção de adulterações em óleos de copaíba. Revista Fitos, v.1, n.1, p.52-56, 2005.
VELIKOVAA, M.; BANKOVAA, V.; TSVETKOVAB, U.I.; KUJUMGIEVB, A.; MARCUCCIC, M.C. Antibacterial ent-kaurene from Brazilian propolis of native stingless bees. Fitoterapia, v.71, p.693-696, 2000.
WILKENS, M.; ALARCON, C.; URZUA, A.; MENDOZA, L. Characterization of the bactericidal activity of the natural diterpene kaurenoic acid. Planta Medica, v. 68, p. 452-454, 2002.
XAVIER FILHO, L.; BARBOSA FILHO, J.M.; MEDEIROS, D.F. Contribuição ao Estudo de plantas medicinais do Cerrado, Brasil Central. Boletim da Sociedade Broteriana de Portugal, v.58, Série 2, p.43-56, 1995.