Estado da Arte
Produtos Naturais Ativos em Leishmaniose
Natural Products Active in Leishmaiasis
Resumo
Uma variedade surpreendente de substâncias naturais inibe o crescimento experimental de parasitos do gênero Leishmania responsáveis pelas três principais formas da doença leishmaniose - a tegumentar, a muco-tegumentar e a visceral. Resultados obtidos com extratos de plantas, às vezes in vivo, mais freqüentemente in vitro, demonstram que a atividade pode ser encontrada numa extensa diversidade de familias, das quais se destacam, entre muitas outras, Crassulaceae (gênero Kalanchoe), Annonaceae (muitos gêneros). Piperaceae (especialmente o gênero Piper), Rutaceae (com destaque para o gênero Galipea) e Apocynaceae (gênero Peschiera entre outros). Classes químicas que se distinguem incluem alcalóides e chalconas que foram em alguns casos demonstradas agir diretamente sobre o parasito, enquanto outras classes que abrangem uma variedade de substâncias fenólicas, terpênicas, inclusive die triterpenóides, e polissacarídeos, agem, ou parecem agir, sobre o macrófago, célula hospedeira do parasito, estimulando-o a produzir óxido nítrico, mediadores como TNFa e INFs ou outros fatores da reação imunológica letais à Leishmania sem ser prejudiciais ao próprio macrófago. Os resultados, às vezes, confirmam usos tradicionais das plantas e, em conjunto, formam uma base sólida para o desenvolvimento de novos medicamentos para este grupo de doenças.
- Unitermos:
- fitoterápicos.
- Leishmania.
- óxido nítrico.
- fatores imunológicos.
Abstract
A surprising variety of natural substances inhibit the experimental growth of Leishmania parasites, which are responsible for the three main forms of the disease leishmaniasis - cutaneous, muco-cutaneous and visceral. Results obtained with plant extracts, sometimes in vivo, although more frequently in vitro, demonstrate that the activity can be found in a wide variety of botanical families. Notable examples include Crassulaceae (genus Kalanchoe), Annonaceae (many genera). Piperaceae (especially Piper spp), Rutaceae (notably the genus Galipea) and Apocynaceae (genus Peschiera among others). Chemical classes that are important include alkaloids and chalcones that act directly on the parasite, while other classes embrace a variety of substances - phenolics, terpenoids, including diand triterpenoids, and polysaccharides, whose action is often on the macrophage, host cell to the parasite, stimulating it to produce nitric oxide, mediators such as TNFa and INFs or other factors of the immune system lethal to Leishmania without being harmful to the macrophage itself. The results obtained sometimes confirm traditional uses of the plants and together form a solid basis for the development of new drugs to treat this group of diseases.
- Key words:
- phytotherapy.
- Leishmania.
- nitric oxide.
- immune system.
Introdução
A leishmaniose constitui um grupo de doenças endêmicas que se manifestam em praticamente toda a zona tropical do mundo. Existem formas tegumentar, que causa lesões na pele, e visceral, que é mais séria no sentido que ataca a parede intestinal. Nas Américas ainda há uma forma da doença tegumentar que ataca as mucosas, especialmente do nariz e boca, causando desfiguração séria da vítima. O tratamento atual se limita a drogas baseadas em antimônio pentavalente bastante tóxicas e de difícil administração (intramuscular), ou à anfotericina B, ambos de uso sob a mais estrita supervisão. O emprego da fitoterapia promete solucionar o problema do habitante que vive distante dos centros urbanos e que depende, em princípio, daquilo que ele mesmo ou seus familiares podem colher, cultivar e processar.
As Plantas e seus Metabólitos Leishmanicidas
Um número grande de extratos de plantas, algumas de uso tradicional, foi mostrado possuir atividade contra espécies de Leishmania e em alguns casos as substâncias ativas foram identificadas. Embora as várias espécies de Leishmania produzam patologias distintas em humanos, parece haver no momento pouca evidência firme que distinga ou compare, no nível de laboratório, a atividade de um extrato vegetal ou de uma substância ativa isolada contra diferentes formas do parasito.
No animal infectado, inclusive no homem, o parasito reside como uma amastigota sem flagelo dentro de um macrófago. Dois mecanismos básicos de ação de drogas que são observados envolvem ou um incentivo do macrófago para produzir um agente letal para o parasito ou resulta de uma substância intrinsecamente tóxica para a Leishmania que penetra no macrófago e interfere com o parasito mas não com a célula do hospedeiro. Extratos de plantas ativas ou substâncias isoladas foram identificados que exemplificam ambos os mecanismos e o desenvolvimento de uma droga vegetal que associe os dois mecanismos poderia ser uma abordagem útil.
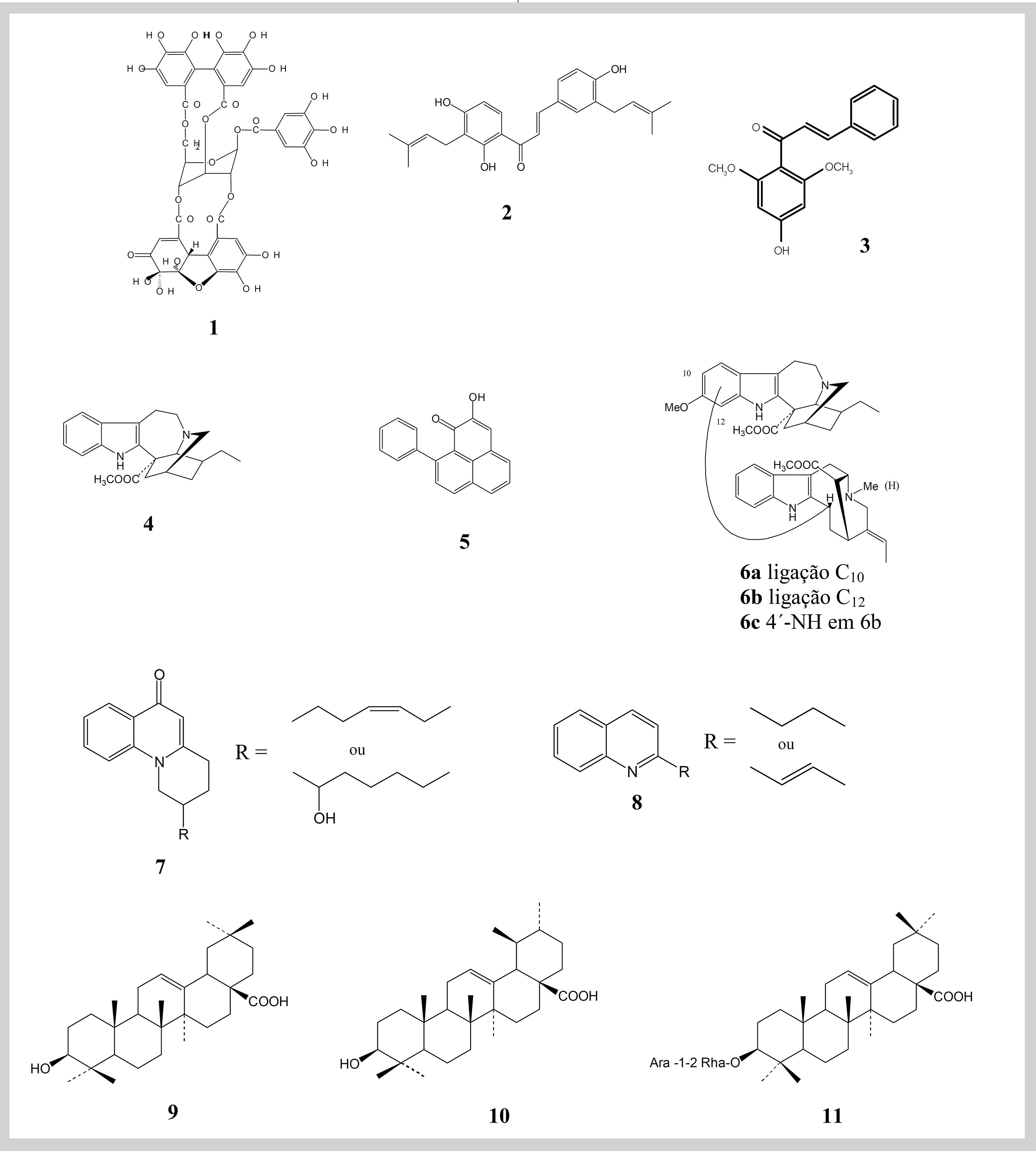
Um exemplo do primeiro mecanismo, em que o macrófago é estimulado para produzir óxido nítrico, letal para o parasito, é representado por extratos ou suco expresso das folhas de Kalanchoe pinnata Pers.(Crassulaceae), folha-da-fortuna, que são ativos em modelos in vitro da doença cutânea e in vivo, quando administrado oralmente (DA-SILVA et al.,1995; DA-SILVA et al., 1999). Um outro caso é exemplificado pelo conhecido Phyllanthus amarus Schum. (Euphorbiaceae), (KOLODZIEJ et al., 2001), uma das quebra-pedras, cujos taninos (por exemplo geraniina 1) parecem agir estimulando o macrófago com a liberação de TNFa e interferons que eliminam a amastigota. Estes taninos não têm efeito sobre o parasito extracelular na forma de promastigota. As duas plantas em questão têm usos medicinais tradicionais outros que não leishmaniose nas regiões no Brasil onde esta doença é prevalente. Kalanchoe seria uma boa candidata para uso popular na forma de suco de folha fresca em regiões de difícil acesso e conseqüente disponibilidade limitada de drogas distribuídas ou de serviços médicos. Os mesmos critérios se aplicariam a Phyllanthus se esta planta for efetiva in vivo, como é in vitro, contra amastigotas do parasito visceral L. donovani. O fato que ambos são plantas medicinais conhecidas deverá facilitar a aceitação por populações rurais.
Princípios ativos que atacam o parasito diretamente são exemplificados por chalconas e alcalóides. Os primeiros destes a ter o seu mecanismo de ação explicado foi licochalcona, 2, uma chalcona que ocorre nas raízes e rizomas do alcaçuz chinês ou Gan Cao, podendo abranger as espécies Glycyrrhiza uralensis Fisch ex DC, G. inflata e G. glabra L. (Fabaceae) (CHRISTENSEN et al.,1994). Ela é ativa contra ambos os parasitos, o cutâneo L. major e o visceral L. donovani, e observou-se que ela destruía o mitocôndrio dos parasitos, promastigotas ou amastigotas, sem prejuízo às demais organelas e sem afetar o mitocôndrio do macrófago. O mecanismo principal foi identificado como sendo pela inibição da enzima fumarato redutase, uma enzima que existe somente no parasito e não em células do hospedeiro, o que explica a especificidade. Uma outra chalcona, 3, isolada da planta medicinal sul-americana Piper aduncum L. (Piperaceae), aperta-ruão (TORRES-SANTOS et al., 1999a, 1999b) e também alcalóides indólicos como coronaridina, 4, de Peschiera (Tabernaemontana) australis Muell. Arg. (Apocynaceae), leiteira, também destrõem o mitocôndrio do parasito, mas, evidentemente, por um mecanismo diferente (DELORENZI et al., 2001, 2002). Outros alcalóides indólicos que, em conjunto, ou separados, inibem o crescimento de promastigotas se encontram em Picralima nitida Th. et H. (IWU, et al.,1994). A fitoalexina, anigorufona, 5, uma semiquinona aromática policíclica, produzida por infecção da bananeira Musa acuminata Colla (Musaceae) por um fungo do gênero Fusarium, foi demonstrada bloquear a cadeia respiratória de L. donovani por inibição de fumarato redutase e sucinato desidrogenase (LUQUE-ORTEGA et al., 2004). Alcalóides diméricos também do grupo da coronaridina, como conoduramina, conodurina e gabunina, 6a, 6b e 6c, da planta medicinal boliviana Peschiera van heurkii (Muell. Arg.) L. Allorge (Apocynaceae) são muito ativos contra as amastigotas do parasito cutâneo sul-americano L. amazonensis (MUNOZ,V. et al.,1994). As chalconas, e análogos, são passíveis de síntese em muitos casos, e representam uma classe muito promissora para o desenvolvimento de novos medicamentos. Os alcalóides provavelmente seriam mais caros como drogas isoladas mas ambos os grupos estariam prontamente disponíveis como extratos das plantas originais, e os mais ativos merecem comparação e seleção para desenvolvimento como medicamentos para o tratamento das formas cutânea, muco-cutânea e visceral da doença.
Outro grupo de alcalóides que recebeu muita atenção inclui os 2-alquil e aril quinolinas. Estas vieram originalmente de espécies de Rutaceae, especialmente de folhas e casca de Galipea longiflora Kr., usadas pelos indígenas Chimane na Bolívia para o tratamento de lesões cutâneas (FOURNET et al., 1994, 1996). A fácil síntese de alguns membros ativos do grupo, como 2-n-propilquinolina e 2-n-propenilquinolina, 8, esta conhecida como chimanina-B, faria deles candidatos ideais para o desenvolvimento como drogas sintéticas, pelo menos para a doença cutânea. Dictiolomidas A e B, 7, alcalóides quinolônicas de Dictyoloma peruviana Planch. (Simaroubaceae) exemplificam um outro tipo com atividade contra promastigotas de Leishmania spp. (LAVAUD et al.,1995).
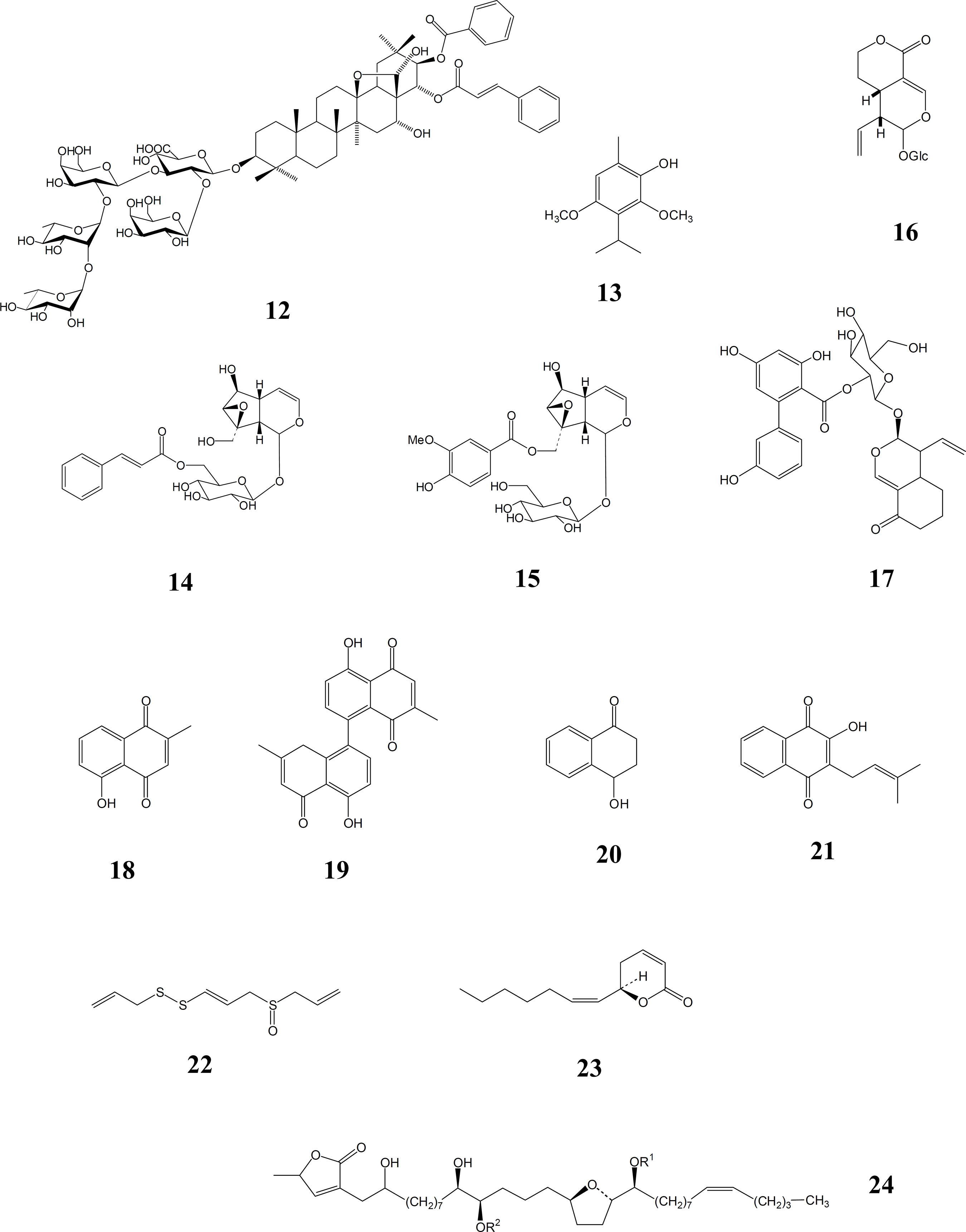
Algumas substâncias naturais, conhecidas por serem estimulantes do sistema imunológico, são eficazes contra infecções causadas por leishmanias, possivelmente funcionando pelo estímulo à atividade do macrófago. Ácidos oleanólico, 9, e ursólico, 10, de Pouroma guianensis Aubl. (Moraceae), que foram ativos contra amastigotas (TORRES-SANTOS et al., 2004), estão entre estes. Outros triterpenóides que poderiam ser imunoestimulantes incluem glicosídeos. Um exemplo é a saponina 12, de Maesa balansae Forssk. (Myrsinaceae), que mostrou atividade in vitro e in vivo (MAES L, et al., 2004). Sempre quando atividade anti-leishmânia observada for muito maior na amastigota dentro do macrófago que em promastigotas extracelulares, a participação do sistema imunológico pode ser suspeitada. Isto é o caso com as saponinas, tipo 11, das folhas de hera, Hedera helix L. (Araliaceae) (DELMAS et al., 2000; MAJESTER-SAVORNIN, et al., 1991) e com as catequinas diméricas de Khaya senegalensis (Desr.) A. Juss. (Meliaceae) (ABREU et al., 1999). A excitação do sistema imunológico também foi invocada para explicar a atividade leishmanicida de um polissacarídeo de Echinacea purpurea Moench (Asteraceae), uma planta conhecida pela capacidade de seus extratos de aumentar resistência à infecção (STEINMULLER et al.,1993; LUETTIG B. et al., 1989). Uma droga indiana feita dos rizomas de Picrorrhiza kurroa Royle ex Benth. (Scrophulariaceae), e conhecida como kutki ou kurro, é outro imunoestimulante embora o seu uso principal na Índia seja como um agente hepatoprotetor (PURI et al.,1992). Ela proporciona proteção considerável de animais e de tecidos contra a infecção por L. donovani, uma atividade que foi relacionada aos glicosídeos de iridóides 14 e 15 presentes. Este grupo químico como, por exemplo, 17, nas folhas e sementes de Nyctanthes arbor-tristis L. (Oleaceae), e 16 de Swertia chirata Buch.-Ham. (Gentianaceae), foi identificado em vários outros extratos de planta antileishmânia (TANDON et al., 1991; RAY et al.,1996) embora a possível contribuição de outras substâncias que acompanham os iridóides, como o monoterpeno espintanol, 13, em Oxandra espintana (Spruce) Baill.(Annonaceae) (HOCQUEMILLER et al.,1991) sempre deva ser levada em conta. Especula-se que todas estas classes químicas ajam sobre o macrófago, estimulando-o a reagir contra o parasito.
Leishmania não possuem defesa contra radicais livres de oxigênio e por isso não é surpreendente que benzoquinonas e, particularmente, naftoquinonas sejam letais para eles. Entre as naftoquinonas e derivados, a atividade leishmanicida é encontrada em plumbagina, 18, de várias espécies de Plumbago da família Plumbaginaceae e em dímeros de plumbagina, 19, do talo ou da casca da raiz, ambos amarelos, de Pera benensis Rusby (Euphorbiaceae) cuja fração rica em quinonas era ativa contra promastigotas dos três tipos de Leishmania responsáveis pelas três formas comuns da doença (FOURNET et al.,1992). A observação desta atividade durante a investigação dos remédios tradicionais para a doença, dos índios bolivianos Chimane, veio a confirmar as observações anteriores feitas com plumbagina sintética. Outro remédio tradicional de uma planta boliviana preparado de Ampelocera edentula Kuhlm. (Ulmaceae), rendeu um precursor de naftoquinona, 4-hidroxi-1-tetralona, 20, cuja atividade também foi confirmada (FOURNET et al., 1994). Infelizmente as naftoquinonas isoladas deste grupo parecem ser tóxicas demais para uso oral e seriam limitadas à aplicação tópica, que poderia também não ser tolerada. Assim há lugar para uma reinvestigação dos extratos de planta ou frações originais que possam ser efetivos em doses toleráveis. Naftoquinonas menos tóxicas pertencem ao grupo de lapachol, 21, que é encontrado em Tecoma e Tabebuia spp (Bignoniaceae) (SCHMEDA-HIRSCHMANN e PAPASTERGIOU, 2003). A atividade leishmanicida destas em promastigotas pôde ser aumentada por modificações semi-sintéticas (TEIXEIRA et al., 2001).
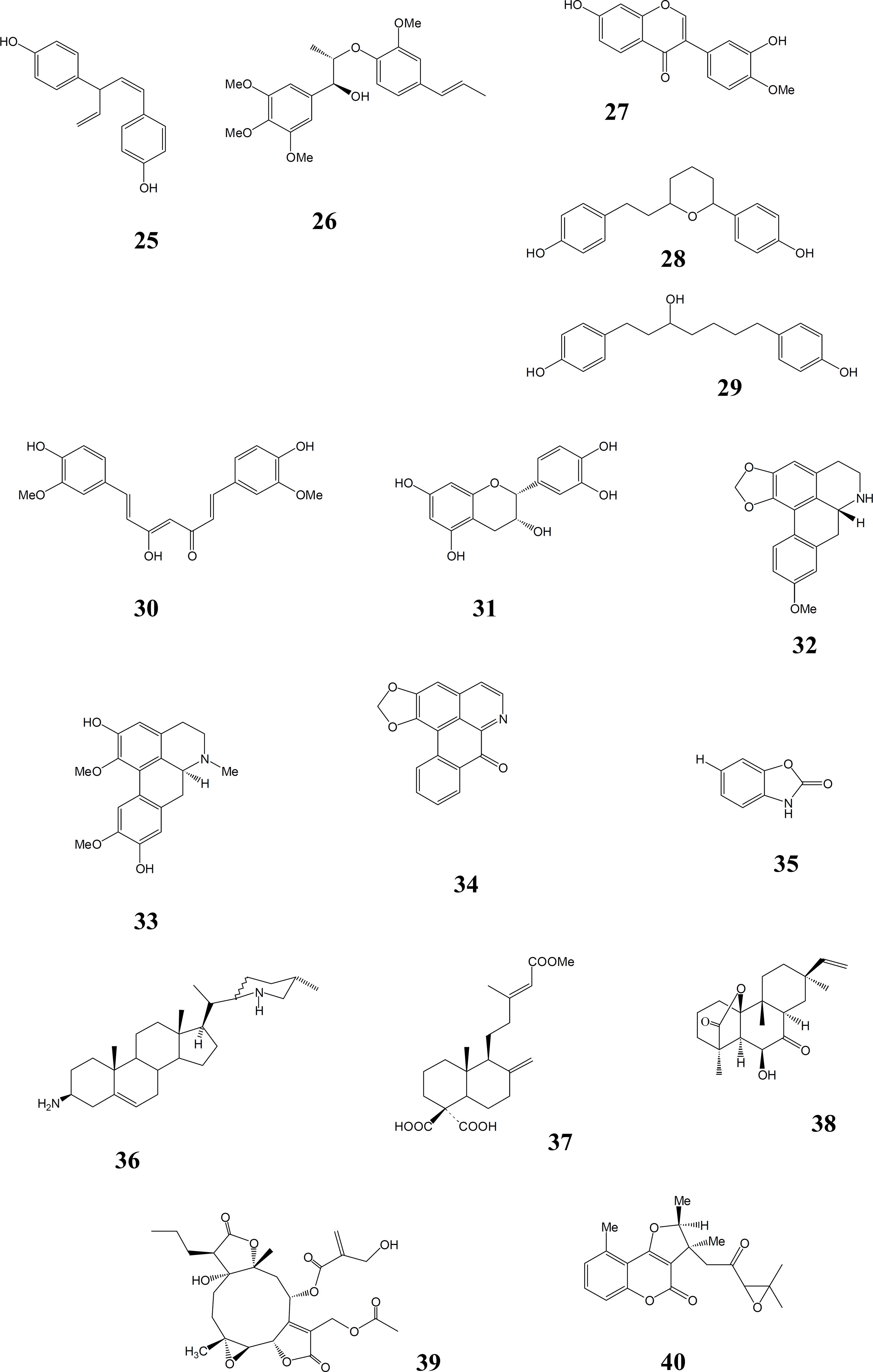
Muitos outros produtos naturais ativos foram identificados. Eles incluem alguns dos derivados insaturados lineares contendo carbono e enxofre , por exemplo, ajoeno, 22, característicos dos bulbos de cebola e alho, Allium cepa L. e A. sativum L. respectivamente (Liliaceae) (SALEHEEN et al., 2004; LEDEZMA et al., 2002), a α-pirona oleosa, argentilactona, 23, de Annona haematantha Miq. (Annonaceae) e também de Aristolochia argentinum Griseb. (Aristolochiaceae) (WAECHTER et al., 1997;), e outras αpironas e alguns tetraidrofuranos de cadeia longa, como senegaleno, 24, provenientes de várias espécies de Annonaceae tanto africanas como sulamericanas (SAHPAZ et al.,1994; CARMONA et al., 2003; FEVRIER et al.,1999). Lignanas como (+)- niasol, 25, de Asparagus africanus Lam. (Liliaceae) (OKETCH-RABAH et al., 1997b), e surinamensina, 26, achada nas folhas de Virola surinamensis (Rol.) Warb., o ucuúba, e V. pavonis (A.DC.) A.C. Smith (Myristicaceae), (BARATA et al., 2000) são ativas, como o são muitos outros tipos fenólicos, exemplificados pelo diarilheptanol fenólico, 29, o seu derivado cíclico, 28, e 3 ‘,7-diidroxy-4 ‘-metoxiisoflavona, 27, de Centrolobium sclerophylum Lima (Fabaceae) (ARAUJO et al., 1998). Outros produtos naturais fenólicos ativos incluem o corante e tempero alimentício curcumina, 30, e seus desmetoxie bisdesmetoxi derivados dos rizomas de Curcuma longa L. (Zingiberaceae), açafrão (RASMUSSEN, 2000), e vários flavanas, taninos e catequinas, exemplificados pela 3-epicatequina, 31, além das chalconas já mencionadas (SAUVAIN, 1994; MENDONÇA FILHO, 2004).
Além dos alcalóides citados acima, outros grupos de alcalóides foram demonstrados ativos em leishmaniose experimental. Entre estes são bisbenzilisoquinolinas de Menispermaceae e de outras famílias, aporfinas, como boldina, 33, uma noraporfina, xilopina, 32, e uma oxoaporfina, liriodenina, 34, classes freqüentemente encontradas na família Annonaceae, cujas espécies em alguma forma ou outra são tradicionalmente usadas para o tratamento da doença (HUNG et al., 2003; MONTENEGRO et al., 2003; QUEIROZ et al., 1996; WAECHTER et al.,1999). Entre alcalóides esteroidais, saraquina, 36, de Saracha punctata Ruiz et Pav. (Solanaceae) foi ativo in vitro (MORETTI, 1998) e holamina foi a mais ativa contra promastigotas entre aminoesteróides e aminoglicoesteróides de Holarrhena curtsii King et Gamble (Apocynaceae) (KAM et al.,1998). Entre heterocíclicos contendo nitrogênio também se encontra a leishmanicida 2-benzoxazolinona, 35, reportada nas folhas de Acanthus illicifolius L. (Acanthaceae) (KAPIL et al., 1994).
Além dos triterpenóides já citados outros terpenóides mostram atividade. Um ácido dicarboxílico monoéster do grupo labdânico dos diterpenos bicíclicos, 37, isolado de Polyalthia macropoda Rei. (Annonaceae), foi ativo em L. donovani (RICHOMME et al., 1991) e 6b-hidroxirosenonolactona, 38, dos diterpenos tricíclicos isolado de Holarrhena floribunda (G. Don.) T. Durand et Schinz. (Apocynaceae) exibe uma atividade fraca contra proe amastigotas de L. donovani in vitro (LOUKACI et al., 2000). Atividade em amastigotas foi mostrada por pelo menos uma lactona sesquiterpênica (TADESSE ET AL., 1993), e em promastigotas por uma lactona sesterterpênica (C25), brachicalixolídeo, 39 (OKETCH-RABAH et al.,1998), ambas isoladas de espécies de Vernonia, V. amygdalina Del.e V. brachycalyx Hoffm. (Asteraceae) Na espécie V. brachycalyx há também duas cumarinas ativas, isômeros do epôxido de cicloisobraquicumarinona, 40, que evidentemente reforçam a atividade da sesterterpenóide (OKETCH-RABAH et al., 1997a). Algumas saponinas esteroidais também mostraram atividade in vitro, mas é improvável que estas teriam uso prático in vivo (OKUNJI et al., 1996; OKETCH-RABAH et al., 1997b).
Não é de surpreender que os princípios ativos de várias plantas não foram identificados. Kalanchoe pinnata foi mencionado como uma planta muito promissora para uso rural ainda que um número grande de componentes do extrato tenha sido identificado, na hora de escrever este artigo, nenhum deles foi divulgado como responsável pela atividade, embora o mecanismo de ação fosse elucidado. Outras plantas nesta classe são Cola attiensis Aubrev. et Pellegr. (Sterculiaceae), Desmodium gangeticum Blanco (Fabaceae) e Dorstenia multiradiata Engl. (Moraceae) (IWU et al., 1992).
Um outro caso de uma planta tradicionalmente usada para tratar lesões de leishmania mas cujo componente ativo não foi identificado é Anacardium occidentale L. (Anacardiaceae), o cajueiro, usado extensamente por trabalhadores de cacau no sul da Bahia, Brasil (FRANCA et al., 1993; FRANCA et al., 1996). O princípio ativo poderia bem ser o vesicante ácido anacárdico, ou anacardol, o fenol derivado dele por descarboxilação.
Para desenvolver qualquer destes produtos como um medicamento serão necessários ensaios pré-clínicos inclusive de toxicidade, de preferência comparando os melhores candidatos, sejam estes extratos ou substâncias isoladas, lado a lado em um único modelo, seguido por testes clínicos preliminares, para selecionar uma ou duas drogas neste amplo espectro de remédios naturais, que mereçam ser levadas a cabo. Ênfase deve ser dada aos produtos ativos por via oral, embora aplicações interlesionais ou tópicas não devem ser excluídas. Nesta investigação será desejável estender o estudo a modelos in vivo de leishmaniose visceral. Deve se levar em conta também que, sendo as leishmanioses prevalentes entre populações de baixa renda e muitas vezes isoladas dos serviços de saúde, é necessário desenvolver não somente um medicamento estável e distribuível pelo serviço público de saúde, ou pela rede comercial, mas também um remédio de aplicação local preparado pela própria comunidade. As drogas candidatas aos dois tipos de uso poderiam ser diferentes. Vários dos produtos naturais descritos possuem, nos modelos experimentais em que foram examinados, atividades equivalentes às, ou superiores das, drogas antimoniais e em muitos casos a toxicidade das drogas naturais é mais baixa ou praticamente inexistente. Ao mesmo tempo existe amplo âmbito para a exploração de análogos sintéticos como tem sido feito com a licochalcona e a surinamensina. Indubitavelmente o presente reconhecimento de atividade leishmanicida em tal grande variedade de produtos naturais oferece um prospecto favorável para o desenvolvimento de novas drogas para este grupo de doenças.
Referências
ABREU, P.M.; MARTINS, E.S.; KAYSER, O., BINDSEIL, K.U.; SIEMS, K.; SEEMANN, A.; FREVERT, J. Antimicrobial, antitumor and antileishmania screening of medicinal plants from Guinea-Bissau. Phytomedicine, v.6, n.3, p.187-195, 1999.
ARAUJO, C.A.; ALEGRIO, L.V.; GOMES, D.C.; LIMA, M.E.; GOMES-CARDOSO, L; LEON, L.L. Studies on the effectiveness of diarylheptanoid derivatives against Leishmania amazonens. Memórias do Instituto Oswaldo Cruz, v 94, n.6, p.791-794, 1999.
BARATA, L.E.; SANTOS, L.S.; FERRI, P.H.; PHILLIPSON, J.D.; PAINE, A; CROFT, S.L. Anti-leishmanial activity of neolignans from Virola species and synthetic analogues. Phytochemistry, v.55, n.6, p.589-595, 2000.
CARMONA, D.; SAEZ, J. GRANADOS, H.; PEREZ, E.; BLAIR, S., ÂNGULO, A., FIGADERE, B. Antiprotozoal 6-substituted-5,6-dihydro-alpha-pyrones from Raimondia cf. monoica. Natural Product Research, v.17, n.4, p.275-280, 2003.
CHRISTENSEN, S.B.; MING, C.; ANDERSEN, L.; HJORNE, U.; OLSEN, C.E.; CORNETT, C.; THEANDER, T.G.; KHARAZMI, A. An antileishmanial chalcone from Chinese licorice roots. Planta Medica, v.60, n.2, p.121-123, 1994.
DA SILVA, S.A.; COSTA, S.S.; MENDONÇA, S.C.; SILVA, E.M.; MORAES, V.L.; ROSSI-BERGMANN, B. Therapeutic effect of oral Kalanchoe pinnata leaf extract in murine leishmaniasis. Acta Tropica, v.60, n.3, p.201-210, 1995.
DA-SILVA, S.A.; COSTA, S.S.; ROSSI-BERGMANN, B. The anti-leishmanial effect of Kalanchoe is mediated by nitric oxide intermediates. Parasitology. v. 118, n.6, p.575-282, 1999.
DELMAS, F; DI GIORGIO, C.; ELIAS, R.; GASQUET, M.; AZAS, N.; MSHVILDADZE, V.; DEKANOSIDZE, G.; KEMERTELIDZE, E.; TIMON-DAVID, P. Antileishmanial activity of three saponins isolated from ivy, alpha-hederin, beta-hederin and hederacolchiside A1, as compared to their action on mammalian cells cultured in vitro Planta Medica, v.66, n.4, p.343-347, 2000.
DELORENZI; J.C.; ATTIAS, M.; GATTASS, C.R.; ANDRADE, M.; REZENDE, C.; PINTO, A. C.; HENRIQUES, A.T.; BOU-HABIB; D.C.; SARAIVA, E.M.;. Antileishmanial activity of na indole alkaloid from Peschiera australis. Antimicrobial Agents Chemotherapy, v.45, n.5, p.1349-1354, 2001.
DELORENZI, J.C.; FREIRE-DE-LIMA, L.; GATTASS, C.R.; DE ANDRADE-COSTA, D.; HE, L.; KUEHNE, M.E.; SARAIVA, E.M.. In vitro activities of iboga alkaloid congeners coronaridine and 18-methoxycoronaridine against Leishmania amazonensis. Antimicrobial Agents Chemotherapy, v.46, n.7, p.2111-2115, 2002.
FEVRIER, A.; FERREIRA, M.E.; FOURNET, A.; YALUFF, G.; INCHAUSTI, A.; ROJAS-DE-ARIAS, A.; HOCQUEMILLER, R.; WAECHTER, A.I. Acetogenins and other compounds from Rollinia emarginata and their antiprotozoal activities..Planta Med. v.65, n.1, p.47-9, 1999.
FOURNET, A.; ANGELO, A.; MUNOZ, V.; ROBLOT, F.; HOCQUEMILLER, R.; CAVE, A. Biological and chemical studies of Pera benensis, a Bolivian plant used in folk medicine as a treatment of cutaneous leishmaniasis. J Ethnopharmacology, v. 37, n. 2, p.159-164, 1992.
FOURNET, A.; BARRIOS, A.A. MUÑOZ, V.; HOCQUEMILLER, R.; ROBLOT, F.; CAVE, A. Antileishmanial activity of a tetralone isolated from Ampelocera edentula, a Bolivian plant used as a treatment for cutaneous leishmaniasis. Planta Medica, v.60, n.1, p.8-12, 1994.
FOURNET, A.; FERREIRA, M.E.; ROJAS-DE-ARIAS, A.; TORRES-DE-ORTIZ, S.; FUENTES, S.; NAKAYAMA, H.; SCHININI, A.; HOCQUEMILLER, R. In vivo efficacy of oral and intralesional administration of 2-substituted quinolines in experimental treatment of new world cutaneous leishmaniasis caused by Leishmania amazonensis. Antimicrobial Agents Chemotherapy, v.40, n.11, p.2447-2451, 1996.
FRANCA, F.; CUBA, C.A.; MOREIRA, E.A., MIGUEL, O.; ALMEIDA, M.; DAS VIRGENS, M.D.E.L.; MARSDEN, P.D. An evaluation of the effect of a bark extract from the cashew (Anacardium occidentale L.) on infection by Leishmania (Viannia) braziliensis. Revista da Sociedade Brasileira Medicina Tropical, v.26, n.3, p.151-155, 1993.
FRANCA, F.; LAGO, E.L.; MARSDEN, P.D. Plants used in the treatment of leishmanial ulcers due to Leishmania (Viannia) braziliensis in an endemic area of Bahia, Brazil. Revista da Sociedade Brasileira de Medicina Tropical, v.29, n.3, p.229-232, 1996.
HOCQUEMILLER, R.; CORTES, D.; ARANGO, G.J.; MYINT, S.H.; CAVE, A.; ANGELO, A.; MUNOZ, V.; FOURNET, A. Isolation and synthesis of espintanol, a new antiparasitic monoterpene. Journal of Natural Products, v.54, n.2, p.445-452, 1991.
HUNG, J.; CASTILHO, J.; JIMENEZ, G.; HASEGAWA, M.; RODRIGUEZ, M. Spectroscopic study of antileishmanial drug incubated in the promastigotes of Leishmania mexicana. Spectroquimica Acta pt. A, v.59, p.3177-3183, 2003.
IWU, M.M.; KLAYMAN, D.L.; JACKSON, J.E.; TALLY, J.D.; ANDERSEN, S.L. Alkaloids of Picralima nitida used for treatment of protozoal diseases. United States Patent 5,290,553, March 1, 1994.
IWU, M.M.; JACKSON, J.E.; TALLY, J.D.; KLAYMAN, D.L. Evaluation of plant extracts for antileishmanial activity using a mechanism-based radiorespirometric microtechnique (RAM). Planta Medica, v.58, n.5, p.436-441, 1992.
KAM, T.S.; SIM, K.M.; KOYANO, T.; TOYOSHIMA, M.; HAYASHI, M.; KOMIYAMA, K Cytotoxic and leishmanicidal aminoglycosteroids and aminosteroids from Holarrhena curtisii. Journal of Natural Products, v.61, n.11, p.1332-1326, 1998.
KAPIL, A.; SHARMA, S.; WAHIDULLA, S. Leishmanicidal activity of 2-benzoxazolinone from Acanthus illicifolius in vitro. Planta Medica, v.60, n.2, p.187-188, 1994.
KOLODZIEJ, H.; KAYSER, O.; KIDERLEN, A.F.; ITO, H.; HATANO, T.; YOSHIDA, T.; FOO, L.Y. Antileishmanial activity of hydrolyzable tannins and their modulatory effects on nitric oxide and tumour necrosis factor-alpha release in macrophages in vitro. Planta Medica, v.67, n.9, p.825-832, 2001.
LAVAUD, C.; MASSIOT, G.; VASQUEZ, C.; MORETTI, C.; SAUVAIN, M.; BALDERRAMA, L. 4-Quinolinone alkaloids from Dictyoloma peruviana. Phytochemistry, v.40, n.1, p.317-320, 1995.
LEDEZMA, E.; JORQUERA, A.; BENDEZU, H.; VIVAS, J.; PEREZ, G. Antiproliferative and leishmanicidal effect of ajoene on various Leishmania species: ultrastructural study. Parasitology Research, v.88, n.8, p.748-753, 2002.
LOUKACI, A.; KAYSER, O.; BINDSEIL, K.; SIEMS, K.; FREVERT, J.; ABREU, P.M. New trichothecenes isolated from Holarrhena floribunda. Journal of Natural Products, v.63, n.1, p.52-56, 2000.
LUETTIG, B.; STEINMULLER, C.; GIFFORD, G.E.; WAGNER, H.; LOHMANN-MATTHES, M.L. Macrophage activation by the polysaccharide arabinogalactan isolated from plant cell cultures of Echinacea purpurea. Journal of the National Cancer Institute, v.81, n.9, p.669-675, 1989.
LUQUE-ORTEGA, J.R.; MARTINEZ, S.; SAUGAR, J.M.; IZQUIERDO, L.R.; ABAD, T.; LUIS, J.G.; PINERO, J.; VALLADARES, B.; RIVAS, L. Fungus-elicited metabolites from plants as an enriched source for new leishmanicidal agents: antifungal phenyl-phenalenone phytoalexins from the banana plant (Musa acuminata) target mitochondria of Leishmania donovani promastigotes. Antimicrobial Agents Chemotherapy, v.48, n.5, p.1534-1540, 2004.
MAES, L.; BERGHE D.V.; GERMONPREZ, N.; QUIRIJNEN, L.; COS, P.; DE KIMPE, N.; VAN PUYVELDE, L. In vitro and in vivo activities of a triterpenoid saponin extract (PX-6518) from the plant Maesa balansae against visceral leishmania species. Antimicrob Agents Chemotherapy, v.48, n.1, p.130-136, 2004.
MAJESTER-SAVORNIN, B.; ELIAS, R,; DIAZ-LANZA, A.M.; BALANSARD, G.; GASQUET, M.; DELMAS, F. Saponins of the ivy plant, Hedera helix, and their leishmanicidic activity. Planta Medica, v.57, n.3, p.260-262, 1991.
MENDONCA-FILHO, R.R.; RODRIGUES, I.A.; ALVIANO, D.S.; SANTOS, A.L., SOARES, R.M.; ALVIANO, C.S.; LOPES, A.H.; ROSA, M.D.O.S. Leishmanicidal activity of polyphenolic-rich extract from husk fiber of Cocos nucifera Linn. (Palmae). Research in Microbiology, v.155, n.3, p, 136-143, 2004.
MONTENEGRO, H.; GUTIERREZ, M.; ROMERO, L.I.; ORTEGA-BARRIA, E.; CAPSON, T.L.; RIOS, L.C. Aporphine alkaloids from Guatteria spp. with leishmanicidal activity. Planta Medica, v.69, n.7, p.677-679, 2003.
MORETTI, C.; SAUVAIN, M.; LAVAUD, C.; MASSIOT, G.; BRAVO, J.; MUNOZ, V. A novel antiprotozoal aminosteroid from Saracha punctata. Journal of Natural Products, v.61, n.11, p.1390-1393, 1998.
MUNOZ, V.; MORETTI, C.; SAUVAIN, M.; CARON, C.; PORZEL, A.; MASSIOT, G.; RICHARD, B.; LE MEN-OLIVIER, L. Isolation of bis-indole alkaloids with antileishmanial and antibacterial activities from Peschiera van heurkii (syn. Tabernaemontana van heurkii). Planta Medica, v.60, n.5, p.455-459, 1994.
OKETCH-RABAH, H.A.; LEMMICH, E.; DOSSAJI, S.F.; THEANDER, T.G.; OLSEN, C.E.; CORNETT, C.; KHARAZMI, A.; CHRISTENSEN, S.B. Two new antiprotozoal 5-methylcoumarins from Vernonia brachycalyx. Journal of Natural Products , v.60, n 5, p. 458-461, 1997a.
OKETCH-RABAH, H.A.; DOSSAJI, S.F.; CHRISTENSEN, S.B.; FRYDENVANG, K.; LEMMICH, E.; CORNETT, C.; OLSEN, C.E.; CHEN, M.; KHARAZMI, A.; THEANDER, T. Antiprotozoal compounds from Asparagus africanus. Journal of Natural Products, v.60, n.10, p.1017-1022, 1997b.
OKETCH-RABAH, H.A.; CHRISTENSEN, S.B.; FRYDENVANG, K.; DOSSAJI, S.F.; THEANDER, T.G.; CORNETT, C.; WATKINS, W.M.; KHARAZMI, A.; LEMMICH, E. Antiprotozoal properties of 16,17-dihydrobrachycalyxolide from Vernonia brachycalyx. Planta Medica, v.64, n.6, p.559-562, 1998.
OKUNJI, C.O.; IWU, M.M.; JACKSON, J.E.; TALLY, J.D. Biological activity of saponins from two Dracaena species. Advanced Experimental Medical Biolology, v.404, p.415-428, 1996.
PURI, A.; SAXENA, R.P.; SUMATI, GURU P.Y.; KULSHRESHTHA, D.K.;, SAXENA, K.C.; DHAWAN, B.N. Immunostimulant activity of Picroliv, the iridoid glycoside fraction of Picrorrhiza kurroa, and its protective action against Leishmania donovani infection in hamsters. Planta Medica, v.58, n.6, p528-532, 1992.
QUEIROZ, E.F.; ROBLOT, F.; CAVE, A.; PAULO, M.Q.; FOURNET, A. Pessoine and spinosine, two catecholic berbines from Annona spinescens. Journal of Natural Products, v.59, n.4, p.438-440, 1996.
RASMUSSEN, H.B.; CHRISTENSEN, S.B.; KVIST, L.P.; KARAZMI, A. A simple and efficient separation of the curcumins, the antiprotozoal constituents of Curcuma longa. Planta Medica, v.66, n.4, p.396-398, 2000.
RAY, S.; MAJUMDER, H.K.; CHAKRAVARTY, A.K.; MUKHOPADHYAY, S.; GIL, R.R.; CORDELL, G.A. Amarogentin, a naturally occurring secoiridoid glycoside and a newly recognized inhibitor of topoisomerase I from Leishmania donovani. Jornal of Natural Products, v.59, n.1, p.27-29, 1996.
RICHOMME, P.; GODET, M.C.; FOUSSARD, F.; TOUPET, L.; SEVENET, T.; BRUNETON, J. A novel leishmanicidal labdane from Polyalthia macropoda. Planta Medica, v.57, n.6, p.552-554, 1991.
SAHPAZ, S.; BORIES, C.; LOISEAU, P.M.; CORTES, D.; HOCQUEMILLER, R.; LAURENS, A.; CAVE, A Cytotoxic and antiparasitic activity from Annona senegalensis seeds. Planta Medica, v.60, n.6, p.538-540, 1994.
SALEHEEN, D.; ALI, S.A.; YASINZAI, M.M. Antileishmanial activity of aqueous onion extract in vitro. Fitoterapia, v.75, n., p.9-13, 2004.
SAUVAIN, M.; DEDET, J.P.; KUNESCH, N.; POISSON, J. Isolation of flavins from the Amazonian shrub Faramea guianesis. Journal of Natural Products, v.57, n.3, p.403-406, 1994.
SCHMEDA-HIRSCHMANN, G.; PAPASTERGIOU, F. Naphthoquinone derivatives and lignans from the Paraguayan crude drug tayã-pytã (Tabebuia heptaphylla Bignoniaceae). Zeitschrift Naturforschung [C], v.58, n.7-8, p.495-501, 2003.
STEINMULLER, C.; ROESLER, J.; GROTTRUP, E.; FRANKE, G.; WAGNER, H.; LOHMANN-MATTHES, M.L. Polysaccharides isolated from plant cell cultures of Echinacea purpurea enhance the resistance of immunosuppressed mice against systemic infections with Candida albicans and Listeria monocytogenes. International Journal of Immunopharmacology, v.15, n.5, p.605-614, 1993.
TADESSE, A.; GEBRE-HIWOT, A.; ASRES, K.; DJOTE, M.; FROMMEL, D. The in vitro activity of Vernonia amygdalina on Leishmania aethiopica. Ethiopian Medical Journal, v.31, n.3, p.183-189, 1993.
TANDON, J.S.; SRIVASTAVA, V.; GURU, P.Y. Iridoids: a new class of leishmanicidal agents from Nyctanthes arbortristis. Journal of Natural Products, v.54, n.4, p.1102-1104, 1991.
TEIXEIRA, M.J.; DE ALMEIDA, Y.M.; VIANA, J.R.; HOLANDA-FILHO, J.G,; RODRIGUES, T.P.; PRATA JR, J.R.; COELHO, I.C.; RAO, V.S.; POMPEU, M.M. In vitro and in vivo Leishmanicidal activity of 2-hydroxy-3-(3-methyl-2-butenyl)- 1,4-naphthoquinone (lapachol). Phytotherapy Research, v.15, n.1, p.44-48, 2001.
TORRES-SANTOS, E.C.; MOREIRA, D.L.; KAPLAN, M.A.; MEIRELLES, M.N.; ROSSI-BERGMANN, B. Selective effect of 2',6'-dihydroxy-4'-methoxychalcone isolated from Piper aduncum on Leishmania amazonensis. Antimicrobial Agents Chemotherapy, v.43, n.5, p.1234-1241, 1999a.
TORRES-SANTOS, E.C.; RODRIGUES JR, J.M.; MOREIRA, D.L.; KAPLAN, M.A.; ROSSI-BERGMANN, B. Improvement of in vitro and in vivo antileishmanial activities of 2', 6'-dihydroxy-4'-methoxychalcone by entrapment in poly(D,L-lactide) nanoparticles. Antimicrobial Agents Chemotherapy, v.43, n.7, p.1776-1778, 1999b.
TORRES-SANTOS, E.C.; LOPES, D.; OLIVEIRA, R.R. CARAUTA, J.P.; FAL-CÂO, C.A.; KAPLAN, M.A.; ROSSI-BERGMANN, B. Antileishmanial activity of isolated triterpenoids from Pourouma guianensis. Phytomedicine, v.11, n.2-3, p.114-120, 2004.
WAECHTER, A.I.; CAVE, A.; HOCQUEMILLER, R.; BORIES, C.; MUNOZ, V.; FOURNET, A. Antiprotozoal activity of aporphine alkaloids isolated from Unonopsis buchtienii (Annonaceae). Phytotherapy Research, v.13, n.2, p.175-177, 1999.
WAECHTER, A.I.; FERREIRA, M.E.; FOURNET, A.; ROJAS-DE-ARIAS, A.; NAKAYAMA, H.; TORRES, S.; HOCQUEMILLER, R.; CAVE, A. Experimental treatment of cutaneous leishmaniasis with argentilactone isolated from Annona haematantha. Planta Medica, v.63, n.5, p.433-435, 1997.