Artigo Original
Obtenção de Nanoformulações do Tipo Microemulsão Objetivando a Biodisponibilização de Anacardium occidentale e sua Eficiência como Agente Antioxidante
Nanoformulations Type Microemulsion System Aiming the Bioavailability of Anacardium occidentale and its Antioxidant Effectiveness
Resumo
Dois diferentes tipos de sistemas microemulsionados (SME) foram obtidos utilizando-se uma mistura dos tensoativos Tween 80 e Span 20 (3:1), miristato de isopropila (IPM) como fase orgânica e água bidestilada (sistema SME-4) e com adição de etanol como cotensoativo obteve-se o outro sistema (SME-1). Estes sistemas foram obtidos objetivando-se otimizar a avaliação do potencial antioxidante de Anacardium occidentale. A ação antioxidante do extrato metanólico (MeOH) obtido das cascas do caule desta planta, bem como do óleo fixo (FO) e de uma fração rica em taninos (FT) provenientes deste extrato, foi avaliada utilizando-se como fonte de radical livre o 2,2-difenil-picril-hidrazila (DPPH). Em função da difícil solubilização de FT, a atividade antioxidante desta fração só foi avaliada após solubilização nos sistemas SME-1 e SME-4. Os resultados obtidos mostraram uma forte atividade antioxidante para o extrato MeOH (CE50 = 42,47 ± 0,14 μg/mL) e para a fração FT solubilizada nos dois sistemas microemulsionados (CE50 = 39,27 ± 1,07 μg/mL e CE50 = 42,20 ± 5,20 μg/mL para FT-SME-1 e FT-SME-4, respectivamente). O óleo fixo não apresentou atividade até a dose de 710 μg/mL. Estes resultados indicam que a atividade antioxidante do extrato metanólico de Anacardium occidentale está correlacionada com a presença de taninos. Em relação aos sistemas encapsuladores SME-1 (contendo o cotensoativo etanol) e SME-4 (ausência de cotensoativo), não foi observada interferência significativa destes sistemas, nos resultados observados para a atividade antioxidante de FT-SME-1 e FT-SME-4.
- Unitermos
- Microemulsão.
- Anacardium occidentale.
- Taninos.
- Atividade Antioxidante.
Abstract
Two different microemulsions systems (SME) were performed using a mixture of Tween 80 and Span 20 (3:1) as surfactant, isopropyl myristate as oil phase, and bidistilled water consisting on two different compositions (SME-1 AND SME-4). In one of these systems ethanol was included as cosurfactant (SME-1) and for SME-4 ethanol-free, which were used as solubilizing agent on evaluation of the antioxidant potential of Anacardium occidentale. The antioxidant activity of a methanolic extract (MeOH, obtained from stem bark of this plant), as well as its two fractions FO (fixed oil) and FT (a polar fraction rich in tannin) were evaluated in DPPH-method. Due to the poor solubility of the tannin fraction, it was evaluated after its solubilization in SME-1 and SME-4 systems. The obtained results showed high antioxidant activity for MeOH extract (CE50 = 42,47 0,14 g/mL) and FT (CE50 = 39,27 1,07 g/mL for FT-SME-1, and CE50 = 42,20 5,20 g/mL for FT-SME-4), but no activity for the FO fraction at 710 g/mL was confirmed. These results indicated that the antioxidant activity of the MeOH extract corresponded to the presence of tannins constituents. The tested microemulsions systems do not caused any significant interference in the antioxidant activity results evidenced on the FT-SME-1 and FT-SME-4 fractions.
- Key Words
- Microemulsion.
- Anacardium occidentale.
- Tannins.
- Antioxidant Activity.
Introdução
A espécie Anacardium occidentale (Anacardiaceae) popularmente conhecida como caju, é nativa das regiões norte e nordeste do Brasil. A Amazônia parece ter sido o berço de diferentes espécies do gênero Anacardium que se irradiou para o resto do mundo. E o cajueiro, seu representante mais conhecido, é uma árvore rústica; espontânea, nativa da zona arenosa litorânea de campos e dunas, que vai do nordeste do País até o baixo Amazonas (SILVA; TASSARA, 1996). Os indígenas de fala tupi, habitantes autóctones do nordeste do Brasil, já conheciam muito bem o caju e faziam dele um de seus mais completos e importantes alimentos (SILVA; TASSARA, 1996).
Muitos são os usos etnofamacológicos associados ao caju, dentre eles encontram-se: adstringente, antidiabético, antidiarréico, anti-hemorrágico, antiinflamatório, antireumático, antitérmico, antiulcerogênico, diurético e vermífugo, onde são utilizados cascas do caule, casca da castanha, ramos, pendúculos, raiz, folhas, frutos, semente e óleo (GONÇALVES et al., 2005). Metabólitos especiais (ácidos anacárdicos, cardanóis, cardóis e fenóis alquílicos) extraídos do líquido da castanha de caju de Anacardium occidentale apresentaram atividade antioxidante (TREVISAN et al., 2006). Diversos metabólitos presentes nas plantas têm apresentado atividade antioxidante, sendo cada vez mais reconhecidos como importantes agentes na captura de radicais livres (cuja formação ocorre espontaneamente em diferentes etapas do metabolismo, onde processos oxidativos estão envolvidos) que estão diretamente relacionados ao processo de envelhecimento e às doenças degenerativas, dentre elas o câncer. Um dos objetivos deste trabalho foi avaliar a atividade antioxidante do extrato metanólico (MeOH), do óleo fixo (FO; fração apolar) e de uma fração polar rica em taninos (FT) obtidos das cascas de Anacardium occidentale. Devido à grande insolubilidade de FT, dois sistemas microemulsionados (SME1 e SME-4) foram obtidos e testados no estudo de solubilidade desta fração, para ampliar sua biodisponibilidade.
Sistemas Microemulsionados: considerações gerais e aspectos relevantes
Nanoformulações do tipo microemulsões são sistemas coloidais termodinamicamente estáveis e opticamente isotrópicos contendo água, óleo, tensoativo e, freqüentemente, um cotensoativo (FLORENCE, 2005). Estas formulações vêm sendo utilizadas como sistemas de liberação de fármacos devido a inúmeras vantagens, podendo-se destacar: o aumento da capacidade de solubilização de fármacos e a diminuição de efeitos adversos (FORMARIZ et al., 2005; OLIVEIRA et al., 2004; LAWRENCE; REES, 2000). O aumento da biodisponibilidade de fármacos está correlacionado com a solubilização de substâncias pouco solúveis, bem como com a diminuição da dose administrada, garantindo além de vantagens econômicas, a diminuição de efeitos adversos (KAWAKAMI et al., 2002). Como exemplos, a veiculação da camptotecina (com comprovado efeito tóxico) e do metotrexato que vêm sendo encapsulados em sistemas microemulsionados e são administrados para o tratamento de alguns tipos de câncer (CORTESI et al., 1997; ALVAREZ-FIGUEROA; BLANCO-MÉNDEZ, 2001).
Adicionalmente, as microemulsões podem atuar ainda como um sistema reservatório para o fármaco, garantindo a sua liberação lenta e a prolongação do seu efeito farmacológico (DALMORA et al., 2001), bem como atuar como protetores contra a hidrólise enzimática (LYONS et al., 2000). Recentemente foi comprovado que microemulsões ricas em colesterol tendem a se concentrar em certos tumores sólidos, garantindo, assim, a liberação de agentes antineoplásticos no seu sítio de ação farmacológica (AZEVEDO et al., 2005). Quando um fármaco é administrado a um indivíduo, ele é absorvido e distribuído por todo o seu corpo. Porém, apenas uma pequena parte da dose administrada alcança o seu sítio de ação farmacológica. A fração restante pode agir em outras partes do organismo e provocar efeitos adversos (LEE et al., 2003). A utilização dos sistemas de liberação de fármacos visa exatamente diminuir a incidência desses efeitos adversos e aumentar o índice terapêutico dos fármacos, através da sua liberação controlada em sítios específicos e/ou a taxas constantes. Nesse aspecto, as microemulsões apresentam propriedades e vantagens peculiares, como por exemplo, podemos destacar a existência de microdomínios de diferentes polaridades no seio de uma solução unifásica que permite a solubilização de fármacos hidrossolúveis e lipossolúveis, separadamente ou ao mesmo tempo (LEE et al., 2003). Em geral, fármacos lipofílicos tendem a se localizar no interior de microemulsões do tipo O/A (ou seja, na região hidrofóbica das moléculas do tensoativo que formam a camada interfacial) ou na fase contínua oleosa no caso de microemulsões do tipo A/O (rica em óleo).
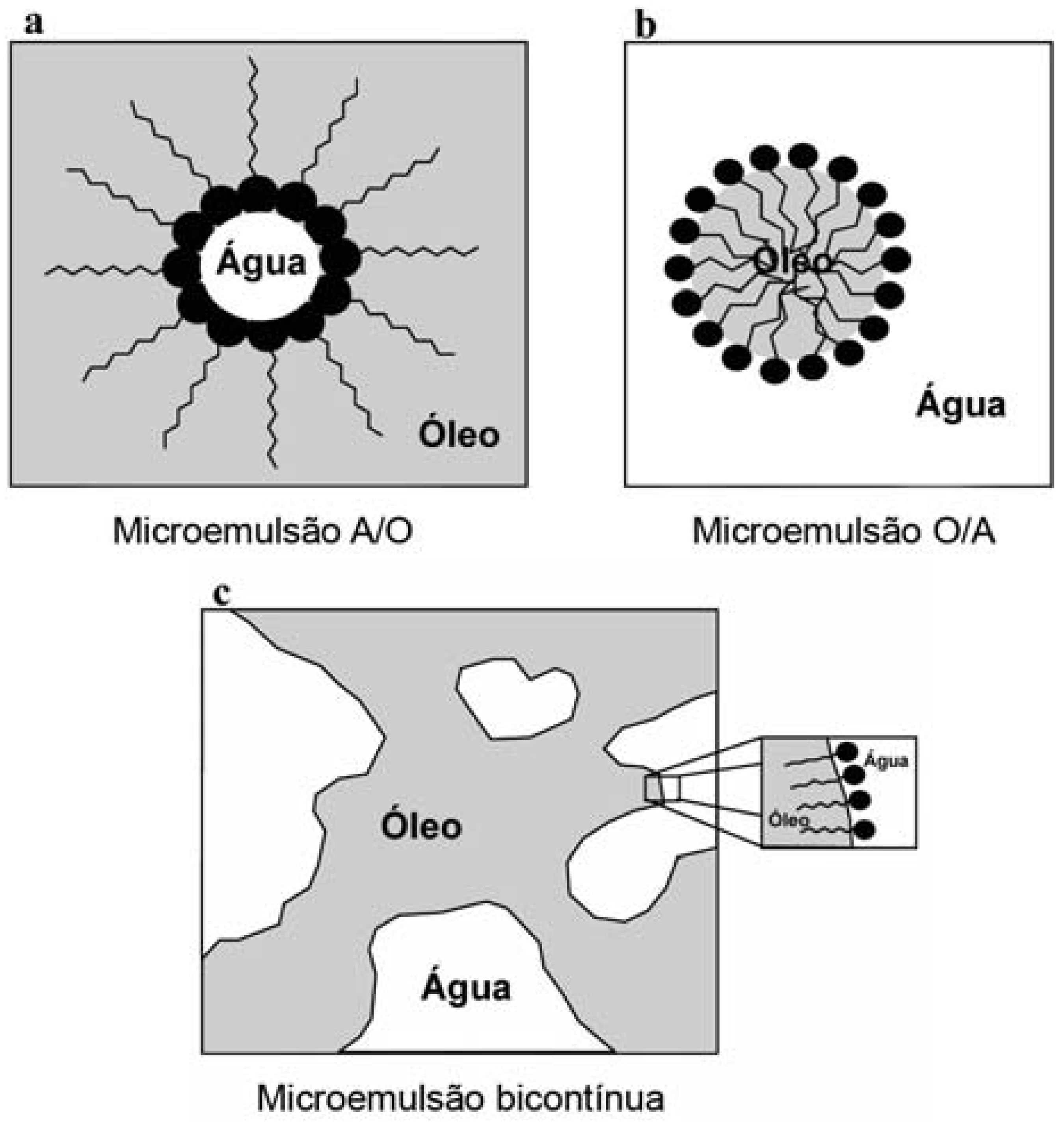
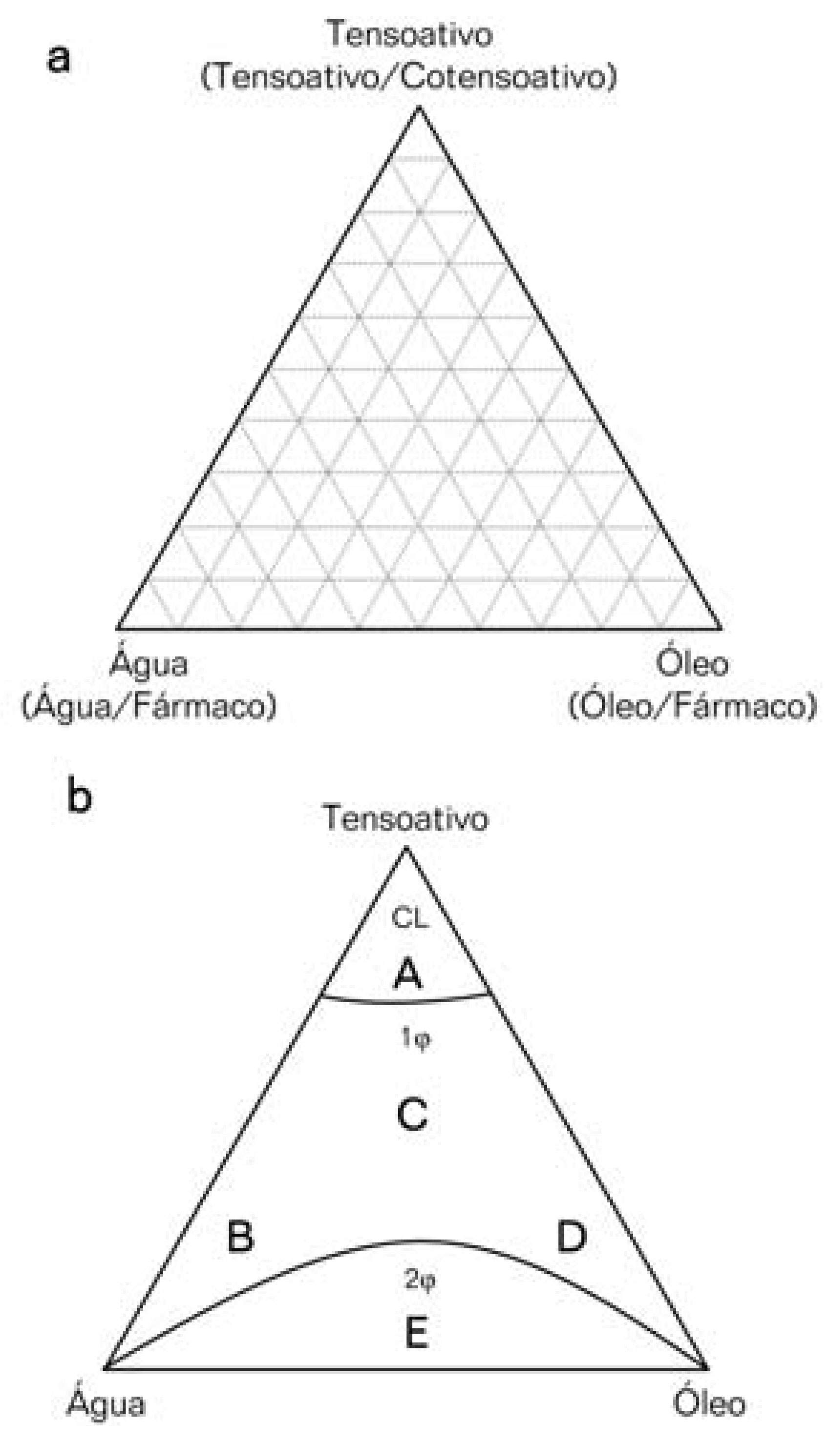
A mistura entre água, óleo e tensoativo(s) é capaz de gerar uma vasta variedade de estruturas e fases (FIGURA 1). Além das microemulsões, investigações estruturais podem revelar a existência de emulsões, fases cúbicas ou hexagonais cristalinas e estruturas lamelares, dependendo da razão e natureza dos componentes. A relação entre a formação de diversas fases e estrutura de uma mistura e sua composição pode ser visualizada com o auxílio de um diagrama de fases, que são sistemas ternários onde cada vértice do diagrama representa 100% de um determinado componente. No entanto, as microemulsões podem eventualmente conter componentes adicionais como cotensoativos, aditivos e fármacos, que podem influenciar na formação das microestruturas. Neste caso, quando quatro ou mais componentes são estudados, diagramas de fase pseudoternários são utilizados, onde um dos vértices do diagrama estará representando uma mistura binária de razão fixa como tensoativo/cotensoativo, água/fármaco ou fase oleosa/fármaco (FIGURA 2A).
A construção de diagramas de fase pode requerer um gasto dispendioso de tempo, principalmente quando um dos objetivos é delinear com precisão, os limites de cada fase. Geralmente, quando são utilizados tensoativos não-iônicos, fatores como sonicação e aquecimento podem contribuir para se alcançar rapidamente o equilíbrio do sistema (WARISNOICHAROEN et al., 2000). A metodologia mais prática para a construção de diagramas de fase envolve a preparação de uma série de misturas binárias e a sua posterior titulação com um terceiro componente, avaliando-se a mistura após cada adição do titulante (DJORDJEVIC et al., 2004). No entanto, alguns cuidados são necessários, no sentido de evitar discrepâncias no diagrama de fases, com relação ao controle da temperatura e ao tempo de espera, para que o sistema atinja o equilíbrio. Estes cuidados são aplicados, principalmente, quando se utilizam tensoativos não-iônicos, por serem muito susceptíveis à temperatura, podendo ocorrer, em temperaturas mais elevadas, diminuição de sua solubilidade (WARISNOICHAROEN et al., 2000; DJORDJEVIC et al., 2004).
A análise de um diagrama de fases pode revelar regiões em que são encontradas predominantemente certas fases e microestruturas (FIGURA 2B). Estas regiões podem ser maiores ou menores dependendo da natureza dos componentes, da razão tensoativo/ cotensoativo e da temperatura. Em misturas muito ricas em tensoativo há a tendência da formação de cristais líquidos (região A) e estruturas lamelares, nas quais o tensoativo e o cotensoativo organizamse sob a forma de bicamadas na interface água/óleo separando ambas as fases (ALANY et al., 2001). Esta região é caracterizada por misturas viscosas, e em alguns casos, pode ser observada a formação de géis (ALVAREZ-FIGUEROA; BLANCO-MÉNDEZ, 2001). Na região próxima ao vértice da água (região B), podem ser observadas microgotículas de óleo, dispersas no meio aquoso (microemulsões do tipo O/ A), desde que a concentração de tensoativos seja suficiente para formar fluidos filmes interfaciais. A diluição infinita com a fase aquosa tende a formar micelas diretas. O outro extremo do diagrama, próximo ao vértice da fase oleosa (região D), é caracterizado pela presença de microgotículas de água dispersas na fase oleosa (microemulsões do tipo A/ O), sendo o volume da fase interna pequeno. A diluição infinita com a fase oleosa tende a formar micelas inversas, com a fase aquosa dissolvida em seu interior. Entre estas duas regiões pode existir uma outra intermediária (região C), onde podem ser observadas fases bicontínuas, caracterizadas por extensas fases de água e óleo separadas por um filme interfacial composto por tensoativo e cotensoativo. Nas composições próximas ao eixo binário água-óleo (região E), a quantidade do tensoativo é insuficiente para facilitar a formação de microemulsões. Nesta região, fases múltiplas podem existir, tais como emulsões, emulsões em equilíbrio com a fase aquosa ou oleosa, microemulsões em equilíbrio com a fase aquosa ou oleosa e até mesmo, sistemas trifásicos (LAWREENCE; RESS, 2000; OLIVEIRA et al., 2004).
Finalmente, pode-se concluir que as microemulsões apresentam microestruturas que podem ser constituídas de microgotículas de óleo em água (microemulsões do tipo O/A) ou de água em óleo (microemulsões do tipo A/O) (FIGURA 1). As primeiras são observadas quando a fração de volume do óleo é baixa em comparação à água, e as últimas quando a fração de volume da água é pequena. Quando as quantidades de água e óleo em um sistema microemulsionado forem similares, podem ser observadas estruturas bicontínuas, onde a água e o óleo coexistem como fase contínua na presença de uma dinâmica interface estabilizada por moléculas do tensoativo.
Materiais e Métodos
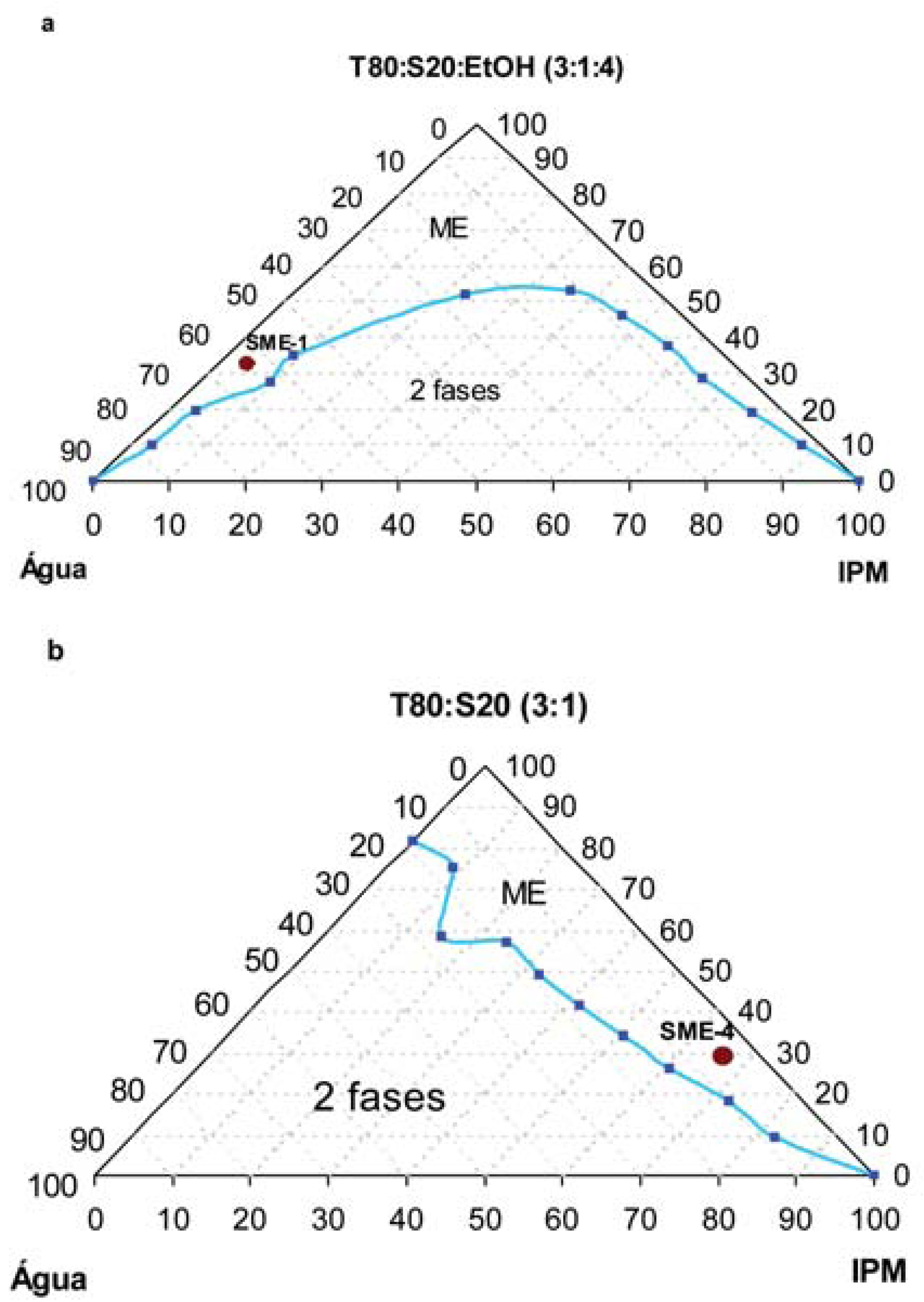
As cascas do caule de Anacardium occidentale foram coletadas em Natal (RN) e a identificação botânica da espécie foi realizada pela botânica Maria Iracema Bezerra Loiola. Uma exsicata elaborada foi depositada no herbário da Universidade Federal do Rio Grande do Norte. O material vegetal (1,3 Kg) foi fragmentado em pequenos pedaços e submetido à extração via percolação, com MeOH. O extrato metanólico obtido (62,3 g) foi submetido a um procedimento cromatográfico em gel de sílica, e forneceu uma fração apolar (eluída em hexano) correspondente ao óleo fixo (FO), uma fração de polaridademediana (FM, eluída em CHCl3), uma fração polar (FP, eluída em MeOH) e uma fração muito polar[eluída em MeOH /H2O (8:2)] rica em taninos (FT), que após liofilização foi solubilizada nos sistemas microemulsionados SME-1 e SME-4, obtendo-se FT-SME-1 E FT-MSE-4. O extrato MeOH, bem como as frações FO e FT-SME-1 e FT-SME-4, foram submetidos a análises que avaliaram a ação antioxidante de Anacardium occidentale. As microemulsões testadas foram preparadas utilizando a mistura Tween 80 e Span 20 (3:1) como tensoativo, miristato de isopropila (IPM) como óleo (fase orgânica) e água bidestilada. Em apenas um dos sistemas testados (SME-1) foi utilizado etanol como cotensoativo na razão C/T = 1 (TABELA 1). Os diagramas de fase foram obtidos a partir da titulação com água bidestilada e fase oleosa (quando necessário) de misturas pré-determinadas contendo tensoativo/cotensoativo (FIGURA 3).
| Componente | SME-1 | SME-4 |
|---|---|---|
| Tween 80 | 13,12% | 22,50% |
| Span 20 | 4,38% | 7,50% |
| Etanol | 17,50% | ----- |
| IPM | 5,00% | 65,00% |
| Água bidestilada | 60,00% | 5,00% |
Avaliação da capacidade antioxidante
Na metodologia empregada para a avaliação da atividade antioxidante utilizou-se como fonte de radical livre o DPPH (2,2-difenil-picril-hidrazila) (MENSOR et al., 2001). As soluções-estoque foram preparadas em metanol na concentração de 1 mg/mL. O ensaio foi realizado em microplacas de 96 poços, no volume total de 100 μL. Foram feitas diluições do extrato metanólico (MeOH) e das frações FO e FT para as concentrações de 710, 71, 7,1 e 0,71 μg/mL, que foram adicionadas às microplacas, juntamente com uma solução 0,3 mM de DPPH (em metanol). Após o tempo de 30 minutos de repouso no escuro, foi feita a leitura das microplacas em leitora Elisa a 490 nm. Foram realizados 3 ensaios independentes, todos em triplicata. O percentual antioxidante foi calculado a partir da seguinte equação:
%AA = 100 − (A amostra − A branco) × 100 / A controle
Onde:
Aamostra = absorbância da amostra correspondente ao extrato com DPPH;
Abranco = absorbância do branco correspondente ao extrato sem DPPH;
Acontrole = absorbância da solução pura de DPPH 0,3mM.
A atividade antioxidante foi expressa em valores de CE50± dp (concentração efetiva na captura de 50% do radical livre DPPH e desvio padrão, respectivamente), obtidos através do gráfico que relaciona o percentual de atividade com a concentração da substância ensaiada.
Resultados e Discussão
De maneira geral, o uso de cotensoativo em um sistema microemulsionado favorece a formação de microemulsões através da estabilização do sistema e do aumento da fluidez do filme interfacial de tensoativo formado (LAWRENCE; REES, 2000). O tipo de cotensoativo que se utiliza e a razão C/T (cotensoativo/tensoativo) auxiliam na formação da microemulsão (ME), podendo acarretar em um aumento da região de ME no diagrama de fase, especificamente próximo ao vértice da água (ME do tipo O/A).
Neste trabalho utilizou-se uma mistura dos tensoativos Tween 80 e Span 20 objetivando-se a obtenção de extensas regiões de microemulsão (LI et al.; 2005), bem como a utilização de um cotensoativo que pudesse ampliar ainda mais, região de ME, e ao mesmo tempo pudesse elevar o poder de solubilização deste sistema. Para tanto, foram testadas várias misturas dos tensoativos (Tween 80 e Span 20) em diferentes concentrações. Dentre as várias formulações obtidas, duas delas (SME-1 e SME-4) (TABELA 1) foram as que apresentaram melhores resultados, já que no diagrama de fase mostrou uma maior região de ME. Comparativamente, a formulação SME-4 [composta pela mistura de Tween 80:Span 20 (3:1), IPM (como fase orgânica) e água bidestilada] apresentou no diagrama de fase, uma maior região de ME ao longo do eixo binário tensoativo-óleo (ME do tipo A/O) (FIGURA 3). De acordo com o esperado, a utilização do etanol (cotensoativo) na formulação SME-1 (TABELA 1) aumentou de forma considerável, a região de microemulsão do tipo O/A (rica em água) (FIGURA 3), ideal para a solubilização de substâncias polares. No entanto, apesar do caráter polar da fração FT (rica em taninos), ambos os sistemas testados SME-1 (com microestrutura do tipo O/A, FIGURA 2B) e SME-4 (com microestrutura do tipo A/O, FIGURA 2A) solubilizaram parcialmente esta fração.
Os resultados da avaliação da ação antioxidante mostraram-se muito positivos, particularmente para o extrato MeOH bruto e para fração FT, tendo sido obtidos os valores de CE50 = 42,47 ± 0,14 μg/mL para o extrato MeOH, CE50 = 39,27 ± 1,07 μg/mL para o sistema FT-SME-1 e CE50 = 42,20 ± 5,20 μg/mL para FT-SMET-4. No entanto, a fração FO não apresentou atividade até a dose de 710 μg/mL. De acordo com o esperado, estes resultados indicam que a atividade antioxidante do extrato MeOH decorre, provavelmente, da fração FT rica em taninos (CHANWITHEESUK et al., 2005). Em relação aos sistemas testados SME-1 e SME-4; não se observou interferência significativa na atividade avaliada.
A utilização do álcool de cadeia média (EtOH) como cotensoativo no sistema SME-1, pode ser considerado como um componente adicional não tóxico em função da baixa concentração (17,5%) que foi utilizada. Adicionalmente, a presença deste álcool no sistema SME-1 favorece o uso desta formulação para solubilização (e encapsulamento) de substâncias hidrofílicas, já que consiste em um sistema com região rica em água. No entanto, neste trabalho, apesar do caráter polar da fração FT, ambas as formulações testadas (SME-1 e SME-4) solubilizaram parcialmente esta fração. Apesar disso, foram significantemente eficazes na avaliação da ação antioxidante de Anacardium occidentale, já que possibilitaram a biodisponibilização de FT. Desta forma, o poder antioxidante de Anacardium occidentale foi atribuído à presença de taninos, contidos nesta fração. Os sistemas SME-2 e SME-3 não foram selecionados como prioridade de estudos porque continham o cotensoativo (etanol) em percentuais mais elevados, e também, porque não foram mais eficazes na solubilização de FT.
Em um contexto mais abrangente, os sistemas microemulsionados obtidos neste trabalho, podem vir a ser utilizados para a solubilização, e conseqüente biodisponibilização, de fármacos de caráter lipofílico (SME-4) e/ou hidrofílico (SME-1), com contribuição adicional para a redução da dose administrada, favorecendo a relação dose/resposta e diminuição de efeitos adversos.
Agradecimentos
Os autores agradecem ao CNPq e ao Programa Prodoc/CAPES.
Referências
ALANY, R.G.; TUCKER, I.G.; DAVIES, N.M.; RADES, T. Characterizing colloidal structures of pseudoternary phase diagrams formed by oil/water/amphiphile systems. Drug Development and Industrial Pharmacy, v.27, n.1, p.31-38, 2001.
ALVAREZ-FIGUEROA, M.J.; BLANCO-MÉNDEZ, J. Transdermal delivery of methotrexate: iontophoretic delivery from hydrogels and passive delivery from microemulsions. International Journal of Pharmaceutics, v.215, n.1-2, p.57-65, 2001.
AZEVEDO, C.H.M.; CARVALHO, J.P.; VALDUGA, C.J.; MARANHÃO, R.C. Plasma kinetics and uptake by tumor of a cholesterol-rich microemulsion (LDE) associated to etoposide oleate in patients with ovarian carcinoma. Gynecologic Oncology, v.97, n.1, p.178-182, 2005.
CHANWITHEESUK, A.; TEERAWUTGULRAG, A.; RAKARIYATHAM, N. Screening of antioxidant activity and antioxidant compounds of some edible plants of Thailand. Food Chemistry, v.92, n.3, p.491-497, 2005.
CORTESI, R.; ESPOSITO, E.; MAIETTI, A.; MENEGATTI, E.; NASTRUZZI, C. Formulation study for the antitumor drug camptothecin: liposomes, micellar solutions and a microemulsion. International Journal of Pharmaceutics, v.159, n.1, p.95-103, 1997.
DALMORA, M.E.; DALMORA, S.L.; OLIVEIRA, A.G. Inclusion complex of piroxicam with â-cyclodextrin and incorporation in cationic microemulsion. In vitro drug release and in vivo topical anti-inflammatory effect. International Journal of Pharmaceutics, v.222, n.1, p.45-55, 2001.
DJORDJEVIC, L.; PRIMORAC, M.; STUPAR, M.; KRAJISNIK, D. Characterization of caprylocaproyl macrogolglycerides based microemulsion drug delivery vehicles for an amphiphilic drug, International Journal of Pharmaceutics, v.271, n.1-2, p.11-19, 2004.
FLORENCE, A.T. Nanoparticle uptake by the oral route: Fulfilling its potential? Drug Discovery Today, v.2, n.1, p.75-81, 2005.
FORMARIZ, T.P.; URBAN, M.C.C.; SILVA JR., A.A.; GREMIÃO, M.P.D.; OLIVEIRA, A.G. Microemulsões e fases líquidas cristalinas como sistemas de liberação de fármacos. Revista Brasileira de Ciências Farmacêuticas, v.41, n.3, p.301-313, 2005.
GONÇALVES, J.L.S.; LOPES, R.C.; OLIVEIRA, D.B.; COSTA, S.S.; MIRANDA, M.M.F.S.; ROMANOS, M.T.V.; SANTOS, N.S.O.; WIGG, M.D. In vitro anti-rotavirus activity of some medicinal plants used in Brazil against diarrhea. Journal of Ethnopharmacology, v.99, n.3, p.403-407, 2005.
KAWAKAMI, K.; YOSHIKAWA, T.; MOROTO, Y.; KANAOKA, E.; TAKAHASHI, K.; NISHIHARA, Y.; MASUDA, K. Microemulsion formulation for enhanced absorption of poorly soluble drugs. I. Prescription design, Journal of Controlled Release, v.81, n.1-2, p.65-74, 2002.
LAWRENCE, M.J.; REES, G.D. Microemulsion-based media as novel drug delivery systems. Advanced Drug Delivery Reviews, v.45, n.1, p.89-121, 2000.
LEE, P.J.; LANGER, R.; SHASTRI, V.P. Novel microemulsion enhancer formulation for simultaneous transdermal delivery of hydrophilic and hydrophobic drugs. Pharmaceutical Research, v.20, n.2, p.7-27, 2003.
LI, P.; GHOSH, A.; WAGNER, R.F.; KRILL, S.; JOSHI, Y.M.; SERAJUDDIN, A.T.M. Effect of combined use of nonionic surfactant on formation of oil-in-water microemulsions. International Journal of Pharmaceutis, v.288, n.1, p.27-34, 2005.
LYONS, K.C.; CHARMAN, W.N.; MILLER, R.; PORTER, C.J.H. Factors limiting the oral bioavailability of N-acetylglucosaminyl- N-acetylmuramyl dipeptide (GMDP) and enhancement of absorption in rats by delivery in a water-in-oil microemulsion, International Journal of Pharmaceutics, v.199, n.1, p.17-28, 2000.
MENSOR, L.L.; MENEZES, F.S.; LEITÃO, G.G.; REIS, A.S.; SANTOS, T.C.; COUBE, C.S.; LEITÃO, S.G. Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method. Phytoterapy Research, v.15, n.2, p.127-130, 2001.
OLIVEIRA, A.G.; SCARPA, M.V.; CORREA, M.A.; CERA, L.F.R.; FORMARIZ, T.P. Microemulsões: estrutura e aplicações como sistema de liberação de fármacos. Química Nova, v.27, n.1, p.131-138, 2004.
SILVA, S.; TASSARA, H. Frutas no Brasil. 4.ed. São Paulo: Empresa das Artes, 1996.
TREVISAN, M.T.S; PFUNDSTEIN, B.; HAUBNER, R.; WUERTELE, G.; SPIEGELHALDER, B.; BARTSCH, H.; OWEN, R.W. Characterization of alkyl phenols in cashew (Anacardium occidentale) products and assay of their antioxidant capacity. Food and Chemical Toxicology, v.44, n.2, p.188-197, 2006.
WARISNOICHAROEN, W.; LANSLEY, A.B.; LAWRENCE, M.J. Nonionic oil-in-water microemulsions: the effect of oil type on phase behaviour, International Journal of Pharmaceutics, v.198, n.1, p.7-27, 2000.