Artigo Original
Aspectos sobre Produtos Naturais na Descoberta de Novos Agentes Antitumorais e Antimutagênicos
Aspects of Natural Products on the Discovery of New Antitumoral and Antimutagenic Agents
Resumo
O presente estudo traz um breve histórico sobre produtos naturais anticarcinogênicos, bem como aspectos relevantes de pesquisas quimiofarmacológicas onde agentes anticancerígenos são o alvo principal de investigações. Neste contexto, mostra uma abordagem geral sobre quimioterapia e mutagenicidade. Focaliza ainda, aspectos químicos e propriedades anticâncer e antimutagênica de uma das mais importantes plantas medicinais brasileiras da atualidade: Croton cajucara Benth, uma euforbiácea, muito utilizada na medicina popular da região Amazônica, de onde se isola a promissora substância trans-desidrocrotonina, cujo uso vem sendo difundido por todo o país, e que poderia representar uma substância a ser mais bem explorada como agente anticâncer. Sua incorporação em sistemas de liberação controlada também é abordada.
- Unitermos:
- Plantas Medicinais.
- Produtos Naturais.
- Atividade Antitumoral.
- Atividade Antimutagênica.
Abstract
This paper presents a brief historic of bioactive natural products against cancer. Some aspects of current research in pharmacological and biochemical profiling of lead compounds obtained from traditional medicinal plants are herein presented. Emphasize some important natural anticancer agents and general chemotherapeutic approaches, including mutagenic investigation. The very efficient Amazonian Euphorbiaceae medicinal plant Croton cajucara, which is the source of the bioactive clerodane trans-dehydrocrotonin, is focused. The chemotherapeutic potential of this substance should be explored in order to achieve new anticancer drugs. The advantage of its incorporation into drug delivery systems is also explored.
- Key words:
- Medicinal plants.
- Natural Products.
- Antitumoral Activity.
- Antimutagenic Activity.
Introdução
Os estudos científicos envolvendo produtos naturais mostram uma tendência evolutiva em termos tecnológicos, que poderá levar a uma redução drástica do diferencial observado na relação número de vegetais existentes/espécies estudadas. Dentre as inúmeras mudanças, destacam-se: condutas adotadas na seleção e coleta de plantas, técnicas de isolamento, evolução em técnicas espectrométricas para a elucidação estrutural de moléculas orgânicas, avaliação biológica, semisínteses e biossínteses, amplamente relatados em diversos trabalhos científicos e livros didáticos ou de divulgação científica. Com relação às pesquisas fitofarmacológicas e etnofarmacológicas no País, em 1993 pesquisadores brasileiros mostraram os avanços obtidos através dos trabalhos intitulados “ Fourty years of Brazilian medicinal plant research” (SOUZA-BRITO; SOUZA-BRITO, 1993) e “The status of ethnopharmacology in Brazil” (ELISABETSKY; WANNMCHER, 1993). Recentemente, Kato (2001) discute em um artigo intitulado “Global phytochemistry: the Brazilian approach” os avanços obtidos em pesquisas fitoquímicas, tendo como base o esforço científico de grupos de pesquisadores especializados nesta área, que levou ao desenvolvimento tecnológico adquirido no país. Pinto et al. (2003) ampliaram estas abordagens, relatando historicamente o desenvolvimento da área de Produtos Naturais no Brasil através dos trabalhos “ Um olhar holístico sobre a química de produtos naturais Brasileira” e “Produtos naturais: atualidade, desafios e perspectivas” (PINTO et al., 2002; 2003). Neste último ( PINTO et al., 2002), encontram-se dados estatísticos que comprovam o desenvolvimento da pesquisa em Química de Produtos Naturais no Brasil, tomando como base os números de artigos publicados entre 1997-2001, nos periódicos científicos Journal of the Brazilian Chemical Society e Química Nova; bem como em 6 periódicos internacionais de impacto relevante. Em adição aos trabalhos de Souza-Brito, Elisabestsky, Kato e Pinto, citados acima, Calixto (2005) reforça estatisticamente o progresso das pesquisas Brasileiras com plantas medicinais nos últimos 25 anos, em um artigo intitulado “Twenty-five years of research on medicinal plants in Latin América: a personal view”. Em todas estas publicações, percebe-se, dentre os muitos pontos relevantes que são abordados, a importância de se desenvolver pesquisas multidisciplinares, objetivando a otimização de novas drogas com potencial farmacológico. Com relação a este enfoque, Cechinel Filho e Yunes (1998) divulgaram estratégias para a obtenção de compostos farmacologicamente ativos a partir de plantas medicinais e, mais recentemente, Maciel et al. (2002), publicaram um trabalho intitulado “Plantas medicinais: a necessidade de estudos multidisciplinares”, onde foram abordados aspectos botânicos, etnobotânicos, fitoquímicos e farmacológicos. Recentemente, Viegas Jr. et al. (2006) no trabalho “Os produtos naturais e a química medicinal moderna”, reforçam dentre outros assuntos, a importância dos produtos naturais como fonte de novos fármacos, assim como o avanço tecnológico que favorece o mercado farmacêutico mundial.
Nos últimos 15 anos, o progresso científico de pesquisas com Produtos Naturais em todo o mundo, pode ser acompanhado por periódicos consagrados, tais como: Phytochemistry; Journal of Natural Products; Natural Products Reports; Planta Medica; Journal of Ethnopharmacology; Phytotherapy Research; bem como, pelo surgimento de novos periódicos: Natural Product Letters; Thai Journal of Phytochemistry; Phytotherapy Research; Phytochemical Analysis; Phytomedicine; Natural Product Letter; Current Topics in Phytochemistry; Revista Brasileira de Plantas Medicinais; Revista Brasileira de Farmacognosia; Revista Fitos, e o retorno do International Journal of Pharmacognosy, dentre tantos outros. O fortalecimento evidenciado pela elevação de índices de impacto científico de determinados periódicos como Fitoterapia, Planta Medica, Journal of Ethnopharmacology, Journal of the Brazilian Chemical Societ e Química Nova; bem como o surgimento de novos livros de análise estrutural, revisões de livros de fitoquímica, livros de divulgação científica (como por exemplo: Farmacognosia, da Planta ao Medicamento), publicações de artigos originários de simpósios e divulgação ampliada de volumes de novas séries (como exemplos: Recent Progress in Medicinal Plants, Advances in Phytomedicine e Current Topics in Phytochemistry), são igualmente importantes para o empreendimento de pesquisas de Produtos Naturais.
Do ponto de vista educacional, a elaboração de novos livros, bem como artigos de divulgação, atualizam o profissional da área de Produtos Naturais e, ao mesmo tempo, motivam novos pesquisadores a ingressarem na pesquisa de plantas medicinais (botânica, etnobotânica, fitoquímica, química farmacêutica, farmacologia, bioquímica e áreas afins). Dentro deste contexto, o presente artigo focaliza os progressos na Farmacologia de Produtos Naturais e sua importância na descoberta de novos agentes antitumorais, destacando experimentos farmacológicos voltados para a pesquisa de quimioterápicos. Além disso, divulga resumidamente os resultados científicos de uma planta medicinal brasileira nativa da região Amazônica, a espécie Croton cajucara Benth (Euphorbiaceae), por apresentar o exemplo de uma comprovada ação anticâncer. Neste contexto, destaca-se ainda, o potencial anticâncer e antimutagênico do clerodano trans-desidrocrotonina, isolado desta espécie de Croton.
Produtos Naturais Bioativos
No século XVI, o médico suíço Paracelso, considerado o pai da Físico-Química, foi o primeiro a propor a extração de produtos naturais bioativos a partir de fontes vegetais, originando a noção de princípio bioativo. Porém, foi apenas no século XVIII que teve início o processo de identificação destas substâncias e, com isso, a transição entre plantas medicinais e produtos farmacêuticos modernos. Uma das primeiras substâncias isoladas de plantas foi a morfina (analgésico), seguida da aconitina e emetina (amebicida/emético); atropina (anticolinérgico); digitoxina (cardiotônico); vincristina (antitumoral); reserpina (antiipertensivo); quinina e artemisinina (antimaláricos); citando apenas alguns exemplos clássicos (FARNSWORTH; MORRIS, 1976). Atualmente, muitas destas substâncias são sintetizadas e comercializadas em grande escala. No entanto, de maneira geral, os medicamentos de origem natural foram ao longo dos anos sendo substituídos paulatinamente, por análogos ou derivados sintéticos (WALTON, 2003). Como exemplo, pode-se citar o ácido acetilsalicílico, conhecido nas farmácias como aspirina, substituto do ácido salicílico (FIGURA 1), que foi isolado das cascas do “salgueiro-branco” (Salix alba); espécie comumente utilizada na metade do século XIX para o tratamento da malária. A aspirina completou 100 anos em 1997 e é um dos medicamentos mais conhecidos e vendidos em todo o mundo. Nos Estados Unidos por exemplo, são consumidos por ano, mais de 30 bilhões de comprimidos deste derivado semi-sintético (AGOSTA, 1997). A eficácia farmacológica do Salix alba encontra-se bem documentada.Teve início no século V a.C. com Hipócrates (filósofo e médico grego, considerado o pai da medicina moderna) que prescrevia preparações com espécies vegetais, dentre elas, as cascas e folhas do salgueiro, que eram utilizadas para o tratamento de febres e para aliviar as dores do parto (MACIEL, 1997). Outro notável médico na antiguidade, Dioscórides, que viveu na Grécia no século I da era cristã e autor da obra “De Materia Medica”, receitava emplastros feitos com as cascas e folhas do salgueiro para o tratamento de dores reumáticas (MACIEL, 1997). A vanilina, um componente natural (FIGURA 1), é utilizado no mundo inteiro como aromatizante de alimentos, e é consumida em cerca de 12.000 toneladas por ano. Deste montante, hoje apenas 1% do consumo é de origem natural (Vanilla planifolia Andrews). O produto sintetizado envolve um custo comercial de 15 dólares/kg, enquanto o preço da vanilina natural varia entre 1.200-4.000US$/Kg (FARNSWORTH; MORRIS, 1976).
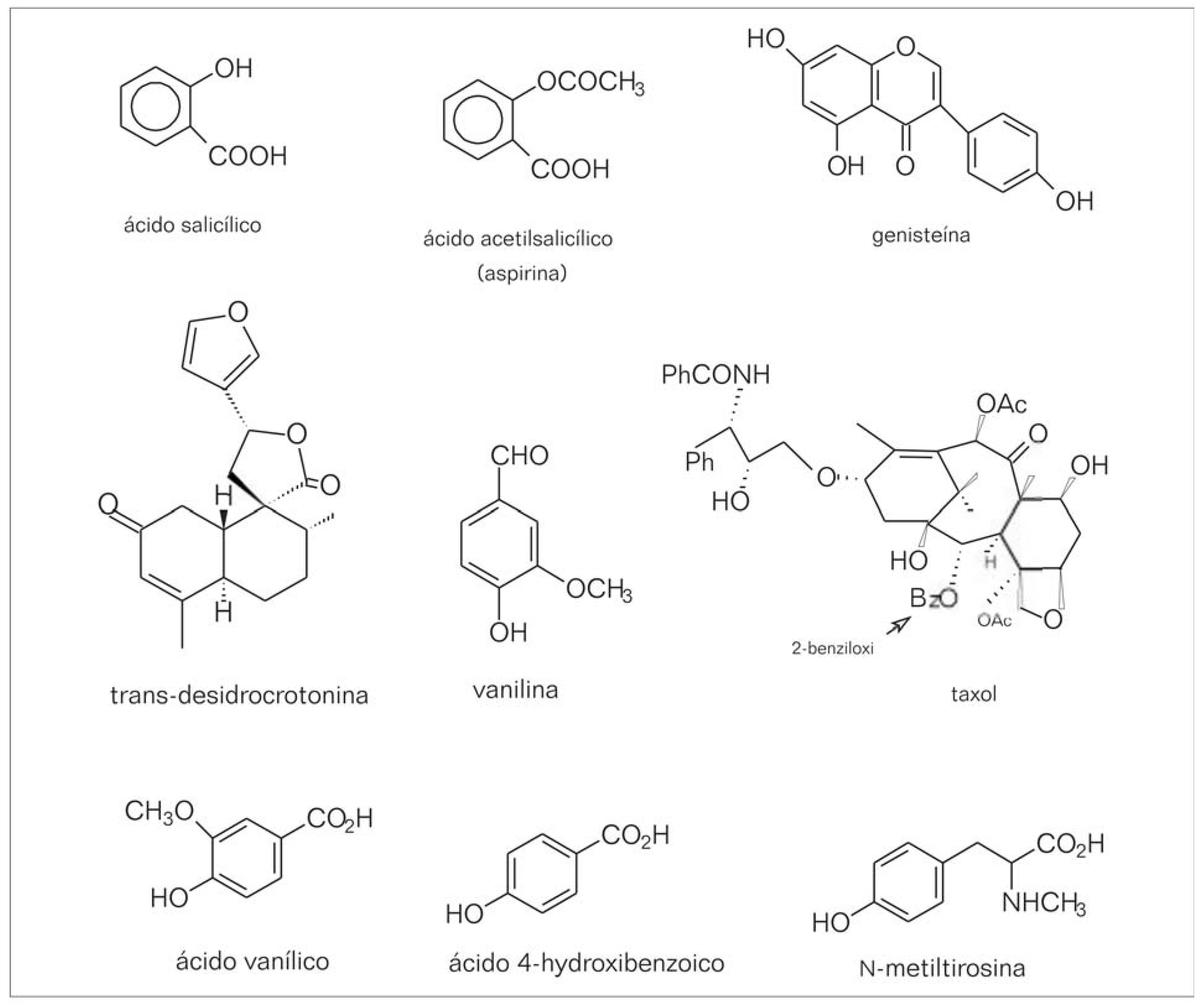
De maneira geral, substâncias naturais de estrutura química complexa inviabilizam sua obtenção sintética, sendo necessário o isolamento de fonte natural para posterior aplicação medicinal. Este é o caso do taxol (FIGURA 1), uma substância de comprovada ação anticâncer isolado inicialmente como componente de Taxus brevifolia Nutt; e posteriormente de variadas espécies de Taxus, que foi selecionado em 1977 como um forte candidato à aplicação clínica, em decorrência da sua alta atividade antitumoral sobre o melanoma B16. No entanto, o baixo rendimento de seu isolamento (variando entre 0,00003 até 0,069%) dificultava sua aplicabilidade clínica, já que para cada 1900g de taxol são necessários 27300kg de cascas, envolvendo coletas de 6000 unidades de árvores (KINGSTON, 1991; NADEEM et al., 2002). Apesar desta limitação, o taxol foi aprovado pela FDA em dezembro de 1992, para o tratamento de câncer de ovário; e em 1994, para tratamento do câncer de mama (BORMAN, 1994; HOLMES et al., 1991; NADEEM et al., 2002; POTIER, 1992). Nesta época, estimou-se a necessidade de 25kg da droga para distribuição em centros clínicos dos Estados Unidos (BORMAN, 1994; HOLMES et al., 1991; POTIER, 1992). Motivados pela importância clínica do taxol, pesquisadores do mundo inteiro passaram a colaborar com os estudos sintéticos desta molécula. Este esforço científico pode ser evidenciado nos últimos 20 anos, onde cerca de 40 grupos de pesquisa vêm trabalhando na síntese parcial ou total, não só do taxol como de outros produtos pertencentes à classe dos taxanos (HONGJIE et al., 1994; HORIGUCHI et al., 2003a, 2003b; MA et al., 1994; VORONKOV et al., 2003). Diversos estudos clínicos demonstraram que o taxol é um agente quimioterápico efetivo para vários tipos de câncer, dentre eles destacam-se: ovário; mama; pulmão; cérebro e garganta; próstata (BORMAN, 1994; CHANG et al., 1993; HE et al., 2003; KRIS et al., 1986; MURPHY et al., 1993; SUFFNESS, 1993). A combinação do taxol com outros agentes quimioterápicos, bem como em variadas formulações, após investigação em vários tipos de câncer, forneceu novas opções de tratamentos (JEONG et al., 2005; KANG et al., 2004; SUFFNESS, 1993; VENKATRAMAN et al., 2005). Atualmente, a comercialização do paclitaxel® (suplemento comercial do taxol/Bristol-Myers-Squibb, isolado das cascas de Taxus brevifolia) e seus derivados docetaxel® (taxotere/Rhone-Poulenc Rorer) ainda dependem de fontes naturais.
A investigação de plantas na busca de metabólitos com ação anticâncer, conduziu à descoberta de substâncias com potencial antiestrogênico, que vêm sendo utilizadas para o tratamento do câncer de mama. Dentre todos os produtos naturais bioativos que apresentam atividade estrogênica, destacamse os esteróides, alcalóides, coumestanos e isoflavonóides (CHAVES et al., 2004; HARBONE, 1994; LAEKEMAN, 1986; PUPO et al., 2002; SAITO et al., 1993). Tomando-se como exemplo a classe dos flavonóides, ocorreu, há muitos anos atrás, um fato curioso com um rebanho de carneiros (da região oeste da Austrália) que se alimentava de um trevo conhecido cientificamente como Trifolium subterraneum. Os animais, independente de serem fêmeas ou machos, apresentaram distúrbios de gravidez, desenvolvimento mamário e secreção láctea. Esta atividade estrogênica foi atribuída à presença de uma isoflavona, a genisteína (FIGURA 1) que fazia parte dos constituintes químicos desta planta (BRADBURY; WHITE, 1951). Atualmente, sabe-se que esta substância está presente em grãos de soja em um percentual relativamente elevado (cerca de 3 mg/g) (DIXON; FERREIRA, 2002) e apresenta significante ação farmacológica, dentre elas a prevenção de câncer (ARLISS; BIERMANN, 2002; BARNES, 1995; NAKAGAWA et al., 2000); ação antimutagênica (MIYAZAWA et al., 1999); antioxidante (CONKLIN, 2000); imunoprotetora, cardioprotetora e antiosteoporose (POLKOWSKI; MAZUREK, 2000; SETCHELL, 1999). A ampla bioatividade da genisteína vem sendo atribuída a sua ação estrogênica (BRANDI, 1997; POLKOWSKI; MAZUREK, 2000; SETCHELL, 1999). A exemplo desta isoflavona, outros flavonóides apresentam benefícios para a saúde dos humanos, podendo ser citados: as atividades bactericida, antifúngica, anticarcinogênica e antimutagênica, além dos efeitos imunoprotetor, antialérgico e antiateroscleroses (HAVSTEEN, 1983; MIDDLETON; KANDASWAMI, 1992; RICE-EVANS et al., 1995).
Atualmente, os avanços medicinais de derivados semi-sintéticos obtidos de produtos naturais que são clinicamente utilizados no tratamento de diversos tipos de câncer, podem ser evidenciados para derivados do taxol, bem como de outros agentes quimioterápicos, tais como: etoposídeo (Podophyllum peltatum); teniposídeo (Podophyllum peltatum); irinotecan (Camptotheca acuminata); topotecan (Camptotheca acuminata); vimblastina (Catharanthus roseus); vincristina (Catharanthus roseus); camptotecina (Camptotheca acuminata) e homoharringtonina (Cephalotaxus harringtonia) (CASTRO et al., 2003; CRAGG; NEWMAN, 2005; HITT, 2002; KELLER et al., 2001; KUDOH et al., 2005; MILLER et al., 2005; QUOIX et al., 2005; REDDY et al., 2005; VISANI et al., 1997; ZIOTOPOULOS et al., 2005).
A relevância do uso destes quimioterápicos pode ser exemplificada pela pesquisa publicada no Journal of the American Medical Association (JAMA) onde se registra que cerca de 42% dos americanos utilizaram ao menos uma terapia alternativa no ano de 1997, contra 34%, em 1990 (SOLOMON et al., 2002). Entre os portadores do vírus HIV, o percentual atual atinge índice relevante (78%) (WHO, 2002). O Instituto Nacional do Câncer (NCI) dos EUA, que investiga medicamentos anticâncer, proporcionou, no período entre 1987 e 1996, o desenvolvimento de infraestrutura apropriada para a realização de pesquisas voltadas para a descoberta de novas drogas contra o vírus HIV (WHO, 2002). Vários produtos naturais obtidos de plantas, animais, microorganismos ou substâncias produzidas por enzimas ou semi-sínteses, foram ativas contra este tipo de vírus HIV (BALUNAS; KINGHORN, 2005; YANG, 2001).
Quando o assunto é medicamento correlacionado com produto natural para o tratamento do câncer, várias são as substâncias com grande chance de se tornarem líderes de mercado, já que podem gerar derivados semi-sintéticos e/ou produtos sintéticos (provenientes de sínteses totais ou parciais), como é o caso da colchicina, demecolchina (Colchium autumnale), etoposídeo, vimblastina e vincristina (KINGHORN; SEO, 1996). A indústria farmacêutica demonstra no mundo inteiro, grande interesse pelo uso de quimioterápicos naturais eficazes e, diante da complexidade das estruturas moleculares destes metabólitos, praticamente impossíveis de serem sintetizadas com custos favoráveis, optou pelos análogos semi-sintéticos. Atualmente, derivados semi-sintéticos vêm sendo inseridos com êxito, substituindo aqueles de origem natural por serem menos tóxicos, mais ativos ou, simplesmente, de mais fácil aquisição. O vumon, por exemplo, é um análogo da podofilotoxina, derivado do etoposídeo, e foi introduzido recentemente para o tratamento de leucemia (KINGHORN; SEO, 1996). O vinorelbina (ou navelbina), um derivado dos alcalóides bisindólicos vimblastina e vincristina, vem sendo utilizado como agente antitumoral por cerca de 40 anos, tendo sido desenvolvido para tratamentos específicos de tumores de pulmão (KINGHORN; SEO, 1996). No entanto, dentre os fármacos que obtiveram mais sucesso no tratamento de câncer, destaca-se o já mencionado taxol (paclitaxel) pela eficácia na cura de diversos tipos de câncer, tendo sido, juntamente com a camptotecina, um dos primeiros metabólitos secundários de planta introduzido no mercado americano nos últimos 30 anos (KINGHORN; SEO, 1996). O processo de desenvolvimento para uso clínico destes quimioterápicos (e seus derivados) data do início dos anos de 1960, até a consolidação na década de 1990 (CRAGG; NEWMAN, 2005).
Apesar da grande viabilização medicinal comprovada para substâncias bioativas obtidas de espécies vegetais, estimou-se em 1991 que são necessários 12 anos de pesquisa com uma determinada substância bioativa, até que a sua comercialização possa ser aprovada pelo FDA. Isto representa um custo de US$ 231 milhões, aplicados em pesquisas (VAGELOS, 1991). Uma estimativa aponta que, para cada 10000 substâncias sintetizadas e avaliadas em experimentos farmacológicos in vitro, apenas 20 serão testadas em experimentos in vivo e, metade destas 20, em ensaios clínicos em humanos. Deste montante, apenas uma recebe a aprovação da FDA (VAGELOS, 1991).
Abordagem Quimioterápica
Em decorrência de extratos de plantas medicinais representarem uma fonte complexa contendo inúmeros e diferentes constituintes químicos, normalmente por isso apresentam efeitos sinérgicos. O isolamento de componentes presentes nas plantas, a descoberta de suas atividades, bem como seus mecanismos de ação, continua sendo um dos maiores desafios para profissionais de fitoquímica, química farmacêutica, bioquímica e farmacologia. No estudo da atividade biológica de plantas, um dos primeiros passos envolve a seleção de bioensaios objetivando a detecção do efeito biológico específico correlacionado com as indicações terapêuticas de cada espécie medicinal. Muitas vezes, a presença de substâncias de classes diferentes ou de mesma classe, que apresentem pequenas variações estruturais, podem contribuir para a mesma atividade biológica. Desta forma, pode ocorrer de um extrato apresentar determinada ação farmacológica, e seus componentes isolados serem menos ativos (maiores doses para uma resposta biológica significativa) ou mesmo inativos. Os sistemas de ensaios biológicos devem ser simples, sensíveis e reprodutíveis; podem envolver organismos inferiores (microorganismos e microcrustáceos, por exemplo), ensaios bioquímicos visando alvos moleculares (enzimas e receptores) e cultura de células animais, ou humanas. Pesquisas que objetivam o desenvolvimento de drogas bioativas necessitam de modelos apropriados para a identificação de alvos moleculares que sejam fundamentais no crescimento celular seja in vitro ou in vivo. Entre os principais alvos intracelulares encontram-se o DNA, RNA, microtúbulos e enzimas (MACIEL et al., 2002).
A terapia do câncer (quimioterapia) geralmente está associada a efeitos adversos e historicamente, os agentes quimioterápicos têm sido selecionados com base na sua toxidez, que por sua vez, não contempla a intervenção sofisticada do quimioterápico na biologia específica do tumor. O que normalmente se estabelece são os efeitos tóxicos em linhagens de células cancerígenas, complementados com ensaios em tumores de crescimento rápido em roedores. Esta estratégia aponta os agentes que apresentam toxidez para células e tecidos normais e mostram características de células tumorais, tais como alto turnover celular. Portanto, o futuro desta área de pesquisa é promissor, já que existe um grande interesse no desenvolvimento de terapias que protejam o tecido normal dos efeitos de agentes quimioterapêuticos, sem que haja uma interferência na sua ação anticâncer. Atualmente, um número significativo de drogas antimutagênicas de origem sintética ou natural, encontra-se em vários estágios de triagem clínica como agentes quimioprotetores. Nestes estudos, testes de curta duração em organismos eucariotos e procariotos mostram-se primordiais, já que alguns resultados têm conduzido a triagens clínicas, onde a efetivação de seu uso em humanos está sendo cautelosamente demonstrada (GIRI et al., 1999; HAMMONS et al., 1999; LOHMAM, 2002; MITSCHER et al., 1996).
Atividade Mutagênica e Antimutagênica
O DNA é a macromolécula precursora de todas as características de vida. É o componente informacional de todos os seres vivos, com exceção de alguns vírus que possuem o ácido ribonucléico (RNA) como material genético. Assim, da bactéria ao homem, o DNA possui as mesmas características, sendo os mecanismos de estocagem da informação e expressão gênica muito semelhantes em todos os organismos. Durante a evolução de toda a forma de vida, o DNA sofreu mutações que levaram à otimização da capacidade reprodutiva no nosso ambiente ancestral. No entanto, existem mutações que possuem efeitos deletérios, pois podem envolver alterações relativamente permanentes na seqüência linear do DNA (SHAMON; PEZZUTO, 1994). E quando a composição de um gene é modificada, pode resultar em um produto gênico inativo, ou eventualmente, ocorrer morte celular (BRUSICK, 1987). Os mecanismos que induzem processos mutagênicos variam desde os indiretos (transições, transversões, mutações frameshifts, dentre outros) até aqueles que levam a erros produzidos durante os processos de reparo ou de replicação do DNA. As radiações ionizantes e substâncias químicas com ação genotóxica, são exemplos de agentes mutagênicos. Estas substâncias têm em comum as propriedades químicas e físicas que permitem suas interações com os ácidos nucléicos (SHUGART, 1995). Devido às suas altas reatividades, podem levar a defeitos hereditários através de mutações em células germinativas (MITCHELMORE; CHIPMAN, 1998). Quando a mutação ocorre no material somático, a conseqüência mais comum é a formação de tumores benignos ou malignos ou o desenvolvimento de outras doenças; como a arteriosclerose, a morte celular que conduz ao envelhecimento precoce, efeitos teratogênicos ou mal-formações, além de abortos (BRIDGES, 1987, 1990, 1991; HANSEN, 1990; PENN, 1990; WAKABAYASHI, 1990).
A avaliação da genotoxicidade envolve diferentes tipos de interação do agente mutagênico com o DNA e seus efeitos, podendo ser investigados separadamente. Desta forma, a capacidade de ligação entre o agente genotóxico e o material genético pode ser avaliada através da observação de adutos no DNA. A sua potência na quebra do DNA pode ser estimada por eluição alcalina ou pelo teste do Cometa e as mutações cromossômicas e/ou genômicas geradas pelo agente genotóxico, podem ser quantificadas pelos testes do micronúcleo ou de aberrações cromossômicas (VAN-GOETHEM et al., 1997). As mutações podem ser detectadas utilizando-se microorganismos, bem como células de mamíferos ou de plantas. Investigar a mutagenicidade/genotoxicidade através de testes (in vitro ou in vivo) de curta duração em células de mamíferos, possibilita estimar tanto o potencial gerador de danos genéticos de compostos químicos genotóxicos, como avaliar seus riscos para a saúde humana, dada à curta distância filogenética existente entre os sistemas. No entanto, é importante salientar que espécies animais diferem umas das outras por características bioquímicas, funcionais e morfológicas distintas e, conseqüentemente, suas respostas à ação de drogas também podem variar tanto quantitativa como qualitativamente. Portanto, no processo de extrapolação de resultados com animais experimentais para o ser humano, estas variações devem ser levadas em consideração (JACOB, 1968). Sabe-se que uma grande variedade de mecanismos pode produzir a mutagênese; em contrapartida, existem mecanismos biológicos facilitados por substâncias antimutagênicas que trabalham impedindo a ação de agentes genotóxicos (VAN-GOETHEM et al., 1997). Pesquisas recentes mostram que muitos produtos naturais apresentam propriedades que reduzem direta ou indiretamente a ação mutagênica de substâncias tóxicas (REDDY et al., 2003; SLUPPHAUG et al., 2003; VERHAGEN et al., 2003). Muitos exemplos podem ser destacados, tais como: o efeito antimutagênico do chili (Capsicum sp.; especiaria indígena americana), do tumérico (tempero usado na Ásia; testado em ensaios com roedores) e de chás verde e preto (onde o ensaio com a bactéria Salmonella, demonstrou que a atividade protetora do chá verde foi mais eficaz) (ESPINOSA-AGUIRRE et al., 1993; HERNAEZ; DASHWOOD, 1998; LAHIRI et al., 1993; MUKUNDAN et al., 1993; TANAKA et al., 1994).
Mecanismo de Ação Quimioterápica
O estudo dos principais mecanismos de ação de substâncias naturais desperta grande interesse na busca de novos agentes quimioterápicos. Os avanços nos estudos revelam que os principais alvos moleculares são: os microtúbulos, o DNA via apoptose e radicais livres, a membrana, através de radicais livres, e as moléculas sinalizadoras. Alguns artigos de revisão mostram perspectivas globais para a prevenção e tratamento de vários tipos de câncer (CORTESI et al., 1997; REDDY et al., 2003; SLUPPHAUG et al., 2003; VERHAGEN et al., 2003; VITAGLIONE; FOGLIANO, 2004).
Mecanismo de Ação Via Microtúbulos
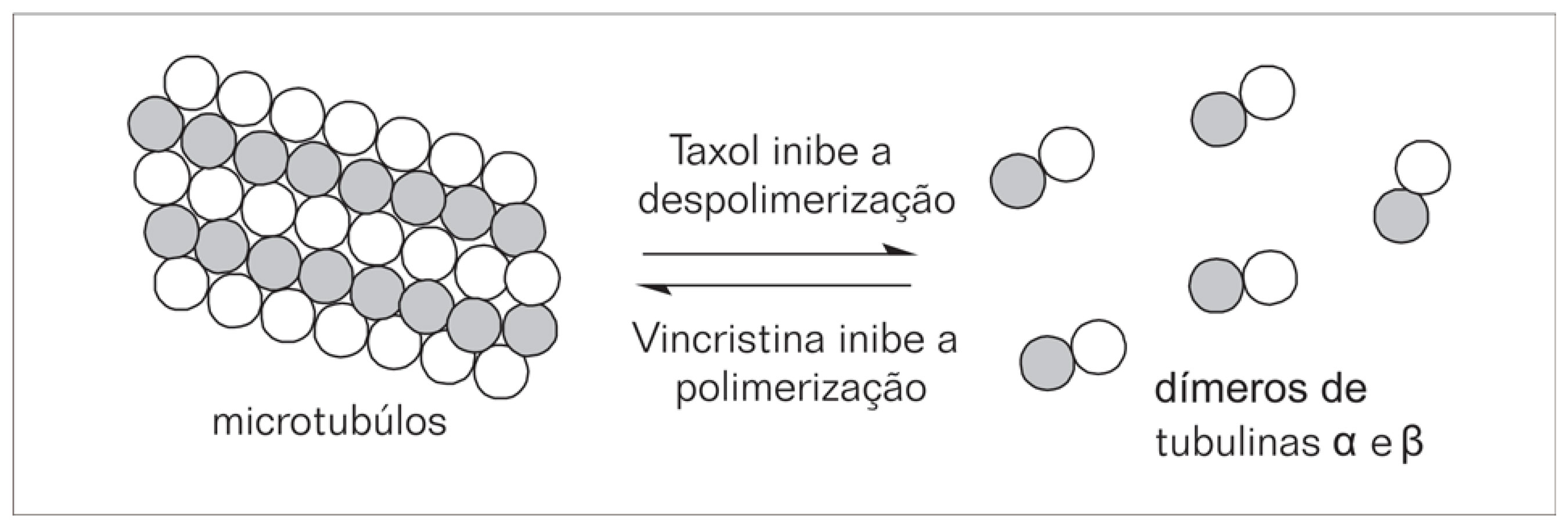
Os microtúbulos são componentes do fuso mitótico vital para muitas funções celulares, dentre elas destacam-se: a manutenção da forma celular, o transporte intracelular, os processos secretores e a mitose. Os microtúbulos são formados por proteínas estruturais, as tubulinas α e β que existem em equilíbrio dinâmico envolvendo a polimerização e despolimerização em resposta a mensagens fisiológicas (DE VITA, 1997) (ESQUEMA 1). Os alcalóides da vinca (vincristina e vinblastina, citados anteriormente), por exemplo, atuam por ligação a um sítio ativo específico da tubulina, inibindo a polimerização em microtúbulos na metáfase. Outros agentes antimicrotúbulos como a colchicina, a podofilotoxina e o taxol (também citados anteriormente) atuam em sítios diferentes. Os taxanos por exemplo, ligam-se aos microtúbulos na subunidade β da tubulina, estabilizando-os contra a despolimerização tendo efeito antimitótico (DE VITA, 1997).
Apoptose
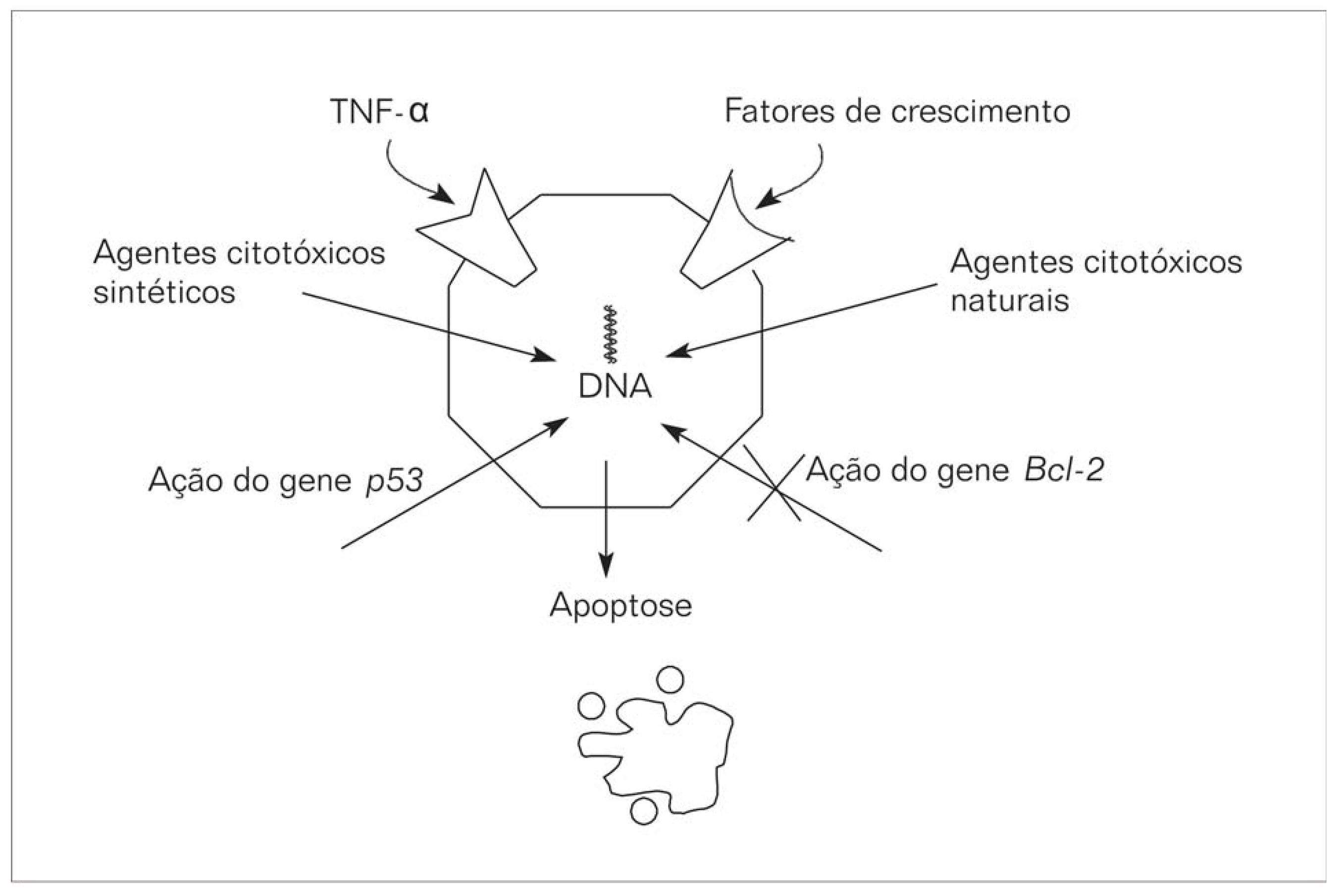
A apoptose consiste no mecanismo de autodestruição da célula em seqüência de eventos bioquímicos geneticamente programados, resultando na morte celular. Esse processo requer energia e síntese de proteínas para seu processamento. A apoptose pode ser induzida por agentes citotóxicos, calor, e irradiação quando em doses baixas; em altas doses, em contrapartida, causam morte celular por necrose - que é a desintegração desordenada das células danificadas, onde ocorre a ruptura da membrana celular resultando geralmente em resposta inflamatória (RANG et al., 2001). A apoptose é descrita por critérios morfológicos e bioquímicos. Os critérios morfológicos incluem a agregação da cromatina, condensação do citoplasma e núcleo, e a formação de corpos apoptóticos. As modificações bioquímicas, como a clivagem da cromatina resulta em fragmentos de DNA em múltiplos de cerca de 180 pares de bases que podem ser detectados por eletroforese em gel de agarose resultando em padrão (em escada) do DNA (RANG et al., 2001). A apoptose em animais e vegetais ocorre em 3 fases: (i) fase de indução, onde as principais vias sinalizadoras que desencadeiam a apoptose são a retirada de fatores de crescimento, a ligação do TNF (fator de necrose tumoral) a receptores, e a ativação do gene supressor de tumor p53 por agentes genotóxicos, agentes de estresse oxidativo, ceramidas, vírus, inibidores da síntese de proteínas, hipoxia ou óxido nítrico; (ii) fase efetora, que envolve membros da família de proteínas mitocondriais Bcl-2, que possuem função pró e antiapoptóticas; e (iii) fase de execução, que representa a via final da apoptose, onde os mecanismos sinalizadores e reguladores convergem para uma cascata de proteases chamadas caspases. As caspases existem como zimogênios. Depois que uma caspase desencadeante é ativada, o programa de morte é executado seqüencialmente havendo a hidrólise de proteínas do citoesqueleto e da matriz nuclear levando à destruição da célula (JABS, 1999; MUZITANO; COSTA,2006; RANG et al., 2001) (ESQUEMA 2).
Nesta atividade, podem ser inseridos os diterpenos da classe dos cauranos, que são encontrados em numerosas plantas utilizadas na medicina popular no tratamento de processos inflamatórios e do câncer (LEE et al., 2002). A ação antiinflamatória desses terpenos envolve a inibição da atividade do fator de transcrição nuclear kB (NF-kB), que é um fator mediador da apoptose e da resposta imune. O NF-kB promove a expressão de genes por macrófagos envolvidos na defesa do hospedeiro tais como: NOS-2 (oxido nítrico sintase-2), ciclooxigenase 2, moléculas de adesão e várias metaloproteinases da matriz. Além disso, esses diterpenos estão envolvidos na síntese das giberilinas e possuem atividade citotóxica sobre diferentes linhagens celulares humanas (CASTRILLO et al., 2001). Diterpenos do tipo cauranos e clerodanos, apresentam a possibilidade de sofrer reação de adição de Michael, cujo mecanismo é importante na inibição da atividade da NF-kB (CASTRILLO et al., 2001). O tratamento de células de câncer de mama humana MCF-7 com o caurano kamebakaurina, por exemplo, aumentou a susceptibilidade à apoptose induzida por TNF-α via elevação da atividade da caspase-8 (LEE et al., 2002). Diterpenos do tipo labdanos também induzem apoptose nas células de leucemia humana MOLT3, pela diminuição da expressão do proto-oncogene c-myc; em contrapartida, o gene bcl-2 não é alterado (DIMAS et al., 2001). O taxol além de ser um agente antimitótico, também induz apoptose em células tumorais, possivelmente através da ativação da cascata do NF-kB (MILLER, 1999). No entanto, alguns tumores como as células de câncer de mama MCF-7 e o tumor de próstata de rato, são resistentes à apoptose por não induzir essa ativação (MILLER, 1999). Por outro lado, são sensíveis à ação do taxol sobre os microtúbulos (MILLER, 1999).
Radicais Livres
Os processos metabólicos nas plantas e no corpo humano produzem inevitavelmente radicais livres altamente reativos, especialmente derivados do oxigênio, que oxidam biomoléculas resultando em morte celular e dano aos tecidos (CHEESEMAN; SLATER, 1993). Os danos oxidativos têm papel significativo na etiologia de doenças como aterosclerose, câncer, artrite e cirrose. A autoproteção normal do organismo contra o dano celular causado por radicais livres, é através de agentes antioxidantes que podem ser de caráter enzimático ou não. Enzimas como a superóxido-dismutase, catalase, glutationa-peroxidase e substâncias antioxidantes endógenas como glutationa, ácido ascórbico, carotenóides e α-tocoferol, bem como antioxidantes exógenos como os flavonóides, podem ser encontrados em plantas. Como exemplo, pode se citar o chá verde, que promove o seqüestro de radicais livres, uma atividade atribuída ao componente flavon-3-ol e respectivo galato, que inibem o estresse oxidativo celular (MIDDLETON et al., 2000). Como exemplos de agentes antioxidantes diterpênicos do tipo fenólicos, pode-se citar o carnosol, rosmanol e epirosmanol extraídos de Rosmarinus officinalis, planta originária do Mediterrâneo (ZENG et al., 2001). O extrato desta espécie vem sendo usado na medicina popular na prevenção de doenças cardiovasculares e também, na indústria cosmética. Esses derivados contêm hidroxilas fenólicas em posição orto que facilmente doam radical hidrogênio facilitando a reação com outros radicais livres endógenos ou exógenos formando produtos estáveis (ZENG et al., 2001). Diterpenos do Podocarpus nagi como o totarol e seus análogos, inibem a peroxidação lipídica. Esses diterpenos apresentam em sua estrutura o grupo isopropila em posição orto no anel fenólico, e atuam como antioxidantes que quebram a cadeia carbônica, gerando radicais livres (HARAGUCHI et al., 1997).
Pequenas quantidades dos ácidos fenólicos 4-hidroxi-3-metoxibenzóico (ácido vanílico) e ácido 4-hidroxibenzóico (0.005% na razão 87:13 respectivamente) e do ácido 2-metilamino-3-(4-hidroxifenil) propanóico (0,014%, conhecido como N-metiltirosina) (FIGURA 1), foram isolados das cascas do caule de Croton cajucara (MACIEL et al., 2006a). Os ácidos vanílico e 4-hidroxibenzóico são citados na literatura como agentes antioxidantes (HUNG; YEN, 2002; OHSUGI et al., 1999). Desta forma, reforçam o uso terapêutico das cascas do Croton cajucara, de resto já amplamente utilizadas na medicina tradicional brasileira (MACIEL et al., 2002).
Moléculas Sinalizadoras
As células animais possuem sistemas complexos de proteínas que possibilitam a interação com outras células através do envio de sinais, que podem ou não, permear a membrana. As moléculas sinalizadoras pertencem a duas classes: (i) moléculas muito grandes ou hidrofílicas, que interagem com receptores protéicos da superfície celular envolvendo proteíno-quinases, fosfatases, proteínas acopladas à proteína G e várias citocinas; e (ii) moléculas pequenas e hidrofóbicas que se difundem através da membrana celular (RANG et al., 2001). Esta segunda classe envolve os hormônios esteroidais, hormônios da tireóide, a vitamina D, o ácido retinóico, entre outros, que interagem com receptores que regulam a transcrição de genes, ou seja, as proteínas citosólicas ou intranucleares solúveis.
O fator de necrose, uma das moléculas sinalizadoras, foi descoberto por sua atividade antitumoral, e está relacionado também com a resposta imunológica e inflamatória. Trata-se de uma proteína produzida principalmente por macrófagos e monócitos entre outras células e, após ligação aos receptores da membrana, promove variadas atividades biológicas em órgãos e tecidos, tais como: nas células endoteliais induz a adesão (ICAM-1), iNOS, e estimulam as células T a produzir IL-2 e IFN-ã. O TNF tem atividade citotóxica ou citostática resultando em morte celular por apoptose. Já em altas doses, pode originar várias doenças como a caquexia associada ao câncer e AIDS, morte por choque séptico, e doenças imunológicas (DE VITA, 1997).
A espécie Croton cajucara Benth (Euphorbiaceae)
O Croton cajucara, conhecido vulgarmente por ‘sacaca’, é amplamente utilizado na região Amazônica e em outras regiões do país no controle dos diabetes, dos índices elevados de colesterol e de distúrbios gastrointestinais (gastrite, úlceras) (MACIEL et al., 2000, 2002, 2006a, 2006b). O primeiro estudo fitoquímico do Croton cajucara levou ao isolamento do diterpeno 19-nor-clerodano trans-desidrocrotonina (DCTN, FIGURA 1); na seqüência, outros clerodanos inéditos foram isolados (MACIEL, 1997; MACIEL et al., 2003, 2006a, 2006b). Pesquisas farmacológicas realizadas com o Croton cajucara comprovaram que a DCTN é um agente medicinal eficaz para vários tipos de doenças, dentre elas, destaca-se a ação antiestrogênica (LUNA-COSTA et al., 1999), antitumoral (GRYNBERG et al., 1999), antimutagênica (AGNER et al., 1999; 2001) e cardiovascular (SILVA et al., 2005).
Recentemente, também foi comprovada a ausência de mutagenicidade do extrato metanólico (EM; obtido das cascas do caule) deste Croton em células da medula óssea de camundongos Swiss albinos (SANTOS et al., 2006), não tendo sido observado aumento na freqüência de micronúcleos (MN). Anteriormente, a avaliação da DCTN como componente majoritário deste extrato, apontara para a não mutagenicidade deste clerodano (AGNER et al., 1999; 2001). Incentivados por estes resultados e levando em consideração o amplo uso popular do de Croton cajucara, a ação quimioprotetora de ambos, EM e DCTN, foi avaliada, em correlação com a citotoxicidade da ciclofosfamida, um quimioterápico usado como controle, cujo mecanismo de ação envolve a ação alquilante frente ao DNA. Para tanto, foram realizados experimentos na fase aguda e subcrônica com EM. Os resultados revelaram que os animais tratados com a menor concentração do EM (312,5 mg/Kg p.c.) tiveram uma redução na freqüência de células MN resultantes do tratamento com a ciclofosfamida apenas nas duas últimas semanas de tratamento. No entanto, concentrações mais elevadas (625 e 1250 mg/Kg p.c.) levaram a um efeito protetor durante todo o período de tratamento, com redução significativa da freqüência de MN produzidos pela ação da ciclofosfamida (SANTOS et al., 2006). Adicionalmente, o efeito quimioprotetor da DCTN foi avaliado em células da medula óssea de camundongos Swiss, utilizando-se testes de aberrações cromossômicas (AC) e micronúcleos (AGNER et al., 2001). Os animais foram submetidos a tratamentos intraperitoneal e gavagem, com uso concomitante das duas drogas (DCTN e ciclofosfamida), tendo sido sacrificados após 24h dos tratamentos. A dose de 25% da DL50 apresentou efeito antimutagênico em relação a ciclofosfamida somente para os animais submetidos ao tratamento via gavagem. Nas doses de 50 e 75% da DL50, a DCTN reduziu a genotoxicidade exercida pela ciclofosfamida (nas duas vias de administração), nos dois tipos de testes citogenéticos avaliados (MN e AC). Estes resultados confirmam o efeito antimutagênico da DCTN e do EM em células do sangue e da medula óssea, e sinalizam para a realização de novas investigações com a droga isolada (DCTN) ou com extratos brutos, visando o uso fitoterápico da espécie, que apresenta comprovada ação antitumoral e quimioprotetora. A ação antitumoral da DCTN (38 mg/Kg) foi comprovada em testes que avaliaram o tumor S180 (sarcoma 180) e o carcinoma de Ehrlich nas formas ascíticas, produzidos em camundongos (singênicos DBA/2 machos) por transplantes semanais (GRYNBERG et al., 1999). A inibição significativa da DCTN em menor dose (20 mg/Kg) foi recentemente confirmada em animais portadores de carcinoma de Ehrlich (MELO et al., 2004). Doses elevada de DCTN (120 mg/kg), utilizada no tratamento de animais portadores de carcinoma de Ehrlich, resultaram no aumento significativo do nível de TNF-á (GRYNBERG et al., 1999).
Toxicidade de Croton Cajucara
A toxicidade subaguda da DCTN foi investigada em ratos Wistar adultos. Os animais (40 machos e 40 fêmeas) foram aleatoriamente distribuídos em 4 grupos (1 controle e 3 tratados). A DCTN foi administrada por via oral na forma de suspensão em Tween 80 (12 %) nas doses de 25, 50 e 100 mg/Kg, durante 35 dias. Após este período, observou-se um aumento significativo no peso do fígado de todos os animais que receberam doses mais elevadas. A redução nos níveis de fosfatase alcalina e colesterol, bem como um aumento na γ-glutamil transpeptidase (na dose 100 mg/Kg) foi observado em ratas. A DCTN causou alterações histopatológicas no fígado, que incluiu tumefação turva, degeneração microvacuolar e alterações nucleares (RODRÍGUEZ et al., 2004).
A toxicidade aguda da DCTN foi observada por um período de 72 h após a administração oral. A DL50 da DCTN foi de 555,0 mg/Kg (v.o.) em camundongos, dez vezes mais alta do que a DE50 (CARVALHO et al., 1996). Neste estudo não foram detectados sintomas que justificassem a ação tóxica ao nível de sistema nervoso central, como estereotipia, ataxia e convulsão. A toxicidade aguda da DCTN foi também avaliada em camundongos Swiss machos. Após jejum de 12 h, os animais receberam tratamento com a DCTN por via oral (125, 250, 500, 750 e 1000 mg/Kg) e intraperitoneal (31, 25, 62,5; 125, 250 e 500 mg/kg). O número de sobreviventes foi monitorado duas vezes ao dia, num período de 14 dias. Os valores de DL50 obtidos por via oral e intraperitoneal foram de 876 mg/Kg (12 h) e de 47,2 mg/Kg, respectivamente. Os resultados obtidos mostraram a baixa toxicidade da DCTN (SOUZA-BRITO et al., 1998). A citotoxicidade da DCTN também foi avaliada em experimentos in vitro utilizando-se carcinoma de Ehrlich, bem como células leucêmicas K562 e HL60. Nestes ensaios, a DCTN só foi eficaz em doses elevadas (FREIRE et al., 2003; ANAZETTI et al., 2003, 2004).
Apesar dos estudos de toxicidade aguda e subcrônica da DCTN em animais demonstrarem baixa toxicidade, o uso indevido da sacaca (folhas com indicação de cascas em tratamentos prolongados) como remédio caseiro pode acarretar hepatite tóxica, bem como o uso das cascas em tratamentos prolongados. Pelo menos em duas cidades (Belém e Rio de Janeiro), o uso dessa planta já mostrou que pode provocar efeitos hepatotóxicos irreversíveis (SOARES, 2004; VEIGA JR. et al., 2005). Casos de hepatite aguda, crônica e fulminante foram notificados na região Amazônica e em outras regiões do país, em pacientes que fizeram uso da sacaca no controle de peso e redução dos níveis de colesterol (MACIEL et al., 2002). O hospital Universitário da Universidade Federal do Pará possui um histórico significativo de pessoas vitimadas por doenças do fígado, as quais estavam ingerindo folhas em prolongadas dietas de emagrecimento. No entanto, o alerta deste efeito tóxico das folhas desta planta já há tempos é propalado em Belém (PA); no entanto a população, mesmo avisada, persiste em consumir as folhas do Croton cajucara em dietas de emagrecimento. Neste caso, os usuários se dizem encorajados pelo percentual de pessoas que garantem ter emagrecido com saúde (SOARES, 2004; MACIEL et al., 2002). Estudo recente realizado em pacientes da região Amazônica, que fizeram uso da sacaca durante 36 meses registrou 25 casos de hepatotoxicidade atribuídos à sacaca, evidenciando-se hepatite aguda em 21 pessoas, hepatite crônica em 3 e hepatite fulminante em 1 (SOARES, 2004).
Nanotecnologia: uma alternativa terapêutica para o uso clínico da DCTN e de outros agentes antitumorais
A nanotecnologia farmacêutica representa uma das fronteiras multidisciplinares das ciências farmacêuticas, que visa o desenvolvimento de sistemas nanométricos carreadores de fármacos, com o objetivo de contribuir para o melhoramento da biodisponibilidade, através do controle da liberação, diminuição da toxicidade, complementados com a redução da dose terapêutica (RAVI-KUMAR, 2000). No final da década de 1960 houve uma evolução considerável na tecnologia farmacêutica, com pesquisas e desenvolvimento industrial de sistemas nanocarreadores de fármacos: micropartículas, nanopartículas e lipossomas, bem como sistemas de liberação controlada de fármacos (implantes e bioadesivos), visando o uso clínico. Concomitantemente, surgiram os desafios relacionados à tecnologia de fabricação, à eficácia e ao alto custo dos sistemas de vetorização e à liberação controlada dos fármacos. O planejamento racional e a otimização de parâmetros, tais como: biocompatibilidade, estabilidade, dimensões, esterilidade, controle da taxa de liberação, e sítio-especificidade do fármaco contribuíram para o avanço no sucesso destes sistemas (RATNER, 2002). Nos últimos anos, houve um considerável aumento no interesse das indústrias farmacêuticas na área de nanotecnologia, motivado pelo sucesso comercial de alguns produtos, associado à variedade nos processos de fabricação, à larga disponibilidade de materiais poliméricos, e por conseguinte, ao êxito obtido para um bom número de fármacos, que também promoviam uma versatilidade na produção para diferentes vias de administração. Estimou-se que a possibilidade de adoção de uma nova realidade terapêutica, representada pela incorporação de fármacos consagrados em sistemas nanocarreadores, poderia proporcionr uma diminuição de 20% nos custos, além de reduzir pela metade o período para lançamento de um novo medicamento, com relação à descoberta de novas moléculas bioativas (FENG et al., 2004). Estes sistemas têm como vantagens: (a) o aumento de maneira racional e efetiva da eficácia terapêutica, bem como a diminuição da toxicidade dos fármacos pela redução dos picos de concentração plasmática máxima, objetivando manter em nível constante o fármaco no sangue; (b) o controle e prolongação da liberação do fármaco, reduzindo a freqüência de doses; e (c) a otimização da atividade biológica, resultando em doses mais baixas devido a sítioespecificidade e à proteção da substância terapêutica de efeitos deletérios dos fluidos do organismo (BERKLAND et al., 2002).
Diversos trabalhos comprovaram o aumento da eficácia e a redução da toxicidade de substâncias bioativas (de origem natural ou sintética) administrados em lipossomas ou sistemas nanoparticulados. Dentre muitos exemplos, relatos mais recentes demonstram a atividade antitumoral do taxol (GUPTE; CIFTCI, 2004) e do ácido úsnico (Cladonia substellata) em microesferas (RIBEIRO-COSTA, 2004); da lectina de Cratylia mollis encapsulada em lipossomas (ANDRADE et al., 2004); de xantonas (TEIXEIRA et al., 2005); da doxorrubicina em nanopartículas (BARRAUD et al., 2001); de 5-fluorouracil em lipossomas (JIN et al., 2005); atividade antiparasitária do praziquantel em lipossomas (MOURÃO et al., 2005); atividade antibiótica da vancomicina em micropartículas (LE-RAY et al., 2005) e da anfotericina B em lipossomas (BELLOCCHIO et al., 2005); atividade hipoglicemiante da insulina em micropartículas (KIM et al., 2005) e antiestrógenos em lipossomas e nanopartículas para tratamento do câncer de mama (KIM et al., 2005; MAILLARD et al., 2005).
Fundamentado nos resultados promissores da atividade antitumoral da DCTN e sendo posta a sua eventual hepatotoxicidade (conforme relatado acima) este produto natural representa, portanto, um bom protótipo de fármaco a ser utilizado no desenvolvimento de nanossistemas de liberação controlada, seja como lipossomas, nanopartículas ou micropartículas. Para tanto, formulações da DCTN incorporada em micropartículas de copolímero de ácido lático e glicólico (PLGA) vêm sendo desenvolvidas pelo grupo de pesquisa em Sistemas de Liberação Controlada de Fármacos e Vacinas (LIKA - UFPE), com o objetivo de aumentar a eficácia terapêutica e minimizar possíveis efeitos hepatotóxicos causados por este fármaco, quando administrado na forma livre. A atividade hipoglicemiante da DCTN livre e microencapsulada está sendo avaliada em animais normais e hiperglicêmicos, tendo sido obtidos resultados preliminares promissores que provavelmente viabilizarão a otimização da biodisponibilidade deste produto natural (COSTA et al., 2006).
Referências
. AGNER, A.R.; MACIEL, M.A.M.; PINTO, A.C.; CÓLUS, I.M.S., Antigenotoxicity of trans--dehydrocrotonin, a clerodane diterpene from Croton cajucara. Planta Medica, v.67, n.9, p.815-819, 2001.
. AGNER, A.R.; MACIEL, M.A.M.; PINTO, A.C.; PAMPLONA, S.G.S.R.; CÓLUS, I.M.S. Investigation of genotoxicity activity of trans-dehydrocrotonin, a clerodane diterpene from Croton cajucara. Teratogenesis Carcinogenesis and Mutagenesis, v.19, n.6, p.377-384, 1999.
. AGOSTA, W.C. Medicines and drugs from plants. Journal of Chemical Education, v.74, n.7, p.857-860, 1997.
. ANAZETTI, M.C.; MELO, P.S.; DURÁN, N.; HAUN M. Comparative cytotoxicity of dimethylamidecrotonin in the promyelocytic leukemia cell line (HL60) and human peripheral blood mononuclear cells. Toxicology, v.188, n.2-3, p.261-274, 2003.
. ANAZETTI, M.C.; MELO, P.S.; DURÁN, N.; HAUN M. Dehydrocrotonin and its derivative, dimethylamide-crotonin induce apoptosiswith lipid peroxidation and activation of caspases-2, -6, and - 9 in human leukemic cells HL60. Toxicology, v.203, n.1-3, p.123-137, 2004.
. ANDRADE, C.A.; CORREIA, M.T.; COELHO, L.C., NASCIMENTO, S.C.; SANTOS-MAGALHÃES, N.S. Antintumor activity of Cratylia mollis lectin encapsulated into liposomes. International Journal of Pharmaceutics, v.278, n.2, p.435-445, 2004.
. ARLISS, R.M.; BIERMANN, C.A. Do soy isoflavones lower cholesterol, inhibit atherosclerosis, and play a role in cancer prevention? Holistic Nursing Practice, v.17, n.1, p.40-48, 2002.
. BALUNAS, M.J.; KINGHORN, A.D. Drug discovery from medicinal plants. Life Sciences, v.78, n.5, p.431-441, 2005.
. BARNES, S. Effect of genistein on in vitro and in vivo models of cancer. Journal of Nutrition, v.125, supl.3, p.777S-783S, 1995.
. BARRAUD, L.; MERLE, P.; SOMA, E.; LEFRANÇOIS, L.;GUERRET, S.; CHEVALLIER, M.; DUBERNET, C.; COUVREUR, P.; TREPO, C.; VITVITSKI, L. Increase of doxorubicin sensitivity by doxorubicin-loading into nanoparticles for hepatocellular carcinoma cells in vitro and in vivo. Journal of Hepatology, v.42, n.5, p.736-743, 2001.
. BELLOCCHIO, S.; GAZIANO, R.; BOZZA, S.; ROSSI, G.; MONTAGNOLI, C.; PERRUCCIO, K.; CALVITTI, M.; PITZURRA, L.; ROMANI, L. Liposomal amphotericin B activates antifungal resistance with reduced toxicity by diverting Toll-like receptor signalling from TLR-2 to TLR-4. Journal of Antimicrobial Chemotherapy, v.55, n.2, p.214-222, 2005.
. BERKLAND, C.; KING, M.; COX, A.; KIM, K.; PACK, D.W. Precise control of PLG microsphere size provides enhanced control of drug release rate. Journal of Controlled Release, v.82, n.1, p.137-147, 2002.
. BORMAN, S. Total synthesis of anticancer agent taxol achieved by two different routes. Chemical & Engineering News, v.72, p.32-34, 1994.
. BRADBURY, R. B.; WHITE, D. E. Chemistry of subterranean clover. I. Isolation of formononetin and genistein. Journal of Chemical Society, p.3447-3449, 1951.
. BRANDI, M.L. Natural and synthetic isoflavones in the prevention and treatment of chronic diseases. Calcified Tissue International, v.61, suppl.1, p.S5-S8, 1997.
. BRIDGES, B.A. International Commission for Protection Against Environmental Mutagens and Carcinogens. Report of ICPEMC Subcommittee 7/1. The possible involvement of somatic mutations in the development of atherosclerotic plaques. Atherosclerosis, v.89, n.2-3, p.255-261, 1991.
. BRIDGES, B.A.; BOWYER, D.E.; HANSEN, E.S.; PENN, A.; WAKABAYASHI, K. International Commission for Protection Against Environmental Mutagens and Carcinogens. The possible involvement of somatic mutations in the development of atherosclerotic plaques. Report of ICPEMC Subcommittee 7/1. Conclusions and recommendations. Mutation Research, v.239, n.3, p.143-148, 1990.
. BRIDGES, B.A. International Commission for Protection against Environmental Mutagens and Carcinogens. ICPEMC Topic No. 1. Are somatic mutations involved in atherosclerosis? Mutation Research, v.182, n.6, p.301-302, 1987.
. BRUSICK, D. Principles of Genetic Toxicology. Nova Iorque: Plenum Press, 2.ed., p.13, 1987.
. CALIXTO, J.B. Twenty-five years of research on medicinal plants in Latin America: a personal view. Journal of Ethnopharmacology, v.100, n.1-2, p.131-134, 2005.
. CARVALHO, J.C.T.; SILVA, M.F.C.; MACIEL, M.A.M.; PINTO, A.C.; NUNES, D.S.; LIMA, R.M.; BASTOS, J.K.; SARTI, S.J. Investigation of antiinflammatory and antinociceptive activities of trans-dehydrocrotonin, a 19-nor-clerodane diterpene from Croton cajucara. Part 1. Planta Medica, v.62, n.5, p.402-404, 1996.
. CASTRILLO, A.; DE LAS HERAS, B.; HORTELANO, S.; RODRÍGUEZ, B.; VILLAR, A.; BOSCÁ, L. Inhibition of the nuclear factor êB (NF-êB) pathway by tetracyclic kaurene diterpenes in macrophages. Specific effects on NF-êB-inducing kinase activity and on the coordinate activation of ERK and p38 MAPK. Journal of Biological Chemistry, v.276, n.19, p.15854-15860, 2001.
. CASTRO, A.; DEL CORRAL, J.M.M.; GORDALIZA, M.; GRANDE, C.; GÓMEZ-ZURITA, A.; GARCÍA-GRÁVALOS, D.; FELICIANO, A.S.; Synthesis and cytotoxicity of podophyllotoxin analogues modified in the A ring. European Journal of Medicinal Chemistry, v.38, n.1, p.65-74, 2003.
. CECHINEL FILHO, V.; YUNES, R.A. Strategies for obtaining pharmacologically active compounds from medicinal plants. Concepts about structural modification for improvement of activity. Quimica Nova, v.21, n.1, p.99-105, 1998.
. CHANG, A.Y.; KIM, K.; GLICK, J.; ANDERSON, T.; KARP, D.; JOHNSON, D. Phase II study of taxol, merbarone, and piroxantrone in stage IV non-small-cell lung cancer: The Eastern Cooperative Oncology Group Results, Journal of National Cancer Institute, v.85, n.5, p.388-394, 1993.
. CHAVES, M.H.; ROQUE, N.F.; AYRES, M.C.C. Steroids and flavonoids of Porcelia macrocarpa. Journal of the Brazilian Chemical Society, v.15, n.4, p.608-613, 2004.
. CHEESEMAN, K.H.; SLATER, T.F. An introduction to free radical biochemistry. British Medical Bulletin, v.49, n.3, p.481-493, 1993.
. CONKLIN, K.A. Dietary antioxidants during cancer chemotherapy: impact on chemotherapeutic effectiveness and development of side effects. Nutrition and Cancer, v.37, n.1, p.1-18, 2000.
. CORTESI, R.; ESPOSITO, E.; MAIETTI, A.; MENEGATTI, E.; NASTRUZZI, C. Formulation study for the antitumor drug camptothecin: liposomes, micellar solutions and a microemulsion. International Journal of Pharmaceutics, v.159, n.1, p.95-103, 1997.
. COSTA, M.P.; OLIVEIRA, A.L.M.; PAIXÃO, A.D.; MACIEL, M.A.M.; SANTOS-MAGALHÃES, N.S. In vivo hypoglycemic activity of DCTN-loaded microspheres. XXXV Reunião Anual da SBBq, Águas de Lindóia, SP, 2006.
. CRAGG, G. M.; NEWMAN, D.J. Plants as a source of anti-cancer agents. Journal of Ethnopharmacology, v.100, n.1-2, p.72-79, 2005.
. DE VITA, J.E.; HELLMAN, S.; ROSENBERG, S.A. Cancer, Principles & Practice of Oncology. Filadelfia: Lippincott-Raven Publishers, 5.ed., v.1, 1997.
. DIMAS, K.; DEMETZOS, C.; VAOS, V.; IOANNIDIS, P.; TRANGAS, T. Labdane type diterpenes down-regulate the expression of c-myc protein, but not of bcl-2, in human leukemia T-cells undergoing apoptosis. Leukemia Research, v.25, n.6, p.449-454, 2001.
. DIXON, R.A.; FERREIRA, D. Genistein. Phytochemistry, v.60, n.3, p.205-211, 2002.
. ELISABETSKY, E.; WANNMACHER, L. The status of ethnopharmacology in Brazil. Journal of Ethnopharmacology, v.38, n.2-3, p.137-143, 1993.
. ESPINOSA-AGUIRRE, J.J.; REYES, R.E.; RUBIO, J.; OSTROSKY-WEGMAN, P.; MARTINEZ, G. Mutagenic activity of urban air samples and its modulation by chili extracts. Mutation Research, v.303, n.2, p.55-61, 1993.
. FARNSWORTH, N.R.; MORRIS, R.W. Higher plants - the sleeping giant of drug development. American Journal of Pharmacy, v.148, n.2, p.46-52, 1976.
. FENG, S.S.; RUAN, G.; LI, Q.T. Fabrication and characterization of a novel drug delivery device liposomes-in-microspheres (LIM). Biomaterials, v.25, n.21, p.5181-5189, 2004.
. FREIRE A.C.G.; SILVA M.P.; AOYAMA H.; HAUN M.; DURAN N.; FERREIRA C.V. Cytotoxic effect of the diterpene lactone dehydrocrotonin from Croton cajucara on human promyelocytic leukemia cells. Planta Medica, v.69, n.1, p.67-69, 2003.
. GIRI, A.K.; MUKHOPADHYAY, A.; SUN, J.; HSIE, A.W.; RAY, S. Antimutagenic effects of centchromana contraceptive and a candidate drug for breast cancer in multiple mutational assays. Mutagenesis, v.14, n.6, p.613-619, 1999.
. GRYNBERG, N.F.; ECHEVARRIA, A.; LIMA, J.E.; PAMPLONA, S.G.S.R.; PINTO, A.C.; MACIEL, M.A.M. Anti-tumour activity of two 19-nor-clerodane diterpenes, trans-dehydrocrotonin and trans-crotonin, from Croton cajucara. Planta Medica, v.65, n.8, p.687-689, 1999.
. GUPTE, A.; CIFTCI, K. Formulation and characterization of Paclitaxel, 5-FU and Paclitaxel + 5-FU microspheres. International Journal of Pharmaceutics, v.276, n.1-2, p.93-106, 2004.
. HAMMONS, G.J.; FLETCHER, J.V.; STEPPS, K.R.; SMITH, E.A.; BALENTINE, D.A.; HARBOWY, M.E.; KADLUBAR, F.F. Effects of chemoprotective agents on the metabolic activation of the carcinogenic arylamines PhIP and 4-aminobiphenyl in human and rat liver microsomes. Nutrition and Cancer, v.33, n.1, p.46-52, 1999.
. HANSEN, E.S. International Commission for Protection Against Environmental Mutagens and Carcinogens. ICPEMC Working Paper 7/1/2. Shared risk factors for cancer and atherosclerosis - a review of the epidemiological evidence. Mutation Research, v.239, n.3, p.163-179, 1990.
. HARAGUCHI, H.; ISHIKAWA, H.; KUBO, I. Antioxidative action of diterpenoids from Podocarpus nagi. Planta Medica, v.63, n.3, p.213-215, 1997.
. HARBONE, J.B. (ed). The Flavonoids, Advances in Research Since 1986. London: Chapman and Hall, 1994.
. HAVSTEEN, B. Flavonoids, a class of natural products of high pharmacological potency. Biochemical Pharmacology, v.32, n.7, p.1141-1148, 1983.
. HE, L.; WANG, G.I.; ZHANG, Q. An alternative paclitaxel microemulsion formulation: hypersensitivity evaluation and pharmacokinetic profile. International Journal of Pharmaceutics, v.250, n.1, p.45-50, 2003.
. HERNAEZ, J.F.; XU, M.; DASHWOOD, R.H. Antimutagenic activity of tea towards 2-hydroxyamino-3-methylimidazo[4,5-f]quinoline: effect of tea concentration and brew time on electrophile scavenging. Mutation Research, v.402, n.1-2, p.299-306, 1998.
. HITT, E. Homoharringtonine effective in CML patients. Lancet Oncology, v.3, n.5, p.259, 2002.
. HOLMES, F.A.; WALTERS, R.S.; THERIAULT, R.L.; FORMAN, A.D.; NEWTON, L.K.; RABER, M.N.; BUZDAR, A.U.; FRYE, D.K.; HORTOBAGYI, G.N. Phase II trial of taxol, an active drug in the treatment of metastatic breast cancer. Journal of the National Cancer Institute, v.83, n.24, p.1797-1805, 1991.
. HONGJIE, Z.; TAKEDA, Y.; MATSUMOTO, T.; MINAMI, Y.; YOSHIDA, K.; WEI, X.; QING, M.; HANDONG, S. Taxol Related Diterpenes from the Roots of Taxus yunnanensis. Heterocycles, v.38, n.5, p.975-980, 1994.
. HORIGUCHI, T.; ORITANI, T.; KIYOTA, H. Synthesis and antitumor activity of 2-(m-substitutedbenzoyl)baccatin III analogs from taxinine. Tetrahedron, v.59, n.9, p.1529-1538, 2003a.
. HORIGUCHI, T.; RITHNER, C.D.; CROTEAU, R.; WILLIAMS, R.M. Studies on taxol biosynthesis. Preparation of 5á -acetoxytaxa-4(20),11-dien-2á,10â-diol derivatives by deoxygenation of a taxadiene tetra-acetate obtained from Japanese yew. Tetrahedron, v.59, n.2, p.267-273, 2003b.
. HUNG, C.H.; YEN, G.C. Antioxidant Activity of Phenolic Compounds Isolated from Mesona procumbens Hemsl. Journal of Agricultural and Food Chemistry, v.50, n.10, p.2993-2997, 2002.
. JABS, T. Reactive oxygen intermediates as mediators of programmed cell death in plants and animals. Biochemical Pharmacology, v.57, n.3, p.231-245, 1999.
. JACOB, J. The influence of variations in species and strains of experimental animals on drug responses. In: TEDESCHI, D.H.; TEDESCHI, R.E. (eds.). Importance of fundamental principles in drug evaluation. Nova Iorque: Raven Press, 1968.
. JEONG, Y.; SEO, S.; PARK, I.; LEE, H.; KANG, I.; AKAIKE, T.; CHO, C. Cellular recognition of paclitaxel-loaded polymeric nanoparticles composed of poly(ã-benzyl L-glutamate) and poly(ethylene glycol) diblock copolymer end-capped with galactose moiety. International Journal of Pharmaceutics, v.296, n.1-2, p.151-161, 2005.
. JIN, Y.; LI, J.; RONG, L.F.; LI, Y.H.; GUO, L.; XU, S.Y. Anti-hepatocarcinoma effects of 5-fluorouracil encapsulated by galactosylceramide liposomes in vivo and in vitro. World Journal of Gastroenterology, v.11, n.17, p.2643-2646, 2005.
. KANG, B.K.; CHON, S.K.; KIM, S.H.; JEONG, S.Y.; KIM, M.S.; CHO, S.H.; LEE, H.B.; KHANG, G. Controlled release of paclitaxel from microemulsion containing PLGA and evaluation of anti-tumor activity in vitro and in vivo. International Journal of Pharmaceutics, v.286, n.1-2, p.147-156, 2004.
. KATO, M.J. Global phytochemistry: the Brazilian approach. Phytochemistry, v.57, n.5 p.621-623, 2001.
. KELLER, L.; DUMAS, F.; D´ANGELO, J. Enantioselective synthesis of the ester side chain of homoharringtonine. Tereahedron Letters, v.42, n.10, p.1911-1913, 2001.
. KIM, B.Y.; JEONG, J.H.; PARK, K.; KIM, J.D. Bioadhesive interaction and hypoglycemic effect of insulin-loaded lectin-microparticle conjugates in oral insulin delivery system. Journal of Controlled Release, v.102, n.3, p.525-538, 2005.
. KINGHORN, A.D.; SEO, E.K. Cultivating the pharmacopoeia. CHEMTHEC, v.26, n.7, p.46-54, 1996.
. KINGSTON, D.G.I. The chemistry of taxol. Pharmacology & Therapeutics, v.52, n.1, p.1-34, 1991.
. KRIS, M.G.; O´CONNELL, J.P.; GRALLA, R.J.; WERTHEIM, M.S.; PARENTE, R.M.; SCHIFF, P.B.; YOUNG, C.W. Phase I trial of taxol given as a 3-hour infusion every 21 days. Cancer Treatment Reports, v.70, n.5, p.605-607, 1986.
. KUDOH, S.; NAKAMURA, S.; NAKANO, T.; KOMUTA, K.; ISOBE, T.; KATAKAMI, N.; FUKUDA, Y.; TAKADA, Y.; TAKADA, M.; FUKUOKA, M.; ARIYOSHI, Y. Irinotecan and etoposide for previously untreated extensivedisease small cell lung cancer: a phase II trial of West Japan Thoracic Oncology Group. Lung Cancer, v.49, n.2, p.263-269, 2005.
. LAEKEMAN, G.M.; CLAEYS, M.; RWANGABO, P.C.; HERMAN, A.G.; VLIETINCK, A.J. Cardiovascular effects of 3-methylquercetin. Planta Medica, n.6, p.433-437, 1986.
. LAHIRI, M.; MARU, G.B.; BHIDE, S.V. Effect of plant phenols, â-carotene and á-tocopherol on benzo[a]pyrene-induced DNA damage in the mouse forestomach mucosa (target organ) and bone marrow polychromatic erythrocytes (non-target organ). Mutation Research, v.303, n.2, p.97-100, 1993.
. LE-RAY, A.M.; GAUTIER, H.; LATY, M.K.; DACULSI, G.; MERLE, C.; JACQUELINE, C.; HAMEL, A.; CAILLON, J. In vitro and in vivo bactericidal activities of vancomycin dispersed in porous biodegradable poly(å-caprolactone) microparticles. Antimicrobial Agents and Chemotherapy, v.49, n.7, p.3025-3027, 2005.
. LEE, J.H.; KOO, T.H.; HWANG, B.Y.; LEE, J.J. Kaurane diterpene, kamebakaurin, inhibits NF-êB by directly targeting the DNA-binding activity of p50 and blocks the expression of antiapoptotic NFêB target genes. Journal of Biological Chemistry, v.277, n.21, p.18411-18420, 2002.
. LOHMAN, P.H.M. International Commission for the Protection of the Environment against Mutagens and Carcinogens: A historical perspective. Mutatation Research, v.511, n.1, p.63-71, 2002.
. LUNA-COSTA, A.M.; SILVA, J.C.R.; CAMPOS, A.R.; RAO, V.S.N.; MACIEL, M.A.M.; PINTO, A.C. Antiestrogenic effect of trans-dehydrocrotonin, a nor-clerodane diterpene from Croton cajucara. Phytotherapy Research, v.13, n.8, p.689-691, 1999.
. MA, W.; PARK, G.L.; GOMEZ, G.A.; NIEDER, M.H.; ADAMS, T.L.; AYNSLEY, J.S.; SAHAI, O.P.; SMITH, R.J.; STAHLHUT, R.W.; HYLANDS, P.J.; BITSCH, F.; SHACKLETON, C. New bioactive taxoids from cell cultures of Taxus baccata, Journal of Natural Products, v.57, n.1, p.116-122, 1994.
. MACIEL, M.A.M., DANTAS, T.N.C., CÂMARA, J.K.P., PINTO, A.C., VEIGA JR., V.F., KAISER, C.R., PEREIRA, N.A., CARNEIRO, C.M.T.S., VANDERLINDE, F.A., LAPA A.J., AGNER, A.R., CÓLLUS, I.M.S., ECHEVARRIA-LIMA, J., GRYNBERG, N.F., ESTEVES-SOUZA, A., PISSINATE, K., ECHEVARRIA A. Pharmacological and biochemical profiling of lead compounds from traditional remedies: the case of Croton cajucara. In: Advances in Phytomedicine (Lead molecules from natural products, Discovery and New Trends), Eds. Khan, M.T.H.; Ather, A., v.2, chapter 14, p.229-257, 2006a.
. MACIEL, M.A.M.; CORTEZ, J.K.P.C.; GOMES, F.E.S. O gênero Croton e aspectos relevantes de diterpenos clerodanos. Fitos, v.2, p.54-73, 2006b.
. MACIEL, M.A.M.; PINTO, A.C.; KAISER, C.R. NMR and structure review of some natural fluroclerodanes. Magnetic Resonance in Chemistry, v.41, n.4, p.278-282, 2003.
. MACIEL, M.A.M.; PINTO, A.C.; VEIGA JR., V.F.; ECHEVARRIA, A.; GRYNBERG, N.F. Plantas medicinais: a necessidade de estudos multidisciplinares. Quimica Nova, v.25, n.3, p.429-438, 2002.
. MACIEL, M.A.M.; PINTO, A.C.; ARRUDA, A.C.; PAMPLONA, S.G.S.R.; VANDERLINE, F.A.; LAPA, A.J.; ECHEVARRIA, A.; GRYNBERG, N.F.; CÔLUS, I.M.S.; FARIAS, R.A.F.; LUNA COSTA, A.M.; RAO, V.S.N. Ethnopharmacology, phytochemistry and pharmacology: a successful combination in the study of Croton cajucara. Journal of Ethnopharmacology, v.70, n.1, p.41-55, 2000.
. MACIEL, M.A.M. Croton cajucara: uma escolha etnobotânica. Tese de Doutorado em Química: IQ, UFRJ; Rio de Janeiro; RJ; Brasil, 1997.
. MAILLARD, S.; AMELLER, T.; GAUDUCHON, J.; GOUGELET, A.; GOUILLEUX, F.; LEGRAND, P.; MARSAUD, V.; FATTAL, E.; SOLA, B.; RENOIR, J.M. Innovative drug delivery nanosystems improve the anti-tumor activity in vitro and in vivo of antiestrogens in human breast cancer and multiple myeloma. Journal of Steroid Biochemistry and Molecular Biology, v.94, n.1-3, p.111-121, 2005.
. MELO, P.S.; JUSTO, G.Z.; DURÁN, N.; HAUN, M. Natural killer cell activity and anti-tumor effects of dehydrocrotonin and its synthetic derivatives. European Journal of Pharmacology, v.487, n.1-3, p.47-54, 2004.
. MIDDLETON JR., E.; KANDASWAMI, C. Effects of flavonoids on immune and inflammatory cell functions. Biochemical Pharmacology, v.43, n.6, p.1167-1179, 1992.
. MIDDLETON JR., E.; KANDASWAMI, C.; THEOHARIDES, T.C. The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease, and cancer. Pharmacological Reviews, v.52, n.4, p.673-751, 2000.
. MILLER III, M.C.; JOHNSON, K.R.; WILLINGHAM, M.C.; FAN, W. Apoptotic cell death induced by baccatin III, a precursor of paclitaxel, may occur without G2/M arrest. Cancer Chemotherapy and Pharmacology, v.44, n.6, p.444-452, 1999.
. MILLER, D.S.; BLESSING, J.A.; SCHILDER, J.; MUNKARAH, A.; LEE, Y.C. Phase II evaluation of topotecan in carcinosarcoma of the uterus: A Gynecologic Oncology Group study. Gynecologic Oncology, v.98, n.2, p.217-221, 2005.
. MITCHELMORE, C.L.; CHIPMAN, J.K. DNA strand breakage in aquatic organisms and the potential value of the comet assay in environmental monitoring. Mutation Research, v.399, n.2, p.135-147, 1998.
. MITSCHER, L.A.; TELIKEPALLI, H.; MCGHEE, E.; SHANKEL, D.M. Natural antimutagenic agents. Mutation Research, v.350, n.1, p.143-152, 1996.
. MIYAZAWA, M.; SAKANO, K.; NAKAMURA, S.; KOSAKA, H. Antimutagenic Activity of Isoflavones from Soybean Seeds (Glycine max Merrill). Journal of Agricultural and Food Chemistry, v.47, n.4, p.1346-1349, 1999.
. MOURÃO, S.C.; COSTA, P.I.; SALGADO, H.R.; GREMIÃO, M.P. Improvement of antischistosomal activity of praziquantel by incorporation into phosphatidylcholine-containing liposomes. International Journal of Pharmaceutics, v.295, n.1, p.157-162, 2005.
. MUKUNDAN, M.A.; CHACKO, M.C.; ANNAPURNA, V.V.; KRISHNASWAMY, K. Effect of turmeric and curcumin on BP-DNA adducts. Carcinogenesis, v.14, n.3, p.493-496, 1993.
. MURPHY, W.K.; FOSSELLA, F.V.; WINN, R.J.; SHIN, D.M.; HYNES, H.E.; GROSS, H.M.; DAVILLA, E.; LEIMERT, J.; DHINGRA, H.; RABER, M.N.; KRAKOFF, I.H.; HONG, W.K. Phase II study of taxol in patients with untreated advanced non-small-cell lung cancer, Journal of National Cancer Institute, v.85, n.5, p.384-388, 1993.
. MUZITANO, M.F.; COSTA, S.S. Produtos Naturais e a Apoptose: Um Enfoque Promissor para a Descoberta de Novos Fármacos. Fitos, v.2, n.2, p.46-53, 2006
. NADEEM, M.; RIKHARI, H.C.; KUMAR, A.; PALNI, L.M.S.; NANDI, S.K. Taxol content in the bark of Himalayan yew in relation to tree age and sex. Phytochemistry, v.60, n.6, p.627-631, 2002.
. NAKAGAWA, H.; YAMAMOTO, D.; KIYOZUKA, Y.; TSUTA, K.; UEMURA, Y.; HIOKI, K.; TSUTSUI, Y.; TSUBURA, A. Effects of genistein and synergistic action in combination with eicosapentaenoic acid on the growth of breast cancer cell lines. Journal of Cancer Research and Clinical Oncology, v.126, n.8, p.448-454, 2000.
. OHSUGI, M.; FAN, W.; HASE, K.; XIONG, Q.; TEZUKA, Y.; KOMATSU, K.; NAMBA, T.; SAITOH, T.; TAZAWA, K.; KADOTA, S. Active-oxygen scavenging activity of traditional nourishing-tonic herbal medicines and active constituents of Rhodiola sacra. Journal of Ethnopharmacology, v.67, n.1, p.111-119, 1999.
. PENN, A. ICPEMC working paper 7/1/1: mutational events in the etiology of arteriosclerotic plaques. Mutation Research, v.239, n.3, p.149-162, 1990.
. PINTO, A.C.; REZENDE, C.M.; GARCEZ, F.R.; EPIFANIO, R.A. An overview of the Brazilian natural product community. Quimica Nova, v.26, n.6, p.966-971, 2003.
. PINTO, A.C.; SILVA, D.H.S.; BOLZANI, V.S.; LOPES, N.P.; EPIFANIO, R.A. Current status, challenges and trends on natural products in Brazil. Quimica Nova, v.25, supl.1, p.45-61, 2002.
. POLKOWSKI, K.; MAZUREK, A.P. Biological properties of genistein: A review of in vitro and in vivo data. Acta Poloniae Pharmaceutica, v.57, n.2, p.135-155, 2000.
. POTIER, P. Search and discovery of new antitumor compounds. Chemical Society Reviews, v.21, n.2, p.113-119, 1992.
. PUPO, M.T.; ADORNO, M.A.T.; VIEIRA, P.C.; FERNANDES, J.B.; SILVA, M.F.G.F.; PIRANI, J.R. Terpenoids and steroids from Trichilia species. Journal of the Brazilian Chemical Society, v.13, n.3, p.382-388, 2002.
. QUOIX, E.; BRETON, J.; GERVAIS, R.; WILSON, J.; SCHRAMEL, F.; CARDENAL, F.; ROSS, G.; PRESTON, A.; LYMBOURA, M.; MATTSON, K. A randomised phase II study of the efficacy and safety of intravenous topotecan in combination with either cisplatin or etoposide in patients with untreated extensive disease small-cell lung cancer. Lung Cancer, v.49, n.2, p.253-261, 2005.
. RANG, H.P.; DALE, M.M.; RITTER, J.M. Farmacologia. Rio de Janeiro: Guanabara Koogan, 4.ed., 2001.
. RATNER, B.D. Reducing capsular thickness and enhancing angiogenesis around implant drug release systems. Journal of Controlled Release, v.78, n.1-3, p.211-218, 2002.
. RAVI-KUMAR, M.N.V. Nano and microparticles as controlled drug delivery devices. Journal of Pharmacy & Pharmaceutical Sciences. v.3, n.2, p.234-258, 2000.
. REDDY, L.H.; SHARMA, R.K.; CHUTTANI, K.; MISHRA, A.K.; MURTHY, R.S.R. Influence of administration route on tumor uptake and biodistribution of etoposide loaded solid lipid nanoparticles in Dalton’s lymphoma tumor bearing mice. Journal of Controlled Release, v.105, n.3, p.185-198, 2005.
. REDDY, L.; ODHAV, B.; BHOOLA, K.D. Natural products for cancer prevention: A global perspective. Pharmacology & Therapeutics, v.99, n.1, p.1-13, 2003.
. RIBEIRO-COSTA, R.M.; ALVES, A.J.; SANTOS, N.P.; NASCIMENTO, S.C.; GONÇALVES, E.C.P.; SILVA, N.H.; HONDA, N.K.; SANTOSMAGALHÃES, N.S. In vitro and in vivo properties of usnic acid encapsulated into PLGA-microspheres. Journal of Microencapsulation, v.21, n.4, p.371-384, 2004.
. RICE-EVANS, C.A.; MILLER, N.J.; BOLWELL, P.G.; BRAMLEY, P.M.; PRIDHAM, J.B. The relative antioxidant activities of plant-derived polyphenolic flavonoids. Free Radical Research, v.22, n.4, p.375-383, 1995.
. RODRÍGUEZ, J.A.; HIRUMA-LIMA, C.A.; SOUZA BRITO, A.R.M. Antiulcer activity and subacute toxicity of trans-dehydrocrotonin from Croton cajucara. Human and Experimental Toxicology, v.23, n.9, p.455-461, 2004.
. SAITO, K.; KOIKE, Y.; SUZUKI, H.; MURAKOSHI, I. Biogenetic implication of lupine alkaloid biosynthesis in bitter and sweet forms of Lupinus luteus and L. albus. Phytochemistry, v.34, n.4, p.1041-1044, 1993.
. SANTOS, F.V.; MESQUITA, S.F.P.; FARIA, M.J.S.S.; POERSH, A.; MACIEL, M.A.M.; PINTO, A.C.; MORIMOTO, H.K.; CÓLUS, I.M.S. Absence of mutagenicity in somatic and germ cells of mice submitted to subchronic treatment with an extract of Croton cajucara Benth. (Euphorbiacae). Genetic and Molecular Biology, v.29, n.1, p.159-165, 2006.
. SETCHELL, K.D.R.; CASSIDY, A. Dietary isoflavones: Biological effects and relevance to human health. Journal of Nutrution, v.129, n.3, p.758S-767S, 1999.
. SHAMON, L.A.; PEZZUTO, J.M. Plant antimutagens: Review and strategy for the identification of therapeutically useful agents. In: Economic and Medicinal Plant Research. Nova Iorque: Academic Press, p.235, 1994.
. SHUGART, L.R. Environmental genotoxicology. In: RAND, G.M. Fundamentals of aquatic toxicology: Effects, environmental fate and risk assessment. Washington: Taylor & Francis, 2.ed., p.405, 1995.
. SILVA, R.M.; OLIVEIRA, F.M.; CUNHA, K.M.A; MAIA, J.L.; MACIEL, M.A.M.; PINTO, A.C.; NASCIMENTO, N.R.F.; SANTOS, F.A.; RAO, V.S.N. Cardiovascular effects of trans-dehydrocrotonin, a diterpene from Croton cajucara in rats. Vascular Pharmacology, v.43, n.1, p.11-18, 2005.
. SLUPPHAUG, G.; KAVLI, B.; KROKAN, H.E. The interacting pathways for prevention and repair of oxidative DNA damage. Mutation Research, v.531, n.1-2, p.231-251, 2003.
. SOARES, M.P. Would sacaca, Croton cajucara Benth. (Euphorbiaceae) be an hepatotoxic plant like Germander, Teucrium chamaedrys L. (Labiatae)? Revista da Sociedade Brasileira de Medicina Tropical, v.37, n.2, p.96-97, 2004.
. SOLOMON, P.R.; ADAMS, F.; SILVER, A.; ZIMMER, J.; DEVEAUX, R. Ginkgo for memory enhancement: a randomized controlled trial. Journal of the American Medical Association, v.288, n.7, p.835-840, 2002.
. SOUZA-BRITO, A.R.; SOUZA-BRITO, A.A. Forty years of Brazilian medicinal plant research. Journal of Ethnopharmacology, v.39, n.1, p.53-67, 1993.
. SOUZA-BRITO, A.R.M.; RODRÍGUEZ, J.A.; HIRUMA-LIMA, C.A.; HAUN, M.; NUNES, D.C. Antiulcerogenic activity of trans-dehydrocrotonin from Croton cajucara. Planta Medica, v.64, n.2, p.126-129, 1998.
. SUFFNESS, M. Taxol: from discovery to therapeutic use. Annual Reports in Medicinal Chemistry, v.28, p.305-314, 1993.
. TANAKA, T.; KAWAMORI, T.; OHNISHI, M.; OKAMOTO, K.; MORI, H.; HARA, A. Chemoprevention of 4-nitroquinoline 1-oxideinduced oral carcinogenesis by dietary protocatechuic acid during initiation and postinitiation phases. Cancer Research, v.54, n.9, p.2359-2365, 1994.
. TEIXEIRA, M.; ALONSO, M.J.; PINTO, M.M.M. ; BARBOSA, C.M. Development and characterization of PLGA nanospheres and nanocapsules containing xanthone and 3-methoxyxanthone. European Journal of Pharmaceutics and Biopharmaceutics, v.59, n.3, p.491-500, 2005.
. VAGELOS, P.R. Are prescription drug prices high? Science, v.252, n.5010, p.1080-1084, 1991.
. VAN-GOETHEM, F.; LISON, D.; KIRSCHVOLDERS, M. Comparative evaluation of the in vitro micronucleus test and the alkaline single cell gel electrophoresis assay for the detection of DNA damaging agents: genotoxic effects of cobalt powder, tungsten carbide and cobalt-tungsten carbide. Mutation Research, v.392, n.1-2, p.31-43, 1997.
. VEIGA Jr., V.F.; PINTO, A.C.; MACIEL, M.A.M. Plantas Medicinais: Cura segura? Química Nova, v.28, n.3, p.519-528. 2005.
. VENKATRAMAN, S.S.; JIE, P.; MIN, F.; FREDDY, B.Y.C.; LEONG-HUAT, G. Micelle-like nanoparticles of PLA-PEG-PLA triblock copolymer as chemotherapeutic carrier. International Journal of Pharmaceutics, v.298, n.1, p.219-232, 2005.
. VERHAGEN, H.; ARUOMA, O.I.; VAN DELFT, J.H.M.; DRAGSTED, L.O.; FERGUSON, L.R.; KNASMÜLLER, S.; POOL-ZOBEL, B.L.; POULSEN, H.E.; WILLIAMSON, G.; YANNAI, S. The 10 basic requirements for a scientific paper reporting antioxidant, antimutagenic or anticarcinogenic potential of test substances in in vitro experiments and animal studies in vivo. Food and Chemical Toxicology, v.41, n.5, p.603-610, 2003.
. VIEGAS JR., C.; BOLZANI, V.S.; BARREIRO, E.J. Natural products and modern medicinal chemistry. Química Nova, v.29, n.2, p.326-337, 2006.
. VISANI, G.; RUSSO, D.; OTTAVIANI, E.; TOSI, P.; DAMIANI, D.; MICHELUTTI, A.; MANFROI, S.; BACCARANI, M.; TURA, S. Effects of homoharringtonine alone and in combination with alpha interferon and cytosine arabinoside on “in vitro” growth and induction of apoptosis in chronic myeloid leukemia and normal hematopoietic progenitors. Leukemia, v.11, n.5, p.624-628, 1997.
. VITAGLIONE, P.; FOGLIANO, V. Use of antioxidants to minimize the human health risk associated to mutagenic/ carcinogenic heterocyclic amines in food. Journal of Chromatography B, v.802, n.1, p.189-199, 2004.
. VORONKOV, M.V.; GONTCHAROV, A.V.; WANG, Z.M. Improved large-scale synthesis of phenylisoserine and the taxol C-13 side chain. Tetrahedron Letters, v.44, n.2, p.407-409, 2003.
. WAKABAYASHI, K. International Commission for Protection Against Environmental Mutagens and Carcinogens. ICPEMC Working Paper 7/1/3. Animal studies suggesting involvement of mutagen/ carcinogen exposure in atherosclerosis. Mutation Research, v.239, n.3, p.181-187, 1990.
. WALTON, N.J.; MAYER, M.J.; NARBAD, A. Vanillin. Phytochemistry, v.63, n.5, p.505-515, 2003.
. WHO Traditional Medicines Strategy 2002-2005, Genebra, 2002.
. YANG, S.S.; CRAGG, G.M.; NEWMAN, D.J.; BADER, J.P. Natural Product-Based Anti-HIV Drug Discovery and Development Facilitated by the NCI Developmental Therapeutics Program. Journal of Natural Products, v.64, n.2, p.265-277, 2001.
. ZENG, H.H.; TU, P.F.; ZHOU, K.; WANG, H.; WANG, B.H.; LU, J.F. Antioxidant properties of phenolic diterpenes from Rosmarinus officinalis. Acta Pharmacologica Sinica, v.22, n.12, p.1094-1098, 2001.
. ZIOTOPOULOS, P.; ANDROULAKIS, N.; MYLONAKI, E.; CHANDRINOS, V.; ZACHARIADIS, E.; BOUKOVINAS, I.; AGELIDOU, A.; KENTEPOZIDIS, N.; IGNATIADIS, M.; VOSSOS, A.; GEORGOULIAS, V. Front-line treatment of advanced non-small cell lung cancer with irinotecan and docetaxel: a multicentre phase II study. Lung Cancer, v.50, n.1, p.115-122, 2005. chemotherapeutic carrier. International Journal of Pharmaceutics, v.298, n.1, p.219-232, 2005.