Artigo Original
Determinação de Cumarina em Extratos de Guaco Comercial: Um Estudo de Caso sobre o Controle de Qualidade de Fitoterápicos
Coumarin determination in Commercial Extracts of Guaco: A Case Study of the Quality Control of Phytotherapics
Resumo
Os fitoterápicos necessitam de um controle de qualidade da produção (plantio, secagem, armazenamento) e da comercialização do produto acabado. Para isso, deve-se garantir o resultado da análise qualitativa e quantitativa dos princípios ativos, a fim de comprovar que não houve degradação, de modo que os mesmos não percam suas características. Para a avaliação de qualidade de um fitoterápico foi utilizado o guaco comercial como exemplo de caso. O guaco é muito utilizado como brônquio-dilatador no Brasil, sendo a cumarina o principal metabólito secundário responsável por esta atividade farmacológica desta espécie. Neste artigo é descrito um método simples e seletivo para extração e determinação via Cromatografia Gasosa (CG) do teor de cumarina em guaco, comercializado como Mikania glomerata Sprengel. Foram utilizadas amostras de sete distribuidoras de diferentes Estados do Brasil, sendo os resultados confrontados com as normas da Agência Nacional de Vigilância Sanitária (ANVISA), que recomenda uma dose diária máxima de 4,89 mg. As amostras comerciais de guaco mostraram estar de acordo com as recomendações da ANVISA. Contudo, a variação de cumarina observada de uma distribuidora para outra (1,41 mg a 4,48 mg por grama de folha) mostra a necessidade de padronização, para garantir o consumo seguro deste fitoterápico. O método permitiu a quantificação rápida e simples de cumarina em guaco comercial, mostrando uma recuperação de 90,22 ± 0,32%.
- Unitermos:
- Fitoterápicos.
- Controle de Qualidade.
- Guaco.
- Cumarina.
Abstract
Phytotherapics need a quality control of production (planting, drying and storage) and the finish product commercialization. For that, it is necessary to get the results of qualitative and quantitative analysis of the active compounds, showing that there was no degradation and lost of pharmacological properties. This article describe a selective method of extraction and coumarin quantification in commercial samples of guaco by gas chromatography (GC), commercialized as Mikania glomerata Sprengel. For this end, seven commercial samples were used from different States of Brazil. The results were confronted with the rules of the National Health Surveillance Agency (ANVISA), Brazilian agency that regulates and registers medicines, which recommends a daily maximum dose of 4.89 mg. Guaco is an important bronchodilatator used in Brazil, whose biological activity comes from coumarin. The commercial samples of guaco were according to ANVISA’s Recommendations. However, the wide range of coumarin noticed (1.41 mg to 4.48 mg for leaf gram) shows that the commercial samples need to be standardized, getting a safe consumption of this phytotherapic. The method allowed a fast and simple quantification of coumarin in commercial samples of guaco, showing a recovery of 90.22 ± 0.32%.
- Key words:
- Phytotherapics.
- Quality Control.
- Guaco.
- Coumarin.
Introdução
No Brasil, o uso de plantas medicinais pela população com a finalidade de tratar enfermidades foi sempre expressivo, principalmente devido à extensa e diversificada flora. Com base na evolução histórica do uso de plantas medicinais e aromáticas a Organização Mundial de Saúde (OMS), em 1978, passa a reconhecer a fitoterapia como terapia alternativa de enfermidades humanas de eficácia comprovada (VIEIRA, 1992). Segundo a Resolução RDC nº 48 (BRASIL, 2004a) da Agência Nacional de Vigilância Sanitária - ANVISA/MS, fitoterápico é o medicamento obtido empregando-se exclusivamente matérias-primas ativas vegetais. Devido ao crescente interesse da população e de órgãos governamentais por terapias alternativas e produtos naturais, atualmente o mercado de plantas medicinais e aromáticas vem crescendo de forma expressiva em todo o mundo, inclusive no Brasil. O mercado mundial de fitoterápicos está avaliado em US$ 12,4 bilhões, o que representa 5% do mercado internacional de produtos farmacêuticos. Deste montante, US$ 355 milhões são gerados por medicamentos produzidos a partir de espécies vegetais brasileiras (FERREIRA, 1998).
Seguindo essa tendência, através da Portaria nº 971 (BRASIL, 2006) do Conselho Nacional de Saúde/ MS foi estabelecida a política Nacional de Práticas Integrativas e Complementares-PNPIC no Sistema Único de Saúde-SUS. A finalidade, entre outras, foi estabelecer financiamento para o desenvolvimento de ações voltadas à implantação das plantas medicinais e fitoterápicos no SUS. Além disso, visa garantir o monitoramento dos fitoterápicos pelo Serviço Nacional de Vigilância Sanitária-SNVS. Isto porque, segundo a Resolução RE nº 89 (BRASIL, 2004b) da Agência Nacional de Vigilância Sanitária - ANVISA/MS, somente os fitoterápicos que fazem parte da Lista de Registro Simplificado de Fitoterápicos-LRSF da ANVISA, estão liberados para serem comercializados por empresas que possuam o Certificado de Boas Práticas de Fabricação e Controle-CBPFC (NETTO et al., 2006).
Dentre os fitoterápicos que fazem parte da LRSF está o guaco (Mikania glomerata Sprengel). Tratase de uma planta que pertence à família Compositae, gênero Mikania, sendo empregada para tratamento de doenças respiratórias como bronquite, tosse e asma (MARTINS et al., 1995; PANIZZA, 1997). É comercializado principalmente nas formas de extrato fluido, tintura, xarope, in natura e planta seca. A Mikania glomerata Sprengel apresenta muitas outras atividades farmacológicas, entre elas fungicida, antimicrobiana, antiinflamatória (FIERRO et al., 1999; MOURA et al., 2001; PEREIRA et al., 1994). Além disso, é relatada a sua atividade antiofídica, pois de acordo com a tradição popular o extrato aquoso é usado como um antídoto contra o veneno de certas serpentes (CORREA, 1984; CRUZ, 1965; MAIORANO et al., 2005; OLIVEIRA et al., 1985; RUPPELT et al., 1991). Esta planta contém a cumarina (FIGURA 1) como um dos principais metabólitos secundários, sendo responsável pela atividade do guaco em seu efeito brônquio-dilatador (LEITE et al., 1993).
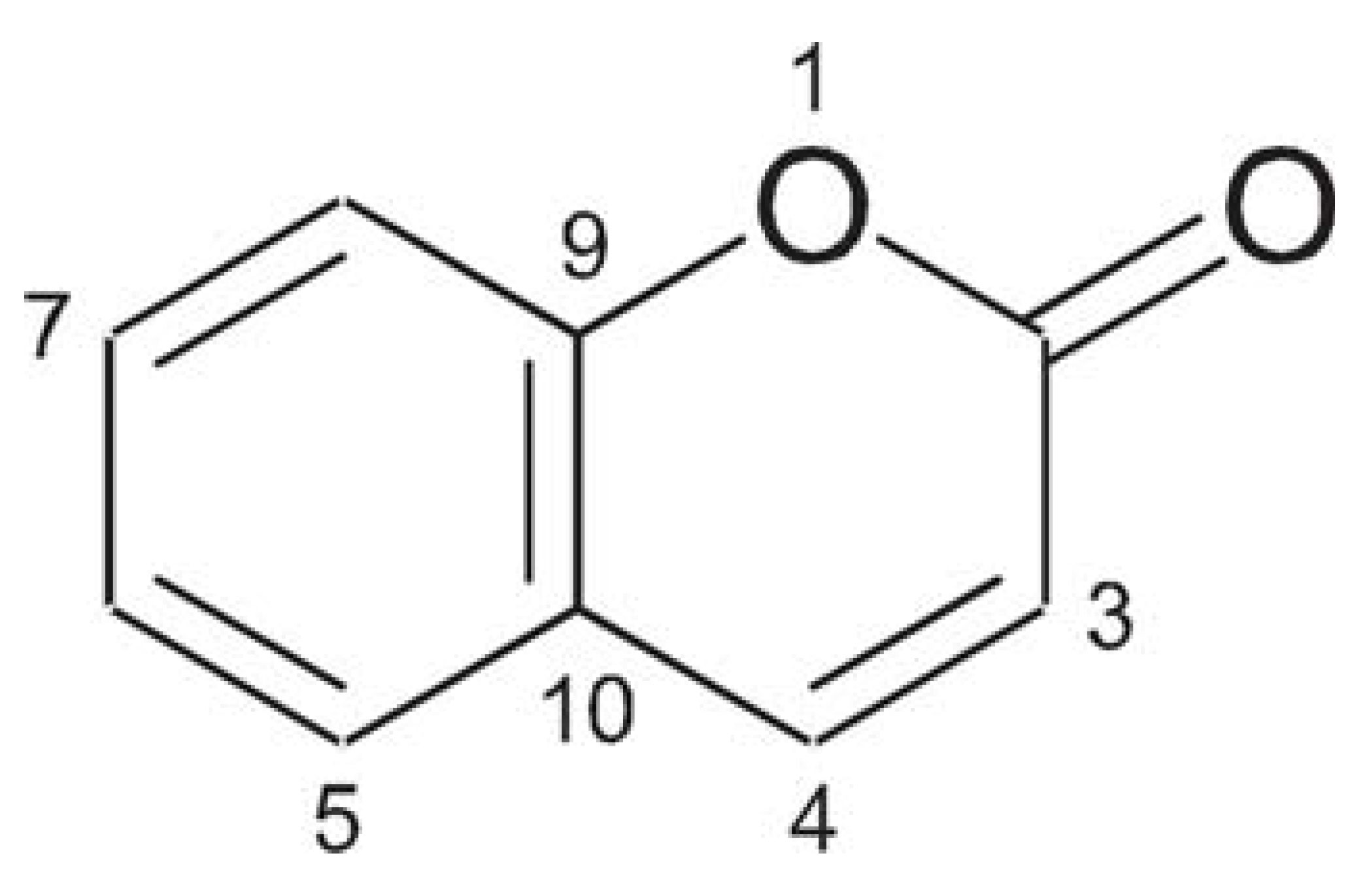
Vários estudos relatam a presença de diversas substâncias na Mikania glomerata Sprengel, sendo as principais, além da cumarina, o ácido caurenóico, ácido cinamoilgrandiflórico, estigmasterol, friedelina, lupeol e acetato de lupeol (CABRAL et al., 2001; CELEGHINI et al., 2001; VENEZIANI et al., 1999; VILEGAS et al., 1997; VILEGAS et al., 1997). O interesse na quantificação de cumarina no guaco tem grande importância não somente devido as suas comprovadas atividades farmacológicas, mas também devido aos problemas colaterais pelo uso excessivo, tais como vômitos, diarréias e hipertensão, além de não poder ser usado por mulheres durante o ciclo menstrual, pois causa aumento do fluxo sangüíneo (NOLLA, 2005).
Qualquer fitoterápico necessita de controle de qualidade do produto acabado comprovando, através de análise quantitativa, a presença dos princípios ativos característicos ou mesmo se houve degradação como, por exemplo, devido às variações sazonais que muitas vezes influenciam drasticamente em seus teores (NETTO et al., 2006). É desejável que os métodos empregados para o controle de qualidade apresentem um mínimo de complexidade e custos, de forma a não encarecer demais o fitoterápico, senão este deixaria de ser interessante comercialmente. Nesta linha de penasamento, o presente trabalho relata a determinação quantitativa do teor de cumarina, e as variações, no fitoterápico guaco comercializado como Mikania glomerata Sprengel por diferentes distribuidoras, como parte de um estudo de caso sobre o controle de qualidade de fitoterápicos disponíveis no mercado.
Os métodos quantitativos para a determinação de cumarina na espécie de Mikania glomerata Sprengel são baseados em Cromatografia Líquida de Alta Eficiência (CLAE) e Cromatografia a Gás (CG), que estão bem descritos na literatura (CABRAL et al., 2001; CELEGHINI et al., 2001; VENEZIANI et al., 1999; VILEGAS et al., 1997; VILEGAS et al., 1997). Para determinação de cumarina nesse trabalho, utilizou-se do fitoterápico comercial guaco, como planta seca e na forma de extrato aquoso (chá), pois este é o principal modo de uso popular. Através de uma extração simples e de uma análise quantitativa contra um padrão interno por Cromatografia a Gás (CG), verificou-se a variação do teor de cumarina de diversos fornecedores. Os resultados obtidos foram ainda comparados com as recomendações da ANVISA, que delimita a dose diária máxima de cumarina de 4,89 mg de acordo com a Lista de Registro Simplificado de Fitoterápicos (Resolução RE nº 89, de 16 de março de 2004).
Material e Métodos
Cumarina (99%) e o clorofórmio foram adquiridos da Merck (Brasil). Na2SO4 anidro, n-hexano (85%), diclorometano e éter etilílico da Tedia (Brasil). O padrão interno fumarato de dietila foi preparado a partir da esterificação do ácido fumárico 99% (Aldrich) e etanol anidro em presença de SOCl2 99% (Aldrich), sendo purificado por destilação (80%). Este padrão interno foi analisado pelos métodos de RMN e CG mostrando pureza superior a 99,8%. Foram analisadas folhas secas de guaco comercial de 7 distribuidoras diferentes e adquiridas no varejo, sendo 5 do Estado do Rio de Janeiro (A, B, C, D, E), uma do Estado de São Paulo (F) e uma do Estado de Santa Catarina (G). Nenhuma das empresas discriminava o teor de cumarina, nem tão poucos possuíam o Certificado de Boas Práticas de Fabricação e Controle (CBPFC) ou mesmo indicavam prazo de validade.
As matrizes de análises foram geradas por extração aquosa de 1,0 g de folhas pulverizadas de guaco comercial, obtidos por infusão a quente (140 mL de água) seguido de resfriamento a temperatura ambiente. Após filtração, as soluções foram extraídas com diclorometano (3 x 60 mL). A proporção água:solvente foi otimizada a partir de testes em soluções aquosas de cumarina padrão, para determinar melhor proporção para máxima extração. Os extratos orgânicos foram secos com Na2 SO4 anidro, filtrados e evaporados em evaporador rotatório (sob vácuo a 37 ºC). Os resíduos sólidos obtidos foram dissolvidos em 2,0 mL de solução de clorofórmio contendo 1,0 mg.mL-1 de fumarato de dietila (padrão interno).
As análises cromatográficas foram realizadas em um cromatógrafo a gás (Hewlett Packard - modelo HP 5890 Série II) acoplado a um Detector por Ionização em Chamas (CG-DIC). As condições de CG-DIC foram as seguintes: coluna capilar com 30m de comprimento, 0,32 mm de diâmetro interno e 0,25 μm de espessura de fase de 5% de fenil em metil silicone (HP-5). Foi usado hidrogênio como gás carreador à velocidade média de 50 cm/s. A temperatura do injetor a 280 ºC e divisão de fluxo (split) de 1:20. A temperatura do forno programada de 80 ºC até 200 ºC com taxa de aquecimento de 12 ºC/min.
Estudos prévios sobre a quantificação de cumarina em Mikania glomerata por CG e CLAE-UV (CABRAL et al., 2001; CELEGHINI et al., 2001; VENEZIANI et al., 1999; VILEGAS et al., 1997a; VILEGAS et al., 1997b), serviram de base para a elaboração da curva de calibração (cinco pontos em triplicata na faixa de 0,4 a 2,0 mg.mL-1 de cumarina padrão, com 1,0 mg.mL-1 do padrão interno), que foi utilizada nas quantificações por CG. A curva de calibração tomou como base as áreas normalizadas do pico de cumarina em relação ao pico do padrão interno de fumarato de dietila versus as concentrações em mg/mL de cumarina. Foram realizados experimentos para verificar a recuperação de cumarina a partir da extração de cumarina comercial com 60 mL de CH2 Cl2 (3x) de soluções preparadas, adicionando 2,0 e 3,0 mg de cumarina em 140 mL de água em ebulição, e em seguida repetido o mesmo procedimento realizado nas amostras de guaco comercial. Os experimentos foram realizados em triplicata.
Resultados e Discussão
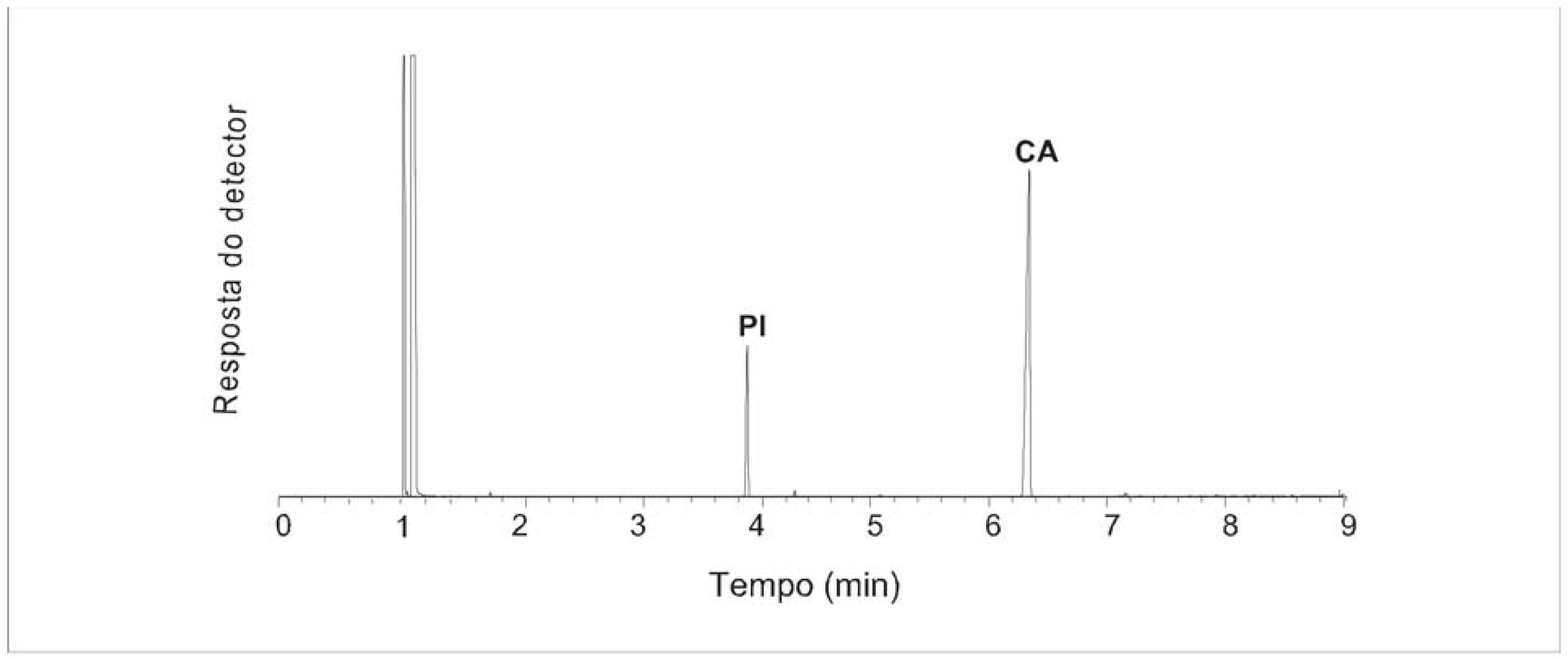
A regressão linear da curva de calibração resultou na equação y = -7,3.10-3 + 1,89x (R2 = 0,9996). Os limites de detecção e de quantificação foram de 0,029 mg.mL-1 e 0,087 mg.mL-1, respectivamente. As análises de CG mostraram uma boa separação entre o padrão interno e o composto de interesse, em um tempo total de análise menor que 10 min. A FIGURA 2 exemplifica um cromatograma típico do extrato diclorometânico, o que evidencia também a seletividade do processo de extração.
Os experimentos de recuperação de cumarina padrão resultaram em 90,22 (± 0,32)% de recuperação média após as várias etapas, indicando uma quantificação satisfatória de cumarina pelo método (TABELA 1). Os resultados das quantificações das sete amostras analisadas estão apresentados na TABELA 2.
| Cumarina utilizada, Mg | Cumarina recuperada, mg e desvio padrão* | Recuperação, % | Recuperação média, % |
|---|---|---|---|
| 2,0 | 1,80 ± 0,07 | 89,99 | 90,22 ± 0,32 |
| 3,0 | 2,71 ± 0,03 | 90,44 | |
| *Medidas feitas em triplicata. | |||
| Guaco comercial | Cumarina, mg e desvio padrão* |
|---|---|
| A | 2,72 ± 0,06 |
| B | 1,41 ± 0,01 |
| C | 3,26 ± 0,03 |
| D | 2,44 ± 0,05 |
| E | 2,99 ± 0,02 |
| F | 1,86 ± 0,01 |
| G | 4,48 ± 0,02 |
| *Medidas feitas em triplicata. | |
O resultado da quantificação de cumarina nas amostras comerciais apresenta uma variação considerável. Por exemplo, entre as amostras das distribuidoras B (1,41 mg) e E (2,99 mg), houve uma diferença de mais de duas vezes em quantidade de cumarina, para produtores de uma mesma região geográfica do País, ou seja, do Estado do Rio de Janeiro. Comparando amostras de Estados diferentes, Rio de Janeiro e Santa Catarina, a diferença é maior do que três vezes (distribuidoras B e G, respectivamente). Isto reforça a necessidade de padronização dos fitoterápicos através de um controle de qualidade em todas as etapas da produção (plantio, secagem, armazenamento), com a finalidade de garantir o seu uso como tal. Mesmo antes da comercialização, é primordial o controle de qualidade do produto acabado, através de análises qualitativas e quantitativas dos princípios ativos, a fim de comprovar que não houve degradação dos mesmos. O método desenvolvido para determinação de cumarina em extratos aquosos de guaco por CG, mostrou ser simples e seletivo. Além disso, foi utilizado um padrão interno de baixo custo, que elimina qualquer etapa de derivatização. Com esta metodologia, o conteúdo de cumarina no guaco comercial pôde ser determinado em um tempo muito menor que os métodos descritos na literatura (cada experimento necessita de menos de 30 min, entre extração e quantificação). Um exemplo de caso que demonstra como se pode garantir o monitoramento dos fitoterápicos pelo Serviço Nacional de Vigilância Sanitária (SNVS) e como laboratórios de Universidades, que agreguem o conhecimento e a disponibilidade para tal, podem auxiliar neste objetivo.
As amostras de guaco comerciais das sete distribuidoras analisadas mostraram estar de acordo com as recomendações da ANVISA. Contudo, a variação de cumarina, determinada entre as distribuidoras, mostra a necessidade de padronização para que o consumo desse tipo de fitoterápico, principalmente no SUS, possa ser realizado com segurança. Necessita-se também uma maior fiscalização na comercialização de fitoterápicos, principalmente para a observância das Boas Práticas de Fabricação e Controle, determinado pela ANVISA. O exemplo de caso aqui apresentado demonstra isso. Na conjuntura atual, dificilmente é possível se comprometer com a prescrição de um fitoterápico. Haveria o risco de não causar efeito algum e a doença se agravar ou de intoxicar o paciente pelo excesso de princípio ativo. Certos fitoterápicos são potentes mesmo em pequenas doses, como qualquer medicamento alopático. Contudo neste último, o médico e paciente tem pleno conhecimento e segurança na quantidade de princípio ativo presente, pois o controle é muito mais rigoroso.
Agradecimentos
Os autores agradecem a CAPES (A. S. Abreu, bolsa DSc), ao LADETEC-IQ-UFRJ pelo acesso aos cromatógrafos e as Professoras Débora A. Azevedo e Paula F. Aguiar pelo auxílio técnico e ao Professor Ângelo Cunha Pinto pela revisão.
Referências
. BRASIL, Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC 48 de 16 Março de 2004. Dispõe sobre o registro de medicamentos fitoterápicos. D.O.U., Brasília 18/03/2004a.
. BRASIL, Ministério da Saúde. Agencia Nacional de Vigilância Sanitária. Resolução RE 89 de 16 Março de 2004. Determina a publicação da Lista de Registro Simplificado de Fitoterápicos. D.O.U., Brasília 18/03/2004b.
. BRASIL, Ministério da Saúde. Conselho Nacional de Saúde. Portaria 971 de 03 Maio de 2006. Aprova a Política Nacional de Políticas Integrativas e complementares no Sistema Único de Saúde, conteúdo. D.O.U., Brasília 04/05/2006.
. CRUZ, G.L. Livro verde das plantas medicinais e industriais do Brasil, 1 ed., Oficinas Gráficas de Veloso S.A., Belo Horizonte, 1965.
. CORREA, M.P. Dicionário das plantas úteis do Brasil e das exóticas cultivadas : Ministério da Agricultura, Rio de Janeiro, 1984.
. CABRAL, L.M.; DOS SANTOS, T.C.; ALHAIQUE, F. Development of a profitable procedure for the extraction of 2-H-1-benzopyran-2-one (coumarin) from Mikania glomerata. Drug Development and Industrial Pharmacy, v.27, p.103-106, 2001.
. CELEGHINI, R.M.S.; VILEGAS, J.H.Y.; LANÇAS, F.M. Extration and quantitative HPLC analysis of coumarin in hydroalcoholic extracts of Mikania glomerata. Journal of the Brazilian Chemical Society, v.12, p.706-709, 2001.
. FIERRO, I.M.; DA SILVA, A.C.; LOPES, C.S. ; DE MOURA, R.S.; BARJA-FIDALGO, C.J. Studies on the anti-allergic activity of Mikania glomerata. Journal of Ethnopharmacology, v.66, p.19-24, 1999.
. FERREIRA, S.H. Medicamentos a partir de plantas medicinais no Brasil. Academia Brasileira de Ciências, Rio de Janeiro, 1998.
. LEITE, M.G.R.; SOUZA, C.L.; SILVA, M.A.M.; MOREIRA, L.K.A.; MATOS, G.S.B.; VIANA, G.S.B. Estudo farmacológico comparativo de Mikania glomerata Sprengel (guaco), Justicia pectoralis Jacq (anador) e Torresea cearensis (cumaru). Revista Brasileira de Farmácia, v.74, n.1, p.12-15, 1993.
. MAIORANO, V.A.; MARCUSSI, S.; DAHER, M.A. F.; OLIVEIRA, C.Z.; COUTO, L.B.; GOMES, O.A.; FRANÇA, S.C.; SOARES, A.M.; PEREREIRA, P.S.; Antiophidian properties of the aqueous of Mikania glomerata. Journal of Ethnopharmacology, v.102, p.364-370, 2005.
. MOURA, R.S.; COSTA, S.S.; JANSEN, J.M.; SILVA, C.A.; LOPES, C.S.; BERNARDO-FILHO, M.; SILVA, V.N.; CRIDDLE, D.N.; PORTELA, B.N.; RUBENICH, L.M.S.; ARAUJO, R. G.; CARVALHO, L. C. R. M. Bronchodilator activity of Mikania glomerata Sprengel on human bronchi and guinea-pig trachea. Journal of Pharmacy and Pharmacology, v.54, p.249-256, 2001.
. MARTINS, E.R.; DE CASTRO, M.D.; CASTELLANI, D.C.; DIAS, J.E. Plantas Medicinais, Universidade Federal de Viçosa, Imprensa Universitária, Viçosa, 1995.
. NETTO, E.M.; SHUQAIR, N.S.M.S.A.Q.; BALBINO, E.E.; CARVALHO, A.C.B. Comentários sobre o registro de fitoterápicos. Fitos, v.1, n.3, p.09-17, 2006.
. NOLLA; D.; SEVERO, B.M.A; MIGOTA, A.M. Plantas medicinais, 2 ed., Editora da Universidade de Passo Fundo, Passo Fundo, 2005.
. OLIVEIRA, F.; OGA, S.; AKISUE, G.; AKISUE, M.K. Parâmetros físicos e químicos e efeito antiedema dos extratos fluídos de guaco (Mikania glomerata Sprengel) e de guaco do mato (Mikania laevigata Schultz Bip. Ex Baker). Anais de Farmácia e Química, v.25, n.1/2, p.50-54, 1985.
. PEREIRA, N.A.; PEREIRA, B.M.R.; NASCIMENTO, M.C.; PARENTE, J.P.; MORS, W.B. Pharmacological screening of plants recommended by folk medicine as anti-snake venom. IV. Proction against jararaca venom by isolated constituints. Planta Medica, v.60, p.99-100, 1994.
. PANIZZA, S. Plantas que curam: cheiro de mato, IBRASA, São Paulo, 1997.
. RUPPELT, B.M.; PEREIRA, E.F.R; GONCALVES, L.C.; PEREIRA, N.A. Pharmacological screening of plants recommended by folk medicine as anti-snake venom. I. Analgesis and anti-inflamatory activities. Memórias do Instituto Oswaldo Cruz, v.86, n.2, p.203-205, 1991.
. VILEGAS, J.H.Y.; MARCHI, E.; LANÇAS, F.M. Extraction of low-polarity compounds (with emphasis on coumarin and kaurenoic acid) from Mikania glomerata (guaco) leaves. Phytochemical Analysis, v.8, p.266-270, 1997a.
. VILEGAS; J.H.Y; DE MARCHI; E.; LANÇAS, F.M. Determination of Coumarin and Kaurenoic Acid in Mikania glomerata (guaco) leaves by Capillry Gas Chomatography. Phytochemical Analysis, v.8, p.74-75, 1997b.
. VENEZIANI, R.C.S.; CAMILO, D.; OLIVEIRA, R. Contituents of Mikania glomerata Spreng. Biochemical Systematics and Ecology, v.27, n.1, p.99-102, 1999.
. VIEIRA, L.S.; Fitoterapia da Amazônia: manual de plantas medicinais. 2. ed. São Paulo: Agronômica Ceres, 1992.