Artigo Original
Triterpenos das folhas de Protium strumosum1
Triterpenes from the leaves of Protium strumosum
Resumo
Este trabalho descreve o isolamento de triterpenos a partir da espécie Protium strumosum (Daly) (Burseraceae). A partição em diclormetano do extrato metanólico das folhas P. strumosum conduziu, após cromatografia em coluna aberta e placas preparativas e gel de sílica, ao isolamento ou caracterização dos triterpenos 3-epifridelanol, friedelina, lupeol, lupenona, á-amirina e â-amirina, além do âsitosterol 3-O-glicosídeo. Os triterpenos e o esteróide foram caracterizados pelos métodos espectroscópicos convencionais (1 H-RMN,13 C-RMN, CG-EM, IV), experimentos de co-injeções em CG-DIC com substâncias autênticas, e pela identificação de derivados obtidos por acetilação. O isolamento de epifriedelanol, constituinte majoritário da fração menos polar estaria relacionado com o potencial antiinflamatório da espécie.
- Unitermos:
- Burseraceae.
- Protium.
- Triterpenes.
- â-Friedelanol.
Abstract
The present study reports the isolation of triterpenes from the species Protium strumosum (Daly) (Burseraceae). Partitioning of the methanolic extract of the leaves of P. strumosum followed by silica gel chromatographic purification (columns and preparative plates), led to isolation or characterization of the following triterpenes: epifriedelanol, friedeline, lupeol, lupenone, á-amyrin and â-amyrin and also the steroid â-sitosterol 3-O-glucoside. The compounds were characterized by spectroscopic means (1 H-RMN,13 C-RMN, CG-EM, IV), co-injection experiments in GC-FID using authenticated patterns, and also by identifying the acetylated derivatives. The isolation of 3-epifridelanol as the majors constituent in the less polar fraction might be related with the anti-inflammatory potential of such Protium species.
- Key words:
- Burseraceae.
- Protium.
- Triterpenos.
- â-Friedelanol.
Introdução
A família Burseraceae é largamente distribuída nas regiões tropicais e subtropicais, com maiores centros de irradiação nas zonas áridas do nordeste da África, Arábia, América tropical, Ásia, Austrália e Madagascar. Segundo Engler, está dividida em três tribos: Protieae (4 gêneros), Boswellieae (8 gêneros) e Canarieae (9 gêneros) (KHALID, 1983). A tribo Protieae por sua vez, está distribuída em quatro gêneros: Garuga, Crepidospermum, Tetragastris e Protium. (DALY, 1989), e este último é o mais representativo, com cerca de 140 espécies, totalizando 84% das burseráceae no universo complexo da flora Amazônica, onde 10% das árvores da floresta pertencem a esta família (SUSUNAGA, 1996) contendo 17 gêneros e cerca de 550 espécies (MABBERLEY, 1998).
As espécies de burceráceas compreendem plantas lenhosas, arbustivas ou arbóreas, que possuem ductos verticais esquizógenos de onde exsudam óleo-resinas e gomo-resinas. Essas bolsas secretoras encontramse, com freqüência, nas folhas, no limbo, nas raízes e caules, na casca, medula e líber; e ainda no pericarpo. As espécies dessa família são utilizadas desde os tempos mais remotos para as mais diversas finalidades. Os bálsamos aromáticos, que são segregados por espécies de burseráceas, serviam aos egípcios na preparação das múmias, e também nos rituais religiosos dos índios e da Igreja Romana. O padre José de Anchieta, ao encontrar algumas espécies no Brasil, não hesitou em identificá-las como sendo verdadeiras ‘mirras e bálsamos’ e passou a utilizá-las em seus cultos, na ausência das mirras africanas e asiáticas (HOENE, 1939). As burseráceas são úteis principalmente pelo exudato líquido que segregam, o qual é obtido pela lesão do tronco, pela resposta ao ataque de insetos, pela mão do homem, ou ainda secretados espontaneamente. Apresenta-se de consistência variável, geralmente espesso, e não possui composição simples. Dele se separam resinas sólidas e fixas que, no todo ou em parte, se encontram dissolvidas em óleos essenciais líquidos e voláteis (COSTA 1975, RIZZINI; MORS 1995; RAMOS et al., 2000)
As resinas apresentam várias aplicações. Algumas são conhecidas por fornecerem essências utilizadas na perfumaria, destacando-se também na fabricação de vernizes, tintas, incensos, cosméticos; como aromatizantes alimentares, uso farmacêutico, repelentes de insetos, e na calefação de barcos. Muitas das substâncias secretadas são indicadas na literatura como responsáveis por muitas propriedades das quais faz uso a medicina popular (COSTA, 1975).
Segundo Susunaga (1996), a medicina popular registra o uso de 47 espécies de burseráceas, com a resina destacando-se como a parte mais utilizada em 34 delas. Cinco casos descrevem o uso da resina misturada com outra parte da planta, e em oito casos utilizam-se outras partes da planta, com apenas 1 registro para utilização de folhas como antiinflamatório. Revisões bibliográficas sobre a família podem ser encontradas em Arévalo (1993); Guimarães, (1997); Silva (1995); Siqueira (1991); e Susunaga (1996), onde são apresentadas análises mais detalhadas dos aspectos químicos e farmacológicos da família Burseraceae.
O principal gênero sul-americano de Burseraceae é Protium, com perto de 85 espécies descritas (MABBERLEY, 1998). Estas espécies são descritas como árvores com folhas imparipenadas, ramente unifoliadas, com folíolos geralmente inteiros e glabros. Possuem inflorescência racemosa a paniculada, flores perfeitas ou unissexuais; cálice 4-5-lobado ou dentado; pétalas 4-5; estames 8-10; disco nectarífero 8-10-crenado; ovário 4-5-loculado; estigma 4-5-lobado. Fruto com (1-)4-5-nozes cada um com 1 semente (GENTRY, 1993). Dentre os relatos do uso na medicina popular de espécies de burseráceas, destaca-se a utilização das folhas das espécies de Protium heptaphyllum e P. icicariba como cicatrizantes, antiinflamatórios e no tratamento de úlceras (COSTA, 1975; PERNET, 1972). No presente trabalho, as folhas da espécie Protium strumosum (Daly) foram investigadas quanto à composição em triterpenos; substâncias associadas a atividades antiinflamatória e analgésica, entre outras (LIMA et al., 2005; OLIVEIRA et al., 2004; OLIVEIRA et al., 2005b; SUSUNAGA, 1996).
Material e Métodos
Material botânico
As folhas de P. strumosum (PS) foram coletadas em Abril de 1994, na Reserva Colosso, situada no Km 60 da estrada Manaus-Caracaraí (área n° 1202/ 1301). A identificação da planta foi realizada pelo Dr. Douglas Daly, do New York Botanical Garden, EUA. As folhas de Protium strumosum foram secas à sombra, à temperatura ambiente, e trituradas em moinho de lâminas.
Extração e Fracionamento
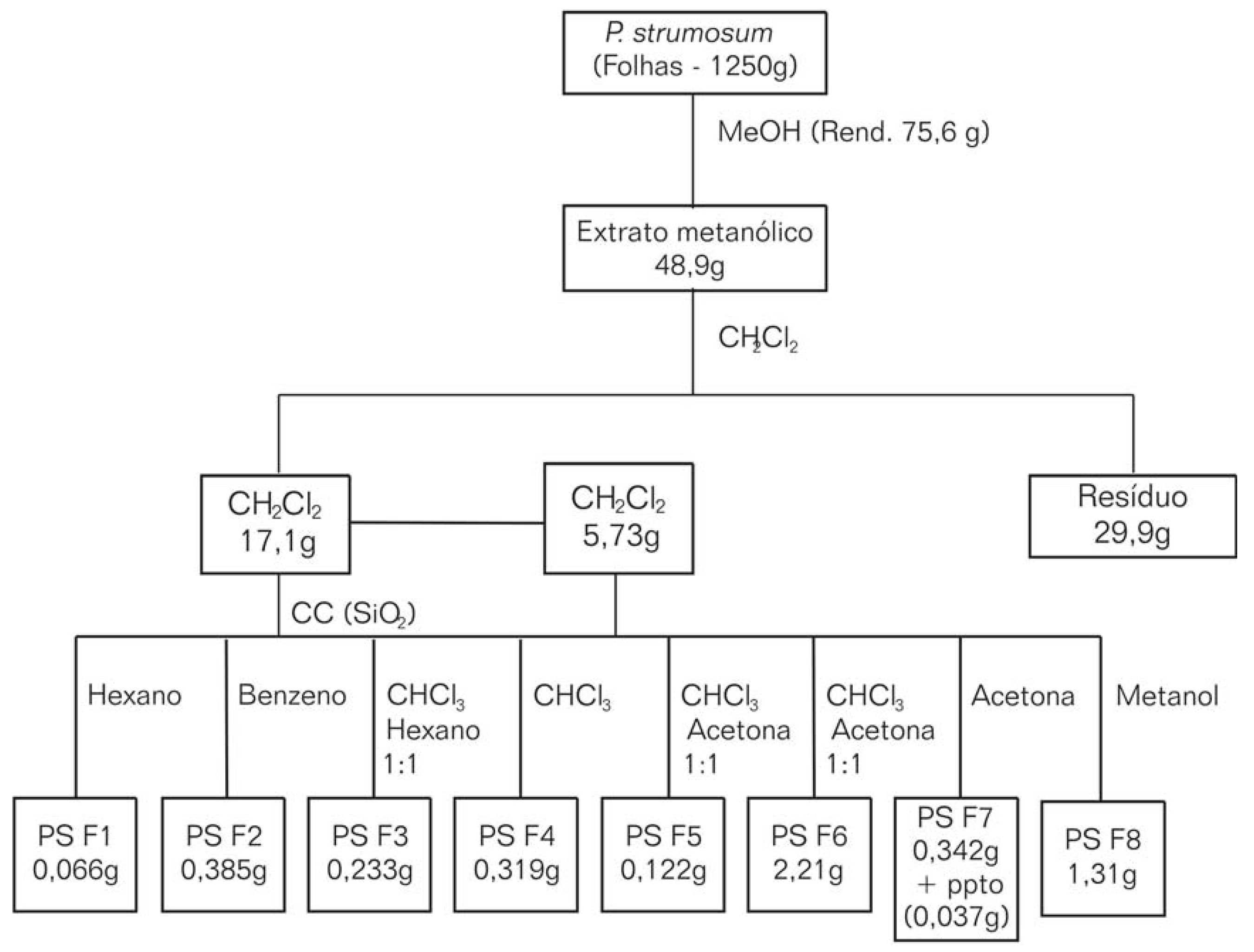
As folhas secas e moídas (1250 g) de PS foram submetidas à maceração exaustiva à temperatura ambiente com metanol (10 L, 8 dias) através de maceração. Filtração e evaporação do solvente conduziram a 75,6 g (6,04%) de extrato. Uma parte deste extrato (48,9 g) foi extraída exaustivamente com diclorometano, que em seguida foi evaporado sob pressão reduzida, produzindo a fração solúvel neste solvente (17,1 g). 5,73 g desta fração foram pré-cromatografados em coluna de gel de sílica G 60 (diâmetro interno 2,5 cm; altura 30 cm) sob pressão exercida por uma bomba peristáltica, utilizando-se os seguintes solventes: hexano, benzeno, clorofórmio:hexano 1:1, clorofórmio, clorofórmio:acetona 1:1, acetona e metanol. O processo foi monitorado com luz UV para acompanhar a eluição dos pigmentos na coluna. O processo, contendo os rendimentos obtidos para os extratos e frações, está resumido no fluxograma da FIGURA 1.
Isolamento e Caracterização das Substâncias
Todas as frações obtidas foram monitoradas por Cromatografia Gasosa de Alta Resolução, acoplada a Espectrometria de Massas (CGAR-EM), em combinação com Cromatografia em Camada Delgada (CCD), com uso p-anisaldeído em meio ácido sulfúrico como revelador (WAGNER, 1996). As colorações características (tonalidades entre azul, vermelho, violeta e verde) em CCD, aliadas à informação de M+ e fragmentação característica em CGAR-EM conduziram à caracterização e isolamento das substâncias-alvo.
A fração PS-F2 (FIGURA 1) apresentou-se como um óleo amarelo claro (385 mg, 7,7%), que foi inicialmente submetido a uma cromatografia em coluna de Sephadex, utilizando-se CHCl3 :i-PrOH como eluente. Foram coletadas 38 frações de 5 mL cada, que foram reunidas em 7 frações principais, de acordo com respostas similares em CCD. Purificação por CCD preparativa (20 x 20 x 0,10 cm) das primeiras (eluente Benzeno:Acetona 95:5) e das últimas (eluente: Hexano:EtOAc) frações forneceram a friedelina (24 mg) e uma mistura de epifriedelanol e lupenona (22 mg), respectivamente (MAHATO; KUNDU, 1994; PATRA et al., 1981; PATRA; CHAUDHURI, 1987). Ambas foram confirmadas por co-injeções com substâncias de referências em CG-FID. Dados de CGAR-EM e RMN-1 H das frações intermediárias demonstraram ainda a presença de traços de epifriedelanol.
A fração PS-F3 (FIGURA 1) apresentou-se como um óleo levemente esverdeado que cristalizou em repouso (233 mg, 4,6%), sendo inicialmente submetida a uma cromatografia em coluna de Sephadex, utilizando-se CHCl3 :i-PrOH como eluente. Foram coletadas 60 frações de 5 mL cada, estas reunidas em 7 frações principais, de acordo com a similaridade em CCD. A terceira fração (122 mg) cristalizou um sólido incolor (44 mg), identificado como o epifriedelanol (ARAGÃO et al., 1990; BUDZIKIEWICZ, 1963; KUNDU et al., 2000). A estrutura desta substância foi confirmada quimicamente, pela acetilação da hidroxila secundária em C-3, e o 3-O-acetil-epifriedelanol resultante foi caracterizado pelos métodos espectroscópicos convencionais, e por comparação com dados da literatura (PATRA; CHAUDHURI, 1987).
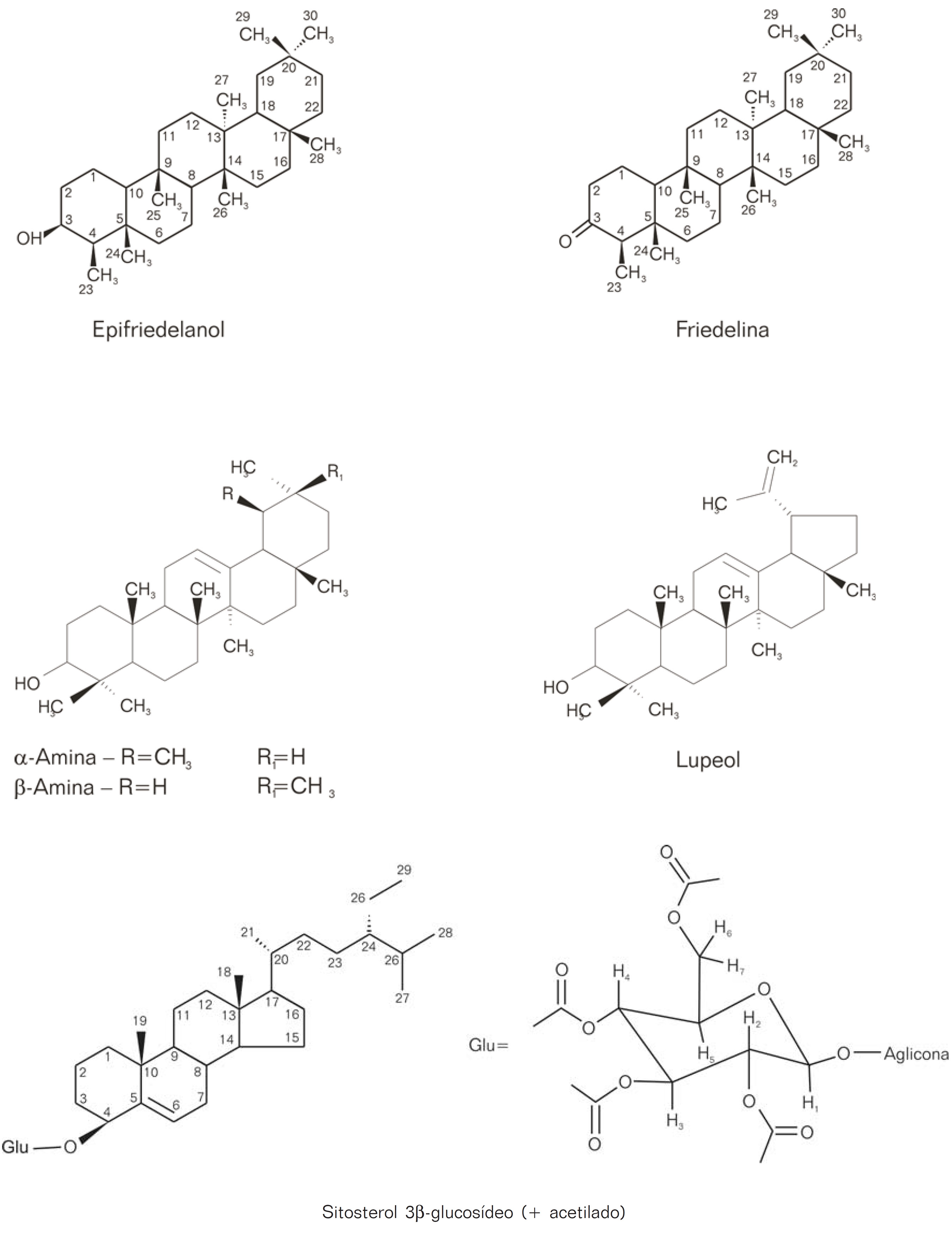
A fração PS-F4 (FIGURA 1) apresentou-se como um sólido pastoso esverdeado. Re-cromatografia em CCD preparativa (50 mg aplicados; eluente: CHCL3 :i-PrOH) conduziram a 13 mg de um sólido incolor que, após análise por1 H-RMN,13 C-RMN, CGAR-EM, e comparação com padrões autênticos em CCD e co-injeção em CG-FID, revelou constituirse de uma mistura ternária de â-amirina, á-amirina e lupeol (ARAGÃO et al., 1990; MAIA et al., 2000). A fração PS-F7 (FIGURA 1), após a redução do solvente, levou à precipitação de um sólido de alto ponto de fusão, identificado por intermédio de seu derivado tetraacetilado, como sendo o sitosterol 3âO-glucosídeo (BRAZ FILHO, 1986; GUEVARA, 1989). As estruturas do triterpenos isolados estão dispostas na FIGURA 2.
Acetilação do epifriedelanol (β-friedelanol)
10 mg do sólido obtido em PSF3 foram dissolvidos em uma mistura de 2 mL de CH2 Cl2 , 1mL de piridina e 0,6 mL de anidrido acético e uma quantidade catalítica (1 mg) N,N-dimetilaminopiridina (DMAP). A mistura foi agitada à temperatura ambiente durante uma noite. Mais 15 mL de CH2 Cl2 foram adicionados à reação, e a mistura foi lavada exaustivamente com solução aquosa de sulfato de cobre (até a coloração azul não se alterar), e em seguida lavada com água. A fase orgânica foi então seca com sulfato de sódio e evaporada, para resultar em 10 mg de acetato de 3-epi-friedelanol, purificado posteriormente por CCD.
Acetilação do Sitosterol 3â-O-glucosídeo
4,4 mg do precipitado obtido a partir de PSF7, 2 mL de piridina, 0,5 mL de anidrido acético DMAP (cerca de 0,5 mg) foram refluxados suavemente durante 4 h. O solvente foi então evaporado, e o resíduo suspenso em 10 mL de HCl 0,05 N e extraído com CHCl3 (2 x 20 mL). As frações orgânicas foram reunidas e a resultante lavada com H2 O (15 mL), seca com Na2 SO4 e evaporada, resultando em 7,0 mg de sólido que foi analisado sem pós-purificação, para gerar os dados de13 C e1 H-RMN compatíveis com a estrutura do sitosterol tetraacetil-3β-O-glucosídeo.
Solventes, Equipamentos e Condições de Análises
Todos os solventes utilizados (grau analítico) e gel de sílica 60 (0,063-0,200mm, 70-230 mesh ASTM) foram da MERCK. Pequenos equipamentos: agitador magnético (Alphalab AA 500), balança analítica (Sartorius Basic BA 2105), bomba peristáltica, evaporador rotativo (Brinkmann-Buchi), lâmpada de ultravioleta (Camag 29011, 254-366nm), ponto de fusão (Microquímica MQAPF-301). O sistema de Cromatografia Gasosa de Alta Resolução, acoplado ao Espectrômetro de Massas (CGAR-EM) Hewlett-Packard modelo 6890, com analisador de íons quadripolo e ionização por impacto de elétrons, 70 eV, equipado com coluna capilar HP-5 MS (5% difenil e 95% dimetilpolisiloxano; 30 m x 0.32 mm i.d. x 0.25 μm espessura do filme); o cromatógrafo a gás com Detector por Ionização de Chama (CG-DIC) Hewlett-Packard 6890 foi acoplado a um integrador Hewlett-Packard 3396, usando-se a mesma especificação de coluna. Espectrômetro de Infravermelho Nicolet FT-IR 205 e Perkin-Elmer FT-IR Spectrum 2000; Espectrômetro de Ressonância Magnética Nuclear Brucker AC 200-A. As análises de CGAR-EM e CG-DIC, das misturas e dos triterpenos isolados, assim como as co-injeções com amostras autênticas, foram efetuadas em três condições experimentais diferentes: (a) Ti 250o C, Tf 290o C, taxa de aquecimento de 5o C/min e fluxo de 0,5 mL/min; (b) Ti 250o C, Tf 290o C, taxa de aquecimento de 10o C/min e fluxo de 0,5 mL/min; e (c) Ti 150o C, Tf 290o C, taxa de aquecimento de 5o C/min e fluxo de 0,5 mL/min.
Resultados e Discussão
Os triterpenos identificados foram o epifriedelanol, a friedelina, o lupeol, a lupenona, a α-amirina e a β-amirina, além do 3-O-glicosilsitosterol; entre os quais o primeiro e o último foram purificados, e tiveram suas estruturas comprovadas por acetilação e comparação dos dados espectrométricos com os descritos na literatura. Quanto aos outros triterpenos, não houve preocupação maior na purificação dos mesmos, já que está bem estabelecida na literatura a análise de misturas dos mesmos, baseada principalmente em13 C-RMN. Por outro lado, a técnica de CG-DIC, aliada aos experimentos de co-injeção, já se tornou em uma ferramenta usual eficiente para a identificação de misturas deste tipo, principalmente para a análise de substâncias de média ou baixa polaridade (ARAGÃO et al., 1990; MAIA et al., 2000). A técnica de co-injeção em CG com padrões isolados ou autenticados foi utilizada como maneira de apoiar definitivamente as estruturas propostas dos triterpenos, bem como de monitorar a presença dos mesmos em frações que apresentavam perfis cromatográficos mais complexos. Neste caso, as respostas foram bastante satisfatórias nas três condições cromatográficas diferentes (mesma coluna), e é digno de menção o fato da constante co-eluição entre a á-amirina e o lupeol em todas as condições utilizadas (além de outras tentativas aqui não registradas). Neste caso, a resolução da mistura é mais adequadamente realizada pelos sinais olefínicos de cada tipo de esqueleto triterpênico, que funcionam como diagnósticos precisos no espectro de13 C-RMN. A acetilação do epifriedelanol e do sitosterol glicosilado geraram produtos mais solúveis, e por isso mais facilmente analisáveis. É praxe encontrar-se na literatura os dados espectroscópicos das substâncias acetiladas, ao invés do álcool livre original (ARAGÃO et al.; 1990). A baixa solubilidade do epifriedelanol em solventes polares, quando comparada a outros estereoisômeros do esqueleto friedelano, é provavelmente derivada da conformação particular que a molécula adota, quando a fusão cis dos anéis D/E da molécula na maneira bote-bote faz com que 5 dos 7 grupamentos metilas ocupem um mesmo lado da molécula, em alinhamento com a hidroxila orientada em â (KIKUCHI et al., 1980; LAING et al., 1977). Por outro lado, além das propriedades químicas que eventualmente determinam, as conformações espaciais específicas, assumidas pelas estruturas moleculares dos triterpenos, podem estar diretamente relacionadas às atividades biológicas que apresentam (GOETZ, 1998).
Os triterpenos são substâncias com presença ubíqua nos vegetais superiores (CONNOLY; HILL, 2005). Do ponto de vista farmacológico, têm sido investigados dentro de uma ampla variedade de efeitos, onde se destacam as atividades anticâncer e antivírus, demonstradas principalmente pelos seus derivados ácidos (AIKEN; CHIN, 2005; LIU, 2005); e a atividade antiinflamatória e analgésica - estas, pela classe de triterpenos em geral (LIMA et al., 2005; LOGGIA et al., 1994; OLIVEIRA et al., 2004; OLIVEIRA et al., 2005b; SUSUNAGA, 1996). Neste contexto, é importante se enfatizar a atividade antiinflamatória descrita para o epifriedelanol (CHATURVEDI et al., 1974), e o emprego terapêutico do sitosterol e da sitosterina (sitosterol glicosilado) como um dos poucos agentes efetivos no combate à hiperplasia prostática (AWAD et al., 2000; VON HOLTZ et al., 1998; WAGNER et al., 1995). Também já foi reportado o potencial antidiabético deste esterol glicosilado (IVORRA et al., 1989).
A capacidade antiinflamatória do epifriedelanol foi testada em nossos laboratórios como agente por via oral na inflamação aguda induzida por zimosan em camundongos (30 e 100 mg/Kg), medida 4 horas após indução; e no modelo de pleurisia induzida por lipopolissacarídeo (30 e 100 mg/Kg), medida 24 h após a indução. Ao contrário da inibição descrita pelo uso de doses maiores de epifriedelanol (CHATURVEDI et al., 1974), nenhum efeito inibitório foi observado em nossos experimentos. Também, inversamente ao que foi descrito para a inflamação induzida por carragenina em patas de ratos, nenhuma inibição foi observada na dose de 30 mg/Kg. Neste sentido, respostas mais fidedignas requerem ampliação dos ensaios quanto às doses utilizadas e ao modelo de indução da inflamação. Esta assertiva deve servir de base para o desenho de novos projetos visando o aproveitamento terapêutico do epifriedelanol, assim como uma maneira menos custosa de purificá-lo a partir do substrato renovável representado pelas folhas de Protium strumosum ; já que, neste trabalho, alcançou o bom rendimento de aproximadamente 4% sobre o extrato metanólico (ou 0,15% sobre as folhas secas).
A família Burseraceae sempre ocupou um lugar de destaque na etnobotânica dos locais onde grassam suas espécies. No caso das espécies sul-americanas, o foco dos trabalhos tem sido o potencial aromático de suas resinas, folhas e frutos (RAMOS et al., 2000; SIANI et al., 1999b; SIANI et al., 2004; ZOGHBI et al., 1994), com alguma extensão para a exploração do potencial farmacológico e outros estudos multidisciplinares (OLIVEIRA et al., 2005a; SIANI et al., 1999a; SUSUNAGA, 1996). A grande parte dos estudos existentes com as espécies de Protium está focalizada nas resinas. O presente trabalho vem adicionar informações científicas aos raros estudos sobre componentes não voláteis de folhas de espécies desta família (SIANI, 1995; SIANI, 1999a).
Friedelina:1 H-RMN (CDCl3 , ppm): δ 0,88 (3H, d, J 6,48); 0,73 (3H, s); 0,87 (3H, s); 1,01 (3H, s); 1,05 (3H, s); 1,18 (3H, s); 0,96 (3H, s); 1,01 (3H, s). 13C-RMN (CDCl3 , ppm): δ 6,84 (C-23); 14,69 (C-24); 17,97 (C-25); 18,26 (C-27); 18,67 (CH3); 20,27 (C-26); 22,31 (C-1); 28,20 (C-20); 31,82 (CH3); 30,05 (C-17); 30,53 (C-12); 32,11 (C-28); 32,11 (C-30); 32,38 (C-15); 32,84 (C-21); 35,04 (C-29); 35,38 (C-19); 35,60 (C-11); 36,11 (C-11); 37,49 (C-9); 38,42 (C-14); 39,29 (C-22); 39,73 (C-13); 41,35 (C-6); 41,54 (C-2); 42,18 (C-5); 42,85 (C-18); 53,24 (C-8); 58,28 (C-4); 59,54 (C-10); 213,15 (C-3).
Epifriedelanol (β-friedelanol) : Pf 275-278°C [lit. 292-294 °C (MALDONADO et al., 1998)]. IV (KBr, cm-1 ) : 3624, 3479, 3000, 2933, 2871, 1448, 1385, 1361, 1172, 1089, 1048, 1001, 921. 1 H-RMN (CDCl3 , ppm): δ 0,89 (3H, d, J 9,56 Hz); 0,94 (3H, s); 0,95 (3H, s); 0,97 (3H, s); 0,99 (6H, s); 1,01 (3H, s); 1,17 (3H, s); 3,72 (1 H, s). 13C-RMN (CDCl3 , ppm): δ 11,58 (C-23); 15,85 (C-1); 16,40 (C-24); 17,59 (C-7); 18,25 (C-25); 18,61 (C-26); 20,12 (C-27); 28,19 (C-20); 30,08 (C-17); 30,67 (C-12 ou C-15 ou C-21); 31,81 (C-29); 32,12 (C-28); 32,41 (C-15 ou C-12 ou C-21); 32,92 (C-21 ou C-12 ou C-15); 35,01 (C-30); 35,30 (C-2); 35,40 (C-19); 35,64 (C-11); 36,17 (C-16); 37,19 (C-9); 37,92 (C-5); 38,45 (C-14); 39,33 (C-22); 39,74 (C-13); 41,85 (C-6); 42,96 (C-18); 49,27 (C-4); 53,27 (C-8); 61,50 (C-10); 72,77 (C-3) Massas : m/z (%rel.): 428 [M]+ (5), 413 (13), 395 (1), 275 (23), 261 (6), 248 (9), 231 (24), 220 (4), 206 (21), 191 (18), 177 (25), 165 (76), 149 (22,5), 135 (29), 123 (59), 109 (78).
Acetato de epifriedelanol : Pf: 287-290 °C [lit. 292-294 °C (PATRA et al., 1987)]. IV (KBr, cm-1 ): 3006, 2867, 1736, 1454, 1384, 1252, 1165, 1095, 1043, 1022, 983, 887, 801, 759. 1H-RMN (CDCl3 , ppm): δ 0,81 (3H, d, J 7,1 Hz); 0,86 (3H, s); 0,93 (3H, s); 0,94 (3H, s); 0,99 (6H, s); 1,00 (3H, s); 1,17 (3H, s); 2,03 (3H, s); 4,89 (1 H, s). 13C-RMN (CDCl3 , ppm): δ 11,3 (C-23); 15,81 (C-24); 16,37 (C-1); 17,73 (C-7); 18,26 (C-25); 18,64 (C-26); 20,13 (C-27); 21,39 (COCH3); 28,67 (C-20); 30,05 (C-17); 30,65 (C-12); 31,79 (C-29); 32,11 (C-28); 32,21 (C-2); 32,38 (C-15); 32,84 (C-21); 35,05 (C-30); 35,38 (C-19); 35,60 (C-11); 36,09 (C-16); 37,93 (C-5); 37,35 (C-9); 38,39 (C-14); 39,29 (C-22); 39,70 (C-13); 41,72; (C-6); 42,88 (C-18); 48,09 (C-4); 53,19 (C-8); 61,02 (C-10); 74,63 (C-3); 170,87 (C=O). Massas : m/z (% rel.): 470 [M]+ (6), 455 (7), 410 (7), 395 (9), 317 (20), 290 (17), 275 (19), 257 (16), 231 (36), 207 (43), 191 (28), 177 (45), 163 (34), 147 (60), 109 (100).
Sitosterol 3 β-O-glucosídeo: Pf > 290 °C. IV (KBr, cm-1 ): 3600-3200, 2936, 2873, 1461, 1376, 1073, 1025.
Sitosterol tetraacetil-3 β-O-glucosídeo: IV (KBr, cm-1 ): 2800-3000 (CH), 1750 (C=O, larga), 1641, 1463, 1435, 1378, 1224, 1164-1040, 802, 737. 1H-RMN (CDCl3 , ppm): δ 4,59, H1 (d, J 7,94); 4,94 H2 (dd, J 7,94; 7,92 Hz); 5,22 H3 (dd, J3’4’ 9,16; J3’2’ 7,64 Hz); 5,05 H4 (t, J 9,46 Hz); 3,69 H5’ (m); 4,25 H6’a (dd, J6’a6’b 12,2; 4,88 Hz); 4,11 H6’b (dd, J6’b6’a 12,2; 3,4 Hz); 5,34 H-6 (dl, J 4,88 Hz); 0,82 CH2 -27 (d, J 6,7 Hz); 0,84 CH3 -26 (d, J 6,7 Hz); 1,00 CH3 -19 (s); 0,92 CH3 -21 (d, J 6,4 Hz); 0,85 CH3 -29 (t, J 7,0 Hz); 0,68 CH3 -18 (s); 2,06; 2,03; 2,01; 1,99 (s) [COCH3 ]. 13C-RMN (CDCl3 , ppm): δ 11,90 (C-29); 12,03 (C-18); 18,84 (C-21); 19,30 (C-19); 19,81 (C-26); 19,89 (C-27); 21,10 (C-11); 23,20 (C-28); 24,30 (C-15); 26,30 (C-23); 28,25 (C-16); 29,39 (C-25); 29,56 (C-2); 32,01 (C-7); 32,01 (C-8); 34,12 (C-22); 36,18 (C-20); 36,84 (C-10); 37,32 (C-1); 39,00 (C-4); 39,90 (C-12); 42,40 (C-13); 46,06 (C-24); 50,35 (C-9); 56,20 (C-17); 56,90 (C-14); 62,30 (C-6’); 68,88 (C-4’); 73,10 (C-3’); 71,74 (C-2’); 71,74 (C-5’); 99,73 (C-1’); 80,10 (C-3); 140,51 (C-5); 122,10 (C-6).
Mistura de α-amirina, β-amirina e lupeol:1 H-RMN (CDCl3 , ppm): δ 0,84-1,14 ppm (metilas ligadas em C-sp3 ); 1,59 ppm (metilas ligadas a C-sp2 ); 3,22 ppm (dd, próton carbinólico, JH2-H3β 9; 6,3 Hz); 5,19 ppm (m, próton olefinico H-12, β-amirina); 5,13 ppm (m, próton olefínico H-12, α-amirina); 4,56 e 4,68 ppm (s x 2; prótons olefinicos H-29a, H-e 29b, lupeol). A lupenona, presente em PS-F2, apresentou sinais no espectro de1 H-RMN em 4.57 e 4.68 ppm (C20 -C29 da olefina terminal) e o sinal em 0.73 ppm, correspondente ao grupo metila em C-24, característicos dos esqueletos do tipo friedelano. Todas as misturas foram co-injetadas em CG-DIC com os componentes individuais, nas condições especificadas acima.
Referências
. AIKEN, C.; CHIN, H.C. Betulinic acid derivatives as HIV-1 antivirals. Trends in Molecular Medicine, v.11, n.1, p.31-36, 2005.
. ARAGÃO, P.C.A.; TOLEDO, J.B.; MORAIS, A.A.; FILHO, R.B. Substâncias Naturais Isoladas de Stigmaphyllon tomentosum e Byrsonima variabilis. Química Nova, v.13, n.4, p.254-258, 1990.
. ARÉVALO, A.G.A. Estudo químico das espécies T. glaziovii Swartz e T. rhoifolia Willd (Burseraceae), MSc. Thesis, University of Amazon, Manaus, Brazil, 176 pp, 1993.
. AWAD, A.B.; CHAN, K.C.; DOWNIE, A.C.; FINK, C.S. Peanuts as a source of â-sitosterol, a sterol with anticancer properties. Nutrition and Cancer, v.36, n.2, p.238-241, 2000.
. BRAZ-FILHO, R.; GOTTLIEB, H. E.; MOURÃO, A. P.; MIRANDA, C. A. 3βO-β-Glicopiranosilespinasterol, um novo glicosídio esteroidal de Amarthospermum schomburghinana (Miq.) Baehni. Anais da Academia Brasileira de Ciências, v.58, n.3, p.363-368, 1986.
. BUDZIKIEWICZ, H.; WILSON, J. M.; DJERASSI, C. Mass Spectrometry in Structural and Stereochemical Problems. XXXII. Pentacyclic Triterpenes. Journal of the American Chemical Society, v.85, p.3688-3699, 1963.
. CHATURVEDI, A. K.; PARAMAR, S. S.; BHATNAGAR, S.C.; MISRA, G.; NIGAM, S. K. Anticonvulsivant and anti-inflammatory activity of natural plant coumarins and triterpenoids. Research Communications in Chemical Pathology and Pharmacology, v.9, n.1, p.11-22, 1974
. CONNOLY, J.D.; HILL, R.A. Triterpenoids. Natural Product Reports v.22, p.487-503, p.487-503, 2005 e revisões precedentes ali citadas.
. COSTA, A.F. Farmacognosia, Vol I, 1a ed., Fundação Calouste Gulbenkian, Lisboa, Portugal, pp. 841-842, 1975.
. DALY, C.D. Studies in Neotropical Burseraceae. II. Generic Limits in New World Protieae and Canarieae. Brittonia, v.41, p.17-27, 1989.
. GENTRY, A.H. Woody Plants of Northwest South America (Colombia, Ecuador, Peru), Conservation International, Washington DC, pp. 299-304 (1993).
. GOETZ, M.A.; HENSENS, O.D.; ZINK, D.L.; BORRIS, R.P.; MORALES, F.; TAMAYO-CASTILLO, G.; SLAUGHTER, R.S.; FELIX, J.; BALL, R.G. Potent Nor -triterpenoid Blockers of the Voltagegated Potassium Channel Kv1.3 from Spachea correae, n.39, p.2895-2898, 1998.
. GUEVARA, A.P.; LIM-SYLIANCO, C.Y.; DYRIT, F.M.; FINCH, P. Acylglucosyl sterols from Momordica Charatia. Phytochemistry, v.28, n.6, p.1721-1724, 1989.
. GUIMARÃES, A.C. Estudo Químico e Avaliação Biológica das Folhas de Protium strumosum, P. grandifolium, P. llewelynii e P. altsonii, MSc Thesis, University of Amazon, Manaus, Brasil, 1997.
. HOENE, F.C. Plantas e substâncias vegetais tóxicas e medicinais, São Paulo Graphicars ed., 355 pp.,1939.
. IVORRA, M.D.; PAYA, M.; VILLAR, A. A review of natural products ans plants as potencial antidiabetic drugs. Journal of Ethnopharmacology, v.27, n.3, p.243-275, 1989.
. KHALID, S.A. Chemistry of the Burseraceae. In: P.G. Waterman and M. F. Grundon. Ed. Chemistry and Chemical Taxonomy of the Rutales, Academic Press, New York, pp. 281-299, 1983.
. KIKUCHI, T.; YOKOI, T.; NIWA, M.; SHINGU, T. Application of Homonuclear Internuclear Double Resonance Technique in the Triterpene Field. II. Assignements of Methyl Ressonances of Triterpenes related to Friedelin. Chemical Pharmaceutical Bulletin, v.28, n.7, p.2014-2023, 1980.
. KUNDU, J.K.; ROUF, A.S.S.; HOSSAIN, M.N.; HASAN, C.M.; RASHID, M.A. Antitumor activity of epifriedelanol from Vitis trifolia, Fitoterapia, v.71, n.5, p.577-579, 2000.
. LAING, M.; BURKE-LAING, M.; BARTHO, R.; WEEKS, C.M. Crystal and Molecular Structure of Epifriedelinol. Tetrahedron Letters, n. 43, p.3839-3842, 1977.
. LIMA, F.V.; MALHEIROS, A.; OTUKI, M.F.; CALIXTO, J.B.; YUNES, R.A.; CECHINEL-FILHO, V.; MONACHE, F.D. Three New Triterpenes from the Resinous Bark of Protium kleinii and their Antinociceptive Activity. Journal of the Brazilian Chemical Society, v.16, n.3B, p.578-582, 2005.
. LIU, J. Oleanolic acid and ursolic acid: Research perspectives. Journal of Ethnopharmacology, v.100, n.1-2, p.92-94, 2005.
. LOGGIA, R.D.; TUBARO, A.; SOSA, S.; BECKER, H.; SAAR, S.; ISAAC, O. The Role of Triterpenoids in the Topical Anti-Inflammatory Activity of Calendula officinalis Flowers. Planta Medica, v.60, n.6, p.516-520, 1994.
. MALDONADO, E.; BELLO, M.; VILLASEÑOR, J.L.; ORTEGA, A. Acyclic diterpenes from Perymenium hintonii. Phytochemistry, v.49, n.4, p.1115-1118, 1998.
. MABBERLEY, D.J., The Plant Book - A portable dictionary of the vascular plants. 2nd ed. Cambridge University Press, London, p.241, 1998.
. MAHATO, S.B.; KUNDU, A.P.13 C NMR Spectra of Pentacyclic Triterpenoids - A compilation and some salient features. Phytochemistry, v.37, n.6, p.517-1575, 1994.
. MAIA, R.M.; BARBOSA, P.R.; CRUZ, F.G.; ROQUE, N.F.; FASCIO, M. Triterpenos da Resina de Protium heptaphyllum March (Burseraceae): Caracterização em Misturas Binárias. Química Nova, v.23, n.3, p.623-626, 2000.
. OLIVEIRA, F.A.; VIEIRA-JUNIOR, G.M.; ALMEIDA, F.R.; FLORÊNCIO, M.G.; LIMA JR., R.C.; SILVA, R.M.; SANTOS, F.A.; RAO, V.S. Gatroprotective and anti-inflammatory effects of resin from Protium heptaphyllum in mice and rats. Pharmacological Research, n.49, n.2, p.105-111, 2004.
. OLIVEIRA, F.A.; CHAVES, M.H.; ALMEIDA, F.R.C.; LIMA JR., R.C.P.; SILVA, R.M.; MAIA, J.L.; BRITO, G.A.A.C.; SANTOS, F.A.; RAO, V.S. Protective effect of of áand â-amyrin, a triterpene mixture from Protium heptaphyllum (Aubl.) March. trunk wood resin, against acetaminophen-induced liver injury in mice. Journal of Ethnopharmacology, n.98, n.1-2, p.103-108, 2005a.
. OLIVEIRA, F.A.; COSTA, C.L.S.; CHAVES, M.H.; ALMEIDA, F.R.C.; CAVALCANTE, I.J.M.; LIMA, A.F.; LIMA JR., R.C.P.; SILVA, R.M.; CAMPOS, A.R.; SANTOS, F.A.; RAO, V.S. Attenuation of capsaicininduced acute and visceral nociceptive pain by áand â-amyrin, a triterpene mixture isolated from Protium heptaphyllum resin in mice. Life Sciences, v.77, n.23, p.2942-2952, 2005b.
. PATRA, A.; MUKHOPADHYAY, A.K.; MITRA, A.K. Carbon-13 Resonance Assignment of some Friedelanes and Taraxasteranes. Organic Magnetic Resonance, v.17, n.3, p.166-168, 1981.
. PATRA, A.; CHAUDHURI, S.K. Assignment of Carbon-13 Nuclear Magnetic Resonance Spectra of Some Friedelanes. Magnetic Resonance in Chemistry, v.25, p.95-100, 1987.
. PERNET, R. Phytochimie des Burseracees. Lloydia, v.35, n.3, p.280-287, 1972
. RAMOS, M.F.S.; SIANI, A.C.; TAPPIN, M.R.R.; GUIMARÃES, A.C.; RIBEIRO, J.E.L.S. Essential oils from oleoresins of Protium spp. Of the Amazon region. Flavour and Fragrance Journal, v.15, p.383-387, 2000.
. RIZZINI, C. T.; MORS, W. B. Botânica Econômica Brasileira, 2a Ed., Âmbito Cultural Edições Ltda., Rio de Janeiro, p.49-50, 1995.
. SIANI, A.C., RIBEIRO, M.N.S. Podocarpusflavone A from the leaves of Trattinnickia glaziovii ”, Biochemical Systematic and Ecology v.23, p.879, n.7-8, 1995.
. SIANI, A.C.; RAMOS, M. F.S.; MENEZES-DE-LIMA JR. O.; RIBEIRO-DOS-SANTOS, R.; FERNANDEZ-FERREIRA, E.; SOARES, R.O.A.; ROSAS, E.C.; SUSUNAGA, G.S.; GUIMARÃES, A.C.; ZOGHBI M.B.; HENRIQUES, M.G.M.O. Journal of Ethnopharmacology, v.66, n.1, p.57-69, 1999a.
. SIANI, A.C.; RAMOS, M.S.F.; GUIMARÃES, A.C.; SUSUNAGA, G.S.; ZOGHBI, M.G.B. Volatile Constituents from Oleoresin of Protium heptaphyllum (Aubl.) March. Journal of the Essential Oil Research, v.11, p.72-74, 1999b.
. SIANI, A.C.; GARRIDO, I.S.; MONTERIO, S.S.; CARVALHO, E.S.; RAMOS, M.F.S. Protium icicariba as a source of volatile essences. Biochemical Systematic and Ecology, v.32, p.477-489, 2004.
. SILVA, J.R.A. Óleo-resinas de Dez Espécies do Gênero Protium. MSc Thesis, University of Amazon, Manaus, Brazil, 120 pp, 1995.
. SIQUEIRA, J.B.G. Estudo fitoquímico do gênero Protium: P. unifoliolatum (Engl.) Engl. e P. laxiflorum Engl. MSc Thesis, University of Amazon, Manaus, Brazil, 119 pp, 1991.
. SUSUNAGA, G.S. Estudo químico e biológico da resina produzida pela espécie Protium heptaphyllum March. (Burseraceae). MSc Thesis, University of Amazon, Manaus, Brazil, 155 pp., 1996.
. VON HOLTZ, R.L.; FINK, C.S.; AWAD, A.B. âsitosterol activates the sphingomyelin cycle and induces apoptosis in LNCaP human prostate cancer cells. Nutrition and Cancer, v.32, n.1, p.8-12, 1998.
. WAGNER, H.; WIESENAUER, M. Phytotherapie. Ed. Gustav Fisher Verlag, Stuttgart, p.197-199, 1995.
. WAGNER, H.; BLADT, S. Plant Drug Analysis: A Thin Layer Chromatography Atlas. Berlin: Springer, 384pp. 1996.
. ZOGHBI, M.G.B.; SIQUEIRA, J.B.G.; WOLTER, E.L.A.; PEREIRA JÚNIOR, O.L. Constituintes Químicos de Protium paniculatum (Burseraceae). Acta Amazônica, v.24, p.59-61, 1994.