Estado da Arte
Cynara scolymus L. (Alcachofra)
Cynara scolymus L. (Artichoke)
Resumo
Devido as suas propriedades antioxidantes e seqüestrador de radicais livres, os extratos da alcachofra têm sido usados na medicina popular como hepatoprotetor, no tratamento de doenças cardiovasculares e na inibição da biossíntese do colesterol. Os flavonóides e os polifenóis presentes nesses extratos são os responsáveis por essas ações.
- Unitermos:
- Alcachofra.
- Nutracêutico.
- Substâncias Antioxidantes.
- Flavonóides.
- Planta Medicinal..
Abstract
Because of their antioxidant and free radical scavenging properties, extracts from artichoke have been used in folk medicine as hepatoprotective, in the treatment of cardiovascular diseases and in the inhibition of cholesterol biosynthesis. Flavonoids and polyphenols present in these extracts are responsible for such actions.
- Key Words:
- Artichoke.
- Nutraceutic.
- Antioxidant compounds.
- Flavonoids.
- Medicinal Plants.
Introdução
Cultivada e empregada com finalidades terapêuticas pelos antigos egípcios, gregos e romanos, a alcachofra apresenta propriedades colagoga, colerética, antiespasmódica, antidispéptica, hepatoprotetora e antitrombótica bem descritas na literatura.
Considerado um vegetal de baixo valor calórico, rico em fibras e ferro, baixo teor de gordura, e por conter carboidratos, em sua maioria, formados pela inulina, é, desta forma, indicado em dietas de diabéticos e pessoas com constipação intestinal e obesidade. Devido a sua riqueza nutricional, a alcachofra também é recomendada como antianêmico. Na França, a legislação permite a utilização de folhas de plantas, da droga moída ou extratos hidroalcoólicos como suplemento alimentar com as indicações ‘tradicionalmente usada como colerético e colagogo e para promover a eliminação renal de água’ (ALONSO, 2004; CARVALHO et al., 2003; BLUMENTHAL, 2000; WEISS; FINTELMANN, 2000; GARCIA, 2000; PDR, 1998; BOTSARIS, 1997; NEWALL et al., 1996).
Parte usada
A droga consiste das folhas de Cynara scolymus L. (Asteraceae).
Distribuição geográfica
A alcachofra é uma planta de porte herbáceo, nativa do Mediterrâneo e norte da África, sendo possivelmente originada a partir de espécies selvagens, tais como Cynara cardunculus e Cynara horrida, naturais da flora daquelas regiões (ALONSO, 2004; BLUMENTHAL, 2000; WEISS; FINTELMANN, 2000; PDR, 1998;BOTSARIS, 1997; NEWALL et al., 1996).
Descrição macroscópica
Planta herbácea perene, podendo atingir 1m. de altura; caule estriado ou sulcado, folhas pinatifadas, carnosas, pubescentes, denteadas e muito grandes (50 cm de comprimento e 25 cm de largura) com espinhos. A superfície superior é marrom-esverdeada e a inferior branco-acizentada, densamente coberta por espinhos. Pecíolo longo, com 1 cm de espessura. As flores são azuis com grandes brácteas inermes ou sub-inermes; carnosa na base, verdes ou vermelhas, formando capítulos muito grandes (ALONSO, 2004; BRITISH PHARMACOPOEIA, 1996; PIO CORRÊA, 1984).
Constituintes químicos principais
Devido à instabilidade dos metabólitos secundários presentes nos extratos da alcachofra e responsáveis pelas suas atividade terapêuticas, diversos métodos analíticos foram desenvolvidos para a determinação e separação desses componentes, como a cromatografia de camada fina (TLC), cromatografia de fase reversa acoplada à cromatografia de líquida de alta performance (RP-HPLC) (ADZET E PUIGMACIA, 1985; SÁNCHEZ-RABANEDA et al., 2003; SEVCIKOVA et al., 2002; SCHÜTZ et al., 2006a). Sevcikova et al. (2002) também argumentam que a TLC apresenta baixa resolução ou uma pequena reprodutibilidade e que; embora RP-HPLC apresente alta eficiência e reprodutibilidade adequada, as colunas cromatográficas são caras e utilizam grandes quantidades de solventes. Para superar esses problemas, Sevcikova e colaboradores propuseram a cromatografia micelar eletrocinética capilar (MEKC) para a análise do extrato da alcachofra. Esta técnica permitiu uma separação eficiente, análise rápida, baixo custo de corrida e o uso de solventes aquosos em vez de alcoólicos.
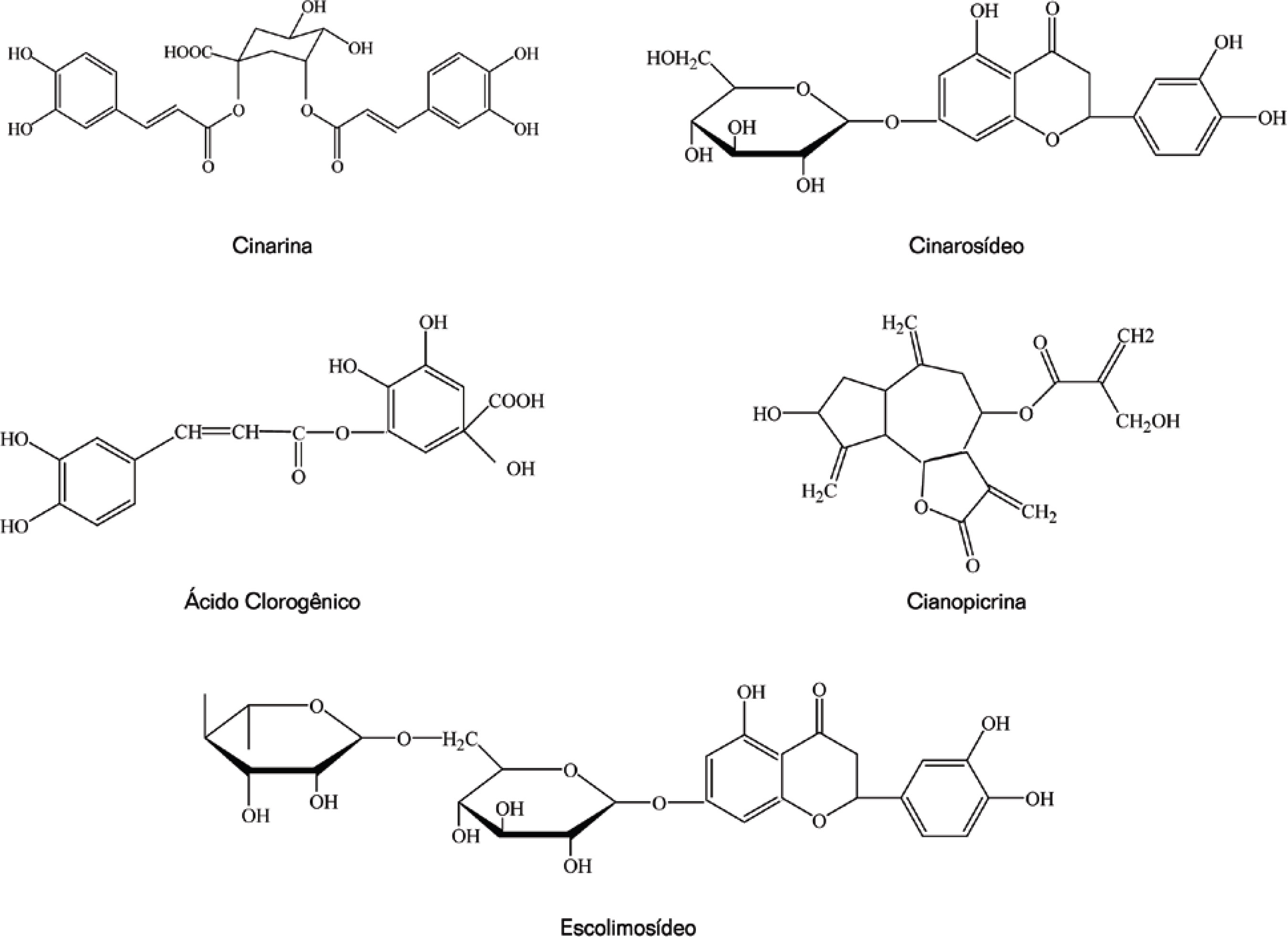
Os principais constituintes químicos da alcachofra são os polifenóis, principalmente os flavonóides. Schütz e colaboradores (2004) identificaram e quantificaram, por HPLC e espectrometria de massa, 22 metabólitos secundários presentes na alcachofra, sendo 11 ácidos cafeolquínicos (ácido cafeico, quatro ácido monocafeoilquínicos, o ácido dicafeoilquínico e 5 de seus derivados) e 8 flavonóides (três derivados da luteolina, 3 da apigenina, 1 da narigenina e a nariritina). Apigenina 7-O-glucoronídeo foi o principal flavonóide encontrado em todas as amostras, enquanto que o ácido 1,5-cafeoilquínico representou o principal ácido hidroxicinâmico isolado do ‘coração’da planta. Por outro lado, a cinarina (ácido 1,3-di-O-cafeoilquínico foi o componente predominante no suco devido a isomerização ocorrida durante a extração. Durante o processo de industrialização da alcachofra ocorre perda considerável de material na forma de resíduo que pode atingir 60% do material colhido. SÁNCHEZ-Rabaneda et al. (2003) identificaram 45 substâncias fenólicas presentes nesses resíduos, sendo que 33 foram isoladas pela primeira vez dos resíduos ou da própria alcachofra como o ácido gálico, o ácido protocatéico, a esculetina, o ácido p-cumárico, uma série de derivados da quercitrina como a rutina, o hiperosideo, a avicularina, além da própria quercitrina, além de novos derivados da luteolina. Numa determinação quantitativa dos componentes fenólicos de suplementos dietéticos e de fitomedicamentos da alcachofra, Schütz et al. (2006b) puderam determinar a presença majoritária do acido clorogênico em todas as amostras estudadas (exceto no suco das flores frescas), de derivados da apigenina, dos ácidos monoe di-cafeoilquínicos, luteolina e naringenina.
Polifenóis: ácido 5-O-cafeoilquínico (ácido clorogênico), o ácido 1,5-O-dicafeoilquínico (1,5-CQA), o ácido 1,3-O-dicafeoilquínico (cinarina) (SEVCIKOVA et al., 2002). A presença dos ácidos cafeico e clorogênico, da cinarina, do cinarosídeo, do escomolisídeo, de monoe diderivados do ácido cafeoilquínicos é relatada por uma série de autores (ADZET; PUIGMACIA, 1985; HINOU et al., 1985; NOLDIN et al., 2003; PANIZZI; SCARPATI, 1954; SÁNCHEZ-RABANEDA et al., 2003; SCHÜTZ et al., 2006a, 2006b; WANG et al., 2003).
Flavonóides: narirutina, luteolina-7-O-rutinosídeo, luteolina-7-O-glucosídeo, apigenina-7-O-rutinosídeo, apigenina-7-O-glucosídeo. A presença desses flavonóides nas folhas da alcachofra foi descrita por diversos autores (ADZET; PUIGMACIA, 1985; HINOU et al., 1985; NOLDIN et al., 2003; SÁNCHEZRABANEDA et al., 2003; SCHÜTZ et al., 2004, 2006a, 2006b; WANG et al., 2003).
Sesquiterpenos: cinaropicrina, aguerina B, e grosheimina. Sesquiterpenos glicosideos: cinarascolosideos A, B e C (SHIMODA et al 2003). NOLDIN et al., (2003), também conseguiram obter a cinaropicrina de alcachofra cultivada no Brasil.
Triterpenos: O lupeol foi obtido pela primeira da alcachofra por Noldin e colaboradores (2003); taraxasterol e ß-taraxasterol (fitosteróis) (ALONSO, 2004).
Composição alimentar por 100 g: calorias 49, proteínas 2,4 g, lipídeos totais, 0,1 g, hidratos de carbono 9,5 g, fibra 2 g, água 82,5 g, colesterol 0 g, sódio 47 g, potássio 350 g, fósforo 130 g, cálcio 53 g, ferro 1,2 mg, provitamina A 17 μg, vitamina E 0,2 mg, tiamina 0,14 mg, riboflavina 0,01 mg, niacina 0,9 mg, vitamina C 8 mg, cobre 320 μg, manganês 380 μg, magnésio, sódio, ácido sílicico, ácido fosfórico (ALONSO, 2004; PIO CORRÊA, 1984).
Outros: São encontrados ainda na alcachofra: ácidos alifáticos (cítrico, fumárico, láctico, málico, succínico), enzimas (catalase, oxidase, peroxidases, cinarase, ascorbinase, protease), carboidratos (inulina), sais minerais, taninos, mucilagens, óleos essenciais (muuroleno, ß-selineno, alfa-humuleno, humuleno), pectina, galactosamina (ALONSO, 2004). Além dos componentes mencionados acima, Schütz e colaboradores (2006a) identificaram uma série de derivados das antocianina-cianidinas na alcachofra.
Farmacologia
Atividade antimicrobiana
Os extratos clorofórmico, etanólico, butanólico e de acetato de etila das folhas, cabeça, e do talo dessa planta apresentaram atividade antifúngica e antimicrobiana contra as bactérias Candida albicans, Candida lusitaniae, Agrobacterium tumefaciens, Micrococcus luteus, Escherichia coli, Salmonella typhimurium, Pseudomnonas aeruginosa, Bacilus subtili; e antifúngica contra Staphylococcus aureus, Saccharomyces cerevisiae, Saccharomyces carlsbergensis, Aspergillus niger, Penicillium oxalicum, Mucor mucedo, e Cladosporium cucumerinum em diferentes graus de inibição de acordo com o solvente e a parte da planta utilizada. O ácido clorogênico, a cinarina, a luteolina-7-rutinosídeo e o cinarosídeo apresentaram as maiores atividades, sendo mais ativas contra os fungos do que contra as bactérias. A concentração inibitória mínima ficou entre 50 e 200 μg/mL (ZHU et al., 2004, 2005).
Atividade gastrintestinal
O uso tradicional do extrato da alcachofra em gastroenterologia se deve à sua ação antidispéptica que é mediada pela sua atividade colerética. Rodriguez et al. (2002) verificaram um aumento significativo no fluxo da bile, contribuindo assim para a redução do colesterol, em ratos Wistar machos tratados durante 7 dias consecutivos com extrato de folhas da alcachofra (100, 200, 400 mg/kg) contendo 1,5% de ácido cafeoilquínico (medido como ácido clorogênico) e 0,5% de flavonóides (medido como luteolina-7-glucosideo). O resultado foi significativamente melhor do que o obtido com o ácido diidrocólico, uma droga colerética conhecida que aumenta o fluxo da bile. Emendorfer e colaboradores (2005a, 2005b) verificaram a atividade antiespasmódica (idem) da alcachofra. A fração diclorometano foi a mais promissora com uma IC50 de 0,93 mg/mL. O seu componente principal, o sesquiterpeno cinaropicrina, apresentou uma potência semelhante à da papaverina, um antiespasmódico bem conhecido e 14 vezes mais potente que a fração total, com uma IC50 de 0,065 mg/mL (EMENDORFER et al., 2005b). Wegener e Fintelmann (1999) identificaram os flavonóides e os derivados do ácido cafeoilquínico como sendo os responsáveis pela eficácia do extrato da alcachofra no tratamento de complicações digestivas como perda de apetite, náusea e dores abdominais.
A alcachofra também tem sido utilizada com sucesso por pacientes portadores da síndrome do intestino irritado (BUNDY et al., 2004; HOLTMANN et al 2003; MARAKIS et al., 2002, WALKER et al., 2001). Holtmann et al. (2003), realizaram um estudo envolvendo 244 pacientes portadores de dispepsia (129 dos quais tratados com extrato de alcachofra e 115 com placebo). Os voluntários receberam 320 mg do extrato duas vezes por dia durante seis semanas. Os resultados mostraram uma melhora significativa no alívio dos sintomas da doença para aqueles que receberam o extrato. Em um estudo envolvendo 208 indivíduos portadores da síndrome do intestino irritado, Bundy et al. (2004), relataram uma sensível melhora (26,8%) após a utilização do extrato das folhas de alcachofra. Já no estudo realizado por Walker et al. (2001), 96% dos pacientes tratados apresentaram uma melhora após a administração do extrato. Os sintomas da dispepsia também podem ser tratados com o mesmo extrato, como relatado por Marakis et al. (2002). Esses autores observaram uma redução de 40% nos sintomas de dispepsia em 526 pacientes (454 dos quais completaram o tratamento) tratados durante 2 meses com extrato da planta contendo um mínimo de 0,3% de flavonóides (calculado como luteolina-7-glucosideo) e 2,4% de ácidos cafeoilquínico (calculado como ácido clorogênico). Cada um dos participantes recebeu 1 ou 2 cápsulas de 320 mg diariamente. Esses resultados confirmam o uso popular da alcachofra nos problemas gastrintestinais.
Atividade antivírus
McDougall et al. (1998), Zhu et al. (1999) e King et al. (1999) relataram a atividade anti-HIV da alcachofra através da inibição da enzima HIV integrase, o que impede a replicação do vírus em células de cultura. A concentração para a inibição da enzima é de 150-840 nM e entre 2 e 12 μM para a replicação. Os ácidos dicafeoilquínicos (e seus derivados) são os responsáveis por esta ação. KING et al., (1999) demonstraram que a porção biscatecol dos ácidos é necessária para a inibição da enzima, enquanto que pelo menos um grupo carboxila livre para a atividade anti-HIV. Slanina e colaboradores (2001) apresentaram um método para a preparação da cinarina (ácido 1,3-cafeoilquínico), substância capaz de inibir a replicação do HIV em células MT-2.
Atividade hepatoprotetora
Adzet et al., (1987) testaram a capacidade hepatoprotetora da cinarina, da luteolina-7-glucosideo e dos ácidos clorogênico, isoclorogênico, cafeico e quínico e concluíram que apenas a cinarina e em menor proporção o ácido caféico exerceram um efeito protetor contra a toxicidade produzida por CCl4 em hepatócitos de ratos. Wegener e Fintelmann (1999) também observaram resultados semelhantes.
Atividade no sistema cardíaco
Dados epidemiológicos mostram uma pequena incidência de doenças coronarianas no Mediterrâneo, o que está relacionado à dieta da população daquela região, onde o consumo de vegetais, entre os quais o de alcachofra, é elevado. Na França, apesar do alto consumo de alimentos gordurosos, o índice de doenças cardíacas também é pequeno. Este fato é conhecido como ‘o Paradoxo Francês’ e tem sido atribuído ao consumo de vinho tinto naquele país. Tanto os vegetais como o vinho tinto, são ricos em flavonóides. Como foi mencionado na seção anterior, polifenóis e flavonóides são os principais constituintes da alcachofra e as suas propriedades antioxidantes são responsáveis pelas suas atividades terapêuticas, principalmente no combate a aterosclerose e a hipercolesterolemia (BROWN; RICE-EVANS, 1998; CAI; HARRISON, 2000; ENGLISCH et al., 2000; GEBHARDT 1997, 1998, 2001, 2002; GRANDE et al., 2004; HECKERS et al., 1977; JIMÉNEZ-ESCRIG et al., 2003; LIETTI, 1977; LUPATTELLI et al., 2004; SHIMODA et al., 2003; SPERONI et al., 2003; ZAPOLSKA-DOWNAR et al., 2002).
Em 1977, Lietti desenvolveu um trabalho in vivo usando extratos de alcachofra e 17 ratos machos (10 dos quais serviram como controle e 7 tratados com extrato de alcachofra). Foram utilizados os extratos purificados (contendo 46% de ácidocafeoilquínico, medido como ácido clorogênico) e o bruto (contendo 19% de ácidocafeoilquínico, medido como ácido clorogênico). O extrato purificado administrado em doses diárias de 100 mg/kg, por via intraperitoneal, reduziu de maneira significativa o nível do colesterol no plasma. Ficou também demonstrado que os responsáveis pela ação colerética são os ácidos monocafeoilquínicos e não a cinarina (ácido 1,5-dicafeoilquínico) como se acreditava. Na mesma época Heckers et al., (1977) testaram a cinarina (doses de 250 e 750 mg/dia) durante 3 meses, em 17 pacientes portadores de hiperlipoproteinemia e verificaram que as concentrações de colesterol e triglicerídeos, não sofreram alterações significativas durante o tratamento. Estudando o efeito do extrato aquoso das folhas de alcachofra em hepatócitos de ratos, Gebhardt (1998) concluiu que o mesmo é capaz de inibir a biossíntese do colesterol hepático de maneira bifásica, sendo o cinarosídeo e a aglicona luteolina os principais responsáveis por esta inibição. Lupatteli et al., (2004) realizaram estudos semelhantes em seres humanos avaliaram 18 indivíduos moderadamente hiperlipêmicos (LDL colesterol > 130 < 200 mg/dL e/ou triglicerídeos >150 < 250 mg/dL) de ambos os sexos, com idade entre 35-60 anos e 10 indivíduos hiperlipêmicos. Após o tratamento com a alcachofra (20 mL/dia durante seis semanas) houve uma redução acentuada tanto no colesterol total como no LDL colesterol, o que indica uma capacidade do vaso se dilatar. Depois do tratamento, foi constada uma pequena diminuição no colesterol HDL e um aumento de cerca de 6% nos triglicerídeos. Resultados referentes à diminuição da biossíntese do colesterol foram apresentados por Gebhardt (1997, 1998, 2001), Grande et al. (2004), Jiménez-Escrig et al. (2003), Zapolska-Downar et al. (2002) e ENGLISCH et al. (2000) avaliaram a eficácia e a tolerabilidade do extrato seco da alcachofra e do extrato aquoso de tabletes contendo extrato da planta (CY 450) no tratamento da hiperlipoproteinemia em comparação com placebo em 145 indivíduos. Mudanças no colesterol total e no colesterol LDL no final do tratamento evidenciaram uma superioridade estatística significativa no extrato seco da alcachofra sobre o placebo. A diminuição do colesterol total foi de 18,5%, comparada com 8,6% do grupo placebo. O LDL colesterol no grupo CY 450 sofreu uma diminuição de 22,9% comparado com 6,3% do placebo. Os resultados desse estudo mostram que os tabletes contendo extrato seco de alcachofra podem ser usados no tratamento da hiperlipoproteinemia e, assim, prevenir aterosclerose (o correto é aterosclerose e não aterosclerose) e doenças coronarianas.
Uma vez que as preparações comerciais da alcachofra podem diferir nas suas atividades terapêuticas Speroni et al. (2003) examinaram e compararam os efeitos de quatro amostras comerciais da alcachofra no fluxo biliar e na capacidade antioxidante em ratos machos. Dois grupos, cada um com seis animais, receberam (via oral) 40 e 80 mg/kg de ácido clorogênico, correspondente ao conteúdo de derivados do ácido cafeoil em 1 e 2 g/Kg do terceiro extrato. Além disso, cada grupo recebeu também 0,005 e 0,01 mg/Kg de cinarina, correspondente ao conteúdo de 1 e 2 g/kg do primeiro extrato. A cinarina e o ácido clorogênico, administrados em estado puro, não apresentaram atividade colerética nas doses testadas. Os resultados mostraram que os extratos com maior conteúdo de derivados fenólicos apresentaram uma proteção maior do fígado assim como na capacidade antioxidante. Por outro lado, a administração do ácido clorogênico em doses equivalentes às presentes no extrato, não mostrou atividade colerética ou protetora. É provável, portanto, que os derivados cafeoílicos exerçam um papel nas atividades terapêuticas da alcachofra quando administrados in vitro, mas não isoladamente. O extrato das folhas da alcachofra é capaz não apenas de aumentar o fluxo biliar, ao reduzir o nível do colesterol, mas também de restabelecer este fluxo quando o mesmo é inibido. Esses efeitos são exercidos pela luteolina e em menor grau pela luteolina-7-0-gluscosídeo, enquanto o ácido clorogênico e o ácido 1,5-dicafeoilquínico são quase ineficientes. Os efeitos citotóxicos só foram observados com doses elevadas (<1mg/mL) (GEBHARDT, 1998, 2001).
Brown e Rice-Evans (1998) examinaram as propriedades do extrato da alcachofra rico em luteolina, também observaram uma diminuição na oxidação do LDL de maneira dose dependente. A aglicona pura, luteolina (1 μM) demonstrou uma eficiência semelhante a 20 vezes maior do que o extrato bruto na inibição da peroxidação de lipídeos. Acho que assim fica melhor: A luteolina pura demonstrou uma eficiência 20 vezes superior ao do extrato bruto na inibição da peroxidação de lipídeos. A luteolina-7-O-glicosídeo também apresentou uma redução dose-dependente, porém menos eficaz que a do luteolina.
Farmacocinética e Farmacodinâmica
A aterosclerose é uma patologia complexa produzida pelo stress oxidativo, disfunção endotelial e inflamação. A disfunção endotelial; que é caracterizada pela perda da biodisponibilidade do óxido nítrico, é a primeira etapa da aterosclerose e a sua principal complicação e existem evidências sobre o envolvimento do stress oxidativo no início e na manutenção da doença. O stress oxidativo é definido como o desequilíbrio entre a produção local de espécies reativas de oxigênio (ERO) e mecanismos antioxidantes. As EROs são subprodutos de diversas enzimas cujas atividades são expressas e controladas pelas citocinas e fatores de crescimento (BANDYOPADHYAY et al., 2004; ZAPOLSKA-DOWNAR et al., 2002). Acredita-se que, a oxidação do LDL pelas espécies reativas de oxigênio seja um passo primordial no início e progressão da doença (ROSS, 1999). Estas espécies reativas de oxigênio (EROs) são produzidas em todas as células aeróbicas, sendo constituídas de moléculas muito pequenas, como é o caso do ânion superóxido (O -), do radical hidroxila (.OH), do peróxido de hidrogênio (H2O2), do ácido hipoclorídrico (HClO) e do óxido nítrico (NO). A produção excessiva de EROs pode superar o mecanismo de defesa endógena antioxidante, levando à oxidação de macromoléculas como DNA, proteínas, carboidratos e lipídeos. Essa condição é conhecida como stress oxidativo; o qual está envolvido na patogenia de doenças cardiovasculares, incluindo a hipercolesterolemia, aterosclerose, (é aterosclerose) hipertensão, diabetes e doenças da pele; podendo ainda provocar danos no DNA (BERRA et al., 2006; CAI; HARRIISON, 2000; GUARATINI et al., 2007). Normalmente, o organismo tem as defesas naturais contra as ROS através de mecanismos enzimáticos e não enzimáticos. Entre os primeiros encontram-se a superóxido desmutase, a catalase, glutationa peroxidase. Os mecanismos não enzimáticos incluem o selênio, a vitamina E, a vitamina C, o betacaroteno, o ácido úrico, a coenzima Q10 (ubiqüinona) e os flavonóides (BANDYOPADHYAY et al., 2004).
As substâncias antioxidantes podem limitar o stress oxidativo e restaurar as funções endoteliais (SCHULZ et al., 2004). Entre elas encontram-se os flavonóides. Os flavonóides são um grupo heterogêneo de metabolitos secundários encontrados em diversas partes dos vegetais (folhas, flores, caules, ramos, raízes e frutos) protegendo-os dos raios ultravioleta, do ataque de insetos, fungos e microorganismos, atuando ainda na atração de polinizadores, na pigmentação, no controle da ação hormonal, inibidores de enzimas, antioxidantes e na alelopatia. Dentro deste grupo existem subgrupos como flavonas, flavonóis, flavanonas, isoflavonóides, neoflavonóides, biflavonóides, flavanas, flavanonas, flavonas, chalconas, auronas e antocianinas. Do ponto de vista terapêutico, eles podem atuar como agentes antivirais, antiinflamatórios, antioxidantes, antitumorais e ainda na atividade hormonal e sobre a permeabilidade capilar. Existem atualmente mais de 4.200 dessas substâncias (ZUANAZZI e MONTANHA, 2003). Os flavonóides são capazes de inibir a oxidação do LDL através de uma série de mecanismos: 1) seqüestro de radicais livres agindo como agentes redutores; 2) quelação de íons metálicos de transição, portanto reduzindo a geração de radicais livres; 3) sparing da vitamina E, e dos carotenóides no LDL, protegendo-o da oxidação; 4) favorecendo a ação das serum-paraoxonases, assim antagonizando a peroxidação de lipídeos (FUHRMAN; AVIRAM 2001).
A atividade antioxidante dos flavonóides está obviamente ligada à sua estrutura e pode ser determinada pelos seguintes fatores: (1) reatividade como agente doador de H ou de elétrons, (2) estabilidade do radical flavonil formado, (3) reatividade frente a outros antioxidantes, (4) capacidade de quelar metais de transição e (5) solubilidade e interação com as membranas. Ao mesmo tempo, a sua capacidade de seqüestrar radicais livres está diretamente ligada ao seu potencial de oxidação e das espécies a serem seqüestradas, sendo que quanto menor o potencial de oxidação dos flavonóides, maior é a sua capacidade como seqüestrador de radicais livres (BARREIROS et al., 2006).
Zapolska-Downar et al. (2002) verificaram que os extratos etanólico e aquoso das folhas de alcachofra inibem o stress oxidativo de maneira dose-dependente e tempo dependente. A inibição também depende da velocidade de produção das ERO. O extrato da alcachofra foi capaz de neutralizar a produção de ERO. Nas células endoteliais, o extrato etanólico (50 μg/mL) reduziu a produção de ERO induzida por LDL oxidado em 60%, enquanto que com o extrato aquoso (50 μg/mL) a redução foi de 43%. As propriedades da alcachofra observadas por Zapólska podem ser explicadas através da ação antioxidante de seus constituintes, como os flavonóides, principalmente luteolina e seus derivados, e os ácidos hidroxicinâmicos, que são eficientes doadores de hidrogênio.
Lupatteli et al. (2004) avaliaram 18 indivíduos moderadamente hiperlipêmicos (LDL colesterol > 130 < 200 mg/dL e/ou triglicerídeos >150 < 250mg/ dL) de ambos os sexos e 10 indivíduos hiperlipêmicos. Após o tratamento com a alcachofra (20 mL/ dia durante seis semanas) houve um aumento nos triglicerídeos e uma redução no colesterol total e no LDL colesterol. A proteção conferida pelo extrato de alcachofra contra o stress oxidativo induzido por hidroperóxido foi demonstrada por GEBHARDT (1997). A oxidação do LDL pode ser diminuída por esse extrato. O extrato de alcachofra pode reduzir o risco de aterosclerose por dois mecanismos: 1) impedindo a oxidação das lipoproteínas do sangue e 2) reduzindo os níveis de colesterol no sangue. Gebhardt (1998) verificou a inibição da biossíntese do colesterol em cultura de hepatócitos de ratos com o extrato aquoso de folhas de alcachofra a partir do acetato-C14, sendo a luteolina a principal responsável por esse efeito seguida do cinarosídeo, do ácido clorogênico, do ácido caféico e da cinarina. Os efeitos citotóxicos só foram observados com doses elevadas (<1mg/mL). De acordo com esse autor, a inibição ocorre ao nível da enzima hidroximetilglutarico-CoA-redutase, uma vez que a substituição do acetato-C14 pelo mevalonato-C14, impediu a inibição. Posteriormente, esse mesmo autor verificou que doses elevadas do extrato metanólico produziam moderadamente o mesmo efeito em células HepG2. Uma vez que o cianorisídeo é o principal glicosídeo do extrato, tanto esse componente como a sua aglicona luteolina, foram testados. Como resultado, ficou demonstrado que a alcachofra reduz a biossíntese do colesterol de maneira indireta. A atividade do extrato bruto da alcachofra contra o stress oxidativo em leucócitos humanos foi avaliada por Perez-Garcia et al. (2000). Esses autores também observaram a atividade a atividade dosedependente da cinarina, dos ácidos caféico e clorogênico e da luteolina nesse sentido.
O óxido nítrico produzido pela enzima óxido nítrico sintase (eNOS) representa um princípio antitrombótico e antiaterosclerose (é aterosclerose). Portanto, um aumento na expressão dessa enzima pode oferecer uma proteção contra doenças cardiovasculares. Em células EA.hy 926, uma linha de células derivadas da veia umbilical endotelial humana, o extrato de folhas da alcachofra aumentou a atividade da eNOS. Uma subfração orgânica do extrato foi mais potente do que o extrato bruto, enquanto que a subfração aquosa não teve efeito. A produção de NO aumentou com ambos os extratos. Os ácidos cafeoilquínicos e os flavonóides representam os dois principais grupos de constituintes do extrato da alcachofra. Os flavonóides luteolina e cinarosídeo aumentaram a produção da enzima, enquanto que os efeitos dos ácidos cafeoilquínicos cinarina e ácido clorogênico foram nulos. Assim, além da capacidade de reduzir a taxa de lipídeos da sua propriedade antioxidante, um aumento na eNOS pode contribuir na prevenção de doenças cardiovasculares. O óxido nítrico é um potente vasodilatador, contribuindo para o controle da pressão arterial. O bloqueio da síntese do NO provoca vasoconstrição periférica e elevação da pressão arterial. Além do seu efeito vasodilatador, o NO protege os vasos sangüíneos da trombose, inibindo a agregação plaquetária e a adesão. Além disso, o NO endotelial apresenta diversas atividades antiaterosclerose: 1) impede a adesão de leucócitos ao endotélio vascular e a migração de leucócitos na parede vascular; 2) diminui a permeabilidade do endotélio, reduz o influxo de lipoproteínas e inibe a oxidação do LDL; 3) inibe a síntese do DNA, a mitogênese e a proliferação de células do músculo vascular liso. O extrato de alcachofra também estimula a produção vascular de óxido nítrico. Os constituintes ativos responsáveis pela regulação da eNOS estão presentes na fração orgânica, rica em polifenóis, principalmente ácidos cafeoilquínicos (cinarina e acido clorogênico) e flavonóides (luteolina e apigenina) (LI et al., 2004). A produção/disponibilidade da função vasorelaxante do óxido nítrico (NO) desempenha um papel importante no desenvolvimento do stress oxidativo da disfunção endotelial (CAI e HARRISON, 2000). As espécies reativas de oxigênio podem inativar diretamente o NO, modular funções protéicas e atuar como sinalizadores de moléculas celulares. A ação deste gás na vasoproteção está associada a: (1) manutenção do tônus vascular, (2) regulação da pressão sangüínea, (3) prevenção da agregação plaquetária, (4) inibição da adesão de monócitos e neutrófilos ao endotélio vascular, (5) efeito antiproliferativo e (6) efeito antioxidante (DUSSE et al., 2003).
BROWN e RICE-EVANS (1998) examinaram as propriedades do extrato rico em luteolina presentes na alcachofra como agentes sequetradores de radicais livres, através da sua capacidade de evitar a oxidação do LDL mediata por Cu2+. O extrato da alcachofra retarda esse processo de maneira dose-dependente. As propriedades quelantes do cobre da luteolina e da luteolina-7-O-glicosídeo, sugerem um papel da quelação nos efeitos antioxidantes do extrato. Os flavonóides presentes no extrato atuam como doadores de hidrogênio e quelantes de íons metálicos. As funções do NO são complexas e antagônicas. O NO pode ser benéfico ou potencialmente tóxico dependendo de sua concentração ou depuração tecidual. É como uma ‘faca de dois gumes’ na expressão de Schmidt e Walter (1996). Ele pode atuar como neurotransmissor, na regulação da pressão sanguínea e como agente citotóxico. No sistema cardiovascular a principal função do óxido nítrico é no controle de adesão dos elementos sanguíneos (leucócitos e plaquetas) à parede do endotélio (BARRETO et al., 2005; BECKMAN et al., 1996; DUSSE et al., 2003; FLORA FILHO; ZILBERSTEIN, 2000; QUEIROZ; BATISTA, 1999). Uma alteração nos níveis de concentração do NO (deficiência ou excesso) pode provocar uma série de processos patológicos. A sua deficiência pode haver hipertensão, angina ou impotência. Nesse caso, o uso de doadores de NO pode aumentar a sua disponibilidade. Por outro lado, a superprodução pode causar inflamações severas, choque circulatório ou infarto. Utilizam-se então inibidores da NO sintase, enzima responsável pela sua produção (BARRETO et al., 2005). Para a maioria dos autores, o NO é uma molécula de vida curta e altamente reativa, mas para BECKMAN e KOPPENOL (1996) essa descrição é incorreta. Para eles, o NO é menos reativo e tóxico em concentrações biológicas relevantes do que as experiências in vitro sugerem. A toxicidade do NO é modesta, mas é potencialmente aumentada através da reação com o anion superóxido, produzindo o poderoso oxidante peroxinitrito (ONOO-). O NO seria o lado bom, o superóxido o lado mau e o peroxinitrito o lado feio do sistema.
A fim de examinar a participação não apenas dos constituintes presentes na alcachofra, mas também dos seus metabólitos. Wittemer e Veit (2003) estudaram o metabolismo de alguns desses componentes (ácidos monoe dicafeoilquinicos): ácido caféico e flavonóides (luteolina-7-O-glucosideo). Os pesquisadores administraram dois extratos A e B a 14 indivíduos sadios. O extrato A continha o ácido cafeoilquínico (equivalente a 107,0 mg de ácido caféico e luteolina glicosideo equivalente a 14.4 ,mg de luteolina), enquanto que o extrato B continha o ácido cafeoilquínico (equivalente a 153,8 mg de ácido caféico e luteolina glicosídeo equivalente a 35,2 mg de luteolina). A análise do plasma e da urina não mostrou a presença dos polifenóis e ácidos fenólicos presentes no extrato. Entretanto, o ácido caféico, os seus derivados metilados (ácido ferúlico e isoferúlico), e seus produtos de hidrogenação (ácidos dihidrocaféico e diidroferúlico) foram identificados como metabólitos derivados dos ácidos cafeoilquínicos. Em um estudo anterior, Rechner et al. (2001) chegaram a um resultado semelhante. Além dos flavonóides e polifenóis, a alcachofra possui outros constituintes químicos com ação farmacológica. Shimoda et al. (2003) relataram que os sesquiterpenos e sesquiterpenos glicosídeos por eles isolados da folhas da alcachofra apresentaram atividade na redução do nível de triglicerídeos e que os grupos funcionais nas posições 3 e 8 e a porção exo-metileno no anel alfa-metilenogama-butirolactonico são essenciais para a atividade anti-hiperlipidêmica. Embora este texto se refira exclusivamente à alcachofra, outros nutracêuticos contendo polifenóis podem, em princípio, apresentar os mesmos benefícios. Assim, a atividade antioxidante da manga (Mangifera indica) foi confirmada por Núñez-Sellés (2005).
Matéria estranha
Não mais do que 2% (BRITISH PHARMACOPOEIA, 1996).
Cinzas totais
Não mais do que 15% (BRITISH PHARMACOPOEIA, 1996). PELEGRINI ET AL., (2001), registraram um teor de 13,21%, enquanto que o de cinzas insolúveis em água foi de 0,29%.
Cinzas insolúveis em ácido hidroclórico
Não mais do que 4% (BRITISH PHARMACOPOEIA, 1996).
Matéria solúvel em água
Não mais do que 25% (BRITISH PHARMACOPOEIA, 1996).
Contra-indicações
Devido ao efeito sobre o trato biliar, não deve ser administrado se houver bloqueio do duto biliar. Podem ocorrer cólicas em pacientes que sofrem de pedras nos rins. (BLUMENTHAL, 2000, GARCIA, 2000; PDR, 1998). Segundo Garcia (2000) e Alonso (2004) deve ser evitada durante a lactação, mas Blumenthal (2000) afirma não haver restrições durante esse período.
Dosagem:
A dose diária média é de 6 mg da droga. Dose única: 500 mg do extrato seco.
Folhas: 2 g, três vezes ao dia.
Infusão: Para Blumenthal (2000), a alcachofra não é preparada como infusão, mas Garcia (2000) preconiza a ingestão, antes das refeições, de uma xícara de infusão obtida a partir de 30 g/L durante 15 minutos. Tintura (1:5 g/mL) três vezes ao dia (ALONSO, 2004; BLUMENTHAL, 2000; GARCIA, 2000; PDR, 1998).
Precaução/intoxicação
O uso de diuréticos em presença de hipertensão ou cardiopatias só deve ser feita sob controle médico, dada a possibilidade de aparição de uma descompensação tensional ou, se a eliminação de potássio for considerável, uma potenciação do efeito dos cardiotônicos (GARCIA, 2000). Apesar de reações de hipersensibilidade aos alimentos ocorrerem geralmente após a ingestão, antígenos de alimentos podem provocar sintomas alérgicos pela manipulação constante dos mesmos. A ocorrência de urticária em pessoas que trabalham no processamento da alcachofra foi relatada por QUIRCE et al., (1996) e atribuída à presença de lactonas sequiterpênicas como a cinaropicrina (MEDING, 1983). NOLDIN e colaboradores (2003), alertaram para o uso da alcachofra produzida no Brasil devido à presença, desta mesma lactona considerada neurotóxica.
Descrição nos códigos oficiais
Está descrita nas Farmacopéias Francesa, Brasileira (segunda edição e Fasc. 3, 2001) Britânica, Romena, Italiana e Africana. Suas folhas estão recomendadas para uso medicinal pelos Ministérios da Saúde da Argentina, Bolívia, Chile, Colômbia, Espanha e Venezuela (ALONSO, 2004; BLUMENTHAL, 2000).
Referências
ADZET, T.A.; CAMARASA, J.; LAGUNA. J.C. Hepaptoprotective activity of polyphenolic compounds from Cynara scolymus against CCl4 toxicity in isolated rat hepatocytes. Journal of Natural Products, v.50, p.612-617, 1987.
ADZET, T.A.; PUIGMACIA, M. High Performance Liquid Chromatography of Caffeoylquinic acid derivatives of Cynara scolymus L. leaves. Journal of Chromatography A, v.348, p.447-453, 1985.
ALONSO, J. Tratado de Fitofármacos y Nutraceuticos. Editora Corpus. Argentina, 2004
BANDYOPADHYAY, D.; CHATTOPADHYAY, A.; GHOSH, G.; DATTA, A.S. Oxidative Stress-Induced Ischemic Heart Disease: Protection by Antioxidants. Current Medicinal Chemistry, v.11, p.369-387, 2004.
BARREIROS, A.L.B; DAVID, J.; DAVID, J.M. Estresse oxidativo: relação entre geração de espécies reativas e defesa do organismo. Química Nova, v.29, p.113-123, 2006.
BARRETO, R.L.; CORREIA, C.R.D; MUSCARÁ, M.N. Óxido nítrico: propriedades e potencial terapêutico. Química Nova, v. 2, p. 1046-1054, 2005.
BECKMAN, J.S.; KOPPENOL, W.H. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and the ugly. American Journal of Physiology, v.271, p.1424-1437, 1996.
BERRA, C.M, MENCK, C.F.M. e MASCIO, P. Estress oxidativo, lesões e processos de sinalização no controle do ciclo celular. Química Nova, v.29, p.1340-1344, 2006.
BLUMENTHAL, M. Herbal Medicine. American Botanical Council. New York, 2000.
BOTSARIS, A.S. As Fórmulas Mágicas das Plantas, 2ª Edição. Ed. Nova Era, p. 234-237, 1997.
BRITISH PHARMACOPOEIA. Artichoke, British Herbal Medicine Association. Londres, p. 26-27, 1996.
BROWN, J.E; RICE-EVANS, C.A. Luteolin-rich artichoke extract protects low density lipoprotein from oxidation in vitro. Free Radical Research v.29, p.247-255, 1998.
BUNDY, R.; WALKER, A. F.; MIDDLETON, R. W.; MARAKIS, G.; BOOTH, J. C. Artichoke leaf extract reduces symptoms of irritable bowel syndrome and improves quality of life in otherwise healthy volunteers suffering from concomitant dyspepsia: a subset analysis. Alternative Complementary Medicine, v.10, N.4, p.667-669, 2004.
CAI, H.; HARRISON, D.G. Endothelial dysfunction in cardiovascular diseases. Circulation Research, v.87, p.840-844, 2000.
CARVALHO, J.C.T.; GOSMANN, G. e SCHENKEL, E. P. Compostos fenólicos simples e heterosídeos. In: Farmacognosia: Da Planta ao Medicamento, Simões, C.M.O.; Schenkel, E.P.; Gosmann, G,; Palazzo de Melo, J.C.; Mentz, L.A.; Petrovick. P.R. eds. Editora da UFRGS/ Editora da UFSC. Porto Alegre/Florianópolis, p. 519-535, 2003.
DUSSE, L.M.S.; VIEIRA, L.M.; CARVALHO, M.G. Revisão sobre o óxido nítrico. Jornal Brasileiro de Patologia Médica e Laboratorial, v.39, p.343-350, 2003.
EMENDORFER, F,; EMENDORFER. F., BELLATO, F., NOIDIN, V.F., NIERO, R., CECHINEL-FILHO, V.; CARDOZO, A, M. Evaluation of the relaxant action of some Brazilian medicinal plants in isolated guinea-pig ileum duodenum. Journal of Pharmacy and Pharmaceutical Sciences, v.18, p.63-68, 2005a.
EMENDORFER, F.; EMENDORFER, F.; BELLATO, F.; NOIDIN, V.F.; CECHINEL-FILHO, V.; YUNES, R.A.; MONACHE, F.D.; CARDOZO, A.M. Antispasmodic activity of fractions and cynaropicrin from Cynara scoluymus L. on guinea-pig ileum. Biological and Pharmaceutical Bulletin, v.28, p.902-904, 2005b.
ENGLISCH, W.; BECKERS, C.; UNKAUF, M.; RUEPP, M E ZINSERLING, V. Efficacy of Artichoke Dry Extract in patients with hyperlipoproteinemia. Arzneimittel Forschung / Drug Research v.50, p.260-265, 2000.
FLORA, R.F.; ZILBERSTEIN, B. Óxido nítrico: o simples mensageiro percorrendo a complexidade. Metabolismo, síntese e funções. Revista da Associação Médica Brasileira, v.46, p.265-271, 2000.
FUHRMAN, B.; AVIRAM, M. Flavonoids protect LDL from oxidation and attenuates atherosclerose. Current Opinion in Lipidology, v.12, p.41-48, 2001.
GARCIA, A.A. Fitoterapia: Vademecum de Prescriptiones. Masson. Barcelona, 2000.
GEBHARDT, R. Antioxidative and protective properties of extracts from leaves of the artichoke (Cynara scolymus) against hydroperoxide-induced oxidative stress in cultured rat hepatocytes. Toxicology and Applied Pharmacology, v.144, p.279-286, 1997.
GEBHARDT, R. Inhibition of cholesterol biosynthesis in primary cultured rat hepatocytes by artichoke (Cynara scolymus L.) extracts. Journal of Pharmacology and Experimental Therapeutics, v.286, p.274-286, 1998.
GEBHARDT, R. Anticholestatic activityt of flavonoids from artichoke (Cynara scolymus L.) and their metabolites. Medicinal Science Monitor, suppl.1, p.316-320, 2001.
GEBHARDT, R. Inhibition of cholesterol biosynthesis in HepG2 cells by artichoke extracts is reinforced by glucosidase pretreatment. Phytotherapy Research, v.16, p.368-372, 2002.
GRANDE, S.; BOGANI, P.; SAIZIIEU, A.; SCHUELLE, G.; GALL, C.; VISIOLI, F. Vasomodulating potential of Mediterranean Wild Plant Extracts. Joiurnal of Agricultural and Food Chemistry, v.52, p.5021-5026, 2004.
GUARATINI, T.; MEDEIROS, M.H.G.; COLEPICOLO, P. Antioxidantes na manutenção do equilíbrio redox cutâneo: uso e avaliação da sua eficácia. Química Nova, v.30, p.206-213, 2007.
HECKERS, H.; DITTMAR, K.; SCHMAHL, F.W.; HUTH, K. Inefficiency of cynarin as therapeutic regimen in familial type II hyperlipoiproteinaemia. Atherosclerose, v.26, p.249-253, 1997.
HINOU, J., HARVALA, C.; PHILIANOS, S. Polyphenolic substances of Cynara scolymus L. leaves. Annales Pharmaceutique de France, v.47, p.95-98, 1985. Artigo em francês. PubMed (acessado em 30 de abril de 2007).
HOLTMANN, G.; ADAM, B.; HAAG, S.; COLLET, W.; GRUNEWALD, E.; WINDECK, T. Efficacy of artichoke leaf extract in the treatment of patients with functional dyspepsia: a six week placebo-controlled, double-blind, multicentre trial. Alimentary Pharmacological Therapy, v.18, p.1099-10105, 2003.
JIMÉNEZ-ESCRIG, A.; DRAGSTED, L.O.; DANESHVAR, B.; PULIDO, R.; SAURA-CALIXTO, F. In vitro antioxidant activities of edible artichoke (Cynara scolymus L.) and effect on biomarkers of artichoke in rats. Journal of Agricultural and Food Chemistry, v.51, p.5540-5545, 2003.
KING, P.J.; MA, G.X.; MIAO, W.F.; JIA, Q.; McDOUGALL, B.R.; REINECKE, M.G.; CORNELL, C.; KUAN, J.; KIM, T.R.; ROBINSON, W.E. Structureactivity relationships: analogues of the dicaffeoylquinic and dicaffeoiltartaric acids as potent inhibitors of human immunodeficiency virus type 1 integrase and replication. Journal of Medicinal Chemistry, v.42, p.497-509, 1999.
LI, H.; XIA, N.; BRAUSCH, I.; YAO, Y.; FÖRSTERMANN, U. Flavonoids from artichoke (Cynara scolymus) up-regulate endothelial-type nitric-oxide synthase gene expression in human endothelial cells. Journal of Pharmacology and Experimental Therapeutics, v.310, p.926-932, 2004.
LIETTI, A. Choleretic and cholesterol lowering properties of two artichokes extracts. Fitoterapia, v.48, p.153-158, 1977.
LUPATTELLI, G.; MARCHESI, S.; LOMBARDINI, R.; ROSCINI, R.; TRINCA, F.; GEMELI, F.; VAUDO, G. ; MANNARIONO, E. Artichoke juice improves endothelial function in hyperlipemia. Life Science, v.76, p.775-782, 2004.
MARAKIS, G.; WALKER, A. F.; MIDDLETON, R. W.; BOOTH, J. C. ; WRIGHT, J.; PIKE, D. J. Artichoke leaf extract reduces mild dyspepsia in all open study. Phytomedicine, v.9, p.694-699, 2002.
McDOUGALL, B.; KING, P.J.; WU, B.W.; HOSTOMSKY, Z.; REINECKE, M.G.; ROBINSON Jr. W.E. Dicaffeoylquinic and dicaffeoyltartaric acids are selective inhibitors of human immunodeficiency virus type I integrase. Antimicrobial Agents and Chemotherapy, v.42, p.140-146, 1998.
MEDING, B. Allergic contact dermatitis from artichoke, Cynara scolymus. Contact Dermatitis, v.9, p.314, 1983.
NEWALL, C.A.; ANDERSON, L. A.; PHILLIPSON, J.D. Herbal Medicines. Pharmaceutical Press, Londres, 1996.
NOLDIN, V.F.; CECHINEL-FILHO, V.; MONACHE, F.D.; BENASSI, J.C.; CHRISTMANN, I.L.; PEDROSA, R,C. e YUNES, R.A. Composição química e atividades biológicas das folhas de Cynara scolymus L. (Alcachofra) cultivada no Brasil. Química Nova, v.26, p.331-334, 2003.
NÚÑEZ-SELLÉS, A.J. Antioxidant: myth or reality? Journal of the Brazilian Chemical Society, v.16, p.699-710, 2005.
PANIZZI, L.; SCARPATI, M.L. 1954. Constitution of cynarin, the active principle of the artichoke. Nature, v.174, p.1062, 1954
PDR FOR HERBAL MEDICINES. Cynara scolymus, Medical Economic Company. New Jersey, p. 793-794, 1998.
PELEGRINI, D.D.; RESENDE, F.O.; SANFELICE, A.C.; PALAZZO DE MELLO, J.C.; ABOY, A.L; ZUANAZZI, J.A. Ensaios físico-químicos e cromatográficos das folhas de alcachofra - Cynara scolymus - Asteraceae. III Simpósio Brasileiro de Farmacognosia, Resumo CQ-15, 2001.
PEREZ-GARCIA, ADZET, T.; CAÑIGUERAL, S. Activity of artichoke leaf extract on reative oxygen species in human leukocites. Free Radicals, v.33, p.661-665, 2002.
PIO CORRÊA, M. Dicionário de Plantas Úteis do Brasil, volume I, Ministério da Agricultura. Brasília, p. 49-50, 1984.
QUEIROZ, S.L.; BATISTA, A.A. Funções biológicas do óxido nítrico. Química Nova, v.22, p.584-590, 1999.
QUIRCE, S.; TABAR, A.I.; OLAGUIBEL, J.M.; CUEVAS, M. Occupational contact urticária syndrome caused by globe artichoke (Cynara scolymus). Journal of Allergy and Clinical Immunology, v.97, p.710-711, 1996.
RECHHNER, A. R.; PANALA, A.S.; RICE-EVANS, C.A. Caffeic acid derivatives in artichoke extract are metabolised to phenolic acids in vivo. Free Radical Research, v.35, p.195-202, 2001.
RODRIGUEZ, T.S.; GIMENÉZ, D.G.; VÁZQUEZ, R.P. Choleretic activity and biliary elimination of lipid and bile acids induced by artichoke leaf extract in rats. Phytomedicine, v.9, p.687-693, 2002.
ROSS, R. Atherosclerosis - an inflammatory disease. New England Journal of Medicine, v.340, p.115-126, 1999.
SÁNCHEZ-RABANEDA, F.; JÁUREGUI, O.; LAMUELA-RAVENTÓS, R.M.; BASTIDA, J.; VILADOMAT, F.; CODINA, C. Identification of phenolic compounds in the artichoke waste by high performance liquid chromatography-tandem mass spectrometry. Journal of Chromatography A, v.1008, n.1, p.57-72, 2003.
SEVCIKOVA, P.; GLATZ, Z; SLANIMA, J. Analysis of artichoke (Cynara cardunculus L.) extract by means of micellar electrokinetic capillary chromatography. Eletrophoresis, v.23, p.249-252, 2002.
SCHMIDT, H.H.H.W.; WALTER, U. NO at work. Cell, v.78, p.919-925, 1994.
SCHULZ, E.; ANTER, E.; KEANEY, J.F. Oxidative stress, antioxidants, and endothelial function. Current Medicinal Chemistry, v.11, p.1093-1104, 2004.
SCHÜTZ, K.; KAMMERER, D.; CARLE,R.; SCHIEBER, A. Identification and quantification of caffeoylquinic acid and flavonoids from artichoke (Cynara scolymus L.) heads, juice and pomace by HPLC-DAD-ESI/MS. Journal of Agricultural and Food Chemistry, v.52, p.4090-4096, 2004.
SCHÜTZ, K.; PERSIKE, M. CARIE, R.; SCHIEBER, A. Characterization and quantification of anthocyanins selected artichoke (Cynara scolymus L.) cultivars by HPLC-DAD-ESI-MSn. Analytical and Bioanalytical Chemistry, v.384, p.1511-1517, 2006a.
SCHÜTZ, K.; MUKS, E.; CARLE, R.; SCHIEBER, A. Quantitative determination of phenolic compounds in artichoke-based dietary supplements and pharmaceuticals by high-performance liquid chromatography. Journal of Agricultural and Food Chemistry, v.54, p.8812-8817, 2006b.
SHIMODA, H.; NINOMIYA, K.; NISHIDA, N.; YOSHINO, T. MORIKAWA, T.; MATSUDA, H.; YOSHIKAWA, M. Anti-hyperlipidemic sesquiterpenes and new sesquiterpenes glycosides from the leaves of artichoke (Cynara scolymus): structure requirement and mode of action. Bioorganic Medicinal Chemical Letters, v.13, p.223-228, 2003.
SLANINA, J.; TABORSKA, E.; BOCHORAKOVA, H.; SLANIKOVA, I.; HUMPA, O.; ROBINSON, W.E.; SCHRAM, K.H. New and facile method of preparation of the anti-HIV-1 agent, 1,3-dicaffeoilquinic acid. Tetrahedron Letters, v.42, p.3383-3385, 2001.
SPERONI, E.; CERVALLATI, R.; GOVONI, P.; RENZULLI, C.; GUERRA, M.C. Efficacy of different Cynara scolymus preparations on liver complaints. Journal of Ethnopharmacology, v.86, p.203-211, 2003
WALKER, A. F.; MIDDLETON, R. M.; PETROWICZ, O. Artichoke leaf extract reduces symptoms of irritable bowel syndrome in a post-marketing surveillance study. Phytotherapy Resarch, v.15, p.58-61, 2001.
WANG, M.; SIMON, J.E.; AVILES, I.F.; HE, K.; ZHENG, Q.Y.; TADMOR, Y. Analysis of Antoxidative Compounds in Artchoke (Cynara scolymus L.). Journal of Agricultural and Food Chemistry, v.51, p.601-608, 2003.
WEGENER, T.; FINTELMANN, V. Pharmakologische eigenschaften und therapeutisches profil der artischoke (Cynara scolymus L.). Wiener Medizinische Wochenschrift: WMW, v.149, p.241-147, 1999.
WEISS, R.F.; FINTELMANN, V. Herbal Medicine. Thieme. Stuttgart, 2000.
WITTEMER, S.M.; VEIT, M. Validates method for the determination of six metabolites derived from leaf extract in human plasma by high-performance liquid chromatography-coulometric detection. Journal of Chromatography B, v.793, n.2, p.367-375, 2003.
ZAPOLSKA-DOWNAR, D.; ZAPLOSKA-DOWNAR, A.; NARUSZEWICZ, M.; SIENNICKA, A.; KRASNODEBSKA,B.; KOLODZIEJ, B. Protective properties of artichoke (Cynara scolymus) against oxidative stress induced in cultured endothelial cells and monocytes. Life Sciences, v.71, p.2897-2908, 2002.
ZHU, K.; CORDEIRO, M.; ATIENZA, J. ROBINSON Jr, W.E.; CHOW, S.A. Irreversible inhibition of human immunodeficiency vírus type 1 integrase by decaffeoylquinic acids. Journal of Virology, v.73, p.3309-3316, 1999.
ZHU, X.F., ZHANG, H.X.; LO, R. Phenolic compounds from the leaf extract of artichoke (Cynara scolymus L.) and their antimicrobial activities. Journal of Agricultural and Food Chemistry, v.52, p.7272-7278, 2004.
ZHU, X.F., ZHANG, H.X.; LO, R. Antifungal activity of Cynara scolymus L. leaves. Fitoterapia, v.76, p.108-111, 2005.
ZUANAZZI, J.A.S.; MONTANHA, J.A. Flavonóides. In: Farmacognosia: Da Planta ao Medicamento. Simões, C.M.A.; Schenkel, E.P.; Gosmann, G.; Palazzo de Melloi, J.C.; Mentz, L.A.; Petrovick, P.R. Editora da Universidade de Santa Catarina/Editora da Universidade do Rio Grande do Sul. Florianópolis/Porto Alegre, p. 577-614, 2003.