Artigo Original
Desenvolvimento e Validação de Metodologia Analítica para o Controle Químico da Qualidade de Fitoterápicos à Base de Extrato Seco de Alcachofra
Developing and Validating Analytical Methods for the Chemical Quality Control of Phytotherapics Containing Artichoke Dry Extracts
Resumo
A ação farmacológica e terapêutica das folhas de alcachofra, Cynara scolymus L. está associada a um conjunto de constituintes polifenólicos. Muitos métodos analíticos são citados na literatura para a quantificação do teor de cinarina ou de ácido clorogênico presente nas folhas de alcachofra ou em preparações farmacêuticas, principais representantes desta classe e marcadores da espécie. Neste trabalho, foi investigada, de forma comparativa, a utilização das metodologias oficiais: a da Farmacopéia Européia 5ª edição e a da Farmacopéia Brasileira 3ª edição, para quantificar esta classe de substâncias. Foram comparadas as eficiências destas metodologias com uma terceira metodologia desenvolvida e validada, utilizando o reativo de Arnow como agente complexante dos polifenóis totais. O método proposto foi considerado como linear, exato e repetitivo; de menor custo e com maior rapidez e praticidade, quando comparado com o método proposto pela Farmacopéia Brasileira.
- Unitermos:
- Validação de Metodologia Analítica.
- Extrato Seco de Alcachofra.
- Cynara scolymus.
Abstract
The pharmacologic and therapeutic actions of the artichoke, Cynara scolymus L. are related to a group of constituents called polyphenols. Some analytical methods are cited in literature to quantify the cinarine or chlorogenic acid content in the leaves of artichoke or in pharmaceutical preparations. In this work two official methodologies have been used: that from the European Pharmacopeia 5th edition and that from Brazilian Pharmacopeia 3rd edition. A third methodology was developed and validated, using as complexant reactive the Arnow agent for the total polyphenols. The proposal method was considered linear, accurate, affording good reproducibility; and moreover less costing, and more rapid and practical, when compared with Brazilian Pharmacopoeia method.
- Key Words:
- Analytical Method Validation.
- Antichoke Dry Extract.
- Cynara scolymus.
Introdução
Apesar do vasto uso dos fitoterápicos em todo o mundo, no Brasil poucos deles foram, até o momento, validados cientificamente visando à comprovação da eficácia clínica da sua segurança dos mesmos (SIANI, 2003). A regulamentação e o registro de fitoterápicos variam de acordo com o país em análise, sendo que se encontram solidamente determinados nos países europeus liderados pela Alemanha, onde se apresenta o sistema mais avançado de controle de registro e produção destes medicamentos (CALIXTO, 2001). No Brasil, a normatização de fitoterápicos iniciou-se em 1994, através da Portaria nº 123/SVS (BRASIL, 1994). Esta sofreu adequações ao longo dos anos e atualmente, a Resolução da Diretoria Colegiada (RDC) nº 48, de 16 de março de 2004, exige todos os resultados dos testes de controle de qualidade no ato do registro e na renovação do registro de um medicamento fitoterápico; com exceção daqueles registrados anteriormente a 31/01/1995 (BRASIL, 2004).
Os medicamentos fitoterápicos podem ser comercializados nas formas de formulações líquidas, sólidas ou semi-sólidas obtidas de extratos padronizados (SIANI, 2003). Para garantir a qualidade de um extrato é necessário isolar um componente desse extrato que seja quantificável, estabelecendo-se depois a variação admissível desse componente. Assim, os diversos lotes terão uma composição qualitativa e quantitativa semelhante (RIBEIRO, 2000). A padronização de fitoterápicos é realizada com base na concentração de um princípio ativo único ou através de uma substância marcadora presente em um extrato qualquer. No caso da padronização através de uma substância marcadora, assume-se que se esta esteja presente numa quantidade apropriada, e todos os demais componentes necessários estão igualmente representados durante a análise; assegurando-se, com isto, uma atividade farmacológica uniforme (DAVID et al., 2004). O controle de qualidade, a padronização e a estabilização dos medicamentos fitoterápicos constituem uma tarefa bastante complexa, pois envolvem o isolamento e a identificação dos constituintes químicos presentes em baixíssimas concentrações nas plantas (SIANI, 2003).
A alcachofra, Cynara scolymus L., é uma das plantas medicinais tida como uma das mais antigas do mundo. No Brasil, é uma das plantas com maior número de produtos farmacêuticos no mercado, indicados principalmente como coleréticos e colagogos (CARVALHO, 2004). As folhas da alcachofra caracterizam-se pela sua composição em ácidos fenólicos (até 2%), como o ácido caféico, o ácido clorogênico e a cinarina; flavonóides (0,1 a 1%), e óleos voláteis (CARVALHO, 2004). A composição do extrato vegetal em ácidos fenólicos depende da forma de secagem das folhas e do seu processo extrativo, haja vista a possibilidade de hidrólise e transesterificações que podem ocorrer em meio aquoso. Assim, a cinarina, um diéster caféico do ácido quínico, citada usualmente como o componente principal, pode não ser detectada, em especial ao se considerar a baixa estabilidade química desta substância (CARVALHO, 2004). O extrato seco de alcachofra é feito a partir das folhas frescas da planta e não das folhas secas, já que o processo de secagem resulta num produto final com teores inferiores de princípios ativos (SANTOS, 2000). Para o doseamento dos princípios ativos da alcachofra, a Farmacopéia Brasileira 3ª edição (1977) descreve o método de doseamento da cinarina, utilizando tampão acetato de sódio, nitrito de sódio e hidróxido de sódio como reagentes. O resultado é expresso em percentagem de cinarina. Entretanto, não há descrição sobre o preparo da amostra nem da maneira de se obter a curva analítica linear do padrão (cinarina). Pelo método da Farmacopéia Italiana (1991), a porcentagem de ácidos cafeoilquínicos é obtida através da precipitação com acetato de chumbo, dissolução em metanol e a determinação espectrofotométrica a 325 nm, com o resultado expresso como ácido clorogênico. Recentemente, em julho de 2006, a Farmacopéia Européia (5ª edição) editou em seu suplemento um método de quantificação de ácido clorogênico em folhas de alcachofra por CLAE (Cromatografia Líquida de Alta Eficiência).
A validação dos métodos utilizados no controle de qualidade de um produto fitoterápico é uma exigência legal para o seu registro, além de constar nas Boas Práticas de Fabricação (BRASIL, 2003a). No Brasil, com a publicação da normativa RE nº 899, de 29 de maio de 2003, a ANVISA divulgou o “Guia para Validação de Métodos Analíticos e Bioanalíticos”, que preconiza, no caso de metodologia não descrita em farmacopéias ou formulários oficiais devidamente reconhecidos pela ANVISA, a necessidade da validação da metodologia analítica utilizada, pelos seguintes parâmetros (BRASIL, 2003b): especificidade e seletividade, linearidade, intervalo, precisão, limite de detecção (sensibilidade), limite de quantificação, exatidão e robustez.
Neste trabalho descreve-se o desenvolvimento e validação de uma metodologia analítica espectrofotométrica destinada ao doseamento de polifenóis em extrato seco de alcachofra, visando o controle químico da qualidade de seus fitoterápicos derivados, conforme estabelecido na RE nº 899, de 29 de maio de 2003, da ANVISA, comparando-se sua eficiência com a metodologia oficial atualmente aceita e proposta pela Farmacopéia Brasileira 3ª Edição.
Material e Métodos
Equipamentos e acessórios utilizados: cromatógrafo líquido Shimadzu, modelo LC-20AT, com injetor automático e detector com arranjo de fotodiodos modelo SPD-M20A; Coluna de fase reversa ODS Hypersil, marca Thermo, 250 x 4,6 mm (5 µ); Balanças analíticas Mettler Toledo, modelo XS205 e GEHAKA, modelo AG 200; Filtro Chromafil RC-45/25 (celulose regenerada), marca Macherey-Nagel, de 0,45 µm de poro; Membrana filtrante para a fase móvel RC55 (celulose regenerada), marca SeS, de 0,45 µm de poro; espectrofotômetro Biospectro SP220.
Substâncias-padrão utilizadas: ácido clorogênico, 98%, fabricado por SIGMA-ALDRICH e cinarina, 99,96%, padrão da Farmacopéia Européia. Amostras de extrato seco de alcachofra (ESA) padronizado a 1% em cinarina (lote: 82.209, data de validade: 17/10/2007) foi fornecida pelo Laboratório Farmacêutico Millet Roux. Três amostras de fitoterápicos à base de alcachofra de empresas distintas foram adquiridas no mercado, com as seguintes características: Fitoterápico A - solução oral, lote: 10040601, validade: 04/2011 (cada mL da solução oral contém 0,225 g de ESA padronizado a 1,0% em cinarina); Fitoterápico B - cápsulas, lote: B04J4268, validade: 04/2007 (cada cápsula contém 350mg de ESA padronizado a 0,5% em cinarina); Fitoterápico C - cápsulas, lote: 947786, validade: 08/2008 (cada cápsula contém 300 mg de ESA padronizado a 0,45-0,55% em cinarina).
Solventes utilizados: acetonitrila UV/HPLC, marca VETEC, lote: 0507026; ácido fosfórico P.A., marca VETEC, lote: 0505805; metanol UV/HPLC, marca VETEC, lote: 0506186; água Milli-Q.
Soluções utilizadas: tampão de acetato (50 g de acetato de sódio em ácido acético a 10% q.s.p. 100mL); 10% (p/v) hidróxido de sódio em água purificada; 40% (p/v) nitrito de sódio em metanol; padrão de cinarina (0,05 mg/mL); padrão de ácido clorogênico (0,025 mg/mL); soluções A e B, filtradas com membrana de 0,45µm, para a fase móvel: solução A: ácido fosfórico P.A. (5 mL), água Milli-Q (995 mL); solução B: ácido fosfórico P.A. (5 mL), acetonitrila UV/HPLC (995 mL).
Procedimento da análise de Ácido Clorogênico por CLAE
Neste experimento utilizaram-se a solução-amostra de ESA (2,5 mg/mL) e a solução padrão de ácido clorogênico (0,025 mg/mL). Condições cromatográficas: temperatura da coluna: 40 °C; fluxo: 1,2 mL/min; comprimento de onda do detector: 330 nm; volume injetado: 25 µL; fase móvel: mistura das soluções (A) (água acidificada) e (B) (acetonitrila: ácido fosfórico). Foram injetados, em duplicata, 25 µL de cada preparação (padrão e amostra), sendo realizadas duas preparações de amostra, tanto do padrão quanto da solução da amostra. O cálculo de teor de ácido clorogênico na solução-amostra (ESA) foi executado a partir da comparação da média das áreas dos cromatogramas da solução-padrão com a área de cada replicata da solução-amostra. Sendo a porcentagem de ácido clorogênico calculada para cada solução-amostra pela expressão:
% ácido clorogênico = Aam × Pp × Tp × Fd / Ap × Pam
Onde: Aam = área do pico do ácido clorogênico no cromatograma obtido com a solução da amostra; Pp = peso do padrão utilizado na preparação da solução-padrão, em gramas; Tp = teor do padrão (%); Ap = média das áreas dos picos do ácido clorogênico no cromatograma obtido com a solução padrão; Pam = peso da droga vegetal (ESA) utilizado na preparação da solução-amostra, em gramas; Fd = fator de diluição.
Procedimento do método espectrofotométrico da Farmacopéia Brasileira 3ª Edição
Neste experimento utilizaram-se soluções padrão de cinarina (0,05mg/mL) e de ácido clorogênico (0,025mg/mL). Como amostras, foram utilizadas a ESA padronizado a 1% em cinarina (Laboratório Farmacêutico Millet Roux) e o fitoterápico à base de alcachofra adquirida no mercado (Fitoterápico A). As absorbâncias de duas soluções do fitoterápico A foram medidas a 505 nm. A solução ‘branco’ foi utilizada para zerar o espectrofotômetro. As absorbâncias de três tubos em diferentes concentrações foram diminuídas das absorbâncias dos tubos do branco, respectivamente. A quantidade de cinarina presente em cada uma das soluções do fitoterápico A foi encontrada utilizando a curva analítica. O valor correspondente a 1,0 mL da solução-amostra foi calculado utilizando a expressão: µg/mL x fator de diluição = % peso/volume.
Desenvolvimento e validação da Metodologia de dosagem de polifenóis adaptada de Arnow.
Desenvolvimento da Metodologia Analítica
Esta metodologia se baseou na proposta inicial para o doseamento de polifenóis em fitoterápicos à base de folhas de alcachofra por espectrofotometria no UV/VIS utilizando o reativo de Arnow, nitrito/molibdato de sódio (NICHIFORESCO; COUCOU, 1965). Três curvas analíticas foram construídas: com cinarina (SQR), com ácido clorogênico (SQR), e com uma amostra de ESA (a mesma usada na metodologia por cromatografia líquida). O reativo de Arnow foi preparado pela mistura de nitrito de sódio (10 g) e molibdato de sódio (10 g), ambos de grau P.A., em água destilada; completando-se o volume final para 100,0 mL.
Obtenção das curvas analíticas
As soluções padrão foram preparadas, de maneira a não fornecer valores de absorvância muito baixos (Tabela 1). As curvas analíticas foram feitas em triplicata variando-se de 100 a 260% do valor teórico de cinarina que porventura contivesse a amostra. A mesma situação se refletiu na análise do ácido clorogênico, trabalhando-se com valores de 100 a 220%, considerando-se a presença de cerca de 1,0% destas substâncias na droga vegetal. A solução-mãe de ESA foi preparada em balão volumétrico de 200 mL com ESA (200,0mg), padronizado a 1,0% em cinarina, dissolvido em uma solução de DMSO/água 10/90 (150mL) em banho de ultra-som por 30 minutos. O volume foi completado com água destilada. Concentração da solução-mãe: extrato seco (1,0 mg/mL) e cinarina (0,01 mg/mL). Foram feitas diluições de forma a se obter cinco soluções com concentrações variando entre 60 a 140%, conforme descrito na Tabela 1.
| CINARINA | ||
| Quantidade (mg) | Concentração final de análise (μg/mL) | Ativo (%) |
| 10,0 | 11 | 100 |
| 15.0 | 15 | 150 |
| 18,0 | 18 | 180 |
| 22,0 | 22 | 220 |
| 26.0 | 26 | 260 |
| ÁCIDO CLOROGÊNICO | ||
| Quantidade (mg) | Concentração final de análise (μg/mL) | Ativo (%) |
| 10,0 | 10,0 | 100 |
| 12,5 | 12,5 | 125 |
| 15,0 | 15,0 | 150 |
| 20,0 | 20,0 | 200 |
| 22,0 | 22,0 | 220 |
| ESA | ||
| Quantidade (mg) | Concentração final de análise (μg/mL) | Ativo (%) |
| 120 | 120 | 60 |
| 160 | 160 | 80 |
| 200 | 200 | 100 |
| 240 | 240 | 120 |
| 280 | 280 | 140 |
Preparo das soluções das amostras.
a) Fitoterápico A: Com o auxílio de uma pipeta volumétrica, transferiu-se 1,0 mL (2,25 mg de cinarina) do fitoterápico A para um balão volumétrico de 200,0 mL, adicionando-se em seguida a solução DMSO/água 10/90 (150 mL), e deixando em banho ultra-som por 30 minutos. Após o resfriamento, completou-se o volume do balão com água destilada. Foram preparadas triplicatas da solução-mãe. Concentração da solução: 11,25 µg/mL em cinarina.
b) Fitoterápico B: Inicialmente foi determinado o peso médio do conteúdo de 20 cápsulas que, em seguida, foram misturados num bécher. A solução-mãe foi preparada em balão volumétrico de 200,0 mL, dissolvendo ESA (200,0 mg) em DMSO/Água 10/90 (150 mL) em banho de ultra-som por 30 minutos. Após resfriamento, completou-se o volume do balão com água destilada e a solução foi filtrada através de papel de filtro comum. Foram preparadas triplicatas da solução-mãe. Concentração da soluçãomãe: 1,0 mg/mL de extrato (10,0 µg/mL em cinarina).
c) Fitoterápico C: Preparada da mesma forma que o fitoterápico B. Concentração da solução-mãe: 1,0 mg/mL de extrato (10,0 µg/mL em cinarina).
No procedimento da metodologia de dosagem de polifenóis adaptada de Arnow, as absorbâncias das soluções foram medidas utilizando o fluxograma mostrado na Figura 1.
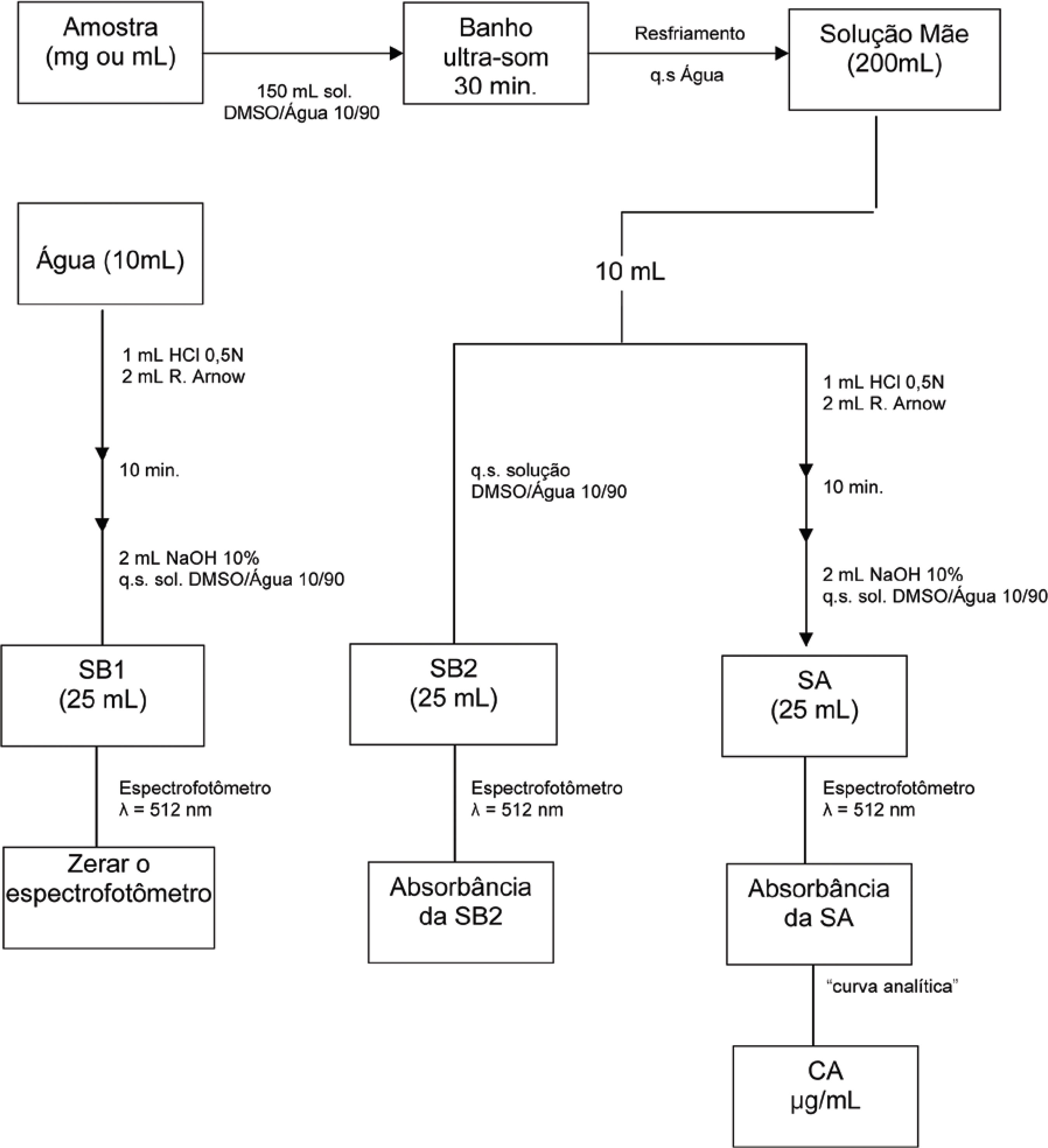
Validação da metodologia analítica
A linearidade do método desenvolvido foi analisada frente às três substâncias: cinarina, ácido clorogênico e extrato seco de alcachofra. Na exatidão do método foram calculados percentuais de recuperação do analito de uma matriz contendo os excipientes utilizados na formulação estudada em três níveis: 80, 100 e 120%. A precisão do método foi expressa pelo ensaio da repetitividade (precisão intracorrida). Para verificação da repetitividade foram feitas seis determinações da amostra na concentração de 100% e calculado o desvio padrão relativo (RSD), não devendo ser superior a 5%.
Resultados e Discussão
Resultados do método cromatográfico.
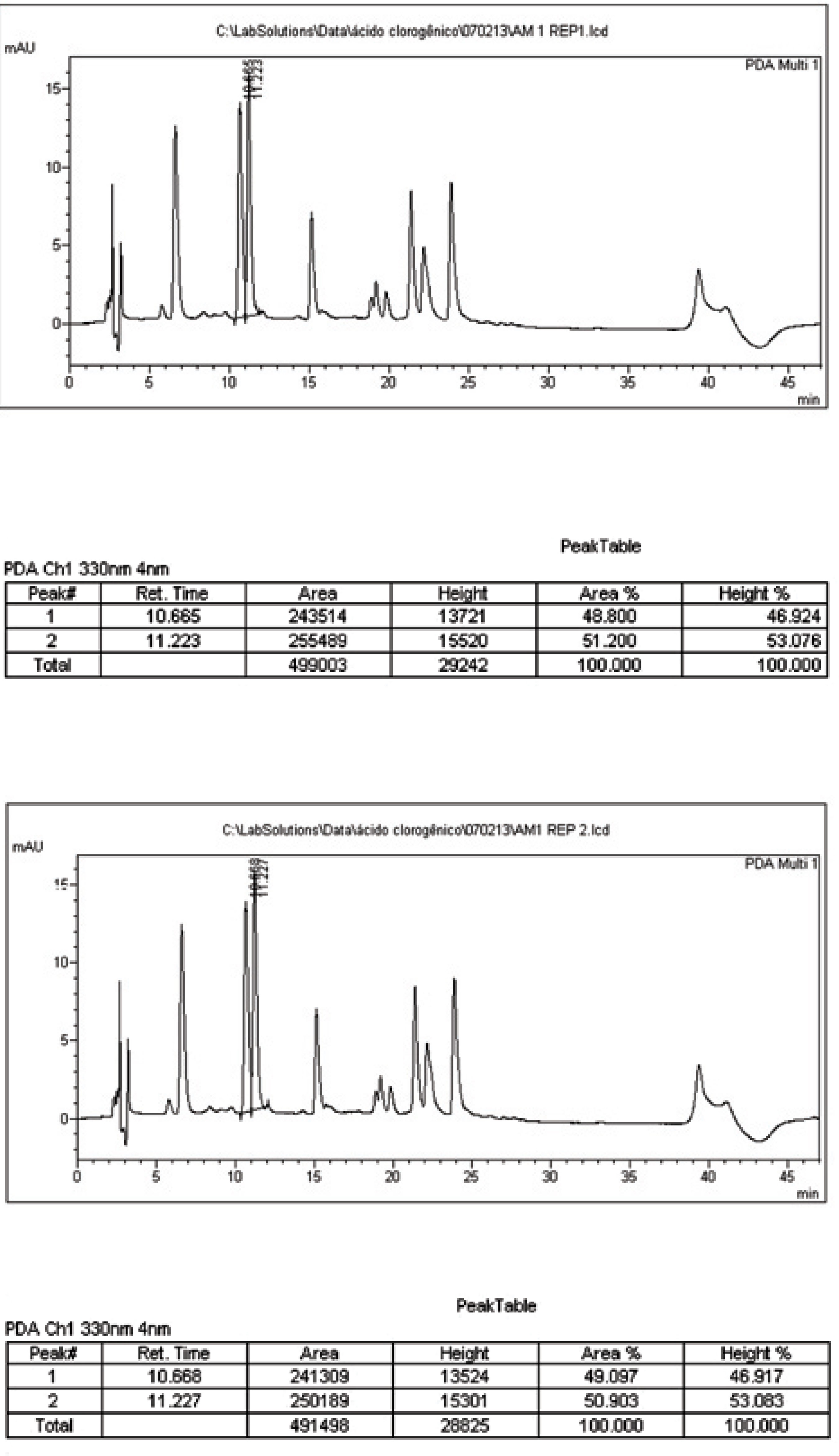
Diferentes métodos cromatográficos têm sido propostos para a análise dos marcadores da alcachofra, especificamente, a cinarina e o ácido clorogênico (BETTERO, 1981; MULINACCI et al., 2004; ROMANI et al., 2006). Na maioria dos casos, os métodos utilizados são capazes de separar estes dois fenóis dos demais constituintes do extrato, entretanto não apresentam dados sobre a validação da metodologia analítica nem consideram uma possível instabilidade da cinarina nos sistemas de solventes utilizados (CARVALHO, 2004). Recentemente, foi proposta uma metodologia oficial de análise para a dosagem do ácido clorogênico (EUROPEAN PHARMACOPEIA 2006), a qual determina a possibilidade de quantificar esta substância em folhas de alcachofra, o que poderia ser transposto para a análise do extrato seco derivado. Considera-se toda metodologia analítica farmacopéica como sendo validada (BRASIL, 2003b). Entretanto, a mudança da matriz, de folhas de alcachofra para extrato seco de alcachofra, poderia levar à conclusão de que este teria perdido seu status validado. Porém, a validade da metodologia para a quantificação do marcador no extrato seco é inegável, prestando-se também como forma de avaliar a especificidade de métodos não cromatográficos, como por exemplo, métodos de dosagem de polifenóis por espectroscopia de ultravioleta (NICHIFORESCO; COUCOU, 1965). Inicialmente, testou-se a metodologia proposta pela Farmacopéia Européia para a análise de ácido clorogênico, substituindo-se as folhas de alcachofra (que devem ser extraídas antes da análise), pelo extrato seco (ESA), o qual exige uma simples dissolução. A injeção em duplicata de duas amostras do padrão de ácido clorogênico levou à obtenção de dois picos com praticamente o mesmo tempo de retenção, tr = 10,66 min (replicata 1) e tr = 10,652 min (replicata 2). Esta metodologia foi, então, empregada na análise do ESA a ser utilizado nas análises subseqüentes por espectrofotometria de UV/VIS. O extrato foi apenas dissolvido na fase móvel a ser utilizada na análise, dispensando-se a etapa de extração necessária para análise das folhas de alcachofra. Os cromatogramas obtidos da injeção em duplicata de duas amostras diferentes de extrato seco (Figura 2) permitiram a resolução do pico referente ao ácido clorogênico em relação aos demais constituintes do extrato. Em todas as injeções foi possível se integrar o pico do ácido clorogênico sem a interferência dos demais sinais em torno deste, sendo o teor de marcador encontrado de 0,16%, bem inferior aos 0,8% regulamentados na Farmacopéia Européia. Este método cromatográfico mostrou-se adequado para a análise de ESA admitindo-se a possibilidade desta substância ser utilizada como marcador da espécie (BRASIL, 2004).
Resultados do método da Farmacopéia Brasileira 3ª Edição
No procedimento de leitura das absorvâncias das soluções preparadas, verificaram-se valores elevados, tanto para a cinarina como para o ácido clorogênico, salvo em valores de concentrações menores do que 10 µg/mL. Ambas as retas apresentaram linearidade adequada, considerando-se os coeficientes de correlação observados 0,9985 para a cinarina e 0,9905 para o ácido clorogênico (Tabela 2). A análise, no caso do extrato seco, tomou como padrão a posologia média de fitoterápicos à base de alcachofra, em especial os sólidos orais, que preconizam em média cerca de 200 mg de material como dosagem farmacologicamente ativa.
| Concentração de cinarina μg/mL) | Absorbância resultante |
| 2,5 | 0,027 |
| 5,0 | 0,043 |
| 10,0 | 0,065 |
| 25,0 | 0,131 |
| 50.0 | 0,270 |
| Concentração de ácido clorogênico μg/mL) | Absorbância resultante |
| 1.25 | 0,028 |
| 2,5 | 0,028 |
| 5 | 0,030 |
| 10 | 0,054 |
| 25 | 0,240 |
Os resultados obtidos demonstram valores muito baixos de absorvância, próximos ao erro de medida do equipamento, com imensas variações dentro de uma mesma tomada de amostra, apesar destes resultados se mostrarem condizentes com o teor esperado de cinarina no extrato. No preparo de uma nova amostra com 200 mg de amostra diluídos em 100 mL (visto que na primeira pesada eram 200 mg em 500 mL), foram obtidos valores irreprodutíveis, e maiores do que o esperado pela lei de Lambert e Bier (CIENFUEGOS, 2000), indicando a impossibilidade de utilização desta metodologia para dosagem dos marcadores no ESA (Tabela 3).
| ESA1 (201 mg de ES em 500 mL) | |||
| Absorbância resultante | Curva analítica de cinarina (μg/mL) | Cinarina presente na amostra (%) | Valor teórico esperado |
| 0,006 | 1,190 | 0,300 | 1,000% |
| 0,005 | 0,990 | 0,250 | |
| 0,015 | 2,990 | 0,750 | |
| ESA2 (200 mg de ES em 100 mL) | |||
| Absorbância resultante | Curva analítica de cinarina (μg/mL) | Cinarina presente na amostra (%) | Valor teórico esperado |
| 0,046 | 9,190 | 0,460 | 1,000% |
| 0,093 | 15,800 | 0,920 | |
| 0,173 | 31,800 | 1,730 | |
As médias das absorvâncias medidas nas duas diluições, quando inseridas na curva analítica obtida para o ácido clorogênico, demonstram concentrações 0,22% e 2,25%, com elevadas variações intermediadas e teores muito acima ou abaixo do esperado pela Farmacopéia Européia ou Brasileira (0,8%), confirmando a inviabilidade de uso desta metodologia, até mesmo do uso de ácido clorogênico como marcador da espécie. Estes resultados confirmam a variabilidade inerente aos métodos espectrofotométricos, em especial, a alcachofra, uma matéria-prima vegetal que além de composição variada, possui várias substâncias estruturalmente semelhantes (DE MARIA & MOREIRA, 2004; NOLDIN et al., 2003). Na análise da amostra do fitoterápico A, foram obtidas novamente medidas erráticas, de grande variação e fora da faixa esperada (0,225% de cinarina e 0,18% de ácido clorogênico), conforme está na Tabela 4.
| a) Com alíquota de 1 mL: | |||
| Absorbância resultante | Curva analítica de cinarina(μg/mL) | Cinarina (%) (p/V) | Valor teórico esperado |
| 0,018 | 0,800 | 0,040 | 0,225% |
| 0,021 | 1,400 | 0,070 | |
| 0,037 | 4,600 | 0,230 | |
| b) Com alíquota de 2 mL: | |||
| Absorbância resultante | Curva analítica de cinarina (μg/mL) | Cinarina (%) (p/V) | Valor teórico esperado |
| 0,022 | 1,600 | 0,040 | 0,225% |
| 0,053 | 7,800 | 0,195 | |
| 0,070 | 11,200 | 0,280 | |
| c) Com alíquota de 1 mL: | |||
| Absorbância resultante | Curva analítica de ácido clorogênico (μg/mL) | Ácido clorogênico (%)(p/V) | Valor teórico esperado |
| 0,018 | 5,100 | 0,260 | 0,180% |
| 0,021 | 5,400 | 0,270 | |
| 0,037 | 6,800 | 0,340 | |
| c) Com alíquota de 2 mL: | |||
| Absorbância resultante | Curva analítica de ácido clorogênico (μg/mL) | Ácido clorogênico (%) (p/V) | Valor teórico esperado |
| 0,022 | 5,500 | 0,140 | 0,180% |
| 0,053 | 8,300 | 0,210 | |
| 0,070 | 9,900 | 0,250 | |
Resultados com o método desenvolvido
O reativo de Arnow (molibdato de sódio), largamente utilizado para análise de fenóis como descrito por Nichiforesco & Coucou (1965), agiria como agente complexante específico para compostos denominados “o-dihidroxifenóis” (RODRIGUEZ, 1966) presente nos marcadores do ESA. Entretanto, outros constituintes da alcachofra também possuem estrutura capaz de promover esta complexação, o que dificultaria a correlação dos valores de absorvância medidos para o produto de reação do extrato ou outra fonte de matéria-prima vegetal com curvas analíticas de cinarina ou de ácido clorogênico, individualmente. Contudo, caberia aqui uma avaliação da variabilidade de resultados obtidos com o uso do reagente de Arnow, de maneira a comparar sua aplicabilidade à metodologia da Farmacopéia Brasileira. Assim, duas curvas analíticas para a calibração foram preparadas, com cinarina e ácido clorogênico, utilizando-se esta nova proposta. No caso da cinarina, a análise não conduziu a resultados lineares, o que poderia ser explicado pela possível instabilidade desta substância no meio (coeficiente de correlação de 0,9817). Por outro lado, para o ácido clorogênico, os resultados obtidos indicaram uma boa linearidade, com um coeficiente de correlação de 0.9908 (Figura 3).
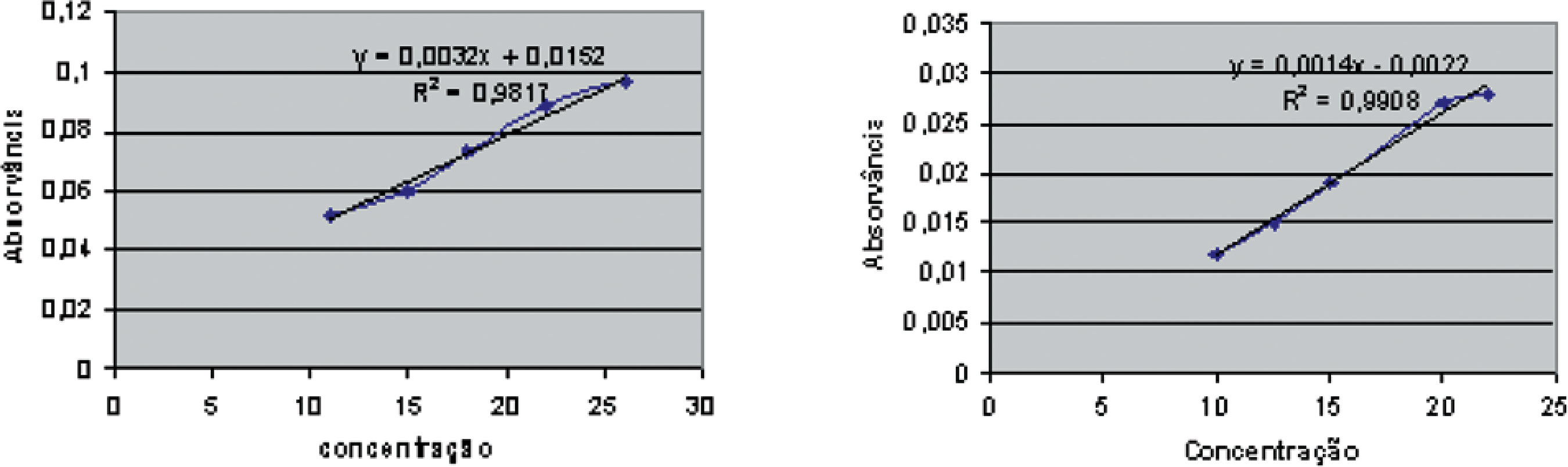
Uma menor variabilidade de resultados de absorvância foi observada nestas medidas, mesmo se considerando a não linearidade das análises realizadas com cinarina (Tabela 5). A análise de ESA (considerando-se 200 mg como dose farmacologicamente ativa usual) em confronto com os valores de absorvância; medidos frente às curvas analíticas (lineares) de cinarina e de ácido clorogênico, demonstraram valores muito maiores dos marcadores do que o esperado. Este resultado confirmou a hipótese de que outras substâncias, além dos marcadores, reagiram com reagente de Arnow, levando a uma falsa idéia de teores maiores do que os realmente presentes (Tabela 6).
| Cinarina | Ácido Clorogênico | ||
| Concentração final de análise (g/mL) | Absorvância | Concentração final de análise (g/mL) | Absorvância |
| 11,0 | 0,052 | 10,0 | 0,012 |
| 15,0 | 0,060 | 12,5 | 0,015 |
| 18,0 | 0,073 | 15,0 | 0,019 |
| 22,0 | 0,089 | 20,0 | 0,027 |
| 26,0 | 0,097 | 22,0 | 0,028 |
| Extrato (mg) | Absorvância | Concentração final (g/mL) | |
| ácido clorogênico | cinarina | ||
| 120 | 0,050 | 35,72 | 15,64 |
| 160 | 0,068 | 48,57 | 21,27 |
| 200 | 0,082 | 58,57 | 25,64 |
| 240 | 0,101 | 72,15 | 31,58 |
| 280 | 0,120 | 85,74 | 37,52 |
De forma a se propor a utilização desta metodologia como rotina para o controle da qualidade de indústrias produtoras de medicamentos fitoterápicos, poderia se utilizar o extrato seco vegetal padronizado em termos do teor de ácido clorogênico como analito a ser quantificado em fitoterápicos produzidos com esta matéria-prima vegetal, garantindo não só a manutenção da quantidade de matéria vegetal presente no produto final obtido, como também, o teor de marcador, obtido da correlação do teor de ácido clorogênico determinado no material por CLAE. Essa proposta resume a análise inicial da matériaprima por CLAE, a análise de teor de rotina por UV, através do uso da metodologia de Arnow (UV/VIS), e a análise de estabilidade do produto, novamente por CLAE. Desta forma, se reduziriam sobremaneira os custos operacionais das indústrias produtoras de medicamentos fitoterápicos, ao tornar as análises mais rápidas; reduzindo o tempo médio de produção de medicamentos à base de alcachofra, e mantendo-se, entretanto, a segurança de uso e a qualidade requerida para os mesmos. A confirmação desta proposta se iniciou pela avaliação da linearidade do método para o do extrato de alcachofra, onde foram registradas absorvâncias em níveis de concentração entre 60 a 120% do teor tido como mais usual (200 mg de extrato). Os resultados demonstraram uma excelente linearidade para o método, visto o coeficiente de correlação medido 0,9974 (Tabela 7 e Figura 4).
| Extrato (mg) | Concentração final de análise ( g/mL) | Ativo (%) | Absorvância |
| 120 | 120 | 60 | 0,050 |
| 160 | 160 | 80 | 0,068 |
| 200 | 200 | 100 | 0,082 |
| 240 | 240 | 120 | 0,101 |
| 280 | 280 | 140 | 0,120 |
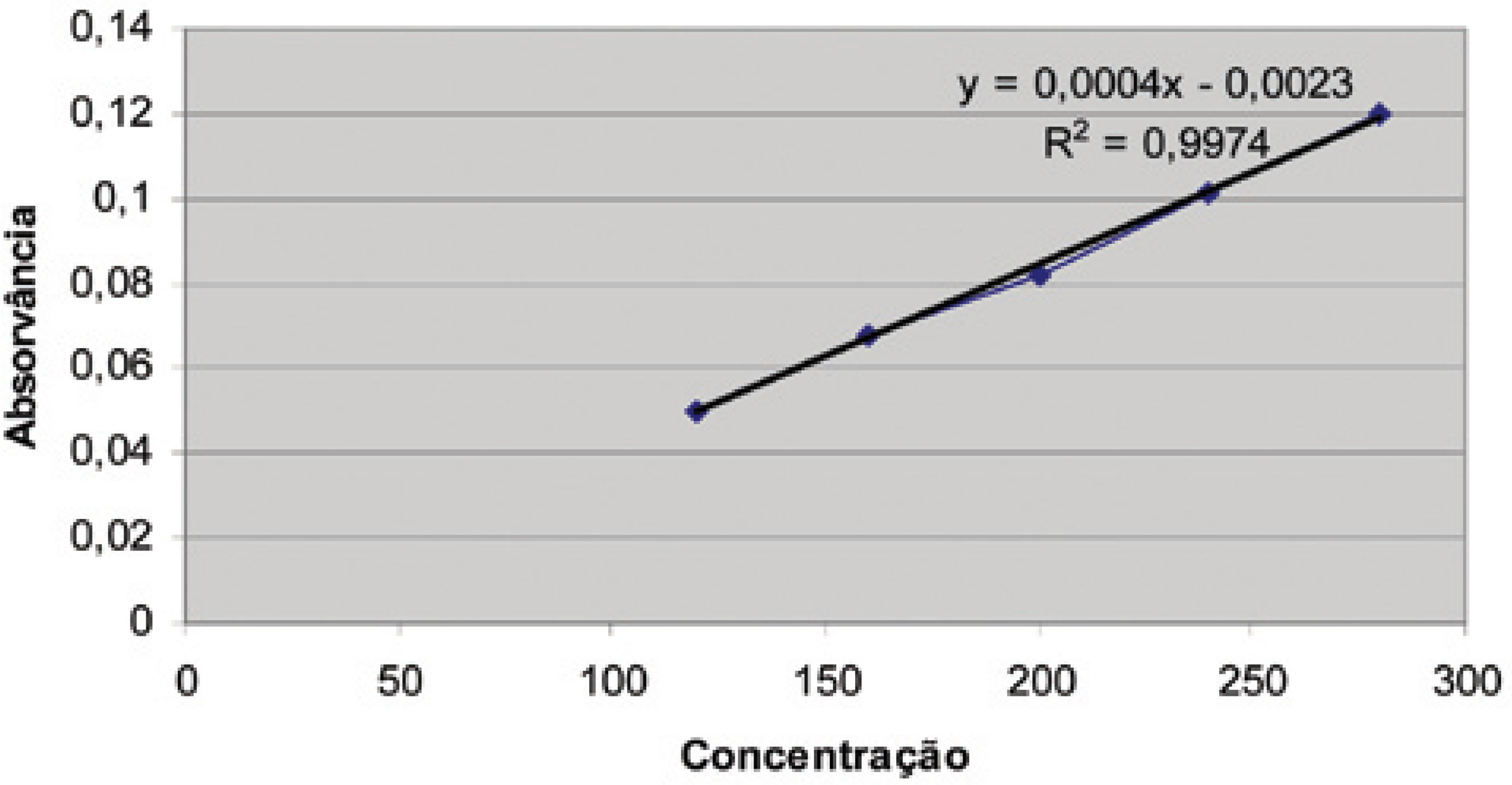
Os resultados obtidos da avaliação do percentual de recuperação, utilizando o ESA adicionado ao placebo, nessa formulação mantiveram-se muito próximos aos obtidos em todas as análises de linearidade e exatidão, justificando a aplicação do método. Foram adicionados extratos de alcachofra equivalentes a 80, 100 e 120% do teor, tido como 100% equivalendo a 200 mg. Os resultados estão demonstrados na Tabela 8. Os valores médios recuperados de acordo com a curva analítica de extrato de alcachofra (y = 0,0004 X -0,0023) estão listados na Tabela 9.
| Análise 01 | |||
| Extato (mg) | Concentração final de análise (mg/mL) | Ativo (%) | Absorvância |
| 161,7 | 161,7 | 80 | 0,063 |
| 200.0 | 200,0 | 100 | 0,084 |
| 240.7 | 240.7 | 120 | 0,096 |
| Análise 02 | |||
| Extato (mg) | Concentração final de análise (mg/mL) | Ativo (%) | Absorvância |
| 160,3 | 160,3 | 80 | 0,069 |
| 200,9 | 200.9 | 100 | 0.087 |
| 240,2 | 240.2 | 120 | 0,096 |
| Análise 03 | |||
| Extato (mg) | Concentração final de análise (mg/mL) | Ativo (%) | Absorvância |
| 161,8 | 161.8 | 80 | 0,065 |
| 201,7 | 201,7 | 100 | 0,085 |
| 241,5 | 241,5 | 120 | 0.097 |
| Teórico (%) | Real (%) | RSD |
| 80 | 81,44 | 3,39 |
| 100 | 106,47 | 3,21 |
| 120 | 120,01 | 3,14 |
A precisão do método foi avaliada realizando-se 06 análises em triplicata, com um produto disponível no mercado, com fórmula idêntica àquela utilizada na avaliação da exatidão. Os resultados estão explícitos na Tabela 10, com o produto comercializado com numero de lote 09090416. A precisão intermediária foi avaliada realizando-se três análises em 03 dias com 03 analistas diferentes, utilizando-se o mesmo espectrofotômetro Tabela 11. Os resultados obtidos demonstraram novamente uma boa precisão do método, mesmo com a complexa constituição do produto.
| Análise | Absorvância medida | RSD | Teor |
| 01 | 0,084 | 1,28 | 102.43 |
| 02 | 0,087 | 1.13 | 106.09 |
| 03 | 0,082 | 0,98 | 100,00 |
| 04 | 0,085 | 2.15 | 103.65 |
| 05 | 0,083 | 2.05 | 101.21 |
| 06 | 0,083 | 1.73 | 101,22 |
| Análise dia 01 / Analista 1 | Absorvância medida | RSD | Teor |
| 01 | 0,082 | 1,20 | 100,00 |
| 02 | 0,084 | 102,43 | |
| 03 | 0,082 | 100,00 | |
| Análise dia 01 / Analista 2 | Absorvância medida | RSD | Teor |
| 01 | 0,082 | 1,15 | 100,00 |
| 02 | 0,085 | 103,65 | |
| 03 | 0,088 | 107,30 | |
| Análise dia 01 / Analista 3 | Absorvância medida | RSD | Teor |
| 01 | 0,082 | 1.12 | 100,00 |
| 02 | 0,082 | 100,00 | |
| 03 | 0,081 | 98,78 | |
| Análise dia 02 Analista 1 | Absorvância medida | RSD | Teor |
| 01 | 0,082 | 1,28 | 100,00 |
| 02 | 0,080 | 97,56 | |
| 03 | 0,081 | 98,78 | |
| Análise dia 02 / Analista 2 | Absorvância medida | RSD | Teor |
| 01 | 0,083 | 1,85 | 101,21 |
| 02 | 0,087 | 106,09 | |
| 03 | 0,087 | 106,09 | |
| Análise dia 02 / Analista 3 | Absorvância medida | RSD | Teor |
| 01 | 0,082 | 1,08 | 100,00 |
| 02 | 0,080 | 97,56 | |
| 03 | 0,082 | 100,00 | |
| Análise dia 03 / Analista 1 | Absorvância medida | RSD | Teor |
| 01 | 0,084 | 1.12 | 102,43 |
| 02 | 0,084 | 102,43 | |
| 03 | 0,080 | 97,56 | |
| Análise dia 03 / Analista 2 | Absorvância medida | RSD | Teor |
| 01 | 0,080 | 1,33 | 97,56 |
| 02 | 0,080 | 97,56 | |
| 03 | 0,087 | 106,09 | |
| Análise dia 03 / Analista 3 | Absorvância medida | RSD | Teor |
| 01 | 0,082 | 1,54 | 100,00 |
| 02 | 0,083 | 101,21 | |
| 03 | 0,083 | 101,21 |
Considerando-se 0,8% o teor médio de ácido clorogênico no extrato, conforme monografias farmacopéicas, a concentração destes marcadores poderia ser estimada comparando-se o teor de ácido clorogênico medido por CLAE e a absorvância determinada na metodologia anteriormente validada. Desta forma, a valor de absorvância de 0,78 a 0,82, determinaria um teor de 0,16% de ácido clorogênico no extrato (considerando-se uma diluição de 1,0 mg de extrato para 100 mL de solvente), visto que o extrato analisado anteriormente por CLAE era o mesmo utilizado no esforço de validação.
Outros fitoterápicos à base de alcachofra foram analisados, de maneira a confirmar a aplicabilidade do método. Iniciou-se a pesquisa com o uso de um elixir a base de ESA (fitoterápico A), contendo 0,255 mg de extrato por cada mL de produto. Este produto foi analisado recolhendo-se 1,0 mL de amostra e diluindo-a em balão volumétrico de 200 mL. Considerando-se a absorvância de 0,92 o valor esperado para 225 mg de extrato, verifica-se que o valor médio de absorvância registrado (0,186), após três amostras preparadas, equivale a 45,49 mg de extrato; um valor muito inferior ao teórico rotulado, o que reporta a um teor de 0,03% de ácido clorogênico. Verificou-se a possibilidade de haver interferência do veículo aquoso ou dos excipientes utilizados na eficiência da metodologia analítica proposta. Assim, preparou-se um placebo do elixir contendo sacarose, etanol, água, nipagim, e essência de baunilha, adicionando-se posteriormente 200 mg de extrato de alcachofra por mL no mesmo. A leitura foi realizada em três amostras preparadas com este novo analito. Registrou-se o valor médio de absorvância como 0,84, provando não haver interferência destes na eficiência da metodologia analítica proposta.
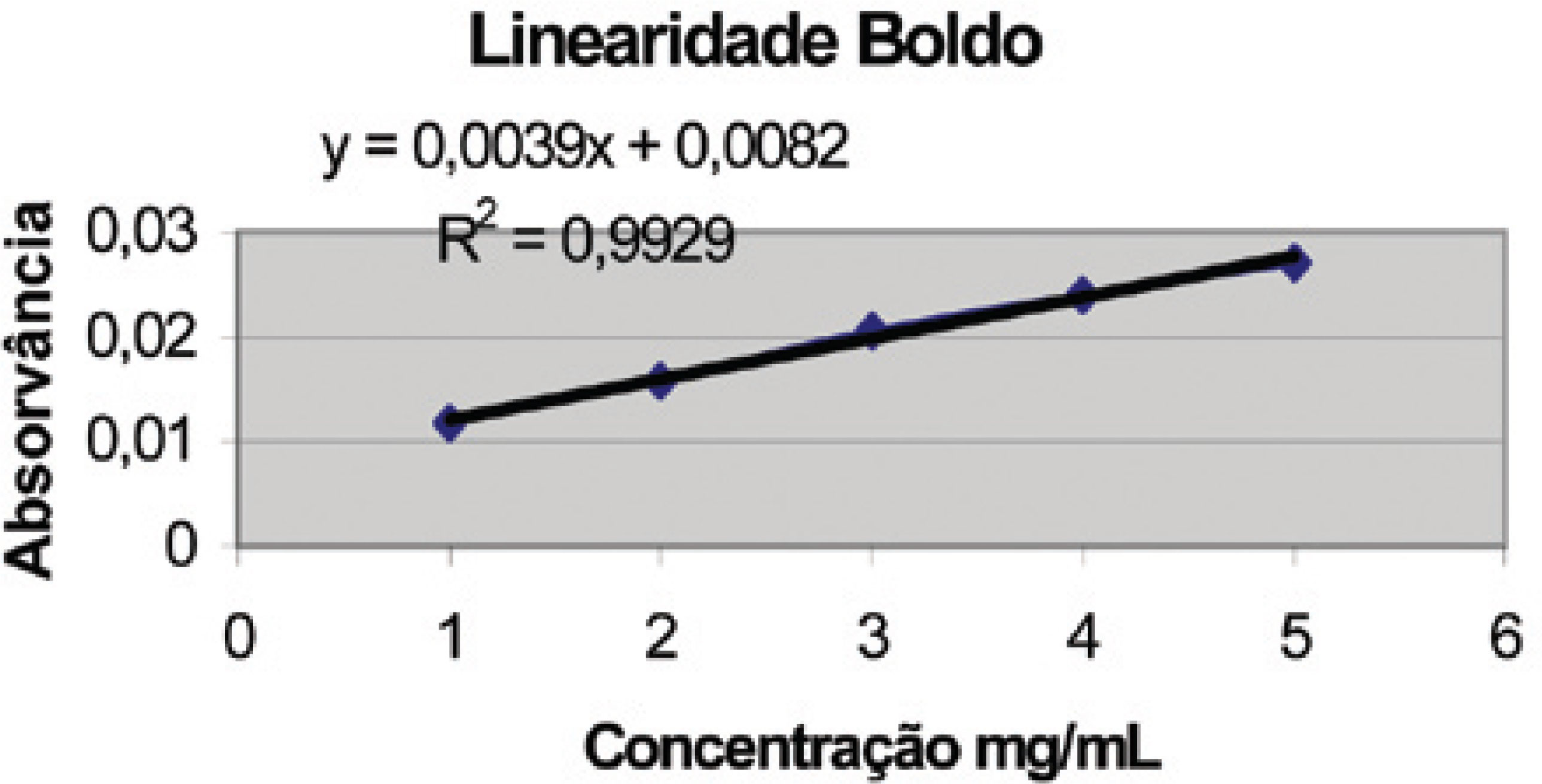
Foram ainda analisados os fitoterápicos B e C, ambas as cápsulas gelatinosas duras, as quais continham, teoricamente, 350 e 300 mg de ESA em suas composições. Na análise deste material, foram determinados valores de absorvância muito abaixo do esperado (0,160 e 0,130, respectivamente) indicando a possibilidade de utilização de valores de extrato muito menores que os rotulados na preparação destes produtos, ou até a possibilidade de não ser utilizado sequer ESA na preparação do mesmo. Buscou-se avaliar a aplicabilidade do método em formulações de extrato seco de alcachofra associada a outros extratos. Para tal, optou-se por trabalhar com um produto na forma de drágeas contendo extrato seco de alcachofra combinado a extrato seco de boldo. Como a absorção esperada deveria ser evidentemente maior do que a medida para os produtos contendo apenas alcachofra (0,82), a diluição da amostra foi realizada em balão de 500 mL e não 200 mL, sendo portanto as absorvâncias esperadas 2,5 vezes menor do que as inicialmente lidas. A avaliação inicial da linearidade do método frente ao uso de extrato de boldo foi conduzida, considerando-se 50 mg de extrato como 100% de teor, trabalhando-se de 60 a 140%. A reta obtida se mostrou linear com coeficiente de correlação de 0,9929 (Figura 5). Em um segundo momento, de forma a se avaliar se os dois extratos em conjunto respondem de forma linear e aditiva frente à relação concentração/absorvância, foram preparadas misturas de extrato de alcachofra e boldo e a leitura obtida confrontada com os valores individuais, obtidos nas duas curvas analíticas. Os resultados obtidos se encontram listados na Tabela 12. A mistura ainda mostrou linearidade de leitura, trabalhando-se com 50 mg e 200 mg como 100% de teor para os extratos de boldo e alcachofra respectivamente (Figura 6).
| ativo (%) | Alcachofra (nm) | Boldo (nm) | absorbâncias | Mistura (nm) | absorbâncias |
| 60 | 0,02353 | 0,01178 | 0,03531 | 0,03152 | 0,00379 |
| 80 | 0,03282 | 0,01474 | 0,04756 | 0,04450 | 0,00306 |
| 100 | 0,03922 | 0,02062 | 0,05984 | 0,05532 | 0,00452 |
| 120 | 0,04887 | 0,02398 | 0,07285 | 0,06491 | 0,00794 |
| 140 | 0,05473 | 0,02708 | 0,08181 | 0,07914 | 0,00267 |
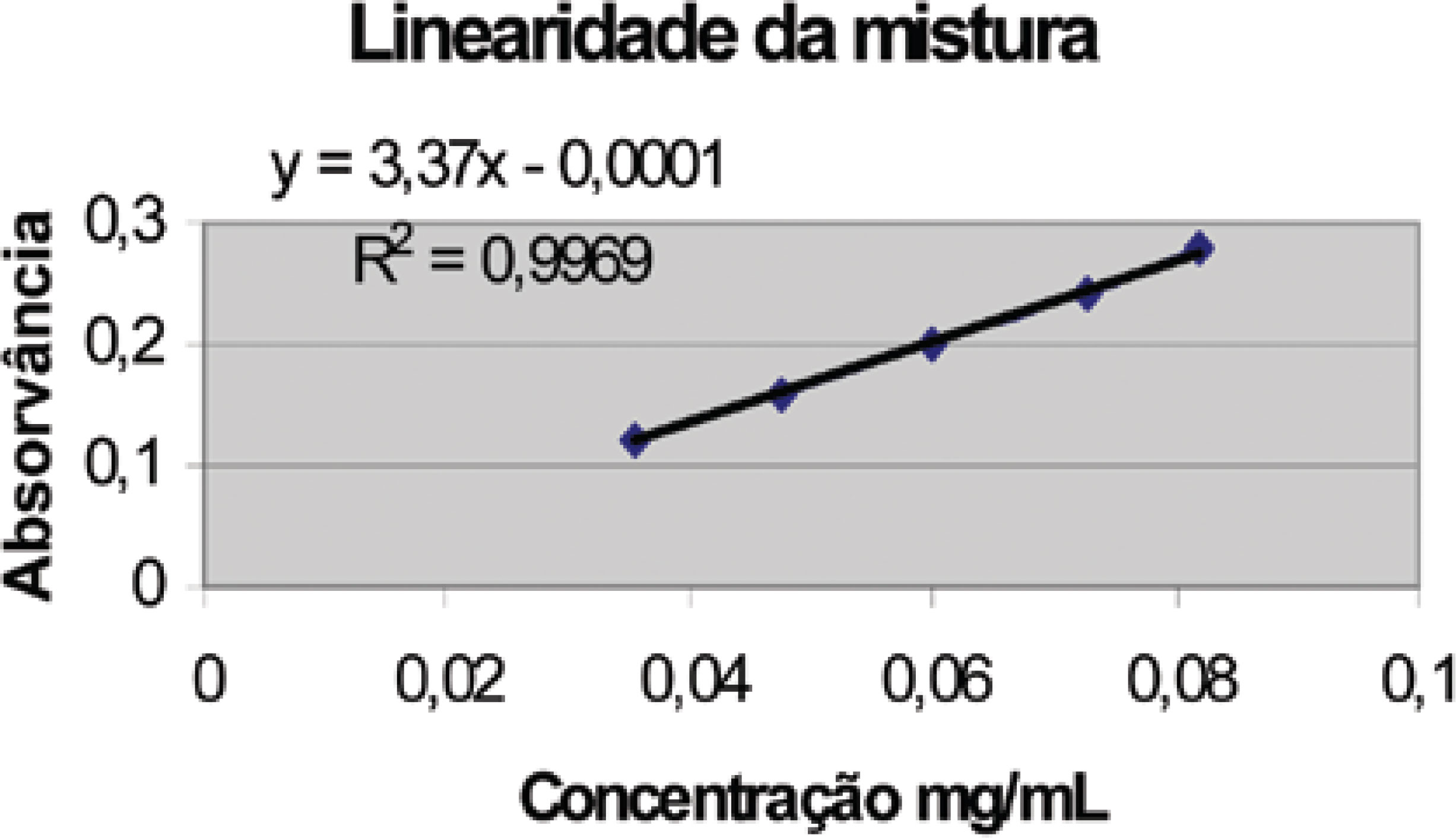
Pelos resultados acima pode se propor a quantificação de fenóis como forma de doseamento quantitativo de marcadores de ambos os extratos, dadas a linearidade e a aditividade de absorvância de cada uma das matérias-primas utilizadas individualmente. O teste realizado utilizando-se apenas o placebo mostrou, por avaliação em triplicata, uma média de absorvância igual a 0,001, descontando-se a absorção referente ao branco, não influenciando de forma alguma na análise.
Os resultados obtidos indicam que, pela aplicação da combinação de análise de matéria-prima e estudos de estabilidade por CLAE, segundo a metodologia proposta neste trabalho, e de teor de produto por espectroscopia de UV/VIS, torna-se possível atender as exigências legais para a rotina de controle de qualidade de produtos fitoterápicos, conforme estabelecido na resolução RDC 48, de 16 de março de 2004, da ANVISA, no caso da alcachofra. A análise por CLAE foi adaptada de forma a torná-la mais rápida e prática, confirmando a maior aplicabilidade do ácido clorogênico em relação a cinarina como marcador analítico da alcachofra, visto a maior instabilidade desta última em diferentes condições de análise.
A metodologia analítica baseada na espectroscopia no UV/VIS descrita pela farmacopéia Brasileira se mostra falha e inadequada para a rotina de controle de qualidade. Por outro lado, a adaptação da proposta da metodologia de Arnow, aqui desenvolvida e validada, mostrou-se linear, exata e reprodutível, prestando como valioso instrumento para o bom funcionamento dos laboratórios de controle de qualidade de fitoterápicos, visto seu menor custo, rapidez e praticidade. Por fim, a aplicação desta metodologia em produtos disponíveis no mercado, apontou sérias distorções de qualidade de diferentes fitoterápicos a base de alcachofra, ressaltando a gravidade da situação deste seguimento do mercado farmacêutico. Os resultados apresentados indicam a necessidade de um maior rigor nas ações pós-registro de medicamentos a serem adotadas em nosso sistema de vigilância sanitária, de maneira a assegurar a saúde da população e garantir os direitos do consumidor destes produtos.
Agradecimentos
CNPq; FAPERJ; Laboratório Farmacêutico Millet Roux.
Referências
BETTERO, A. Determinazione di cinarina per HPLC in forme farmaceutiche. Bolletino Chimico Farmaceutico, v.120, p.49-54, 1981.
BRASIL, 1994. Portaria SVS/MS nº 123, de 19 de outubro de 1994. Estabelece as normas para o registro de produtos fitoterápicos. Diário Oficial [da] República Federativa do Brasil, Brasília, DF, 20 de outubro de 1994.
BRASIL, 2003a. Resolução RDC nº 210, de 04 de agosto de 2003. Determina a todos os estabelecimentos fabricantes de medicamentos, o cumprimento das diretrizes estabelecidas no Regulamento Técnico das Boas Práticas para a Fabricação de Medicamentos, conforme ao Anexo I da presente Resolução. Diário Oficial [da] República Federativa do Brasil, Brasília, DF, 14 de agosto de 2003.
BRASIL, 2003b. Resolução (RE) nº 899, de 29 de maio de 2003. Determina a publicação do “Guia para validação de métodos analíticos e bioanalíticos”. Diário Oficial [da] República Federativa do Brasil, Brasília, DF, 02 de junho de 2003.
BRASIL, 2004. Resolução (RDC) nº 48, de 16 de março de 2004. Dispõe sobre o registro de medicamentos fitoterápicos. Diário Oficial [da] República Federativa do Brasil, Brasília, DF, 18 de março de 2004.
CALIXTO; J.B. Medicamentos Fitoterápicos. In: YUNES, R.A. & CALIXTO, J. B. (Orgs.). Plantas medicinais sob a ótica da química medicinal moderna. Ed. Argos, Chapecó, p.297-315, 2001.
CARVALHO, J.C.T.; GOSMANN, G.; SCHENKEL, E.P. Compostos fenólicos simples e heterosídicos. In: Farmacognosia: da planta ao medicamento, 5.ed., Editora da UFRGS/Editora da UFSC, Porto Alegre/Florianópolis, p.371-400, 2004.
CIENFUEGOS, F.; VAITSMAN, D. Análise Instrumental. Ed. Interciência, Rio de Janeiro, 2000.
DAVID, J.P.L.; NASCIMENTO, J.A.P.; DAVID, J.M. Produtos fitoterápicos: uma perspectiva de negócio para a indústria, um campo pouco explorado pelos farmacêuticos. Infarma, v.16, n.9-10, p.71-76, 2004.
DE MARIA, C.A.B.; MOREIRA, R.F.A. Métodos para análise de ácido clorogênico. Química Nova. v.27, n.4, p.586-592, 2004.
EUROPEAN Pharmacopoeia. 5th ed., suppl. 5.5, jul/2006.
FARMACOPÉIA Brasileira. 3 ed. Andrei Editora, São Paulo, 1977.
FARMACOPEA Ufficiale della Repubblica Italiana, 10 ed. Roma, 1991.
MULINACCI, N.; PRUCHER, D.; PERUZZI, M.; ROMANI, A.; PINELLI, P.; GIACCHERINI, C.; VINCIERI, F.F. Commercial and laboratory extracts from artichoke leaves: estimation of caffeoyl esters and flavonoidic compounds content. Journal of Pharmaceutical and Biomedical Analysis, v.34, p.349-357, 2004.
NICHIFORESCU, E.; COUCOU, V. Sur le dosage des o-dihydrophénols de type acide caféique présents dans les feuilles d’Artichaut (Cynara scolymus L.) Annales pharmaceutiques françaises, v.23, n.6, p.419-427, 1965.
NOLDIN, V.F.; CECHINEL FILHO, V.; MONACHE, F.D.; BENASSI, J.C.; CHRISTMANN, I.L.; PEDROSA, R.C.; YUNES, R.A. Composição química e atividades biológicas das folhas de Cynara scolymus L. (alcachofra) cultivada no Brasil. Química Nova, v.26, n.3, p.331-334, 2003.
RIBEIRO, C.A.F. Justifica-se o uso de extractos de plantas medicinais na terapêutica da ansiedade e da depressão? Revista Saúde Mental, v. II, n.4, p.9-14, 2000.
RODRIGUEZ, H.B. Determinación de princípios ativos em hojas de alcachofras. Revista Farmaceutica, v.108, 199-211, 1966.
ROMANI, A.; PINELLI, P.; CANTINI, C.; CIMATO, A.; HEIMLER, D. Charactherization of Violetto di Toscana, a typical Italian variety of artichoke (Cynara scolymus L.). Food Chemistry, v.95, 221-225, 2006.
SANTOS, E.V.M. Extração de matérias-primas vegetais. In: Fundamentos de tecnologia de produtos fitoterápicos. Convênio Andrés Bello (CAB) e Programa Ibero-americano de Ciência e Tecnologia para o Desenvolvimento (CYTED), Santafé de Bogotá, DC, 248 p., 2000.
SIANI, A.C. (Coord.). Desenvolvimento Tecnológico de Fitoterápicos: Plataforma Metodológica. Scriptorio, Rio de Janeiro, 97 p., 2003.