Artigo de Pesquisa
Anatomia foliar comparada de quatro espécies da família Lauraceae
Compared leaf anatomy of four species of the Lauraceae family
Resumo
Estudou-se a anatomia foliar de Ocotea paulensis Vatt., Ocotea odorifera (Vell.) J. G. Rohwer, Nectandra lanceolata Nees et Mart. ex Nees e Nectandra rigida (H.B.K) Nees, com o objetivo de identificar caracteres anatômicos que possam auxiliar na identificação destas espécies. A presença de tricomas, o tipo de estômato, a formação de periderme no pecíolo, os contrafortes na parede periclinal externa das células epidérmicas, a conformação do bordo foliar, a presença de hipoderme, a conformação do sistema vascular na nervura mediana e o padrão de venação apresentaram diferenças marcantes, possibilitando a separação das espécies, baseada nestes caracteres.
- Palavras-chave:
- Anatomia foliar.
- Taxonomia.
- Lauraceae.
- Nectandra.
- Ocotea.
Abstract
The leaf anatomy of Ocotea paulensis Vatt., Ocotea odorifera (Vell.) J. G. Rohwer, Nectandra lanceolata Nees et Mart. ex Nees and Nectandra rigida (H.B.K) Nees was made, in order to identify anatomical characters that may assist in the identification of these species. The presence of trichomes, the type of stomata, the formation of the periderm in the petiole, the buttresses in the outer periclinal wall of the epidermal cells, the leaf edge conformation, the presence of hypodermis, the vascular system conformation in the median rib and venation pattern showed marked differences, allowing species separation based on these traits.
- Keywords:
- Leaf anatomy.
- Taxonomy.
- Lauraceae.
- Nectandra.
- Ocotea.
Introdução
A família Lauraceae distribui-se ao longo das florestas tropicais e subtropicais do planeta, sendo formada por 49 gêneros e 2.500-3.000 espécies[1] que se destacam pelo grande número de espécies economicamente importantes. No Brasil, a família é representada por 22 gêneros e cerca de 390 espécies[2] ocorrendo em diversos tipos vegetacionais. Vattimo[3] mencionou a presença de espécies de Ocotea Aubl., em Santa Catarina e no Paraná. Foi citada[4], também, a presença de espécies de Nectandra Rol. ex Rottb. e Ocotea Aubl.,no bioma Cerrado. Na região amazônica, espécies pertencentes aos gêneros Ocotea Aubl. e Aniba Aubl. têm sido descritas como medicinais, com destaque para espécies como Aniba duckei Kosterm., cujo óleo essencial alcança alto valor comercial, conforme mencionado por Marques[5]. Em Minas Gerais, a ocorrência de espécies de Lauraceae tem sido registrada em vários trabalhos[6-9] com registro de 7 gêneros e 17 espécies, no município de Viçosa[10], 11 gêneros e 15 espécies, no Parque Estadual do Rio Doce[11]. Dentre as espécies comumente encontradas em Minas Gerais, Nectandra lanceolata Nees et Mart. ex Nees é usada em marcenaria, construção civil e na fabricação de papel[12]. Já Nectandra rigida, (H.B.K) Nees, é reconhecida pela presença de alcaloides, lignanas, neolignanas, com destaque para o desidrodiidroeugenol que possui atividade citotóxica e antitumoral[13]. Da mesma forma, Ocotea odorífera, a "canela-sassafrás", é uma espécie já consagrada pelo uso medicinal[5], sendo usada no tratamento de reumatismos, artroses, tosses e doenças-da-gota[14], mas que pode ser facilmente confundida com a espécie Ocotea paulensis Vatt.
Em Lauraceae, alguns gêneros são considerados muito próximos, o que dificulta a separação das espécies. Um típico exemplo dessa dificuldade reside nos gêneros Ocotea Aubl., Nectandra Aubl. e Pleurothyrium Nees, que Kostermans reuniu em um único gênero (Ocotea Aubl.), baseadona posição das lojas das anteras[15]. Nectandra Aubl. e Ocotea Aubl. também são considerados, por outros autores[15,16,1] muito próximos, sendo diferenciados pela presença de lóculos das anteras arranjadas em 2 pares superpostos em Ocotea Aubl. e pela presença de lóculos das anteras arranjadas em arco em Nectandra Aubl.
Desde Solereder[17], a anatomia foliar tem fornecido contribuições reconhecidamente importantes à taxonomia. Com relação à família Lauraceae, Vattimo[3] menciona que a folha é um órgão importante na identificação dos gêneros dessa família, merecendo um estudo detalhado, não só quanto à venação, mas também quanto à forma e presença de pilosidade. Além disso, os caracteres da epiderme como tipos de estômatos e tricomas e o padrão de venação foliar também têm sido utilizados para auxiliar na separação de espécies de Lauraceae[18-20].
Dessa forma, o presente trabalho tem como objetivo estudar a anatomia foliar comparada de Ocotea paulensis Vatt., Ocotea odorifera (Vell.) J. G. Rohwer, Nectandra lanceolata Nees et Mart. ex Nees e Nectandra rigida (H.B.K) Nees, ocorrentes em fragmentos florestais no município de Viçosa e no Parque Estadual do Rio Doce – MG, buscando identificar caracteres anatômicos confiáveis que possam auxiliar de forma segura na identificação dessas espécies.
Materiais e Métodos
Foram estudadas quatro espécies da família Lauraceae ocorrentes em fragmentos florestais no município de Viçosa, Zona da Mata Mineira[10] e no Parque Estadual do Rio Doce (PERD), localizado entre os municípios de Timóteo, Marliéria e Dionísio, no Vale do Aço-MG[21]. As coletas do material botânico, em Viçosa, foram realizadas durante os anos de 1999 e 2000, tendo sido coletados 2–3 espécimes para cada espécie, nas seguintes localidades: trecho de mata localizado na área do Jardim Botânico da Universidade Federal de Viçosa (UFV); Horto do departamento de Biologia Vegetal da UFV; Mata do Chaves, localizada no distrito de Silvestre e trecho de mata localizado no Sítio Palmital.
Os materiais botânicos estudados foram coletados em trilhas nas respectivas áreas de estudo e, após herborização, foram incorporados ao Herbário do departamento de Biologia Vegetal da UFV (VIC 18452, VIC 18454, VIC 18463, VIC 18583, VIC 24072, VIC 25052, VIC 26030, VIC 28177).
Foram processadas amostras das regiões proximal, mediana e distal do pecíolo; da região mediana da lâmina foliar e ainda das regiões basal e mediana da nervura mediana. Para os estudos anatômicos, foram coletadas folhas completamente expandidas do 3o ao 5o nós a partir do ápice do ramo, nos ramos mais basais da copa. As amostras foram fixadas em FAA, preparado com etanol 50%, sendo desidratadas em série etílica crescente[22] e, posteriormente, emblocadas em Historesina, conforme instruções do fabricante (Leica). Secções transversais e longitudinais foram obtidas ao micrótomo rotativo, nas espessuras de 8-15 µm e, em seguida, coradas utilizando-se a combinação Azul de Astra–Fucsina básica, seguindo os procedimentos usuais[23]. Os materiais botânicos também foram seccionados manualmente com o auxílio de um micrótomo de mesa, sendo posteriormente corados através da mesma combinação de corantes. Os cortes foram montados entre lâmina e lamínula, usando-se Bálsamo do Canadá sintético, seguindo-se a metodologia usual para montagem de lâminas permanentes. Para a realização dos testes histoquímicos foram utilizados Floroglucina, para verificar a presença de lignina, Lugol, para amido, Sudam III para lipídios ou óleos essenciais e Vermelho de rutênio para substâncias pécticas[22].
Para a observação das epidermes e do padrão de venação, foi feita a dissociação das epidermes pela mistura de Jeffrey por 24–48 horas[22], diafanização dos fragmentos foliares, segundo a técnica de Stritmatter[24], sendo posteriormente corados com fucsina básica. Para a confecção de lâminas de material macerado, utilizou-se mistura de Jeffrey por 48–72 horas[22], sendo também corados com fucsina básica. A terminologia utilizada para a descrição do padrão de venação seguiu a nomenclatura de Hickey[25]. Para a classificação dos estômatos, utilizou-se a terminologia referida por Wilkinson[26]. Os materiais estudados foram documentados ao microscópio fotônico Olympus AX-70. Para observações ao microscópio eletrônico de varredura seguiu-se a metodologia usual[27].
Resultados e Discussão
Ocotea paulensis Vatt.
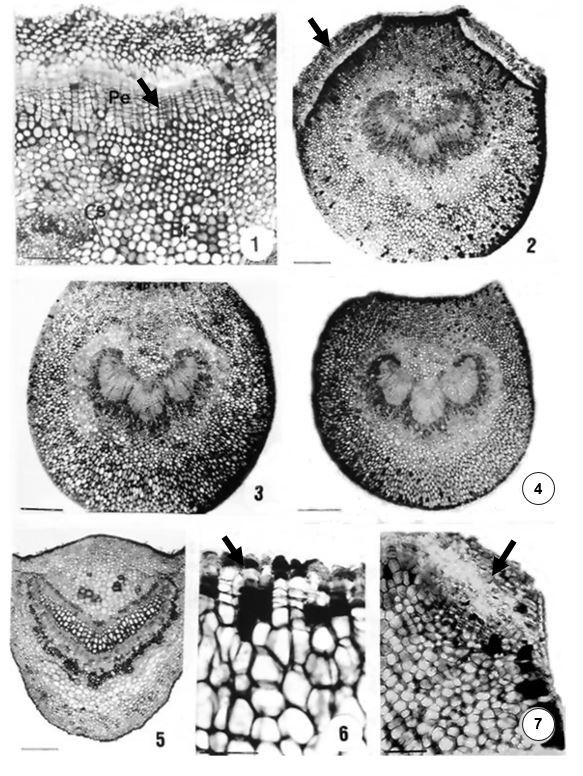
Nos espécimes coletados no Parque Estadual do Rio Doce (PERD) observou-se, na porção proximal do pecíolo, epiderme unisseriada e glabra, com cutícula espessa. Subjacente à epiderme, ocorre um colênquima angular, seguido por células do parênquima fundamental, onde se encontram pequenos braquiesclereídes aleatoriamente dispersos (FIGURAS 1 e 2) e células secretoras que armazenam conteúdo possivelmente mucilaginoso, por não terem reagido positivamente ao teste com Sudam III e por terem reagido ao vermelho de rutênio. O sistema vascular forma um arco com extremidades voltadas para o centro, sendo a porção central proeminente, além de algumas fibras perivasculares que, nesta região, ocorrem em número pequeno (FIGURA 2). Na porção mediana, o sistema vascular pode se fragmentar em três pequenos arcos, podendo separados por algumas células parenquimáticas (FIGURA 3). Na porção distal, observam-se as mesmas características, mas fibras e braquiesclereídes por vezes podem ser encontradas em maior número (FIGURA 4). Os espécimes coletados da Mata do Chaves apresentam diferenças. Nas porções proximal e mediana, podem ocorrer tricomas tectores unicelulares pequenos. O número de braquiesclereídes e fibras tornam-se maior. Na porção distal, o sistema vascular forma um "V" aberto (FIGURA 5).
Nos materiais coletados, em ambas as localidades se observou, no estrato subjacente à epiderme, divisões periclinais sucessivas ocorrendo, inicialmente, em regiões isoladas (FIGURA 6). Estas divisões estendem-se a outras regiões, até formar uma faixa contínua em toda a superfície adaxial que, por vezes, alcança as superfícies laterais do pecíolo. Não foram observadas divisões de células na face abaxial. As camadas de células resultantes dessas divisões sucessivas são originadas tanto em direção à epiderme (para fora) quanto em direção ao parênquima clorofiliano (para dentro). Na etapa subsequente, ocorre o rompimento da epiderme (FIGURA 7) que, a partir daí, dá lugar a uma periderme (FIGURA 1). Forma-se assim, um novo felogênio que empurra para fora parte do colênquima e a periderme anteriormente formada (FIGURA 8). A periderme, nesta espécie, forma uma estrutura contínua que parte dos ramos e chega até as porções proximal e mediana do pecíolo. Na porção distal, não se observa a formação de tal estrutura.
Na lâmina foliar a epiderme é unisseriada e glabra, na face adaxial (FIGURA 9). Na face abaxial, ocorrem estômatos paracíticos que apresentam espessamento parietal nas células subsidiárias (FIGURA 10). Nos materiais da Mata do Chaves, ocorrem ainda tricomas tectores unicelulares (FIGURA 10). Nos espécimes do PERD, o sistema vascular possui a conformação de um traço contínuo (FIGURA 11). Já no material da Mata do Chaves, forma um arco atenuado circundado por fibras perivasculares (FIGURA 12). Subjacente à epiderme, em ambas as faces, ocorrem 7–8 estratos de colênquima, cujas paredes das células podem se lignificar (FIGURA 11). O bordo foliar é reforçado internamente por células do esclerênquima (FIGURA 13).
No mesofilo, o parênquima paliçádico possui 1-2 estratos e o parênquima lacunoso, 6–7 (FIGURA 13). Ocorrem ainda feixes vasculares circundados por células de esclerênquima que formam extensões de bainha, além de células secretoras em meio ao parênquima (FIGURA 13).
O padrão de venação é do tipo camptódromo-broquidódromo, com aréolas ortogonais formadas por 4-7 lados desiguais (FIGURA 14), terminações simples ou com 2-4 ramificações. As nervuras se ramificam até a sétima ordem. Junto às fibras, ocorrem ainda tricoesclereídes que também envolvem nervuras. A venação marginal é do tipo fimbrial (FIGURA 14).
Ocotea odorifera (Vell.) J. G. Rohwer
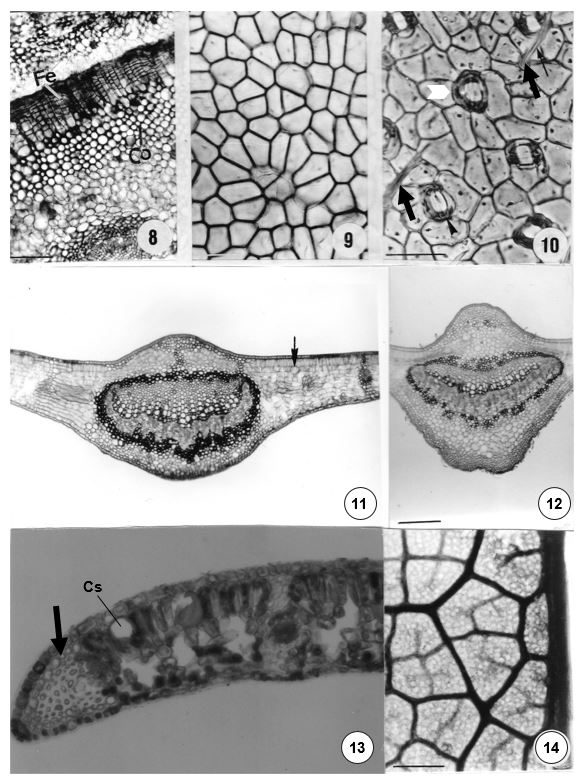
O pecíolo apresenta epiderme unisseriada, glabra. Subjacente à epiderme, observa-se o colênquima e, mais internamente, parênquima, em cujas células podem ocorrer pequenos cristais ou grãos de amido. As células oleíferas que reagem positivamente ao Sudam III, ocorrem aleatoriamente em meio às demais células parenquimáticas, sendo que nas proximidades do arco que integra o sistema vascular, essas células parenquimáticas possuem arranjo mais frouxo, com espaços intercelulares. Na porção proximal, o sistema vascular forma um arco com extremidades voltadas para o centro (FIGURA 15), acompanhado por fibras perivasculares. Na porção mediana, o sistema vascular forma três pequenos arcos com extremidades voltadas para o centro.
Na camada subjacente à epiderme, na face adaxial, também ocorrem divisões periclinais formando uma periderme com 4–5 estratos celulares. Por vezes, há o rompimento da epiderme em decorrência desse crescimento, porém, não forma uma estrutura contínua (FIGURA 16). Na porção distal, o sistema vascular pode voltar a formar um arco (FIGURA 17) ou formar um "V" aberto com extremidades eretas com braquiesclereídes (FIGURA 18) e fibras perivasculares junto ao floema. Algumas fibras podem ser septadas e outras conter amido (FIGURA 24).
Na região da nervura mediana, ocorre colênquima em 5-6 estratos na face adaxial e 2-3 na face abaxial. O sistema vascular forma um traço contínuo, acompanhado por fibras que circundam o sistema vascular (FIGURA 21), além de tricoesclereídes que acompanham as nervuras e também integram as extensões de bainha, junto com as fibras (FIGURAS 23 e 26).
Na lâmina foliar a epiderme é uniestratificada, glabra. Na face adaxial, a epiderme apresenta cutícula espessa e células com paredes anticlinais sinuosas no material do Jardim Botânico da UFV (FIGURA 19). Algumas células epidérmicas podem conter contrafortes. Na face abaxial ocorrem estômatos paracíticos (FIGURA 20), formados por pequenas células-guarda que ficam encobertas pelas células subsidiárias.
O mesofilo apresenta parênquima paliçádico em 2 estratos e lacunoso em 7-8, com espaços intercelulares pequenos e células secretoras de óleo essencial (FIGURA 22). Os feixes vasculares são, em geral, circundados por tricoesclereídes e fibras que se estendem em direção à epiderme nas duas faces. Circundando essas células, pode ocorrer uma bainha de células parenquimáticas. O bordo foliar é levemente fletido em direção à face abaxial, reforçado internamente por células esclerenquimáticas, tal como visto em O. paulensis.
O padrão de venação é do tipo camptódromo-broquidódromo, com nervuras que se ramificam até a sexta ordem, aréolas ortogonais com 4-7 lados desiguais e terminações simples ou com 2-6 ramificações (FIGURA 25). A nervura marginal é do tipo fimbrial (FIGURA 27).
Nectandra lanceolata Nees et Mart. ex Nees
O pecíolo possui epiderme uniestratificada com tricomas tectores unicelulares, tais como os que também são vistos na lâmina foliar (FIGURA 28), podendo ser eretos, curvos, bifurcados ou em forma de gancho. Subjacente à epiderme, em ambas as faces, pode-se encontrar o colênquima. No parênquima ocorrem células oleíferas e outras de conteúdo possivelmente mucilaginoso, por não reagirem ao Sudam III e por reagirem positivamente ao vermelho de Rutênio e ao Azul de Astra (FIGURA 29). Nas porções proximal e mediana, o sistema vascular forma um arco com extremidades voltadas para o centro (FIGURA 29) e, na porção distal, pode formar um arco com as extremidades eretas.
Na nervura mediana, da lâmina foliar, o feixe vascular forma um arco com extremidades eretas, circundado por fibras perivasculares (FIGURA 34), sendo algumas destas visivelmente gelatinosas. As camadas subepidérmicas também apresentam colênquima em 4-5 estratos no material do horto da UFV (FIGURA 34).
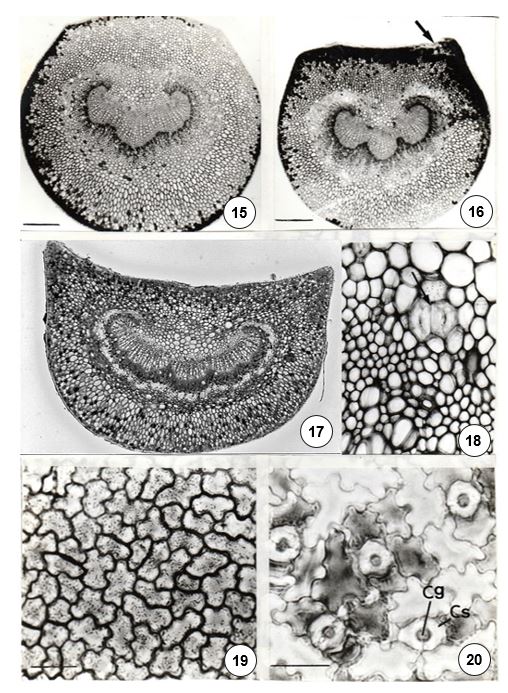
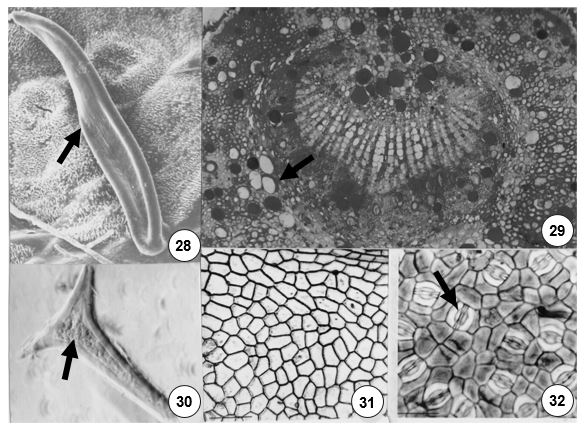
Na lâmina foliar a epiderme é unisseriada com alguns tricomas tectores unicelulares (FIGURA 28). Os tricomas localizam-se principalmente na face abaxial, onde também ocorrem estômatos paracíticos, muito semelhantes aos do tipo graminóide (FIGURA 32). As células epidérmicas possuem paredes anticlinais retas (FIGURA 31). Os feixes vasculares são circundados por fibras e tricoesclereídes que integram extensões de bainhas. As células externas a essa bainha podem conter cristais prismáticos, ráfides e amido. O parênquima paliçádico possui 1-2 estratos, sendo o primeiro estrato formado por células muito alongadas e o lacunoso, 4-5. Células secretoras distribuem-se em meio ao parênquima paliçádico e lacunoso (FIGURA 33). O bordo é levemente fletido para face abaxial, formado por 2 estratos subepidérmicos de células parenquimáticas e células esclerenquimáticas em grupo, tal como nas espécies anteriormente descritas.
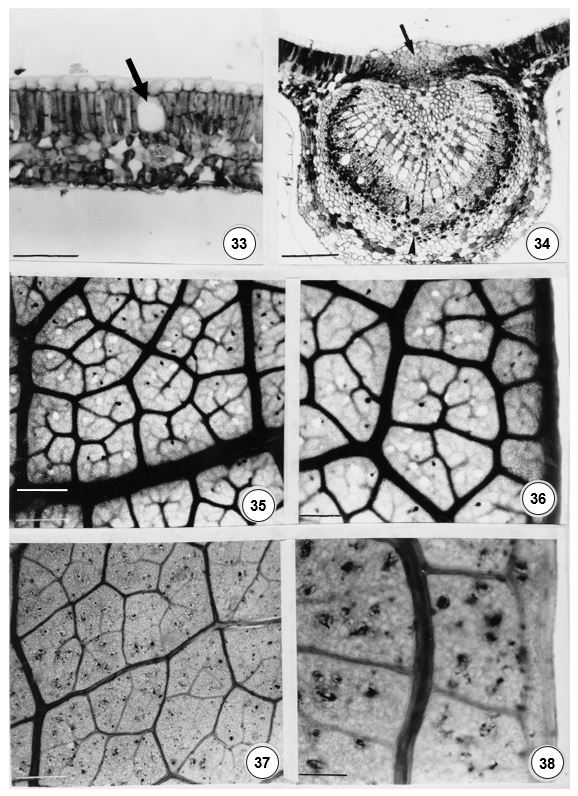
O padrão de venação é do tipo camptódromo-eucamptódromo (FIGURAS 35 e 36), onde as nervuras de segunda ordem se encaminham em direção ao ápice foliar, mas não se anastomosam. Em raras ocasiões, algumas nervuras podem se anastomosar na porção basal da folha. As aréolas são ortogonais, em 4-7 lados desiguais, com nervuras ramificadas até sexta ordem e terminações simples ou com 2-5 ramificações e tricoesclereídes (FIGURA 30) que integram as extensões de bainha. A nervura marginal é fimbrial, no material do horto da UFV (FIGURAS 35 e 36) e, no material da mata do Palmital, as nervuras marginais formam alças (FIGURA 38). Nesta espécie, a venação apresenta aspecto mais laxo (FIGURAS 37 e 38).
Nectandra rigida (H.B.K) Nees
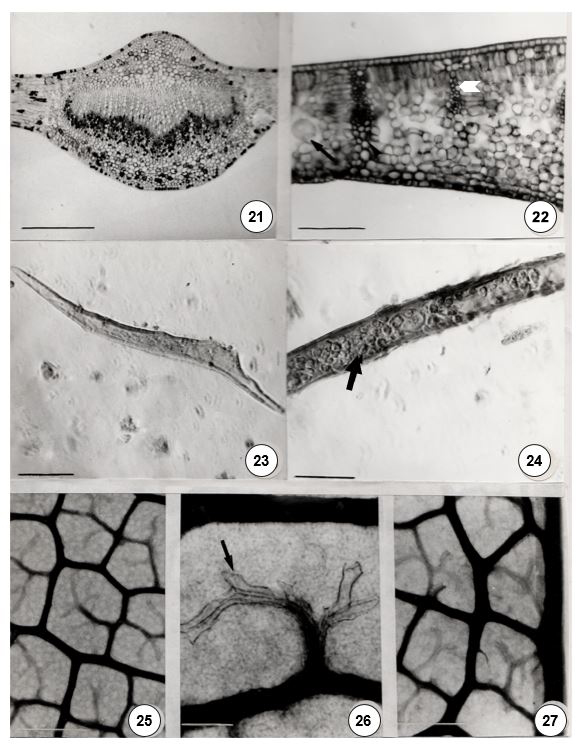
O pecíolo, na porção proximal, possui epiderme unisseriada. Recobrindo toda a superfície, ocorrem tricomas tectores unicelulares longos ou curtos, sinuosos ou na forma de gancho, por vezes com paredes espessadas, tal como os que também podem ser encontrados na lâmina foliar (FIGURA 41). Nos estratos subepidérmicos, ocorrem células oleíferas em meio às demais células parenquimáticas. O sistema vascular forma um arco com extremidades voltadas para o centro e porção central proeminente (FIGURA 39), além de fibras perivasculares. Na porção distal, o sistema vascular forma 3 arcos separados por células parenquimáticas, com fibras perivasculares em maior número nessa região (FIGURA 40).
A lâmina foliar apresenta epiderme unisseriada, com paredes anticlinais retas (FIGURA 43) e cutícula espessa, o que só pode ser observado em corte transversal. Os tricomas tectores são mais abundantes na epiderme abaxial (FIGURA 41), dificultando, inclusive, a visualização dos estômatos paracíticos que apresentam um espessamento parietal (FIGURA 42). Subjacente à epiderme adaxial, ocorre hipoderme em 1-2 camadas interrompidas por células do parênquima paliçádico e células oleíferas.
O parênquima paliçádico possui 2 estratos, sendo a primeira camada formada por células muito alongadas e o lacunoso, 4-5, com poucos espaços intercelulares, no material do PERD (FIGURA 45) e 3-4 no espécime da mata do Chaves. Em meio a essas células, podem-se encontrar células oleíferas. Os feixes vasculares são margeados por fibras e tricoesclereídes (FIGURA 50), algumas células parenquimáticas podem conter amido. Na porção proximal da lâmina foliar, o bordo é revoluto, constituído internamente por células de parênquima e, por vezes, feixes vasculares, além de células oleíferas. Na região mediana da folha, o bordo deixa de ser revoluto, mas permanece completamente fletido para a face abaxial (FIGURA 46). O sistema vascular, na região mediana da lâmina foliar, possui a forma de arco. Frequentemente, pela existência de anastomoses das nervuras secundárias e pseudosecundárias com a nervura primária, pode adquirir a forma de 2 arcos. Um maior, que corresponde à nervura mediana e outro menor, correspondente à nervura pseudosecundária anastomosada (FIGURA 44).
O padrão de venação é do tipo camptódromo-broquidódromo, com aréolas ortogonais em 3-5 lados desiguais, terminações simples ou com 2-4 ramificações (FIGURAS 47 e 49). As nervuras se ramificam até a sétima ordem. As nervuras marginais formam alças, resultantes da anastomose de nervuras secundárias, sem terminações ou ramificações (FIGURA 48). Em um dos espécimes da Mata do Chaves, a nervura marginal possui terminações simples, não ramificadas.
Na família Lauraceae, a semelhança dos caracteres morfológicos das estruturas vegetativas torna a identificação das espécies totalmente dependente da morfologia floral. Com isso, os estudos taxonômicos tornam-se problemáticos quando os órgãos reprodutivos estão ausentes[28]. Estes autores utilizaram caracteres anatômicos do pecíolo, como conformação do sistema vascular e presença de colênquima e esclereídes para separar Ocotea porosa, Ocotea pulchella, Ocotea tristis e Ocotea diospyrifolia. No presente trabalho, os caracteres anatômicos do pecíolo mostraram-se muito homogêneos e não contribuíram para a separação das espécies estudadas.
Foi observada, em Ocotea odorifera e Ocotea paulensis, a formação de uma periderme na face adaxial do pecíolo. Não foi encontrada nenhuma referência, até o presente momento, que mencionasse a ocorrência desta estrutura em pecíolos de nenhuma outra espécie de Lauraceae. Portanto, este caráter pode ser extremamente importante para auxiliar na identificação destas espécies em relação às demais espécies do gênero. Recomenda-se, porém, a análise de espécimes de outras localidades para verificar a validade deste caráter, bem como a análise de outras espécies do gênero, a fim de verificar a presença ou ausência dessa estrutura.
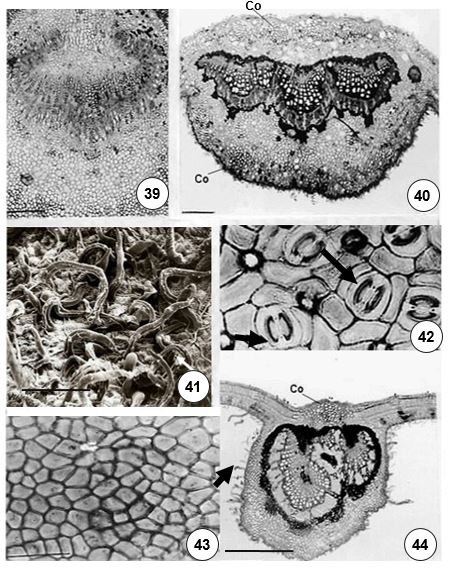
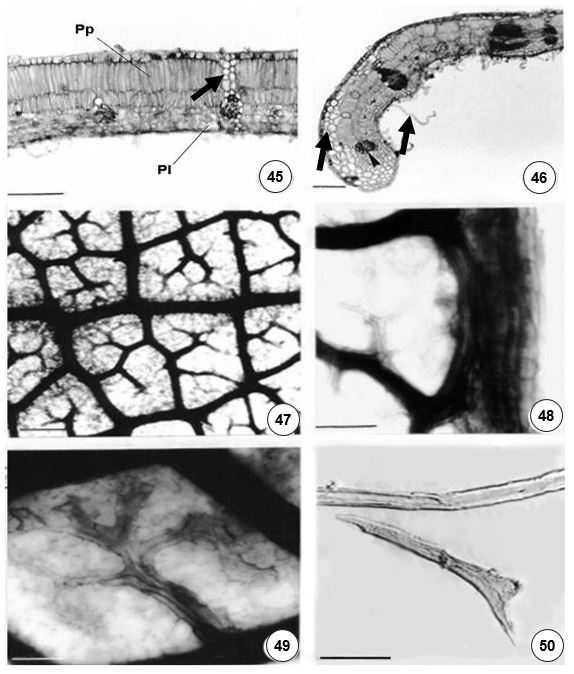
Christophel et al.[19] ressaltam a importância dos caracteres da epiderme para auxiliar na separação das espécies de Lauraceae. Nas espécies estudadas, caracteres como o tipo de estômato, a sinuosidade das paredes anticlinais e a presença de contrafortes parietais apresentaram diferenças em Ocotea paulensis e Ocotea odorifera e não apresentaram variações em nenhum dos espécimes analisados. Segundo os mesmos autores observou-se, também, sinuosidade em células epidérmicas de Beilschmiedia obtusifolia. Porém, os autores não mencionam este caráter como parâmetro para a taxonomia. Moraes & Paoli[20] também observaram sinuosidade nas paredes de células epidérmicas em Ocotea catharinensis e Cryptocaria moschata, sendo que o grau de sinuosidade variou consideravelmente de uma folha para outra. Petzold[29] afirma que a presença de células epidérmicas com paredes anticlinais retas é um caráter preponderante na família Lauraceae e a presença de células epidérmicas da face adaxial, com paredes onduladas, é importante para fins sistemáticos, por seu comportamento constante e por ocorrerem em menor número de espécies. Pyykkö[30] correlaciona o grau de sinuosidade das paredes das células epidérmicas e a intensidade de luz, onde, no estrato superior da floresta, a pleno sol, observa-se paredes retas e, no estrato inferior, paredes fortemente onduladas.
Faggeter[31] observou contrafortes parietais em Endiandra kingsiana e Aiouea spp (Lauraceae). Também se descreveram contrafortes[32] nas paredes anticlinais e periclinais de Beilschmiedia rigida (Lauraceae). Observou-se a presença de contrafortes parietais em epidermes foliares de Eugenia (Myrtaceae), relatando que este caráter não expressa uma resposta às condições ambientais, uma vez que o material foi observado em espécies procedentes da restinga e da mata atlântica, mas que tais penetrações parietais podem estar relacionadas à absorção de água e nutrientes pela epiderme ou à saída de substâncias elaboradas[33].
Avita & Inamdar[34] descreveram a presença de estômatos paracíticos e anomocíticos em espécies de Lauraceae na Índia. Observou-se estômatos paracíticos e pericíticos em espécies de Cinnamomum [18]. Descreveram-se em Cryptocaria moschata, Endlicheria paniculata e Ocotea catharinensis, estômatos paracíticos sendo que, em Cryptocaria moschata, estes estômatos localizam-se em uma depressão[20]. Barros et al.[35] observaram estômatos paracíticos graminóides em Ocotea divaricata e Braga[36] observou estômatos graminóides em Ocotea opifera. Entre as espécies estudadas, Nectandra lanceolata apresentou estômatos que podem ser denominados como paracíticos graminóides, considerando-se sua definição[37], bem como a descrição dos trabalhos anteriormente mencionados[35][36]. Metcalfe[38] afirma que projeções digitiformes em espécies de Lauraceae podem dificultar a determinação do tipo de estômato. Nas espécies estudadas, foram encontrados estômatos com células-guarda parcialmente encobertas pelas projeções das células subsidiárias. Este fato merece atenção, pois pode levar a uma interpretação errônea, fazendo com que os estômatos sejam classificados como anomocíticos, quando na verdade são paracíticos, visto que, em vista frontal, por vezes não é possível visualizar as células-guarda.
Segundo Christophel et al.[19] as espécies de Lauraceae descritas, até então, na literatura, apresentavam somente tricomas unicelulares, quando presentes. Vattimo[39] menciona que, em Ocotea paulensis, as folhas e flores são glabras. Coe-Teixeira[15] utiliza o caráter "folha glabra" na identificação de Ocotea paulensis. Contudo, folhas de Ocotea paulensis, coletadas no distrito de Silvestre, possuem tricomas unicelulares. Desta forma, torna-se necessária a análise de outros espécimes, inclusive depositados em herbários para verificar se a ausência de tricomas é um caráter válido na identificação desta espécie.
Para Metcalfe[38], entre os gêneros de Lauraceae, o mesofilo apresenta 2-3 camadas de parênquima paliçádico. Em alguns espécimes de Nectandra rigida, houve variação no número de camadas do parênquima lacunoso, sendo que todas as espécies estudadas apresentam 1–2 estratos de parênquima paliçádico. Vogelmann & Martin[40] afirmam que folhas submetidas a intensa radiação solar podem apresentar um aumento no número de camadas do parênquima paliçádico.
Coe-Teixeira[41,15] separou Nectandra lanceolata e Nectandra rigida pela coloração, comprimento e largura das folhas e as espécies Ocotea paulensis e Ocotea brachybotrya pelo brilho da superfície foliar, comprimento e largura das folhas. Sabe-se que os caracteres utilizados por Coe-Teixeira como tamanho e coloração das folhas, frequentemente podem variar entre indivíduos da mesma espécie, dependendo das condições ambientais as quais estas se encontram submetidas. Logo, a utilização desses caracteres na separação de duas espécies tem validade questionável. Nesse sentido, a utilização de dados que não variam de acordo com as condições ambientais, fornecidos pelo estudo anatômico, pode fornecer uma identificação mais segura.
Baas & Gregory[42] afirmam que células secretoras de óleo e mucilagem podem ocorrer simultaneamente na mesma planta. As células de óleo ou mucilagem podem ser derivadas de iniciais idênticas e podem ainda substituir umas às outras[43]. Afirma-se ainda que as células secretoras de mucilagem e óleo essencial são muito comuns nas Lauraceae[44]. A ocorrência de células secretoras não constitui um bom caráter para ser aplicado na identificação de gêneros e espécies de Lauraceae, pois a presença destas estruturas ocorre amplamente na família. Pode-se sugerir ainda que as células que não reagiram positivamente ao Sudam III e reagiram positivamente ao vermelho de Rutênio e ao Azul de Astra, no material estudado, estejam armazenando conteúdo mucilaginoso, conforme descrito nas referências citadas.
Nas espécies estudadas, o bordo foliar é constituído internamente por células parenquimáticas de parede lignificada ou, mais frequentemente, por esclereídes. A espécie Nectandra rigida merece destaque, pois, na região mais basal da lâmina foliar, o bordo é revoluto. Este caráter apresenta grande importância, pois permite separar Nectandra rigida das outras espécies.
Os caracteres anatômicos do sistema vascular fornecem dados importantes que podem ser aplicados a taxonomia. Pode-se encontrar, em muitos gêneros de Lauraceae, sistema vascular em arco, na lâmina foliar e no pecíolo[44]. No presente trabalho, o sistema vascular forneceu dados valiosos para separar as espécies. Foi observado, na nervura mediana, sistema vascular em um ou dois arcos, em "v" ou traço contínuo. Nectandra rigida apresentou sistema vascular cuja conformação é extremamente complexa, devido às anastomoses de nervuras de menor calibre com a nervura mediana ao passo que, em Nectandra lanceolata, não se observou o mesmo grau de complexidade. Barros et al.[35] observaram sistema vascular em arco, acompanhado por fibras perivasculares em Ocotea divaricata e Beilschmiedia rigida. Foi observado ainda, em Ocotea porosa, um sistema vascular em um feixe colateral envolvido por um anel de esclerênquima e extensões de bainha[45].
A utilização do padrão de venação foliar para fins taxonômicos na família Lauraceae é controversa. Menciona-se que o padrão de venação em Pleurothyrium pode incluir tanto os tipos camptódromos e broquidódromo quanto seus intermediários, sendo que o tamanho e forma das folhas não afetam o tipo de venação[46]. O autor afirma ainda que os possíveis padrões são difíceis de serem precisamente descritos. Moraes & Paoli[20] descreveram uma notória variação ocorrida entre as nervuras de menor calibre em Cryptocaria moschata, Endlicheria paniculata e Ocotea catharinensis, não sendo este caráter adequado para fins taxonômicos. Os autores mencionam ainda que a densidade dessas nervuras também pode variar. As cinco espécies estudadas, no presente trabalho, mostraram uma uniformidade em relação ao padrão de venação, quando se comparou indivíduos da mesma espécie, ocorrentes em habitats distintos, à exceção de Nectandra lanceolata. Entre Nectandra rigida e Nectandra lanceolata, a venação mostrou diferenças, conforme já mencionado (TABELA 1).
| Espécies | ||||
|---|---|---|---|---|
| Caracteres | Ocotea paulensis | Ocotea odorifera | Nectandra lanceolata | Nectandra rigida |
| Periderme no pecíolo | presente | presente | ausente | ausente |
| Tricomas tectores | Ausentes, raros unicelulares | ausentes | unicelulares | unicelulares |
| Estômatos | paracítico | paracítico | paracítico (graminóide) | paracítico |
| No de camadas: epiderme | 1 | 1 | 1 | 1 |
| Contrafortes | ausentes | presentes | ausentes | ausentes |
| Hipoderme | ausente | ausente | ausente | presente |
| No de camadas: paliçádico | 1 – 2 | 2 | 2 | 2 |
| No de camadas: lacunoso | 6 – 7 | 7 - 8 | 4 - 5 | 3 – 5 (poucas lacunas) |
| Cristais | presentes | ausentes | presentes | ausentes |
| Esclerênquima | Tricoesclereíde, braquiesclereíde e fibras | Tricoesclereíde, braquiesclereíde e fibras | Tricoesclereíde e fibras | Tricoesclereíde e fibras |
| Idioblastos secretores | mucilaginoso | oleífero | oleífero e mucilaginoso | oleífero |
| Sistema Vascular no pecíolo: região proximal | arco com extremidades voltadas para o centro | arco com extremidades voltadas para o centro | arco com extremidades voltadas para o centro | arco com extremidades voltadas para o centro |
| Região mediana | 3 arcos | 3 arcos | arco com extremidades voltadas para o centro | arco com extremidades voltadas para o centro |
| Região distal | 3 arcos ou em "V" | arco com extremidades eretas ou em "V" | arco com extremidades eretas | 3 arcos |
| Sistema Vascular na nervura mediana | arco atenuado traço contínuo | traço contínuo | arco com extremidades eretas | 2 arcos unidos em uma das extremidades na nervura mediana (11 conformações ao longo de toda a lâmina foliar) |
| Bordo foliar | levemente fletido, constituído por esclereídes | levemente fletido, constituído por esclereídes | levemente fletido, parênquima com células de paredes lignificadas presentes | completamente fletido, parênquima com células de paredes lignificadas presentes |
| Colênquima | presente | presente | presente | presente |
| Padrão de venação | camptódromo-broquidódromo | camptódromo-broquidódromo | camptódromo eucamptódromo | camptódromo broquidódromo |
| Venação marginal | fimbrial | fimbrial | fimbrial ou em alças | em alças |
Conclusão
O estudo anatômico realizado permite concluir que a anatomia foliar pode fornecer dados para auxiliar de forma efetiva no reconhecimento das espécies de Lauraceae estudadas. A análise de espécimes provenientes de habitats distintos é muito importante para que se possa levar em consideração a variação ocorrente na estrutura anatômica, determinada pelas condições ambientais as quais as espécies encontram-se submetidas. A associação de caracteres, como: número de células que formam tricomas, tipo de estômato, presença de contrafortes parietais na parede periclinal externa, formação de periderme no pecíolo, conformação do bordo foliar e do sistema vascular na nervura mediana e o padrão de venação (Tabela 1), permitiram separar com maior segurança as espécies estudadas, mostrando-se promissores para auxiliar na identificação de outras espécies pertencentes à família Lauraceae.
Agradecimentos
À FAPEMIG e à CAPES pelas bolsas concedidas (1999-2001) e ao biólogo Gilmar E. Valente pelo auxílio na coleta e herborização do material botânico. Este trabalho é dedicado à memória dos professores Gilberto Pedralli e Eldo A. M. da Silva.
Referências
1. Werff H van der, Richter HG. Toward an improved classification of Lauraceae. Annals of the Missouri Botanical Garden 1996; 83(3):419-432. ISSN 0026-6493. [CrossRef].
2. Barroso GM, Peixoto AL, Ichaso CLF, Guimarães EF, Costa CG. Sistemática das Angiospermas do Brasil. Vol. I. 2a edição. Viçosa: Editora UFV. 2002. 310p. ISBN-10: 8572691278.
3. Vattimo I. O gênero Ocotea Aubl. no sul do Brasil. I - Espécies de Santa Catarina e do Paraná (Lauraceae). Rodriguésia. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro. 1956; 18/19 (30/31): 266-317. ISSN 0370-6583.
4. Felfili JM, Filgueiras TS, Haridassan M, Silva-Junior MC, Cunha-de-Mendonça R, Resende AV. Projeto biogeografia do bioma cerrado: Vegetação e Solos. Cad Geocien. Out./dez. 1994; 12:75-166. ISSN 0103-1597.
5. Marques CA. Importância econômica da família Lauraceae. Rev Floram. 2001; 8(1):195-206. ISSN 1415-0980.
6. Carvalho DA, Oliveira-Filho AT, Vilela EA, Gavilanes ML. Flora arbustivo-arbórea de uma floresta ripária no alto rio grande em Bom Sucesso, MG. Acta Bot Bras. 1995; 9(2):231-245. ISSN 0102-3306.
7. Oliveira-Filho AT, Machado JNM. Composição florística de uma floresta semidecídua montana, na serra de São José, Tiradentes, MG. Acta Bot Bras. 1993; 7(2):71-87. ISSN 0102-3306.
8. Pedralli G, Teixeira MCB, França EG. Lauraceae do Parque Estadual do Rio Doce, MG, Brasil. Cien Cult. 1986; 38(8):1414-1421. ISSN 2317-6660.
9. Pedralli G, Freitas VLO, Meyer ST, Teixeira MCB. Levantamento florístico na estação ecológica do Tripuí, Ouro Preto, MG. Acta Bot Bras. 1997; 11(2):191-213. ISSN 0102-3306.
10. Paula A. Alterações florísticas e fitossociológicas da vegetação arbórea numa floresta semidecidual em Viçosa, MG. Viçosa-MG: UFV. Dissertação de Mestrado [em Botânica], Universidade Federal de Viçosa. 1999.
11. Lopes WP. Florística e Fitossociologia de um trecho de vegetação arbórea no Parque Estadual do Rio Doce, MG. Viçosa-MG: UFV. Dissertação de Mestrado [em Botânica], Universidade Federal de Viçosa. 1998.
12. Carvalho PER. Canela-branca. Circular Técnica. Embrapa Florestas. 2002; 63:1-7. ISSN 1517-5278.
13. Le Quesne PW, Larrahondo JE, Raffauf RF. Antitumor plants. X. Constituents of Nectandra rigida. J Nat Prod. 1980; 43(3): 353-359. ISSN 0163-3864.
14. Tomazi LB, Aguiar PA, Citadini-Zanette V, Rossato AE. Estudo etnobotânico das árvores medicinais do Parque Ecológico Municipal José Milanese, Criciúma, Santa Catarina, Brasil. Rev Bras Plan Med. 2014; 16(2)Supl. 1:450-461. ISSN 1983-084X. [CrossRef].
15. Coe-Teixeira, B. Lauráceas do gênero Ocotea do estado de São Paulo. Rodriguésia. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro. 1980; 32(52):55-139. ISSN 0370-6583.
16. Werff H van der. A key to the genera of Lauraceae in the new world. Annals of the Missouri Botanical Garden 1991; 78:377-387. ISSN 0026-6493.
17. Solereder H. Systematic anatomy of the Dicotyledons. Vol. I. Oxford: Claredon Press; 1908.
18. Baruah A, Nath SC. Foliar epidermal caracters in twelve species of Cinnamomum Schaeffer (Lauraceae) from Northestern India. Phytomorph. 1997; 47(2):127-134. ISSN 0031-9449.
19. Christophel DC, Kerrigan R, Rowett AI. The use of cuticular features in the taxonomy of the Lauraceae. Annals of the Missouri Botanical Garden. 1996; 83:419-432. ISSN 0026-6493.
20. Moraes PLR, Paoli AAS. Epiderme e padrão de venação foliar de espécies de Lauraceae. Acta Botan Bras. 1999; 13(1): 87-97. ISSN 0102-3306.
21. IEF - Instituto Estadual de Florestas. Pesquisas prioritárias para o Parque Estadual do Rio Doce, Brasil. Belo Horizonte, MG. 1994.
22. Johansen DA. Plant Microtechnique. 1st ed. New York: Mc Graw Hill Company: 503p, 1940.
23. Roeser KR. Die Nadel der Schwarzkiefer. Massenprodukt und kunstwerk der Natur. Mikrokosmos. 1972; 61(2): 33-36. ISSN 0026-3680.
24. Stritmatter CGD. Nueva tecnica de Diafanizacion. Boletín de la Sociedad Argentina de Botánica. 1973; 15(1):126-129. ISSN 0373-580X.
25. Hickey LJ. A Revised classification of the architecture of Dicotiledonous leaves. In: Metcalfe CR, Chalk L. Anatomy of the Dicotyledons. Vol. I. 2a ed. Oxford: Oxford Claredon Press; 1979.
26. Wilkinson HP. The plant Surface (Mainly Leaf). Part I: Stomata. In: Metcalfe & CR, Chalk L. Anatomy of the Dicotyledons, Vol. I. 2a ed. Oxford: Oxford Claredon Press; 1979.
27. Silveira M. Preparo de amostras biológicas para microscopia eletrônica de varredura. In: Souza, W. de (Ed.). Manual sobre técnicas básicas em microscopia eletrônica. Vol. I. Técnicas básicas. Sociedade Brasileira de Microscopia Eletrônica. 1989: 49-63.
28. Santos M, Oliveira PL. Aspectos anatômicos do pecíolo de quatro espécies do gênero Ocotea Aubl. (Lauraceae) ocorrentes no Rio Grande do Sul. Insula. 1995; 24:3-14. ISSN 0101-9554.
29. Petzold V. Systematish-anatomische Untersuchungen über die Laubbläter der amerikanischen Lauraceen. Botanische Jahrbücher für Systematik Planzengeschichte und Planzengeographie. 1907; 38:445-474.
30. Pyykkö M. Morphology and anatomy of leaves from woody plants in a humid tropical forest of Venezuelean Guaiana. Acta Bot Fenn. 1979; 112:1-41. ISSN 0001-5369.
31. Faggetter CD. Leaf cuticules (phytoglyphs) of selected Lauraceae. In:Metcalfe CR. (ed.). Anatomy of the Dicotyledons. Vol. III. 2a ed. Oxford, Oxford Claredon Press. 1987. ISBN 10: 0198545932.
32. Marques CA, Barros CF, Costa CG. Beilshmiedia rigida (Mez) Kosterm. (Lauraceae): diferenciação e desenvolvimento da lâmina foliar. Rodriguésia. Instituto de Pesquisas Jardim Botânico do Rio de Janeiro. 2004; 55 (84): 89-100. ISSN 0370-6583.
33. Fontenelle GB, Costa CG, Machado RD. Foliar anatomy and micromorphology of eleven species of Eugenia L. (Myrtaceae). Botan J Lin Soc. 1994; 116 (2):111-133. ISSN 0024-4074.
34. Avita, Inamdar JA. Stomatal complex in Lauraceae; structure and ontogeny. Acta Bot Ind. 1981; 9: 50-56. ISSN 0379-508X.
35. Barros CF, Callado CH, Cunha M, Costa CG, Pugialli HRL, Marquete O, et al. Anatomia ecológica e Micromorfologia Foliar de espécies de Floresta Montana na Reserva Ecológica de Macaé de Cima. In: Lima HC & Guedes-Bruni RR. Serra de Macaé de Cima: Diversidade Florística e Conservação em Mata Atlântica. 1ª ed. Rio de Janeiro: Jardim Botânico do Rio de Janeiro. 1997. ISBN 85-7224-007-1.
36. Braga MMN. Sobre a ocorrência de estômatos "graminóides" em espécies do gênero Virola L. e em outras dicotiledôneas. Acta amazon. 1984; 14(3/4):521-525. ISSN 0044-5967.
37. Esau K. Anatomy of the seed plants. 2nd ed., New York: Ed. Jonh Villey & Sons; 1977; ISBN 978-0-471-24520-9.
38. Metcalfe CR. Anatomy of the Dicotyledons. Vol. III. 2ª ed. Oxford: Oxford Claredon Press, 98-125; 1987. ISBN 10: 0198545932.
39. Vattimo I. Seis novas espécies do gênero Ocotea Aubl. (Lauraceae). Arquivos do Jardim Botânico do Rio de Janeiro. 1958; 16:41-46. ISSN 0103-2550.
40. Vogelmann TC, Martin G.The functional significance of palisade tissue: penetration of directional versus diffuse light. Plant, Cell Environ. 1993; 16:65-72. ISSN 1365-3040.
41. Coe-Teixeira B. Lauráceas do estado de São Paulo III. Nectandra. Anais do XV Congresso da Sociedade Botânica do Brasil. 1964:119-123.
42. Baas P, Gregory M. A survey of oil cells in the dicotyledons with a comments on their replacement by and joint occurence with mucilage cells. Israel J Botany 1985; 34:167- 186. ISSN 2223-8980.
43. Richter HG. Anatomie des Sekundärem Xylems und der Rinde der Lauraceae. Sonderbände des Naturwiss. Vereins Hamburg 5. Parey Hamburg, Berlin; 1981.
44. Metcalfe CR, Chalk L. Anatomy of the Dicotyledons, Vol. I. 1ª ed. Oxford: Oxford Claredon Press: 1155p; 1950. ISBN-10: 0198542534.
45. Santos M, Oliveira PL. Aspectos anatômicos da lâmina foliar de Ocotea porosa (Nees et Mart. ex Nees) J. Angely (Lauraceae). Insula. 1988; 18:3-22. ISSN 0101-9554.
46. Werff H van der. A revision of the genus Pleurothyrium (Lauraceae). Annals of the Missouri Botanical Garden. 1993, 80:39-118. ISSN 0026-6493.