Artigo Original
Cromatografia Contracorrente no Isolamento de Bisflavonóide de Garcinia xanthochymus
Countercurrent Chromatography for the Isolation of Biflavanoids from Garcinia xanthochymus
Resumo
O gênero Garcinia é pertencente à família Clusiaceae e contém cerca de 200 espécies distribuídas nas regiões tropicais. Dados etnofarmacológicos indicam para algumas espécies desse gênero as atividades: adstringentes, diuréticas e antiinflamatórias e a fitoquímica mostra que o gênero Garcinia contém bisflavonóides e xantonas como seus constituintes majoritários. Em contribuição ao estudo químico da espécie Garcinia xanthochymus, o extrato metanólico das folhas de G. xanthochymus foi cromatografado em aparelho de contracorrente utilizando o sistema de solventes Hexano: Acetato de etila: Metanol: Água (2:8:5:5) visando o isolamento de metabólitos especiais. O material cristalino e de coloração amarela obtido através da elucidação estrutural por técnicas espectrométricas de RMN 1H e 13C foi identificado como morelloflavona.
- Unitermos:
- Cromatografia Contracorrente.
- Garcinia xanthochymus.
- Morelloflavona.
Abstract
The Garcinia genus belongs to the Clusiaceae family and contains 200 species distributed in the tropical regions. Ethnopharmacology indicates for this genus the activities: astringent, diuretic and anti-inflammatory and the phytochemical profile shows that the Garcinia genus contains biflavonoids and xanthones as the major constituents. In order to contribute with the chemistry of the species, the methanol extract of leaves was chromatographed in a countercurrent apparatus using the solvent system: n-hexane: ethyl acetate: methanol: water (2:8:5:5) aiming the isolation of metabolites special. The isolated material as yellow crystals was identified as morelloflavona by the 1H and 13C NMR spectrometric analysis.
- Key words:
- Countercurrent Chromatography.
- Garcinia xanthochymus.
- Morelloflavone.
Introdução
O Brasil possui a maior biodiversidade do mundo, estimada em cerca de 20% do número total de espécies do planeta. Esse imenso patrimônio genético tem na atualidade um valor econômico inestimável em várias atividades, mas é no campo do desenvolvimento de novos medicamentos onde se encontra sua maior potencialidade (CALIXTO, 2003). Sendo assim, quaisquer que sejam o projeto de identificação, a exploração e a avaliação da biodiversidade, devem ser considerados os métodos científicos e procedimentos biotecnológicos especiais, particularmente aqueles relacionados com fitoquímica, fitofarmacologia, taxonomia, botânica, fisiologia de plantas e etnobotânica (GARCIA, 1995).
A família Clusiaceae, também conhecida como Guttiferae, pertence à superordem Theiflorae, ordem Theales de acordo com o sistema de classificação de Dahlgren (1980). Essa família compreende 49 gêneros de ampla distribuição nas regiões tropicais e subtropicais, possuindo mais de 1000 espécies distribuídas em 6 subfamílias, todas com representantes no Brasil (JOLY, 1993).
O gênero Garcinia, pertencente a essa família, compreende mais de 200 espécies de hábitos arbóreo ou arbustivo distribuídos nas regiões tropicais (MBWAMBO et al., 2006). O perfil químico de Garcinia é marcado pelas presenças de terpenóides, xantonas, flavonóides, bisflavonóides, benzofenonas, entre outros. As xantonas e os flavonóides são considerados as principais classes de substâncias associadas ao potencial terapêutico do gênero Garcinia (KUETE et al., 2007). A espécie Garcinia xanthochymus Hook. f. ex T. Anders., também chamada de gamboge, é uma árvore de 10 a 12 metros de altura, com folhas lineares-oblongas a oblongo-lanceoladas e frutos com polpa amarela; também chamados de falso mangustão. Entre os inúmeros frutos tropicais, o mangustão é considerado o principal fruto do trópico asiático devido ao sabor e aroma agradáveis de sua polpa, além do uso na medicina para o tratamento de diarréia e disenteria (NASCIMENTO et al., 2001).
A cromatografia contracorrente (CCC) é uma técnica cromatográfica, de partição líquido-líquido, que consiste na utilização de duas fases líquidas imiscíveis sem a necessidade de matriz de sustentação. O princípio da separação envolve a partição de um soluto entre as fases do sistema e a proporção de soluto que passa para cada uma das fases é função do seu coeficiente de partição (LEITÃO, 2005). O CCC apresenta inúmeras vantagens quando comparado com o método de separação tradicional sólido-líquido: não existe adsorção, baixo consumo de solvente, baixo risco de degradação da amostra, curto tempo de análise, dentre outras (MARSTON; HOSTETTMANN, 2006).
Com o objetivo de contribuir com a química da espécie e também visando possíveis avaliações farmacológicas, o extrato metanólico das folhas de G. xanthochymus foi cromatografado em aparelho de contracorrente para isolamento de metabólicos especiais.
Material e Métodos
Equipamentos: O cromatógrafo de contracorrente da marca Pharma-Tech Research Corp.modelo CCC-1000, foi equipado com coluna de 325mL adaptada em três bobinas, bomba de solventes LDC Analytical de modelo ConstaMetric 3500; válvula manual de injeção com loop de 10mL; e coletor de frações CF1 da Spectrum Chromatography. Os espectros de ressonância magnética nuclear de hidrogênio (RMN 1H) e carbono (RMN 13C) além de DEPT, COSY HMBC e HMQC, foram adquiridos em espectrômetro Brücker Digital NMR model 400 em freqüências de 400.15 MHz para o hidrogênio e 100.61 MHz para o carbono. Os espectros de massas foram obtidos por injeção direta da solução de 10 ppm em equipamento da Micromass ZQ com capilar de 4kV.
Solventes e Reagentes: Os solventes utilizados foram hexano, acetato de etila e metanol grau analítico. Para a cromatografia em camada fina foram utilizadas cromatoplacas de gel de sílica 60 F254 da marca Merck, reveladas com Godin (vanilina 1% em etanol e ácido perclórico 3% em água, na proporção 1:1, ácido sulfúrico 10% em etanol) (GODIN, 1954) e NP/PEG (difenilboriloxietilamina/polietilenoglicol) (WAGNER et al., 1984).
Coleta do Material Botânico e Preparo dos Extratos: As folhas de G. xanthochymus foram coletadas e depositadas no Jardim Botânico do Rio de Janeiro, Rio de Janeiro, RJ sob o registro RB 390170. As folhas (904 g) foram previamente secas em estufa a 40 °C, moídas e extraídas por maceração dinâmica com solventes de diferentes polaridades, que após evaporação, forneceram os seguintes extratos: hexânico (11,71 g), diclorometânico (18,29 g) e metanólico (55,55 g).
Escolha do sistema de solvente para a separação em CCC: Para o procedimento cromatográfico o sistema de solvente utilizado foi hexano: acetato de etila: metanol: água (2:8:5:5; v/v/v/v). A mistura dos solventes foi agitada em funil de separação e após o equilíbrio hidrostático, as fases foram separadas. Uma pequena quantidade do extrato metanólico de folhas de G. xanthochymus (GXFM) foi dissolvido em 1 mL de cada uma das fases do sistema. Cada fase foi aplicada em CCD separadamente e eluída com a fase superior desse sistema solvente. A revelação da cromatoplaca com NP/PEG e Godin mostrou uma boa separação dos componentes do extrato metanólico.
Procedimento de separação em CCC: Após a desgaseificação do sistema de solvente em ultra-som, o aparelho CCC foi primeiramente preenchido com a fase estacionária (fase orgânica). Em seguida, a rotação (900 rpm) foi iniciada e a fase móvel (fase aquosa) do sistema selecionado foi bombeada com fluxo constante de 1.0 mL/min.Foi observada uma retenção de fase estacionária de 60,31%. Quando as fases entraram em equilíbrio, 1 g de extrato metanólico foi dissolvido em 10 mL de ambas as fases do sistema (1:1; v/v) e injetado através de uma válvula de injeção, no CCC. Frações de 5 mL foram coletadas com auxílio de um coletor de frações. As 216 frações resultantes da separação foram reunidas de acordo com o seu comportamento cromatográfico em CCD. As frações 55-60 reunidas (43 mg), após completa volatilização do solvente, apresentaram cristais amarelos amorfos, identificados por técnicas espectrométricas de RMN 1H e 13C (COSY, DEPT, HMQC, HMBC).
Resultados e Discussão
A escolha do sistema de solventes para a cromatografia contracorrente é o ponto chave para o sucesso da separação de substâncias de origem vegetal. O sistema foi escolhido com base na pesquisa desenvolvida por Kapadia e colaboradores (1994) que, empregando Hexano: AcOEt: MeOH: H2O (2:8:5:5), conseguiram isolar bisflavonóides de sementes de Garcinia kola. O processo cromatográfico, embora com baixa retenção de fase estacionária (60,31%), permitiu a obtenção de cristais amorfos de coloração amarelada nas frações GXFM 55-60 e GXFM 127-139 sendo que, esta última segue em análise espectral.
De acordo com a aquisição por eletrospray negativo, a fração GXFM 55-60 apresentou o íon majoritário 555,4 m/z, que seria referente ao íon molecular [M-1]. O íon 429,4 m/z aparece como um possível fragmento da molécula em questão que pode ser formado através das perdas do anel E e de uma hidroxila. Na análise por eletrospray positivo essa fragmentação não foi observada, possivelmente pela necessidade do anel E para estabilizar a carga no íon molecular [M+1]. Contudo, houve a formação de um aduto da molécula neutra com o íon sódio pela presença do íon m/z 579,4.
A análise por RMN 1H mostrou um sinal em 5,76 ppm (d, J = 12Hz) referente ao átomo de hidrogênio na posição 2, e a constante de acoplamento sugere que esse átomo de hidrogênio apresenta a configuração trans referente ao átomo de hidrogênio na posição 3 em 4,89 ppm (d, J = 12Hz). Os sinais em 7,11 ppm (d, J = 8,0 Hz) e em 6,41 ppm (d, J = 8,0 Hz) com integração de dois átomos de hidrogênio para cada sinal, confirmam o padrão de substituição 4’ da porção flavanona do bisflavonóide e são referentes aos pares de átomos de hidrogênio nas posições 2’, 6’ e 3’, 5’. Os dupletos em 5,97 ppm e em 5,98 ppm são referentes aos átomos de hidrogênio nas posições 6 e 8 respectivamente. O dupleto mal resolvido em 7,35 ppm, referente ao átomo de hidrogênio 2’’’, mostra uma correlação no espectro COSY como o duplo dupleto em 7,29 ppm (dd, J = 8,0 Hz), referente ao átomo de hidrogênio 6’’’. O sinal em 6,92 ppm (d, J =8,0 Hz; H5’’’) mostra uma correlação no espectro COSY com o sinal em 7,29 ppm, confirmando a substituição 3’’’ e 4’’’ do anel E. Os singletos em 6,41 ppm e em 6,25 ppm são referentes aos átomos de hidrogênio na posição 3” e 6”. A análise do espectro HMBC mostrou uma correlação entre o átomo de hidrogênio na posição 3 (4,89 ppm) da flavanona com o átomo de carbono na posição 8” (103,3 ppm) da flavona, confirmando assim o ponto de ligação entre os átomos de carbono 3 e 8” do bisflavonóide. Dados de RMN 13C para essa substância (Tabela 1) foram comparados com os dados espectrais descrito na literatura, confirmando a identificação do bisflavonóide conhecido como morelloflavone (sinônimo fukugentin) cuja fórmula molecular é C30H20O11 (Figura 1). A morelloflavone foi isolada das folhas de Garcinia morella em 1967, sendo posteriormente isolada de outras espécies de Garcinia (LI et al., 2002; MBWAMBO et al., 2006).
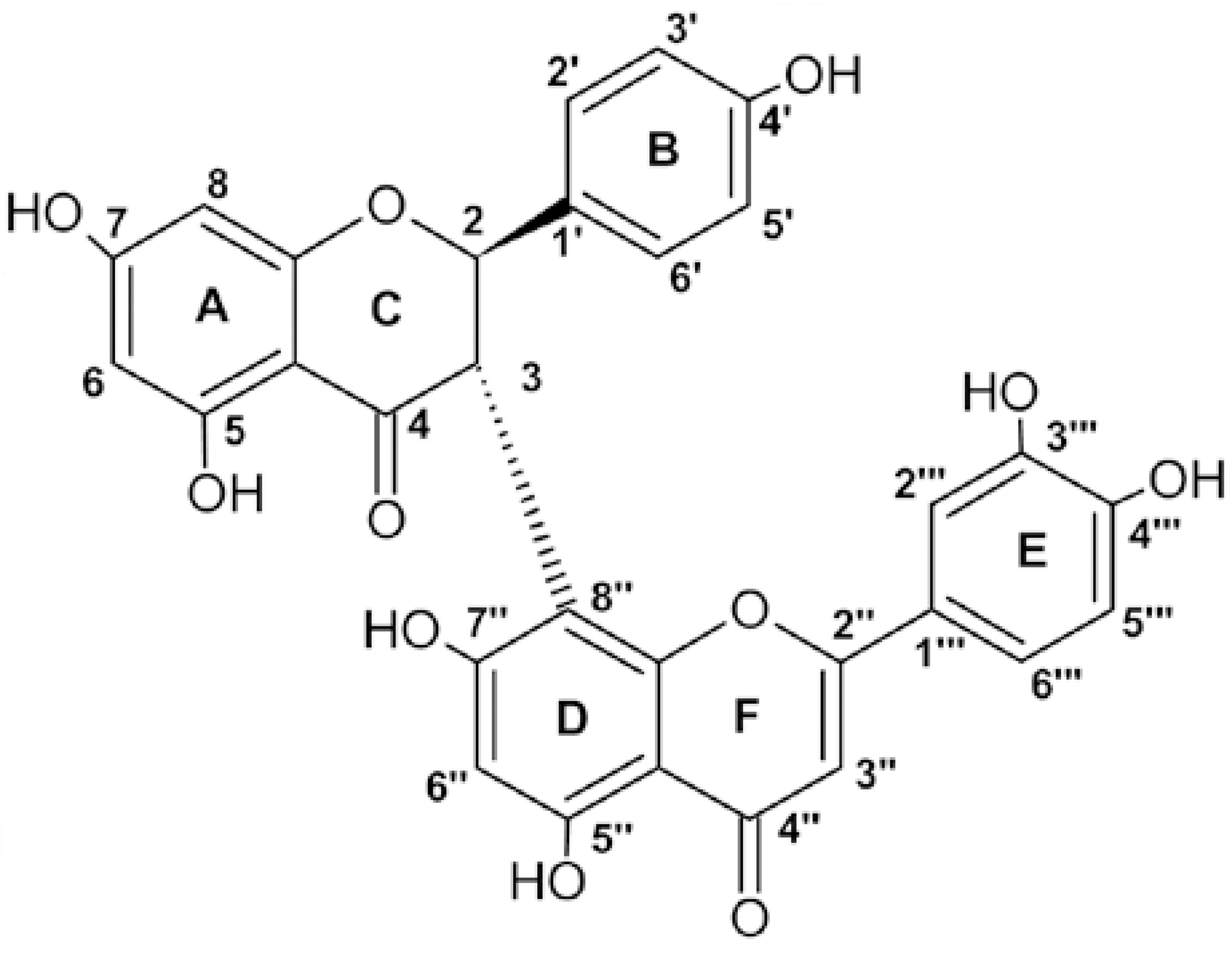
| Posição | 1H (ppm) | 13C (ppm) | Posição | 1H(ppm) | 13C (ppm) |
| 2 | 5,76 | 82.8 | 2” | - | 164.9 |
| 3 | 4,89 | 50.9 | 3” | 6,41 | 103.5 |
| 4 | - | 198.0 | 4” | - | 184.0 |
| 5 | - | 158.7 | 5” | - | 164.5 |
| 6 | 5,97 | 96.5 | 6” | 6,25 | 99.9 |
| 7 | - | 162.4 | 7” | - | 168.3 |
| 8 | 5,98 | 97.5 | 8” | - | 103.3 |
| 9 | - | 162.7 | 9” | - | 168.8 |
| 10 | - | 101.8 | 10” | - | 103.0 |
| 1’ | - | 130.6 | 1'” | - | 120.6 |
| 2’ | 7,11 | 129.4 | 2”’ | 7,35 | 114.3 |
| 3’ | 6,41 | 115.7 | 3”’ | - | 147.0 |
| 4’ | - | 157.5 | 4”’ | - | 151.1 |
| 5’ | 6,41 | 115.5 | 5’” | 6,92 | 117.0 |
| 6’ | 7,11 | 129.9 | 6”’ | 7,29 | 120,7 |
Os resultados reforçam a representatividade da espécie na produção de bisflavonóides e validam a cromatografia contracorrente com uma técnica poderosa na separação e purificação de substâncias do extrato metanólico de G. xanthochymus. O baixo consumo de solvente e a velocidade da análise são um dos principais atrativos dessa técnica em comparação com as demais.
Agradecimentos
Os autores agradecem à Central Analítica de Far-Manguinhos e à Profa Dra Maria Auxiliadora Coelho Kaplan.
Referências
CALIXTO, J.B. Biodiversidade como fonte de medicamentos. Ciência e Cultura, v.55, n.3, 2003.
DAHLGREN, R. M. T. A Revised System of classification of Angiosperms. Botanical Journal of the Linnean Society, v.80, n.2, p.91, 1980.
GARCIA, E.S. Biodiversidade, biotecnologia e saúde. Cadernos de Saúde Pública, v.11, n.3, p.491-494, 1995.
GODIN, P.A. Newspray reagent for paper chromatography of polyols and cetoses. Nature, v.174, p.134, 1954.
JOLY, A.B. Botânica - Introdução à Taxonomia Vegetal. São Paulo: Editora Nacional, 1993.
KAPADIA, G.J.; OGUNTIMEIN, B.; SHUKLA, Y.N.Highspeed counter-current chromatographic separation of boflavanoids from Garcinia Kola seeds. Journal of Chromatography A, v.673, p.142-146, 1994.
KUETE, V.; KOMGUEM, J.; BENG, V.P.; MELI, A. L.; TANGMOUO, J. G.; ETOA, F. X.; LONTSI, D. Antimicrobial components of the methanolic extract from the stem bark of Garcinia smeathmannii Oliver (Clusiaceae). South African Journal of Botany, 2007, <doi:10.1016/j.sajb.2007.01.004>.
LEITÃO, G.G. Uso da cromatografia contracorrente na obtenção de padrões de origem vegetal. Revista Fitos, v.1, n.2, p.48-52, 2005.
LI, X.; JOSHI, A.S.; TAN, B.; ELSOHLY, H.N.; WALKER, L.A.; ZJAWIONY, J.K.; FERREIRA, D. Absolute configuration, conformation, and chiral properties of flavonone-(3-8”)-flavone biflavonoids from Rheedia acuminata. Tetrahedron, v.58, p.8709-8717, 2002.
MARSTON, A.; HOSTETTMANN, K. Developments in the application of counter-current chromatography to plant analysis. Journal of Chromatography A, v.1112, p.181-194, 2006.
MBWAMBO, Z.H.; KAPINGU, M.C.; MOSHI, M..J.; MACHUMI, F.; APERS, S.; COS, P.; FERREIRA, D.; MARAIS, J.P.J.; BERGHE, D.V.; MAES, L.; VLIETINCK, A.; PIETERS, L. Antiparasitic Activity of Some Xanthones and Biflavonoids from the Root Bark of Garcinia liwingstonei. Journal of Natural Products, v.69, p.369-372, 2006.
NASCIMENTO, W. M. O.; TOMÉ, A. T.; CARVALHO, J. E. U.; MÜLLER, C. H. Comportamento fisiológico de sementes de mangostão (Garcinia mangostana L.) submetidas a diferentes períodos de fermentação da polpa. Revista Brasileira de Fruticultura, v.23, n.3, p.735-737, 2001.
WAGNER, W.H.; BLADT, S.; ZGAINSKI, E.M. Plant drug analysis. A thin layer chromatography atlas. Berlin: Springer-Verlag, 1984.