Artigo de Pesquisa
Evaluación de la genotoxicidad de extractos acuosos de hojas de Moringa oleifera Lam. (Moringaceae) utilizando el test de Allium cepa
Evaluation of the genotoxicity of aqueous extracts of Moringa oleifera Lam. (Moringaceae) leaves using the Allium cepa test
Resumen
Actualmente el uso corriente de plantas medicinales para el tratamiento de las diferentes afecciones se ha incrementado y en la mayoría de los casos se comercializan sin previos estudios de toxicidad. M. oleifera es un árbol distribuido en zonas tropicales y subtropicales, muy utilizado en la medicina tradicional para tratar múltiples afecciones. En el marco del Proyecto de Investigación incentivado 16Q626 "Evaluación de la Genotoxicidad de Extractivos de Especies Medicinales de uso corriente para las afecciones más frecuentes en la Ciudad de Posadas Provincia de Misiones Argentina", en esta instancia se propuso analizar la genotoxicidad de extractos acuosos de M. oleifera por medio del test de Allium cepa. El experimento consistió en dos etapas, donde además de determinar la concentración que detiene el crecimiento de las raíces un 50% en comparación con los controles y las anomalías macroscópicas, se buscaron los biomarcadores predeterminados de genotoxicidad (cromosomas rezagados, c-mitosis, anafase puente, etc) a concentraciones iguales o superiores a la concentración 50. Las concentraciones más elevadas probadas mostraron mayor inhibición de la mitosis con respecto a los controles, pero no se encontraron efectos genotóxicos, aunque las concentraciones utilizadas en el experimento, no son usuales de M. oleífera en la medicina tradicional.
- Palavras-chave:
- Genotoxicidad.
- M. oleifera.
- Extractos acuosos.
- A. cepa test.
Abstract
Currently the current use of medicinal plants for the treatment of different conditions has increased and in most cases they are commercialized without previous toxicity studies. M. oleifera is a tree distributed in tropical and subtropical zones, widely used in traditional medicine to treat multiple conditions. Within the framework of the Research Project incentivized 16Q626 "Evaluación de la Genotoxicidad de Extractivos de Especies Medicinales de uso corriente para las afecciones más frecuentes en la Ciudad de Posadas Provincia de Misiones Argentina", in this instance it was proposed to analyze the genotoxicity of aqueous extracts of M. oleifera by means of the Allium cepa test. The experiment consisted of two stages, where in addition to determining the concentration that stops the growth of the roots by 50% in comparison with the controls and the macroscopic anomalies, the predetermined biomarkers of genotoxicity (lagged chromosomes, c-mitoses, anaphase bridge, etc.) at concentrations equal to or greater than the concentration 50. The highest concentrations tested showed greater inhibition of mitosis with respect to the controls, but no genotoxic effects were found, although the doses used in the experiment are not usual doses of M. oleifera in traditional medicine.
- Keywords:
- Genotoxicity.
- M. oleifera.
- Aqueous extracts.
- A. cepa test.
Introducción
Moringa oleifera (Lam.) pertenece a la familia Moringaceae, es un árbol de tamaño pequeño o mediano, de raíces tuberosas y corteza fisurada. Sus hojas son compuestas, largamente pecioladas, de color verde opaco. De flores aromáticas, bisexuales, de color blanco-amarillento, agrupadas en panículas. Fruto capsula, multiseminado[1].
Es ampliamente utilizado debido a las numerosas propiedades medicinales que se le atribuyen, como ser para el tratamiento de anemia, asma, catarro, conjuntivitis, diarrea, dolores, fiebre, gonorrea, hinchazón glandular, hipertensión arterial, infecciones cutáneas, llagas, picaduras venenosas, problemas de la vejiga y la próstata, psoriasis, tumores, úlceras, etc.[2]. Además es ampliamente utilizada como alimento para el humano y el ganado[3].
Ha sido ampliamente estudiada, los extractos acuosos de las hojas han inhibido el crecimiento de Pseudomonas aeruginosa y Staphylococcus aureus en pruebas in vitro [4], también posee acción hipoglucemiante en ratas aloxano diabéticas[5], antiinflamatoria principalmente sobre vías respiratorias[6] y el aceite extraído de sus semillas posee propiedades antioxidantes[7].
Los antecedentes de toxicidad de la droga vegetal son aún escasos, extractos de semilla han sido evaluados a una concentración de 0,2 µg/µL por medio los ensayos de Ames, Kado y análisis de ADN plasmídico, no encontrando efectos genotóxicos[8]. También se ha estudiado el potencial de toxicidad de nutracéuticos a base de M. oleifera en niveles de supra-suplementación, encontrando efectos genotóxicos en modelos animales a una dosis alta de 3000 mg/kg de peso debido a la presencia de micronúcleos en eritrocitos policromaticos[9]. Los efectos tóxicos del extracto acuoso de las hojas de Moringa oleifera fueron evaluados por su toxicidad oral por vía oral y para la toxicidad subaguda en parámetros hematológicos, bioquímicos e histológicos en ratas. En la prueba de toxicidad aguda, el extracto de M. oleifera no causó la muerte en animales, incluso a dosis de 2000 mg/kg. Los tratamientos orales en ratas con este extracto a 400, 800 y 1600 mg/kg causaron cambios significativos en los niveles de proteínas totales, enzimas hepáticas, y bilirrubina, pero no se observaron cambios significativos en todos los órganos examinados[10].
Las células de los meristemos apicales de cebolla muestran fácilmente un amplio rango de alteraciones citológicas, lo que constituye el trabajo con raíces de esa especie vegetal en material biológico sensible para detectar sustancias potencialmente peligrosas tanto para la salud humana como para el medio ambiente en general[11]. Se han reportado estudios en los que se han evaluado los efectos citotóxicos del algunos extractos utilizados para fines terapéuticos, como el de Crecentia cujete[12] y Maytenus laevis[13], en los cuales se evidencian efectos citotóxicos y genotóxicos luego de 24 hs de exposición, incluso también en extractos comerciales como el de Croton lechleri[14].
El presente trabajo tiene como objetivo evaluar la genotoxicidad de los extractos acuosos de las hojas de Moringa oleifera (Lam.) por medio del test de Allium cepa.
Materiales y métodos
Recolección de M. oleifera
M. oleifera fue recolectado en la Ciudad de Posadas a 27º 22' 19.6'' S, 55º 56' 00'' W, e identificado por medio de técnicas taxonómicas de rutina. El material de herbario (voucher) fue depositado en el Herbario del Departamento de Farmacia (MNESF) en el Laboratorio de Farmacobotánica "Dr. Aníbal Gumersindo Amat", de la Facultad de Ciencias Exactas, Químicas y Naturales, Universidad Nacional de Misiones.
Acondicionamiento del material vegetal
Los bulbos de A. cepa fueron adquiridos en el comercio local, se seleccionaron unidades de un tamaño homogéneo, de buen aspecto e integridad.
Las hojas de M. oleífera fueron limpiadas, y luego secadas a estufa a 45 °C por 48 hs. Posteriormente se trituraron en mortero manual, hasta obtener un tamaño de polvo homogéneo.
Preparación de extractos de M. oleifera
El método extractivo seleccionado fue la infusión, según Farmacopea Nacional Argentina 6ta Edición, colocando agua mineral baja en sodio hirviendo, en contacto con la cantidad necesaria de droga previamente molida, por el transcurso de 20 minutos. Posteriormente, se filtró y se lavó el residuo hasta completar el volumen necesario para cada experiencia[15].
Pretratamiento de bulbos
Los bulbos fueron despojados de sus catáfilas, mas externas, se raspó el disco inferior con cuidado de no dañar la zona meristemática, y fueron lavados con agua corriente durante 2 horas, para eliminar cualquier residuo que pudieran contener provenientes de la actividad comercial[16].
Test de A. cepa
El test de A. cepa fue realizado por duplicado, utilizando para todas las diluciones y los controles agua mineral baja en sodio. Fue dividido en dos ensayos (Etapa 1 y Etapa 2), donde en cada experiencia se seleccionaron 5 bulbos de A. cepa por cada concentración a ensayar (ensayando 3 concentraciones diferentes en cada experiencia), y 5 bulbos para el control (considerando un total de 20 bulbos por experiencia)[17].
Tanto para la Etapa 1 y la Etapa 2, los bulbos fueron colocados en agua mineral baja en sodio durante 24 horas, a temperatura ambiente, al resguardo de la luz, hasta que liberasen raicillas y estas alcanzaran una longitud promedio de 1 cm.
Para los ensayos se utilizó un dispositivo diseñado para el experimento (FIGURA 1) con recipientes de vidrio fijos donde apoyar los bulbos, sumergiendo los discos, provistos de un suministro de aire constante por medio de 2 aireadores impulsando el aire que fue distribuido por mangueras hacia cada uno de los recipientes.
Las distintas concentraciones probadas y el agua mineral baja en sodio fueron reemplazadas cada 24 hs. Los extractos de M. oleifera se prepararon al momento de ser utilizados por medio de infusiones, utilizando también agua mineral baja en sodio.

Etapa 1 y Etapa 2
Una vez transcurridas las 48 hs y emergidas las raicillas, se procedió a realizar la Etapa 1 primero. En esta instancia se probaron concentraciones de 50 g/L, 100 g/L y 200 g/L.
En Etapa 2 se probaron concentraciones de 25 g/L, 50 g/L y 100 g/L.
En todos los casos, los bulbos estuvieron en contacto con los extractos por 48 hs [17].
Obtención de biomarcadores de genotoxicidad
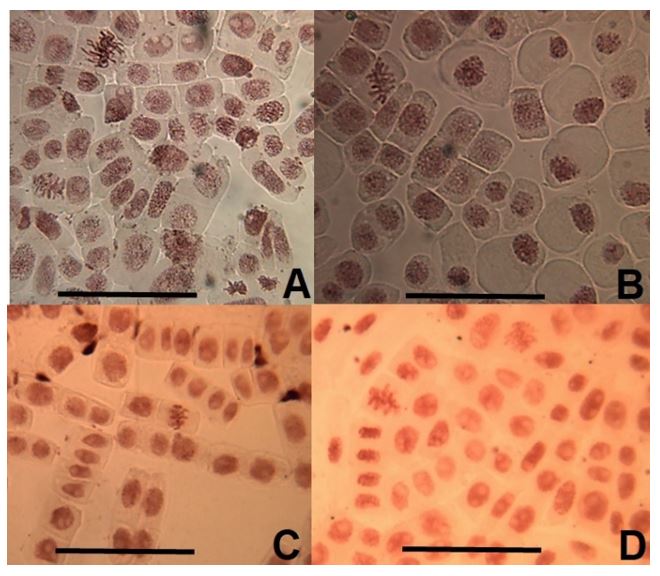
Para observar el estado de las mitosis en los meristemas de las raicillas de A. cepa expuesta a los extractos, se realizaron preparados histológicos in situ.
Para ello se cosecharon las raíces, que fueron fijadas en Farmer[18] por 24 hs en heladera a -3°C y luego se trasladaron a alcohol 70° donde se mantuvieron hasta el momento de realizar los preparados[16].
Bajo la lupa se seccionó la zona meristemática y se la colocó en un portaobjeto con orceína acética al 2% que fue llevado directo a la llama. Luego se colocó el cubreobjeto y se ejerció una leve presión sobre el preparado ("squash"). Posteriormente se observó en un microscopio óptico motic BA2000 y se tomaron fotografías con cámara Motic10 para su posterior análisis[17].
Índices mitóticos
Los índices mitóticos se calcularon como la relación entre las células en división y el total de células. Se contabilizaron un total de 2500 células por cada raicilla, tomando 2 raicillas por cada bulbo de cada uno de los 20 bulbos en total, utilizados para cada experiencia[17].
Análisis estadístico
El análisis estadístico fue realizado por medio de Statgraphic 6.0 y GraphPad Prism 6.0.
Resultados y discusión
Etapa 1 y determinación de la concentración 50
La Etapa 1 se realizó con la finalidad de obtener la concentración 50, que es la concentración de extracto necesaria para que el crecimiento en longitud de las raicillas de A. cepa, alcancen un 50% en comparación con las raicillas de los controles.
Los resultados obtenidos se representan en el GRAFICO 1. Las longitudes promedio obtenidas menores a 0,5 cm fueron descartadas del análisis.
Como puede observarse en el GRAFICO 1, se probaron las concentraciones de 50 g/L, 100 g/L y 200 g/L, resultando ser la concentración de 50 g/L la que logro mayor disminución del crecimiento de las raicillas. Se probaron concentraciones altas en esta instancia para obtener la curva de toxicidad, y determinar la concentración ideal, donde posteriormente buscar biomarcadores de genotoxicidad (en Etapa 2).
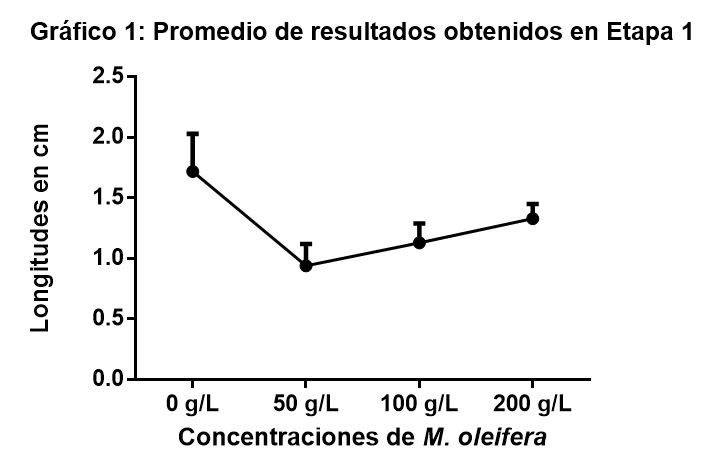
Con los resultados obtenidos en esta etapa, se procedió a diseñar la Etapa 2 considerando abarcar la concentración de 50 g/L, analizando los biomarcadores de genotoxicidad por encima y por debajo de esta concentración, considerando el comportamiento que presentó la curva en esta experiencia y siendo 50 g/L la concentración que mayor inhibición del crecimiento presento.
Etapa 2 y Evaluación de la Genotoxicidad de Extractos
En la Etapa 2 se probaron concentraciones de 25 g/L, 50 g/L y 100 g/L, y se analizaron las anomalías microscópicas (aberraciones cromosómicas) y los índices mitóticos, para cada una de las concentraciones estudiadas. Se contabilizaron un total de 2500 células por raíz, de cada bulbo de cada concentración analizada (FIGURA 2).
| Fuente | Suma de Cuadrados | Gl | Cuadrado Medio | Razón-F | Valor-P |
| Entre grupos | 199,804 | 3 | 66,6014 | 7,69 | 0,0021 |
| Intra grupos | 138,655 | 16 | 8,66592 | ||
| Total (Corr.) | 338,459 | 19 |
En la TABLA 1 se descompone la varianza del Índice Mitótico en dos componentes: un componente entre-grupos y un componente dentro-de-grupos. La razón-F, que en este caso es igual a 7,68544, es el cociente entre el estimado entre-grupos y el estimado dentro-de-grupos. Puesto que el valor-P de la prueba-F es menor que 0,05, existe una diferencia estadísticamente significativa entre la media del Índice Mitótico entre un nivel de Concentración y otro, con un nivel del 95,0% de confianza.
| Concentración | Casos | Media | Grupos Homogéneos |
| 100 | 5 | 10,44 | X |
| 50 | 5 | 13,68 | XX |
| 25 | 5 | 15,54 | X |
| 0 | 5 | 19,85 | X |
| Contraste | Sig. | Diferencia | +/- Límites |
| 0 - 25 | * | 4,112 | 3,94689 |
| 0 - 50 | * | 5,876 | 3,94689 |
| 0 - 100 | * | 8,718 | 3,94689 |
| 25 - 50 | 1,764 | 3,94689 | |
| 25 - 100 | * | 4,606 | 3,94689 |
| 50 - 100 | 2,842 | 3,94689 | |
| * indica una diferencia significativa. | |||
En las TABLAS 2 y 3 se aplica un procedimiento de comparación múltiple para determinar cuáles medias son significativamente diferentes de otras. En la TABLA 2 se han identificado 3 grupos homogéneos según la alineación de las X's en columnas. No existen diferencias estadísticamente significativas entre aquellos niveles que compartan una misma columna de X's. El método empleado es el de la diferencia mínima significativa (LSD) de Fisher donde existe un riesgo del 5,0% al decir que cada par de medias es significativamente diferente, cuando la diferencia real es igual a 0. En la TABLA 3 se muestran las diferencias estimadas entre cada par de medias, el asterisco que se encuentra al lado de los 4 pares indica que estos pares muestran diferencias estadísticamente significativas con un nivel del 95,0% de confianza.
| Concentraciones de extractos de M. oleifera | Longitudes promedio en cm (Etapa 1) | Índices Mitóticos en % (Etapa 2) | Aberraciones cromosómicas observadas (Etapa 2) |
| 0 g/L | 1,46 ± 0,36 | 19,85 ± 3,49 | No observadas. |
| 25 g/L | - | 15,54 ± 2,43 | No observadas. |
| 50 g/L | 0,85 ± 0,18 | 13,68 ± 2,89 | No observadas. |
| 100 g/L | 0,93 ± 0,18 | 10,44 ± 3,21 | No observadas. |
| 200 g/L | 1,15 ± 0,20 | - | No observadas. |
Los resultados obtenidos son similares a otros estudios[9,10].
Conclusiones
En la etapa 1 se observa que a medida que la concentración aumenta, también lo hace la longitud de las raíces, por lo que se considera la concentración más tóxica la de 50 g/L (la concentración que más inhibió el crecimiento de las raíces). En la etapa 2 las concentraciones más elevadas mostraron mayor inhibición de la mitosis (I. mitótico=15,54 %; 13,68 % y 10,44 % respectivamente) con respecto a los controles (I. mitótico =19,85 %), donde a mayores concentraciones la mayoría de las células meristemáticas en división permanecieron en interfase. Si bien los índices mitóticos disminuyeron en función del aumento de la concentración del extracto con una diferencia estadísticamente significativa entre la media del Índice Mitótico entre un nivel de Concentración y otro, con un nivel del 95,0% de confianza, no han sido encontrados micronúcleos, anafase puente, cromosomas rezagados ni otros tipos de biomarcadores de genotoxicidad, en los preparados realizados de las raicillas expuestas en las diferentes concentraciones de M. oleifera.
Aunque cabe destacar que las concentraciones que han sido utilizadas en el experimento, no son usuales de M. oleífera en la medicina tradicional.
Podríamos concluir en base a los resultados planteados en el presente estudio, que los extractos de las hojas de M. oleifera cuentan con un relativo grado de seguridad(19), por lo que serían necesarios futuras investigaciones en otros modelos biológicos, a los fines de determinar el grado de toxicidad y genotoxicidad de los extractos de las hojas de M. oleifera.
Referências
1. Ramachandran C, Peter KV, Gopalakrishnan PK. Drumstick (Moringa oleifera): a multipurpose Indian vegetable. Econ Bot. 1980; 34(3):276-283. [Link].
2. Fuglie LJ. The miracle tree; the multiple attributes of moringa (No. 634.97 M671). Technical Centre for Agricultural and Rural Co-operation, Wageningen (Países Bajos). 2001. [Link].
3. Anwar F, Latif S, Ashraf M, Gilani AH. Moringa oleifera: a food plant with multiple medicinal uses. Phytotherapy Research: An International Journal Devoted to Pharmacological and Toxicological Evaluation of Natural Product Derivatives. 2007; 21(1):17-25. [Pubmed] [CrossRef].
4. Caceres A, Cabrera O, Morales O, Mollinedo P, Mendia P. Pharmacological properties of Moringa oleifera. 1: Preliminary screening for antimicrobial activity. J Ethnopharmacol. 1991; 33(3):213-216. [Pubmed] [CrossRef].
5. Kar A, Choudhary BK, Bandyopadhyay NG. Comparative evaluation of hypoglycaemic activity of some Indian medicinal plants in alloxan diabetic rats. J Ethnopharmacol. 2003; 84(1): 105-108. [Pubmed] [CrossRef].
6. Mehta A, Agrawal B. Investigation into the mechanism of action of Moringa oleifera for its anti-asthmatic activity. Oriental Pharm Experim Med. 2008; 8(1):24-31. [CrossRef].
7. Ogbunugafor HA, Eneh FU, Ozumba AN, Igwo-Ezikpe MN, Okpuzor J, Igwilo IO et al. Physico-chemical and antioxidant properties of Moringa oleifera seed oil. Pakistan J Nutrition. 2011; 10(5):409-414. [Link].
8. Rolim LA, Macêdo MF, Sisenando HA, Napoleão TH, Felzenszwalb I, Aiub CA et al. (2011). Genotoxicity evaluation of Moringa oleifera seed extract and lectin. J Food Sci. 76(2):T53-T58. [Pubmed] [CrossRef]
9. Asare GA, Gyan B, Bugyei K, Adjei S, Mahama R, Addo P et al. Toxicity potentials of the nutraceutical Moringa oleifera at supra-supplementation levels. J ethnopharmacol. 2012; 139(1):265-272. [Pubmed] [CrossRef]
10. Adedapo AA, Mogbojuri OM, Emikpe BO. Safety evaluations of the aqueous extract of the leaves of Moringa oleifera in rats. J Med Plants Res. 2009; 3(8):586-591. [Pubmed] [Link].
11. Andrioli NB, Wulff AF, y Mudry MD. Allium cepa como monitor de toxicidad y genotoxicidad de metronidazol. Theoria. 2006; 15(2):9-16. [Link].
12. Espitia-Baena JE, del Rosario Duran-Sandoval H, Fandiño-Franky J, Díaz-Castillo F, Gómez-Estrada HA. Química y biología del extracto etanólico del epicarpio de Crescentia cujete L.(totumo). Rev Cubana Plant Medic. 2011; 16(4):337-346. [Link].
13. Freyre S, Estrada M, Bolaños H. Estudio preliminar de la citotoxicidad y la genotoxicidad de un extracto de origen vegetal conocido como palmo rosado en células meristemáticas de Allium cepa. Memorias. 2009; 5(12):12-17. ISSN 0124-4361. [Link].
14. Almeida FKVD, Novais VPD, Salvi JDO & Marson. Rev Fitos. Avaliação tóxica, citotóxica e mutagênica/genotóxica de um extrato comercial de sangue do dragão (Croton lechleri). 2019; 13(1):29-37. ISSN 2446-4775. [CrossRef].
15. Farmacopea Nacional Argentina (1978). 6ta ed. Buenos Aires.
16. Fiskesjo G. The Allium test in wastewater monitorin. Environmental Toxicology and Water Quality. 1993; 8 (3):291-298. [CrossRef].
17. Mudry MD, Carballo MA. Genética Toxicológica, De los Cuatro Vientos Editorial. Buenos Aires, Argentina. 2006. ISBN-987-564-563-X.
18. Zarlavsky GE. Histología Vegetal: Técnicas simples y complejas. Sociedad Argentina de Botánica, Buenos Aires. 2014; p.1-198.
19. Stohs SJ & Hartman MJ. Review of the safety and efficacy of Moringa oleifera. Phytoth Res. 2015; 29(6):796-804. [CrossRef].