Artigo Original
Espectrometria de Massas de Diterpenos do Tipo Clerodano Isolados de Croton cajucara
Mass Spectrometry of Clerodane-Type Diterpenes Isolated from Croton cajucara
Resumo
Neste trabalho utilizou-se espectrometria de massas objetivando-se a identificação de fragmentos característicos de diterpenos do tipo clerodano contendo carbonila α,β-insaturada no anel A do sistema decalínico. Para tanto, dados de espectrometria de massas foram analisados para os seguintes 19-nor-clerodanos de sistemas enona: trans-desidrocrotonina (1), trans-crotonina (2), cis-cajucarina B (3), trans-cajucarina B (4) e cajucarinolida (5) e para os clerodanos isosacacarina (6) e cajucarina A (7), isolados das cascas do caule de Croton cajucara Benth, bem como para clerodanos de sistemas enona isolados de outras espécies. A junção trans de clerodanos foi claramente correlacionada com a presença dos íons característico de m/z 95, 121 e 205; os sistemas de junção cis apresentaram íons característicos de m/z 122 e 124. A junção trans de 19-nor-clerodano foi correlacionada com a presença dos íons característico de m/z 161, 134 e 121.
- Unitermos:
- Croton cajucara.
- Espectrometria de Massas.
- Clerodano.
- 19-nor-Clerodano.
- Sistema Enona.
Abstract
The aim of this work was to identify characteristic fragments on mass spectrometra of both clerodane and 19-nor-clerodane-type diterpenes presenting and α,β-insaturated carbonyl moiety at ring A of the decalin-system. For that study, mass spectroscopy data were analysed for 19-nor-clerodanes [trans-dehydrocrotonin (1), trans-crotonin (2), cis-cajucarin B (3), trans-cajucarin B (4) and cajucarinolide (5)] and clerodanes [isosacacarin (6) and cajucarin A (7)] obtained from the stem bark of Croton cajucara Benth, and also clerodane-type from other species. The trans-junction of the enone-system clerodanes was clear correlated with the presence of the characteristic ions at m/z 95, 121 e 205. Meanwhile the characteristics ions at m/z 122 e 124 were correlated to cis-junction. The trans-junction of the enone-system 19-nor-clerodanes showed characteristics ions at m/z 161, 134 e 121.
- Keywords:
- Croton cajucara.
- Mass Spectroscopy.
- Enone-System Clerodane.
- Enone-System 19-nor-Clerodane.
Introdução
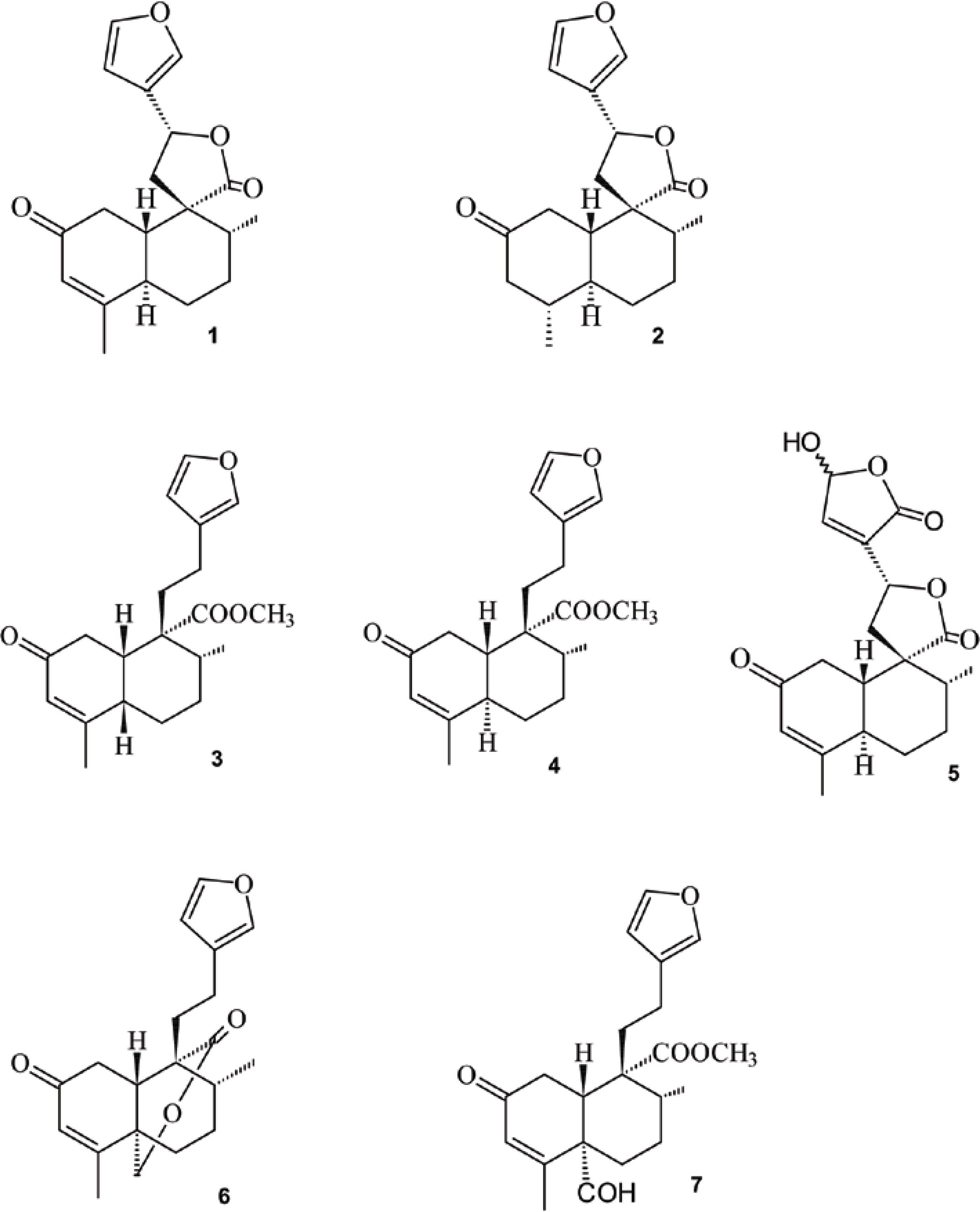
Croton cajucara Benth (Euphorbiaceae), vulgarmente conhecido por sacaca, representa na região Amazônica do Brasil, um recurso medicinal de grande importância no tratamento e cura de várias doenças (MACIEL et al., 2000; 2002a,b; 2005; 2006a,b). Dando continuidade aos estudos fitoquímicos desta espécie (MACIEL et al., 1998a,b; 2000; 2003a,b; 2007), o presente artigo relata os resultados obtidos dos espectros de massas de diterpenos do tipo 19-nor-clerodano [trans-desidrocrotonina (1), transcrotonina (2), cis-cajucarina B (3), trans-cajucarina B (4), cajucarinolida (5)] e clerodano [isosacacarina (6) e cajucarina A (7)], isolados das cascas do caule de Croton cajucara (Figura 1). Estes diterpenos (1-7) foram previamente isolados e caracterizados por RMN (MACIEL et al., 1998a,b; 2003; 2006b). O diterpeno 19-nor-clerodano trans-desidrocrotonina mostrou correlação significativa com as indicações terapêuticas de Croton cajucara (COSTA et al., 2007; MACIEL et al., 2000, 2002a,b; 2006a,b.). A importância medicinal desta planta desperta o interesse de vários grupos de pesquisadores em todo o país, com enfoque especial para a toxicidade e viabilização de um fitoterápico com esta espécie, assim como para a biodisponibilização da DCTN (COSTA et al, 2007; MACIEL et al., 2000; 2005; SILVA et al., 2005; SOARES, 2004; VEIGA JR et al., 2005.).
A maioria dos diterpenos do tipo clerodano apresenta junção A/B trans (5α, 10β) com configuração relativa cis para os substituintes das posições C-5, C-8 e C-9 (Figura 2). Os diterpenos com junção A/B cis (5α, 10α), na sua grande maioria, apresentam os substituintes das posições C-8 e C-9 β-orientados (MACIEL et al., 2006b). A (-)clerodina (8) (Figura 2), um neo-clerodano isolado de Clerodendron infortunatum, cuja estereoquímica absoluta é conhecida, foi o primeiro diterpeno descrito da série dos clerodanos, tendo generalizado o nome clerodano e suas configurações absolutas, que então são estabelecidas através da correlação química quiral com a (-)clerodina (MACIEL et al., 2006b). Os neo-clerodanos estão biogeneticamente relacionados com os ent-labdanos, nos quais a cadeia carbônica ligada ao C-9 está α-orientada, enquanto os ent-neo-clerodanos são relacionados aos labdanos da série normal, que são os de maior ocorrência no reino vegetal, onde a cadeia carbônica ligada ao carbono C-9, encontra-se β-orientada (RODRÍGUEZ et al., 1994).
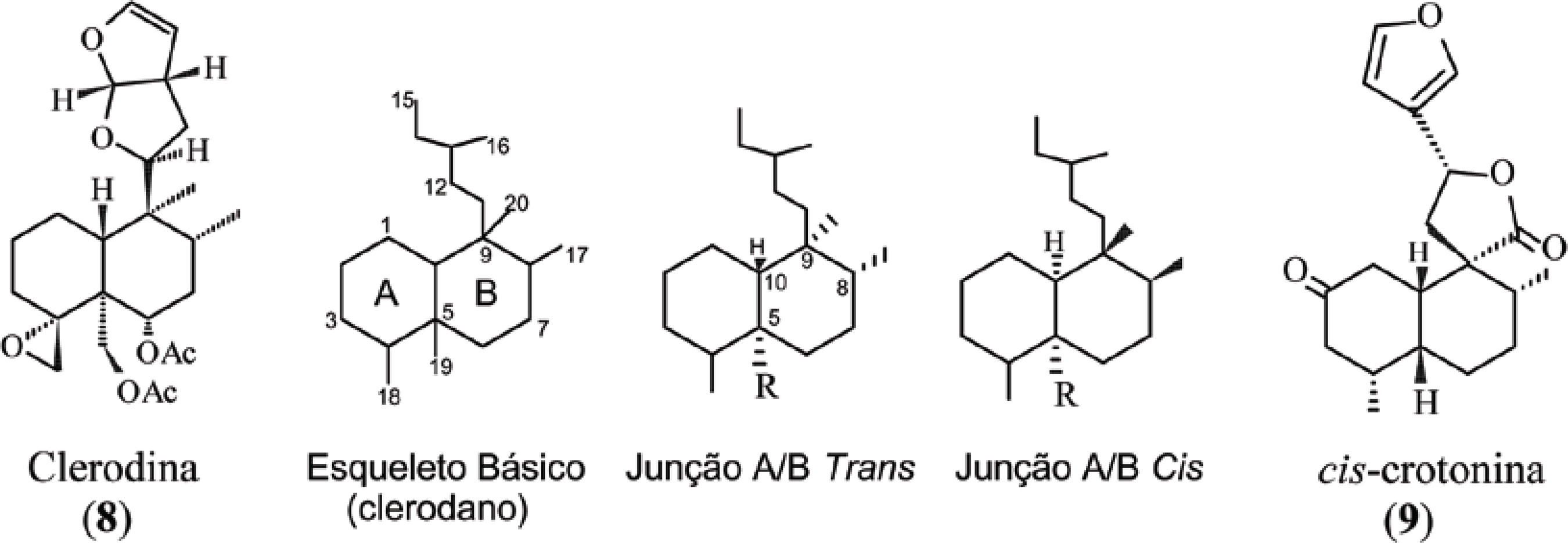
O emprego de prefixos indicando modificações no esqueleto em relação à estrutura básica é bastante comum, como por exemplo, ent, seco, nor. O prefixo ‘ent’ é usado para indicar inversão em todos os centros quirais; ‘seco’ evidencia quebra de alguma ligação do esqueleto anelar e ‘nor’ indica que o produto natural possui um carbono a menos em sua estrutura. Um nor-diterpeno possuirá 19 átomos de carbono e não 20, como seria de se esperar; daí, bisnor, trinor e tetranor indicam a perda de dois, três e quatro átomos de carbono, respectivamente (MACIEL et al., 2006b).
No presente trabalho, foram caracterizados fragmentos padrões para a identificação de clerodanos e 19-nor-clerodanos que apresentem no anel A do sistema decalínico uma enona (carbonila α,β-insaturada) na posição δ3,4, que foram isolados de Croton cajucara (Figura 2), ou de outras fontes vegetais (BARRETO JR. Et al., 2005).
Material e Métodos
As cascas do caule de Croton cajucara foram coletadas em Jacundá, Pará. A identificação botânica da planta foi feita por Nelson A. Rosa, do Museu Paraense Emílio Goeldi, tendo sido depositada uma exsicata no herbário deste Museu, sob código 247. O material vegetal foi seco em estufa a temperatura de 40 oC, e moído em moinho de facas do tipo Willey. O pó resultante foi extraído em aparelho Soxhlet, com hexano e depois metanol. As soluções foram concentradas em evaporador sob pressão reduzida dando origem aos extratos hexânicos e metanólicos. Estes extratos foram fracionados por cromatografia, utilizando-se como adsorvente gel de sílica 35-70 e/ou 70-230 Mesh (Merck) (MACIEL et al., 1998b). Os dados de espectros na região do infravermelho (IV) e ultravioleta (UV), bem como de Ressonância Magnética Nuclear de Hidrogênio (RMN-1H) e de Carbono-13 (RMN-13C) para os diterpenos 1-7 foram previamente reportados (MACIEL et al., 1998a,b; 2003). Os espectros de massas (EM) foram registrados em espectrômetro CG/EM Finnigan-4000 e VG Auto Spec Q-70eV.
O extrato hexânico (471,8 g) de 6 kg de cascas forneceu, após filtração em coluna aberta de gel de sílica (35-70 Mesh), as frações FA (eluída em hexano), FB (eluída em diclorometano) e FC (eluída em metanol). Em seguida, obteve-se deste material vegetal 202,0 g de extrato metanólico. A fração FB sofreu nova filtração em coluna aberta de gel de sílica (35-70 Mesh), eluída com hexano-CH2Cl2-MeOH em gradiente crescente de polaridade. Foram coletadas 53 frações, que sofreram monitoramento por cromatografia de camada fina (CCF) e produziram 6 grupos de frações (7-21; 22-25; 26-29; 30-33; 34-41 e 42-53). Da fração FB foram isoladas as substâncias 1 (37,2 g), 2 (0,151 g), 3 (0,064g) e 4 (0,308 g). A fração FC forneceu, após nova filtração em coluna de gel de sílica (70-230 Mesh), 32 frações. Estas, após monitoramento por CCF e reunião das frações similares, geraram 5 outras frações (2-3; 4-10; 11-18; 19-24 e 25-30). Desta fração (FC) foram isolados 1 (22,3 g), 5 (0,020g), 6 (0,029 g) e 7 (0,062 g). Por sua vez, o extrato metanólico forneceu 26,3 g de 1 e 0,072 g de 6 (MACIEL et al., 1998b). Os clerodanos 2, 3 e 4 foram isolados em pequenos percentuais, a partir das frações apolares do óleo fixo obtido das cascas do caule de Croton cajucara (SOUZA et al., 2006).
Resultados e Discussão
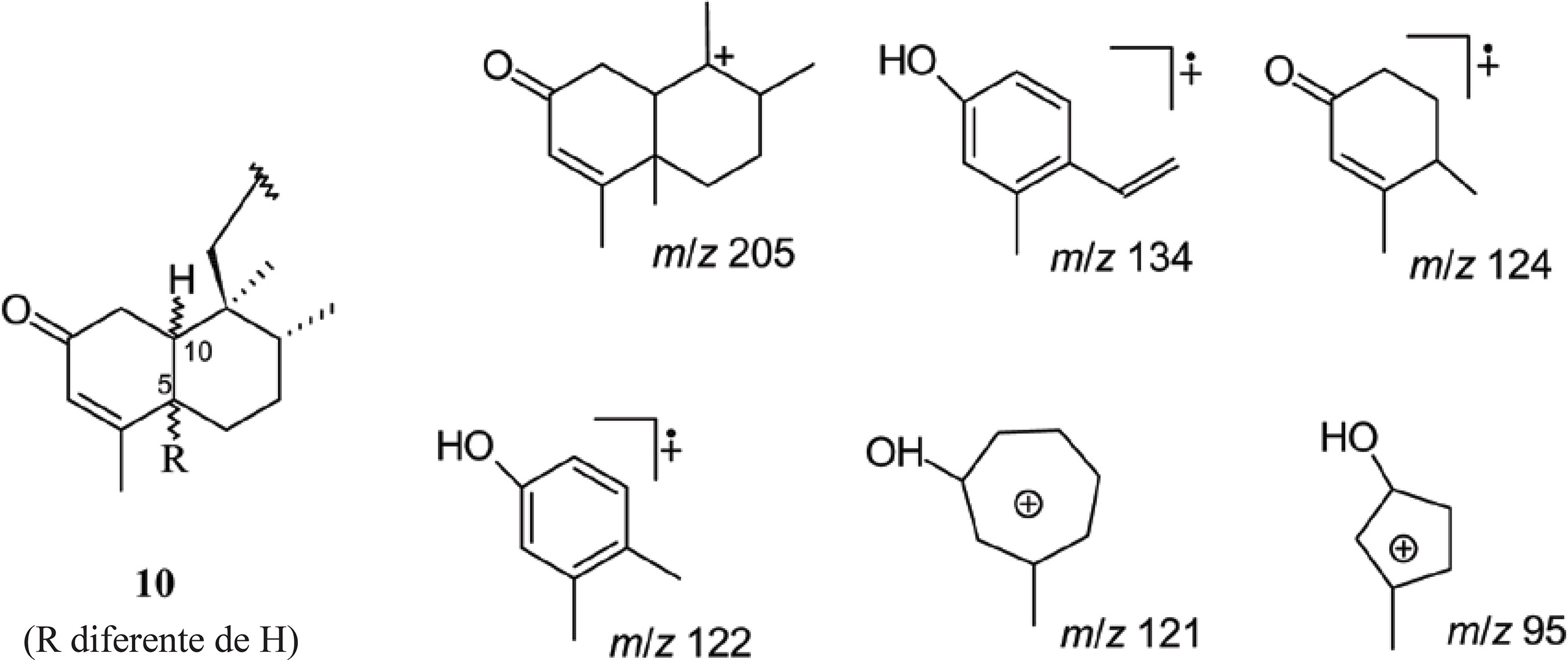
Inicialmente, foram avaliados os dados de íons provenientes de espectros de clerodanos reportados na literatura (AQUINO et al., 1992; ATHONSEN et al., 1973; AVILA et al., 1991; EL-BABILI et al., 1998; ETSE et al., 1989; FANG et al., 1988; FAZIO et al., 1992; HASAN, et al., 1982; KHAN et al., 1990; KIJJOA et al., 1990; LEITÃO et al., 1992; LOPES et al., 1987; MEDINA et al.,1992; MISRA et al.,1985; PINTO et al., 1994;URONES et al., 1989; dentre outros). Para tanto, tomou-se a subunidade decalínica do sistema enona (10) como padrão de referência, como representada no Esquema 1; onde o substituinte 19 (ligado à posição C-5) é obrigatoriamente diferente de hidrogênio (caracterizando, desta forma um clerodano ao invés de um 19-nor-clerodano). As análises dos dados de espectros de massas divulgados na literatura (referências citadas acima) possibilitaram o reconhecimento de padrões de fragmentações para clerodanos de sistema enona padrão deste tipo (10). Os fragmentos de íons m/z 95, 109, 121, 135 e 205 foram os mais encontrados. O fragmento de íon m/z 205 (resultante da quebra da cadeia linear) foi observado em todos os isômeros. Na ausência de substituintes nas posições 6 e 7, os fragmentos de íons m/z 109 e 121 foram os mais abundantes. Os fragmentos de íons m/z 122 e 124 provenientes de rearranjo, foram observados mais freqüentemente nos cis-clerodanos e apresentam abundância relativa mais alta do que os trans-clerodanos. Para os trans-clerodanos, os fragmentos de íon m/z 95, 109, 121 e 205 se destacam em todos os espectros analisados. O esquema da Figura 1 mostra uma proposta de fragmentações para os íons de m/z 205, 134, 124, 122, 121 e 95.
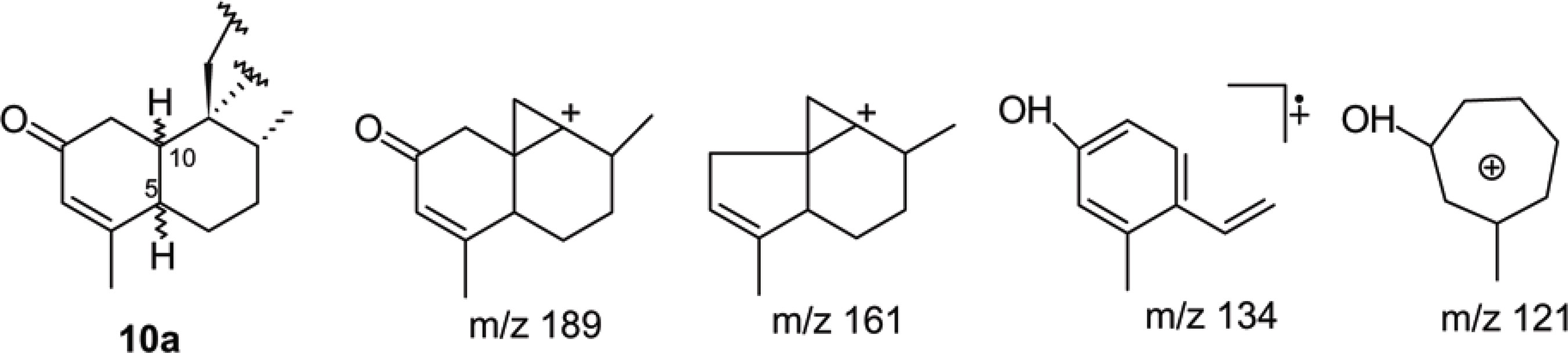
A subunidade decalínica padrão 10a (Figura 2) foi utilizada para o estudo de 19-nor-clerodanos (dentre eles: 1, 3, 4 e 5), tendo sido destacados os padrões de fragmentação de íons m/z 161, 134 e 121 (FiguraS 2 e 3). O isômero trans-cajucarina B (4) apresentou abundância relativa mais alta [m/z 161 (18%), 134 (95%) e 121 (100%)] do que o cis-cajucarina B (3) [m/z 161 (27%), 134 (61%) e 121 (81%)]. Os fragmentos padrões de íons m/z 161, 134 e 121 (característicos de 19-nor-clerodanos) também foram observados para o clerodano isosacacarina (6). No entanto, para este clerodano, que apresenta grupo CH2 na posição C-19, os fragmentos de íons m/z 162 (25%), 122 (57%), 94 (94%) e 82 (100%) foram os mais abundantes (Esquema 4). Em um estudo sintético Grossman e Rasne (2001) obtiveram a síntese total deste clerodano (que possui uma carbonila adicional na posição-C20), bem como do seu isômero sacacarina (carbonila adicional na posição-C19 e grupo CH2 na posição C-20).
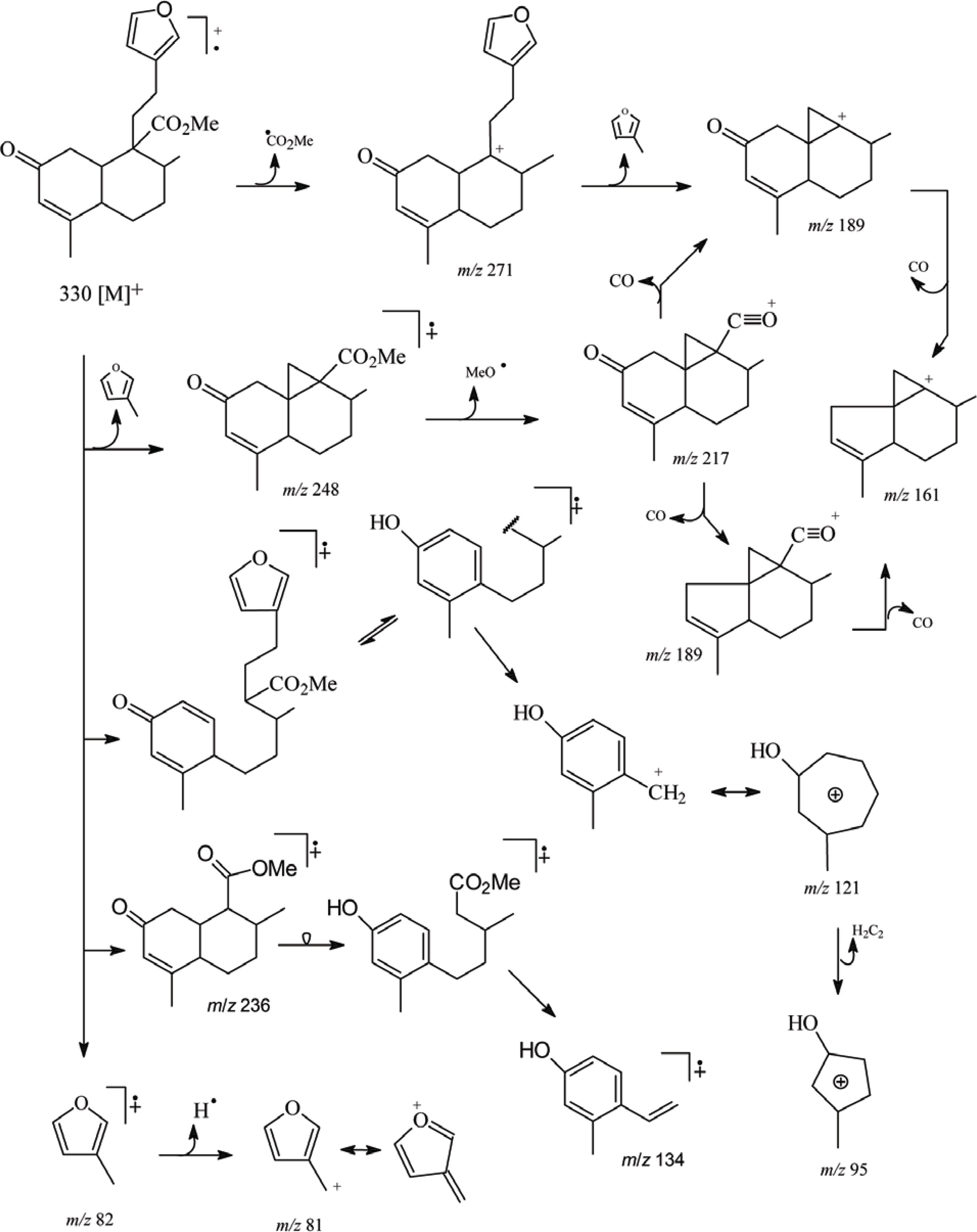
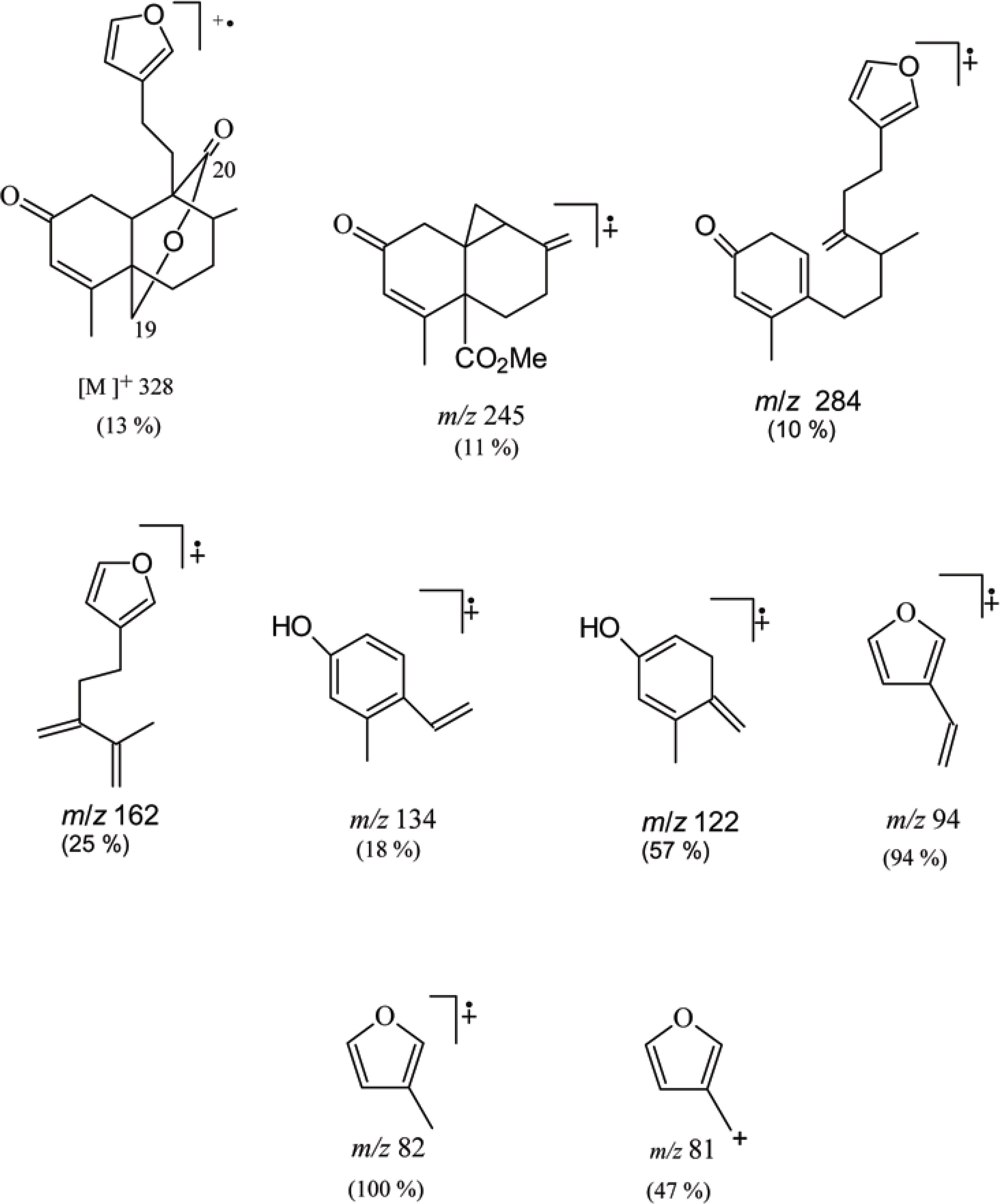
O 19-nor-clerodano trans-crotonina (2) apesar de não possuir a insaturação δ3,4 no anel A do sistema decalínico, apresentou os fragmentos padrões de íons de m/z 161 (38%), 134 (24%) e 121 (51%). No entanto, os fragmentos m/z 94 (100%) e 95 (78%) foram os mais abundantes. O isômero cis-crotonina (9) isolado do Croton lucidus L, também apresentou o fragmento m/z 94 como pico base (CHAN et al., 1968). De acordo com o esperado, para o clerodano trans-cajucarina A (7) que possui um grupo formila na posição C-5, os fragmentos de íons m/z 95 e 121 foram detectados. No entanto, as abundâncias relativas mais altas foram observadas para os fragmentos de íons m/z 330 (47%), 299 (33%), 269 (47%) e 248 (100%).
Conclusão
Utilizando-se dados de espectrometria de massas, foram caracterizados fragmentos padrões para a identificação de diterpenos do tipo clerodano e 19-nor-clerodano que apresentam carbonila α,βinsaturada na posição δ3,4 do anel A do sistema decalínico, tendo sido possível através de íons característicos, definir a junção dos anéis A e B deste sistema. Os fragmentos de rearranjo com íons m/z 122 e 124 são os mais abundantes em cis-clerodanos e, desta forma, permitem correlacioná-los com a estereoquímica dos centros quirais C-5 e C-10. A observação de fragmentos padrões poderá facilitar a identificação de subunidades decalínicas do tipo 10 (onde os fragmentos m/z 95, 121 e 205 são os mais abundantes) e 10a (onde os fragmentos m/z 161, 134 e 121 são os mais característicos). Através deste estudo pôde-se concluir ainda, que o uso de Cromatografia Gasosa de Alta Resolução acoplada à Espectrometria de Massas (CGAR-EM) torna-se uma ferramenta importante na análise de misturas complexas de extratos provenientes de fontes naturais (vegetais ou marinhas) ricas em diterpenos do tipo clerodano. Desta forma, o trabalho exaustivo de isolamento, purificação, identificação, caracterização e definição da configuração relativa dos centros quirais C-5 e C-10 de substâncias clerodânicas com decalina contendo um sistema enona do tipo 10 e 10a, pode ser economizado, senão evitado.
Agradecimentos
Os autores agradecem ao Programa Prodoc/CAPES.
Referências
AQUINO, R.; CIAVATTA, M.L.; TOMMASI, N.; GÀCSBAITZ, E. Tetranorditerpenes from Detarium microcarpum. Phytrochemistry, v.31, n.5, p.1823-1825, 1992.
ANTHONSEN, T.; HENDERSON. M.S.; MARTIN, A.; MURRAY, R.D.H.; McCRINDLE, R.; McMASTER, D. Constituents of Solidago Species. IV, Solodagoic Acid A and B, Diteperpenoids from Solidago gigantea var. Serotina. Canadian Journal of Chemistry, v.51, n.9, p.1332-1345, 1973.
AVILA, D.; MEDINA, J.D. A cis-clerodane diterpenic acid from Eperua purpurea. Phytochemistry, v.30, n.10, p.3474-3475, 1991.
BARRETO JR., A. G.; VEIGA JR., V.F.; MACIEL, M.A.M.; BISCAIA JR.; E.C.; PINTO, A.C.; CARVALHARES, S.F. Cromatografia de troca-iônica aplicada ao isolamento da fração ácida do óleo de copaíba (Copaifera multijuga) e da Sacaca. Química Nova, v.28, n.4, p.719-722, 2005.
CHAN, W.R.; TAYLOR, D.R.; WILLIS, C.R. Terpenoids from the Euphorbiaceae. Part I. The structure of crotonin, a norditerpene from Crotom lucidus L. Journal of the Chemical Society C, v.22, p. 2781-2785, 1968.
COSTA, M.P.; SANTOS-MAGALHÃES, N.S.; GOMES, F.S.; MACIEL, M.A.M. Uma revisão das atividades biológicas da trans-desidrocrotonina, um produto natural obtido de Croton cajucara. Revista Brasileira de Farmacognosia, v.17, n.2, p.141-148, 2007.
EL-BABILI, F.; MOULIS, C.; BON, M.; RESPAUD, M.J.; FOURASTÉ, I. Three furano-diterpenes from the bark of Croton campestris. Phytochemistry, v.48, n.1, p.165-169, 1998.
ETSE, J.T.; GRAY, A.I.; THOMAS, D.W.; WATERMAN, P.G. Terpenoid and alkaloid compounds from the seeds of Monodora brevipes. Phytochemistry, v.28, n.9, p. 2489-2492, 1989.
FANG, N., YU, S.; MABRY, T.J.; ABBOUT, K.A.; SIMONSEN, S.H. Terpenoids from Ageratina saltillensis. Phytochemistry, v.27, n.10, p.3187-3196, 1988.
FAZIO, C.; PASSANNANTI, S.; PATERNOSTRO, M.P.; PIOZZI, F. Neo-clerodane diterpenoids from Stachys rosea. Phytochemistry, v.31, n.9, p.3147-3149, 1992.
GROSSMAN, R.B.; RASNE, R.M. Short Total synthesis of both the putative and cctual structures of the clerodane diterpenoid (±)-sacacarin by double annulation. Organic Letters, v.3, n.25, p.4027-4030, 2001.
HASAN, C.M.; HEALEY, T.M.; WATERMAN, P.G. Kolavane and kaurane diterpenes from the stem bark of Xylopia aethiopica. Phytochemistry, v.21, n.6, p.1365-1368, 1982.
KHAN, M.R.; GRAY, A.I.; SADLER, I.H.; WATERMAN, P.G. Clerodane diterpenes from Casearia corymbosa stem bark. Phytochemistry, v.46, n.11, p.3591-3595,1990.
KIJJOA, A.; PINTO, M.M.M.; PINHO, P.M.M.; TANTISEWIE, B.; HERZ, W. Clerodane derivatives from Polyalthia viridis. Phytochemistry, v.29, n.22, p.653-655, 1990.
LEITÃO, G.G.; KAPLAN, A.C.; GALEFFI, C. Epi-populifolic acid from Aristolochia cymbifera. Phytochemistry, v.31, n.3, p.3277-3279, 1992.
LOPES, L.M.X.; BOLZANI, V.S.B.; TREVISAN, L.M.V. Clerodane diterpenes from Aristolochia species. Phytochemistry v.26, n.10, p.2781-2784, 1987.
MACIEL, M.A.M.; PINTO, A.C.; BRABO, S.N.; ARRUDA, A.C. Estudo da variação dos teores de terpenóides bioativos isolados das cascas do caule de Croton cajucara, nativos e cultivados no estado do Pará. Revista da Universidade Rural, Série Ciências Exatas e da Terra, v.18/20, n.1/2, p.17-34, 1998a.
MACIEL, M.A.M.; PINTO, A.C.; BRABO, S.N.; SILVA, M.N. Terpenoids from Croton cajucara. Phytochemistry, v.49, n.3, p.823-828, 1998b.
MACIEL, M.A.M.; PINTO, A.C.; ARRUDA, A.C.; PAMPLONA, S.G.S.R.; VANDERLINE, F.A.; LAPA, A.J.; ECHEVARRIA, A.; GRYNBERG, N.F.; CÔLUS, I.M.S.; FARIAS, R.A.F.; LUNA-COSTA, A.M.; RAO, V.S.N. Ethnopharmacology, phytochemistry and pharmacology: a successful combination in the study of Croton cajucara. Journal of Ethnopharmacology, v.70, n.1, p.41-55, 2000.
MACIEL, M.A.M.; PINTO, A.C.; VEIGA JR., V.F.; MARTINS, J.R.; GRYNBERG, N.F.; ECHEVARRIA, A.; LAPA, A.J.; VANDERLINDE, F.A. Croton cajucara as an alternative to traditional medicine in a modern health system. In: Phytochemistry and Pharmacology II, Series Recent Progress in Medicinal Plants, v.8, p.502-517, 2002a.
MACIEL, M.A.M.; PINTO, A.C.; VEIGA JR., V.F.; ECHEVARRIA, A.; GRYNBERG, N.F. Plantas Medicinais: a necessidade de estudos multidisciplinares. Química Nova, v.25, n.3, p.429-438, 2002b.
MACIEL, M.A.M.; PINTO, A.C.; KAISER, C.R. NMR and structure review of some natural fluroclerodanes. Magnetic Resonance in Chemistry, v.41, n.4, p.278-282, 2003a.
MACIEL, M.A.M.; DANTAS, T.N.C.; PINTO, A.C.; ESTEVES-SOUZA, A.; GRYNBERG, N.F.; PISSINATI, K.; ECHEVARRIA, A. Cytotoxic effects of natural and semi-syntetic cajucarinolides from Croton cajucara. Revista Brasileira de Ciências Farmacêuticas, v.39, p.212, 2003b.
MACIEL, M.A.M.; DANTAS, T.N.C.; PINTO, A.C.; VEIGA JR., V.F.; GRYMBERG, N.F.; ECHEVARRIA, A. Medicinal Plants: the need for multidisciplinary scientific studies. Part II. Current Topics in Phytochemictry, v.7, p.73-88, 2005.
MACIEL, M.A.M.; DANTAS, T.N.C.; CÂMARA, J.K.P.; PINTO, A.C.; VEIGA JR., V.F.; KAISER, C.R.; PEREIRA, N.A.; CARNEIRO, C.M.T.S.; VANDERLINDE, F.A.; LAPA A.J.; AGNER, A.R.; CÓLLUS, I.M.S.; ECHEVARRIALIMA, J.; GRYNBERG, N.F.; ESTEVES-SOUZA, A.; PISSINATE, K.; ECHEVARRIA A. Pharmacological and biochemical profiling of lead compounds from traditional remedies: the case of Croton cajucara. In: Advances in Phytomedicine (Lead molecules from natural products, Discovery and New Trends), Eds. Khan, M.T.H.; Ather, A., v.2, chapter 14, p.229-257, 2006a.
MACIEL, M.A.M.; CORTEZ, J.K.P.C.; GOMES, F.E.S. O Gênero Croton e Aspectos Relevantes de Diterpenos Clerodanos. Revista Fitos, v.2, n.3, p.54-73, 2006b.
MACIEL, M.A.M.; MARTINS, J.R.; PINTO, A.C.; KAISER, C.R.; ESTEVES-SOUZA, A.; ECHEVARRIA, A. Natural and semi-synthetic clerodanes of Croton cajucara and their cytotoxic effects against Ehrlich carcinoma and human k562 leukemia cells. Journal of the Brazilian Chememical Society, v.18, n.1, p.391-396, 2007.
MEDINA, J.D.; AVILA, D.; DEEMING, A. New clerodane-type diterpenoid from Eperua leucantha. Journal of Natural Products, v.55, n.7, p.845-850, 1992.
MISRA, L.N.; JAKUPOVIC, J.; BOHLMANN, F. Isodaucane derivatives, norsesquiterpenes and clerodanes from Chromolaena laevigata. Tetrahedron, v.41, n.22, p.5353-5356, 1985.
PINTO, A.C.; GARCEZ, W.S.; QUEIROZ, P.P.S.; FIORANI, N.G. Clerodanes and tetranorclerodane from Vellozia bicolor. Phytochemistry, v.37, n.4, p.1115-1117, 1994.
RODRÍGUEZ, B.; DE LA TORRE, M.C.; PERALES, A.; MALAKOV, P.J.; PAPANOV, G.Y.; SIMMONDS, M.S.J.; BLANEY, W.M. Oxirane-opening reactions of some 6,19-oxygenated 4α,18-epoxy-neo-clerodanes isolated from Teucrium. Biogenesis and antifeedant activity of their derivatives. Tetrahedron, v.50, n.18, p.5451-5468, 1994.
SILVA, R.M.; OLIVEIRA, F.A.; CUNHA, K.M.A.; MAIA, J.L.; MACIEL, M.A.M.; PINTO, A.C.; NASCIMENTO, N.R.F.; SANTOS, F.A.; RAO, V.S.N. Cardiovascular effects of trans-dehydrocrotonin, a diterpene from Croton cajucara in rats. Vascular Pharmacology, v.43, p.11-18, 2005.
SOARES, M.P. Would sacaca, Croton cajucara Benth. (Euphorbiaceae) be an hepatotoxic plant like Germander, Teucrium chamaedrys L. (Labiatae)? Revista da Sociedade Brasileira de Medicina Tropical, v.37, n.2, p.96-97, 2004.
SOUZA, M.A.A.; SOUZA, S.R.; VEIGA JR.V.F.; CORTEZ, J.K.P.C.; LEAL, R.S.; DANTAS, T.N.C.; MACIEL, M.A.M. Composição química do óleo fixo de Croton cajucara e determinação das suas propriedades fungicidas. Brazilian Journal of Pharmacognosy, v.16(supl.), p.599-610, 2006.
URONES, J.G.; MARCOS, I.S.; CUBILLO, L.; MONJE, V.A.; HERNÁNDEZ, J.M.; BASABE, P.Derivatives of malonic acid in Parentucellia latifolia. Phytrochemistry, v.28, n.2, p.651-653, 1989.
VEIGA JR.V.F.; PINTO, A.C.; MACIEL, M.A.M. Plantas Medicinais: cura segura? Química Nova, v.28, n.3, p.519-528, 2005.