Revisão
Composição química, atividade biológica e segurança de uso de plantas do gênero Mikania
Chemical composition, biological activity and safety of use of plants from genus Mikania
Resumo
Mikania, guaco é utilizado popularmente há muitos anos, devido às propriedades medicinais atribuídas às folhas, incluindo a ação tônica, depurativa, antipirética e broncodilatora, além de estimulante do apetite e antigripal. Também é empregado no tratamento de doenças respiratórias como asma e bronquite, na forma de xaropes para tosse. Várias dessas ações benéficas à saúde foram comprovadas cientificamente. Estudos foram publicados sobre a ação direta do guaco causando broncodilatação e relaxamento da musculatura lisa respiratória, o que pode estar relacionado ao bloqueio dos canais de cálcio, acompanhado de ações anti-inflamatória e antialérgica, sendo estas benéficas ao tratamento da asma, problema caracterizado por obstrução e inflamação das vias aéreas. Conforme indicações da ANVISA recomenda-se o uso do guaco sob as formas de tintura e extrato, sendo a cumarina o marcador de escolha no controle de qualidade da matéria prima e de produtos fitoterápicos contendo essa droga vegetal. Nesse trabalho, apresenta-se uma revisão sobre plantas do gênero Mikania, incluindo a farmacobotânica, a composição química, atividades biológicas e farmacológicas, interações medicamentosas, toxicidade e controle de qualidade.
- Palavras-chave:
- Gênero Mikania.
- Guaco.
- Composição química.
- Atividade.
- Controle de qualidade.
Abstract
Mikania, guaco has been popularly used for many years because its medicinal properties, attributed to leaves, including tonic, depurative, antipyretic and bronchodilatory actions, as well as appetite stimulant and anti-influenza. It is also used in the treatment of respiratory diseases such as asthma and bronchitis, in the form of cough syrups. Several of these health benefits have been scientifically proven. Studies have been published about the action of guaco causing bronchodilation and relaxation of the respiratory smooth muscle, which may be related to calcium channel blockade, accompanied by anti-inflammatory and anti-allergic actions, which are beneficial to the treatment of asthma, a problem characterized by obstruction and inflammation of the airways. According to ANVISA indications it is recommended to use as tincture and extract forms. Coumarin is the marker of choice in the quality control of the raw material and phytotherapeutic products containing this plant. In this work, a review is presented on plants of the genus Mikania, including pharmacobotanical, chemical composition, biological and pharmacological activities, drug interactions, toxicity and quality control.
- Keywords:
- Genus Mikania.
- Guaco.
- Chemical composition.
- Activity.
- Quality control.
Introdução
As plantas medicinais vêm sendo utilizadas há muito tempo, na tentativa de se descobrir novos princípios ativos para o tratamento de doenças[1]. A fitoterapia foi um dos primeiros recursos terapêuticos utilizados pelos povos, além de ser por muito tempo a única terapia disponível ao homem. Em algumas ocasiões, as plantas curavam, em outras matavam ou produziam graves efeitos colaterais, sendo, portanto, essencial o uso responsável, racional, seguro e não abusivo das mesmas[1].
A ANVISA[2] dispõe sobre o registro de medicamentos fitoterápicos e o registro e a notificação de produtos tradicionais fitoterápicos, definindo um fitoterápico como:
Produto obtido de matéria prima ativa vegetal, exceto substâncias isoladas, com finalidade profilática, curativa ou paliativa, incluindo medicamento fitoterápico e produto tradicional fitoterápico, podendo ser simples quando o ativo é proveniente de uma única espécie vegetal medicinal, ou composto, quando o ativo é proveniente de mais de uma espécie vegetal.
Não podem ser registrados como fitoterápicos aqueles medicamentos que contenham substâncias ativas isoladas na sua composição, de qualquer origem, nem as associações destas com extratos vegetais[3-6]. Os medicamentos fitoterápicos devem ser obtidos com emprego exclusivo de matérias-primas ativas vegetais, cuja segurança e eficácia estejam baseadas e evidenciadas em estudos clínicos e que sejam caracterizados pela constância de sua qualidade[2,7].
O comércio de plantas medicinais opera com várias espécies nativas brasileiras como, por exemplo, a Mikania glomerata Sprengel[8]. Entre as diversas plantas na Lista de Medicamentos Fitoterápicos de Registro Simplificado, publicada pela ANVISA [4], e entre as incluídas nas edições da Farmacopeia, está a Mikania glomerata, popularmente conhecida como guaco[3,9]. Essa espécie é tão importante que foi incluída já na primeira edição da Farmacopeia Brasileira, em 1929[10]. Além disso, na RDC 10, de 10 de março de 2010, a ANVISA publicou medidas, esclarecendo quando e como as plantas medicinais devem ser utilizadas, garantindo os efeitos benéficos e evitando que o uso incorreto possa causar efeitos indesejáveis e toxicidade[1,11]. O guaco está incluído nessas normas atualizadas[2].
O guaco também conhecido como erva-de-serpentes, cipó-catinga ou erva-de-cobra, é uma trepadeira volúvel, glabra. Folhas simples, opostas, ovadas e oblongo-lanceoladas, de base obtusa e ápice agudo, de até 15 cm de comprimento e 7 cm de largura, com três nervuras bem evidentes, pecioladas, carnoso-coriáceas, verde-brilhantes na face superior, mais pálidas na inferior. Flores hemafroditas, reunidas em número de quatro capítulos, iguais entre si, de papus branco e corola tubulosa, de cor branco-creme; capítulos agrupados em ramos espiciformes congestos, ou em glomérulos. Fruto tipo aquênio, glabro[12,13]. Sua composição química é constituída de sesquiterpenos e diterpenos, estigmasterol, flavonoides, cumarinas, resinas, taninos, saponinas, guacosídeos e ácido clorogênico[1,14-16], sendo seu marcador químico a cumarina[16,17]. É uma planta medicinal utilizada contra gripe, rouquidão, infecção na garganta, tosse, bronquite. Pertence a família dasCompositae e tem sua distribuição como espécie nativa do sudeste ao sul do Brasil, de São Paulo ao Rio Grande do Sul. O uso do guaco como planta medicinal é muito antigo. Em 1870, chegou a ser criado um produto preparado com hastes e folhas da planta - era o Opodeldo de Guaco - que durante décadas foi considerado um "santo remédio" contra bronquite, tosse e reumatismo. O guaco também sempre foi muito conhecido pelos índios brasileiros, que usavam a planta para combater o veneno das serpentes (daí vem alguns dos seus nomes populares). Ainda hoje, em algumas regiões do Brasil, o macerado das folhas é aplicado em forma de cataplasma sobre picadas de cobras e outros animais peçonhentos. Existe também a tradição de usar a planta fresca e nova (cujas folhas emanam um aroma intenso e agradável) para manter as cobras afastadas[1].
Atividades farmacológicas como hipoglicemiante, antidiarréica, anti-Trypanosoma cruzi, antioxidante, alelopática, anticonvulsivante e antimalárica também são descritas na literatura para plantas do gênero Mikania[18-23]. Popularmente, o guaco continua sendo usado para tratar reumatismo, infecções intestinais e cicatrizar ferimentos[17,24].
A proposta deste trabalho foi realizar uma revisão sobre plantas do gênero Mikania, especialmente o guaco, apresentando algumas das suas caraterísticas, bem como o controle de qualidade da planta.
Materiais e Métodos
Foi realizada uma revisão sistemática, consistindo em uma pesquisa por diversas bases de dados como Medline (PubMed), ScienceDirect, Scopus, Lilacs, Scielo, Google Scholar e Periódicos Capes sem seleção prévia de datas para busca de todos os artigos disponíveis até julho de 2019. A pesquisa foi realizada usando as seguintes palavras-chave: "Mikania", "Mikania glomerata", "Mikania laevigata", "Guaco", "Composição química", "Controle de qualidade", "Farmacologia" e "Farmacobotânica". Também se utilizou a estratégia de combiná-las: "Mikania" e "Farmacologia" ou "Mikania" "e" "toxicologia", ou "Mikania" "e" Farmacobotânica" ou "Mikania" "e" "Composição química", ou "Mikania" "e" "Controle de qualidade", "Guaco" e "Farmacologia" ou "Guaco" "e" "Toxicologia", ou "Guaco" "e" Farmacobotânica" ou "Guaco" "e" "Composição química", ou "Guaco" "e" "Controle de qualidade". Somente artigos científicos publicados em periódicos, resumos de conferências, dissertações e teses foram selecionados. Este trabalho está organizado em cinco seções, que abordam as características farmacobotânicas, a composição química, atividade biológica, atividade toxicológica e o controle de qualidade da planta, através de resultados de experimentos in vitro e in vivo e estudos clínicos[25,26].
O gênero Mikania
O grupo mais numeroso dentro das Angiospermas é a família Asteraceae, que compreende cerca de 1100 gêneros e 25000 espécies. É constituída por plantas com características variadas, incluindo geralmente pequenas ervas ou arbustos e raramente árvores[27]. Aproximadamente 98% dos gêneros são compostos por plantas de pequeno porte que são encontradas em todos os tipos de habitats, principalmente nas regiões tropicais montanhosas da América do Sul[28]. Na constituição desta família, a composição química torna-se mais importante do que a morfologia, devido à presença de várias classes de metabólitos secundários[1,29].
O gênero Mikania, pertencente à família Asteraceae e à tribo Eupatoriae, tem cerca de 430 espécies distribuídas principalmente na América do Sul. No Brasil, o gênero está representado por aproximadamente 171 espécies. A Mikania é um dos gêneros mais estáveis dessa tribo, embora as espécies sejam de difícil delimitação, devido a grande variabilidade morfológica que estas plantas apresentam[1]. Várias espécies do gênero Mikania de hábito trepador recebem a denominação vulgar de "guaco". Mikania laevigata Sch. Bip. ex Baker, conhecida como "guaco", "guaco-de-casa" e "guaco-do-mato", é uma espécie nativa do Brasil[30].
Rodrigues et al[30] coletaram 16 espécies de Mikania representando as cinco seções propostas por Barroso[31], totalizando 42 amostras, e dois indivíduos de Chromolaena maximilianii (Schrad.) R. M. King & Rob. como grupo externo. As árvores geradas pelos dois métodos foram combinadas pelo software TreeGraph 2 (FIGURA 1).
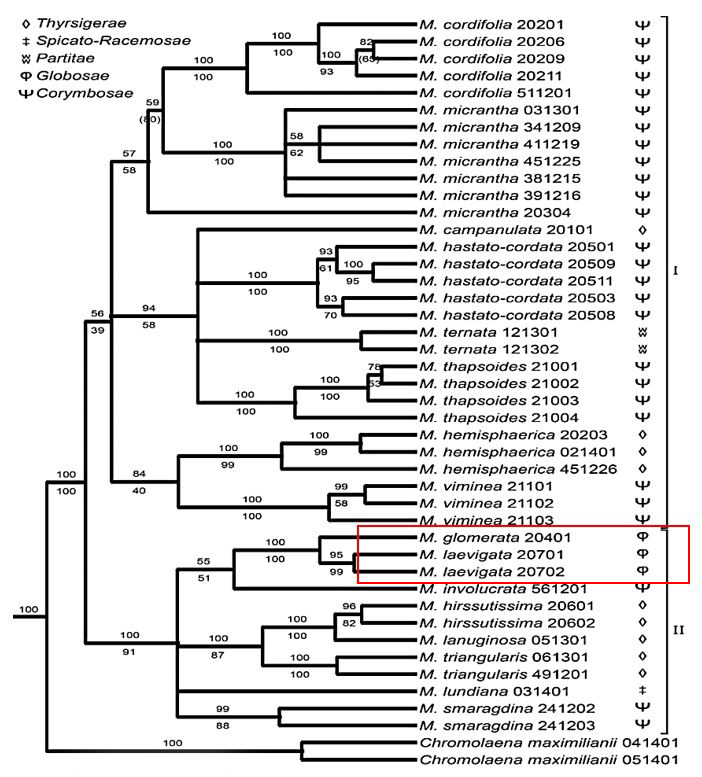
Neste estudo filogenético, Rodrigues et al.[30] observou que as espécies M. micrantha Kunth e M. cordifolia (L.f.) Willd. formam um grupo parafilético, uma vez que, M. micrantha Kunth não engloba todos os descendentes do ancestral comum. Entretanto, as espécies M. glomerata e M. laevigata assim como, M. hirsutissima DCe M. lanuginosa D.C são espécies irmãs com 100% de probabilidade posterior e 100% de bootstrap[32].
Dentre as espécies de Mikania Willdenow, pertencentes à secção Globosae Robinson destacam-se algumas de utilização medicinal, a saber, M. cordifolia (L.f.) Willd., Mikania scandens (L.) Willd., Mikania officcinalis Mart., Mikania opifera D.C., M. glomerata Sprengel e M. laevigata Sch. Bip. ex Baker[33,34]. As espécies mais utilizadas são a M. glomerata e a M. laevigata, conhecidas popularmente como guaco[8].
As espécies M. glomerata e M. laevigata, amplamente empregadas pela população, apresentam semelhanças morfoanatômicas, sendo comercializadas indistintamente[8,34].
A espécie Mikania glomerata Sprengel (guaco) foi oficializada como fitofármaco na primeira edição da Pharmacopeia dos Estados Unidos do Brasil[10] e reconhecidamente, apresenta propriedades biológicas e farmacológicas. A cumarina é uma das substâncias associadas a essas propriedades[34-37].
Farmacobotânica do guaco
A Mikania glomerata é um subarbusto silvestre, escandente, de folhagem densa e perene, com caule cilíndrico, ramificado e glabro. Quando seco, o caule apresenta fratura fibrosa e aspecto estriado no sentido longitudinal, enquanto que, estando jovem, apresenta coloração verde-claro passando a arroxeada e a cinzento-escura nas partes suberificadas. As folhas são pecioladas, cordiforme-deltoides, oval lanceoladas, tri ou pentanervadas e agudas no ápice. A FIGURA 2 mostra alguns aspectos da M. glomerata[30,37]. As flores são esbranquiçadas e carnosas, dispostas em inflorescência panícula tirsoide, com até 30 cm de comprimento, onde os capítulos se encontram reunidos em glomérulos (FIGURA 2). As bractéolas são lineares e apresentam medidas próximas a 2 mm de comprimento. O aquênio é pentangular, com aproximadamente 3 mm[38]. O guaco tem seu habitat nas margens dos rios, crescendo espontaneamente em matas primárias, capoeiras, capoeirões, orla de matas, terrenos de aluvião, várzeas sujeitas a inundações e possui boa adaptação ao cultivo doméstico. A planta é bastante procurada por abelhas melíferas durante a época da floração. Reproduz-se por sementes ou plantio de estacas do caule, preferencialmente em terrenos arenosos e úmidos[1,39,40].

A identificação das espécies de Mikania permanece um dilema, tendo em vista a grande diversidade fenotípica encontrada entre algumas espécies, principalmente em Mikania glomerata. Isso pode resultar em uso incorreto de espécies diversas de guaco como sendo aquela indicada na Farmacopeia Brasileira e aprovada atualmente pelos órgãos oficiais de saúde no Brasil[42 , 43].
As populações existentes de guaco na Mata Atlântica e nos cultivos domésticos apresentam ampla variabilidade fenotípica, principalmente nos aspectos morfológicos foliares (FIGURA 3) e também no rendimento de biomassa e conteúdo de cumarina[43-45].

Quanto aos teores de cumarina, o quimiótipo Q-MLF apresentou baixo teor deste ativo marcador da espécie, ao passo que amostras de M. glomerata Q-P obtidas no Banco de Germoplasma de Bioativas da Epagri - Estação Experimental de Itajaí revelaram a presença de altos níveis de cumarina nas folhas. É importante lembrar que a cumarina ocorre apenas em 20% das espécies de Mikania[46], e sua principal ocorrência acontece nas espécies M. micranta Kunth; M. laevigata Sch. Bip. ex Baker e M. glomerata Spreng.
Fitoquímica do o gênero Mikania
Diferentes classes de compostos foram isoladas a partir de várias partes de Mikania, podendo ser associados a atividades farmacológicas desta planta. Os principais grupos são: cumarinas e derivados, sesquiterpenos, lactonas sesquiterpênicas, diterpenos, fitoesteróis, terpenóides e flavonoides. Derivados de ácidos cafeoioquínicos, além de outros compostos, são encontrados em menor quantidade. Diterpenos como caurenóico e ácido benzoilgrandiflórico (da classe dos cauranos), também têm atraído o interesse por sua ação farmacológica. Além disso, outras substâncias foram encontradas em espécies de Mikania, como álcoois, ácidos, ésteres, aldeídos e ésteres orgânicos[1,14,47].
A classe mais característica dos compostos no gênero Mikania é a das cumarinas e seus derivados[48-50]. Existem quatro subtipos cumarínicos principais: os cumarinas simples, furanocumarinas, piranocumarinas e cumarinas substituídas por pirona. A cumarina (1,2-benzopirano) e o ácido o-cumárico foram identificados em extratos de M. glomerata[51] e M. laevigata[35]. Herz e Kulanthaivel[52] descobriram nas partes aéreas de M. congesta DC, proveniente do estado do Pará, alguns compostos semelhantes, tais como escopoletina e o-geranilescopoletina. Em M. shushunensis W.C.Holmes & McDaniel, coletada no Peru, foram encontradas a herniarina (7-metoxicumarina) e a 2,6-dimetoxiquinona (FIGURA 4).
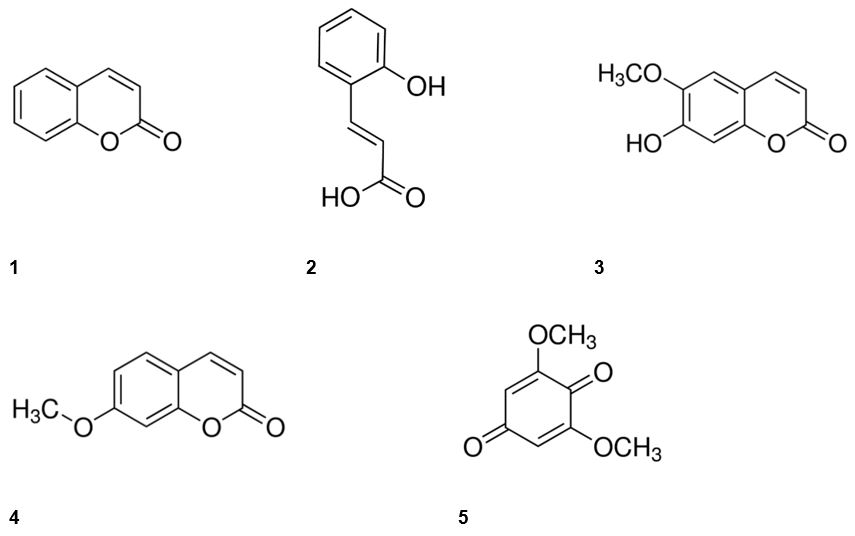
Já foram identificadas cerca de 1.300 cumarinas em fontes naturais, como vegetais, fungos e bactérias, sendo encontradas principalmente nas famílias Asteraceae, Fabaceae, Oleaceae, Moraceae, Thymeleaceae, Apiaceae e Rutaceae. No guaco, a cumarina é utilizada no controle de qualidade na produção dos extratos, devido ao aroma característico que concede às folhas[1,50].
A cumarina é frequentemente associada a atividade farmacológica. Uma grande variedade de atividades biológicas é atribuída a estes compostos, tais como antimicrobiana, antiviral, anti-inflamatória, antiespasmódica, antitumoral, anticoagulante, broncodilatadora e antioxidante[48 , 49].
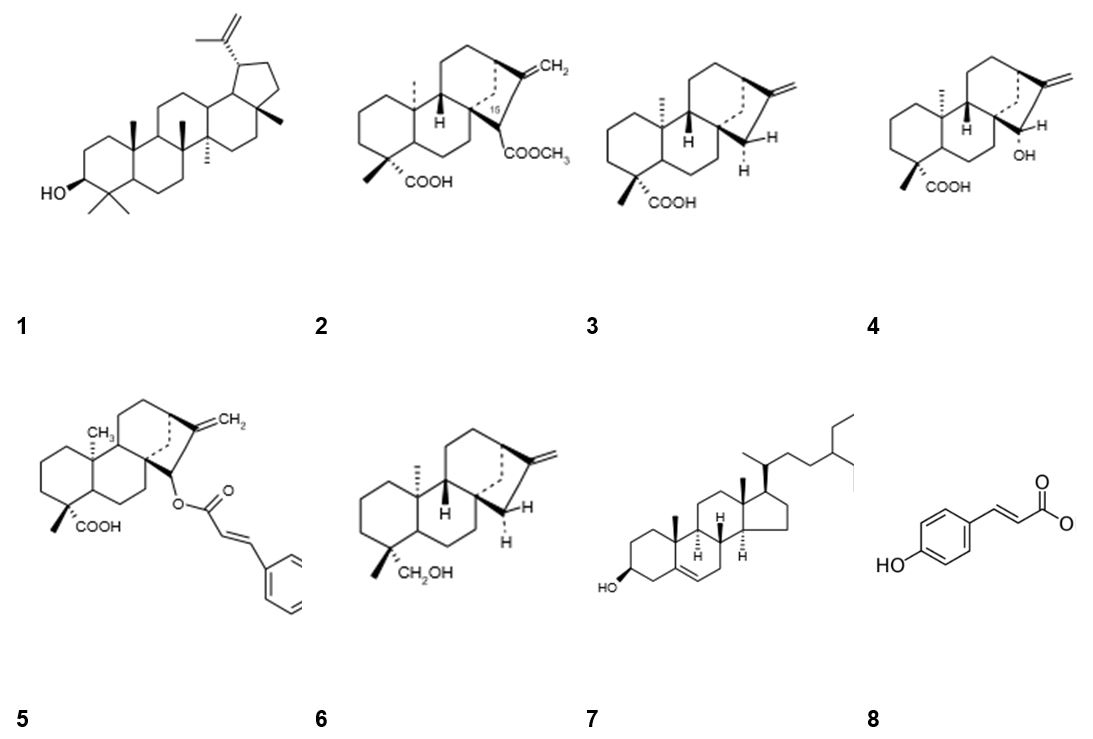
Os sesquiterpenos também são abundantes no gênero Mikania, sendo os mais frequentes o germacreno D, isocomeno e γ-humuleno. Estes compostos foram relatados em cerca de 20% das espécies de Mikania as quais possuem a sua composição química determinada, entre elas M. arrojadoi Mattf.[53], M. officinalis Mart, M. sessilifolia D.C, M. luetzelburgii Mattf e M. belemii R.M.King & H.Rob.[54]. Da mesma forma, terpenos, diterpenos e lactonas sesquiterpênicas são frequentemente encontradas, principalmente as dilactonas derivadas dos tipos mikanolida e miscandenina, que têm atividade analgésica[55], antibacteriana[56] e antitumoral[57]. Alguns diterpenos são comuns no gênero Mikania, como o ácido caurenóico, o principal componente de extrato etanólico de M. obtusata D.C[58] e M. glomerata[59], que é caracterizado pela sua atividade tripanocida. Também o ácido caurenóico tem outras atividades importantes, como antimicrobiana, antinociceptiva, anti-inflamatória e relaxante do músculo liso[14,47,60-62].
Em M. laevigata os principais representantes são o ácido cinamoilgrandiflórico, isopropiloxigrandiflórico, ácido isobutiloxigrandiflórico e kaurenol[35,63-66]. Além disso, em partes aéreas de M. oblongifolia D.Cforam encontrados terpenos do tipo cinamoilgrandiflórico além de outros[67]. Cruz e Roque[68] isolaram a partir de caules de M.triangularis, encontrados no Estado de São Paulo, um novo ácido diterpênico, metil-ent-7-α-hidroxipimara-8,15-dien-19-oato de etila e outros ácidos diterpênicos, metil-ent-pimara-9, 15-dien-19-oato de metila, metil-ent-pimara-8,15-dien-19-oato de metila, metil-8,9α-epoxi-ent-pimara-15-en-19-oato de metila, metil-7β-hidroxi-ent-pimara-8,15-dien-19-oato de etila e metil-7α-hidroxi-ent pimara-8,15-dien-19-oato de metila. Além disso, a fração acídica do extrato hexânico é composta por vários ácidos pimaradienos, que mostraram atividade antibacteriana[69]. Em um estudo realizado por Nunez et al.[70], nas folhas de Mikania sp. (nov.) encontradas no Estado da Bahia, foram encontrados vários diterpenos: metil éster do ácido l-8(17),12,14-trien-19-oico, metilester do ácido pimara-9(11),15-dien-19-oico, metil éster do ácido l-8(17),13(16),14-trien-19-oico, metil éster do ácido l-12α-epoxy-(17),14-dien-19-oico, metil éster do ácido l-12β-epoxy-8(17),14-dien-19-oico, ácido eritroxila-3,15-dien-19-oico, ácido l-12,15-epoxy-8(17),13-dien-19-oico e metil éster do ácido l-12,13-di-idroxi-8(17),14-dien-19-oico. A FIGURA 5 mostra alguns metabólitos secundários encontrados em M. glomerata[71].
Os fitoesteróis mais comuns estão presentes em aproximadamente 10% das espécies de Mikania, que possuem a sua composição química determinada, entre eles estigmasterol, lupeol e sitosterol. Estes compostos foram identificados nas partes aéreas e são encontrados nas espécies M. micrantha Kunth[72,73], M. glomerata Spreng.[74], M. cordata (Burm. f.) B.L.Rob[75,76], M. cordifolia (L.f.) Willd.[77], M. mínima (Baker ex Baker) B.L.Rob.[78], M. hoehnei B.L.Rob.[79], M. alvimii R.M.King & H.Rob., Mikania grazielae R.M.King & H.Rob.[80], M. pseudohoffmanniana G.M.Barroso ex W.Holmes[81], M. stipulacea (Vahl) Willd. [82,83] e M. pohlii (Baker) R.M.King & H.Rob.[53].
A presença de outros fitosteróis comuns como campesterol e taraxasterol foi relatada em espécies como M. cordifolia (L.f.) Willd.[83, M. laevigata[53], M. hoehnei B.L.Rob.[82] e M. parodii Cabrera[76].
Os terpenóides amirina e friedelina, abundantes no gênero Mikania, foram relatados em M. micrantha Kunth, M. cordata (Burm. f.) B.L.Rob, M. cordifolia (L.f.) Willd[83], M. minima (Baker ex Baker) B.L.Rob. e M. lasiandrae DC[84,85], entre outras espécies. Outros terpenóides menos comuns, mas igualmente importantes com respeito à atividade antioxidante, tais como o esqualeno, foram encontrados em várias espécies como Mikania grazielae R.M.King & H.Rob.[80], M. sessilifolli DC, M. luetzelburgii Mattf e M. officinalis Mart[54].
Entre os representantes exóticos de terpenóides presentes no gênero Mikania, foram relatados t-muurolol em M. hookeriana DC[86], estigmasta-4, 22-dien-3-ona em M. microptera DC, olean-9 (11), 13-dien-3-ona em M. rimachii W.C.Holmes & McDaniel[87] e 19,20-dihidroxi-16-oxo-geranil em M. luetzelburgii Mattf[47,54].
Os flavonoides são conhecidos principalmente quanto à sua atividade antioxidante e estão amplamente presentes no gênero Mikania. Em M. laevigata foram identificados flavonoides heterosídeos como patuletina 3-O-β-D-glicopiranosídeo, canferol 3-O-β-D-glicopiranosídeo, quercetina 3-O-β-D-glicopiranosídeo e 3,3',5-tri-hidroxi-4',6,7-trimetoxiflavona, entre outros[76]. Em M. cordata (Burm. f.) B.L.Rob, os flavonoides descritos foram patuletina-3-O-β-D-6 "-(p-cumaroil), glicosídeo (6-metoxiquercetina-3-O-β-D-6" - (p-cumaroil) glicosídeo), mikanin-3-O-sulfato (sal de Ca2+), eupalitin-3-O-sulfato (como sal de K+), eupalitin-3-O-β-D-glicosídeo, 6- metoxicanferol-3-O-βD-glicosídeo, nepetina e canferol-3-O-α-L-ramnosídeo[77]. Na mesma espécie foi relatado o isolamento de uma flavona, a mikanina- (3,5-di-hidroxi-4',6,7-trimetoxiflavona) e epifriedelinol a partir de raízes e do ácido fumárico a partir de folhas e caules[75]. Em M. cordifolia (L.f.) Willd um derivado de quercetina foi identificado como quercetina-3-O-glicosídeo. Em M. micrantha Kunthforam isolados e identificados eupalitina, eupafolina, luteolina[88], mikanina, alpinetina, mikanina-3-O-sulfato[72,73,89-91. Na mesma espécie foi identificada a 3,4',5,7-tetrahidroxi-6-metoxiflavona-3-O-β-D-glicopiranosídeo[92]. Os flavonoides canferol-3-O-glicosídeo e quercetina-3-O-glicosídeo foram identificados em e M. parodii Cabrera[84]. A naringenina foi identificada em Mikania grazielae R.M.King & H.Rob.[80] e um derivado de flavona, a batatifolina foi encontrada em M. batatifolia DC[93]. Uma revisão sobre a presença de flavonoides em Mikania foi relatada por Rufatto et al.[47]. A FIGURA 6 mostra os principais flavonoides identificados em Mikania.
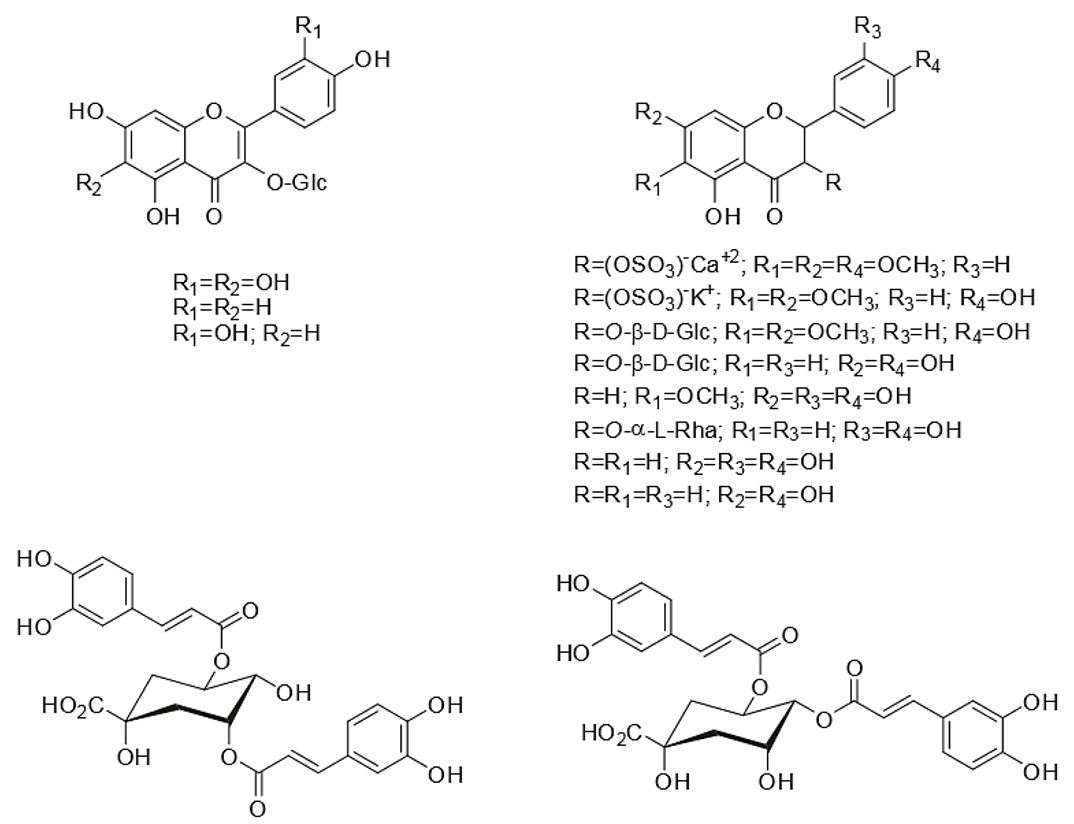
O ácido 5-cafeoilquínico é um éster de ácido cafeico, também conhecido como ácido clorogênico, normalmente encontrado num grande número de plantas, por exemplo, no café e na própolis. É produzido em plantas através de uma ligação éster entre o grupo carboxila do ácido cafeico e o grupo 5-hidroxila do ácido quínico[94]. O ácido clorogênico e o ácido cafeico foram relatados como atenuantes do risco de doenças crônicas, como a inflamação, doenças cardiovasculares e câncer[95,96]. Em M. micrantha Kunthfoi relatada a presença do éster de ácido n-butil-3,5-di-O-cafeoilquínico e do éster do ácido n-butil-3,4-di-O-cafeoilquínico[88]. Para o mesmo ácido 3,5-di-O-cafeoilquínico foi relatada a presença em M. cordifolia (L.f.) Willd, além de outros derivados, como 5-O-cafeoilquínico, ácido 3,4-di-O-cafeoilquinico, ácido 4,5-di-O-cafeoilquínico e do ácido 3-O-feruloil-5-O-cafeoilquínico[84]. Em M. lasiandrae DC também foi relatada a presença de ácido cafeoilquínico[85]. Em M. hirsutissima DC foi descrita a presença de ácido 1,5-dicafeoilquínico[47,97,98].
Apesar da ampla quantidade de estudos sobre Mikania,nota-se a carência de trabalhos que englobem os principais pontos referentes ao uso de uma espécie de planta medicinal, a rota biossintética dos metabólitos secundários, propriedades biológicas (farmacológicas e tóxicas) dos mesmos, morfoanatomia da espécie vegetal, assim como fatores intrínsecos e do meio (por exemplo, luz, vento, calor, chuva) que alteram o potencial de biossíntese[1,52,99-101].
Atividades biológicas e farmacológicas no gênero Mikania
As espécies de Mikania têm múltiplas ações farmacológicas. Em geral, a atividade se dá no trato respiratório, além de anti-inflamatória, antialérgica, analgésica, antioxidante, atuando também no sistema nervoso central[47,102].
Usualmente administrada na forma de xarope, tintura, extrato fluido, decocto ou infuso, preparações empregando-se extratos de droga vegetal Mikania têm suas atividades farmacológicas frequentemente, relacionadas com a presença de cumarina (1,2-benzopirona)[103]. A seguir, são relatadas algumas atividades biológicas e farmacológicas do gênero Mikania.
Baratto et al.[21] investigaram a atividade antimicrobiana de extratos de Mikania. Concluíram que não houve formação de halo de inibição na presença de nenhum dos extratos de M. laevigata, sendo que nas concentrações testadas não houve atividade antibacteriana significativa para as linhagens de Staphylococcus aureus (S.aureus, ATCC 25923), Escherichia coli (E.coli, ATCC 25992), Pseudomonas aeruginosa (P.aeruginosa, ATCC 27853), Enterococcus faecalis (E.faecalis, ATCC 29212) e Enterococcus faecium (E.faecium, ATCC 10541). Estes resultados foram, segundo os autores, inesperados, considerando o uso popular da espécie como antisséptico.
A cumarina é considerada uma das substâncias responsáveis pela atividade antimicrobiana do guaco[104] e sua presença já foi comprovada em M. laevigata. Em um estudo com essa espécie, comprovou-se a atividade inibitória do extrato etanólico sobre o crescimento e a adesão celular de Streptococcus mutans (S.mutans), micro-organismos associados às cáries dentais. Acredita-se que os ácidos cupressênico, diterpênico e caurenóico possam ser responsáveis por esta atividade[65,105].
O óleo essencial de outra espécie de guaco, M. glomerata, exibiu uma forte atividade contra Candida albicans (C.albicans). Dentre os componentes do óleo essencial, alguns apresentaram atividade antimicrobiana, incluindo 1,8-cineol, limoneno, linalol, geranial, germacreno-D e mentol[106,107]. As frações obtidas em diclorometano, acetato de etila e n-butanol a partir de M. lanuginosa DCe o ácido caurenóico apresentaram atividade antimicrobiana frente a bactérias Gram positivas (S. aureus e S. epidermidis), mas foram inativos contra bactérias Gram-negativas (P.aeruginosa, E.coli e Bacillus cereus)[106,108]. O extrato etanólico das folhas de M. hirsutissima DC não exibiu atividade antibacteriana contra E. coli, no entanto mostrou-se ativo contra S. aureus[106,109].
Da Penha et al.[110] avaliaram a atividade antimicrobiana da própolis e do guaco utilizados na manipulação de medicamentos frente a cepas de P. aeruginosa (ATCC 27853 IAL1026), E. coli (ATCC 10536), S. aureus (ATCC 25923 IAL1606), Salmonella sp (ATCC 19196), Candida albicans (C. albicans)(ATCC 64550), as quais são comumente causadoras de infecções em humanos. Os autores concluíram que os produtos naturais comumente utilizados na medicina popular brasileira apresentaram atividade antimicrobiana. A tintura de M. glomerata apresentou forte atividade, com inibição de quatro em cinco cepas utilizadas no estudo. O extrato puro de M. glomerata foi capaz de inibir as cepas de S. aureus e C. albicans. Os resultados apresentam uma expressiva contribuição para a caracterização da atividade antimicrobiana de produtos naturais largamente utilizados na medicina popular.
Estudos avaliaram a composição química de extratos do guaco e sua atividade antimicrobiana sobre S.mutans. Observou-se um efeito inibitório efetivo sobre as cepas bacterianas e inibição da aderência dos micro-organismos à superfície do vidro. A ação antimicrobiana de M. glomerata classifica-a como fonte promissora de novos agentes terapêuticos[65], o que pode ser observado pela ação dos óleos essenciais de M. glomerata na atividade contra candidíase[107]. As cumarinas apresentam atividade citotóxica, anti-HIV1 pela inibição da transcriptase reversa, antifúngica, inseticida, vasodilatadora coronariana através da inibição da cAMPfosfodiesterase e anticoagulante, inibindo a formação de tromboxana nas plaquetas[1,111].
O tratamento com M. glomerata também está indicado em casos de pneumoconiose, que é caracterizada por inflamação pulmonar causada pela exposição ao pó de carvão. A utilização reduz a infiltração pulmonar inflamatória induzida pelo pó de carvão, o que aponta o fitoterápico como preventivo de lesão pulmonar oxidativa[1,112].
Moreira et al.[113] investigaram a atividade antimicrobiana de extratos de M. glomerata, sendo atribuída ao maior teor de um diterpeno do tipo kaurano (KA) (o ácido ent-kaurenóico) presente planta. Os autores desenvolveram um extrato de M. glometara rico em KA (KAMg) e avaliaram-no como uma nova proposta de ingrediente à base de plantas para ser usado em produtos para cuidados orais. Assim, descreveram a preparação de tal extrato, bem como o desenvolvimento de um método validado por HPLC-DAD para determinar o conteúdo de KA. Avaliaram então esse extrato contra várias bactérias cariogênicas em comparação com KA. Concluíram que o extrato de KAMg inibiu o desenvolvimento de alguns micro-organismos responsáveis pela cárie dentária, sendo mais efetivo na inibição de S.mutans, inclusive impedindo a formação do biofilme.
Algumas plantas atuam no trato respiratório como as do gênero Mikania cuja eficácia já foi confirmada. O guaco (M. glomerata e/ou M. laevigata) é usado na cultura popular há séculos devido às propriedades das folhas, que incluem ação tônica, depurativa, antipirética e broncodilatora, além de estimulante do apetite e antigripal[114]. É ainda empregado no tratamento da asma, bronquite e adjuvante no combate à tosse[1,115].
Estudos relataram que o guaco age diretamente causando broncodilatação e relaxamento da musculatura lisa respiratória, o que pode estar relacionado ao bloqueio dos canais de cálcio, acompanhado de ações anti-inflamatória e antialérgica[100,116], que são extremamente benéficas ao tratamento da asma, a qual caracteriza-se por obstrução e inflamação das vias aéreas e, resposta broncodilatadora exagerada[1,72].
Apesar de possuir várias indicações terapêuticas populares, somente a ação broncodilatadora, antitussígena, expectorante e edematogênica sobre as vias respiratórias foram comprovadas[1,76].
Por exemplo, a M. glomerata, uma das espécies mais importantes e comumente utilizadas no gênero Mikania, tem sido popularmente usada no tratamento de asma, bronquite e tosse[47,50,115,117]. Outras espécies, conhecidas como "guaco" são também utilizadas para tratar problemas respiratórios como M. cordifolia (L.f.) Willd[78,118], M. laevigata[16,26] e M. cordata (Burm. f.) B.L.Rob[119]. Outros estudos mostraram a utilização de M. glomerata e M. laevigata como expectorante, no tratamento de doenças da gripe e respiratórias [114,120]. A atividade broncodilatadora foi parcialmente atribuída a cumarina, através do relaxamento da musculatura lisa. Além disso, Moura et al.[117] verificaram que os extratos aquosos e hidroalcoólicos (HAE) obtidos de M. glomerata induziram uma inibição significativa sobre as contrações de histamina na traqueia isolada de cobaia. O HAE induziu uma concentração-dependente no relaxamento na traqueia de cobaia tratada com histamina (IC50 0,34 mg/mL), a acetilcolina (IC50 0,72 mg/mL) ou K+ (IC50 de 1,41 mg/mL) e no brônquio humano isolado pré-contraído com K+ (IC50 de 0,34 (0,26 - 0,42) mg/mL). Em estudos, avaliando-se o HAE de M. laevigata no tratamento de doenças respiratórias, verificou-se que o extrato produziu uma dose dependente no relaxamento no de dois tipos diferentes de epitélio de traqueia de ratos pré-contraídos com acetilcolina com uma concentração eficaz (EC50) de 1406,7 ng/mL e 1378,3 µg/mL, respectivamente, e um efeito máximo (Emax) de 94,7 e 95,7%, respectivamente[14,121]. Estes dados apoiam a indicação de que a M. glomerata e a M. laevigata podem ser usadas para o tratamento de doenças respiratórias broncoconstritoras[47].
Nessa mesma espécie (M. glomerata), em ensaios com extratos: aquoso e hidroalcoólico, utilizando modelos de traqueia de cobaia e brônquio humano isolados verificou-se que o efeito relaxante sobre a musculatura lisa do trato respiratório pode estar relacionado ao bloqueio dos canais de cálcio, sendo que a presença de cumarina nos extratos não interferiu nos resultados. Em ensaios farmacológicos in vivo e in vitro realizados com o extrato hidroalcoólico e uma solução padrão de cumarina, ambos demonstraram efeitos espasmolítico, antiedematogênico e broncodilatador. Além disso, diferentes intensidades nos efeitos farmacológicos foram observadas no extrato indicando que, além da cumarina, outros compostos biologicamente ativos estão presentes[120,122].
A atividade da Mikania no sistema digestivo foi relatada em uma revisão publicada por Rufatto et al.[47]. Muitas plantas e seus extratos são comumente utilizados agindo contra várias desordens do sistema digestivo. Entre eles estão algumas espécies do gênero Mikania como a M. glomerata, M. laevigata e M. cordata. Em um estudo realizado por Salgado et al.[123] com M. glomerata, o extrato aquoso de folhas (1,000 mg/mL) mostrou uma diminuição nos movimentos propulsivos do conteúdo intestinal em ratos. A administração oral produziu uma inibição do trânsito gastrointestinal eficaz como a produzida pela Loperamida, uma droga referência, utilizada como antidiarreico. Estes achados sugerem que o extrato aquoso das folhas de M. glomerata pode produzir um efeito antidiarreico por inibição da motilidade intestinal. Além disso, o decocto das folhas de M. cordata também mostrou efeitos no sistema digestivo, sendo utilizado em dispepsia, úlcera gástrica e disenteria[124].
A fração metanólica do extrato da raiz mostrou efeitos antiúlcera em ratos machos Sprague-Dawley, de forma dose-dependente na inibição de úlceras gástricas induzidas por imersão em água induzida pelo estresse, etanol, ácido acetilsalicílico e fenilbutazona. Os valores de ED50 do extrato nos quatro modelos de úlceras foram verificados: 95,1; 109,7; 125,5 e 136,2 mg/kg, respectivamente[125]. No estudo realizado por Paul et al.[126], a fração obtida a partir de um extrato etanólico de folhas de M. cordata (Burm. f.) B.L.Rob, rico em alcaloides (dose de 50 mg/kg), houve uma inibição da atividade antiúlcera (in vivo) em lesões gástricas induzidas por Diclofenaco de sódio em ratos Long Evans. Mosaddik e Alam[127] realizaram um estudo semelhante ao avaliar o papel da fração de alcaloides em lesões gástricas induzida por Diclofenaco de sódio em ratos Long Evans e descobriram que no grupo avaliado com o extrato rico em alcaloides (50 mg/kg) o índice de úlceras do estômago (0,268 ± 0,0346) e do duodeno (0,050 ± 0,0129) foi significativamente mais baixo do que a do grupo ao qual foi administrado o Diclofenaco (0691 ± 0,0184 e 0,093 ± 0,0346, respectivamente). Assim, os princípios bioativos de M. cordata (Burm. f.) B.L.Rob provaram ter efeitos antiulcerogênicos. O extrato bruto hidroalcoólico a 70% de M. laevigata apresentou atividade antiulcerogênica quando aplicado em ratos Wistar machos, diminuindo o índice ulcerativo produzido pela indometacina, o etanol, estresse e reserpina em 85, 93, 82 e 50%, respectivamente[64]. Desta forma, diferentes espécies de guaco mostram atividade no sistema digestivo[47].
O efeito de extratos de Mikania foi descrito por possuir propriedades neurofarmacológicas confirmadas. Os estudos da fração metanólica do extrato da raiz de M. cordata (Burm. f.) B.L.Rob em animais mostrou alterações no padrão de comportamento de forma geral (por exemplo, redução espontânea da motilidade, analgesia e supressão do comportamento agressivo), entre outros efeitos. As observações sugerem que a raiz de M. cordata (Burm. f.) B.L.Rob possui uma potente ação sobre o sistema nervoso central[128]. O extrato hidroalcoólico das partes aéreas de M. scandens (L.) Willd. apresentaram propriedades neurofarmacológicas em ratos albinos suíços. Os resultados do estudo revelaram uma ação sobre o sistema nervoso central[129].
Estudos com extratos, óleos e compostos de várias espécies demonstraram atividade anti-inflamatória[47]. Oliveira et al.[130] descobriram a ação anti-inflamatória do extrato fluido de M. glomerata no teste de atividade antiedema de pata induzido por carragenina e quantificado por pletismografia. Essas inibições foram ligeiramente menores do que as produzidas pelo controle com fenilbutazona. Além disso, Leite et al.[122] compararam o efeito do extrato de M. glomerata e solução de cumarina (1,2-benzopirano), em testes in vivo (edema de pata). Os resultados mostraram o efeito anti-inflamatório do extrato e, também, da solução de cumarina. Ruppelt et al.[34] estudaram o chá de guaco (M. glomerata) como agentes analgésico e anti-inflamatório. O grupo de animais que ingeriu o chá mostrou inibição de 63,1% em contorções e uma redução de 48,92% em difusão do corante (azul de Evans), em comparação com o controle. Deste modo, a infusão da planta demonstrou atividade analgésica e anti-inflamatória em menor grau em comparação com o controle analgésico.
A atividade anti-inflamatória de M. cordifolia (L.f.) Willd foi atribuída à presença de ácidos dicafeoilquínicos. Foi avaliada a atividade sobre a migração de monócitos e a produção de ânion superóxido[131]. Outras espécies, M. laevigata e M. involucrata Hook. & Arn. demonstraram uma potencial atividade anti-inflamatória em inibir edema e pleurisia. No teste de edema de pata induzido, os animais tratados com decocções de folha de M. laevigata (200 mg/kg) e M. involucrata Hook. & Arn. (50 mg/kg) apresentaram uma inibição do edema de 81,56 e 81,67%, respectivamente, 3 horas após a administração do agente flogístico. No ensaio de pleurisia, decocções das folhas de M. laevigata (400 mg/kg) e de M. involucrata Hook. & Arn. (200 mg/kg) inibiram a migração de leucócitos para o exsudato pleural em 28,26 e 54,35%, respectivamente[112,132]. Em conclusão, muitas espécies de Mikania estão envolvidas em respostas anti-inflamatória, analgésica e antialérgica[47]. Outras atividades descritas foram antiviral e pasitária[47,53,133-135], antiofídica[47,136,137], fitotóxica[47,73,93,138] e alelopática[47,93,139,140].
Interações medicamentosas e toxicidade
A varfarina, cuja estrutura química resulta de uma modificação da cumarina, é um anticoagulante oral que atua como inibidor da vitamina K, um cofator essencial para a síntese de fatores de coagulação II, VII, IX e X[141]. Outras moléculas com o esqueleto químico das cumarinas, como o acenocumarol, femprocumona e dicumarol (FIGURA 7), também apresentam atividades anticoagulantes[141]. Como o guaco é rico em cumarina, é desaconselhável o uso para crianças com idade inferior a um ano e mulheres no período gestacional. Além disso, o uso prolongado pode provocar acidentes hemorrágicos, pelo antagonismo à vitamina K[142]. Além da interação com anticoagulantes, um estudo demonstrou que extratos secos de guaco podem interagir, sinergicamente in vitro, com alguns antibióticos como tetraciclinas, cloranfenicol, gentamicina, vancomicina e penicilina, no entanto, o mecanismo de ação ainda é desconhecido[1,143].
Controle de qualidade de Mikania
A seguir, são relatados alguns trabalhos sobre o controle de qualidade de Mikania. Celeghini et al.[46] avaliaram vários métodos de extração para os extratos hidroalcoólicos das folhas de "guaco" (Mikania glomerata Spreng.), a saber: maceração, maceração com ultrassom, infusão e extração por fluido supercrítico. Dentre os métodos estudados, a maceração com ultrassom proporcionou os melhores resultados, especialmente considerando-se a relação rendimento da extração/tempo de extração. A cromatografia líquida de alta eficiência (HPLC) foi utilizada para determinar a concentração de cumarina nos extratos hidroalcoólicos das folhas de guaco. A metodologia de análise desenvolvida utilizando HPLC mostrou ser sensível e reprodutível. O método de maceração com sonicação se mostrou melhora na escolha, considerando os resultados apresentados na TABELA 1.
| Amostra | Concentração (mg/mL) ± dp* | Rendimento relativo da extração (%) |
| Folhas secas | 0,648 ± 0,015 | 78,7 |
| Folhas depois da primeira maceração | 0,140 ± 0,002 | 17,1 |
| Folhas depois da segunda extração | 0,035 ± 0,004 | 4,2 |
| *Triplicata. Fonte: Celeghini et al.[46]. | ||
Osorio e Martins[24] desenvolveram um método de doseamento de cumarina (1,2-benzopirano) em extrato fluido e tintura de guaco (M. glomerata Sprengel). O método desenvolvido foi por espectrofotometria derivada de primeira ordem, que se mostrou preciso, exato, reprodutível e de fácil execução. A espectrofotometria por derivada de primeira ordem, pelo coeficiente de linearidade alto (0,9987), quando de sua aplicação em extrato fluido de guaco, mostrou-se útil para a aplicação na quantificação da cumarina nos extratos de M. glomerata.
Apesar da grande utilização de extratos de guaco, Bueno e Bastos[144] verificaram que existia uma falta relativa à disponibilidade de métodos validados de análise quantitativa de cumarina em fitomedicamentos contendo extratos de guaco, especialmente xaropes. Além disso, não havia à época da publicação do artigo, nenhum procedimento descrito para controle do processo de fabricação na sua totalidade, incluindo a aquisição da matéria prima até a produção e padronização de extratos. No entanto, o controle de qualidade é baseado na quantificação da cumarina na planta bruta e nos seus extratos, através da aplicação de técnicas cromatográficas, como sugerido por Vilegas et al.[145] e outros autores[66,146,147] e espectrofotométricas[17]. Os dados apresentados por outros autores[144] mostraram que o método desenvolvido por cromatografia gasosa com detector de ionização de chama (GC-FID) foi adequado para a análise quantitativa de rotina da cumarina em xarope de guaco, assim como na droga vegetal e em extratos.
Foi aplicado um método para realizar a análise do teor de cumarina presente em xaropes de guaco (M. glomerata) armazenado em diferentes temperaturas, por espectrometria no UV em comprimento de onda de 275,4 nm. Utilizou-se como veículo para efetuar as diluições da amostra uma mistura de metanol/água destilada, na proporção de 80% v/v. A curva de calibração foi obtida diluindo-se 100 mg de cumarina padrão em 100 mL da solução descrita anteriormente, obtendo-se sete concentrações distintas com variação de 2 µg a 20 µg. Os resultados obtidos demonstraram que a temperatura de armazenamento de 45 °C foi considerada ótima para desenvolver a conversão do isômero trans em cis com subsequente conversão deste a cumarina. Os valores de cumarina, encontrados na forma farmacêutica em estudo, foram de 1,19 a 1,37 mg/mL, sendo que o valor mais alto refere-se às amostras armazenadas a 45 °C durante seis meses [148].
Em outro trabalho, foram avaliadas drogas vegetais constituídas de folhas e tinturas de guaco (M. glomerata), adquiridas no Mercado Central e em farmácias de manipulação de Belo Horizonte, respectivamente. Realizaram-se testes físico químicos de caracterização organoléptica, determinação de matéria estranha, teores de água e cinzas totais para as amostras de drogas vegetais e caracterização organoléptica, medidas de pH e de densidade para as amostras de tinturas. Foram obtidos os perfis cromatográficos por cromatografia em camada delgada (CCD) e HPLC-FR e fez-se a quantificação da cumarina, por HPLC-FR (fase reversa). As amostras analisadas apresentaram um ou mais dos parâmetros avaliados fora dos valores preconizados pela Farmacopeia Brasileira, evidenciando-se a necessidade da realização do controle de qualidade de matérias-primas vegetais, para obtenção de medicamentos fitoterápicos de qualidade, eficientes e seguros [149].
Bolina et al. [17] realizaram um estudo comparativo da composição química das espécies vegetais Mikania glomerata Sprengel e Mikania laevigata Schultz Bip. Ex Baker. Pelos perfis cromatográficos obtidos por CCD, constataram que as duas espécies apresentaram constituição química semelhante, sendo detectada a presença da cumarina (1,2-benzopirona), triterpenos/esteróides e heterosídeos flavônicos. Características semelhantes foram também observadas nos perfis cromatográficos dos extratos etanólicos de M. glomerata e M. laevigata obtidos por HPLC-FR. e os teores de cumarina mostraram-se bastante próximos. Assim, os resultados encontrados sugeriram que as espécies M. glomerata e M. laevigata podiam ser utilizadas de forma indistinta.
O extrato seco de guaco (M. glomerata) obtido pelo processo de liofilização foi considerado adequado como matéria-prima para a produção de cápsulas de forma farmacêutica sólida. O método espectrofotométrico por UV não foi apenas apto para quantificar a substância de referência, mas todas as cumarinas presentes no guaco, enquanto que a técnica de HPLC foi específica para quantificar a 2H-1-benzopiran-2-ona (FIGURA 7) como marcador químico da espécie. No entanto, o método por espectrofotometria-UV teve algumas vantagens em comparação com o HPLC-UV, tais como o custo operacional reduzido e o tempo de análise, sendo uma técnica simples, com menos impacto ambiental, uma vez que o reagente utilizado no método de HPLC-UV, acetonitrila, é teratogênico, com um perfil tóxico por várias vias de absorção [150,151].
Passari et al. [152] desenvolveram um planejamento experimental para caracterizar variações sazonais e efeitos de solvente utilizados na extração sobre as quantidades de cumarina e metabólitos de M. laevigata. Para a quantificação da cumarina, os autores utilizaram RP-HPLC-DAD e UPLC-ESI-MS. Os resultados mostraram que existem efeitos sazonais que refletiram no teor de cumarina, ácido o-cumárico e ácido melilotico. A análise cromatográfica aliada ao desenho experimental foram ferramentas importantes para prover informações a respeito das concentrações dos metabólitos secundários na planta durante as quatro estações do ano [153].
De Melo e Sawaya [16], empregando a técnica de UHPLC-MS, não só identificaram e quantificaram o ácido clorogênico e a cumarina, como outros compostos, os quais fazem parte do perfil químico complexo de amostras de M. glomerata. O método cromatográfico empregado permitiu distinguir amostras de folhas de duas morfologias similares e pode ser empregado, segundo os autores, no controle de qualidade de folhas secas e extratos dessa espécie [153].
Dentro do âmbito de se propor métodos analíticos mais rápidos que podem ser alternativas aos métodos convencionais para a análise de fitomedicamentos, Cappelaro et al. [151] compararam a análise por HS-SPME-HRGC-MS de compostos voláteis e semi-voláteis de folhas secas de M. glomerata, utilizando-se três fibras comerciais diferentes, sugerindo a HS-SPME como uma abordagem analítica alternativa que pode ser utilizada como complemento no controle de qualidade de fitoterápicos a base de M. glomerata, particularmente na análise de matéria-prima a base de guaco. Os resultados apresentados por esses autores sugeriram que a HS-SPME-HRGC-MS pode ser uma ferramenta analítica potencial para a análise de compostos voláteis e semi-voláteis de M. glomerata.
Foi utilizada a técnica de HPLC-RP com detector UV (254 nm) para avaliar folhas da M. glomerata Spreng., coletadas no banco ativo de germoplasma (BAG) da Estação Experimental da Epagri de Itajaí, SC. Os autores validaram o método analítico [154]. Puderam concluir que o mesmo é confiável para os parâmetros avaliados. As principais vantagens do método estariam relacionadas principalmente a redução do tempo de análise e da geração de resíduos, indo desta forma ao encontro dos princípios da química verde. A proposta de um método rápido tornou-se interessante para a rotina do controle de qualidade industrial, visando à obtenção de medicamentos fitoterápicos padronizados. Desta forma, o método desenvolvido e validado para análise de cumarina em extrato de guaco utilizando coluna de fase reversa C18 de 30 mm atendeu às necessidades específicas do estudo, mostrando-se uma alternativa analítica rápida e eficiente [155].
Considerando-se a falta de estudos sobre as condições de cultivo da M. laevigata e da M. glomerata e a importância destes estudos para a sua utilização segura, foram avaliados três metabólitos secundários por UHPLC-MS e MS/MS, os quais são influenciados pela sazonalidade e as seguintes variações nas condições de cultivo: temperatura, luminosidade e disponibilidade de água. Extratos hidroetanólicos das folhas foram avaliados por UHPLC-MS e MS/MS, seguindo as diferenças na concentração do seu marcador químico, cumarina, e outros componentes bioativos: ácido clorogênico (ácido 3-O-cafeoilquínico) e ácido dicafeoilquínico. Este é o primeiro relatório sobre a presença de ácido dicafeoilquínico nestas espécies. Os resultados mostram influência significativa da sazonalidade e dos tratamentos sobre o conteúdo destes compostos [52, 156].
Segundo o relatado no presente trabalho e, observado por Costa et al. [41], devido ao padrão de metabólitos secundários encontrados em M. glomerata e M. laevigata, o perfil químico das folhas, avaliado por UHPLC-MS, foi a característica que melhor diferenciou as duas espécies. A cumarina esteve presente em todas as amostras das folhas de M. laevigata, mas ausente ou em baixa concentração em folhas de M. glomerata. As hastes apresentaram cumarina em ambas as espécies, embora em diferentes concentrações. A quantificação dos ácidos clorogênico e dicafoilquínico foi determinante para a separação das duas espécies, uma vez que maiores concentrações são encontradas em M. glomerata [41,156,157].
Conclusão
O uso de plantas medicinais não pode mais ser considerado apenas como cultura de povos ou tradição, mas como ciência que vem sendo estudada, aperfeiçoada e utilizada por grande parte da população mundial, como terapia alternativa, a qual pode trazer inúmeros benefícios aos usuários. Isto é comprovado em relação ao guaco, através de estudos sobre sua farmacobotânica, composição química e ações biológicas. Para a fitoterapia é fundamental também o conhecimento sobre os metabólitos secundários da planta, os efeitos e a biossíntese, além dos fatores que podem influenciar no acúmulo ou redução destes componentes na planta além de um rígido controle de qualidade dos seus marcadores.
Referências
1. Czelusniak KE, Brocco A, Pereira DF, Freitas GBL. Farmacobotânica, fitoquímica e farmacologia do guaco: revisão considerando Mikania glomerata Sprengel e Mikania laevigata Schulyz Bip. ex Baker. Rev Bras Plant Med. 2012; 14(2):400-409. ISSN 1516-0572. [Link].
2. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada RDC n° 26: Dispõe sobre o registro de medicamentos Fitoterápicos e o registro e a notificação de produtos naturais fitoterápicos. D.O.U. (Diário Oficial da União), 13/05/2014. [Link].
3. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada RDC N° 48: Dispõe sobre o registro de Fitoterápicos. D.O.U (Diário Oficial da União), 16/03/2004. [Link].
4. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária: Determina a publicação da Lista de Registro Simplificado de fitoterápicos, 11/12/2008. [Link].
5. Nicoletti MA, Junior MAO, Bertasso CC, Caporossi PY, Tavares APL. Principais interações no uso de medicamentos fitoterápicos. Infarma. 2007; 19(1/2):32-40. ISSN 0104-021. [Link].
6. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Instrução Normativa IN N° 4: Determina a publicação do guia de orientação para registro de medicamento Fitoterápico e registro e notificação de Produto Tradicional Fitoterápico. D.O.U (Diário Oficial da União), 18/06/2014. [Link].
7. Storion AC. Uso de técnicas analíticas hifenadas na identificação de marcadores fitoquímicos e adulterações em drogas vegetais e fitoterápicos. São Paulo, 2016. Dissertação de Mestrado. [Programa de Mestrado Profissional em Farmácia], UNIAN-SP.
8. Alvarenga FCR, Garcia EF, Bastos EMAF, Grandi TSM, Duarte MGR. Avaliação da qualidade de amostras comerciais de folhas e tinturas de guaco. Rev Bras Farmacogn. 2009; 19(2A):442-448. ISSN 0102-695X. [CrossRef].
9. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Instrução Normativa (IN) nº 5, de 11 de dezembro de 2008. Lista de medicamentos fitoterápicos de registro simplificado. Diário Oficial da União, Brasília, DF, 12 dezembro. 2008. [Link].
10. Silva RAD. Pharmacopeia dos Estados Unidos do Brasil. São Paulo: Companhia Editora Nacional, 1926. 1147p.
11. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada RDC N° 14: Dispõe sobre o registro de medicamentos Fitoterápicos. D.O.U (Diário Oficial da União), 31/03/2010. [Link].
12. Brandão MGL, Cosenza GP, Moreira RA, Monte-Mor RLM. Medicinal plants and other botanical products from the Brazilian Official Pharmacopoeia. Rev Bras Farmacogn. 2006; 16(3):408-420. ISSN 0102-695X. [CrossRef].
13. Brandão MGL, Zanetti NNS, Oliveira GRR, Goulart LO, Monte Mor RLM. Other medicinal plants and botanical products from the first edition of the Brazilian Official Pharmacopoeia. Rev Bras Farmacogn. 2008; 18(1):127-134. ISSN 0102-695X. [CrossRef].
14. Gasparetto JC, De Francisco TMG, Pontarolo R. Chemical constituents of Mikania glomerata Spreng and Mikania laevigata Sch. Bip. ex Baker. J Med Plant Res. 2013; 7(13):753-765. ISSN 1996-0875. [CrossRef].
15. Passari LMZ, Scriminio IS, Bruns RE. Experimental designs charaterizing seasonal variations and solvent effects on the quantities of coumarin and related metabolites from Mikania laevigata. Anal Chim Acta. 2014; 821:89-96. ISSN 0003-2670. [CrossRef].
16. De Melo LV, Sawaya ACHF. UHPLC–MS quantification of coumarin and chlorogenic acid in extracts of the medicinal plants known as guaco (Mikania glomerata and Mikania laevigata). Rev Bras Farmacogn. 2015; 25(2):105-110. ISSN 0102-695X. [CrossRef].
17. Bolina RC, Garcia EF, Duarte MGR. Comparative study of the chemical composition of the species Mikania glomerata Sprengel and Mikania laevigata Schultz Bip. ex Baker. Rev Bras Farmacogn. 2009; 19(1B):294-298. ISSN 0102-695X. [CrossRef].
18. Barbosa-Filho JM, Vasconcelos THC, Alencar AA, Batista LM, Oliveira RAG, Guedes DN et al. Plants and their active constituents from South, Central, and North America with hypoglycemic activity. Rev Bras Farmacogn. 2005; 15(4):392-413. ISSN 0102-695X. [CrossRef].
19. Saúde-Guimarães DA, Faria AR. Substâncias da natureza com atividade anti-Trypanosoma cruzi. Rev Bras Farmacogn. 2007; 17(3):455-465. ISSN 0102-695X. [CrossRef].
20. Vicentino ARR, Menezes FS. Atividade antioxidante de tinturas vegetais, vendidas em farmácias com manipulação e indicadas para diversos tipos de doenças pela metodologia do DPPH. Rev Bras Farmacogn. 2007; 17(3):384-387. ISSN 0102-695X. [CrossRef].
21. Baratto L, Lang KL, Vanz DC, Reginatto FH, Oliveira JB, Falkenberg M. Investigação das atividades alelopática e antimicrobiana de Mikania laevigata (Asteraceae) obtida de cultivos hidropônico e tradicional. Rev Bras Farmacogn. 2008; 18(4):577-582. ISSN 0102-695X. ISSN 0102-695X. [CrossRef].
22. Quintans-Júnior LJ, Almeida JRGS, Lima JT, Nunes XP, Siqueira JS, Oliveira LEG et al. Plants with anticonvulsant properties - a review. Rev Bras Farmacogn. 2008; 18(Supl.):798-819. ISSN 0102-695X. [CrossRef].
23. Mariath IR, Falcão HS, Barbosa-Filho JM, Sousa LCF, Tomaz ACA, Batista LM et al. Plants of the American continent with antimalarial activity. Rev Bras Farmacogn. 2009; 19(1a):158-162. ISSN 0102-695X. [CrossRef].
24. Osório AC, Martins JLS. Determinação de cumarina em extrato fluido e tintura de guaco por espectrofotometria derivada de primeira ordem. Rev Bras Cienc Farm. 2004; 40(4):481-486. ISSN 1516-9332. [CrossRef].
25. Ueno VY, Sawaya ACHF. Influence of environmental factors on the volatile composition of two Brazilian medicinal plants: Mikania laevigata and Mikania glomerata. Metabolonics. 2019; 15:91-95. ISSN 1573-3882.[CrossRef].
26. Verdi LG, Brighente IMC, Pizzolatti MG. The Baccharis genus (Asteraceae): chemical, economic and biological aspects. Quím Nova. 2005; 28(1):85-94. ISSN 0100-4042. [CrossRef].
27. Joly AB. Botânica: Introdução a taxonomia vegetal. 7ª ed. São Paulo: Cia. Editora Nacional. 1967.159p. ISBN 8504002314.
28. Emerenciano VP, Kaplan MAC, Gottlieb OR, Bonfanti MRM, Ferreira ZS, Comegno LMA. Evolution of sesquiterpene lactones in Asteraceae. Biochem System Ecol. 1986; 14(6):585-589. ISSN 0305-1978. [CrossRef].
29. Budel JM, Duarte MR, Kosciuv I, De Morais TB, Ferrari LP. Contribuição ao estudo farmacognóstico de Mikania laevigata Sch. Bip. ex Baker (guaco), visando o controle de qualidade da matéria-prima. Rev Bras Farmacogn. 2009; 19(2B):545-552. ISSN 0102-695X. [CrossRef].
30. Rodrigues KM, De Godoy SM, Ruas CF. Filogenia molecular do gênero Mikania (Asteraceae, Eupatorieae) por meio de marcadores AFLP. Anais do Encontro Anual de Iniciação Científica da UEL. 2015; ISSN 2447-4118. [Link].
31. Barroso GM. Mikania do Brasil, Jardim Botânico, Ed. Rio de Janeiro, 1958.
32. Neves JL, Sá MFA. Contribuição ao estudo de plantas medicinais Mikania glomerata Sprengel. Rev Bras Farmacogn. 1991; 72:42-47. ISSN 0102-695X. [Link].
33. Oliveira F, Oga S, Akisue G, Akisue MK. Parâmetros físicos e químicos e efeito antiedema dos extratos fluidos de guaco (Mikania glomerata Sprengel) e de guaco de mato (Mikania laevigata Schutz Bip. ex Baker). An Farm Quim. São Paulo. 1985; 25:50-54. ISSN 0102-695X. [Link].
34. Ruppelt BM, Pereira EF, Gonçalves LC, Pereira NA. Pharmacological screening of plants recommended by folk medicine as anti-snake venom: I. Analgesic and anti-inflammatory activities. Mem Inst Oswaldo Cruz. 1991; 86:203-205. ISSN 1678-8060. [PubMed].
35. Oliveira F, Alvarenga MA, Akisue G, Akisue MK. Isolamento e identificação de componentes químicos de Mikania glomerata Sprengele de Mikania laevigata Schultz Bip. ex Baker. Rev Farm Bioquim. 1984; 2:169-183. ISSN 0301-7052. [Link].
36. De Castro EM, Pinto JEBP, Melo HC, Soares AM, Alvarenga AA, Lima Júnior EC. Aspectos anatômicos e fisiológicos de plantas de guaco submetidas a diferentes fotoperíodos. Hort Bras. 2005; 23 (3):846-850. ISSN 0102-0536. [CrossRef].
37. Bastos CL, Da Mata CZ, Maia VH, Borges RAX, Franco LO, Ferreira PCG et al. Anatomical and molecular identification of "guaco" Mikania glomerata and Mikania laevigata (Asteraceae), two important medicinal species from Brazil. J Med Plant Res. 2011; 5(18): 4579-4583. ISSN 1996-0875. [Link].
38. Freitas TP. Avaliação dos efeitos de Mikania glomerata Sprengele Mikania laevigata Schultz Bip. ex Baker (Asteraceae) no processo inflamatório induzido pela exposição aguda ao carvão mineral. 2006. 48p. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Ambientais], Universidade do Extremo Sul Catarinense, Criciúma. [Link].
39. Cabrera AL, Klein M. Compostas (Eupatoriae). In: Reitz R. Flora Ilustrada Catarinense. Itajaí: Herbário Barbosa Rodrigues, 1989. p.649-750. [Link].
40. Ritter MR, Miotto STS. Taxonomia de Mikania Willd. (Asteraceae) no Rio Grande do Sul, Brasil. Hoehnea. 2005; 32(3):309-359. ISSN 2236-8906. [Link].
41. Costa VCO, Borghi AA, Mayer JLS, Sawaya ACHF. Comparison of the Morphology, Anatomy, and Chemical Profile of Mikania glomerata and Mikania laevigata. Plan. Med. 2017; 84(3):191-200. ISSN 0032‑0943. [CrossRef] [PubMed].
42. Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Formulário de fitoterápicos da farmacopeia brasileira: Brasília. 126p, 2011. [Link].
43. Silva Júnior AA, Ritter MR, Zambonim FM, Deschamps FC, Tcacenco FA, Bertoldi FC. Um novo ecótipo de Mikania glomerata Spreng. (Asteraceae) rico em óleo essencial no Sul do Brasil. Rev Fitos 2015, 9(1):19-28. ISSN 2446-4775. [CrossRef].
44. Silva Júnior AA. Fitoprospecção e avaliação de acessos de Mikania glomerata Sprengel (guaco) no Litoral de Santa Catarina. In: Jornada Catarinense de Plantas Medicinais, 6, Florianópolis, SC. Resumos. Florianópolis, SC: UFSC, 2010. p.58-61. [Link].
45. Silva Junior AA, Deschamps FC, Osaida CC. Fitoprospecção de plantas aromáticas nativas de Santa Catarina. In: Jornada Catarinense de Plantas Medicinais, 6, Florianópolis. Anais. Florianópolis: UFSC, 2010a. p.55-57. [Link].
46. Celeghini RMS, Vilegas JHY, Lanças FM. Extraction and quantitative HPLC analysis of coumarin in hydroalcoholic extracts of Mikania glomerata Spreng ("guaco") leaves. J Braz Chem Soc. 2001; 12(6):706-709. ISSN 0103-5053 [CrossRef].
47. Rufatto LC, Gower A, Schwambach J, Moura S. Genus Mikania: chemical composition and phytotherapeutical activity. Rev Bras Farmacogn. 2012; 22(6):1384-1403. ISSN 0102-695X. [CrossRef].
48. Pereira BMR, Gonçalves LC, Pereira NA. Abordagem farmacológica de plantas recomendadas pela medicina folclórica como antiofídicas III. Atividade antidermatogênica. Congresso Brasileiro de Plantas Medicinais. Curitiba: Universidade Federal do Paraná, p. 1, 1992.
49. Hoult JRS, Payá M. Pharmacological and biochemical actions of simple coumarins: natural products with therapeutic potential. Gen Pharmacol. 1996; 27:713-722. ISSN 0306-3623. [CrossRef].
50. Silva MIG, Gondim APS, Nunes IFS, Sousa FCF. Utilização de fitoterápicos nas unidades básicas de atenção à saúde da família no município de Maracanaú (CE). Rev Bras Farmacogn. 2006; 16:455-462. ISSN 0102-695X. [CrossRef].
51. De Castro EM, Pinto JEBP, Bertolucci SKV, Malta MR, Cardoso MG, Silva FAM. Coumarin contents in young Mikania glomerata plants (guaco) under different radiation levels and photoperiod. Acta Farm Bonaerense. 2006; 25 (3):387-392. ISSN 0326-2383. [Link].
52. Herz W, Kulanthaivel P. Diterpenes and sesquiterpene lactones from Mikania congesta. Phytochemistry. 1985; 24(8):1761-1768. ISSN 0031-9422. [CrossRef].
53. Bohlmann F, Adler A, Jakupovic J, King RM, Robinson H. A dimeric germacranolide and other sesquiterpene lactones from Mikania species. Phytochemistry. 1982; 21(6):1349-1355. ISSN 0031-9422. [CrossRef].
54. Bohlmann F, Adler A, Schuster A, Gupta RK, King RM, Robinson H. Diterpenes from Mikania species. Phytochemistry. 1981; 20:1899-1902. ISSN 0031-9422. [CrossRef].
55. Ahmed M, Rahman MT, Alimuzzaman M, Shilpi JA. Analgesic sesquiterpene dilactone from Mikania cordata. Fitoterapia. 2001; 72:919-921. ISSN 0367-326X. [CrossRef].
56. Facey PC, Peart PC, Porter RBR. The antibacterial activities of mikanolide and its derivatives. West Indian Med J. 2010; 59:249-252. ISSN 0043-3144. [Link].
57. Prevost G, Coulomb H, Lavergne O, Lanco C, Teng B-P. Preparation of pharmaceutical compositions containing mikanolide, dihydromikanolide or an analog thereof combined with another anticancer agent for therapeutic use in cancer treatment PCT Int. Appl. WO 2002096348 A2 20021205, 2002. [Link].
58. Alves TMA, Chaves PPG, Santos LMST, Nagem TJ, Murta SMF, Ceravolo IP et al. A diterpene from Mikania obtusata active on Trypanosoma cruzi. Planta Med. 1995; 61:85-87. ISSN 0032-0943. [CrossRef].
59. Barbosa AD, Ferreira RCV, Valente PHM. Atividade antimicrobiana de extratos fluidos de plantas medicinais brasileiras. Lecta. 1994; 12:153-163. ISSN 0104-0987. [Link].
60. Costa-Lotufo LV, Cunha GMA, Farias PAM, Viana GSB, Cunha KMA, Pessoa C et al. The cytotoxic and embryotoxic effects of kaurenoic acid, a diterpene isolated from Copaifera langsdorffii oleo-resin. Toxicon. 2002; 40:1231-1234. ISSN 0041-0101. [CrossRef].
61. Wilkens M, Alarcon C, Urzua A, Mendoza L. Characterization of the bactericidal activity of the natural diterpene kaurenoic acid. Planta Med. 2002; 68:452-454. ISSN 0032-0943. [CrossRef].
62. Cunha KMA, Paiva LAF, Santos FA, Gramosa NV, Silveira ER, Rao VSN. Smooth muscle relaxant effect of kaurenoic acid, a diterpene from Copaifera langsdorffii on rat uterus in vivo. Phytother Res. 2003; 17:320-324. ISSN 1099-1573. [CrossRef].
63. Bighetti AE, Antônio MA, Kohn LK, Rehder VLG, Foglio MA, Possenti A. Antiulcerogenic activity of a crude hydroalcoholic extract and coumarin isolated from Mikania laevigata Schultz Bip. Phytomed. 2005; 12:72-77. ISSN 0944-7113. [CrossRef].
64. Yatsuda R, Rosalen PL, Cury JA, Murata RM, Rehder VLG, Melo VL. Effects of Mikania genus plants on growth and cell adherence of mutans streptococci. J Ethnopharmacol. 2005; 97:83-89. ISSN 0378-8741. [CrossRef].
65. Santos SC, Krueger CL, Steil AA, Krueger MR, Biavati MW, Wisnievski-Junior A. LC characterization of guaco medicinal extracts, Mikania laevigata and M. glomerata, and their effects on allergic pneumonitis. Planta Med. 2006; 72:679-684. ISSN 1439-0221. [CrossRef].
66. Vichnewski W, Filho HFL, Murari R, Herz W. Cinnamoylgrandifloric acid from Mikania oblongifolia. Phytochemistry 1977; 16:2028-2029. ISSN 0031-9422. [CrossRef].
67. Cruz FG, Roque NF. Diterpene acids from Mikania triangularis. Phytochemistry 1992; 31:2793-2796. ISSN 0031-9422. [CrossRef].
68. Cruz FG, Roque NF, Giesbrecht AM, Davino SC. Antibiotic activity of diterpenes from Mikania triangularis. Fitoterapia. 1996; 67:189-190. ISSN 0367-326X. [Link].
69. Santos SC. Caracterização cromatográfica de extratos medicinais de guaco: Mikania laevigata Schulz Bip. ex Baker e M. glomerata Sprengel e ação de M. laevigata na inflamação alérgica pulmonar. 2005. 93p. Dissertação de Mestrado [Programa de Pós-Graduação em Ciências Farmacêuticas] Universidade do Vale do Itajaí, Itajaí. [Link].
70. Nunez CV, Amendula MC, Lago JHG, Roque NF. Diterpene acids from Mikania sp. Biochem Sist Ecol. 2004; 32:233-237. ISSN 0305-1978. [CrossRef].
71. Herz W, Srinivasan A, Kalyanaraman PS. Mikanokryptin, a new guianolide from Mikania. Phytochemistry. 1975; 14:233-237. ISSN 0031-9422. [CrossRef].
72. Nicollier G, Thompson AC. Essential oil and terpenoids of Mikania micrantha. Phytochemistry. 1981; 20:2587-2588. ISSN 0031-9422. [CrossRef].
73. Gasparetto JC, Campos FR, Budel JM, Pontarolo R. Mikania glomerata Spreng. e M. laevigata Sch. Bip. ex Baker, Asteraceae: estudos agronômicos, genéticos, morfoanatômicos, químicos, farmacológicos, toxicológicos e uso nos programas de fitoterapia do Brasil. Rev Bras Farmacogn. 2010; 20(4):627-640. ISSN 0102-695X. [CrossRef].
74. Kiang AK, Sim KY, Yoong SW. Constituents of Mikania cordata (Burm. F.) B. L. Robinson (Compositae)-II. Phytochemistry. 1968; 7:1035-1037. ISSN 0031-9422. [CrossRef].
75. Aguinaldo AM, Abe F, Yamauchi T, Padolina WG. Germacranolides of Mikania cordata. Phytochemistry. 1995; 38:1441-1443. ISSN 0031-9422. [CrossRef].
76. Oliveira PA, Turatti ICC, Oliveira DCO. Comparative analysis of triterpenoids from Mikania cordifolia collected from four different locations. Rev Bras Ciênc Farm. 2006; 42(4):547-552. ISSN 1516-9332. [CrossRef].
77. Cuenca MDR, Catalán CAN. 14,15-dihydroxygermacranolides and other constituents of Mikania minima. J Nat Prod. 1990; 53:686-691. ISSN 0163-3864. [PubMed].
78. Chaves JS, Oliveira DCR. Sesquiterpene lactones and other chemical constituents of Mikania hoehnei R. J Braz Chem Soc. 2003; 14:734-737. ISSN 0103-5053. [CrossRef].
79. Bohlmann F, Adler A, King RM, Robinson H. Ent-labdanes from Mikania alvimii. Phytochemistry. 1982; 21(1):173-176. ISSN 0031-9422. [CrossRef].
80. Bohlmann F, Adler A, King RM, Robinson H. Germacranolides from Mikania grazielae. Phytochemistry. 1982a; 21(5):1169-1170. ISSN 0031-9422. [CrossRef].
81. De Souza JM, Taleb-Contini SH, De Oliveira DCR. Phytochemical study of Mikania pseudohoffmanianna G. M. Barroso ex W. C. Holmes. Rev Bras Cien Farm. 2006; 42(2):265-268. ISSN 1516-9332. [CrossRef].
82. Nascimento AM, Oliveira DCR. Kaurene diterpenes and other chemical constituents from Mikania stipulacea (M. Vahl) Willd. J Braz Chem Soc. 2001; 12:552-555. ISSN 0103-5053. [CrossRef].
83. Nascimento AM, Chaves JS, Albuquerque S, Oliveira DCR. Trypanocidal properties of Mikania stipulacea and Mikania hoehnei isolated terpenoids. Fitoterapia. 2004; 75:381-384. ISSN 0367-326X. [CrossRef].
84. Ferreira FP, Oliveira DCR. New constituents from Mikania laevigata Shultz Bip.ex Baker. Tetrahed Lett. 2010; 51:6856-6859. ISSN 0040-4039. [CrossRef].
85. Gregorio LE, Moraes SL, Pott A, Oliveira DCR. Chemical constituents of the ethanolic extract of Mikania parodii. Chem Nat Compounds. 2008; 44:512-51. ISSN 0009-3130. [Link].
86. Soares AP, Nascimento AM, Taleb-Contini SH, Oliveira DCR. Constituents of Mikania lasiandrae. Chem Nat Compounds. 2007; 43:708-709. ISSN 0009-3130. [Link].
87. Reis AA, Mendes CC, Ferraz TPL, Roque NF. Terpenes from Mikania hookeriana. Biochem Syst Ecol. 2003; 31:1061-1062. ISSN 0305-1978. [Link].
88. Díaz JG, Goedken VL, Herz W. Sesquiterpene lactones and other constituents of Mikania rimachii and Mikania microptera. Phytochemistry 1992; 31:597-602. ISSN 0031-9422. [CrossRef].
89. Wei X, Huang H, Wu P, Cao H, Ye W. Phenolic constituents from Mikania micrantha. Biochem Syst Ecol. 2004; 32:1091-1096. ISSN 0305-1978. [CrossRef].
90. Boeker R, Jakupovic J, Bohlmann F, Schmeda-Hirschmann G. Germacra-1,10Z,4E-dien-12, 8-α-olides from Mikania micrantha. Plant Med. 1987; 53:105-106. ISSN 1516-0572. [CrossRef].
91. Cuenca MDR, Bardon A, Catalan CAN. Sesquiterpene lactones from Mikania micrantha. J Nat Prod. 1988; 51:625-626. ISSN 0163-3864. [PubMed].
92. Jiang RW, He ZD, But PPH, Chan YM, Ma SC, Mak TCW. A novel 1:1 complex of potassium mikanin-3O-sulfate with methanol. Chem Pharm Bull. 2001; 49:1166-1169. ISSN 1347-5223. [CrossRef].
93. Huang H, Ye W, Wei X, Zhang C. Allelopathic potential of sesquiterpene lactones and phenolic constituents from Mikania micrantha H.B.K. Biochem Syst Ecol. 2009; 36:867-871. ISSN 0305-1978. [CrossRef].
94. Herz W, Santhanam PS. Isolation, structure and synthesis of 4',5,6,7-tetrahydroxy-3'-methoxyflavone (batatifolin), a new flavone from Mikania batatifolia DC. Tetrahed Lett. 1969; 39: 3419-3421. ISSN 0040-4039. [CrossRef].
95. Clifford MN, Marks S, Knight S, Kuhnert N. Characterization by LC-MS(N) of four new classes of p-coumaric acid-containing diacylchlorogenic acids in green coffee beans. J Agric Food Chem. 2006; 54:4095-4101. ISSN 0021-8561. [CrossRef].
96. Boyer J, Liu RH. Apple phytochemicals and their health benefits. Nutr J. 2004; 3:1-15. ISSN 0899-9007. [CrossRef].
97. Bonita JS, Mandarano M, Shuta D, Vinson J. Coffee and cardiovascular disease: in vitro, cellular, animal, and human studies. Pharmacol Res. 2007; 55:187-198. ISSN 1043-6618. [CrossRef].
98. Oliveira FD. Contribuição para o estudo botânico de Mikania hirsutissima DC. var. hirsutissima. II. Morfologia externa e anatomia da folha, flor, fruto e semente. Rev Farm Bioquim. 1972; 10:15-36. ISSN 0301-7052. [Link].
99. Ohkoshi E, Kamo S, Makino M, Fujimoto Y. Entkaurenoic acids from Mikania hirsutissima (Compositae). Phytochemistry. 2004; 65:885-890. ISSN 0031-9422. [CrossRef].
100. Dos Santos RR. Comparação de sistemas de cultivo convencional e orgânico na produção de cumarina em Mikania Glomerata Spreng. (Ssteraceae) e avaliação de genotoxicidade. Criciúma, 2018. Tese de doutorado. Universidade do Extremo Sul Catarinense.
101. Passari LMZG, Scarminio IS, Bruns RE. Experimental designs characterizing seasonal variations and solvent effects on the quantities of coumarin and related metabolites from Mikania laevigata. Anal Chim Acta. 2014; 821:89-96. ISSN 0003-2670. [CrossRef].
102. Almeida CL, Xavier RM, Borghi AA, Santos VF, Sawaya ACHF. Effect of seasonality and growth conditions on the content of coumarin, chlorogenic acid and dicaffeoylquinic acids in Mikania laevigata Schultz and Mikania glomerata Sprengel(Asteraceae) by UHPLC–MS/MS. Internat J Mass Spectr. 2017; 418:162–172. ISSN 1387-3806. [CrossRef].
103. Della Pasqua CSP, Iwamoto RD, Antunes E., Borghi AA, Sawaya ACHF, Landucci ECT. Pharmacological study of anti-inflammatory activity of aqueous extracts of Mikania glomerata (Spreng.) and Mikania laevigata (Sch. Bip. ex Baker). J. Ethnopharmacol. 2019; 231:50-56. ISSN 0378-8741. [CrossRef].
104. Aboy AL, Ortega GG, Petrovick PR, Langeloh A, Bassani VL. Atividade antiespasmódica de soluções extrativas de folhas de Mikania glomerata Sprengel (guaco). Acta Farm Bonaerense 2002; 21(3):185-191. ISSN 0326-2383. [Link].
105. Gonçalves CP, Yasuda FS, Dos Santos MA, Reis RD, Savino MI, Ribeiro W et al. Development and validation of an HPLC-DAD method for the determination of coumarin in syrups with guaco and critical analysis of drug labels. Am J Phytomed Clin Ther. 2017; 5(3):1-8. ISSN 2321-2748. [CrossRef]
106. Dos Santos TC, Tomassini TCB, Sanchez E, Cabral LM. Estudo da atividade antimicrobiana de Mikania glomerata Sprengel. XIV Simpósio de Plantas Medicinais do Brasil. Florianópolis, Brasil, 1996.
107. Baratto L, Lang KL, Vanz DC, Reginatto FH, Oliveira JB, Falkenberg M. Investigação das atividades alelopática e antimicrobiana de Mikania laevigata (Asteraceae) obtida de cultivos hidropônico e tradicional. Rev Bras Farmacogn. 2008; 18(4):577-582. ISSN 0102-695X. [CrossRef].
108. Duarte MCT, Figueira GM, Sartoratto A, Rehder VLG, Delarmelina C. Anti-candida activity of Brazilian medicinal plants. J Ethnopharmacol. 2005; 97:305-31. ISSN 0378-8741. [CrossRef].
109. Rios EM, Silva RZ, Silva MZ, Leal LF, Miguel OG, Cechinel Filho V. Atividade antibacteriana da Mikania lanuginosa DC (Asteraceae). XVI Simpósio de Plantas Medicinais do Brasil. Recife, Brasil, 2000.
110. Da Penha DAC, Hashimoto ET, Silva WRB, Nabas JMABB, Motizuki RS. Avaliação da atividade antimicrobiana de Mikania glomerata e da própolis utilizados no laboratório de fitoterápicos da FAI. Revista OMNIA Saúde, 2008. Acesso em: 22 abr. 29. [Link].
111. Brasileiro BG, Pizziolo VR, Raslan DS, Jamal CM, Silveira D. Antimicrobial and cytotoxic activities screening of some Brazilian medicinal plants used in Governador Valadares district. Rev Bras Ciênc Farm. 2006; 42:195-202. ISSN 1516-9332. [CrossRef].
112. Scio E. Cumarinas encontradas no gênero Kielmeyera Família Clusiaceae. Rev Bras Farmacogn. 2004; 85(1):27-31. ISSN 0102-695X.[CrossRef].
113. Moreira MR, Souza AB, Soares S, Bianchi TC, Eugênio DS, Lemes DC et al. Ent-Kaurenoic acid-rich extract from Mikania glomerata: In vitro activity against bacteria responsible for dental caries. Fitoterapia. 2016; 112:211–216. ISSN 0367-326X. [CrossRef].
114. Freitas TP, Silveira PC, Rocha LG, Rezin GT, Rocha J, Citadini-Zanette V et al. Effects of Mikania glomerata Sprengel and Mikania laevigata Schultz Bip. ex Baker (Asteraceae) extracts on pulmonary inflammation and oxidative stress caused by acute coal dust exposure. J Med Food. 2008; 11(4):761-766. ISSN 1096-620X. [CrossRef].
115. Lorenzi H, Matos FJA. Plantas medicinais no Brasil: nativas e exóticas. 2ª ed. Nova Odessa: Instituto Plantarum. 2008; 544p. ISBN 9788586714283.
116. Teske M, Trentini AMM. Herbarium compêndio de fitoterapia. 3ª ed. Curitiba: Herbarium. 1997. 317p. ISBN 91-944
117. Moura SR, Costa SS, Jansen JM, Silva CA, Lopes CS, Bernardo-Filho M et al. Bronchodilator activity of Mikania glomerata Sprengel on human bronchi and guinea-pig trachea. J Pharm Pharmacol. 2002; 54:249-256. ISSN 0022-3573. [PubMed].
118. Agra MF, Silva KN, Basílio IJLD, França PF, Barbosa-Filho JM. Survey of medicinal plants used in the region Northeast of Brazil. Rev Bras Farmacogn. 2008; 18:472-508. ISSN 0102-695X. [CrossRef].
119. Caribe J, Campos JM. Plantas que ajudam o homem. Ed. Cultrix, São Paulo. 319p, 1991.
120. Ali S, Islam S, Rahman M, Islam R, Sayeed MA. Antibacterial and cytotoxic activity of ethanol extract of Mikania cordata (Burm.F.) B.L. Robinson leaves. J Basic Clin Pharmacol. 2011; 2:103-107. ISSN 2191-0286. [PubMed].
121. Graça C, Baggio CH, Freitas CS, Rattmann YD, Souza LM, Cipriani TR et al. In vivo assessment of safety and mechanisms underlying in vitro relaxation induced by Mikania laevigata Schultz Bip. ex Baker in the rat trachea. J Ethnopharmacol. 2007; 112:430-439. ISSN 0378-8741. [CrossRef].
122. Leite MGR, Souza CL, Silva MAM, Moreira LKA, Matos FJA, Viana GSB. Estudo farmacológico comparativo de Mikania glomerata Spreng (guaco), Justicia pectoralis Jacq (anador) e Torresea cearensis Fr.All (cumarú). Rev Bras Farmacogn. 1993; 1:12-15. ISSN 0102-695X. [CrossRef].
123. Salgado HRN, Roncari AFF, Moreira RRD. Antidiarrhoeal effects of Mikania glomerata Spreng. (Asteraceae) leaf extract in mice. Rev Bras Farmacogn. 2005; 15:205-208. ISSN 0102-695X. [CrossRef].
124. Ghani A. Medicinal plants of Bangladesh. Asiatic Society of Bangladesh, 233, 1998. [Link].
125. Bishayee A, Chatterjee M. Protective effects of Mikania cordata root extract against physical and chemical factors-induced gastric erosions in experimental animals. Planta Med. 1994; 60:110-113. ISSN 1439-0221. [CrossRef].
126. Paul RK, Jabbar A, Rashid MA. Antiulcer activity of Mikania cordata. Fitoterapia. 2000; 71:701-703. ISSN 0367-326X. [CrossRef]
127. Mosaddik MA, Alam KMF. The anti-ulcerogenic effect of an alkaloidal fraction from Mikania cordata on Diclofenac sodium-induced gastrointestinal lesions in rats. J Pharm Pharmacol. 2000; 52:1157-1162. ISSN 0022-3573. [PubMed].
128. Bhattacharya S, Pal S, Chaudhuri AKN. Neuropharmacological studies on Mikania cordata root extract. Planta Med. 1988; 54:483-487. ISSN 1439-0221. [PubMed].
129. Dey P, Chandra S, Chatterjee P, Bhattacharya S. Neuropharmacological properties of Mikania scandes (L.) Willd. (Asteraceae). J Adv Pharmacol Technol Res. 2011; 2:255-259. ISSN 0976-2094. [CrossRef].
130. Oliveira F, Oga S, Akisue G, Akisue MK. Parâmetros físicos e químicos e efeito antiedema dos extratos fluidos de guaco (Mikania glomerata Sprengel) e de guaco de mato (Mikania laevigata Schutz Bip. ex Baker). An Farm Quím. 1985; 25:50-54. ISSN 0003-2441. [Link].
131. Peluso G, De Feo V, De Simone F, Bresciano E, Vuotto ML. Studies on the inhibitory effects of caffeoylquinic acids on monocyte migration and superoxide ion production. J Nat Prod. 1995; 58:639-649. ISSN 0163-3864. [PubMed].
132. Suyenaga ES, Reche E, Farias FM, Schapoval EES, Chaves CGM, Henriques AT. Antiinflammatory investigation of some species of Mikania. Phytother Res. 2002; 16:519-523. ISSN 1099-1573. [PubMed]
133. Arias AR, Ferro E, Inchausti A, Ascurra M, Acosta N, Rodriguez E, Fournet A. Mutagenicity, insecticidal and trypanocidal activity of some Paraguayan Asteraceae. J Ethnopharmacol. 1995; 45:35-41. ISSN 0378-8741. [PubMed].
134. Serrano SM, Nogal JJ, Diaz MRA, Escario JÁ, Fernández AR, Barrio AG. In vitro screening of American plant extracts on Trypanosoma cruzi and Trichomonas vaginalis. J Ethnopharmacol. 2000; 71:101-107. ISSN 0378-8741. [PubMed].
135. But PP-H, He Z-D, Ma S-C, Chan Y-M, Shaw P-C, Ye W-C et al. Antiviral constituents against respiratory viruses from Mikania micrantha. J Nat Prod. 2009; 72:925-928. ISSN 0163-3864. [PubMed].
136. Pereira BMR, Gonçalves LC, Pereira NA. Abordagem farmacológica de plantas recomendadas pela medicina folclórica como antiofídicas III. Atividade antidermatogênica. Congresso Brasileiro de Plantas Medicinais. Curitiba: Universidade Federal do Paraná, p. 1, 1992. [Link].
137. Maiorano VA, Marcussi S, Daher MAF, Oliveira CZ, Couto LB, Gomes AO et al. Antiophidian properties of the aqueous of Mikania glomerata. J Ethnopharmacol. 2005; 102:364-370. ISSN 0378-8741. [CrossRef].
138. Huang H, Ye W, Wu P, Lin L, Wei X. New sesquiterpene dilactones from Mikania micrantha. J Nat Prod. 2004; 67:734-736. ISSN 0163-3864. [PubMed].
139. Nicollier G, Thompson AC. Essential oil and terpenoids of Mikania micrantha. Phytochemistry. 1981; 20:2587-2588. ISSN 0031-9422. [CrossRef].
140. Ismail BS, Chong TV. Effects of aqueous extracts and decomposition of Mikania micrantha H.B.K. debris on selected agronomic crops. Weed Biol Man. 2002; 2:31-38. ISSN 1444-6162. [CrossRef].
141. Chaves DSA, Costa SS, De Almeida AP, Frattani F, Assafim M, Zingali RB. Metabólitos secundários de origem vegetal: uma fonte potencial de fármacos antitrombóticos. Quím Nova. 2010; 33(1):172-180. ISSN 0100-4042. [CrossRef].
142. Freitas TP, Silveira PC, Rocha LG, Rezin GT, Rocha J, Citadini-Zanette V et al. Effects of Mikania glomerata Sprengel. and Mikania laevigata Schultz Bip. ex Baker (Asteraceae) extracts on pulmonary inflammation and oxidative stress caused by acute coal dust exposure. J Med Food. 2008; 11(4):761-766. ISSN 1096-620X. [CrossRef].
143. Betoni JEC, Mantovani RP, Barbosa LN, Di Stasi LC, Fernandes Junior A. Synergism between plant extract and antimicrobial drugs used on Staphylococcus aureus diseases. Mem Inst Oswaldo Cruz. 2006; 101(4):387-390. ISSN 1678-8060. [PubMed].
144. Bueno PCP, Bastos JK. A validated capillary gas chromatography method for guaco (Mikania glomerata S.) quality control and rastreability: from plant biomass to phytomedicines. Rev Bras Farmacogn. 2009; 19(1B):218-223. ISSN 0102-695X. [CrossRef].
145. Vilegas JHY, Marchi E, Lanças FM. Determination of coumarin and kaurenoic acid in Mikania glomerata ("guaco") leaves by high resolution gas chromatography. Phytochem Anal. 1997; 8:74-77. ISSN 0958-0344. [CrossRef].
146. Taleb-Contini SH, Santos PA, Veneziani RCS, Pereira AMS, França SC, Lopes NP et al. Differences in secondary metabolites from leaf extracts of Mikania glomerata Sprengel obtained by micropropagation and cuttings. Rev Bras Farmacogn. 2006; 16(Supl.):596-598. ISSN 0102-695X. [CrossRef].
147. Do Amaral MPH, Vieira FP, Leite MN, Do Amaral LH, Pinheiro LC, Fonseca BG et al. Determinação do teor de cumarina no xarope de guaco armazenado em diferentes temperaturas. Rev Bras Farmacogn. 2009; 19(2B): 607-611. ISSN 0102-695X. [CrossRef].
148. Alvarenga FCR, Garcia EF, Bastos EMAF, Grandi TSM, Duarte MGR. Avaliação da qualidade de amostras comerciais de folhas e tinturas de guaco. Rev Bras Farmacogn. 2009; 19(2A):442-448. ISSN 0102-695X. [CrossRef].
149. Rufatto LC, Gower A, Schwambach J, Moura S. Genus Mikania: chemical composition and phytotherapeutical activity. Rev Bras de Farmacog. 2012; 22(6):1384-1403. ISSN 0102-695X. [CrossRef].
150. Silva LS, Da Silva LS, Brumano L, Stringheta PC, Pinto MAO, Dias LOM et al. Preparation of dry extract of Mikania glomerata Sprengel (guaco) and determination of its coumarin levels by spectrophotometry and HPLC-UV. Molecules. 2012; 17:10344-10354. ISSN 1420-3049. [PubMed].
151. Cappelaro EA, Yariwake JH. HS-SPME-GC-MS Analysis of volatile and semi-volatile compounds from dried leaves of Mikania glomerata Sprengel. Quím Nova. 2015; 38(3): 427-430. ISSN 0100-4042. [CrossRef].
152. Passari MZGL, Scarminiob IS, Marcheafaveb GG, Bruns RE. Seasonal changes and solvent effects on fractionated functional food component yields from Mikania laevigata leaves. Food Chem. 2019; 273:151-158. ISSN 0308-8146. [CrossRef].
153. Bertoldi FC, Deschamps FC, Silva Junior AA, Correa AF, Franco MF, Eberlin MN. Validação de um método analítico rápido por CLAE-UV para determinação de cumarina em guaco (Mikania glomerata Sprengel) confirmado com espectrometria de massas. Rev Bras Plantas Med. 2016; 18(Supl.1):316-325. ISSN 1516-0572. [Link].
154. Honório AC, Quaresma AS, Oliveira CT. Flora do Ceará, Brasil: Mikania (Asteraceae: Eupatorieae). Rodriguésia. 2019; 70:. ISSN 2175-7860. [CrossRef].
155. Gasparetto JC, De Francisco TMG, Campos FR, Pontarolo R. Development and validation of two methods based on high-performance liquid chromatography-tandem mass spectrometry for determining 1,2-benzopyrone, dihydrocoumarin, o-coumaric acid, syringaldehyde and kaurenoic acid in guaco extracts and pharmaceutical preparations. J Sep Sci. 2011; 34(7):740-748. ISSN 1615-9306. [CrossRef].
156. Moreti DLC, Leandro LF, Moraes TS, Moreira MR, Veneziani RCS, Ambrosio SR et al. Mikania glomerata Sprengel extract and its major compound ent-kaurenoic acid display activity against bacteria present in endodontic infections. Anaerobe. 2017; 47:201-208. ISSN 1075-9964 [CrossRef][PubMed].
157. Silva MG, Celeghini RMS, Silva MA. Effect of ethanol on the drying characteristics and on the coumarin yield of dried guaco leaves (Mikania laevigata Schultz Bip. Ex Baker). Braz J of Chem Eng. July/sept. 2018; 35(3):1095-1104. ISSN 0104-6632. [CrossRef][Link].