Artigo de Pesquisa
Atividade antimicrobiana de polifenóis isolados das folhas de Schinopsis brasiliensis (Engl.) guiado por bioautografia
Antimicrobial activity of polyphenols isolated from the leaves of Schinopsis brasiliensis (Engl.) guided by bioautography
Resumo
O extrato metanólico das folhas de Schinopsis brasiliensis apresentou atividade antimicrobiana com concentração mínima inibitória de 31,15 µg/mL frente Staphylococcus aureus, Staphylococcus epidermidis e Staphylococcus saprophyticus. A prospecção fitoquímica das folhas de Schinopsis brasiliensis (Engl.) guiado pelo método bioautográfico permitiu isolar duas moléculas (galato de metila - GM and β-1,2,3,4,6-Pentagaloil-D-Glicose - PGG), as quais apresentaram atividade antimicrobina frente S. aureus, Staphylococcus coagulase negativo e Enterococcus faecalis, com halos de ordem de 14 a 20 mm. Ainda, PGG apresentou atividade antimicrobiana frente Pseudomonas aeruginosa com halos da ordem de 21 mm e GM com halos de ordem de 17 a 18 mm frente Escherichia coli. Novos estudos, tais como a quantificação dos compostos antimicrobianos e identificação de outros metabólitos secundários das folhas de S. brasiliensis, são necessários pelos presentes resultados.
- Palavras-chave:
- β-1,2,3,4,6-Pentagaloil-D-Glicose.
- Staphylococcus aureus MRSA multirresistente.
- Pseudomonas aeruginosa.
- Bioautografia.
Abstract
The methanolic extract of the leaves of Schinopsis brasiliensis presented antimicrobial activity against Staphylococcus aureus, Staphylococcus epidermidis and Staphylococcus saprophyticus with minimum inhibitory concentration of 31.15 μg/mL. Phytochemical prospecting of Schinopsis brasiliensis (leaves) guided by the bioautographic method allowed to isolate two molecules (methyl gallate - GM and β-1,2,3,4,6-Pentagaloil-D-Glucose - PGG), which showed antimicrobial activity against S. aureus, coagulase-negativestaphylococci and Enterococcus faecalis with inhibition zones of 14 to 20 mm. Furthermore, PGG presented antimicrobial activity against Pseudomonas aeruginosa showed inhibition zone of 21 mm and GM showed inhibition zone of 17 to 18 mm against Escherichia coli. Further studies, such as quantification of antimicrobial compounds and identification of other secondary metabolites of leaves of S. brasiliensis are necessary due to the present results.
- Keywords:
- β-1,2,3,4,6-Pentagaloyl-D-Glucose.
- Staphylococcus aureus multiresistant MRSA.
- Pseudomonas aeruginosa.
- Bioautography.
Introdução
O crescimento da resistência bacteriana aos antibióticos é uma ameaça à população mundial. A multirresistência de bactérias virulentas e de alta prevalência nas infecções nosocomiais e comunitárias (Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, entre outras) [1] torna incerta a eficácia dos antimicrobianos. As recorrências nas doenças infecciosas causam prolongamento do tempo de internação hospitalar, bem como têm levado a mortes prematuras de várias pessoas. Por tudo isso, se faz necessário e essencial, a descoberta de novas classes de antimicrobianos, em particular, aquelas oriundos das plantas, que é uma fonte inesgotável de novas moléculas [2].
Schinopsis brasiliensis Engl. é popularmente conhecida por "braúna", "baraúna", "braúna-do-sertão" e "braúna-parda", "quebracho", "chamacoco" e "chamucoco" [3,4]. Na medicina popular são usadas das folhas, casca, caule, entrecasca, resina e fruto de S. brasiliensis como antiinflamatório em geral, gripe, febre, tosse, diarréia, disenteria, impotência sexual, fraturas [5-7], como antiséptico natural no tratamento de micoses superficiais e feridas [8].
Em estudo do extrato das folhas de S. brasiliensis por Saraiva [8] foi observada importante atividade antioxidante e alto teor de polifenóis. Também foi relatada boa atividade antimicrobiana frente cepas multirresistentes de Staphylococcus aureus e Pseudomonas aeruginosa, como as cepas de Staphylococcus coagulase negativo e menor atividade antimicrobiana frente às cepas de Enterococcus faecalis, Salmonella sp., Klebsiella pneumoniae, Escherichia coli, Candida albicans, Candida krusei e Candida tropicalis. Na planta tem sido identificado e/ou isolado a partir das folhas e caule de S. brasiliensis os seguintes metabolitos secundários: ácido gálico, galato de metila, quercetina, quercetina-3-O-β-D-xilopiranoside 5,6,7,8,3', 4'-hexahidroxiflavonol, 5,7,4',5'-tetrahidroxiflavon-3'-o-β-D-glicopiranosídeo, megastigmona, gallic acid 4-O-b-D-glucopyranoside, gallic acid 4-O-b-D-(60-Ogalloyl)-glucopyranoside, ethyl-O-b-D-(6'-O-galloyl)-glucopyranoside, 2-hydroxy-4-methoxyphenol, 2-hydroxy-4-methoxyphenol 1-O-b-D-(6'-O-syringoyl) - glucopyranoside , ácido elágico, 5,6,7,8,3',4'-hexahidroxi-flavonol, aquil e alquenil fenóis, b-sitosterol, estigmast-4en-3-ona, estigmast-4-em-ona-6-b-ol, entre outros [4,9-12].
A pesquisa dos componentes com propriedade antimicrobiana do extrato metanólico das folhas de Schinopsis brasiliensis tomou como indicador os fatores de retenção (Rf) destes, por meio da técnica bioautografica, referentes às zonas de inibição frente o inóculo de Staphylococcus aureus [2].
Material e Método
Químicos e reagentes
Os reagentes e solventes empregados neste estudo foram: ácido fórmico (Vetec), ácido acético glacial (Merck, 99,8%), n-hexano (Vetec, 99%), acetato de etila (Vetec, 99,5%), metanol (Vetec, 99,8%), dimetilsufoxido (Vetec, 99,9%), Tween 80 (Vetec), 2,3,5-cloridrato de trifeniltetrazólio (Sigma), 2-Aminoetildifenil borinato. Como padrões foram utilizados: ácido gálico (Sigma) e tetraciclina (Sigma).
Amostra vegetal e obtenção das frações
A amostra foliar de S. brasiliensis foi coletada na fazenda Cacimba Nova, localizada no município de Mirandiba/PE (08°07'13''S x 38°43'46''W, 450 m) no mês de março de 2008[13]. O material testemunho foi identificado pelo curador A. Bocage e incorporado ao herbário do Instituto Agronômico de Pernambuco (IPA), sob nº 70.007. As amostras foram estabilizadas durante três dias a 45 ± 5ºC em estufa e posteriormente pulverizadas em triturador, obtendo-se granulometria de 16 Mesh.
Os extratos foram obtidos por maceração fracionada com n-hexano, seguido por metanol, sendo descartada a fração hexânica. O extrato metanólico de S. brasiliensis (ExmSb) foi filtrado e evaporado (Marconi MA-120) sob pressão reduzida, obtendo rendimento de 26,27%. A escolha do metanol tem sido recomendada para a extração de compostos fenólicos em tecidos vegetais devido à sua capacidade de inibir a oxidação de polifenóis, que podem alterar a atividade antioxidante [14].
Linhagens microbianas
Os microrganismos utilizados nos ensaiados pertencem à coleção do Laboratório de Análises Microbiológicas do Departamento de Ciências Farmacêuticas da Universidade Federal de Pernambuco - Brasil (código: AM). Foram eles:
- Staphylococcus aureus: MRSA (Clone Epidêmico Brasileiro - AM858, AM793; Clone Pediátrico - AM642 e AM922; MSSA (AM632, AM672) e Padrão (AM103-ATCC 6538);
- Staphylococcus coagulase negativo (AM789), Staphylococcus saprophyticcus (AM245), Staphylococcus epidermidis (AM235), Staphylococcus sp. (AM109);
- Enterococcus faecalis (AM997; AM1056 - ATCC 51299);
- Pseudomonas aeruginosa (AM428; AM458; AM460; ATCC 14502 - AM206);
- Escherichia coli (AM161; AM167; AM251; AM247; AM1050 - ATCC 35218);
- Klebsiella pneumoniae (AM339; AM342; AM379; AM410);
- Salmonella spp. serotype Montevideo (AM1046; ATCC 8387 - AM149);
- ATCC – American Type Culture Collection.
Preparo dos inóculos
Os inóculos foram preparados a partir de culturas de 24 h em agar Mueller-Hinton (Himedia), e suspendidas em soro fisiológico estéril, ajustando a turvação dos inóculos a da escala 0,5 McFarland (108 UFC/ml) [15].
Método Bioautográfico
Na cromatografia em camada delgada (CCD) (GF254 - Merck), o extrato metanólico das folhas de Schinopsis brasiliensis na concentração de 20 mg/mL foi aplicado, tendo como fase móvel o sistema cromatográfico acetato de etila:ácido fórmico:ácido acético:água (100:3:3:3, v/v). As CCD foram eluídas em duplicata, sendo uma usada como referência cromatográfica (CCDa) e a segunda para bioautografia (CCDb).
Bioautografia
A CCDb ficou sob corrente de ar por 8 horas. Após esse período foi instalada numa placa de Petri e recoberta com 20 mL de meio fundido de ágar Mueller Hinton (Himedia®), inoculado com uma suspensão salina de S. aureus ATCC 6538 ou AM793 (108 UFC/ml)[[12]. Após solidificação do meio de cultivo, a placa foi incubada por 24 horas a 37±1ºC. Passado este período, a bioautografia foi revelada com uma solução de 2,3,5-trifeniltetrazólio (TTC) a 2,5 mg/mL e reincubada por 4 horas. A presença de zona de inibição indica a existência de compostos ativos [16].
Isolamento dos constituintes com potencial antimicrobiano das folhas
A prospecção de metabólitos secundários do extrato metanólico da folha de S. brasiliensis (ExmSb) deu partida com o particionamento de 40 g de ExmSb, que se iniciou com n-hexano, clorofórmio, acetato de etila, metanol (3 x 150 mL), obtendo-se, respectivamente as partições hexânica (ExmSb/PH), clorofórmica (ExmSb/PC), em acetato de etila (ExmSb/PAE) e finalmente a partição metanólica (ExmSb/PM). Das partições obtidas, a trabalhada foi a ExmSb/PAE, peso 16,17 g.
Isolamento de S1
A partir de 1 g da ExmSb/PAE fez-se cromatografia em coluna (CC) tendo como fase estacionária a Sephadex LH-20® e sistema eluente (acetona: triclorometano: metanol - 200:100:150, v/v), obtendo-se 102 frações com volume médio de 7 mL. Com as frações 82-102 (F1') (240 mg), fez-se nova CC tendo como fase estacionária Sephadex LH-20 e sistema eluente: (acetona:diclorometano:metanol-200:100:150, v/v), obtendo-se 25 frações, média de 10 mL de volume. A partir das frações F21-24 (F2') (146 mg) e seguindo-se os passos anteriores, obteve-se 15 frações, média de 10 mL de volume, observou o isolamento de S1 nas frações 7-13 (F3') (89 mg). Sendo realizadas análises espectrais (RMN 1H, RMN 13C, Cosy, HSQC, HMBC e Dept 135 - Bruker, modelo Avance DRX-500), cromatografia líquida acoplada ao espectrômetro de massas (Shimadzu LC-MS-IT-TOF) e Infravermelho com transformada de Fourier (IVTF Bruker® modelo IFS66) para elucidação estrutural.
Isolamento de S2
A partir de 1 g do ExmSb/PAE foi realizado o isolamento da molécula dois de polifenol em coluna cromatográfica, tendo como fase estacionária a Sephadex (LH-20), e como sistema eluente Acetona:Diclorometano:Metanol (200:100:150, v/v), obtendo-se 52 frações com volume médio de 10 mL. Seguiu-se nova coluna em Sephadex (LH-20), a partir das frações 22-26 (57 mg), e com novo sistema eluente (Acetona:Diclorometano: Metanol) na proporção de (150:100:150, v/v), onde obteve-se 39 frações, média de 10 mL, onde, na primeira fração (14,7 mg) evidenciou-se o isolamento da molécula (S2), quando foram realizado os espectros de RMN (1H e 13C) (Varian Unity Plus 300 MHz spectrometer) e determinação do comprimento de onda da molécula por varredura num espectrofotômetro UV-Visível (Agilent 8453 UV-Visible spectrophotometer).
Atividade Antimicrobiana
Os estudos se basearam em dois métodos de ensaios: medida do halo de inibição por técnica de poços/difusão em agar e concentração mínima inibitória (CMI) por diluição em ágar.
Preparação das soluções e diluições das frações
O extrato metanólico das folhas de S. brasiliensis (ExmSb) foi ressuspendido em dimetilsulfóxido (DMSO):água (20%, v/v) [17]. A diluição do extrato para determinação da Concentração Mínima Inibitória (CMI) foi 10 mg/mL (fator de diluição = 2) [8]. O antibiótico padrão foi tetraciclina (TET) (Sigma) nas concentrações de 0,31mg/ml a 640mg/ml (fator de diluição = 2).
Os metabólitos secundários isolados das folhas de Schinopsis brasiliensis foram solubilizados em solução aquosa de DMSO (20%, v/v) [17] nas concentrações de 750-6000 μg/mL, para S2 e de 250-2000 μg/mL, para S1 (fator de diluição = 2). O antimicrobiano controle foi a tetraciclina (300 mg/mL). Os controles negativos para ambas as técnicas (DMSO e Tween 80) foram preparados.
Determinação do Halo de Inibição
Após o semeio dos inóculos bacterianos em placas, com agar Mueller-Hinton, foram realizadas perfurações (6 mm de diâmetro) e aplicação dos produtos testes (100 µl por poço), nas concentrações de 75, 150, 300 e 600 µg / poço para o isolado S2 e de 25, 50, 100 e 200 µg / poço para o isolado S1. O antibiótico padrão foi tetraciclina (30 µg / poço). Em seguida, as placas foram incubadas a 37ºC ± 1 por 24 h [17]. Os ensaios foram realizados em duplicata.
Determinação da concentração mínima inibitória (CMI)
A avaliação da CMI foi determinada pela metodologia da microdiluição em caldo proposta pelo Clinical and Laboratory Standards Institute[15] modificada.
Microplacas estéreis com 96 orifícios foram utilizadas. Cada orifício recebeu 160 µL de meio de cultura líquido caldo Mueller-Hinton (Himedia), 20 µL do inóculo a 0.5 da escala McFarland (108 UFC/mL) e 20 µL das soluções de diferentes concentrações de ExmSb (31.25 a 1000.0 mg/mL). Como controles foram utilizados: 20 µL de soro fisiológico, 160 µL de caldo Mueller-Hinton e 20 µL do inóculo (controle de crescimento microbiano); 20 µL de soro fisiológico e 180 µL de caldo Mueller-Hinton (controle de esterilidade); solução aquosa de tetraciclina nas concentrações de 0.125 μg/mL a 64.0 μg/mL (controle positivo); 160 µL de meio de cultura líquido caldo Mueller-Hinton, 20 µL do inóculo a 0.5 da escala McFarland e 20 µL DMSO (40%, v/v) (controle negativo). As microplacas foram incubadas a 37±1ºC por 24 horas e, após esse período, foram adicionados 20 µL da solução aquosa de resazurina 0,2% como revelador.
Resultados e Discussão
A avaliação da atividade antimicrobiana de um extrato é determinada pela presença de metabólitos secundários com toxicidade as cepas microbianas. Estes compostos, contidos nas plantas e adquiridos por processos extrativos, são concentrados e testados frente estudos biológicos. A classificação quanto ao potencial antimicrobiana tomou como referência a classificação de Saraiva[8] - CMI < 100 µg/mL, muito ativo; CMI entre 100 e 500 µg/mL, ativo; CMI > 500 e ≤ 1000 µg/mL, moderadamente ativo; CMI > 1000 e ≤ 2000 µg/mL, pouco ativo; e aqueles com CMI > 2000 µg/mL, inativos.
Na determinação das CMI das folhas de S. brasiliensis (TABELA 1 e 2) foram observadas as menores CMI, classificadas como muito ativos[8], com valores de 31,25 µg/mL frente S. aureus e Staphylococcus (sp.) com valores de 500 µg/mL frente E. coli classificado como ativo.
| MIC - Bactérias Gram Positivas (AM) | ||||||||
| Produtos | Staphylococcus aureus | Staphylococcus2 | ||||||
| 1031 | 672 | 642 | 793 | 235 | 245 | 109 | 789 | |
| ExmSb (µg/mL) | 31,25 | 31,25 | 31,25 | 31,25 | 31,25 | 31,25 | 31,25 | 31,25 |
| Tet (µg/mL) | 16 | 2 | 1 | 1 | 0,5 | 0,5 | 0,25 | <0,062 |
| S. aureus: Staphylcoccus aureus; Tet: tetraciclina; 1,2: Os números abaixo de cada espécie são códigos de identificação que começa com as letras AM e são descritos em detalhe na secção Linhagens microbianas. | ||||||||
| CMI - Bactérias Gram Negativas (AM) | ||||||||||||||
| Produtos | E. coli | P. aeruginosa | K. pneumoniae | Salmonella | ||||||||||
| 10501 | 167 | 251 | 161 | 206 | 428 | 458 | 460 | 342 | 379 | 410 | 339 | 149 | 1046 | |
| ExmSb (µg/mL) | 500 | 500 | 500 | 500 | 1000 | 1000 | 1000 | 1000 | >1000 | >1000 | >1000 | >1000 | >1000 | >1000 |
| Tet (µg/mL) | 1 | 1 | 0,5 | 8 | 4 | 32 | 32 | 32 | 4 | 2 | >64 | 4 | 2 | 2 |
| E. coli: Escherichia coli; P. aeruginosa: Pseudomonas aeruginosa; K. pneumoniae: Klebsiella pneumoniae; Tet: tetraciclina; 1: Os números abaixo de cada espécie são códigos de identificação que começa com as letras AM e são descritos em detalhe na secção "Linhagens microbianas". | ||||||||||||||
No estudo bioautográfico observou-se três zonas de inibição, sendo compatível há pelo menos quatro compostos com potencial antimicrobiano frente às duas linhagens de Staphylococcus aureus (A: AM103 e B: AM793) testadas. Dois destes compostos (S1, Rf 0,1 e S2, Rf 0,71) foram isolados e suas estruturas elucidadas. O metabólito secundário S3 (Rf 0,60) foi identificado, presuntivamente, utilizando o ácido gálico (Sigma) como padrão de referência por cromatografia em camada delgada (CCD), já tendo sido isolado por Souza[9] e Moreira[10]. O quarto metabólito secundário (S4), observado no Rf 0,83, ainda não foi identificado (FIGURA 1).
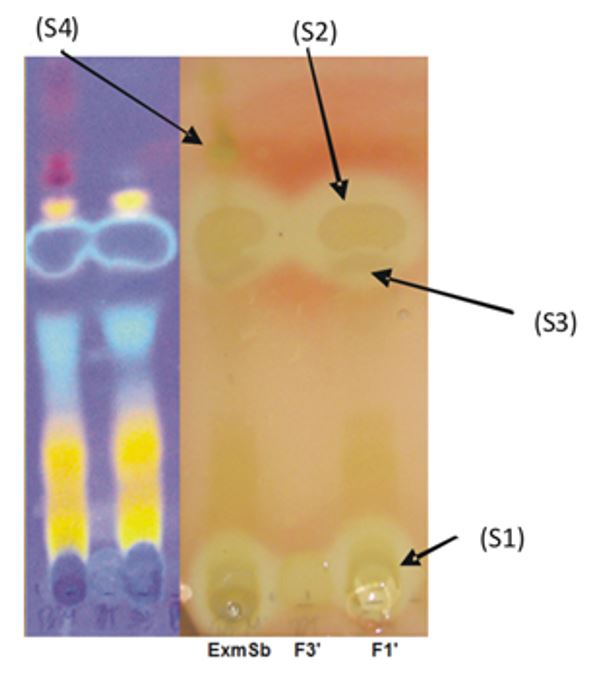
O fracionamento cromatográfico do extrato metanólico das folhas de S. brasiliensis, guiado por bioautografia, resultou no isolamento de dois compostos fenólicos: β-1,2,3,4,6-Pentagaloil-D-Glicose (PPG) ou β-1,2,3,4,6-Pentagaloil-D-piranose e galato de metila, cujas estruturas foram identificadas com base na análise dos dados espectrais por 13C e 1H RMN, com apoio do espectro de infravermelho e GC-MS, para S1 e determinação do comprimento de onda (λ) por varredura no espectrofotômetro de UV-visível e confirmados com os dados da literatura[9,19-21].
S1 - β-1,2,3,4,6-Pentagaloil-D-Glicose
O composto S1 apresentou-se como um pó amorfo de coloração esbranquiçada. Os dados obtidos por espectro de RMN 1H (500 MHz, CD3OD) foi caracterizado como uma substância do grupo dos taninos hidrolisáveis, devido a presença de singletos, referente a dois prótons 1H entre 6,91 e 7,12 ppm do espectro (6,91 ppm – H-2c, H-6c; 6,96 ppm – H-2e, H-6e; 6,98 ppm – H-2d, H-6d; 7,06 ppm – H-2b, H-6b; 7,12 ppm – H-2a, H-6a), magneticamente equivalentes nas posições C-2 e C-6 de cada anel aromático do galoil, grupo dos fenóis, e sete sinais de prótons alifáticos provenientes de uma porção de açúcar foram observados entre as regiões 4,3 à 6,3 ppm do RMN 1H. A ressonância do próton (1H) anomérico em 6,24 (C-1') e os sinais na região de próton (1H) 5,59 (C-2'); 5,91 (C-3'); 5,62 (C-4'); 4,42 (C-5'); 4,39-4,52 (C-6') em conjunto com as ressonâncias observada pelos RMN bidimensionais (2D) 1H -1H - COSY, 13C -1H - HSQC e HMBC, respectivamente, confirmaram a presença da unidade glicopiranose na estrutura de S1, sendo sua configuração β determinada com base na constante de acoplamento do próton anomérico (J = 8,4 Hz)[21].
O espectro de RMN 13C (125 MHz, CD3OD) e DEPT 135 de S1 mostrou trinta e um sinais representando quarenta e um carbonos, dos quais, cinco são carbonos alquilas terciário e um alquila secundário compondo a molécula da glicose. Dos trinta e cinco carbonos restantes, que fazem parte de cinco grupos galoil, tem-se trinta carbonos com hibridização sp2 (110,79 ppm [R'-C=R(2b), R'-C=R(6b)]; 110,50 ppm [R'-C=R(2c), R'-C=R(6c)]; 110,63 ppm [R'-C=R(2d), R'-C=R(6d)]; 110,54 ppm [R'-C=R(2a), R'-C=R(6a)]; 110,57 ppm [R'-C=R(2e), R'-C=R(6e)]; 146,67 ppm [R'-C=R(3b), R'-C=R(5b)]; 146,40 ppm [R'-C=R(3c), R'-C=R(5c)]; 146,49 ppm [R'-C=R(3d), R'-C=R(5d)]; 146,59 ppm [R'-C=R(3a), R'-C=R(5a)]; 146,55 ppm [R'-C=R(3e), R'-C=R(5e)], 140,92 ppm [R'-C=R(4b)], 140,27 ppm [R'-C=R(4c)], 140,45 ppm [R'-C=R(4d)], 140,15 ppm [R'-C=R(4a)], 140,50 ppm [R'-C=R(4e)]); (120,34 ppm [R'-C=R(1b)], 120,34 ppm [R'-C=R(1c)], 120,49 ppm [R'-C=R(1d)], 121,18 ppm [R'-C=R(1a)], 120,27 ppm [R'-C=R(1e)]) e cinco carbonos com hibridização sp2 (acila) (166,37 ppm [R,R'C=O(7b)], 168,08 ppm [R,R'C=O(7c)], 167,16 ppm [R,R'C=O(7d)], 168,55 ppm [R,R'C=O(7a)], 167,44 ppm [R,R'C=O(7e)]) (FIGURA 2)[19-21].

As atribuições completas de S1 foram confirmadas pelos RMN 2D COSY (1H-1H), HSQC e HMBC (13C-1H). Estas indicaram claramente que os sítios de acilação do núcleo da glicopiranose foram referentes às correlações de acoplamento (13C-1H) observadas no RMN HMBC (J2 e J3) entre prótons de glicopiranose e grupo carbonila de cada galoil correspondente, respectivamente 2H-6' acoplado com R,R'C=O (7a) (168,55 ppm); H-4' acoplado com R,R'C=O (7b) (166,37 ppm); H-3' acoplado com R,R'C=O (7c) (168,08 ppm); H-2' acoplado com R,R'C=O (7d) (167,16 ppm); H-1' acoplado com R,R'C=O (7e) (167,44 ppm) para cada unidade gálica (E, D, C, B e A) ligadas a glicopiranose, respectivamente em C-1, C-2, C-3, C-4 e C-6 (TABELA 3)[21, 22].
| Molécula Carbono | δ 1H | δ 13C | J2,3CH |
| Glicose | |||
| C1' | 6,24 d 8,4) | 93,96 | 1H-2'; 1H-5' |
| C2' | 5,59 dd (8,4/9,8) | 72,33 | 1H-3' |
| C3' | 5,91 dd (9,8/9,7) | 74,25 | 1H-4'; 1H1' |
| C4' | 5,62 dd (9,8/9,7) | 69,95 | 1H-3'; 1H-61',2' |
| C5' | 4,42 m | 74,54 | 2H-6a'; 6b' |
| C6' | 4,39 dd (4,0/12,4)1 | 63,26 | 1H-4' |
| 4,52 dd (11,5/12,4)2 | |||
| Anel Galoil A | |||
| C1a | 121,18 | 1H-2a; 1H-6a | |
| C2a | 7,12 s (a) | 110,54 | 1H-6a |
| C3a | 146,59 | 1H-2a | |
| C4a | 140,15 | 1H-2a; 1H-6a | |
| C5a | 146,59 | 1H-6a | |
| C6a | 7,12 s (a) | 110,54 | 1H-2a |
| C7a | 168,55 | 1H-2a; 1H-6a; 2H-61,2' | |
| Anel Galoil B | |||
| C1b | 120,37 | 1H-2b; 1H-6b | |
| C2b | 7,06 s (b) | 110,79 | 1H-6b |
| C3b | 146,67 | 1H-2b | |
| C4b | 140,92 | 1H-2b; 1H-6b | |
| C5b | 146,67 | 1H-6b | |
| C6b | 7,06 s (b) | 110,79 | 1H-2b |
| C7b | 166,37 | 1H-2b; 1H-6b; 1H-4' | |
| Anel Galoil C | |||
| C1c | 120,34 | 1H-2c; 1H-6c | |
| C2c | 6,91 s (c) | 110,50 | 1H-6c |
| C3c | 146,40 | 1H-2c | |
| C4c | 140,27 | 1H-2c; 1H-6c | |
| C5c | 146,40 | 1H-6c | |
| C6c | 6,91 s (c) | 110,50 | 1H-2c |
| C7c | 168,08 | 1H-2c; 1H-6c; 1H-3' | |
| Anel Galoil D | |||
| C1d | 120,49 | 1H-2d; 1H-6d | |
| C2d | 6,98 s (d) | 110,63 | 1H-6d |
| C3d | 146,49 | 1H-2d | |
| C4d | 140,45 | 1H-2d; 1H-6d | |
| C5d | 146,49 | 1H-6d | |
| C6d | 6,98 s (d) | 110,63 | 1H-2d |
| C7d | 167,16 | 1H-2d; 1H-6d; 1H-2' | |
| Anel Galoil E | |||
| C1e | 120,27 | 1H-2e; 1H-6e | |
| C2e | 6,96 s (e) | 110,57 | 1H-6e |
| C3e | 146,55 | 1H-2e | |
| C4e | 140,50 | 1H-2e; 1H-6e | |
| C5e | 146,55 | 1H-6e | |
| C6e | 6,96 s (e) | 110,57 | 1H-2e |
| C7e | 167,44 | 1H-2e; 1H-6e; 1H-1' | |
A massa molecular 940 de S1 foi determinada por GC-MS, sendo 940 [M-] (100); 887 [M- C4H5] (32); 770 [M-ácido gálico] (12); 635 [M-(OH)3-C6H2COO-(OH)2C6H2CO-] (50); 518 [M-ácido elágico (-H)-(OH)-C6H4CO-] (15), em intensidade moderada. No espectro de Infravermelho (IV) observou-se os grupamentos OH [3325, 964 cm-3], CH2 [2931, 2861 cm-3], C=C do Anel aromático [1609, 1534, 1448, 678 cm-3], carbonila [C=O] do éster [1698 cm-3], COO [1310, 1189 cm-3], CO [1091, 1025 cm-3], CH de um metileno [2931, 817, 758, 671 cm-3] [23,19].
S2 - Galato de Metila
No espectro de RMN (300 MHz) de 1H [DMSO-d6] observou-se um singleto em δH 6,93 ppm, com integral referente a dois prótons 1H, sendo um em C-2 e um em C-6 de um anel aromático. Um singleto em δH 3,74 ppm, com integral referente a três prótons 1H no C-8. Um singleto em δH: 9,19 ppm, correspondente a três hidrogênios relativos a três grupo hidroxila (3OH), cada uma ligada a um carbono sp2 nas posições C-3, C-4 e C-5 de anel aromático (fenol).
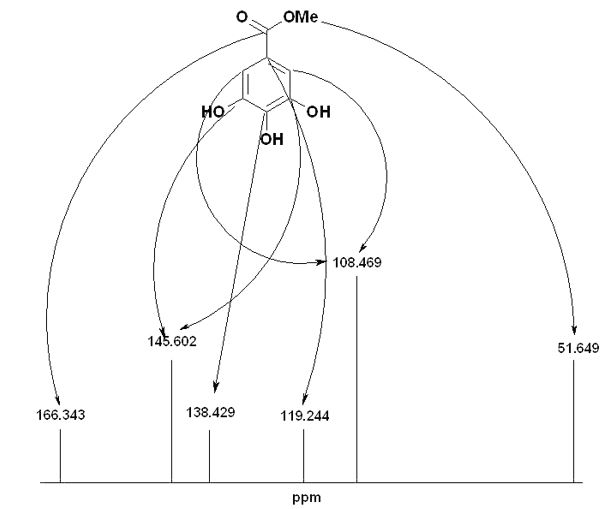
No RMN (75 MHz) de 13C [DMSO-d6] de S2 observaram-se seis carbonos com hibridização sp2 (145,60 ppm [R'-C=R(3), R'-C=R(5)]; 138,43 ppm [R'-C=R (4)]; 119,24 ppm [R'-C=R (1)]; 108,47 ppm [R'-C=R(2), R'-C=R(6)]), um carbono com hibridização sp2 (haleto de acila) (166,34 ppm [R,R'C=O(7)]) e um carbono com hibridização sp3 (alquila primário) (51,65 ppm [C-8, CH3]). O comprimento de onda (λ) de S2 foi 274 nm, que corresponde ao do galato de metila (FIGURA 3 e 4)[24].

Atividade antimicrobiana
No estudo da atividade antimicrobiana de S1 (β-1,2,3,4,6 - pentagaloil-D-glicose - PGG) isolado das folhas de S. brasiliensis frente a bactérias anteriormente ensaiadas para o ExmSb, onde observou-se halos de inibição da ordem de 18 mm (200 µg/poço) e de 14 mm (50 µg/poço), ativos, frente as cepas de S. aureus (ATCC 6538), de 16 mm (200 µg/poço) e 13 mm (50 µg/poço), ativos, frente S. saprophyticus e de 14 mm (200 µg/poço), ativo, e 12 mm (50 µg/poço), pouco ativo, frente cepas E. faecalis (AM997) (TABELA 4).
| S. aureus | Staphylococcus2 | E. faecalis | |||||||||
| Amostras | 1031 | 642 | 632 | 858 | 922 | 789 | 235 | 245 | 997 | 1056 | |
| PGG | 200 | 18* | 16 | 15 | 19 | 16 | 16 | 16 | 16 | 14 | 14 |
| 100 | 16 | 14 | 13 | 16 | 14 | 14 | 14 | 14 | 12 | 12 | |
| 50 | 13 | 12 | 12 | 14 | 12 | - | 12 | 13 | 10 | 10 | |
| 25 | 10 | 10 | 10 | 11 | 10 | - | 10 | 11 | - | - | |
| Tet* | 30 | 30 | 34 | 33 | 16 | 34 | 36 | 34 | 34 | - | - |
| S. aureus: Staphylcoccus aureus; E. faecalis: Enterococcus faecalis; *: µg/poço; Tet: Tetraciclina; 1,2: Os números abaixo de cada espécie são códigos de identificação que começa com as letras AM e são descritos em detalhe na secção "Linhagens microbianas"; -: Sem formação de Halo de inibição. | |||||||||||
Nos resultados da atividade antimicrobiana de PGG frente bactérias Gram negativas observou-se, com halos de inibição da ordem de 21 mm (200 µg/poço), muito ativo, e 14 mm (25 µg/poço), ativo, frente cepas de P. aeruginosa. Não foram observados halos de inibição nas concentrações ensaiadas frente E. coli e K. pneumoniae (TABELA 5).
| E. coli | P. aeruginosa | K. pneumoniae | |||||
| Amostras | 10501 | 247 | 460 | 428 | 339 | 379 | |
| PGG | 200 | - | - | 21* | 21 | - | - |
| 100 | - | - | 18 | 19 | - | - | |
| 50 | - | - | 16 | 16 | - | - | |
| 25 | - | - | 14 | 14 | - | - | |
| Tet* | 30 | 28 | 24 | 13 | 14 | 28 | 27 |
| E. coli: Escherichia coli; P. aeruginosa: Pseudomonas aeruginosa; K. pneumoniae: Klebsiella pneumoniae; *: µg/poço; Tet: Tetraciclina; 1: Os números abaixo de cada espécie são códigos de identificação que começa com as letras AM e são descritos em detalhe na secção "Linhagens microbianas"; -: Sem formação de Halo de inibição. | |||||||
Os resultados da atividade antimicrobiana do galato de metila (GM), molécula isolada das folhas de S. brasiliensis frente cepas Gram positivas e Gram negativas de interesse clínico, foram observados halos de inibição da ordem de 19 mm (600 µg/poço), muito ativo, de 12 mm (150 µg/poço) frente às cepas de S. aureus (ATCC 6538), pouco ativo. Halos de 20 mm (600 µg/poço), muito ativo, de 13 mm (150 µg/poço) frente a cepa de Staphylococcus coagulase negativo (AM789). Em relação E. coli (AM1050) o galato de metila obteve halos de 17 mm (600 µg/poço) e 14 mm (150 µg/poço), ativos [24]. Frente às cepas K. pneumoniae, P. aeruginosa e E. faecalis não foi observado halos de inibição nas concentrações ensaiadas (TABELA 6 e 7).
| S. aureus | Staphylococcus2 | E. faecalis | ||||||||
| Amostra | 1031 | 642 | 632 | 922 | 789 | 235 | 245 | 997 | 1056 | |
| GM | 600 | 19* | 17 | 19 | 17 | 20 | 17 | 16 | - | - |
| 300 | 17 | 13 | 15 | 14 | 16 | 13 | 14 | - | - | |
| 150 | 12 | - | 11 | - | 13 | - | 10 | - | - | |
| 75 | - | - | - | - | - | - | - | - | - | |
| Tet* | 30 | 31 | 28 | 28 | 28 | 35 | 28 | 29 | - | - |
| S. aureus: Staphylcoccus aureus; E. faecalis: Enterococcus faecalis; *: µg/poço; Tet: Tetraciclina; 1,2: Os números abaixo de cada espécie são códigos de identificação que começa com as letras AM e são descritos em detalhe na secção "Linhagens microbianas"; -: Sem formação de Halo de inibição. | ||||||||||
| E. coli | P. aeruginosa | K. pneumoniae | ||||||
| Amostra | 1611 | 1050 | 247 | 460 | 428 | 339 | 379 | |
| GM | 600 | 18* | 17 | 17 | - | - | - | - |
| 300 | 16 | 14 | 12 | - | - | - | - | |
| 150 | 13 | - | - | - | - | - | - | |
| 75 | - | - | - | - | - | - | - | |
| Tet | 30 | 26 | 27 | 26 | - | - | 20 | 22 |
| E. coli: Escherichia coli; P. aeruginosa: Pseudomonas aeruginosa; K. pneumoniae: Klebsiella pneumoniae; *: µg/poço; Tet: Tetraciclina; 1: Os números abaixo de cada espécie são códigos de identificação que começa com as letras AM e são descritos em detalhe na secção "Linhagens microbianas"; -: Sem formação de Halo de inibição. | ||||||||
A atividade antimicrobiana das várias frações de Schinopsis brasiliensis, aqui estudados, pode ser justificada pela alta presença de taninos nas espécies do gênero Schinopsis[26], inclusive na espécie de Schinopsis brasiliensis (Engl.), que também apresenta relevante concentração de flavonoides[8,27,28], entre estes quercetina. Ainda, ácidos fenólicos, como ácido gálico, galato de metila, ácido elágico[10,9,29,30] e sitosterol[11,31].
O β-1,2,3,4,6-Pentagaloil-D-Glicose (PGG) já tinha sido isolado antes na família Anacardiaceae, nas folhas de Schinus terebinthifolius Raddi. (aroeira)[32].
O proposto mecanismo de ação de PGG estaria relacionado na inibição da síntese de ácidos graxos das células bacterianas. Também é reladado que o PGG possuia propriedade antiviral, antidiabética[33], antiangiogenica in vitro e in vivo, que diminui a expressão da ciclooxigenase 2 (COX-2) e da densidade microvascularização e do fator de crescimento vascular, redução do crescimento tumoral e aumento da apoptose das células tumorais[34,35]. Os ácidos fenólicos (ácido elágico, ácido gálico e galato de metila) têm seu mecanismo de ação na modulação do potencial da membrana plasmática (MP) devido à acidificação na interface da MP, implicando distúrbios de bombas e canais proteicos de membrana, na complexação de íons metálicos, inibição de proteínas carreadoras de nutrientes e cofatores enzimáticos. Tudo isso leva a inibição do crescimento bacteriano, diminuição da resistência da bactéria aos agentes antimicrobianos podendo causar morte da célula bacteriana[29,36].
Conclusão
Os estudos com o extrato metanólico das folhas de Schinopsis brasiliensis proporcionaram isolar, guiado pelo método bioautográfico, dois metabólitos com potencial antimicrobiano: β-1,2,3,4,6-Pentagaloil-D-Glicose (PGG) e galato de metila (GM). Estes isolados apresentaram atividade antimicrobiana frente às cepas de S. aureus, Staphylococcus coagulase negativo. Ainda, apresentou boa atividade antimicrobiana frente P. aeruginosa e E. faecalis para PGG e frente E. coli para o GM. A atividade antimicrobiana de PGG frente às linhagens de S. aureus (uma ATCC 6538 - cepa padrão e outra AM858 - Clone Epidêmico Brasileiro multirresistente) sugere que os mecanismos de ação dos compostos isolados são diferentes daqueles, aos quais, as linhagens multirresistentes desenvolveram resistência, já que os halos observados foram equivalentes, em média, entre as cepas responsivas testadas, o que, em tese, revela uma janela de possibilidades para a pesquisa de um mecanismo de ação alternativo, vislumbrando o desenvolvimento de uma nova classe de antimicrobianos. Ainda, para novas pesquisas que quantifiquem os compostos com propriedade antimicrobiana das folhas de S. brasiliensis, como a identificação de outros metabólitos secundários e estudos de suas propriedades farmacológicas, são necessários os resultados apresentados.
Agradecimentos
Aos Professores Dr. Antônio Rodolfo de Faria (Laboratório de Síntese Orgânica Aplicada a Fármacos, Universidade Federal de Pernambuco, Recife, Brasil), Dr. Edilberto Rocha Silveira (Departamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, Fortaleza, Brasil) e Dr. Pedro José Rolim Neto (Laboratório de Tecnologia dos Medicamentos, Universidade Federal de Pernambuco, Recife, Brasil).
Referências
1. Singh AK, Venkatesh V, Singh RP, Singh M. Bacterial and antimicrobial resistance profile of bloodstream infections: A hospital-based study. J Health Res. 2014; 1(3):140-144. [CrossRef]
2. Saraiva AM, Saraiva CL, Gonçalves AM, Soares RR, Mendes FO, Cordeiro RP. Antimicrobial activity and bioautographic study of antistaphylococcal components from Caesalpinia pyramidalis Tull. Braz. J Pharm Sci. 2012; 48(1): 147-154. ISSN 2175-9790.
3. Prado MCG, Barbosa DCA, Alves JLH.Aspecto Morfo-Estruturais da Unidade de Dispersão de Schinopsis brasiliensis Engl. "Baraúna" (Anacardiaceae). Bol Soc Brot. Coimbra. 1995; 67(2): 187-197. ISSN 0081-0657.
4. Cardoso MP, David JM, David JP.A new alkyl phenol from Schinopsis brasiliensis. Nat Prod Res. 2005; 19(5):431-433. [CrossRef].
5. Albuquerque UP, Medeiros PM, Almeida ALS, Monteiro JM, Lins Neto EMF, Melo JG et al. Medicinal plants of the caatinga (semi-arid) vegetation of NE Brazil: A quantitative approach. J Ethnopharmacol. 2007; 114(3):325–354. [CrossRef].
6. Albuquerque UP. Re-examining hypotheses concerning the use and knowledge of medicinal plants: a study in the Caatinga vegetation of NE Brazil. J Ethnomed. 2006; 2:30. [CrossRef].
7. Almeida CFCBR, Silva TCL, Amorim ELC, Maia MBS, Albuquerque UP. Life strategy and chemical composition as predictors of the selection of medicinal plants from the Caatinga (Northeast Brazil). J Arid Environ. 2005; 62(1):127-142. [CrossRef].
8. Saraiva AM, Castro RHA, Cordeiro RP, Peixoto Sobrinho TJS, Castro VTNA, Amorim ELC et al. In vitro evaluation of antioxidant, antimicrobial and toxicity properties of extracts of Schinopsis brasiliensis Engl. (Anacardiaceae). Afr J Pharm Pharmacol. 2011; 5:1724-1731. ISSN 1996-0816.
9. Souza ON. Chemical Constituents of the Leaves of Schinopsis brasiliensis.1990. These of Phylosophy Doctor. The Polytechnic of North London, London. 207p.
10. Moreira BO. Estudo fitoquímico e avaliação da atividade antioxidante dos extratos hexânicos e diclorometânico das folhas de Schinopsis brasiliensis Engl. (Anacardeaceae). 2009. 103p. Dissertação de Mestrado. Instituto de Química. Universidade Federal da Bahia, Salvador. [Link].
11. Cardoso MP. Contribuição ao estudo fitoquímico de Schinopsis brasiliensis (Anacardiaceae). 2001. 106p. Dissertação de Mestrado. [Programa de pós-graduação em Química], Instituto de Química, Universidade Federal da Bahia, Salvador.
12. Santos CCS, Masullo M, Cerulli A, Mari A, Estevam CS, Pizza C, Piacente S. Isolation of antioxidant phenolics from Schinopsis brasiliensis based on a preliminary LC-MS profiling. Phytochem. 2017; 140:45-51. [CrossRef].
13. Brasil. MME (Ministério de Minas e Energia). Diagnóstico do município de Mirandiba. Disponível em: [Link]. Acesso em: 15 ago. 2019.
14. Yao L, Jlang Y, Datta N, Singanusong R, Liu X, Duan J. HPLC analyses of flavanols and phenolic acids in the fresh young shoots of tea (Camellia sinensis) grown in Australia. Food Chem. 2004; 84:253-263. [CrossRef].
15. CLSI - Clinical Laboratory Standards Institute. Metodologia dos testes de sensibilidade a agentes antimicrobianos por diluição para bactéria de crescimento aeróbico. 6ª ed. M7-A6. 2003; 23(2):49. [Link].
16. Pessini GL, Holetz FD, Sanches NR, Cortez DA, Dias Filho BP, Nakamura CV. Avaliação da atividade antibacteriana e antifúngica de extratos de plantas utilizadas na medicina popular. Rev Bras Farmacogn. 2003; 13(suppl.1):21-24. ISSN 0102-695X.
17. Sakagami Y, Linuma M, Piyasema KGNP, Dharmaratne HRW. Antibacterial activity of a-mangostin agins vancomycin resistant Enterococci (VRE) and synergism with antibiotics. Phytomedicine. 2005; 12(3):203-208. [CrossRef].
18. CLSI - Clinical Laboratory Standards Institute. Padronização dos testes de sensibilidade a antimicrobianos por disco-difusão – Norma M2-A8. 8ª ed. ANVISA/MS – CLSI, 2003. [Link].
19. Cho JY, Sohn MJ, Lee J, Kim WG. Isolation and identification of pentagalloylglucose with broad-spectrum antibacterial activity from Rhus trichocarpa Miquel. Food Chem. 2010; 123: 501-596. [CrossRef].
20. Cannell RJP, Farmer P, Walker JM. Purification and characterization of pentagalloylglucose, an α-glucosidase inhibitor/antibiotic from the freshwater green alga Spirogyra varians. Biochem J. 1988; 255:937-941. [CrossRef].
21. Söhretoglu D, Sakar MK, Sabuncuoglu SA, Özgünes H, Sterner O. Polyphenolic Constituents and Antioxidant Potential of Geranium stepporum Davis. Rec Nat Prod. 2001; 5(1):22-28. ISSN 1307-6167.
22. Beretta G, Artali R, Caneva E, Facino RM. Conformation of the tridimensional structure of 1,2,3,4,6-pentagalloyl-β-D-glucopyranose (PGG) by 1H NMR, NOESY and theoretical study and membrane interaction in a simulated phospholipid bilayer: a first insight. Magn Reson Chem. 2011; 49:132-136. [CrossRef].
23. Khanbabaee K, Lötzerich K. Efficient Total Synthesis of the Natural Products 2,3,4,6-Tetra-O-galloyI-D-glucopyranose, 1,2,3,4,6-Penta-O-galloyl-β-D-glucopyranose and the Unnatural 1,2,3,4,6-Penta-O-galloyl-α-D-glucopyranose. Tetrahedron. 1997; 53:10725-10732. [CrossRef].
24. Moura ACS, Vilegas W, Santos LC. Identificação de alguns constituintes químicos de Indigofera hirsuta linn. (Fabaceae) por CLAE-IES-EM (TOF) e avaliação da atividade antirradicalar. Quim Nova. 2011; 34(7):1136-1140. ISSN 0100-4042.
25. Alves TMA, Silva AF, Brandão M, Grand TSM, Smônia FA, Smânia Jr. A et al. Biological Screening of Brazilian Medicinal Plants. Rev Mem Inst Oswaldo Cruz. 2000; 95: 367-373. ISSN 1678-8060.
26. Roux DG, Paulus E. Condensed Tannins - The isolation and distribution of interrelated heartwood components of Schinopsis spp. Biochem J. 1961; 78:785-789. [PubMed].
27. Araújo TAS; Alencar NL; Amorim ELC; Albuquerque UP. A new approach to study medicinal plants with tannins and flavonoids contents from the local knowledge. J Ethnopharmacol. 2000; 120:72–80. [CrossRef].
28. Bylka W, Matlawska I, Pilewski NA. Natural Flavonoids as Antimicrobial Agents. J. Am Nutr Assoc. 2004; 7(2): 24-31. [Link].
29. Vatten DA, Shetty K. Biological functionality of ellagic acid: review. J Food Biochem. 2005; 29: 234-266. [CrossRef].
30. Akiyama H, Fuji K, Yamasaki O, Oono T, Iwatsuki K. Antibacterial action of several tannins against Staphylococcus aureus. J Antimicrob Chemother. 2001; 48:487-491. [CrossRef].
31. Virtuoso S, Davet A, Dias JFG, Cunico MM, Miguel MD, Oliveira AB, Miguel OG. Estudo preliminar da atividade antibacteriana das cascas de Erythrina velutina Willd., Fabaceae (Leguminosae). Rev Bras Farmacogn. 2005; 15: 137-142. ISSN 1981-528X
32. Carvalher-Machado SC, Rosas EC, Brito FA, Heringe AP, Oliveira RR, Kaplan MAC et al. The anti-allergic activity of the acetate fraction of Schinus terebinthifolius leaves in IgE induced mice paw edema and pleurisy. Int Immunopharmacol. 2008; 8: 1552–1560. [CrossRef].
33. Zhang J, Li L, Kim S, Hagerman AE, Lü J. Anti-cancer, anti-diabetic and other pharmacologic and biological activities of penta-galloyl-glucose. Pharm. Res., 2009; 26: 2066. [CrossRef].
34. Chai Y, Lee HJ, Shaik AA, Nkhata K, Xing C, Zhang J et al. Penta-O-Galloyl-β-D-glucose induces G1 arrest and DNA replicative S-phase arrest independently of P21 cyclin-dependent kinase inhibitor 1A, P27 cyclin-dependent kinase inhibitor 1B and P53 in human breast câncer cells and is orally active against triple-negative xenograft growth. Breast Cancer Res. 2010; 12: R67. [CrossRef].
35. Huh J, Lee E, Kim M, Kang S. Penta - O -galloyl-beta- D -glucose suppresses tumor growth via inhibition of angiogenesis and stimulation of apoptosis: roles of cyclooxygenase-2 and mitogen-activated protein kinase pathways. Carcinosenesis. 2005; 26(8): 1436-1445. [CrossRef].
36. Zaidi-Yahiaoui R, Zaidi F, Bessai AA. Influence of gallic and tannic acids on enzymatic activity and growth of Pectobacterium chrysanthemi (Dickeya chrysanthemi bv. chrysanthemi). Afr J Biotechnol. 2008; 7(4): 482-486. ISSN 1684-5315.