Artigo de Pesquisa
Estratégia de patenteamento de derivados de Cannabis sativa para obtenção da anuência prévia da ANVISA
Cannabis sativa derivatives patenting strategy for ANVISA's previous annuity
Resumo
O uso de Cannabis sativa de forma medicinal tem aumentado a cada ano, principalmente pela capacidade de proporcionar alívio imediato dos sintomas de problemas de saúde, tais como convulsões, depressão e insônia. A potencialidade dos fitocanabinoides da espécie para regulação da saúde mental e física tem sido comprovada por meio de estudos publicados em artigos científicos e patentes. O objetivo deste artigo é apresentar estratégias de patenteamento de produtos e processos à base de fitocanabinoides para obtenção da anuência prévia de pedidos de patentes, pela Agência Nacional de Vigilância Sanitária (ANVISA) e prosseguimento ao exame pelo Instituto Nacional da Propriedade Industrial (INPI). A busca foi realizada na base de dados do INPI, por meio de palavras-chaves Cannabis e fitocanabinoides. Foram triados os pedidos depositados no INPI e encaminhados para anuência prévia da ANVISA, no período de janeiro de 2018 a julho de 2019. Foram encontrados 87 documentos, sendo apenas 5 pedidos enviados para análise da ANVISA. Ficou demonstrado que as tecnologias pleiteadas estão entrando em domínio público pela não anuência da ANVISA e consequente arquivamento definitivo dos pedidos de patentes pelo INPI, o que pode acarretar em perda de informação e de oportunidades de mercado.
- Palavras-chave:
- Cannabis.
- Patente.
- Agência Nacional de Vigilância Sanitária.
- Instituto Nacional da Propriedade Industrial.
Abstract
The use of Cannabis sativa medicinally has increased every year, mainly for the ability to provide immediate relief of symptoms of health problems, such as seizures, depression and insomnia. The potential of phytocannabinoids of the species for regulation of mental and physical health has been proven through studies published in scientific articles and through patents. The aim of this paper is to present patenting strategies for phytocannabinoids products and processes to obtain prior approval of patent applications by the Brazilian Health Regulatory Agency (ANVISA) and further examination by Brazilian National Institute of Industrial Property (INPI). The search was performed in the INPI database, using the keywords Cannabis and phytocannabinoids. The applications filed with the INPI and sent to ANVISA for prior approval from January 2018 to July 2019 were screened. There were 87 documents, of which only 5 applications were submitted for analysis by ANVISA. It has been demonstrated that the technologies applied for are entering the public domain through the non-acceptance of ANVISA and consequent final filing of patent applications by INPI, which can lead to loss of information and market opportunities.
- Keywords:
- Cannabis.
- Patent.
- Brazilian Health Regulatory Agency.
- Brazilian National Institute of Industrial Property.
Introdução
A espécie Cannabis sativa é conhecida medicinalmente pela capacidade de proporcionar alívio imediato dos sintomas relacionados a problemas de saúde. Tais como convulsões, depressão e insônia. As comprovações de sua eficácia têm aumentado a cada ano, o que evidencia a potencialidade dos fitocanabinoides da espécie para regulação da saúde mental e física[1].
O canabidiol (CBD)[2] e o delta 9-tetrahidrocanabinol (THC)[3] foram isolados na década de 60, por Raphael Mechoulam, professor do Departamento de Química Medicinal e Produtos Naturais da Escola de Medicina da Universidade Hebraica de Jerusalém. A partir dos anos 90, o uso medicinal ganhou destaque após a descrição científica do sistema endocanabinoide como um sistema que modula vários processos fisiológicos e que se constitui em "alvo terapêutico" para o tratamento de condições patológicas, dentre elas crises convulsivas.
Com a descoberta dos fitocanabinoides canabidiol (CBD) e Δ9-tetraidrocanabidiol (THC), o sistema endocanabinoide pôde ser melhor compreendido, como o sistema constituído pelos receptores canabinoides CB1 e CB2, os endocanabinoides anandamida e 2-arachidonolil-glycerol e suas enzimas de síntese e degradação[4]. A ativação e/ou bloqueio destes receptores pelos fitocanabinoides, tais como THC, CBD, THCa (forma ácida do THC), CBDa (ácido canabidiólico), CBG (canabigerol) dentre outros mais de 100 fitocanabinoides, produz efeitos biológicos que podem trazer alívio para uma série de doenças relacionadas ao sistema biológico envolvido.
Os fitocanabinoides agem no Sistema Nervoso Central (SNC) por meio da ligação específica com um receptor de membrana celular denominado CB1. As maiores concentrações deste tipo de receptor foram encontradas nos gânglios da base (estruturas do cérebro relacionadas com os movimentos), no cerebelo, nos neurônios piramidais do hipocampo (envolvidos na formação de novas memórias, aprendizagem e emoções), no giro denteado e no córtex cerebral. A localização dos receptores pode ressaltar a relação existente entre algumas doenças que podem ser alvo terapêutico dos derivados fitocanabinoides. Por exemplo, a degeneração dos gânglios da base está relacionada à síndrome de Parkinson e a degeneração dos neurônios piramidais do hipocampo está relacionada à síndrome de Alzheimer. Por outro lado, os receptores CB1 estão ausentes, no tronco cerebral, bulbo (responsável pelas funções autônomas como, por exemplo, a respiração) e hipotálamo (responsável pelo equilíbrio das funções internas corporais e do ambiente), o que pode trazer certa segurança ao uso terapêutico e recreativo da Cannabis, uma vez que o risco de parada cardiorrespiratória induzida por fitocanabinoides é praticamente impossível.
É interessante assinalar que nos estados norte-americanos em que o uso medicinal (e mesmo o recreativo) foi legalizado, houve diminuição da prescrição de opioides, cujo vício é considerado um problema de saúde pública[5]. Outra pesquisa demonstrou que os estados que legalizaram o uso medicinal da maconha apresentaram 25% menos mortes por overdose de opioides, que têm um potencial de causar dependência muito maior do que a Cannabis, além de provocar efeitos colaterais desagradáveis, como problemas gastrointestinais [6]. Nove estados e o distrito federal norte-americano já legalizaram os usos medicinal e recreativo, e 20 outros estados legalizaram apenas o uso medicinal. No Brasil, não é permitido o cultivo de Cannabis, nem para fins medicinais nem para fins recreativos. Recentemente, em junho de 2019, a Agência Nacional de Vigilância Sanitária (ANVISA) abriu consulta pública para abordar requisitos técnicos e administrativos para o plantio de Cannabis para fins medicinais, mas apenas para pessoas jurídicas, ainda não havendo previsão acerca do cultivo doméstico.
Aspectos regulatórios
No Brasil, o estudo regulatório da Cannabis para uso medicinal vem avançando. Em 2015, a ANVISA simplificou o procedimento de importação de produtos à base de canabidiol, em associação com outros fitocanabinoides, dentre eles o tetrahidrocanabinol (THC), por pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado para tratamento de saúde, conforme Resolução da Diretoria Colegiada da ANVISA (RDC) nº 17/2015[7]. A autorização excepcional concedida pela ANVISA possui validade de um ano e, durante o período de validade desta autorização, para a importação dos quantitativos necessários, os pacientes ou responsáveis legais devem apresentar a prescrição médica com o quantitativo previsto para o tratamento, diretamente nos postos da ANVISA localizados nos aeroportos, para a internalização do produto no país.
Segundo a RDC nº 17/15, os produtos à base de canabidiol são industrializados e tecnicamente elaborados, constantes do Anexo I da referida RDC, atualizada pela RDC nº 128/16[8], que possuem em sua formulação o canabidiol em associação com outros fitocanabinoides, dentre eles, o THC (TABELA 1), não sendo registrados no país e, portanto, não possuindo eficácia e segurança avaliadas pela ANVISA.
| Nome do Produto | Nome da Empresa |
| Cibdex Hemp CBD Complex | Hemp Meds Px |
| Hemp Blend | Bluebird Botanicals |
| Real Scientific Hemp Oil (RSHO) CBD | Hemp Meds Px |
| Revivid Hemp Tincture | Revivid LLC |
| CBDRX CBD Oil | CBDRX |
| Charlotte Web Hemp Extract | CW Botanicals |
| Endoca Hemp Oil | Endoca |
| Elixinol Hemp Oil CBD | Elixinol |
| EVR Hemp Oil CBD | EVR |
| Mary's Elite CBD Remedy Oil | Mary's Nutritionals |
| Purodiol CBD | Purodiol Limited UK |
Em maio de 2017, a ANVISA atualizou a lista das Denominações Comuns Brasileiras (DCB) com a inclusão de 19 novas substâncias entre produtos biológicos, princípios ativos, excipientes e plantas de interesse da indústria farmacêutica. A atualização da lista DCB é uma rotina da ANVISA, mas a alteração chamou a atenção pela inclusão da Cannabis sativa. Essa inclusão não altera as regras para importação de medicamentos com canabidiol ou outros extratos da Cannabis. A medida também não é uma autorização ou reconhecimento da Cannabis como planta medicinal. Isso porque a DCB é uma lista de nomes oficiais para todas as substâncias que são ou podem vir a ser de interesse da indústria farmacêutica no Brasil e a designação de uma DCB para uma planta não implica em reconhecer que ela é planta medicinal, mas sim que ela tem potencial para ser planta medicinal, ser reconhecida e importada como planta medicinal ou, ainda, ser utilizada como insumo de um medicamento que receba registro.
As proibições fazem com que os pacientes tenham que importar os medicamentos. Em 2018, a ANVISA contabilizou 2.371 novos pedidos de licença para importação da substância e 1.242 revalidações. Já no primeiro trimestre de 2019, a agência permitiu que 885 brasileiros passassem a importar o canabidiol[9].
A burocracia e os altos custos financeiros da importação fazem com que muitos tenham que buscar o Poder Judiciário. Inicialmente, estes pacientes buscavam o Estado para que arcasse com as despesas de importação e de provimento de óleo com CBD ou THC. Foram obtidas decisões favoráveis, mas a demora agravava a situação de saúde dos pacientes. Em razão disso, foi adotada a estratégia do Habeas Corpus para o auto cultivo em que os pacientes buscam um salvo-conduto para plantar e extrair o óleo domesticamente. A ideia é respaldar o paciente para que não seja preso e para evitar que as plantas sejam apreendidas. Existem precedentes favoráveis apontando a omissão constitucional ao não garantir o direito à saúde e à dignidade da pessoa humana. Considerando que em muitas dessas demandas é a saúde de crianças que está em jogo, ainda se deve argumentar que o artigo 227 da Constituição atribui à família o dever de assegurar à criança o direito à vida e à saúde [10].
O único medicamento registrado no Brasil é o Mevatyl®, obtido a partir de extratos isolados da Cannabis que contêm como princípios ativos o tetraidrocanabinol (THC) e o canabidiol (CBD). Na época do registro, a planta ainda não constava na lista DCB. O tratamento varia no valor e na forma de obtenção dos ativos. Uma caixa com três frascos de spray de Mevatyl®, com 10 mL - suficiente para, cerca de, 45 dias de tratamento - pode custar um pouco menos de R$ 3 mil. Por importação, o custo mensal da terapia gira em torno de R$ 1.500,00.
O mercado de medicamentos feitos com a droga pode chegar a US$ 40 bilhões até 2023. Segundo estudo das consultorias New Frontier e Green Hub, o Brasil possui cerca de 3,4 milhões de pacientes que poderiam ser beneficiados por esse tipo de terapia, movimentando cerca de US$ 1,4 bilhão por ano. Mas, até dezembro de 2018, apenas 3.182 pessoas usavam legalmente medicamentos à base da planta no Brasil, ou seja, menos de 0,1% [11].
Propriedade intelectual de derivados de fitocanabinoides
Além das dificuldades advindas de conflitos éticos e sociais e dos requisitos regulatórios para comprovar a qualidade e eficácia dos medicamentos à base de Cannabis, a pesquisa e o desenvolvimento de produtos e processos para saúde à base de fitocanabinoides têm sofrido impacto também no patenteamento.
O art. 10, inciso IX, da Lei de Propriedade Industrial (LPI) brasileira, Lei nº 9.279/1996[12] define que:
Não se considera invenção nem modelo de utilidade: [...] (IX) o todo ou parte de seres vivos naturais e materiais biológicos encontrados na natureza, ou ainda que dela isolados, inclusive o genoma ou germoplasma de qualquer ser vivo natural e os processos biológicos naturais.
O art. 18, III, da LPI define que:
Não são patenteáveis: III - o todo ou parte dos seres vivos, exceto os microrganismos transgênicos que atendam aos três requisitos de patenteabilidade - novidade, atividade inventiva e aplicação industrial - previstos no art. 8º e que não sejam mera descoberta.
Assim, alguns pedidos de patentes de derivados de fitocanabinoides podem ser indeferidos por infringir tanto o artigo 10, IX, como o artigo 18, III, da LPI, por pleitear proteção para matérias tais como extratos de canabinoides per se, cultivares vegetais de espécies de Cannabis e variedades vegetais de espécies de Cannabis.
Adicionalmente, pedidos de patentes de derivados de espécies de Cannabis podem conter substâncias que apresentem risco à saúde, o que poderá levar ao seu arquivamento no INPI. Isso ocorre porque o exame de pedidos de patentes de interesse para a saúde apresenta um trâmite administrativo diferenciado dos demais setores, que inclui a anuência prévia da ANVISA para posterior análise de patenteabilidade pelo INPI. O artigo 229-C da LPI, incluído pelo artigo 1º da Lei nº 10.196/01, determina que a concessão de patentes de invenção aos pedidos referentes a produtos e processos farmacêuticos dependerá da prévia anuência da ANVISA[13]. A Portaria Conjunta INPI/ANVISA nº 1/17 [14] estipula, no seu artigo 2º que, realizado o exame formal pelo INPI, o procedimento para a concessão da prévia anuência será iniciado após o requerimento do pedido de exame, de acordo com o artigo 33 da LPI. Assim, o INPI publica a notificação de encaminhamento dos pedidos de patente para a ANVISA na Revista Eletrônica da Propriedade Industrial (RPI) e, quando aplicável, as decisões sobre a priorização de exame. O procedimento administrativo relativo à prévia anuência da ANVISA foi estabelecido pela RDC nº 168/17[15].
Ficou definido na Portaria Conjunta nº 1/17 que o INPI deve encaminhar oficialmente para a ANVISA uma lista dos pedidos de patentes, concomitantemente à publicação do encaminhamento para a agência, ou da concessão do exame prioritário, na RPI. O artigo 4º define que após recebimento dos pedidos de patente encaminhados pelo INPI, a ANVISA analisará tais pedidos à luz da saúde pública, mediante decisão consubstanciada em parecer técnico emitido pela unidade organizacional competente no âmbito da agência. Considera-se que o pedido de patente será contrário à saúde pública quando o produto ou o processo farmacêutico contido no mesmo apresentar risco à saúde. No contexto da portaria, o risco à saúde será caracterizado quando o produto farmacêutico compreender, ou o processo farmacêutico resultar em substância cujo uso tenha sido proibido no país. Quando a análise da ANVISA concluir pela não anuência, o pedido será encaminhado ao INPI, que publicará a denegação da anuência e o arquivamento definitivo na RPI. O resumo das principais etapas do trâmite administrativo de pedidos de patentes de produtos e processos farmacêuticos no INPI e na ANVISA pode ser visualizado na FIGURA 1, abaixo.
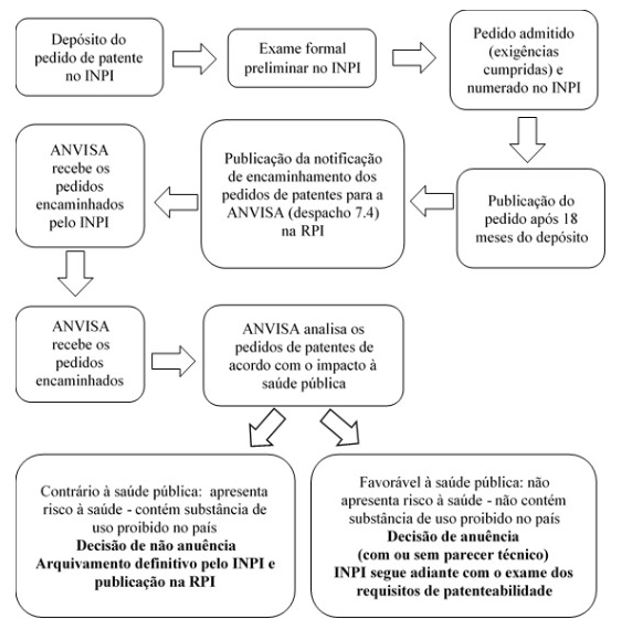
No contexto da análise de pedidos de patente de produtos e processos farmacêuticos à luz da saúde pública, a Orientação de Serviço nº 51/18[16] DIARE/ANVISA foi publicada para detalhar os parâmetros para exame dos pedidos de patentes com esse propósito. O risco à saúde pública, previsto no artigo 4º da RDC nº 168/17 será caracterizado quando o produto farmacêutico compreender, ou o processo farmacêutico resultar, em substância presente na Lista E (Lista de plantas proscritas que podem originar substâncias entorpecentes e/ou psicotrópicas) ou na Lista F (Lista das substâncias de uso proscrito no Brasil), da Portaria SVS/MS 344/98[17], que trata de plantas e substâncias, incluindo seus sais e isômeros, de uso proibido no Brasil. O artigo 61, da Portaria SVS/MS 344/98 define que as plantas constantes da Lista E (plantas que podem originar substâncias entorpecentes e/ou psicotrópicas) e as substâncias da Lista F (substâncias de uso proscrito no Brasil), deste regulamento técnico e de suas atualizações, não poderão ser objeto de prescrição e manipulação de medicamentos alopáticos e homeopáticos.
A espécie Cannabis sativa é a primeira espécie da lista de plantas que podem originar substâncias entorpecentes e/ou psicotrópicas, conhecida como Lista E, que inclui, ainda, seus sais e isômeros. Na lista F, o derivado presente é o tetraidrocanabinol, conhecido como THC.
Conforme mencionado, a pesquisa e o desenvolvimento de produtos e processos para saúde à base de fitocanabinoides podem sofrer entraves adicionais no patenteamento, uma vez que a análise da ANVISA de substâncias que acarretem risco à saúde pública pode determinar o arquivamento dos pedidos de patentes pelo INPI.
Neste contexto, o objetivo deste artigo é apresentar estratégias de patenteamento de produtos e processos à base de fitocanabinoides para obtenção da anuência prévia de pedidos de patentes pela ANVISA e prosseguimento do exame pelo INPI.
Metodologia
Foi realizado um mapeamento de pedidos de patentes no INPI contendo as palavras-chaves Cannabis ou fitocanabinoides(s) no título ou resumo, uma vez que não é possível a busca no quadro reivindicatório. Essa busca foi efetuada sem data limite de depósito e os resultados excluem os pedidos não publicados, devido ao prazo de sigilo de 18 meses, previsto na LPI.
Adicionalmente, foi realizado um mapeamento dos pedidos de patentes contendo fitocanabinoides, depositados no INPI e encaminhados para anuência prévia da ANVISA, no período de janeiro de 2018 a 30 de junho de 2019.
A busca foi realizada, por meio de palavras-chaves (Cannabis, fitocanabinoides)na base de dados do INPI (www.inpi.gov.br) e na base de dados MAP (Mapeamento Anuência Prévia) (www.abifina.org.br), da Associação Brasileira das Indústrias de Química Fina, Biotecnologia e suas Especialidades (ABIFINA).
Foi elaborada uma planilha em Excel com a triagem dos documentos de interesse e, posteriormente, para cada pedido de patente verificou-se o último despacho emitido pelo INPI e seu respectivo andamento administrativo. Como o objetivo do artigo foi mapear os pedidos contendo derivados de Cannabis que já tivessem sido enviados para análise sobre risco à saúde pela anuência prévia da ANVISA, o critério de exclusão foi de pedidos de patentes que tivessem sido enviados e analisados pela área de propriedade intelectual da ANVISA. Os pedidos de patentes foram analisados quanto ao conteúdo do quadro reivindicatório, que inclui as matérias que o requerente está tentando proteger, e pela análise dos pareceres de exigência e de não anuência da ANVISA.
Resultados e Discussão
Na busca geral de pedidos de patentes, depositados no INPI, contendo Cannabis ou fitocanabinoides no título e/ou resumo, encontrou-se 87 pedidos de patentes. Desses documentos encontrados, alguns não entraram no escopo de avaliação da ANVISA, como, por exemplo, os pedidos de patentes de melhoramento vegetal, outros ainda não foram encaminhados para anuência prévia e outros foram para anuência antes da Portaria Conjunta nº 1/17 entrar em vigor.
Na busca realizada, de triagem da ANVISA, foram encontrados 16 pedidos de patentes encaminhados à agência, no período de janeiro de 2018 a julho de 2019, considerados contrários à saúde pública por conterem substâncias proibidas no país. Dos documentos contrários à saúde pública, 5 pedidos de patentes incluíam, nos respectivos quadros reivindicatórios, derivados de Cannabis sp. (BR0518011-2, BR0821461-2, BR0910094-6, BR112013018253-9 e BR112013029773-5), os quais são analisados abaixo.
O pedido de patente BR0518011-2, depositado em 15.11.2005 pela empresa GW Pharma, pleiteia proteção para uso de um ou mais fitocanabinoides, preferencialmente a tetrahidrocanabirina (THCV) para fabricação de medicamentos para uso no tratamento de doenças e condições que se beneficiam do antagonismo neutro do receptor de canabinoide CB como, por exemplo, esquizofrenia, epilepsia e Alzheimer. O requerente foi cientificado pela ANVISA em 03.10.2018 (Parecer 321/18) de que todas as reivindicações compreendiam o uso de substâncias proscritas no Brasil, sendo apenas os compostos derivados dos fitocanabinoides canabidiol (CDB) e tetrahidrocanabidiol (THC) não eram considerados proscritos no Brasil, desde que observadas as condições estabelecidas na RDC nº 227/18[18]. Não houve manifestação do requerente e a ANVISA entendeu pela não concessão da anuência ao pedido de patente. A notificação de não concessão da anuência prévia foi publicada na RPI nº 2530, de 02.07.2019 e, o pedido será arquivado definitivamente.
O pedido de patente BR0821461-2, depositado em 17.12.2008 pela empresa GW Pharma (GB), solicita proteção para uso de fitocanabinoides que incluem a tetrahidrocanabivarina (THCV) e o canabidiol (CBD) em conjunto com um medicamento antipsicótico como o aripiprazol e a formulação farmacêutica contendo o fitocanabinoide e o aripiprazol. O pedido ainda reivindica método de tratamento ou prevenção de psicose por meio do medicamento. A ANVISA apontou a presença da substância tetraidrocanabivarina (Parecer 145/19), substância relacionada entre aquelas proibidas no país, o que torna não patenteável a invenção, de acordo com o artigo 18, I, da LPI. Apesar de o requerente ter sido cientificado pela agência em 15.03.2019, não foi apresentada manifestação ao parecer dentro do prazo. O parecer da ANVISA ainda não foi publicado, porém o pedido de patente será arquivado pelo INPI.
O pedido de patente BR0910094-6, depositado em 26.03.2009 pela empresa Stichting Sanammad (NL), pleiteia proteção para composição de goma de mascar para tratamento da dor. O quadro reivindicatório originalmente depositado possuía 12 reivindicações, sendo 8 de composição, 3 de uso da composição para alívio da dor e 1 reivindicação de embalagem. Neste processo administrativo, a ANVISA deu ciência ao requerente em 09.04.2018 (Parecer 086/18) informando que as substâncias fitocanabinoides e seus derivados, em especial o THC, contidas nas composições pleiteadas, estariam relacionadas entre as substâncias proibidas no país, de acordo com a Lista E e F da Portaria SVS/MS nº 344/1998, o que tornaria parte da invenção não patenteável por ser contrária à saúde pública, nos termos do art. 18, I, da LPI. Foi feita exigência para que o quadro reivindicatório fosse reformulado, de forma a excluir composições contendo substâncias proscritas. Em 07.06.2018, a requerente apresentou manifestação com novo quadro reivindicatório excluindo a substância THC. Entretanto, a ANVISA concluiu que a requerente não atendeu à exigência, pois manteve o termo "canabinoide ou derivado do mesmo" que engloba uma série de substâncias ainda presentes na Lista F mencionada acima. O parecer da ANVISA foi pela denegação da anuência ao pedido de patente. Apesar de o parecer da ANVISA ainda não ter sido publicado na homepage do INPI, o pedido de patente será arquivado, conforme determinado pela Portaria Conjunta nº 01/2017.
O pedido de patente BR112013018253-9, depositado em 18.01.2012 pela empresa Claremont Collection Handelsgesellschaft e Gallathea Ute (DE), pleiteia proteção para método de obtenção de suco de cânhamo (Cannabis sativa)e uso do suco de cânhamo para produção de bebidas que podem ser utilizadas na fabricação de cremes e géis para fins médicos, tais como cicatrização de feridas ou eczemas da pele. A ANVISA emitiu parecer em 26.03.2018 (Parecer 079/18), apontando que o quadro reivindicatório continha produtos produzidos a partir de planta proscrita no Brasil, de acordo com a Lista E da Portaria SVS/MS nº 344/1998. O requerente não apresentou manifestação e, em virtude da ausência de resposta do requerente, a ANVISA concluiu pela não concessão da anuência ao pedido de patente. A notificação de não anuência foi publicada na RPI nº 2508, de 29.01.2019 e o pedido foi arquivado definitivamente em 02.04.2019.
O pedido de patente BR112013029773-5, de titularidade das empresas GW Pharma e Otsuka Pharmaceutical, depositado em 18.05.2012, pleiteia proteção para fitocanabinoides que incluem canabigerol (CBG), canabicromeno (CBC), canabidivarina (CBDV) ou tetra-hidrocanabivarina (THCV) para tratamento de dor neuropática. A ANVISA cientificou o requerente em 04.06.2018 (Parecer 196/18) de que o quadro reivindicatório continha substâncias obtidas de plantas proscritas, de acordo com a Lista E da Portaria SVS/MS nº 344/1998, que tornavam a invenção não patenteável, por ser contrária à saúde pública, nos termos do art. 18, I, da LPI. O requerente não apresentou qualquer manifestação ao parecer dentro do prazo e a ANVISA concluiu pela não concessão da anuência ao pedido de patente. O parecer de não anuência da ANVISA foi publicado na RPI nº 2518, de 09.04.2019 e, o pedido de patente será arquivado, conforme determinado pela Portaria Conjunta 01/2017.
Conforme explicitado acima, todos os pedidos contendo substâncias proscritas no Brasil receberam notificações da ANVISA solicitando restrição do quadro reivindicatório às substâncias não proibidas como tetrahidrocanabidiol (THC) e canabidiol (CBD) e nenhum requerente se manifestou adequadamente. O requerente do pedido de patente BR0910094-6, a empresa Stichting Sanammad (NL), poderia ter se manifestado restringindo a goma de mascar às substâncias permitidas por meio da RDC nº 227/2018, tais como tetrahidrocanabidiol ou canabidiol, ambos em concentração máxima de 30 mg/ml. A empresa restringiu o quadro reivindicatório, porém manteve o termo "canabinoides ou derivados dos mesmos", o qual não foi aceito por aumentar o escopo de proteção aos derivados não permitidos. Os demais requerentes poderiam ter se manifestado, restringindo o escopo de proteção, porém não apresentaram suas manifestações, levando ao arquivamento dos respectivos pedidos de patentes.
Conclusão
A análise dos processos administrativos de pedidos de patentes solicitando proteção para produtos ou processos contendo fitocanabinoides e derivados dos mesmos demonstrou que a maioria dos documentos ainda será encaminhada para anuência prévia da ANVISA. Dentre os encaminhados após a Portaria Conjunta 01/17, ficou demonstrado que as tecnologias pleiteadas estão entrando em domínio público pela não anuência da ANVISA e consequente arquivamento definitivo dos pedidos de patentes pelo INPI. O arquivamento definitivo pode estar ocorrendo por ausência de correspondência entre os escritórios de Propriedade Intelectual no Brasil e os requerentes (todos estrangeiros) ou por desconhecimento da legislação regulatória brasileira que contém as substâncias proibidas no Brasil.
Neste contexto, a questão mais problemática é a entrada em domínio público de tecnologias pleiteadas por ausência de manifestação para adequação. Essas tecnologias podem ser inovadoras, mas agora estão sem proteção no país e, infelizmente, o Brasil não possui uma estratégia usual de prospecção tecnológica que possa usufruir de tecnologias não protegidas para gerar inovações.
As empresas e instituições de pesquisa e desenvolvimento que desejarem proteger invenções, contendo derivados de Cannabis sativa, devem estar atentas às legislações brasileiras, tanto as regulatórias como as de propriedade intelectual. E mais ainda, devem estar atentas às notificações enviadas pela ANVISA para restrição de escopo de reivindicações às substâncias permitidas no Brasil.
Referências
1. Stith SS, Vigil JM, Brockelman F, Keenan K, Hall B. Patient-reported symptom relief following medical cannabis consumption. Fron Pharmacol. 2018; 9: 916. ISSN 2168-6114. [CrossRef].
2. Mechoulam R, Shvo Y. The structure of cannabidiol. Tetrahedron. 1963; 19(12):2073-2078. Pergamon Prem Ltd. Printed in Northern Ireland. [CrossRef] [PubMed].
3. Gaoni Y, Mechoulam R. Isolation, Structure, and Partial Synthesis of an Active Constituent of Hashish. J Am Chem Soc. 1964; 86(8):1646-1647. [CrossRef].
4. Devane WA, Hanus L, Breuer A. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Sci. 1992 Dec 18; 258(5090):1946-1949. ISSN 1095-9203. [CrossRef] [PubMed].
5. Hill KP, Saxon AJ. The Role of Cannabis Legalization in the Opioid Crisis. JAMA Intern Med. 2018; 178(5): 679-680. ISSN 2168-6114. [CrossRef] [PubMed].
6. Bachhuber MA, Saloner B, Cunningham CO, Barry CL. Medical Cannabis Laws and Opioid Analgesic Overdose Mortality in the United States, 1999-2010. JAMA Intern Med. 2014; 174(10):1668-1673. ISSN 2168-6114. [CrossRef] [PubMed].
7. Brasil. Agência Nacional de Vigilância Sanitária - ANVISA. Resolução da Diretoria Colegiada (RDC) nº 17, de 06 de maio de 2015. Define os critérios e os procedimentos para a importação, em caráter de excepcionalidade, de produto à base de Canabidiol em associação com outros canabinóides, por pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado, para tratamento de saúde. Diário Oficial União. 8 mai. 2015. [Link].
8. Brasil. Agência Nacional de Vigilância Sanitária - ANVISA. Resolução da Diretoria Colegiada (RDC) nº 128 de 02 de dezembro de 2016. Dispõe sobre a atualização do Anexo I (Produtos à base de Canabidiol em associação com outros canabinóides, dentre eles o THC, em conformidade com o capítulo I - seção II da Resolução da Diretoria Colegiada - RDC nº 17, de 6 de maio de 2015. Diário Oficial União. 5 dez. 2016. [Link].
9. Cunha J, Soprana P. ANVISA dá primeiro passo para regular plantio de maconha no Brasil. Folha de São Paulo. 04 jun. 2019. [Link].
10. Lambert L, Martins, L. O Poder Judiciário como balcão de direitos: reflexões sobre as estratégias jurídicas para a garantia do uso medicinal da maconha. Rev Dep Ciên Sociais – PUC Minas. 2018; 1(1):190-207. [Link].
11. Araujo T. Maconha medicinal impulsiona indústria bilionária. Valor Econômico. 22 fev. 2019. [Link].
12. Brasil. Instituto Nacional de Propriedade Industrial – INPI, Lei nº 9.279 de 14 de maio de 1996. Regula direitos e obrigações relativos à propriedade industrial. Diário Oficial União. 15 mai. 1996. [Link].
13. Brasil. Agência Nacional de Vigilância Sanitária - ANVISA. Lei nº 10.196 de 14 de fevereiro de 2001. Altera e acresce dispositivos à Lei no 9.279, de 14 de maio de 1996, que regula direitos e obrigações relativos à propriedade industrial, e dá outras providências. Diário Oficial União. 16 fev. 2001. [Link].
14. Brasil. Ministério da Saúde. Portaria Conjunta nº 1 de 12 de abril de 2017. Regulamenta os procedimentos para a aplicação do artigo 229-C da Lei nº 9.279, de14 de maio de 1996, acrescido pela Lei nº 10.196, de 14 de fevereiro de 2001, e dá outras providências. Diário Oficial União. 13 abr. 2017. [Link].
15. Brasil. Agência Nacional de Vigilância Sanitária - ANVISA. Resolução da Diretoria Colegiada (RDC) n° 168, de 8 de agosto de 2017. Dispõe sobre o procedimento administrativo relativo à prévia anuência da ANVISA para a concessão de patentes para produtos e processos farmacêuticos, regulamentado pela Portaria Conjunta ANVISA-INPI n° 01, de 12 de abril de 2017. Diário Oficial União. 10 ago. 2017. [Link].
16. Brasil. Agência Nacional de Vigilância Sanitária - ANVISA. Orientação de Serviço nº 51/2018 DIARE/ANVISA. Detalha os parâmetros para o exame de pedidos de patente de produtos e processos farmacêuticos à luz da saúde pública. [Link].
17. Brasil. Ministério da Saúde. Portaria nº 344 de 12 de maio de 1998. Aprova o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial. Diário Oficial União. 19 mai. 1998. Republicação Diário Oficial União. 31 dezembro 1998. [Link].
18. Brasil. Agência Nacional de Vigilância Sanitária - ANVISA. Resolução da Diretoria Colegiada (RDC) nº 227 de 17 de maio de 2018. Dispõe sobre a atualização do Anexo I (Lista de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial) da Portaria SVS/MS nº 344, de 12 de maio de 1998. Diário Oficial União. 22 mai. 2018. [Link].