Artigo Original
Atividades Antimicrobiana e Antioxidante da Própolis do Estado do Ceará
Antimicrobial and Antioxidant Activities of Própolis from Ceará State
Resumo
A própolis de Apis mellifera L. é um produto da colméia, elaborado a partir de exsudatos de resinas que as abelhas recolhem de determinadas plantas. A composição química da própolis é complexa e relacionada à diversidade vegetal encontrada em torno da colméia. Embora a própolis seja utilizada em medicina popular por milhares de anos, a falta de padrões que avaliem de maneira precisa suas atividades farmacológicas, dificulta a padronização de produtos comerciais que garanta sua eficácia e segurança terapêutica para humanos e outros animais. No presente trabalho, avaliamos a composição química e a atividade antimicrobiana e antioxidante de própolis do Estado do Ceará. Os conteúdos de flavonóides e de fenóis totais foram mensurados empregando-se cloreto de alumínio e o reagente de Folin-Ciocalteau, respectivamente. Os resultados encontrados indicam que existe uma correlação entre o conteúdo fenólico e a atividade antioxidante. Uma das amostras apresentou atividade antimicrobiana contra S. aureus e C. albicans.
- Unitermos:
- Própolis do Ceará.
- Fenóis.
- Flavonóides.
- Atividade Antioxidante.
Abstract
Propolis from Apis mellifera L. is a product of the beehive, elaborated from exudates of resins that bees collect from different plants. The chemical composition of propolis is complex and is related to the vegetal source around the beehive. Although the propolis is used in popular medicine for thousand years, the lack of standards to evaluate its quality control is necessary and its pharmacology activities, turn to be difficult the standardization of commercial products that guarantees its effectiveness and therapeutic security for human and animal uses. In the present work, we evaluated the chemical composition and the antimicrobial and antioxidant activities of propolis from Ceará State. The content of flavonoids and total phenols was measured using aluminum chloride and Folin-Ciocalteau reagent, respectively. The results indicated that there is a correlation between phenolic content and the antioxidant activity. One of the samples showed antimicrobial activity against S. aureus and C. albicans.
- Key Words:
- Propolis from Ceará.
- State.
- Phenols.
- Flavonoids.
- Antioxidant Activity.
Introdução
O consumidor tem se tornado cada vez mais exigente e mais criterioso com a qualidade do produto que consome. É crescente a sua preocupação em fazer uso de produtos menos agressivos, de origem natural, ou o mais próximo possível desta origem. Por tal motivo, remete-se à pesquisa de produtos extraídos de plantas medicinais e outros produtos naturais com valor conhecido, comprovado ou não, que são ofertados à indústria. Um dos melhores exemplos, são produtos que contenham em seus constituintes, flavonóides, como é o caso das própolis (BURDOCK, 1998). Os flavonóides são compostos polifenólicos naturais largamente distribuídos principalmente nos vegetais superiores (angiospermas). Muitos deles apresentam atividade biológica como, por exemplo, podem-se citar as atividades antioxidante, antiinflamatória, antibacteriana que têm um grande potencial de exploração na área cosmética (PIETTA, 2000).
A própolis é utilizada popularmente no tratamento de infecções, em problemas de pele e, também, como antiviral e antiúlcera (DOBROWOLSKI et al., 1991). Estimula o sistema imunológico, é cicatrizante em escaras de decúbito e apresenta atividade antibiótica frente às bactérias gram positivas (MIORIN et al., 2003). A própolis possui também atividades, como anti-séptica, antifúngica, antipirética, adstringente e antiinflamatória; e também possui ação comprovada frente ao Bacillus subtilis e Candida albicans (SALOMÃO et al., 2008). Foi descrita a sua ação contra bactérias endodônticas (FERREIRA et al., 2007). Krol e colaboradores (1993) relataram o efeito sinérgico da própolis associada a antibióticos, contra Staphylococcus aureus.
Tais informações serviram como estímulo para desenvolver um processo de controle de qualidade deste produto, já que o melhor indicador da origem botânica da própolis é a análise da sua composição química comparada com a provável fonte vegetal. A determinação da origem geográfica e, principalmente, a origem vegetal aliada às suas características fisico-químicas, se faz importante no controle de qualidade e até mesmo na padronização das amostras de própolis para uma efetiva aplicação terapêutica (MARCUCCI, 1995). Recentemente, Marcucci (2006a) mostrou a tipificação da própolis brasileira. A principal característica desta tipificação é que possibilitará a agilização do mercado deste produto apícola, desde o campo até à indústria farmacêutica e cosmética, favorecendo a estas utilizarem a tipificação para a confecção dos seus medicamentos e cosméticos, com controle de qualidade estabelecido, já que os marcadores principais dos diferentes tipos foram separados, identificados e quantificados por faixas de concentração. Isto é, a classificação é quantitativa. Todos os dados relatados sobre o teor dos marcadores empregando-se a cromatografia líquida de alta eficiência (CLAE), foram comprovados por CLAE-EM (espectrometria de massas) empregando-se também uma análise por fingerprint de massas (SAWAYA et al., 2004). O outro fator importante da tipificação é que será possível confeccionar produtos farmacêuticos, cosméticos e de higiene oral, conhecendo-se o tipo de própolis empregada e as quantidades dos componentes bioativos presentes, características não relatadas anteriormente em publicações e patentes sobre própolis.
O objetivo deste estudo foi o de verificar a atividade antimicrobiana e antioxidante, e analisar a composição das própolis coletadas nos municípios de Beberibe, Crato e Parambú, localizados no Estado do Ceará, região nordeste do Brasil, nunca antes estudadas para a sua inclusão na tipificação.
Material e métodos
Própolis
As amostras de própolis utilizadas neste trabalho foram coletadas em três diferentes regiões do estado do Ceará, a saber: Beberibe, Crato e Parambú localizadas, respectivamente nas microrregiões: Litoral de Fortaleza, Cariri e Inhamuns. As amostras cedidas pelo SEBRAE/Ceará e foram armazenadas em sacos plásticos na geladeira.
Processo de extração
A própolis em estado bruto foi extraída em soxhlet, acoplado a manta aquecedora para balão de fundo redondo, contendo 250 mL de álcool etílico (Ecibra). Um cartucho de papel de filtro foi preparado e pesado, onde foram adicionados 8 g da amostra, que por sua vez permaneceu no soxhlet até sua total extração pelo solvente. Após esta etapa foi realizada uma filtração simples para a retirada da cera. As amostras foram transferidas para rotaevaporador, até que todo solvente se evaporasse, restando apenas a própolis pura, denominada de “extrato mole”. Em seguida, foram preparados extratos etanólicos na concentração de 10% (m/V).
Determinação do teor de sólidos solúveis
Para cada um dos extratos, foi determinado o teor de sólidos solúveis, pesando-se um becker e notando-se o seu peso. Foram pipetados 5 mL do extrato obtido em soxhlet no becker levando-o à estufa a 60 ºC até a secura. Retirou-se o becker, deixando-o atingir a temperatura ambiente em dessecador. Em seguida, este foi pesado, repetindo-se a operação até se obter um peso constante. Desta forma, foi possível calcular a quantidade de sólidos solúveis no extrato. O procedimento foi realizado em triplicata.
Atividade antioxidante
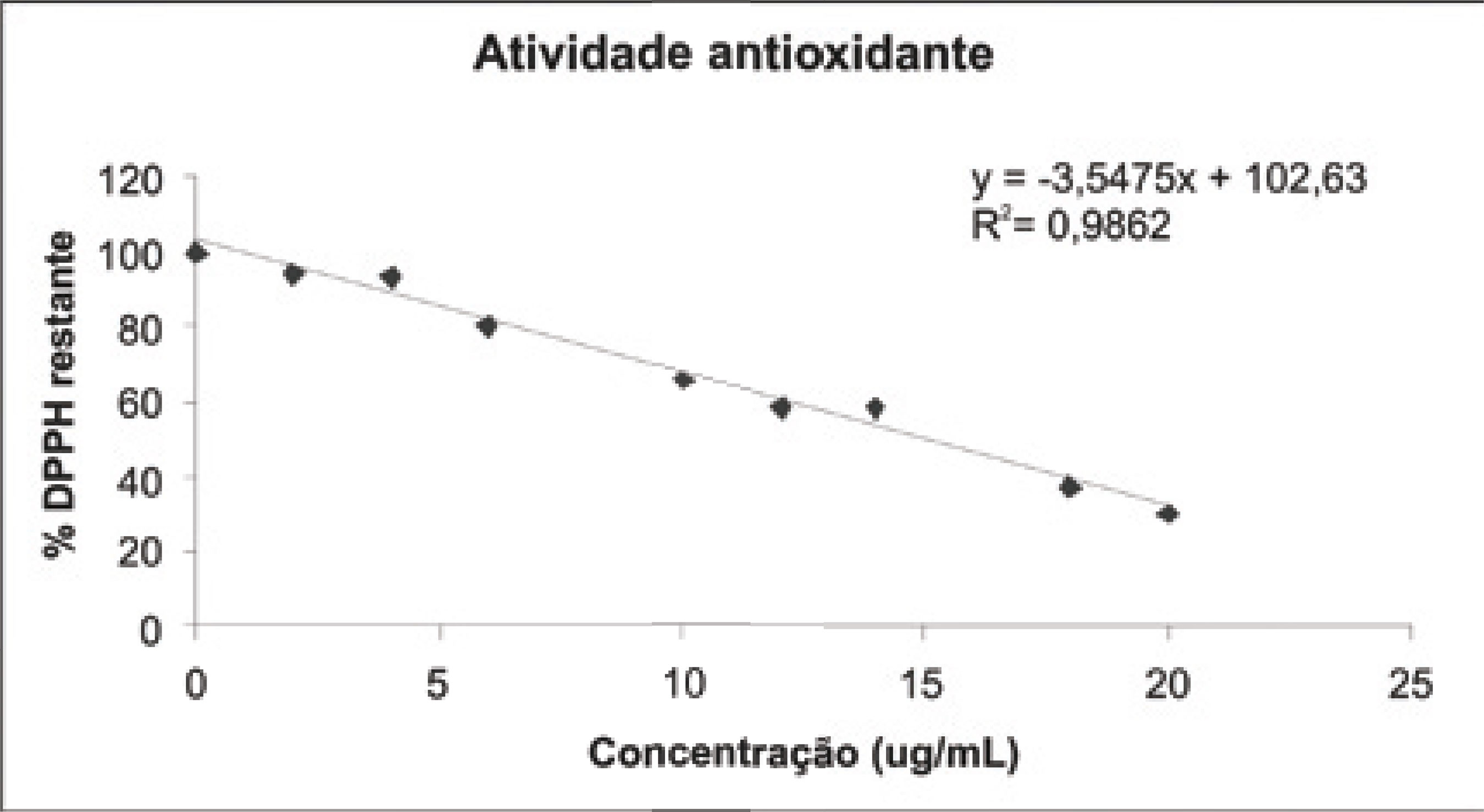
A atividade antioxidante foi analisada pelo método de seqüestro de radicais de DPPH (radical difenilpicrilidrazila) (HATANO et al., 1989; BANSKOTA et al., 2000) que se baseia em uma reação de óxido-redução. Os extratos etanólicos de própolis foram diluídos a 0,01% (V/V). Em seguida, 8 tubos foram enumerados de 0 até 7. Adicionaram-se os volumes de etanol (Ecibra), correspondentes às diluições do teste. Em seguida, foram adicionados os volumes de própolis para se obter as concentrações finais desejadas. Um volume de 1000 µL de DPPH (radical difenilpicrilidrazila, Sigma, St.Louis, USA a 60 µM) foi adicionado no 1º tubo e o cronômetro ligado, desligando-o depois de um minuto. O mesmo volume de DPPH foi adicionado nos outros tubos a cada 1 minuto. A leitura foi realizada em espectrofotômetro (Cary 50 da Varian, EUA) em 517 nm após 30 minutos da adição do DPPH no 1º tubo. Foi construído um gráfico (em %) de DPPH versus concentração de própolis (µg/ mL) e calculada a CE50 (concentração de própolis que elimina 50% dos radicais livres) pela planilha, empregando-se o método dos mínimos quadrados.
A Figura 1 mostra um exemplo de cinética de descoloração do DPPH, empregando-se a própolis de Beberibe.
Análise de fenóis totais em própolis bruta
Foram pesados 0,1 g do extrato seco (mole) de própolis obtida na determinação de teor de sólidos solúveis. Dissolveu-se com um pouco de etanol, em seguida, transferiu-se para um balão volumétrico de 50mL, completando-se o volume com água destilada (solução estoque). A partir deste ponto o procedimento foi realizado em triplicata.
Transferiu-se uma alíquota de 200 µL da solução estoque de própolis, para um balão volumétrico de 10mL, contendo aproximadamente 5mL de água destilada. Foram adicionados 800 µL do reagente Folin-Ciocalteau (Merck, Darmstadt, Alemanha) agitando-se o balão por alguns segundos em um intervalo de 1 a 8 minutos. Em seguida, foram acrescentados 1,2 mL da solução de Carbonatotartarato de sódio (Carbonato de sódio e Tartarato de sódio da Ecibra) completando-se o volume com água destilada até próximo ao menisco. A solução foi mantida em banho-maria a 20 °C por 2 horas. Decorrido este tempo, acertou-se o volume final. A leitura foi realizada em espectrofotômetro em 760nm. Este método foi validado pela empresa Natural Labor (2007a).
Análise de flavonóides na amostra bruta própolis
Foram utilizados 0,05 g do extrato mole de própolis, onde se adicionou uma pequena quantidade de metanol em um balão volumétrico, acertando-se o volume final para 25 mL. A partir deste ponto, o procedimento foi realizado em triplicata. Foram pipetados 200 mL desta solução em um balão de 10 mL, com aproximadamente 5 mL de metanol. Em seguida, acrescentaram-se 200 µL da solução a 5% de cloreto de alumínio (AlCl3 Reagen), completando os 10 µL do balão volumétrico com metanol até próximo ao menisco, agitando-se por alguns segundos. A solução foi mantida a 15 °C por 30 min. Decorrido este tempo, o menisco foi acertado e a leitura da absorbância efetuada em 425 nm. Este método foi validado pela empresa Natural Labor (2007b).
Padronização do inóculo
Inóculos dos microrganismos Staphylococus aureus (S. aureus; ATCC 29213), Escherichia coli (E. coli, ATCC 25922) e Candida albicans (C. albicans, ATCC 10231) foram preparados através da suspensão direta de colônias em 5,0 mL de solução salina a 0,85%, com turvação equivalente a 0,5 da escala de McFarland. Em seguida, diluiu-se à proporção de 1/10 para se obter uma concentração de 107 UFC/mL. Cada inóculo (1 µL) foi distribuído na superfície do ágar, sendo que a concentração final foi de aproximadamente 104 UFC/mL.
Atividade antimicrobiana-difusão em disco
Os extratos obtidos na análise de sólidos solúveis foram empregados na preparação de soluções diluídas a 2% para ser usada no teste de difusão em disco. Foram utilizados os meios de cultura Ágar Nutriente e Agar Saboraud (ambos da Merck, Darmstadt, Alemanha, este último especificamente para C. albicans). Os microrganismos testados foram: E. coli (ATCC 25922) S. aureus (ATCC 29213) Bacillus cereus (B. cereus, ATCC 11778), Staphylococcus epidermidis (S. epidermidis, ATCC 12228) e C. albicans (ATCC 10231). Para cada disco do teste antimicrobiano, foram impregnados 30 µL da concentração de 2% das própolis.
Atividade antimicrobiana empregando a diluição em ágar
A atividade antimicrobiana foi avaliada pelo método de diluição em ágar, conforme o procedimento descrito a seguir: em um erlenmeyer foram pesados 0,68 g de ágar Müller Hinton (Merck, Darmstadt, Alemanha), aos quais foram adicionados 20 mL de água destilada. Em seguida, o meio foi aquecido com uma manta elétrica. Após total solubilização, o meio foi esterilizado em autoclave por 20 minutos a 121 °C. Em seguida, foram pipetados os volumes respectivos das amostras de própolis, no meio de cultivo distribuído em placas de Petri, conforme as diluições desejadas. Todas as placas foram incubadas a 37 °C por 24 h. A concentração inibitória mínima (CIM) foi determinada a partir da placa em que não se observou crescimento bacteriano. Como controle, foram utilizadas placas, contendo apenas o meio de cultura e os inóculos bacterianos. O procedimento foi realizado em triplicata.
Resultados e Discussão
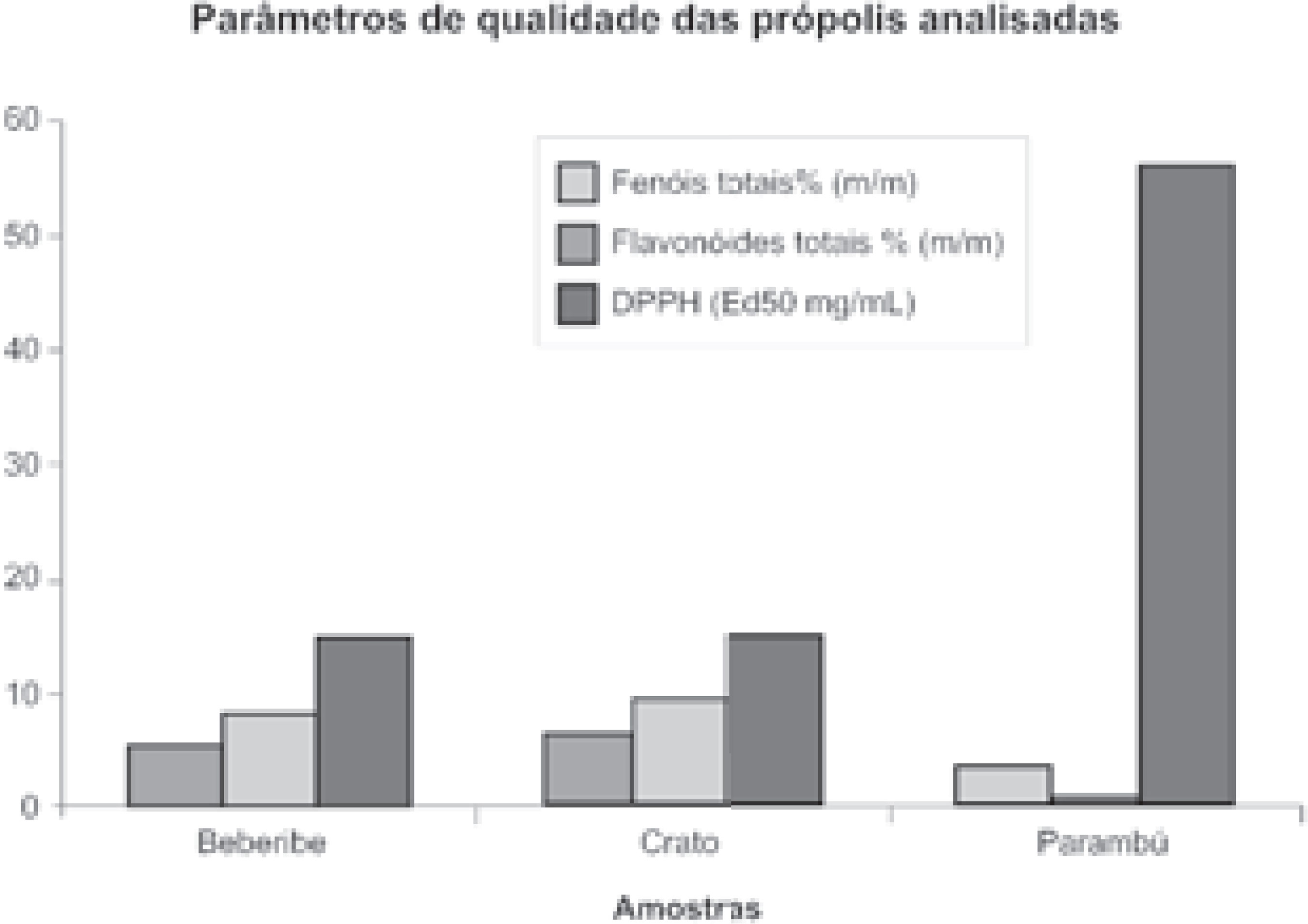
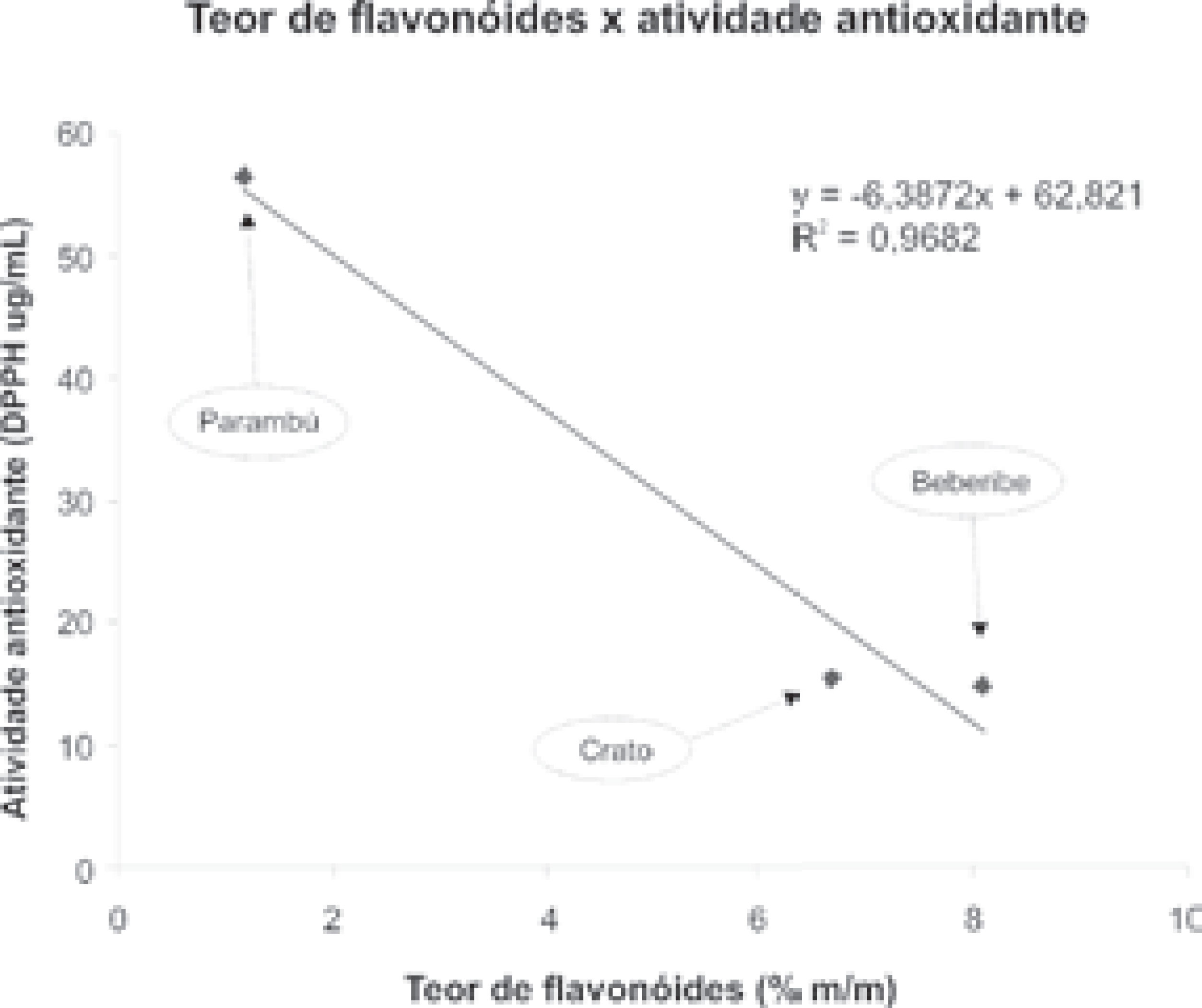
Embora muitos esforços estejam sendo realizados para os estudos da atividade biológica da própolis tipificada, muito pouco ou quase nada se sabe sobre a própolis do Ceará. A própolis denominada de verde (BRP, Marcucci, 2006a) foi exaustivamente estudada e muitas de suas propriedades biológicas e farmacológicas foram estabelecidas. Com respeito à própolis do Ceará, foram realizados estudos preliminares mostrando um potencial de amostras de algumas regiões como antioxidantes e antimicrobianas (MARCUCCI, 2006b) Os resultados apresentados a seguir mostram um perfil do teor de flavonóides, fenóis, atividade antioxidante e antimicrobiana das própolis analisadas. A Tabela 1 mostra os resultados obtidos na análise de fenóis e flavonóides totais. A legislação vigente (MAPA, 1998) indica que o padrão de qualidade requer um teor mínimo de flavonóides e fenóis totais para a própolis bruta com valores de 0,5 % (m/m) e 5,0% (m/m) respectivamente.
| Própolis | Fenóis totais % (m/m) | Flavonóides totais % (m/m) | DPPH (CE50 mg/µL) |
| Beberibe | 5,17 ± 0,18 | 8,09 ± 0,30 | 14,83 |
| Crato | 9,49 ± 0,26 | 6,68 ± 0,23 | 15,53 |
| Parambú | 3,71 ± 0,03 | 1,17 ± 0,05 | 56,29 |
| Própolis | S. aureus CIM (µg/mL) | E.coli CIM ( µ g/mL) | C. albicans CIM (µg/mL) |
| Beberibe | 400 | 600 | 550 |
| Crato | - | - | - |
| Parambú | - | - | - |
| Própolis | S. aureus | E.coli | B. Cereus | S. epidermidis | C. albicans |
| Beberibe | - | - | 9 mm | - | - |
| Crato | 9 mm | - | 8 mm | - | - |
| Parambú | - | - | - | - | - |
| (-) não houve inibição | |||||
A própolis Beberibe apresentou uma CIM (concentração inibitória mínima) de 400 µg/mL contra S. aureus e de 550 µg/mL para C. albicans. A bactéria E. coli não foi inibida por nenhuma própolis, como já constatado na literatura (FERNANDES JR. et al., 1995). A própolis não tem ação antimicrobiana sobre bactérias Gram negativas. As própolis de Crato e Parambú não inibiram os microrganismos em nenhuma das concentrações. Todos os resultados foram negativos.
A própolis de Beberibe apresentou os melhores resultados para a atividade antioxidante e a antimicrobiana, inibindo S. aureus e C. albicans. Portanto, os apicultores do Estado do Ceará, podem agregar valor a essas própolis, investindo em aplicações de melhores técnicas de manejo, de tal forma a produzi-las em escala comercial, conquistando mercado nacional e internacional, gerando aumento no número de empregos e melhoria na qualidade de vida da população cearense.
Agradecimentos
As autoras agradecem ao SEBRAE-CE na pessoa do Sr Vandi Matias Gadelha pelo envio das amostras e aos apicultures do projeto Apis-CE (SEBRAE).
Referências
BANSKOTA, A.H., TEZUKA, Y., ADNYANA, I.K., MIDORIKAWA, K., MATSUSHIGE, K., MESSAGE, D., HUERTAS, A.A.G., KADOTA, S. Journal of Ethnopharmacology, v.72, p. 239-246, 2000.
BURDOCK, G.A. Review of the Biological Properties and Toxicity of Bee Propolis (Propolis). Food and Chemical Toxicology, v.36, p.347-363, 1998.
DOBROWOLSKI, J.W., VOHORA, S.B., SHARMA, K., SHAH, S.A., NAQVI, S.A.H., DANDIYA, P.C. Antibacterial, antifungal, anti-amoebic, antiinflammatory and anti-pyretic studies on propolis bee products. Journal of Ethnopharmacology, v.5, p.77-82, 1991.
FERNANDES JR., A.; SUGIZAKI, M.F.; FOGO, M.L.; FUNARI, S.R.C., LOPES, C.A.M. In vitro activity of propolis against bacterial and yeast pathogens isolated from human infections. Journal of Venomous Animals and Toxins, v.1C, p.63-69, 1995.
FERREIRA, F.B.A., TORRES, S.A., ROSA, O.P.S., FERREIRA, C.M., GARCIA, R.B., MARCUCCI, M.C. Antimicrobial effect of propolis and other substances against selected endodontic pathogens, Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontics, v.104, p.709-716, 2007.
HATANO, T., EDAMATSU, R., MORI, A., FUJITA, Y., YASUHARA, T., YOSHIDA, T., OKUDA, T. Chemical and Pharmaceutical Bulletin, v.37, p.2016-2021, 1989.
KROL, W, SCHELLER, S, SHANI, J, PIETSZ G, CZUBA Z. Synergistic effect of ethanolic extract of propolis and antibiotics on the growth of Staphylococcus aureus, Arzneimitel-Forschung Drug Research, v.43, n.5, p.607-609, 1993.
MAPA (Ministério da Agricultura, Pecuária e Abastecimento) Instrução Normativa no. 3 de 19 de janeiro de 2002 (Portaria Ministerial nº 574, de 8 de dezembro de 1998).
MARCUCCI, M.C. Propolis: chemical composition, biological properties and therapeutic activity. Apidologie, v.26, 83-99, 1995.
MARCUCCI, M.C. Própolis Tipificada: Um Novo Caminho Para a Elaboração de Medicamentos de Origem Natural, Contendo este Produto Apícola, Revista Fitos, v.1, n.3, p. 36-46, 2006a.
MARCUCCI, M.C. Diagnóstico científico da própolis do Ceará M.C. Conferência apresentada em 03-05/07/2006 no X Seminário Nordestino de Pecuária - Pecnordeste, Fortaleza, CE, 2006b.
MIORIN, P.L., LEVY JUNIOR, N.C., CUSTODIO, A.R., BRETZ, W.A., MARCUCCI, M.C. Chemical composition and antibacterial activity of honey and propolis from A. mellifera and T. angustula bees against Staphylococcus aureus. Journal of Applied Microbiology, v.95, p.913-920, 2003.
NATURAL LABOR ANÁLISES E PESQUISAS LTDA. Validação de método analítico: determinação do teor de flavonóides em própolis, documento confidencial, 2007a.
NATURAL LABOR ANÁLISES E PESQUISAS LTDA. Validação de método analítico: determinação do teor de fenóis em própolis. Documento Confidencial, 2007b.
PIETTA, P.G. Flavonoids as antioxidants. Journal of Natural Products, v.63, p.1035-1042, 2002.
SALOMÃO, K., PEREIRA, P.R.S., CAMPOS, L.C., Borba, C.M., CABELLO, P.H., MARCUCCI, M.C., DE CASTRO, S.L. Brazilian propolis: correlation between chemical composition and antimicrobial activity. e-CAM: Evidence Based Complementary and Alternative Medicine, v.5, p.317-324, 2008.
SAWAYA, A.C.H.F., TOMAZELA, D.M., CUNHA, I.B.S., BANKOVA, V.S., MARCUCCI, M.C., EBERLIN, M.N. Electrospray Ionization Mass Spectrometry Fingerprinting of Propolis. Analyst, v.129, n.8, p.739-744, 2004.